Антитіло, яке специфічно зв’язується з людським flt3
Номер патенту: 99194
Опубліковано: 25.07.2012
Автори: Сургуладзе Дейвід, Лу Дань, Лі Івень, Тонра Джеймс Р.
Формула / Реферат
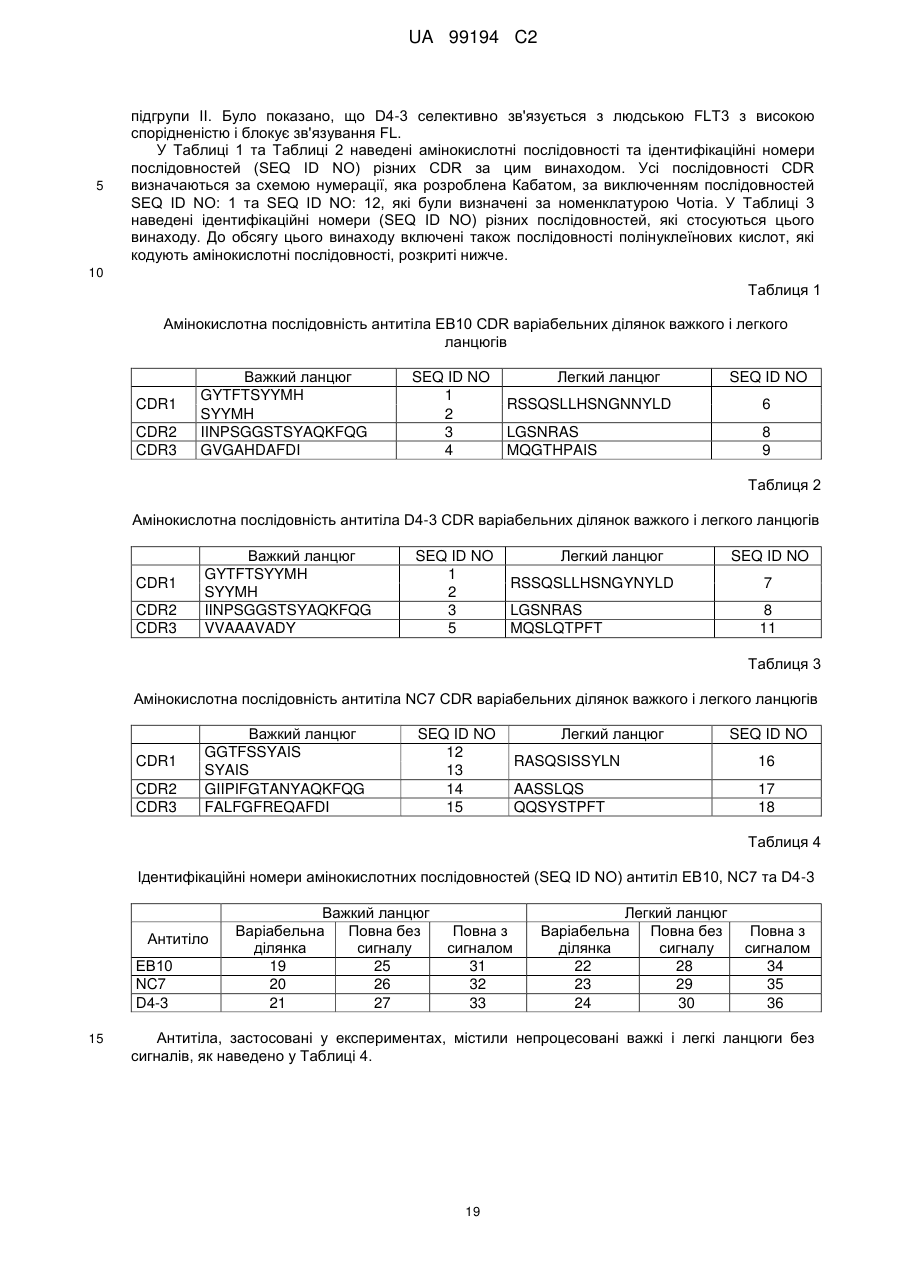
1. Антитіло, що специфічно зв'язує людську FLT3 (послідовність SEQ ID NO: 43), що містить CDRH1, що має послідовність SYYMH (послідовність SEQ ID NO: 2), CDRH2, що має послідовність IINPSGGSTSYAQKFQG (послідовність SEQ ID NO: 3), CDRH3, що має послідовність GVGAHDAFDI (послідовність SEQ ID NO: 4) або VVAAAVADY (послідовність SEQ ID NO: 5), CDRL1, що має послідовність RSSQSLLHSNGNNYLD (послідовність SEQ ID NO: 6) або RSSQSLLHSNGYNYLD (послідовність SEQ ID NO: 7), CDRL2, що має послідовність LGSNRAS (послідовність SEQ ID NO: 8), та CDRL3, що має послідовність MQGTHPAIS (послідовність SEQ ID NO: 9) або MQSLQTPFT (послідовність SEQ ID NO: 11).
2. Антитіло за п. 1, що містить CDRH1, що має послідовність SYYMH (послідовність SEQ ID NO: 2), CDRH2, що має послідовність IINPSGGSTSYAQKFQG (послідовність SEQ ID NO: 3), CDRH3, що має послідовність GVGAHDAFDI (послідовність SEQ ID NO: 4), CDRL1, що має послідовність RSSQSLLHSNGNNYLD (послідовність SEQ ID NO: 6), CDRL2, що має послідовність LGSNRAS (послідовність SEQ ID NO: 8), та CDRL3, що має послідовність MQGTHPAIS (послідовність SEQ ID NO: 9).
3. Антитіло за п. 1 або п. 2, що містить VL, що має амінокислотну послідовність:
та VH, що має амінокислотну послідовність:
4. Антитіло за будь-яким із пп. 1-3, що містить важкий ланцюг, що має амінокислотну послідовність SEQ ID NO: 25, та легкий ланцюг, що має амінокислотну послідовність SEQ ID NO: 28.
5. Антитіло за будь-яким із пп. 1-4, що містить два важкі ланцюги, кожен з яких має амінокислотну послідовність SEQ ID NO: 25, та два легкі ланцюги, кожен з яких має амінокислотну послідовність SEQ ID NO: 28.
6. Антитіло за п. 1, що містить VL, що має амінокислотну послідовність:
та VH, що має амінокислотну послідовність:
7. Фрагмент будь-якого з антитіл за будь-яким із пп. 1-6, де згаданий фрагмент специфічно зв'язує людську FLT3.
8. Фармацевтична композиція, що містить антитіло або фрагмент за будь-яким із пп. 1-7, разом із фармацевтично прийнятним носієм, розріджувачем або наповнювачем.
9. Антитіло або фрагмент за будь-яким із пп. 1-7 для застосування як лікарського засобу.
10. Антитіло або фрагмент за будь-яким із пп. 1-7 для застосування при лікуванні раку.
11. Антитіло або фрагмент за п. 10, де раком є лейкоз.
12. Продукт, що містить антитіло або фрагмент за будь-яким з пп. 1-7, у комбінації з додатковим протираковим засобом або лікарським засобом для одночасного, роздільного або послідовного застосування у терапії.
13. Продукт за п. 12, де протираковим засобом є метотрексат.
14. Антитіло за п. 3, хімічним або біосинтетичним способом зв'язане з протипухлинним засобом, антиангіогенним засобом або засобом, який продукує виявний сигнал.
15. Антитіло за п. 3, кон'юговане з протипухлинним засобом, де згаданий засіб може знищувати або пошкоджувати пухлину, з якою зв'язалось антитіло або яка знаходиться у середовищі навколо клітини, з якою зв'язалось антитіло.
Текст
Реферат: Винахід належить до антитіла, яке специфічно зв’язується з людським FLT3, фармацевтичної композиції та продукту, що містить антитіло, у комбінації з додатковим протираковим засобом для одночасного, роздільного або послідовного застосування у терапії. UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ця заявка претендує на пріоритет за попередніми заявками на патент США № 61/130,395, № 61/130,539 та № 61/103,394, усі з яких були подані 30 травня 2008 року. Цей винахід стосується людських антитіл, у тому числі їх фрагментів або частин, що є специфічними по відношенню до рецептора людської Fms-подібної тирозинкінази-3 (FLT3). Згадані антитіла застосовують для пригнічення росту ракових клітин, і вони можуть бути застосовані окремо або у комбінації з протипухлинним засобом, у тому числі (але без обмеження) з метотрексатом (МХТ), для лікування лейкозу. Рецептор людської Fms-подібної тирозинкінази-3 (FLT3), відомої також як фетальна кіназа печінки-2 (FLK-2), тирозинкіназа стовбурових клітин-1 (STK-1) та CD135 (послідовність SEQ ID NO: 43), є членом родини тирозинкіназних рецепторів класу III. При нормальних умовах FLT3 експресується на незрілих мієлоїдних і лімфоїдних клітинах-попередниках та клітинахпопередниках дендритних клітин, і лише зрідка на зрілих диференційованих клітинах. FLT3 надекспресується у приблизно 90% випадків гострого мієлоїдного лейкозу (AML), у більшості випадків гострого лімфоцитарного лейкозу (ALL) і хронічного мієлоїдного лейкозу у фазі бластного кризу (BC-CML). Стимуляція ліганду FLT3 (FL) посилює проліферацію та виживаність лейкозних клітин. Наслідком пригнічення передавання сигналу FLT3 є апоптоз дендритних клітин та пригнічення імунних реакцій. Дрібномолекулярні інгібітори не є повністю FLTS-специфічними, і при їх застосуванні може розвиватись стійкість до лікарського засобу. Таким чином, дрібномолекулярним інгібіторам FLT3 ще треба буде стати ефективними спрямованими лікарськими засобами для лікування лейкозу. Дуже бажаними є нові лікарські засоби для цієї незадоволеної медичної потреби. Варіант підходу з антитілами може подолати певні недоліки, пов'язані з дрібномолекулярними інгібіторами FLT3. По-перше, антитіла є специфічними до визначеного антигену, внаслідок чого запобігається виникнення потенційних побічних ефектів, які є наслідком пригнічення численних кіназ. По-друге, FLT3-нейтралізуючі антитіла спрямовуються на позаклітинний домен, який є менш схильним до мутацій, порівняно з кіназним доменом, унаслідок чого зменшується ймовірність розвитку стійкості до лікарського засобу. По-третє, антитіла можуть рекрутувати імунні ефекторні механізми, такі як антитілозалежна клітинна цитотоксичність (ADCC) та/або комплементопосередкована цитотоксичність (CMC), для вбивання пухлинних клітин-мішеней, наслідком чого є підвищена терапевтична ефективність. І врешті-решт, FLТ3-специфічні антитіла можуть бути активними як проти FLT3 дикого типу (особливо у випадку нейтралізуючого антитіла), так і проти мутованої FLT3 (внаслідок імунних ефекторних механізмів), що розширює цільову групу пацієнтів. Попередні зусилля стосовно розробки лікарських засобів для лікування лейкозу, у тому числі інгібіторів FLT3 (Li Y., et al., Int. J. Hematol. 82(2): 108-14 (2005), Li Y., Drug Development Research 67(6): 495-500 (2006). Li Y., et al., Expert Opinion in Biological Therapy 7(3): 319-330 (2007)), були значною мірою безуспішними. Інші стратегії розробок включали: US 5,777,084 гібридомні антитіла; WO95/27062 - агоністичні антитіла, WO94/28391 - антитіла проти ліганду; WO2005/094823 - дрібні молекули. Zheng R., et al., Blood 103(1):267-274 (2004), Li Y, et al., Blood 104(4): 1137-44 (2004), Piloto O., et al., Cancer Res. 65(4): 1514-22 (2005), Williams В., et al., Leukemia 19(8):1432-8 (2005), Piloto O., et al., Cancer Res. 66(9):4843-51 (2006) Piloto O., et al., Blood 109(4): 1643-1652 (2007) та Brent R., et al., AACR Annual. Meeting 2007, Los Angeles (2007) розкривають людські антагоністичні антитіла з високою зв'язувальною спорідненістю до рецептора FLT3. Декілька антитіл проти FLT3, у тому числі ЕВ10, NC7 та D4-3, пригнічують як лігандзалежну (рецептор дикого типу), так і ліганднезалежну (рецептор-мутант) активацію FLT3 (дивись Piloto, Cancer Res., supra.). До появи цього винаходу точні послідовності гіперваріабельних ділянок та домени зв'язування антигенних детермінант антитіл проти FLT3 за цим винаходом були невідомі. Крім того, існує потреба у наданні альтернативних інгібіторів FLT3, які мають високу зв'язувальну спорідненість до FLT3 і блокують зв'язування ліганду з рецептором FLT3, з пригніченням тим самим активації FLT3 та її шляху передавання сигналу, порівняно з тими інгібіторами, які є відомими у цій галузі. Цей винахід намагається надати альтернативні антитіла проти FLT3, які мають поліпшені властивості блокування ліганду та поліпшену зв'язувальну спорідненість до FLT3, порівняно з тими інгібіторами, які є відомими у цій галузі. Існує також потреба у наданні альтернативних інгібіторів FLT3, які індукують швидку та ефективну інтерналізацію та негативну модуляцію поверхневоклітинної FLT3. Цей винахід намагається надати людські антитіла проти FLT3, які індукують швидку та ефективну інтерналізацію та негативну модуляцію поверхневоклітинної FLT3, порівняно з тими інгібіторами, які є відомими у цій галузі. 1 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 Існує також потреба у наданні альтернативних інгібіторів FLT3, які пригнічують FLіндуковане фосфорилування FLT3 дикого типу та шляхи передавання сигналу низхідних кіназ МРК, РІ3К та STAT5 у випадку лейкозу. Цей винахід намагається надати людські антитіла проти FLT3, які пригнічують FL-індуковане фосфорилування FLT3 дикого типу та шляхи передавання сигналу низхідних кіназ МРК, РІ3К та STAT5 у випадку лейкозу, порівняно з тими інгібіторами, які є відомими у цій галузі. Крім того, існує потреба у наданні альтернативних інгібіторів FLT3, які мають поліпшену здатність активування низхідних імунних ефекторних функцій, таких як антитілозалежна клітинна цитотоксичність (ADCC). Цей винахід намагається надати людські антитіла проти FLT3, які мають поліпшену здатність активування низхідних імунних ефекторних функцій, у тому числі ADCC, порівняно з тими інгібіторами, які є відомими у цій галузі. Повністю людські або гуманізовані антитіла мають максимальний потенціал для успішного застосування їх у ролі людських терапевтичних засобів, оскільки вони будуть менш імуногенними у людей, ніж мишачі або химерні антитіла, дивись, наприклад, WO 95/07348 та WO 98/25457. Антитіла за цим винаходом мають вищезгадані властивості, надаючи тим самим значні переваги. До появи цього винаходу комбінація інгібіторів FLT3 з метотрексатом (МТХ) вважалось такою, що не надає жодної переваги при лікуванні лейкозу. Це твердження походить із повідомлення, у якому наводились дані про те, що комбінація дрібномолекулярного інгібітору FLT3 та метотрексату із застосуванням ліній лейкозних клітин у культурі була неефективною при лікуванні лейкозу, у той час як комбінації з іншими хіміотерапевтичними засобами були ефективними (Furukawa Y. et al., Leukemia (2007) 21: 1005-1014). Експериментальні результати, пов'язані із цим винаходом, демонструють, що наслідком застосування комбінації антитіла, мішенню для якого є FLT3, а саме ЕВ10, з МТХ на тваринній моделі лейкозу, є різке поліпшення показників виживаності. Цей винахід пропонує антитіло або його фрагмент, що зв'язує антигенну детермінанту у межах доменів D4 або D5 людської FLT3. Цей винахід пропонує спосіб лікування передракового стану або раку у ссавця, який включає введення МТХ у комбінації з інгібітором FLT3 ссавцю у кількості, ефективній для лікування передракового стану або раку. Цей винахід пропонує також кон'югат, що містить інгібітор FLT3, зв'язаний з МТХ. Цей винахід спрямовується на людські антитіла або їх фрагменти, що зв'язуються з людським антигеном FLT3 (послідовність SEQ ID NO: 43) з афінністю, що не перевищує 4,5×10 10 М для розчинного гібридного білка FLT3-Fc при температурі 25 °C, як визначено поверхневим плазмонним резонансом. Цей винахід спрямовується також на людські моноклональні антагоністичні антитіла та їх фрагменти, що зв'язуються з людським антигеном FLT3. Одним з аспектів цього винаходу є антитіло або його фрагмент, який зв'язує FLT3, що містить CDRH1, що має послідовність GYTFTSYYMH (послідовність SEQ ID NO: 1) або SYYMH (послідовність SEQ ID NO: 2), CDRH2, що має послідовність IINPSGGSTSYAQKFQG (послідовність SEQ ID NO: 3), CDRH3, що має послідовність GVGAHDAFDI (послідовність SEQ ID NO: 4) або VVAAAVADY (послідовність SEQ ID NO: 5), CDRL1, що має послідовність RSSQSLLHSNGNNYLD (послідовність SEQ ID NO: 6) або RSSQSLLHSNGYNYLD (послідовність SEQ ID NO: 7), CDRL2, що має послідовність LGSNRAS (послідовність SEQ ID NO: 8), та CDRL3, що має послідовність MQGTHPAIS (послідовність SEQ ID NO: 9) або MQSLQTPFT (послідовність SEQ ID NO: 11). Одним з аспектів цього винаходу є антитіло або його фрагмент, що зв'язує FLT3, що містить CDRH1, що має послідовність GYTFTSYYMH (послідовність SEQ ID NO: 1) або SYYMH (послідовність SEQ ID NO: 2), CDRH2, що має послідовність IINPSGGSTSYAQKFQG (послідовність SEQ ID NO: 3), CDRH3, що має послідовність GVGAHDAFDI (послідовність SEQ ID NO: 4), CDRL1, що має послідовність RSSQSLLHSNGNNYLD (послідовність SEQ ID NO: 6), CDRL2, що має послідовність LGSNRAS (послідовність SEQ ID NO: 8), та CDRL3, що має послідовність MQGTHPAIS (послідовність SEQ ID NO: 9). За ще одним аспектом антитіло, що має вищезгадані CDR (гіперваріабельні ділянки), специфічно зв'язує людську FLT3 з афінністю, -10 що не перевищує 4,5×10 М при температурі 25 °C, як визначено поверхневим плазмонним резонансом. У іншому аспекті цього винаходу антитіло або його фрагмент, що специфічно зв'язує FLT3, містить CDRH1, що має послідовність GYTFTSYYMH (послідовність SEQ ID NO: 1) або SYYMH (послідовність SEQ ID NO: 2), CDRH2, що має послідовність IINPSGGSTSYAQKFQG (послідовність SEQ ID NO: 3), CDRH3, що має послідовність VVAAAVADY (послідовність SEQ ID NO: 5), CDRL1, що має послідовність RSSQSLLHSNGYNYLD (послідовність SEQ ID NO: 7), 2 UA 99194 C2 5 10 CDRL2, що має послідовність LGSNRAS (послідовність SEQ ID NO: 8), та CDRL3, що має послідовність MQSLQTPFT (послідовність SEQ ID NO: 11). У іншому аспекті цього винаходу антитіло або його фрагмент, що специфічно зв'язує FLT3, містить CDRH1, що має послідовність GGTFSSYAIS (послідовність SEQ ID NO: 12) або SYAIS (послідовність SEQ ID NO: 13), CDRH2, що має послідовність GIIPIFGTANYAQKFQG (послідовність SEQ ID NO: 14), CDRH3, що має послідовність FALFGFREQAFDI (послідовність SEQ ID NO: 15), CDRL1, що має послідовність RASQSISSYLN (послідовність SEQ ID NO: 16), CDRL2, що має послідовність AASSLQS (послідовність SEQ ID NO: 17), та CDRL3, що має послідовність QQSYSTPFT (послідовність SEQ ID NO: 18). Іншим аспектом цього винаходу є антитіло або його фрагмент, що зв'язує FLT3 і містить VL, що має послідовність: та VH, що має послідовність: 15 Іншим аспектом цього винаходу є антитіло або його фрагмент, що зв'язує FLT3 і містить VL, що має послідовність: та VH, що має послідовність: 20 Іншим аспектом цього винаходу є антитіло або його фрагмент, що зв'язує FLT3 і містить VL, що має послідовність: та VH, що має послідовність: 25 30 35 Іншим аспектом цього винаходу є моноклональне антитіло, що містить легкий ланцюг, що має послідовність SEQ ID NO: 28, і важкий ланцюг, що має послідовність SEQ ID NO: 25; або легкий ланцюг, що має послідовність SEQ ID NO: 29, і важкий ланцюг, що має послідовність SEQ ID NO: 26; або легкий ланцюг, що має послідовність SEQ ID NO: 30, і важкий ланцюг, що має послідовність SEQ ID NO: 27. У іншому аспекті цього винаходу антитіло містить два легкі ланцюги, що мають послідовність SEQ ID NO: 28, і два важкі ланцюги, що мають послідовність SEQ ID NO: 25, або містить два легкі ланцюги, що мають послідовність SEQ ID NO: 29, і два важкі ланцюги, що мають послідовність SEQ ID NO: 26; або містить два легкі ланцюги, що мають послідовність SEQ ID NO: 30, і два важкі ланцюги, що мають послідовність SEQ ID NO: 27. FLT3-зв'язувальні фрагменти таких антитіл є частиною цього винаходу. Цей винахід також спрямований на виділену ДНК, що кодує такі антитіла та їх частини. Інші аспекти цього винаходу включають: виділену полінуклеїнову кислоту, яка містить нуклеотидну послідовність, що кодує згадане антитіло або його фрагмент; вектор експресії, який містить 3 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 згадану нуклеотидну послідовність, зв'язану з експресійною послідовністю або рекомбінантною клітиною-хазяїном, яка містить згаданий вектор експресії, або рекомбінантну клітину-хазяїна чи її потомство, де згадана клітина експресує згадане антитіло або його фрагмент. Ще одним аспектом цього винаходу є спосіб продукування або очищення антитіла або його фрагмента, що включає культивування згаданих клітин за умов, що надають можливість експресії згаданого антитіла або його фрагмента. Крім того, цей винахід спрямований на створення способів пригнічення росту ракової клітини та способів лікування лейкозу шляхом введення ефективної кількості антитіла, причому згадані способи призначені для застосування на ссавцях. Антитіла за цим винаходом можуть бути застосовані для лікування неопластичних захворювань, у тому числі солідних та несолідних пухлин, і для лікування лейкозу. Одним з аспектів цього винаходу є застосування описаних вище антитіл або їх фрагментів як лікарського засобу. У ще іншому аспекті описані вище антитіла або їх фрагменти повинні бути застосовані для лікування раку, у тому числі (але без обмеження) лейкозу. Цей винахід пропонує також застосування антитіла за цим винаходом для виготовлення лікарського засобу для лікування раку. У варіанті здійснення, якому віддається перевага, згаданим раком є лейкоз. Антитіла за цим винаходом можуть бути застосовані окремо або у комбінації з протипухлинним засобом або лікарським засобом. Одним з аспектів цього винаходу є застосування описаних вище антитіл у комбінації з додатковим протираковим засобом або лікарським засобом. За ще одним аспектом згаданим протираковим засобом є метотрексат (methotrexate). Природні антитіла, як правило, мають два ідентичні важкі ланцюги і два ідентичні легкі ланцюги, де кожен легкий ланцюг є ковалентно зв'язаним з важким ланцюгом міжланцюговим дисульфідним зв'язком. Численні дисульфідні зв'язки також зв'язують два важкі ланцюги між собою. Генно-інженерні антитіла можуть вносити різноманітні зміни у структуру та/або формат природних антитіл. Термін "антитіло", вжитий у цьому описі, охоплює імуноглобулінові молекули, що складаються з 4 поліпептидних ланцюгів, двох важких (Н) ланцюгів і двох легких (L) ланцюгів, які зв'язуються один з одним за допомогою дисульфідних зв'язків. Індивідуальні ланцюги можуть укладатись у домени, які мають однакові розміри (110-125 амінокислот) та однакові структури, але різні функції. Легкий ланцюг може містити одну варіабельну ділянку (скорочено позначену у цьому описі як VL) та/або одну константну ділянку (скорочено позначену у цьому описі як CL). Легкі ланцюги антитіл (імуноглобулінів) є легкими ланцюгами типу каппа (К) або легкими ланцюгами типу лямбда ( ). Вжите у цьому описі скорочення VL охоплює варіабельні ділянки як легких ланцюгів типу каппа (VK), так і легких ланцюгів типу лямбда (V ). Константна ділянка легкого ланцюга складається з одного домену і позначається CL. Важкий ланцюг може також містити одну варіабельну ділянку (скорочено позначену у цьому описі як VH) та/або, у залежності від класу або ізотипу антитіла, три або чотири константні ділянки (СН1, СН2, СН3 та СН4) (спільно скорочено позначені у цьому описі як СН). У людей згаданими ізотипами є IgA, IgD, IgE, IgG та IgM, де IgA та IgG, крім того, підрозділяються на підкласи або підтипи (IgA1-2 та IgG1-4). До обсягу цього винаходу включені антитіла будь-якого з вищезгаданих класів або підкласів. За варіантом, якому віддається перевага, ізотипом для антитіл за цим винаходом є людський IgG1. Як правило, варіабельні ділянки демонструють значну варіабельність амінокислотних послідовностей між антитілами, зокрема, у положенні антигензв'язувального центру антитіла. Кожна з VL та VH містить три ділянки, які називають гіперваріабельними ділянками або ділянками, що обумовлюють компліментарність (CDR), які підтримуються менш варіабельними ділянками, які називають каркасними ділянками (скорочено позначені у цьому описі як FR). Амінокислоти конкретної гіперваріабельної ділянки або домену позначаються за схемою нумерації, яка розроблена Кабатом (Kabat, et al, Ann. NY Acad. Sci. 190: 382-93 (1971); Kabat, et al, Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242 (1991)), або за схемою нумерації, яка розроблена Чотіа (С. Chothia and A.M. Lesk, J. Mol. Biol. 196 (4): 901-917 (1987).) (A. Martin, http://www.bioinf.org.uk/abs/chotliia.html). Кожна VH та VL складається з трьох гіперваріабельних ділянок (CDR) та чотирьох каркасних ділянок (FR), які у напрямку від аміно-кінця до карбоксильного кінця розміщуються у такому порядку: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. Частина антитіла, що складається з домену VL та домену VH, позначена як Fv (варіабельний фрагмент), являє собою антигензв'язувальний центр антитіла. Одноланцюговий Fv (scFv) являє собою фрагмент антитіла, що містить домен VL та домен VH на одному поліпептидному ланцюзі, де N-кінець одного домену та С-кінець другого домену з'єднуються 4 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 гнучким лінкером (дивись, наприклад, патент США № 4,946,778 (Ladner et al.), WO 88/09344 (Huston et al.), WO 92/01047 (McCafferty et al.)), де описаний дисплей scFv-фрагментів на поверхні розчинних рекомбінантних генетичних пакунків "дисплейного" типу, таких як бактеріофаг. Пептидні лінкери, що застосовуються для продукування одноланцюгових антитіл, можуть бути гнучкими пептидами, вибраними для забезпечення відповідного тривимірного укладання та зв'язування доменів VL та VH. Згаданий лінкер, як правило, складається з 10-50 амінокислотних залишків. За варіантом, якому віддається перевага, згаданий лінкер складається з 10-30 амінокислотних залишків. За варіантом, якому віддається більша перевага, згаданий лінкер складається з 12-30 амінокислотних залишків. Лінкер, якому віддається найбільша перевага, складається з 15-25 амінокислотних залишків. Необмежувальним прикладом таких лінкерних пептидів є (Gly-Gly-Gly-Gly-Ser)3. "Виділеним антитілом" є антитіло, яке (1) було частково, значною мірою або повністю очищене від інших компонентів; (2) було ідентифіковане та відокремлене та/або виділене з компонента його природного середовища; (3) є моноклональним; (4) є вільним від інших білків з того самого виду; (5) експресоване клітиною від іншого виду; або (6) не зустрічається у природі. Забруднювальними компонентами його природного середовища є речовини, які можуть перешкоджати діагностичному або терапевтичному застосуванню згаданого антитіла, причому згадані речовини можуть включати ферменти, гормони та інші білкові або небілкові розчинені речовини. Приклади виділеного антитіла включають антитіло, очищене афінним шляхом, антитіло, продуковане гібридомою або іншою лінією клітин in vitro, та людське антитіло від трансгенної миші. Термін "моноклональне антитіло", вжитий у цьому описі, означає антитіло, яке одержали з популяції по суті гомогенних антитіл, наприклад, індивідуальні антитіла, які складають популяцію, є по суті ідентичними за виключенням можливих природних мутацій або незначних посттрансляційних варіацій, які можуть бути присутніми. Моноклональні антитіла є високоспецифічними і спрямовуються проти окремих ділянок детермінанти у молекулі антигену (відомої також як антигенна детермінанта або епітоп). Крім того, на відміну від препаратів, які містять традиційні (поліклональні) антитіла, які, як правило, включають різні антитіла, спрямовані проти різних антигенних детермінант, кожне моноклональне антитіло спрямоване проти однієї антигенної детермінанти на антигені. Визначник "моноклональне" вказує на властивість антитіла, яке було одержане з по суті однорідної популяції антитіл, і не повинен вважатись таким, що вказує на продукування згаданого антитіла будь-яким конкретним способом. Термін "людське антитіло", вжитий у цьому описі, включає антитіла, які мають варіабельні та константні ділянки, які відповідають людським зародковим імуноглобуліновим послідовностям (як описано у Kabat, et al., supra та Chothia et al., supra). Людські антитіла за цим винаходом можуть включати амінокислотні залишки, які не кодуються людськими зародковими імуноглобуліновими послідовностями (наприклад, мутації, введені довільним або сайтспецифічним мутагенезом in vitro або соматичною мутацією in vivo), наприклад, у CDR. Людське антитіло може мати щонайменше одне положення, замінене на амінокислотний залишок, наприклад, активність, що стимулює амінокислотний залишок, який не кодується людською зародковою імуноглобуліновою послідовністю. Однак термін "людське антитіло", вжитий у цьому описі, не включає антитіла, у яких послідовності CDR, які були одержані із зародкової лінії ссавців іншого виду, таких як миші, були пересаджені на людські каркасні послідовності. Словосполучення "рекомбінантне людське антитіло" охоплює людські антитіла, які одержані, експресовані, створені або виділені рекомбінантними способами, наприклад, антитіла, експресовані за допомогою рекомбінантного вектора експресії, трансфікованого у клітину-хазяїна, антитіла, виділені з бібліотеки рекомбінантних комбінаторних людських антитіл, антитіла, виділені з тварини, яка є трансгенною через людські імуноглобулінові гени, або антитіла, одержані, експресовані, створені або виділені будь-якими іншими способами, які спричиняють сплайсування послідовностей людських імуноглобулінових генів до інших послідовностей ДНК. Такі рекомбінантні людські антитіла мають варіабельні та константні ділянки, одержані з людських зародкових імуноглобулінових послідовностей (дивись Kabat, et al., supra та Chothia et al., supra). Fc (фрагмент, що кристалізується) є позначенням частини або фрагмента антитіла, яка(-ий) містить два константні домени важкого ланцюга. У антитіла IgG, наприклад, Fc містить СН2 та СН3. Fc антитіла IgA або IgM також містить СН4. Fc пов'язують зі зв'язуванням Fc-рецептора, активацією комплементопосередкованої цитотоксичності (CMC) та ADCC. Для антитіл, таких як 5 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 IgA та IgM, які являють собою комплекси численних IgG-подібних білків, утворення комплексу потребує константні ділянки Fc. Таким чином, антитіла за цим винаходом включають (але без обмеження ними) природні антитіла, антитіла, людські антитіла, гуманізовані антитіла, рекомбінантні людські антитіла, моноклональні антитіла, фрагменти розщеплення, їх визначені частини та варіанти, у тому числі антитіла-міметики або такі, які містять частини антитіл, які імітують структуру та/або функцію антитіла або його конкретного фрагмента чи конкретної частини, причому кожне антитіло, його фрагмент або частина містить щонайменше одну CDR. Функціональні фрагменти включають антигензв'язувальні фрагменти, які зв'язуються з антигеном FLT3. Наприклад, фрагменти антитіл, здатні до зв'язування з FLT3 або його частиною, які входять до обсягу цього винаходу, включають бівалентні фрагменти, такі як (Fab') 2, з інтактними міжланцюговими дисульфідними зв'язками, моновалентні фрагменти, такі як Fab (антигензв'язувальний фрагмент), до яких належать фрагменти антитіла, які складаються з VL-CL VL-CH1 ділянок і не зберігають шарнірну ділянку важкого ланцюга (одержані, наприклад, шляхом папаїнового розщеплення), Fabs, які зберігають шарнірну ділянку важкого ланцюга, Facb (одержані, наприклад, шляхом плазмінового розщеплення), F(ab')2, Fab', яким бракує дисульфіднихзв'язків, pFc' (одержані, наприклад, шляхом пепсинового або плазмінового розщеплення), Fd (одержані, наприклад, шляхом пепсинового розщеплення, часткового відновлення та повторного агрегування) та Fv або scFv (одержані, наприклад, методами молекулярної біології). Фрагменти антитіл включають також, наприклад, антитіла з видаленими доменами, лінійні антитіла, одноланцюгові антитіла, scFv, однодоменні антитіла, полівалентні одноланцюгові антитіла, мультиспецифічні антитіла, утворені з фрагментів антитіла, у тому числі діатіла, триатіла тощо, які специфічно зв'язуються з антигенами. Шарнірна ділянка відокремлює Fab- та Fc-фрагменти антитіла із забезпеченням взаємної рухливості Fab та рухливості відносно Fc, а також включає численні дисульфідні зв'язки для ковалентного зв'язування двох важких ланцюгів. Були розроблені формати антитіл, що зберігають зв'язувальну специфічність, але мають інші властивості, які можуть бути бажаними, у тому числі, наприклад, біспецифічність, полівалентність (більше двох зв'язувальних центрів) та компактний розмір (наприклад, лише зв'язувальні домени). Антитіла або їх фрагменти за цим винаходом є специфічними до FLT3. Специфічність антитіла означає вибіркове розпізнання антитілом конкретної антигенної детермінанти антигену. Антитіла за цим винаходом можуть, наприклад, бути моноспецифічними або біспецифічними. Біспецифічними антитілами (BsAb) є антитіла, які мають дві різні антигензв'язувальні специфічності або два різні антигензв'язувальні центри. Якщо антитіло має більше однієї специфічності, то розпізнані антигенні детермінанти можуть пов'язуватись з одним антигеном або більше ніж з одним антигеном. Таким чином, цей винахід пропонує біспецифічні антитіла, які зв'язуються з двома різними антигенами, із щонайменше однією специфічністю до FLT3. Як вказувалось вище, такі антитіла включають будь-які їх фрагменти. Специфічність антитіл за цим винаходом або їх фрагментів до FLT3 може бути визначена, виходячи із афінності та/або авідності. Афінність, представлена константою дисоціації антигену з антитілом у стані рівноваги (KD), визначає силу зв'язування між антигенною детермінантою та антигензв'язувальним центром антитіла. Антитіла або їх фрагменти за цим винаходом зв'язуються з антигенною детермінантою FLT3, яка може містити будь-який один із п'яти сегментів позаклітинного домену FLT3 (які нижче позначені просто як "домени" або "ECD"), тобто D1, D2, D3, D4 та D5. Антигенна детермінанта, з якою зв'язуються антитіла або фрагменти за цим винаходом, знаходиться у межах домену D4 або D5. Антитіла ЕВ10 та D4-3 зв'язуються з антигенною детермінантою у межах домену 4 FLT3, у той час як NC7 зв'язується з антигенною детермінантою у межах домену 5 FLT3. Термін "антигенна детермінанта", вжитий у цьому описі, означає дискретні тривимірні сайти на антигені, які розпізнаються антитілами за цим винаходом. Антигенними детермінантами є імунологічно активні ділянки на комплексному антигені, ділянки, які фактично зв'язуються з рецептором В-клітини і які фактично є зв'язаними молекулами антитіл, що продукуються Вклітиною. Антигени, як правило, містять щонайменше одну антигенну детермінанту, а, як правило, більше однієї антигенної детермінанти. Антигенні детермінанти на білкових антигенах можуть бути лінійними або нелінійними. Лінійними антигенними детермінантами є антигенні детермінанти, які складаються з прилеглих амінокислотних залишків у амінокислотній послідовності білка. Лінійні антигенні детермінанти можуть потребувати або можуть не потребувати конформаційного укладання для утворення нативної тривимірної структури та викликання імунної реакції, що продукує антитіла зі зв'язувальною специфічністю до антигену. 6 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 Нелінійні антигенні детермінанти складаються з несуміжних амінокислотних залишків. Таким чином, нелінійні антигенні детермінанти потребують певного ступеня укладання білка для розміщення необхідних амінокислотних залишків у безпосередній взаємній близькості для утворення нативної тривимірної структури та викликання імунної реакції, що продукує антитіла зі зв'язувальною специфічністю до антигену. Антитіла або їх фрагменти за цим винаходом зв'язуються з FLT3 дикого типу або мутантною FLT3. FLT3, мутантна або дикого типу, наприклад, часто експресується при AML та ALL, а також у разі іншого типу лейкозу. Вона зазнає мутації приблизно у третини пацієнтів, які страждають на гострий AML, шляхом внутрішньої тандемної дуплікації (ITD) юкстамембранного домену або унаслідок точкових мутацій, які, як правило, присутні у кіназному домені (KD). Мутації обох типів конститутивно активують FLT3. Крім перешкоджання передавання сигналу FLT3, антитіла проти FLT3 можуть також індукувати ADCC як додатковий механізм індукування цитотоксичності. До антитіл за цим винаходом або їх фрагментів належать також антитіла, зв'язувальні властивості яких були модифіковані або поліпшені шляхом безпосередньої мутації, методами "визрівання афінності", технікою фагового дисплею або перестановкою ланцюгів. Афінність та специфічність можуть бути модифіковані або поліпшені шляхом мутування залишків CDR та/або FR і проведенням перевірки з пошуком антигензв'язувальних центрів антитіла, які мають бажані властивості (дивись, наприклад, Yang et al., J. Mol. Biol., 254: 392-403 (1995)). Мутацію CDR здійснюють різними способами. Один зі способів полягає у рандомізації окремих залишків або комбінацій залишків так, щоб у популяції за всіма іншими властивостями ідентичних антигензв'язувальних центрів субпопуляції, що містять від двох до двадцяти амінокислот, знаходились у конкретних положеннях. У альтернативному варіанті мутації спричинені у ряду залишків методами схильної до помилок полімеразної ланцюгової реакції (дивись, наприклад, Hawkins et al., J. Mol. Biol., 226: 889-96 (1992)). Наприклад, вектори фагового дисплею, які містять гени варіабельних ділянок важких та легких ланцюгів, можуть розмножуватись у штамах-мутаторах Е. coli (дивись, наприклад, Low et al., J. Mol. Biol., 250: 359-368 (1996)). Ці методи мутагенезу є ілюстративним для багатьох методів, відомих фахівцю у цій галузі. Зручним способом одержання замінених варіантів є "визрівання афінності" за допомогою техніки фагового дисплею. Коротко кажучи, декілька сайтів CDR піддають мутаціям для одержання усіх можливих амінокислотних замін на кожному сайті. Одержані таким чином варіанти антитіл відображають моновалентним чином із частинок нитчастих фагів як злиття з продуктом гена III М13, який є запакованим у кожній частинці. Після цього варіанти, одержані за допомогою техніки фагового дисплею, перевіряють на їх біологічну активність (наприклад, зв'язувальна спорідненість, специфічність, ІС50, EC50, КD), як розкрито у цьому описі. Для розпізнавання сайтів CDR, які є кандидатами для модифікації, може бути проведеним аланіновий сканувальний мутагенез для розпізнавання залишків CDR, які значною мірою сприяють зв'язуванню антигену. У альтернативному варіанті або додатково довільному мутагенезу може бути піддана одна або декілька послідовностей CDR у одному чи декількох положеннях залишків або тоді, коли CDR є функціонально зв'язаною з варіабельною ділянкою, або тоді, коли CDR є незалежною від іншої послідовності варіабельної ділянки, з подальшим поверненням зміненої CDR до варіабельної ділянки за допомогою методу рекомбінантних ДНК. Після одержання та експресії таких антитіл-варіантів панель варіантів піддають скринінгу як розкрито у цьому описі, і антитіла з кращими властивостями за допомогою одного або декількох відповідних аналізів можуть відбиратись для подальшого дослідження. Як розкрито у цьому описі, крім конкретно описаних антитіл, інші "по суті гомологічні" модифіковані антитіла можуть бути легко розроблені та одержані за допомогою різних методів рекомбінантних ДНК, добре відомих фахівцям у цій галузі. Наприклад, каркасні ділянки можуть відрізнятись від нативних послідовностей на первинному структурному рівні декількома амінокислотними замінами, термінальними та проміжними доданнями та делеціями тощо. Крім того, цілий ряд різних людських каркасних ділянок може застосовуватись окремо або у комбінації як основа для гуманізованих імуноглобулінів за цим винаходом. Загалом модифікування генів можуть бути легко здійснені за допомогою цілого ряду добре відомих методів, таких як сайтспрямований мутагенез. До обсягу цього винаходу включені FLT3-зв'язувальні поліпептиди з амінокислотними послідовностями, по суті такими самими, що і описана амінокислотна послідовність варіабельних або гіперваріабельних ділянок непроцесованих антитіл проти FLT3. По суті така сама амінокислотна послідовність визначена у цьому описі як послідовність із щонайменше 70%, за варіантом, якому віддається перевага, щонайменше приблизно 80% та за варіантом, якому віддається більша перевага, щонайменше приблизно 90% гомологією з іншою амінокислотною послідовністю, як визначено пошуковим методом FASTA згідно з Pearson та 7 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 Lipman (Proc. Natl. Acad. Sci. USA 85: 2444-8 (1988)). Крім того, цей винахід включає консервативні амінокислотні заміни, що зберігають функціональні властивості антитіл, розкритих у цьому описі. До обсягу цього винаходу включені нуклеїновокислотні послідовності, які кодують важкий ланцюг антитіла проти FLT3, що містить будь-яку VH або її частину чи будь-яку з CDR домену VH, у тому числі будь-які її варіанти, як розкрито у цьому описі. До обсягу цього винаходу включені також нуклеїновокислотні молекули, які кодують легкий ланцюг антитіла проти FLT3, що містить будь-яку VL або її частину чи будь-яку з CDR домену VL, у тому числі будь-які її варіанти, як розкрито у цьому описі. Кожен домен антитіл за цим винаходом може бути повним антитілом з варіабельною ділянкою важкого або легкого ланцюга, або він може бути функціональним еквівалентом чи мутантом або похідною природного домену чи сконструйованим штучним доменом, наприклад, in vitro, за допомогою такого методу як метод, описаний у WO 93/11236 (Griffiths et al.). Наприклад, можна з'єднати між собою домени, які відповідають варіабельним ділянкам антитіла, яким бракує щонайменше однієї амінокислоти. Також таким антитілом є антитіло з однією або декількома амінокислотними замінами, мутаціями або делеціями у межах однієї з послідовностей CDR. Важливою відмітною особливістю є здатність кожного домену до зв'язування з комплементарним доменом для утворення антигензв'язувального центру. Таким чином, словосполучення "фрагмент варіабельної ділянки важкого ланцюга" та "фрагмент варіабельної ділянки легкого ланцюга" не повинні розглядатись як такі, що виключають варіанти, у тому числі варіанти CDR, які не чинять істотного впливу на специфічність. Антитіла за цим винаходом можуть продукуватись методами, відомими у цій галузі. До цих методів належить імунологічний метод, опис якого наведений у Kohler and Milstein, Nature 256: 495-497 (1975) і у Campbell, Monoclonal Antibody Technology, The Production and Characterization of Rodent and Human Hybridomas, Burdon et al., Eds., Laboratory Techniques in Biochemistry and Molecular Biology, Volume 13, Elsevier Science Publishers, Amsterdam (1985); а також метод рекомбінантних ДНК, опис якого наведений у Huse et al., Science 246: 1275-1281 (1989). Антитіла також можуть бути одержані з бібліотек у форматі фагового дисплею, що несуть комбінації доменів VH та VL у формі scFv або Fab. Домени VH та VL можуть кодуватись нуклеотидами, що є синтетичними, частково синтетичними або мають природне походження. У певних варіантах здійснення перевага може віддаватись бібліотекам у форматі фагового дисплею, що несуть фрагменти людських антитіл. Іншими джерелами людських антитіл є трансгенні миші, створені методами генної інженерії для експресії людських імуноглобулінових генів. Фрагменти антитіл можуть продукуватись шляхом розщеплення цілого антитіла або шляхом експресії ДНК, що кодує згаданий фрагмент. Фрагменти антитіл можна одержати за допомогою методів, описаних у Lamoyi et al., J. Immunol. Methods 56: 235-243 (1983) та у Parham, J. Immunol. 131: 2895-2902 (1983). Такі фрагменти можуть містити один або обидва Fabфрагменти чи F(аb')2-фрагмент. Такі фрагменти можуть також містити одноланцюгові фрагменти варіабельної ділянки антитіл, тобто scFv, діатіла або фрагменти інших антитіл. Методи продукування таких функціональних еквівалентів розкриті у WO 93/21319, заявці на європейський патент ЕР 239,400; WO 89/09622; заявці на європейський патент ЕР 338,745; та заявці на європейський патент ЕР 332,424. У цій заявці термін "антитіла" за цим винаходом означає будь-які їх фрагменти, незалежно від того, вказується це конкретно чи ні. Клітинами-хазяями для трансформації векторів та експресії антитіл за цим винаходом, яким віддається перевага, є клітини ссавців, наприклад, клітини NSO (несекретуючі (0) клітини мишачої мієломи), клітини 293 і клітини СНО (клітини яєчника китайського хом'ячка) та інші клітинні лінії лімфоїдного походження, такі як клітини лімфоми, мієломи або гібридоми. У альтернативному варіанті можуть бути застосовані інші хазяї-еукаріоти, такі як дріжджі. Цей винахід пропонує виділені антитіла або їх фрагменти, специфічні до FLT3. Антитіла за цим винаходом є здатними до однієї або декількох із наведених нижче активностей: 1) демонстрація високоафінного зв'язування з FLT3; 2) блокування зв'язування ліганду з рецептором FLT3, а отже, пригнічення активації FLT3 та її шляху передавання сигналу; 3) індукування швидкої та ефективної інтерналізації та негативної модуляції поверхневоклітинної FLT3; 4) пригнічення FL-індукованого фосфорилування FLT3 дикого типу та шляхів активації низхідних кіназ МРК, РІ3К та STAT5 при лейкозі; 5) демонстрація зниженого рівня імуногенності у людей; 6) демонстрація поліпшеної здатності активації низхідних імуноефекторних функцій, таких як антитілозалежна клітинна цитотоксичність (ADCC); 7) індукування інтерналізації рецептора FLT3 та 8) пригнічення росту пухлин in vitro та in vivo. У одному з аспектів цього винаходу антитіла проти FLT3 за цим винаходом є людськими антитілами, що демонструють 8 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 одну або декілька з наведених нижче властивостей, які також пояснені у цьому описі, у тому числі у Прикладах: (і) пригнічення зв'язування ліганду FLT3 (FL) з FLT3 дикого типу; (іі) пригнічення зв'язування FL з мутантною (унаслідок внутрішньої тандемної дуплікації) FLT3 (FLT3-ITD); (iiі) зв'язування з антигенною детермінантою у межах домену 4 та/або домену 5 FLT3; (iv) нейтралізація FL-активації FLT3; (v) нейтралізація активації FLT3 незалежно від FL; (vi) опосередковування ADCC; (vii) інтерналізація FLT3; (viii) зменшення поверхневої FLT3; або -10 (ix) зв'язування з FLT3 зі значенням КD не більшим ніж приблизно 4,5×10 М. Антитіла за цим винаходом зв'язуються із зовнішнім доменом FLT3 та пригнічують зв'язування FL з FLT3. Пригнічення може визначатись, наприклад, за допомогою аналізу прямого зв'язування із застосуванням очищеного або мембранного рецептора. У одному з варіантів здійснення антитіла за цим винаходом або їх фрагменти за варіантом, якому віддається перевага, зв'язують FLT3 принаймні з такою самою інтенсивністю, що і природні ліганди FLT3. Антитіла за цим винаходом нейтралізують FLT3. Нейтралізація здійснюється за допомогою різноманітних механізмів. Одним із таких механізмів є зв'язування FL з позаклітинним доменом FLT3, що стимулює аутофосфорилування бета-субодиниці та фосфорилування субстратів FLT3, у тому числі STAT5, Akt, PI3K та МАРК, які являють собою низхідні шляхи. Нейтралізація FLT3 включає також пригнічення, зниження, інактивацію та/або руйнування однієї або декількох із цих активностей, які при нормальних умовах пов'язуються з трансдукцією сигналу. Крім того, нейтралізація включає пригнічення як гетеродимерів FLT3, так і гомодимерів FLT3. Таким чином, нейтралізація FLT3 має різні ефекти, у тому числі пригнічення, зниження, інактивацію та/або припинення росту (проліферації та диференціації), ангіогенезу (відновлення, проникнення та метастазування кровоносних судин) та рухливості і метастазування клітин (адгезія та проникнення клітин). Внаслідок нейтралізації FLT3 за допомогою (але без обмеження) різних розкритих механізмів антитіла за цим винаходом зменшують активність FLT3 з пригніченням тим самим розвитку захворювання. Одним зі способів нейтралізації FLT3 є пригнічення тирозинкіназної активності рецептора. Пригнічення тирозинкінази може бути визначене за допомогою добре відомих способів, наприклад, шляхом визначення рівня аутофосфорилування рекомбінантного кіназного рецептора та/або фосфорилування природних або синтетичних субстратів. Таким чином, аналіз фосфорилування є придатним для визначення нейтралізуючих антитіл у контексті цього винаходу. Фосфорилування може бути виявлено, наприклад, за допомогою антитіла, специфічного до фосфотирозину, при проведенні ELISA (імуноферментний твердофазний аналіз) або вестерн-блотингу. Опис певних аналізів на тирозинкіназну активність наведений у Panek et al., J. Pharmacol. Exp. Thera. 283: 1433-44 (1997) та Batley et al., Life Sci. 62: 143-50 (1998). Антитіла за цим винаходом спричиняють значне зниження фосфорилування тирозину FLT3 на щонайменше приблизно 60%, за варіантом, якому віддається перевага, на щонайменше приблизно 75% і за варіантом, якому віддається більша перевага, на щонайменше приблизно 85-90% у клітин, що реагують на ліганд. Іншим способом нейтралізації FLT3 є пригнічення інтенсивності фосфорилування низхідних субстратів FLT3. Таким чином, може бути визначений рівень фосфорилування STAT5, РІ3К, Akt або МАРК. Крім того, способи виявлення експресії білків можуть бути застосовані для встановлення нейтралізації FLT3, де білки, що визначаються, регулюються тирозинкіназною активністю FLT3. Ці способи включають імуногістохімію (ІНС) для виявлення експресії білків, гібридизацію in situ із флуоресцентною міткою (FISH) для виявлення ампліфікації генів, аналізи конкурентного зв'язування радіолігандів, методи блотингу на твердих матеріалах, такі як назерн- та саузернблотинги, полімеразна ланцюгова реакція зі зворотною транскриптазою (RT-PCR) та ELISA. Дивись, наприклад, Grandis et al., Cancer 78: 1284-92 (1996); Shimizu et al., Japan J. Cancer Res. 85: 567-71 (1994); Sauter et al., Am. J. Path. 148: 1047-53 (1996); Collins, Glia 15: 289-96 (1995); Radinsky et al., Clin. Cancer Res. 1: 19-31 (1995); Petrides et al., Cancer Res. 50: 3934-39 (1990); Hoffmann et al., Anticancer Res. 17: 4419-26 (1997); Wikstrand et al., Cancer Res. 55: 3140-48 (1995). Для визначення нейтралізації FLT3 можуть бути застосовані також аналізи in vivo. Наприклад, пригнічення рецептора тирозинкінази може спостерігатись при проведенні 9 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 мітогенних аналізів із застосуванням ліній клітин, стимульованих рецепторним лігандом у присутності та при відсутності інгібітору. Один зі способів включає випробування на пригнічення росту пухлинних клітин, що експресують FLT3, або клітин, трансфікованих для експресії FLT3. Пригнічення може спостерігатись також на пухлинних моделях, наприклад, на пухлинних клітинах людини, введених в організм миші. Цей винахід не обмежується жодним конкретним механізмом нейтралізації FLT3. Антитіла проти FLT3 за цим винаходом можуть (1) зв'язуватись із поверхневоклітинним рецептором FLT3 зовні, (2) блокувати зв'язування з FL і подальшу трансдукцію сигналу, що опосередковується зв'язаною з рецептором тирозинкіназою, та (3) запобігати фосфорилуванню FLT3 та інших низхідних білків у каскаді трансдукції сигналів. У іншому варіанті здійснення антитіла за цим винаходом негативно модулюють FLT3. Кількість FLT3, присутньої на поверхні клітини, залежить від продукування, інтерналізації та розкладу рецепторного білка. Кількість FLT3, присутньої на поверхні клітини, може бути визначена опосередковано, шляхом виявлення інтерналізації рецептора або молекули, зв'язаної з рецептором. Наприклад, інтерналізація рецептора може бути визначена шляхом контактування або сенсибілізації клітин, що експресують FLT3 з міченим антитілом. Після цього зв'язане з мембраною антитіло знімають, збирають та підраховують. Інтерналізація антитіла визначається шляхом лізування клітин та виявлення мічених компонентів. Кількість FLT3, присутньої на поверхні клітини, може бути визначена безпосередньо шляхом визначення кількості рецептора, присутнього на клітині після обробки антитілом проти FLT3 або іншою речовиною, наприклад, за допомогою клітинного сортера зі збудженням флуоресценції клітин, забарвлених для поверхневої експресії FLT3. Забарвлені клітини інкубують із визначенням інтенсивності флуоресценції впродовж певного проміжку часу. Як контроль, частина забарвленої популяції може інкубуватись при умовах, при яких інтерналізація рецептора припиняється. Як описано у наведених нижче Прикладах, поверхневоклітинна FLT3 може бути виявлена та визначена за допомогою різних антитіл, що є специфічними до FLT3 і які не блокують і не конкурують зі зв'язуванням антитіла, яке піддають випробуванню (Burtrum, et al., Cancer Res. 63: 8912-21 (2003)). У одному з варіантів здійснення наслідком обробки клітини, що експресує FLT3, антитілом за цим винаходом, є зниження поверхневоклітинної FLT3. Зменшення загального рецепторного білка, присутнього у клітині, яке є іншим критерієм негативної модуляції, відображає розклад внутрішніх рецепторів. Таким чином, наслідком обробки клітин (зокрема, ракових клітин) антитілами за цим винаходом є значне зниження загальної клітинної FLT3. Антитіла за цим винаходом пригнічують ріст пухлин. Наприклад, підшкірні ксенотрансплантатні пухлини можна одержати шляхом введення клітин лінії ракових клітин імунодефіцитним мишам. Після цього мишей обробляють шляхом внутрішньоочеревинного введення антитіл, і розмір пухлин визначають через однакові проміжки часу. Порівняно з контрольними ін'єкціями, антитіла за цим винаходом пригнічують ріст пухлин. У одному з варіантів здійснення антитіло за цим винаходом стимулює зворотний розвиток пухлин при застосуванні його разом із протипухлинним засобом. У іншому варіанті здійснення антитіла за цим винаходом стимулюють зворотний розвиток пухлин при їх застосуванні як монотерапії. Стимулювання зворотного розвитку пухлин означає, що наслідком введення ефективної кількості антитіла або ефективної кількості комбінації антитіла та протипухлинного засобу є зменшення розміру або некроз пухлини. Зворотний розвиток пухлини може бути визначений як середнє значення для групи суб'єктів, яких піддають лікуванню за певною схемою, або може бути визначений за кількістю суб'єктів у експериментальній групі, пухлини у яких зазнають зворотного розвитку. Антитіла за цим винаходом можуть бути відділені або очищені від фізіологічного розчину будь-яким методом, відомим у цій галузі, у тому числі осаджуванням за допомогою сульфату амонію або сульфату натрію, з подальшим діалізом проти фізіологічного розчину, іонообмінною хроматографією або імуноафінною хроматографією, а також гель-фільтрацією або зонним електрофорезом. Методом очищення антитіл за цим винаходом, якому віддається перевага, є білок А-специфічна афінна хроматографія. ДНК, що кодує людські антитіла, можна одержати шляхом рекомбінування ДНК, що кодує людські константні ділянки та варіабельні ділянки, за винятком CDR, одержаної по суті або виключно з відповідних ділянок людських антитіл, та ДНК, яка кодує CDR, одержаної від людини. Прийнятні джерела ДНК, яка кодує фрагменти антитіл, включають будь-яку клітину, таку як клітини гібридом та селезінки, які експресують непроцесоване антитіло. Згадані фрагменти 10 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 можуть бути застосовані самі по собі як еквіваленти антитіл або можуть бути рекомбіновані у еквіваленти, як описано вище. Делеції, рекомбінації ДНК та інші способи, описані у цьому розділі, можуть бути здійснені відомими методами. Іншим джерелом ДНК є фаг-дисплейна бібліотека антитіл, як відомо у цій галузі. Антитіла за цим винаходом, наведені як приклади, були одержані за допомогою техніки фагового дисплею. Крім того, цей винахід пропонує вектори експресії, які містять полінуклеотидні послідовності, опис яких наведений вище, функціонально зв'язані з експресійною послідовністю, промотором та енхансерною послідовністю. Був розроблений цілий ряд векторів експресії для ефективного синтезу поліпептиду антитіла у прокаріотних системах, таких як бактерії, та еукаріотних системах, у тому числі (але без обмеження ними) системах культури клітин дріжджів та ссавців. Вектори за цим винаходом можуть містити сегменти послідовностей хромосомної, нехромосомної та штучної ДНК. Може бути застосований будь-який прийнятний вектор експресії. Наприклад, прокаріотні клонувальні вектори включають плазміди з Е. coli, такі як colE1, pCR1, pBR322, pMB9, pUC, pKSM та RP4. Прокаріотні вектори також включають фагової ДНК, такі як М13, та похідні інших нитчастих фагів з одноланцюжковою ДНК. Прикладом вектора, прийнятного у дріжджів, є плазміда 2μ. До числа прийнятних векторів для експресії у клітинах ссавців належать добре відомі похідні SV-40, аденовірусу, послідовності ДНК ретровірусного походження та "човникові" вектори, що є похідними комбінації функціональних векторів ссавців, таких як вектори, опис яких наведений вище, та функціональних плазмід і фагової ДНК. У цій галузі відомі інші еукаріотні вектори експресії (описані, наприклад, у P.J. Southern and P. Berg, J. Mol. Appl. Genet. 1: 327-41 (1982); Subramani et al., Mol. Cell. Biol. 1: 854-64 (1981); Kaufmann and Sharp, J. Mol. Biol. 159: 601-21 (1982); Kaufmann and Sharp, Mol. Cell. Biol. 159: 601-64 (1982); Scahill et al., Proc. Nat'l Acad. Sci. 80: 4654-59 (1983); Urlaub and Chasin, Proc. Nat'l Acad. Sci. 77: 4216-20 (1980)). Вектори експресії, прийнятні для застосування за цим винаходом, містять щонайменше одну контрольну послідовність експресії, яка є функціонально зв'язаною з послідовністю ДНК або її фрагментом, що підлягає експресії. Контрольну послідовність вводять до складу вектора для контролювання та регулювання експресії клонованої послідовності ДНК. Прикладами прийнятних контрольних послідовностей експресії є lac система, trp система, tac система, trc система, головні операторні та промоторні ділянки фага лямбда, контрольна ділянка білка оболонки fd, гліколітичні промотори дріжджів, наприклад, промотор 3-фосфогліцераткінази, промотори кислої фосфатази дріжджів, наприклад, Pho5, промотори альфа-фактора дріжджів та промотори, одержані від поліоми, аденовірусу, ретровірусу та мавпячого вірусу, наприклад, ранній та пізній промотори SV40 та інші послідовності, які, як відомо, контролюють експресію генів прокаріотних або еукаріотних клітин та їх вірусів або їх комбінації. При необхідності експресії генно-інженерної конструкції у дріжджах відповідним селекційним геном для застосування у дріжджах є ген trp1, присутній у дріжджовій плазміді YRp7. Stinchcomb et al., Nature 282:39 (1979); Kingsman et al., Gene 7:141 (1979). Ген trp1 забезпечує селекційний маркер для штаму-мутанта дріжджів, якому бракує здатності до росту на триптофані, наприклад, АТСС (Американська колекція типових культур) № 44076 або РЕР4-1. Jones, Genetics 85:12 (1977). Присутність пошкодження trp1 у геномі дріжджової клітини-хазяїна у подальшому надає ефективне середовище для виявлення трансформації, яка відбувається внаслідок росту при відсутності триптофану. Подібним же чином, Leu2-дефіцитні дріжджові штами (АТСС 20,622 або 38,626) передбачаються відомими плазмідами, що несуть ген Leu2. Цей винахід пропонує також рекомбінантні клітини-хазяї, які містять вектори експресії, опис яких наведений вище. Антитіла за цим винаходом можуть бути експресовані у інших лініях клітин, крім гібридом. Нуклеїнові кислоти, які містять послідовність, яка кодує поліпептид за цим винаходом, можуть бути застосовані для трансформації прийнятної клітини-хазяїна ссавця. Лінії клітин, яким віддається особлива перевага, можуть бути вибрані, виходячи з високого рівня експресії, конститутивної експресії білка, який становить інтерес, та мінімального забруднення білками хазяїна. Лінії клітин ссавців, доступні як хазяї для експресії, є добре відомими у цій галузі і включають багато імморталізованих ліній клітин, таких як (але без обмеження ними) клітини COS-7, клітини яєчника китайського хом'ячка (СНО), клітини нирок дитинча хом'ячка (ВНК) та багато інших, у тому числі лінії клітин лімфоїдного походження, такі як клітини лімфом, мієлом або гібридом. Інші прийнятні еукаріотні клітини включають дріжджі та інші гриби. Прийнятні хазяї-прокаріоти включають, наприклад, Е. coli, такі як Е. coli SG-936, Е. coli НВ 101, Е. coli W3110, Е. coli X1776, Е. coli X2282, Е. coli DHI та Е. coli MRC1, Pseudomonas, Bacillus, такі як Bacillus subtilis та Streptomyces. 11 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рекомбінантні клітини-хазяї за цим винаходом можуть бути застосовані для продукування антитіла або його фрагмента шляхом культивування згаданих клітин при умовах, які уможливлюють експресію антитіла або його фрагмента, та відділення антитіла або його фрагмента від клітини-хазяїна або середовища, яке оточує згадану клітину-хазяїна. Спрямування експресованого антитіла або фрагмента для секреції у рекомбінантних клітинаххазяях може бути полегшене шляхом введення послідовності, яка кодує сигнальний або секреторний лідерний пептид (дивись Shokri et al., Appl Microbiol Biotechnol. 60: 654-64 (2003), Nielsen et al., Prot. Eng. 10: 1-6 (1997); та von Heinje et al., Nucl. Acids Res. 14: 4683-90 (1986)), на 5'-кінці антитілокодувального гена, який становить інтерес. Ці секреторні лідерні пептидні елементи можуть бути одержані як з прокаріотної, так і з еукаріотної послідовностей. Таким чином, застосовують прийнятні секреторні лідерні пептиди, які являють собою амінокислоти, приєднані до N-кінця поліпептиду для спрямування пересування поліпептиду із цитозолю клітини-хазяїна та секреції у живильне середовище. Трансформовані клітини-хазяї культивують методами, відомими у цій галузі, у рідкому живильному середовищі, що містить засвоювані джерела вуглецю (вуглеводи, такі як глюкоза або лактоза), азот (амінокислоти, пептиди, білки або продукти їх розкладу, такі як пептони, солі амонію тощо) та неорганічні солі (сульфати, фосфати та/або карбонати натрію, калію, магнію та кальцію). Згадане живильне середовище також містить, наприклад, рістстимулювальні речовини, такі як мікроелементи, наприклад, залізо, цинк, марганець тощо. Іншим варіантом одержання антитіл за цим винаходом є експресія нуклеїнової кислоти, яка кодує антитіло за цим винаходом, у трансгенній тварині, що має введену у неї значну частину людського геному, що продукує антитіло, і яку роблять дефіцитною щодо продукування ендогенних антитіл. Трансгенні тварини включають (але ними не обмежуються) мишей, кіз та кроликів. Один з інших варіантів здійснення цього винаходу включає експресію антитілокодувального гена, наприклад, у молочній залозі тварини для секреції поліпептиду під час лактації. Як описано нижче у прикладах, наведених нижче, високоафінні антитіла проти FLT3 за цим винаходом можуть бути виділені з фаг-дисплейної бібліотеки, яку конструюють із генів варіабельних ділянок людського важкого і легкого ланцюгів. Наприклад, варіабельний домен за цим винаходом може бути одержаний з лімфоцита периферичної крові, який містить ген реаранжованої варіабельної ділянки. У альтернативному варіанті частини варіабельного домену, такі як гіперваріабельні та каркасні ділянки, можуть бути одержані з різних людських послідовностей. Більше 90% виділених клонів після трьох циклів селекції є специфічними до FLT3. Зв'язувальна спорідненість відібраних Fab до FLT3 може знаходитись у рамках наномольного діапазону, тобто бути на такому самому високому рівні, що і у бівалентних моноклональних антитіл проти FLT3, які були одержані за гібридомною технологією. Антитіла за цим винаходом можна одержати, наприклад, із природних антитіл або Fab чи scFv фаг-дисплейних бібліотек. Однодоменні антитіла можуть бути одержані шляхом відбирання VH або VL домену з природного антитіла чи гібридоми або шляхом відбирання з бібліотеки VH доменів чи бібліотеки VL доменів. Зрозуміло, що амінокислотні залишки, які є головними визначниками зв'язування однодоменних антитіл, можуть знаходитись у межах гіперваріабельних ділянок (визначених за Кабатом або Чотіа), але можуть включати також інші залишки, такі як залишки, які у протилежному випадку були б "заховані" на поверхні розділу VHVL гетеродимеру VH-VL. До антитіл за цим винаходом належать також антитіла, зв'язувальні властивості яких були поліпшені шляхом безпосередньої мутації, методами "визрівання афінності", технікою фагового дисплею або перестановкою ланцюгів. Афінність та специфічність можуть бути модифіковані або поліпшені шляхом мутування CDR і проведенням перевірки з пошуком антигензв'язувальних центрів антитіла, які мають бажані властивості (дивись, наприклад, Yang et al., J. Mol. Biol., 254: 392-403 (1995)). Мутацію CDR здійснюють різними способами. Один зі способів полягає у рандомізації окремих залишків або комбінацій залишків таким чином, щоб у популяції за всіма іншими ознаками ідентичних антигензв'язувальних центрів усі двадцять амінокислот знаходились у конкретних положеннях. У альтернативному варіанті мутації спричинені у ряду залишків CDR методами схильної до помилок ПЛР (дивись, наприклад, Hawkins et al., J. Mol. Biol., 226: 889-896 (1992)). Наприклад, вектори фагового дисплею, які містять гени варіабельних ділянок важких та легких ланцюгів, можуть розмножуватись у штамах-мутаторах Е. coli (дивись, наприклад, Low et al., J. Mol. Biol., 250: 359-368 (1996)). Ці методи мутагенезу є ілюстративними для багатьох методів, відомих фахівцю у цій галузі. Білком, що застосовується для ідентифікації FLT3-зв'язувальних антитіл за цим винаходом, за варіантом, якому віддається перевага, є FLT3, і за варіантом, якому віддається більша 12 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 перевага, позаклітинний домен FLT3. Позаклітинний домен FLT3 може бути вільним або кон'югованим з іншою молекулою. Антитіла за цим винаходом можуть зливатись з додатковими амінокислотними залишками. Такими амінокислотними залишками може бути пептидна мітка, можливо, для полегшення ізоляції. Передбачені також інші амінокислотні залишки для спрямування антитіл у конкретні органи або тканини. У іншому аспекті цього винаходу інгібітори FLT3, у тому числі (але без обмеження ними) антитіла за цим винаходом, можуть вводитись у поєднанні (або хімічним чи біосинтетичним способом зв'язуватись) з протипухлинними засобами чи антиангіогенними засобами або засобами, які продукують виявний сигнал. У наведеному нижче прикладі антитіла за цим винаходом ефективно інтерналізуються при зв'язуванні з клітинами, що несуть FLT3. До протиракових засобів, що вводяться у поєднанні з антитілом, кон'югованими або зв'язаними з ним, належать будь-які засоби, що знищують або пошкоджують пухлину, з якою зв'язалось антитіло, або пухлину, яка знаходиться у середовищі навколо клітини, з якою зв'язалось антитіло. У одному з аспектів інгібітор FLT3 (у тому числі антитіла за цим винаходом) може бути введене як кон'югат, який специфічно зв'язується з рецептором і доставляє токсин після інтерналізації комплексу ліганд-токсин. У іншому аспекті складові кон'югату інгібітор FLT3лікувальний засіб, можуть взаємозв'язуватись безпосередньо або сполучатись за допомогою лінкера, пептиду або непептиду. Наприклад, протипухлинним засобом є токсичний засіб, такий як хіміотерапевтичний засіб або радіоізотоп. Прийнятні протипухлинні засоби є відомими фахівцям у цій галузі і включають антрацикліни (наприклад, дауноміцин (daunomycin) та доксорубіцин (doxorubicin)), ауристатин (auristatin), метотрексат (МТХ), віндезин (vindesine), неокарциностатин (neocarzinostatin), цисплатин (cis-platinum), хлорамбуцил (chlorambucil), цитозин-арабінозид (cytosine arabinoside), 5-фторуридин (5-fluorouridine), мелфалан (melphalan), рицин (ricin) та каліхеаміцин (calicheamicin). Хіміотерапевтичні засоби кон'югують з інгібітором, антитілом або дрібною молекулою за допомогою традиційних способів (дивись, наприклад, Hermentin and Seller, Behring Inst. Mitt. 82: 197-215 (1988)). У одному з аспектів МТХ є протипухлинним засобом за цим винаходом, якому віддається перевага. Крім того, цей винахід передбачає антитіла проти FLT3, зв'язані зі спрямувальними або репортерними складовими, які включають, наприклад, лише протипухлинні засоби, інші антитіла або репортерні молекули, такі як радіоактивні ізотопи, у діагностичній системі, де засіб, що продукує виявний сигнал, кон'югується з антитілом. Засоби, які продукують виявні сигнали, застосовують in vivo та in vitro з діагностичними цілями. Засіб, який продукує сигнал, продукує вимірний сигнал, який виявляється за допомогою зовнішніх засобів, як правило, шляхом вимірювання електромагнітного випромінювання. У більшості випадків засобом, який продукує сигнал, є фермент чи хромофор або ж згаданий засіб випромінює світло шляхом флуоресценції, фосфоресценції або хіміолюмінесценції. До хромофорів належать барвники, які абсорбують світло в ультрафіолетовій або видимій частині спектра, і вони можуть бути субстратами або продуктами розкладу, які утворюються під час реакцій, каталізованих ферментами. Цей винахід також передбачає антитіла проти FLT3, з якими зв'язуються спрямувальні або репортерні складові. Спрямувальні складові є першими членами зв'язувальних пар. Протипухлинні засоби, наприклад, кон'югуються з другими членами таких пар і внаслідок цього спрямовуються у ділянку, з якою зв'язується антитіло проти FLT3. Поширеним прикладом такої зв'язувальної пари є авідин та біотин. У варіанті здійснення, якому віддається перевага, біотин кон'югується з антитілом проти FLT3 і тим самим надає мішень для протипухлинного засобу або іншої складової, яка є кон'югованою з авідином або стрептавідином. У альтернативному варіанті біотин або інша така складова зв'язується з антитілом проти FLT3 за цим винаходом і застосовується як репортерна складова, наприклад, у діагностичній системі, де засіб, який продукує виявний сигнал, є кон'югованим з авідином або стрептавідином. Фахівцям у цій галузі відомі також прийнятні радіоізотопи, які можуть бути застосовані як 131 211 протипухлинні засоби. Наприклад, застосовують І або At. Ці ізотопи приєднують до антитіла за допомогою традиційних способів (дивись, наприклад, Pedley et al., Br. J. Cancer 68: 69-73 (1993)). У альтернативному варіанті протипухлинним засобом, який приєднується до антитіла, є фермент, який активує проліки. У такий спосіб вводять проліки, які залишаються у своїй неактивній формі, доки не досягнуть ділянки пухлини, де перетворюються на свою цитотоксичну форму після введення антитіла. Фактично кон'югат антитіло-фермент вводять пацієнту, при цьому кон'югату антитіло-фермент надають можливість розміщення на ділянці тканини, яка підлягає лікуванню. Після цього пацієнту вводять проліки, внаслідок чого перетворення на цитотоксичний лікарський засіб відбувається на ділянці тканини, яка підлягає 13 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 лікуванню. У альтернативному варіанті протипухлинним засобом, кон'югованим з антитілом, є цитокін, такий як інтерлейкін-2 (IL-2), інтерлейкін-4 (IL-4) або фактор некрозу пухлин альфа (TNF- ). Антитіло спрямовує цитокін на пухлину, внаслідок чого цитокін опосередковує пошкодження або знищення пухлини без ураження інших тканин. Цитокін зливають з антитілом на рівні ДНК за допомогою традиційних методів рекомбінантних ДНК. Цей винахід пропонує також спосіб лікування росту пухлини у ссавця шляхом введення згаданому ссавцю ефективної кількості антитіла, як було описано вище. Патологічні стани, які підлягають лікуванню способом за цим винаходом, уражають клітини, які за варіантом, якому віддається перевага, експресують FLT3. Не обмежуючись жодним конкретним механізмом, способи за цим винаходом передбачають лікування росту ракових клітин в тому числі, наприклад, росту клітин новоутворень, а також лікування відторгнення органних трансплантатів або імунологічного розладу, такого як аутоімунне захворювання, яке стимулюється FLT3. Терміни "лікування" або "лікувати" у контексті цього винаходу означають терапевтичне лікування, у тому числі пригнічення, уповільнення, зменшення або обертання розвитку стану, що лежить у основі, або небажаної фізіологічної зміни, пов'язаної із захворюванням або розладом, полегшення клінічних симптомів стану або запобігання появі клінічних симптомів стану. Сприятливі або бажані клінічні результати включають (але ними не обмежуються) полегшення тяжкості симптомів, зменшення ступеня захворювання або розладу, стабілізацію захворювання або розладу (тобто коли захворювання або розлад не погіршується), уповільнення або затримку розвитку захворювання або розладу, зменшення інтенсивності або тимчасове полегшення або ослаблення проявів захворювання або розладу та ремісію (як часткову, так і повну) захворювання або розладу, як виявну, так і невиявну. Термін "лікування" може також означати подовження виживаності, порівняно з очікуваною виживаністю при відсутності лікування. До числа тих, хто потребує лікування, належать ті, у кого захворювання вже діагностовано. У одному з варіантів здійснення цей винахід може бути застосований як лікарський засіб. Одним із передракових станів, які підлягають лікуванню, є мієлодиспластичний синдром. Інші види раку, які підлягають лікуванню, включають (але ними не обмежуються) гематологічні неоплазії, такі як лейкоз, тобто AML, ALL та CML у фазі бластного кризу, разом з іншими. Інші лейкози включають представлені у Таблиці 9, у якій наведено експресію FLT3 у вибраних людських лейкозних клітинних лініях, яку визначили шляхом забарвлювання ЕВ10 вибраних лейкозних клітинних ліній. Рак може бути також солідною пухлиною, такою як пухлина щитоподібної залози або головного мозку. У способах за цим винаходом терапевтично ефективну кількість антитіла за цим винаходом вводять ссавцю, який цього потребує. Ефективні дози композицій за цим винаходом для лікування розладів, наведених у цьому описі, різняться у залежності від багатьох різних факторів, у тому числі засобів введення, ділянки-мішені, фізіологічного стану пацієнта, чи є пацієнт людиною або твариною, від інших введених лікарських засобів, від того, чи є лікування профілактичним або терапевтичним. Термін "введення", вжитий у цьому описі, означає доставку антитіл за цим винаходом ссавцю будь-яким способом, який може забезпечити досягнення бажаного результату. Вони можуть бути введені, наприклад, внутрішньовенним або внутришньом'язовим шляхом. Незважаючи на те, що людські антитіла за цим винаходом є особливо прийнятними для введення людям, вони можуть бути введені також іншим ссавцям. Термін "ссавець", вжитий у цьому описі, включає (але не обмежується ними) людей, лабораторних тварин, домашніх тварин та сільськогосподарських тварин. Терапевтично ефективна кількість означає кількість антитіла за цим винаходом, яка при введенні ссавцю є ефективною щодо одержання бажаного терапевтичного впливу, такого як пригнічення росту пухлин. Лікувальні дози можуть бути титровані звичайними способами, відомими фахівцям у цій галузі, для оптимізації безпечності та ефективності. Фармацевтичні композиції за цим винаходом можуть містити "терапевтично ефективну кількість" антитіла проти FLT3 за цим винаходом. "Терапевтично ефективна кількість" означає кількість, яка є ефективною, у дозах та впродовж необхідних періодів часу, для досягнення бажаного терапевтичного результату. Терапевтично ефективна кількість антитіла може змінюватись у залежності від таких факторів, як стан захворювання, вік, стать та маса пацієнта, здатність антитіла або частини антитіла викликати бажану реакцію у пацієнта. Терапевтично ефективною кількістю також є кількість, при введенні якої будь-який токсичний або шкідливий вплив антитіла або частини антитіла переважується терапевтично сприятливим впливом. Схема приймання лікарського засобу може регулюватись для забезпечення оптимальної бажаної реакції (наприклад, терапевтичної або профілактичної реакції). 14 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 Антитіла проти FLT3 за цим винаходом вводять для терапевтичного лікування в організм пацієнта, який цього потребує, у кількості, достатній для пригнічення або уповільнення розвитку пухлини або патологічного стану. Розвиток включає, наприклад, ріст, інвазивність, метастазування та/або рецидивування пухлини або патологічного стану. Кількість, достатня для здійснення цього, визначається як терапевтично ефективна доза. Кількості, ефективні для цього застосування, будуть залежати від тяжкості захворювання та загального стану власної імунної системи пацієнта. Схеми застосування лікарського засобу будуть також змінюватись у залежності від стану захворювання та статусу пацієнта у залежності від рекомендацій лікаря, що лікує пацієнта, та від стану пацієнта, причому згадані схеми застосування лікарського засобу будуть, як правило, коливатись у межах від однієї дози у вигляді болюса або безперервного вливання до декількох введень на добу (наприклад, кожні 4-6 год) Прикладом необмежувального діапазону для терапевтично ефективної кількості антитіла за цим винаходом є 0,1-50 мг/кг, за варіантом, якому віддається більша перевага, 3-35 мг/кг, за варіантом, якому віддається більша перевага, 5-20 мг/кг. Кількість та частота введення доз буде визначена лікарем, який лікує пацієнта, і може включати дози від менше ніж 1 мг/кг до більше ніж 100 мг/кг, які вводять щодобово, три рази на тиждень, щотижнево, один раз на два тижні або рідше. Доза на одне введення може знаходитись у межах 1-100 мг/кг, 2-75 мг/кг або 5-60 мг/кг. Однак варто зауважити, що цей винахід не обмежений жодною конкретною дозою. У альтернативних варіантах здійснення цей винахід включає також способи пригнічення активації або визрівання дендритних клітин, що включає контактування дендритної клітини з антитілом за цим винаходом окремо або у комбінації з іншими засобами. Інший спосіб за цим винаходом включає запобігання відторгнення органного трансплантату або лікування аутоімунного захворювання, такого як розсіяний склероз або енцефаліт, що включає введення антитіла за цим винаходом окремо або у комбінації з іншими засобами. У певному варіанті здійснення цього винаходу антитіла проти FLT3 можуть бути введені у комбінації з одним або декількома іншими протипухлинними засобами. Приклади комбінованих способів лікувального впливу дивись, наприклад, у патенті США № 6,217,866 (Schlessinger et al., Anti-EGFR antibodies in combination with anti-neoplastic agents); WO 99/60023 (Waksal et al., AntiEGFR antibodies in combination with radiation). Може бути застосований будь-який прийнятний протипухлинний засіб, такий як хіміотерапевтичний засіб, опромінювання або їх комбінації. Протипухлинні засоби, які на цей час є відомими у цій галузі або випробуються, можуть бути згрупованими у ряд класів, що включають, наприклад, інгібітори мітозу, алкілувальні засоби, антиметаболіти, інтеркалюючі антибіотики, інгібітори фактора росту, інгібітори клітинного циклу, ферменти, інгібітори топоізомераз, засоби, що знижують виживаність, модифікатори біологічних реакцій, антигормони та протиангіогенні засоби. Приклади алкілувальних засобів включають (але ними не обмежуються) цисплатин (cisplatin), циклофосфамід (cyclophosphamide), мелфалан (melphalan) та дакарбазин (dacarbazine). Приклади антиметаболітів включають (але ними не обмежуються) цитозин-арабінозид, доксорубіцин (doxorubicin), даунорубіцин (daunorubicin), паклітаксел (paclitaxel), гемцитабін (gemcitabine), ALIMTA® та інгібітори топоізомераз, іринотекан (СРТ-11), амінокамптотецин (aminocamptothecin), камптотецин (camptothecin), DX-8951f, топотекан (топоізомераза І), етопозид (VP-16) та теніпозид (VM-26) (топоізомераза II). При застосуванні опромінювання як протипухлинного засобу джерело випромінювання, по відношенню до пацієнта, якого піддають лікуванню, може бути зовнішнім (дистанційна променева терапія - EBRT) або внутрішнім (контактна променева терапія - ВТ). Доза протипухлинного засобу, що вводиться, залежить від численних факторів, у тому числі, наприклад, від типу засобу, типу та тяжкості пухлини, яку піддають лікуванню, та шляху введення засобу. Однак слід підкреслити, що цей винахід не обмежується жодною конкретною дозою. У одному з аспектів цього винаходу МТХ є протипухлинним засобом, якому віддають перевагу, призначеним для введення у комбінації з антитілом за цим винаходом. Дані, наведені у цьому описі, демонструють синергічні впливи антитіла проти FLT3, ЕВ10, у комбінації з МТХ. Ця комбінація є особливо новою і неочікуваною, приймаючи до уваги результати in vitro дослідження, опубліковані у роботі Furukawa et al. (Leukemia 21: 1005-1014 (2007)), у якій повідомляється, що одночасне введення інгібітору FLT3, PKC412, з іншими хіміотерапевтичними засобами, за виключенням МТХ, є клінічно ефективним проти FLT3 лейкозу. У цьому винаході може бути застосований будь-який прийнятний спосіб або шлях для введення антитіл проти FLT3 за цим винаходом і факультативно для сумісного введення протипухлинних засобів та/або антагоністів інших рецепторів. При застосуванні комбінованих способів лікувального впливу за цим винаходом антитіло проти FLT3 може бути введеним 15 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 перед початком лікування, під час лікування або після початку лікування із застосуванням іншого засобу, у тому числі, наприклад, лише МТХ, а також будь-якої їх комбінації, тобто перед початком лікування і під час лікування, перед початком лікування та після нього, під час лікування та після нього або перед ним, під час лікування та після початку лікування із застосуванням протипухлинного засобу. Наприклад, антитіло проти FLT3 може бути введеним між 1 днем та 30 днем, за варіантом, якому віддається перевага, між 3 днем та 20 днем, за варіантом, якому віддається більша перевага, між 5 днем та 12 днем перед початком променевої терапії. У варіанті здійснення цього винаходу, якому віддається перевага, хіміотерапію проводять одночасно з терапією антитілами або за варіантом, якому віддається більша перевага, після неї. У іншому аспекті цього винаходу для лікування лейкозу може бути застосований будь-який інгібітор FLT3 у комбінації з МТХ. Антитіла проти FLT3 за цим винаходом можуть бути введені з антитілами, що які нейтралізують інші рецептори, залучені до росту або ангіогенезу пухлин. У одному з варіантів здійснення цього винаходу антитіло проти FLT3 застосовують у комбінації з антагоністом рецепторів, що специфічно зв'язується з EGFR (рецептор епідермального фактору росту). Іншим прикладом такого рецептора є VEGFR (рецептор фактору росту судинного ендотелію). Антитіло проти FLT3 за цим винаходом може бути застосоване у комбінації з антагоністом VEGFR. У додатковому альтернативному варіанті здійснення антитіло проти FLT3 може бути введеним у комбінації з одним або декількома прийнятними ад'ювантами, такими як, наприклад, цитокінами (наприклад, IL-10 та IL-13), або іншими імуностимуляторами, такими як (але без обмеження ними) хемокінами, пухлиноспецифічними антигенами та пептидами. Крім того, ці стимулятори можуть бути введені з МТХ. Однак слід розуміти, що самостійне введення антитіла проти FLT3, як монотерапії, є достатнім для запобігання, пригнічення або уповільнення розвитку пухлини терапевтично ефективним чином. У цьому винаході може бути застосований будь-який прийнятний спосіб або шлях для введення антитіл проти FLT3 за цим винаходом і факультативно для сумісного введення протипухлинних засобів, таких як МТХ та/або антагоністів інших рецепторів. Схеми приймання протипухлинного засобу, які застосовують за цим винаходом, включають будь-яку схему, яка, як гадають, є оптимально прийнятною для лікування пухлинного стану пацієнта. Різні злоякісні стадії, у тому числі різні форми лейкозу, можуть потребувати застосування специфічних протипухлинних антитіл та специфічних протипухлинних засобів, які будуть визначатись індивідуально для кожного пацієнта. Шляхи введення включають, наприклад, пероральне, внутрішньовенне, внутрішньоочеревинне, підшкірне, підоболонкове або внутрішньом'язове введення. Доза антагоністу, що вводиться, залежить від численних факторів, у тому числі, наприклад, від типу антагоністів, типу та тяжкості пухлини, яку піддають лікуванню, та шляху введення антагоністів. Однак слід прийняти до уваги, що цей винахід не обмежується жодним конкретним способом або шляхом введення. Слід розуміти, що антитіла проти FLT3 за цим винаходом, при їх застосуванні у ссавця для профілактики або лікування, будуть вводитись у формі композиції, яка, крім того, містить фармацевтично прийнятний носій. Відповідні фармацевтично прийнятні носії включають, наприклад, один або декілька носіїв, вибраних із групи, до складу якої входить вода, фізіологічний розчин, фосфатно-сольовий буферний розчин, декстроза, гліцерин, етанол тощо, а також їх комбінації. Фармацевтично прийнятні носії можуть також містити незначні кількості допоміжних речовин, таких як зволожувальні засоби або емульгатори, консерванти або буфери, які подовжують строк придатності при зберіганні або підвищують ефективність зв'язувальних білків. Рецептура композиції для ін'єкцій може, як це добре відомо у цій галузі, складатись так, щоб композиції забезпечували швидке, тривале або пролонговане виділення активного інгредієнта після введення ссавцю. Цей винахід також включає набори для пригнічення росту пухлин та/або ангіогенезу, до складу яких входить терапевтично ефективна кількість людського антитіла проти FLT3. Інший варіант здійснення цього винаходу включає набори для пригнічення росту пухлин та/або ангіогенезу, до складу яких входить терапевтично ефективна кількість людського антитіла проти FLT3 з МТХ. Згадані набори можуть також містити будь-який прийнятний антагоніст, наприклад, антагоніст іншого рецептора фактору росту, який є залученим до канцерогенезу або ангіогенезу (наприклад, EGFR (рецептор епідермального фактору росту), VEGFR-1/Flt-1 (рецептор фактору росту судинного ендотелію-1/Flt-1), VEGFR-2 (рецептор фактору росту судинного ендотелію-2), PDGFR (рецептор тромбоцитарного фактору росту), NGFR (рецептор фактору росту нервової тканини) та FGFR (рецептор фактору росту фібробластів)). У альтернативному варіанті або додатково набори за цим винаходом можуть також містити протипухлинний засіб. Приклади 16 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 прийнятних протипухлинних засобів у контексті цього винаходу були описані вище. Набори за цим винаходом можуть також містити ад'ювант, приклади якого були описані вище. Крім того, до обсягу цього винаходу включено застосування антитіл за цим винаходом in vivo та in vitro для дослідницьких або діагностичних методів, які є добре відомими у цій галузі. Діагностичні методи включають набори, які містять антитіла за цим винаходом. Антитіла за цим винаходом зв'язуються з FLT3 з інтенсивністю, яка перевищує зв'язувальну -12 -12 активність ліганду FLT3, тобто з КD у межах від приблизно 200×10 М до 500×10 М. Значення КD для антитіла, що зв'язується з людським гібридним білком FLT3-Fc, знаходиться у межах від -10 -10 0,5×10 М до 0,5×10 М і визначається при температурі 25 °C; антитіла, яким віддається перевага, зв'язуються з людським гібридним білком FLT3-Fc із значенням KD у межах від 1,0×10 10 -10 -10 -10 -10 М до 4,75×10 М, 1,5×10 М до 4,5×10 М або не більше ніж 4,5×10 М, усі з яких визначаються при температурі 25 °C. За варіантом, якому віддається перевага, згадане -5 -1 антитіло зв'язується з FLT3 з константою дисоціації (Кd або koff) у межах від 4,5×10 1/с (с , 1/с) -5 -5 -5 до 6×10 1/с, від 5,0×10 1/с до 5,7×10 1/с, за визначенням за допомогою поверхневого плазмонного резонансу, як описується, при температурі 25 °C, а за варіантом, якому віддається -5 -5 більша перевага, антитіло зв'язується з FLT3 з Kd або koff у межах від 5,1×10 1/с до 5,6×10 1/c або у межах 10% цих констант швидкості. За іншим варіантом, якому віддається перевага, 5 -1 -1 згадане антитіло зв'язується з FLT3 з константою асоціації (Ка або kon) у межах від 0,5×10 М с 5 -1 -1 5 -1 -1 5 -1 -1 (1/Мс; 1/моль 1/с) до 5×10 М с або від 1×10 М с до 4×10 М с , за визначенням за допомогою поверхневого плазмонного резонансу, наведеному у цьому описі, при температурі 25 °C, а за варіантом, якому віддається більша перевага, антитіло зв'язується з FLT3 з К а або 5 -1 -1 5 -1 -1 kоn у межах від 1,2×10 М с до 3,6×10 М с або у межах 10% цих констант швидкості. У іншому варіанті здійснення згадане антитіло зв'язується з FLT3 з константою дисоціації, визначеною за допомогою поверхневого плазмонного резонансу при температурі 25 °C, що знаходиться у межах 10% константи дисоціації, визначеної для ЕВ10, NC7 або D4-3 при таких же самих умовах. Цей винахід являє собою моноклональне антитіло або його фрагмент, специфічне(-ий) до FLT3, що містить одну або декілька гіперваріабельних ділянок (CDR), вибраних з групи, до складу якої входять CDR, представлені у Таблиці 1 та Таблиці 2. У іншому аспекті цей винахід являє собою моноклональне антитіло або його фрагмент, специфічне(-ий) до FLT3, що має CDR3 легкого ланцюга з послідовністю: MQGTHPAIS (послідовність SEQ ID NO: 9). У іншому аспекті цей винахід являє собою моноклональне антитіло або його фрагмент, специфічне(-ий) до FLT3, що має CDR3 важкого ланцюга з послідовністю: GVGAHDAFDI (послідовність SEQ ID NO: 4). У іншому аспекті цей винахід являє собою моноклональне антитіло або його фрагмент, що містить (і) варіабельну ділянку легкого ланцюга, вибрану з групи, до складу якої входить ЕВ10, NC7 та D4-3, і (іі) варіабельну ділянку важкого ланцюга, вибрану з групи, до складу якої входить ЕВ10, NC7 та D4-3. У іншому аспекті цей винахід являє собою моноклональне антитіло або його фрагмент, специфічне(-ий) до FLT3, що містить (і) варіабельну ділянку легкого ланцюга ЕВ10, NC7 та D4-3, (іі) варіабельну ділянку важкого ланцюга ЕВ10, NC7 та D4-3, і (ііі) константні ділянки людського імуноглобуліну G1 (hIgG1). Одним з аспектів цього винаходу є антитіло або його фрагмент, який зв'язує антигенну детермінанту FLT3, де згадана антигенна детермінанта містить до п'яти позаклітинних доменів (D1, D2, D3, D4 та D5) та щонайменше містить будь-який з або обидва домени D4 або D5. У іншому аспекті згаданою антигенною детермінантою є D4. У ще одному іншому аспекті згаданою антигенною детермінантою є D5. У одному з варіантів здійснення цього винаходу згадане антитіло або фрагмент антитіла пригнічує фосфорилування низхідного шляху FLT3, у тому числі STAT5, Akt, PI3K та МАРК. У одному з аспектів антитіла за цим винаходом, розкриті у цьому описі, утворюють імунокон'югат з протипухлинним засобом, у тому числі ауристатином або метотрексатом. Згаданий імунокон'югат може зв'язуватись з виявною міткою. Іншим аспектом є спосіб виявлення контактування зразка клітин-мішеней з антитілом або фрагментом антитіла та виявлення шляхом виявлення міченого антитіла, чи містить FLT3 згаданий зразок. У одному з аспектів терапевтична композиція є ефективною щодо пригнічення росту неопластичних клітин, які експресують FLT3 або стимулювання зворотного розвитку людських пухлин, що експресують FLT3. У інших аспектах терапевтичними композиціями є антитіла за цим винаходом, розкриті у цьому описі, та фармацевтично прийнятний носій. Іншим аспектом цього винаходу є спосіб нейтралізації активації FLT3 у організмі ссавця шляхом введення згаданому ссавцю ефективної кількості антитіла або фрагмента цього антитіла. Ще іншим аспектом є спосіб пригнічення активації або визрівання дендритної клітини, який включає контактування згаданої дендритної клітини з антитілом або фрагментом, що 17 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 розкриваються у цьому описі, у кількості, ефективній для пригнічення активації або визрівання дендритної клітини. Іншим аспектом цього винаходу є спосіб лікування раку у ссавця, що включає введення згаданому ссавцю ефективної кількості антитіла або його фрагмента за будь-яким із вже описаних аспектів. Цей винахід пропонує також спосіб лікування гематологічних неоплазій, у тому числі лейкозу. У цьому винаході лейкоз включає (але не обмежується): гострий мієлоїдний лейкоз (AML), гострий лімфоцитарний лейкоз (ALL), хронічний мієлоїдний лейкоз у фазі бластного кризу (CML у фазі бластного кризу) та мієлодиспластичний синдром. Інший спосіб лікування, запропонований цим винаходом, об'єднує застосування антитіл або їх фрагментів за цим винаходом з введенням іншого протипухлинного засобу або лікарського засобу. У одному із способів лікування протипухлинним засобом є метотрексат (МТХ). Таким чином, розкриті у цьому описі рецепторні антитіла можуть бути застосовані in vivo та in vitro для дослідницьких, діагностичних, профілактичних або лікувальних методів, які є добре відомими у цій галузі. Певні зміни можуть бути внесені будь-яким фахівцем у цій галузі у суттєві ознаки цього винаходу, розкриті у цьому описі, і це означає, що такі модифікації повинні охоплюватись обсягом цього винаходу. Слід розуміти і очікувати, що будь-яким фахівцем у цій галузі можуть бути внесені зміни у суттєві ознаки цього винаходу, розкриті у цьому описі, і це означає, що такі модифікації повинні охоплюватись обсягом цього винаходу. Наведені нижче приклади також ілюструють цей винахід, але вони не повинні розглядатись як такі, що будь-яким чином обмежують обсяг цього винаходу; однак вони жодним чином не повинні розглядатись як такі, що обмежують обсяг цього винаходу. Докладний опис традиційних способів, таких як способи, які застосовують при конструюванні векторів та плазмід, при введенні генів, що кодують поліпептиди, у такі вектори та плазміди, при введенні плазмід у клітини-хазяї та при експресії і визначенні генів та генних продуктів, можна знайти у численних публікаціях, у тому числі у Sambrook, J. et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press (1989) та Coligan, J. et al. Current Protocols in Immunology, Wiley & Sons, Incorporated (1994). Експресія та очищення людських антитіл проти FLT3: Для кожного антитіла конструюють прийнятну нуклеотидну послідовність важкого ланцюга, наприклад, послідовності SEQ ID NO: 37, SEQ ID NO: 38 або SEQ ID NO: 39 (для ЕВ 10, NC7 та D4-3, відповідно), у відповідній експресійній плазміді, наприклад, pGSHC, і конструюють прийнятну нуклеотидну послідовність легкого ланцюга, наприклад, послідовності SEQ ID NO: 40, SEQ ID NO: 41 або SEQ ID NO: 42 (для ЕВ 10, NC7 та D4-3, відповідно), у відповідній експресійній плазміді, такій як pGSLC, прийнятним способом, таким як ПЛР-клонування. Для одержання стабільної клітинної лінії котрансфікують прийнятну лінію клітин-хазяїв, таку як клітини NSO або СНО, з переведеними у лінійну форму плазмідами важкого та легкого ланцюгів шляхом електропорації, та культивують у прийнятному живильному середовищі, такому як безглутамінове модифіковане за способом Дульбекко середовищі İгла з діалізованою сироваткою плода корови, доповненому глутамінсинтетазою. Перевіряють клони на експресію антитіла за допомогою імуноферментного твердофазного аналізу (ELISA), та вибирають максимального продуцента для культивування у обертових колбах. Очищають антитіла прийнятним способом, таким як білок А-специфічна афінна хроматографія. Цей винахід охоплює рекомбінантне людське моноклональне антитіло ЕВ10, непроцесований IgG1κ, спрямований на рецептор людської FLT3. Згадане антитіло складається з людського важкого ланцюга типу гамма-1 підгрупи І та людського легкого ланцюга типу каппа підгрупи II. ЕВ10 Fab ізолювали з людської Fab фаг-дисплейної бібліотеки шляхом відбирання за принципом високоафінного зв'язування з рецептором людської FLT3 та здатністю до блокування зв'язування ліганду із згаданим рецептором. Було показано, що ЕВ10 вибірково зв'язується з людською FLT3 з високою спорідненістю, блокує зв'язування FL та опосередковує ефективну протипухлинну активність на моделях ксенотрансплантатів за допомогою механізму, який охоплює активацію імунної ефекторної функції. Цей винахід включає також рекомбінантне людське моноклональне антитіло NC7, непроцесований IgG1κ, спрямований на рецептор людської FLT3. Згадане антитіло складається з людського важкого ланцюга типу гамма-1 підгрупи І та людського легкого ланцюга типу каппа підгрупи II. Було показано, що NC7 селективно зв'язується з людською FLT3 з високою спорідненістю і блокує зв'язування FL. Цей винахід включає також рекомбінантне людське моноклональне антитіло D4-3, непроцесований IgG1κ, спрямований на рецептор людської FLT3. Згадане антитіло складається з людського важкого ланцюга типу гамма-1 підгрупи І та людського легкого ланцюга типу каппа 18 UA 99194 C2 5 підгрупи II. Було показано, що D4-3 селективно зв'язується з людською FLT3 з високою спорідненістю і блокує зв'язування FL. У Таблиці 1 та Таблиці 2 наведені амінокислотні послідовності та ідентифікаційні номери послідовностей (SEQ ID NO) різних CDR за цим винаходом. Усі послідовності CDR визначаються за схемою нумерації, яка розроблена Кабатом, за виключенням послідовностей SEQ ID NO: 1 та SEQ ID NO: 12, які були визначені за номенклатурою Чотіа. У Таблиці 3 наведені ідентифікаційні номери (SEQ ID NO) різних послідовностей, які стосуються цього винаходу. До обсягу цього винаходу включені також послідовності полінуклеїнових кислот, які кодують амінокислотні послідовності, розкриті нижче. 10 Таблиця 1 Амінокислотна послідовність антитіла ЕВ10 CDR варіабельних ділянок важкого і легкого ланцюгів CDR1 CDR2 CDR3 Важкий ланцюг GYTFTSYYMH SYYMH IINPSGGSTSYAQKFQG GVGAHDAFDI SEQ ID NO 1 2 3 4 Легкий ланцюг SEQ ID NO RSSQSLLHSNGNNYLD 6 LGSNRAS MQGTHPAIS 8 9 Таблиця 2 Амінокислотна послідовність антитіла D4-3 CDR варіабельних ділянок важкого і легкого ланцюгів CDR1 CDR2 CDR3 Важкий ланцюг GYTFTSYYMH SYYMH IINPSGGSTSYAQKFQG VVAAAVADY SEQ ID NO 1 2 3 5 Легкий ланцюг SEQ ID NO RSSQSLLHSNGYNYLD 7 LGSNRAS MQSLQTPFT 8 11 Таблиця 3 Амінокислотна послідовність антитіла NC7 CDR варіабельних ділянок важкого і легкого ланцюгів CDR1 CDR2 CDR3 Важкий ланцюг GGTFSSYAIS SYAIS GIIPIFGTANYAQKFQG FALFGFREQAFDI SEQ ID NO 12 13 14 15 Легкий ланцюг SEQ ID NO RASQSISSYLN 16 AASSLQS QQSYSTPFT 17 18 Таблиця 4 Ідентифікаційні номери амінокислотних послідовностей (SEQ ID NO) антитіл ЕВ10, NC7 та D4-3 Антитіло ЕВ10 NC7 D4-3 15 Важкий ланцюг Варіабельна Повна без ділянка сигналу 19 25 20 26 21 27 Повна з сигналом 31 32 33 Легкий ланцюг Варіабельна Повна без ділянка сигналу 22 28 23 29 24 30 Повна з сигналом 34 35 36 Антитіла, застосовані у експериментах, містили непроцесовані важкі і легкі ланцюги без сигналів, як наведено у Таблиці 4. 19 UA 99194 C2 Таблиця 5 Узагальнення in vitro даних для антитіл ЕВ10, NC7 та D4-3 Антитіло ЕВ10 NC7 D4-3 Дані ELISA Дані конкурентного ELISA стосовно стосовно зв'язування зв'язування FLT3 ліганду і рецептора (IС50) (EC50) 0,5-1,0 нМ 0,5-1,0 нМ 0,3 нМ 0,8 нМ 0,2 нМ 7 нМ FACS (MFI*) 54 63 72 Афінність KD ADCC y (М) людини (%) -10 1,58×10 -10 4,5×10 -10 2,7×10 67% 27% 7% * FACS - аналіз проводили із застосуванням лейкозних клітин лінії EOL-1, як описано нижче. 5 10 15 20 25 30 35 40 45 MFI=Середня інтенсивність флуоресценції Зв'язування антигенної детермінанти антитілами проти FLT3 Конструюють ряд делеційних мутантів позаклітинних доменів FLT3-Fc, шляхом поступового видалення позаклітинних Ig доменів FLT3 з С-кінця, наслідком чого є одержання 5 генноінженерних конструкцій, що включають 4 скорочені рецепторні білки: FLT3-D1, FLT3-D1-2, FLT3D1-3, FLT3-D1-4 та повнорозмірний рецептор, FLT3-D1-5. Одержують ряд варіантів ECD FLT3 шляхом поступового видалення Ig-подібних доменів ECD FLT3 за допомогою методики на основі ПЛР. Одержують чотири делеційні варіанти: Fd1 (амінокислоти 24-183), Fd1-2 (амінокислоти 24-271), Fd1-3 (амінокислоти 24-370) та Fd1-4 (амінокислоти 24-451). Як позитивний контроль, подібним же чином одержують непроцесовану FLT3 (Fd1-5), яка містить амінокислоти 24-541. Клонують усі генно-інженерні конструкції у експресійному векторі pcDNA 3.1(+) (Invitrogen, Carlsbad, Каліфорнія) із застосуванням сайтів рестрикції NheI та HindIII, де вони лігуються у межах рамки зчитування з Fc-доменом людського IgGI, злитим на С-кінці з гексагістидиновою (His) міткою. Перевіряють цілісність кожної генно-інженерної конструкції шляхом ДНК-секвенування. Тимчасово експресують генно-інженерні конструкції у клітинах COS, і за допомогою вестерн-блотингу перевіряють правильність розміру кожної експресованої генноінженерної конструкції. Концентрують культуральні супернатанти. Перевіряють зв'язування FL з рецепторами-мутантами шляхом визначення відносної концентрації білка кожного варіанту у супернатанті за допомогою як ELISA із застосуванням антитіла проти людських Fc-рецепторів, так і вестерн-блотингу, з подальшим доведенням до приблизно однакового рівня перед застосуванням у аналізі зв'язування. Аналізують зв'язування делеційних варіантів ECD FLT3 з FL та антитілами за допомогою ELISA. Коротко кажучи, сенсибілізують 96-лункові планшети антитілом проти His (Qiagen), з подальшим інкубуванням з делеційними варіантами Ig ECD FLT3, як описано вище, впродовж 1 год з обережним струшуванням. Тричі промивають планшети PBST (фосфатно-сольовий буферний розчин з 0,1% TWEEN®-20), після чого інкубують з 100 мкл/лунку серійних розведень IgG антитіл проти FLT3 у PBST з 2% молока. Після 3 промивань інкубують планшети з HRP (пероксидаза хрону) - кон'югованим антилюдським Fab антитілом (100 мкл/лунку) (Jackson ImmunoResearch Labs Inc.). При проведенні аналізу зв'язування ліганду сенсибілізують планшети FL (100 нг/лунку) впродовж ночі при температурі 4 °C, з подальшим інкубуванням з делеційними варіантами Ig ECD FLT3 впродовж 1 год з обережним струшуванням. Після 3 промивань інкубують планшети з HRP-кон'югованим антилюдським Fc антитілом (100 мкл/лунку) (Jackson ImmunoResearch Labs Inc.). Проявляють планшети, як описано вище. Перевіряють зв'язування FL з мутантними рецепторами. Дослідження з картуванням антигенних детермінант показали, що обидва ЕВ10 та D4-3 моновалентні Fab-фрагменти, але не NC7 Fab, блокують зв'язування FLT3 з її лігандом, як показано фактом, що ЕВ10 та D4-3 зв'язуються з FLT3-D1-4 (але не з FLT3-D1-3) та повнорозмірним рецептором, вказуючи тим самим на знаходження їх зв'язувальної(-их) антигенної(-их) детермінанти(детермінант) у межах Ig домену 4, з яким також зв'язується людський FL. З іншого боку, NC7 зв'язується лише з повнорозмірним рецептором, і не зв'язується з жодним з інших мутантів, вказуючи тим самим, що його зв'язувальний сайт знаходиться у межах Ig домену 5. Таким чином, антитіла за цим винаходом зв'язують домен 4 або домен 5, на відміну від лігандів, відомих у цій галузі, які зв'язуються з доменами 1-3. Конкурентний імуноферментний твердофазний аналіз (ELISA) та аналізи блокування 20 UA 99194 C2 5 10 15 20 Для проведення аналізу зв'язування FLT3 96-лунковий планшет був сенсибілізований антитілом проти His (Qiagen, Hilden, Германія) впродовж ночі при температурі 4 °C. Лунки блокують впродовж 1 год блокувальним буфером (PBS (фосфатно-сольовий буферний розчин), ® що містить 0,1% TWEEN-20 та 5% сироватки плода корови (FCS)), після чого інкубують з FLT3Fc (1 мкг/мл×100 мкл/лунка) впродовж 1 год при кімнатній температурі. Тричі промивають лунки PBST, після чого додають ЕВ10 або контрольний IgG, та інкубують при кімнатній температурі впродовж 1 год. Після промивання інкубують планшет із кон'югатом антитіла проти людського ланцюга типу каппа з HRP (100 мкл) при кімнатній температурі впродовж 1 год. Промивають планшети, після чого інкубують з 3,3',5,5'-тетраметилбензидином (100 мкл). Застосовують мікропланшет-рідер для визначення оптичної густини при 450 нм. Для проведення аналізу блокування рецептора-ліганду змішують різні кількості ЕВ10 або контрольного IgG з встановленою кількістю біотинілованого гібридного білка FLT3-Fc (45 нг/лунку) та інкубують при кімнатній температурі впродовж 1 год. Переносять суміш до 96лункових планшетів, попередньо сенсибілізованих FL (25 нг/лунку), після чого інкубують при кімнатній температурі впродовж ще 1 год. Після промивання додають кон'югат стрептавідинуHRP, і зчитують оптичну густину при 450 нм. Обчислюють концентрацію антитіла, необхідну для 50% пригнічення зв'язування FLT3 з FL (ІС50). Здатність ЕВ10 до зв'язування із згаданим рецептором була перевірена за допомогою ELISA. Як показано у Таблиці 6, ЕВ10 зв'язує FLT3 з ЕС50 у межах 0,5-1 нМ. Здатність ЕВ10 до блокування зв'язування рецептора-ліганду перевіряли за допомогою конкурентного ELISA із зв'язуванням FL. Як показано у Таблиці 7, ЕВ10 блокувало зв'язування FL з FLT3 з ІС50 У межах 0,5-1 нМ, у той час, як у контрольного IgG блокувальної активності не спостерігалось. Таблиця 6 Активність зв'язування FLT3 антитілами проти FLT3 за результатами імуноферментного твердофазного аналізу (ELISA) Антитіло Зв'язування з FLT-3 (ЕС50) 0,5-1,0 нМ 0,3 нМ 0,2 нМ ЕВ10 NC7 D4-3 25 Таблиця 7 Активність блокування зв'язування ліганду з рецептором FLT3 антитіл проти FLT3 за результатами імуноферментного твердофазного аналізу (ELISA) Антитіло ЕВ10 NC7 D4-3 Контрольний IgG 30 35 40 Блокування зв'язування FL з FLT-3 (ІС50) 0,5-1,0 нМ 0,8 нМ 7 нМ Блокування відсутнє Відповідно, антитіла за цим винаходом мають високу здатність до блокування ліганду і високу зв'язувальну спорідненість до FLT3. Аналіз кінетики зв'язування поверхневим плазмонним резонансом/Аналіз Biacore™ Кінетику зв'язування антитіла з FLT3 при температурі 25 °C визначають за допомогою поверхневого плазмонного резонансу із застосуванням, наприклад, біосенсора Biacore 2000™ (Pharmacia Biosensor, Uppsala, Швеція). Іммобілізують приблизно 1000 RU (умовних одиниць) антитіла на сенсорному чіпі, і вводять розчинний гібридний білок FLT3-Fc з концентраціями у межах 1,5~100 нМ. Одержують сенсорограми при кожній концентрації, і оцінюють за допомогою програми приладу, наприклад, програми ВІА Evaluation 2.0 для визначення констант швидкості kоn та koff. Кd, яку також позначають як koff, являє собою константу швидкості реакції дисоціації. Ка, яку також позначають як kоn, являє собою константу швидкості реакції асоціації. Константу спорідненості (KD) обчислюють з відношення констант швидкості kоn:koff, при цьому константа спорідненості вимірюється у молях (М). Значення Ка, Kd та KD для антитіл, наведених у цьому описі як приклад, ЕВ10, NC7 та D4-3, в узагальненому вигляді наведені у Таблиці 8. 21 UA 99194 C2 Таблиця 8 Кінетика зв'язування антитіл з рекомбінантною людською FLT3 Антитіло ЕВ10 NC7 D4-3 5 10 15 Ка (1/М·с) kon 5 3,52×10 5 1,24×10 5 1,9×10 Кd (1/с) Кoff -5 5,55×10 -5 5,6×10 -5 5,1×10 KD (М) -10 1,58×10 -10 4,5×10 -10 2,7×10 Відповідно, антитіла за цим винаходом мають високу кінетику зв'язування з FLT3. Протоковий цитометричний аналіз 5 Двічі промивають різні клітини, наведені нижче (5×10 у 0,1 мл), у холодному PBS, після чого інкубують впродовж 30 хв з антитілом проти CD16/CD32 (10 мкг/мл) (BD Pharmingen, San Diego, Каліфорнія) у 100 мкл PBS для блокування Fc-рецепторів на різних клітинах (дивись Таблицю 9). Промивають клітини холодним PBS, після чого інкубують впродовж 45 хв з ЕВ10 (10 мкг/мл) або відповідним контрольним ізотиповим IgG, розведеним у PBS. Промивають клітини холодним PBS, після чого інкубують у 100 мкл РЕ-кон'югованого другого антитіла проти людського F(ab')2 (Jackson Immunoresearch) (розведення 1/200) впродовж 45 хв на льоду. Після промивання аналізують клітини засобами протокової цитометрії, такими як протоковий ® ® цитометр Coulter Epics (Beckman Coulter, Miami, Флорида); дані оцінюють за показником середньої інтенсивності флуоресценції (MFI). У Таблиці 9 наведені результати забарвлення ЕВ10 вибраних лейкозних клітинних ліній. Протоковий цитометричний аналіз показав, що ЕВ10 зв'язалось з FLT3 дикого типу, експресованою на клітинах лінії EOL-1, а також з ITD-мутантною FLT3, експресованою на клітинах лінії BaF3-ITD. Зв'язування ЕВ10 з FLT3-негативними клітинами лінії JM1 або контрольними клітинними лініями BaF3 не спостерігалось. Таблиця 9 Зв'язування ЕВ10 з FLT3 у вибраних людських лейкозних клітинних лініях за даними протокової цитометрії Пухлинна клітинна лінія BaF3/ITD ЕМ-3 EOL-1 SEMK2 MOLM-14 MV-4-11 OCI-AML5 Reh RS4 JM1 Тип лейкозу Фенотип FLT3 MFI ALL CML AML ALL ITD-мутантна Дикого типу Дикого типу Дикого типу Дикого типу /ITD (гетерозиготний) 143,0 37,5 53,5 526,3 ITD 16,3 Дикого типу Дикого типу Дикого типу FLT3-негативний 24,3 19,7 91,6 0,1 AML Біфенотиповий В мієломоноцитарний лейкоз AML ALL ALL В-клітинна лімфома - лейкоз 68,5 20 25 30 Аналіз фосфоритування Культивують клітини у безсироватковому середовищі RPMI (Rosewell Park Memorial Institute) 1640 впродовж ночі. Обробляють клітини впродовж 60 хв різними концентраціями антитіл у безсироватковому середовищі. Стимулюють клітини FL (30 нг/мл) впродовж 15 хв при температурі 37 °C. Отримують лізати клітин за допомогою лізисного буфера (50 мМ розчин трис-буфера, 150 мМ розчин NaCl, 1% NP-40, 1 мМ розчин EDTA, 1 мМ розчин фенілметилсульфонілфториду, 0,5 мМ розчин натрію ортованадату, 1 мкг/мл лейпептину, 1 мкг/мл пепстатину А та 1 мкг/мл апротиніну). Інкубують однакові кількості клітинних лізатів із кожного зразка впродовж ночі при температурі 4 °C з антитілом проти FLT3, 4G8 (BD Pharmingen), після чого з білком А - агарозою (Upstate Biotechnology, Lake Placid, Нью-Йорк) впродовж ще 2 год. Після електрофорезу переносять на нітроцелюлозні мембрани (Invitrogen), здійснюють імуноблотинг з антитілом проти фосфотирозину, 4G10 (Upstate Biotechnology) для 22 UA 99194 C2 5 10 15 20 25 одержання фосфорилованої FLT3. Очищають мембрани, оброблені посилювачем сигналу Qentix™ (Pierce, Rockford, Іллінойс), і проводять повторне зондування за допомогою антитіла S18 проти FLT3 (Santa Cruz Biotechnology, Santa Cruz, Каліфорнія) для виявлення загального вмісту білка FLT3. Візуалізують смуги білка за допомогою хемілюмінесценції (Amersham, Piscataway, Нью-Джерсі). Для виявлення активованих МАРК, Stat5 або АКТ відділяють 50 мкг клітинного білкового екстракту за допомогою SDS-PAGE (електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію), переносять на нітроцелюлозні мембрани та імуноблотують із вказаними антитілами: антитілом проти Phospho-p44/42 МАРК, Phospho-Stat5 (Cell Signaling Technology, Beverly, Массачусетс) або антитілом проти Phospho-AKT (BD Pharmingen). Для виявлення загальних вмісту білків МАРК, Stat5 або АКТ очищають мембрани, і проводять повторне зондування з вказаними антитілами: антитілом проти р44/42 МАРК, антитілом проти Stat5 (Cell Signaling Technology) або антитілом проти АКТ (BD Pharmingen). ЕВ 10 пригнічує FL-індуковане фосфорилування FLT3 дикого типу та ліганд-незалежне конститутивне фосфорилування ITD-мутантної FLT3: У клітин ліній EOL-1 та ЕМ3 додання FL сильно підвищує фосфорилування рецептора FLT3. Інкубування з ЕВ10 блокувало FLіндуковане фосфорилування дозозалежним чином із значенням ІС 50 0,4~4 нМ. Ці результати вказують, що ЕВ10 є сильнодіючим інгібітором ліганд-індукованої активації FLT3 дикого типу. Відомо, що мутація типу ITD, яка з високою частотою виявляється у випадку AML, спричиняє FL-незалежне фосфорилування рецептора та активацію сигнальних шляхів кінази. У Таблиці 10 показаний інгібувальний вплив ЕВ10 на конститутивну активацію мутантної FLT3 із застосуванням клітинних ліній BaF3-ITD та MV4;11. Мутантна FLT3 як у клітинній лінії BaF3-ITD, так і у клітинній лінії MV4;11 була конститутивно фосфорилованою. Порівняно з контрольним антитілом антитіло ЕВ10 пригнічувало FL-незалежне фосфорилування FLT3-ITD у клітин лінії BaF3-ITD. EB10 також значно, хоча і меншою мірою, пригнічувало FL-незалежне фосфорилування FLT3-ITD у клітин лінії MV4;11. Узяті разом, ці результати демонструють, що ЕВ10 також є сильнодіючим інгібітором активності FLT3-ITD. Таблиця 10 ЕВ10 пригнічує FL-індуковане фосфорилування FLT3 дикого типу та ліганд-незалежне конститутивне фосфорилування ITD-мутантної FLT3: Клітинна лінія EOL-1 ЕМ3 BaF3-ITD MV4;11 30 35 40 Мутаційний статус FLT3 Дикого типу Дикого типу Мутація типу ITD Мутація типу ITD Пригнічення фосфорилування FLT3 (ІС50) 0,4 нМ 4 нМ 4 нМ 40 нМ Антитіла за цим винаходом пригнічують FL-індуковане фосфорилування FLT3 дикого типу. ЕВ10 пригнічує FLT3-опосередковану активацію низхідних кіназ: Встановили, що шляхи МАРК, РІ3К та Stat5 були залучені до низхідного передавання сигналу активованої FLT3 (Stirewalt DL and JP, Radich, JP. Nat Rev Cancer 3: 650-665 (2003)). Антитіла за цим винаходом пригнічують низхідні шляхи кіназ МРК, РІ3К та STAT5 при лейкозі. Ефект ЕВ10 на FL-незалежне фосфорилування МАРК, індуковане мутацією FLT3 типу ITD, досліджували із застосуванням клітин ліній BaF3-ITD та MV4;11. EB10 сильно блокувало фосфорилування МАРК у обох клітинних лініях. Ці результати демонструють, що результатом блокади взаємодії ліганду-рецептора FLT3 антитілом ЕВ10 є пригнічення низхідного сигнального шляху МАРК (Таблиця 11). Інкубування з ЕВ10 пригнічувало FL-індуковане фосфорилування АКТ у клітин лінії EOL-1 та FL-незалежне фосфорилування АКТ у клітин лінії BaF3-ITD (Таблиця 12). У клітин лінії BaF3-ITD FL-незалежне фосфорилування Stat5 сильно пригнічувалось антитілом ЕВ10, у той час як у клітин лінії EOL-1 згаданого ефекту не спостерігалось (Таблиця 13). 23 UA 99194 C2 Таблиця 11 ЕВ10 пригнічує FLT3-опосередковану активацію низхідних МАРК-кіназ Клітинна лінія EOL-1 ЕМ3 BaF3-ITD MV4;11 Мутаційний статус FLT3 Дикого типу Дикого типу Мутація типу ITD Мутація типу ITD Пригнічення фосфорилування МАРК (IС50) 0,1 нМ 0,1 нМ 0,1 нМ 0,4 нМ Таблиця 12 Вплив ЕВ10 на фосфорилування АКТ Клітинна лінія EOL-1 BaF3-ITD Мутаційний статус FLT3 Мутаційний статус FLT3 Мутація типу ITD Пригнічення фосфорилування АКТ (ІС50) 1 нМ 0,1 нМ Таблиця 13 ЕВ10 пригнічує FL-незалежне фосфорилування Stat5 Клітинна лінія EOL-1 BaF3-ITD 5 10 15 20 25 Мутаційний статус FLT3 Дикого типу Мутація типу ITD Пригнічення фосфорилування Stat5 (IC50) Відсутність впливу 4 нМ Аналіз клітинної проліферації Збирають клітини лінії EOL-1, і тричі промивають за допомогою безсироваткового середовища RPMI 1640. Культивують клітини у безсироватковому середовищі RPMI 1640 впродовж 12 год. Для клітин лінії BaF3-ITD проводять аналіз проліферації у середовищі RPMI 1640, доповненому 10% FCS (сироватка плода корови), при відсутності екзогенного FL. Відновлюють клітини у безсироватковому середовищі AIM-V, висівають по три однакових зразка 4 на плоскодонному 96-лунковому планшеті (1×10 /100 мкл/лунка), та інкубують з різними концентраціями антитіл (від 0 нМ до 100 нМ) та із використанням 30 нг/мл FL при температурі 37 °C впродовж 68 год. Як фоновий контроль інкубують клітини лише з середовищем при 3 відсутності екзогенного FL. Піддають клітини імпульсній обробці (0,25 мкКі/лунку) [ Н]-тимідином впродовж 4 год. Збирають клітини, та визначають кількість імпульсів на хвилину за допомогою рідинного сцинтиляційного лічильника PerkinElmer Wallace-1205 Betaplate (Wellesley, Массачусетс). Обчислюють відсоткове пригнічення FL-індукованої проліферації клітин лінії EOL1; віднімають кількість імпульсів на хвилину фонової проліферації (тобто зразки клітин, не стимульовані FL) від кількості імпульсів на хвилину усіх експериментальних зразків. Обчислюють відсоткове пригнічення за допомогою такої формули: [(кількість імпульсів на хвилину, визначена для необробленого зразка-кількість імпульсів на хвилину, визначена для зразка, який був оброблений антитілом)/кількість імпульсів на хвилину, визначена для необробленого зразка]×100%. ЕВ10 пригнічує проліферацію лейкозних клітин, які експресують FLT3 дикого типу: FL відіграє важливу роль у проліферації лейкозних клітин. Інкубування з FL підвищує захоплення [3Н]-тимідину клітинами лінії EOL-1. Обробка ЕВ10 пригнічує FL-індуковану проліферацію клітин лінії EOL-1 дозозалежним чином (Таблиця 14). 24 UA 99194 C2 Таблиця 14 ЕВ10 пригнічує FL-індуковану проліферацію лейкозних клітин лінії EOL-1 Обробка ЕВ10 ЕВ10 ЕВ10 ЕВ10 ЕВ10 ЕВ10 ЕВ10 Контрольний IgG 5 Концентрація (нМ) 1,5 3 6 13 25 50 100 100 % пригнічення FL-індукованої проліферації (Середнє ± Середнє квадратичне відхилення) 12,4±2,1 19,4±1,8 29,3±6,5 32,9±1,7 37,2±7,2 40,3±11,5 51,8+8,2 0,4±0,1 ЕВ10 пригнічує проліферацію лейкозних клітин, які експресують ITD-мутантну FLT3: Клітини лінії BaF3, трансформовані FLT3-ITD, проліферують при відсутності FL-стимуляції. FLстимуляція не підвищує проліферацію клітин лінії BaF3-ITD. Обробка ЕВ10 пригнічувала FLнезалежну проліферацію цих клітин дозозалежним чином (Таблиця 15). Таблиця 15 ЕВ 10 пригнічує FL-індуковану проліферацію лейкозних клітин лінії BaF3 Обробка ЕВ10 ЕВ10 ЕВ10 ЕВ10 ЕВ10 ЕВ10 ЕВ10 Контрольний IgG 10 15 20 Концентрація (нМ) 1,5 3 6 13 25 50 100 100 % пригнічення FL-незалежної проліферації (Середнє ± Середнє квадратичне відхилення) 0,5±2,4 0,5±5,6 9,6±3,1 13,0±4,0 23,3±0,6 28,6±3,1 29,2±3,0 2,0±4,0 Аналіз інтерналізації антитіла 125 Помічають антитіла радіоактивним йодом ( І) за допомогою IODO-гранул (Pierce Biotechnology, Rockford, Іллінойс, США) за інструкціями виробника. Вносять аліквоти клітин лінії 5 EOL-1 у мікроцентрифужні пробірки (5×10 клітин/зразок) у 500 мл холодного живильного 125 середовища повного складу. Додають до клітин приблизно 1 мг ЕВ10 і І-мічене антитіло D4-3, та інкубують впродовж 1 год при температурі 4 °C. Двічі промивають клітини холодним PBS, ресуспендують у 500 мл живильного середовища повного складу, після чого інкубують при температурі 4 °C або 37 °C впродовж 0 хв, 30 хв, 60 хв, 120 хв, 240 хв або 360 хв. У кожній часовій точці тричі промивають клітини у PBS, після чого за допомогою гамма-лічильника визначають рівень радіоактивності зразків, які інкубувались при температурі 4 °C, для визначення загальної кількості радіоактивності, зв'язаної з поверхнею клітин. Впродовж 5 хв знімають зразки, інкубовані при температурі 37 °C, за допомогою буфера для знімання клітин (100 мМ розчин гліцину, 2 М розчин сечовини, рН 2,5). За допомогою гамма-лічильника визначають рівень радіоактивності як буфера для знімання клітин, так і знятого дебрісу для визначення відсотка інтерналізованої радіоактивності. 25 UA 99194 C2 Таблиця 16 Інтерналізація антитіл проти FLT3, зв'язаних з FLT3 на поверхні клітин лінії EOL-1 Антитіло ЕВ10 D4-3 5 10 15 20 25 Час при температурі 37 °C (хв) 0 30 60 120 240 360 0 30 60 120 240 360 % інтерналізованих антитіл (± середнє квадратичне відхилення) 11,1 (9,2) 40,5 (13,2) 55,0 (19,1) 53,9 (10,3) 79,9 (24,9) 50,4 (8,5) 6,3 (5,1) 30,1 (4,9) 52,2 (1,7) 59,5 (7,3) 60,4 (4,9) 68,5 (17,1) Клітини лінії EOL-1, мічені радіоактивним ЕВ10 або D-43, легко зв'язувались із поверхнею пухлинних клітин та інтерналізувались часозалежним чином (Таблиця 16). Антитілозалежна клітинна цитотоксичність (ADCC) проти людського лейкозу in vitro 51 Проводять аналізи ADCC за допомогою стандартного аналізу виділення Сr. Одержують збагачену культуру людських природних клітин-кілерів (NK) з нормальної донорської крові, наприклад, з RosettaSep NK Cell Enrichment Cocktail; StemCell Technologies, Inc., Vancouver, British Columbia, Канада, або з NK Cell Isolation Kit II, Miltenyi Biotec. Мітять клітини-мішені 6 51 (2×10 ) Cr (200 мкКі) впродовж 2 год, після чого їх промивають. Інкубують підвищену кількість природних клітин-кілерів (від 0 клітин до 400000 клітин), які попередньо були інкубовані з контрольним IgG (10 мкг/мл, 67 нмоль/л) та моноклональними антитілами С225, ЕВ10, NC7 або 51 D4-3 впродовж 45 хв, з ~4000 Сr-міченими клітинами-мішенями по три однакових зразка у 96лункових планшетах із V-подібним дном впродовж 6 год при температурі 37 °C або 5% SDS (додецилсульфат натрію) для визначення рівня загальної кількості лізатів. Для визначення рівня спонтанного виділення інкубують клітини-мішені (4000 клітин, 100 мкл/лунку) лише з 100 мкл середовища. Збирають з кожної лунки супернатант цитотоксичних культур, і підраховують 51 рівень Сr за допомогою гамма-лічильника (наприклад, 1470 Wallac WIZARD, PerkinElmer Life and Analytical Sciences, Inc., Boston, Массачусетс). Обчислюють відсоток лізису або відсоток цитотоксичності таким чином: 100×(виділення зразка-спонтанне виділення)/(загальне виділення-спонтанне виділення). На відміну від дрібномолекулярних інгібіторів FLT3, антитіла проти FLT3 можуть ініціювати імунні реакції пацієнтів, спрямовані на пухлинні клітини, які експресують FLT3. Зокрема, антитіла можуть індукувати лізис клітин, якщо клітини, що експресують FLT3, є сенсибілізованими людським IgG. Згаданий лізис може бути наслідком активації лейкоцитів, зокрема, природних клітин-кілерів (NK), що експресують Fc-рецептор. Антитіла за цим винаходом являють собою людські антитіла проти FLT3, які мають поліпшену здатність активації низхідних імунних ефекторних функцій, таких як ADCC. ЕВ10 індукував сильну реакцію ADCC; NC7 та D4-3 індукують слабкішу реакцію ADCC (Таблиця 17). 30 Таблиця 17 ADCC FLT3 людських лейкозних клітин in vitro Відношення Е:Т 100:1 33:1 11:1 4:1 % цитотоксичності NC7 27 8 7 1 ЕВ10 67 47 32 22 26 D4-3 7 1 0 0 UA 99194 C2 5 10 15 20 25 30 35 40 45 50 55 60 ЕВ10, NC7 та D4-3 ефективно лікують лейкозні ксенотрансплантати Моделювання людського AML (гострого мієлоїдного лейкозу) шляхом ксенотрансплантації клітин лінії EOL-1: Внутрішньовенним шляхом (i.v.) вводять мишам лінії NOD-SCID у групах з 10 6 тварин лейкозні клітини (5×10 ). Розпочинають лікування через день після введення пухлинних клітин. Обробляють мишей тричі на тиждень шляхом внутрішньоочеревинного (і.р.) введення вказаних кількостей (500 мкг/дозу, 250 мкг/дозу або 100 мкг/дозу) ЕВ10 у 200 мкл фосфатносольового буферного розчину (PBS). Обробляють контрольну групу очищеним людським IgG (500 мкг/дозу). Щоденно контролюють мишей на виживаність. Порівнюють рівень виживаності у експериментальних групах за логарифмічним ранговим критерієм. Усі миші у контрольній групі загинули унаслідок екстенсивного поширення захворювання впродовж 40 днів (середній час виживаності 36,0±3,1 дня). У порівнянні, виживаність була значно довшою у групах мишей, яким вводили 500 мкг/дозу, 250 мкг/дозу або 100 мкг/дозу ЕВ10 (середній час виживаності 62,3±18,7, 55,3±18,9 або 52,8±18,6 зі значенням Р менше ніж 0,001, менше ніж 0,005 або менше ніж 0,001, відповідно). У групі, що одержувала 10 мкг ЕВ10, жодного ефекту не спостерігалось, що вказує на те, що антилейкозний вплив ЕВ10 був дозозалежним. Приживлення людських лейкозних клітин у кістковому мозку: Збирають на 20 день кістковий мозок зі стегнових кісток мишей, які були оброблені ЕВ10 (500 мкг/дозу), та групи мишей, що були оброблені контрольним IgG. Аналізують клітини на людські CD45 засобами протокової цитометрії (на 6 тижні та 14 тижні після ін'єкції лейкозних клітин) на ступінь інфільтрації кісткового мозку пухлинними клітинами. Порівнюють ступінь інфільтрації кісткового мозку пухлинними клітинами за допомогою імуногістохімічного забарвлювання з міченим флуоресцентними барвником антитілом проти людського CD45. Кількість пухлинних клітин у кістковому мозку мишей, які були оброблені ЕВ10, значно зменшилась. 4 BaF3-ITD модель лейкозу: Здійснюють внутрішньовенну ін'єкцію клітин лінії BaF3-ITD (5×10 ) групі з 10 "голих" (nu/nu) мишей. Статистичний аналіз виконують із застосуванням непараметричного однофакторного критерію рангових сум Манна-Уітні (SigmaStat 2.03, SPSS, Inc., Chicago, Іллінойс). Розпочинають лікування через день після введення пухлинних клітин. Обробляють мишей тричі на тиждень шляхом внутрішньоочеревинного (і.р.) введення 500 мкг/дозу або 100 мкг/дозу ЕВ10 у 200 мкл фосфатно-сольового буферного розчину (PBS). Обробляють контрольну групу очищеним людським IgG (500 мкг/дозу). Щоденно контролюють мишей на виживаність. У порівнянні з обробкою контрольним IgG (середній час виживаності 32,4±10,6 дня) обробка ЕВ10 значно подовжила виживаність мишей (63,4±44,6 дня, Р
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibody that specifically binds to human flt3
Автори англійськоюLi, Yiwen, Lu, Dan, Surguladze, David, Tonra, James, R.
Назва патенту російськоюАнтитело, специфически связывающееся с человеческим flt3
Автори російськоюЛи Ивень, Лу Дань, Сургуладзе Дейвид, Тонра Джеймс Р.
МПК / Мітки
МПК: A61P 35/00, C12N 15/13, A61K 39/395, C07K 16/28
Мітки: специфічно, яке, антитіло, зв'язується, людським
Код посилання
<a href="https://ua.patents.su/64-99194-antitilo-yake-specifichno-zvyazuehtsya-z-lyudskim-flt3.html" target="_blank" rel="follow" title="База патентів України">Антитіло, яке специфічно зв’язується з людським flt3</a>
Попередній патент: Спосіб зварювання вузлів металевої сітки
Наступний патент: Система для розпилення сорбенту в середовищі димових газів теплотехнічних установок
Випадковий патент: Металогідридний акумулятор водню