Сполука 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1′-)-етилен з потенційними фізіологічними властивостями
Формула / Реферат
Сполука 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1'-)-етилен з потенційними фізіологічними властивостями загальної формули:
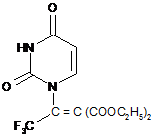 .
.
Текст
Реферат: Сполука 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1'-)-етилен фізіологічними властивостями загальної формули: O HN N O F3 C С = С (СOOС2H5)2 . з потенційними UA 108907 U про видачу патенту: UA 108907 U UA 108907 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до хімії гетероциклічних сполук, а саме до 1,1-діетилкарбокси-2трифторметил-2-(уридил-1'-)-етилен (далі сполука) з потенційними фізіологічними властивостями та високою реакційною здатністю, які можуть проявлятися за рахунок наявності в будові молекули спряженої системи: подвійних зв'язків гетероциклічного ядра, груп С=О у складі ефірних фрагментів, етиленового зв'язку та при електронегативному впливі на молекулу з боку атомів фтору. Структурні аналоги сполуки 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1'-)-етилен в літературі не описані, але різноманітні синтези нових похідних урацилу дозволили отримати оригінальні фізіологічно активні речовини, як свідчать літературні джерела. Після синтезу похідних урацилу, а особливо, 5-фторурацилу та фторафуру, які продемонстрували високу протипухлинну активність, значно зросла кількість досліджень з цього напрямку. Стало відомо, що пухлини використовують молекули урацилу активніше, ніж нормальні клітини. Оскільки вандерваальсові радіуси водню та фтору близькі, можна очікувати, що 5фторурацил (або його похідне) буде виконувати роль субстрату та/або інгібітору ферментів і буде переважно поглинатися тканинами пухлини. З іншого боку, молекули 5 (6)-заміщеного та/або незаміщеного урацилу та його похідних, інших галогеновмісних гетероциклів, здатні виконувати роль фтор(галоген)вмісних синтонів в органічному синтезі з метою створення оригінальних біологічно активних молекул. Введення фтор(галоген)вмісних фармакофорів в гетероциклічну молекулу призводить до підвищення розчинності сполук в ліпідах та робить лікарські засоби ефективнішими у зв'язку із легкістю їх транспорту в організмі [1, 2]. Авторами роботи [3] описано метод введення при використанні доступного фторотану фармакофорної групи -СF2СHBrCl до аліфатичного ланцюга та ароматичного кільця з метою синтезу біологічно активних сполук з поліфторалкоксигрупами. В роботі [4] описано метод синтезу 1,1-диціано-2-хлор-2-трифторметилетилену, який за хімічною будовою подібний до сполуки корисної моделі та синтезований реакцією ацилювання малонодипітрилу метиловим ефіром трифтороцтової кислоти в присутності метилату натрію з послідуючою обробкою продукту першої стадії реакції п'ятихлористим фосфором. Раніше, як описано в роботі [5], автором була синтезована оригінальна сполука - біс-аддукт 1,1'-(2"-бром-2"-хлоретеніл)-біс-(5-фторурацил) в умовах міжфазного каталізу дибензо-18-краун6-ефіром в лужному середовищі, яка має протипухлинну активність на моделях експериментального пухлинного зросту різного гістогенезу: Лімфосаркомі Пліса, Карциномі Герена, Саркоми 45. Даний модифікований метод синтезу перенесено нами на молекулу урацилу незаміщеного з метою отримання сполуки 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1'-)-етилен з потенційними фізіологічними властивостями. Сполука 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1'-)-етилен синтезована з метою отримання нового поліфункціонального фторвмісного синтону для подальшого вивчення її фізико-хімічних та біологічних властивостей, а також дослідження можливості проходження хімічних реакцій між урацилами та фторвмісними реагентами, наприклад, з новим хімічно активним реагентом 1,1-діетилкарбокси-2-хлор-2-трифторметилетиленом. Сполука 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1'-)-етилен поліфункціональна містить в молекулі одночасно з атомами фтору, подвійний зв'язок, дві складноефірні групи, гетероциклічне ядро, тому здатна виконувати роль фтор(галоген)вмісних синтонів в органічному синтезі з метою створення оригінальних складних за будовою біологічно активних молекул. Суть корисної моделі. В основу корисної моделі поставлено хімічну будову молекули сполуки 1,1-діетилкарбокси2-трифторметил-2-(уридил-1'-)-етилен з потенційними фізіологічними властивостями, яка отримана реакцією нуклеофільного заміщення між урацилом, що виконує роль нуклеофільного реагенту, та 1,1-діетилкарбокси-2-хлор-2-трифторметилетиленом, в молекулі якого атом хлору активовано двома діетилкарбоксигрупами, в системі безводних розчинників (ефір діетиловий диметилформамід) в присутності триетиламіну безводного як галогенвіднімаючого агенту. 1,1-діетилкарбокси-2-хлор-2-трифторметилетилен синтезовано реакцією ацилювання діетилового ефіру малонової кислоти трифтороцтовою кислоти в присутності метилату натрію (продукт А) з послідуючою обробкою продукту І стадії реакції п'ятихлористим фосфором в дихлоретані з нагріванням реакційної суміші (продукт В. II стадія реакції) (схема 1): 1 UA 108907 U Схема 1 надл. CF3COOH , CH3ONa CH2(COOC2H5)2 CF3 - C = C(COOС2H5)2 - CH3OH , - H2O PCl5 -NaCl , - POCl3 ONa ( продукт А, І стадія реакції ) CF3 - C = C(COOC2H5)2 uracile, ester- DMFA , t0 , N(C2H5)3 - N (C2H5)3 x HCl Cl 1,1 -діетилкарбокси -2-хлор-2 - трифторметилетилен (продукт В, ІІ стадія реакції ) O HN N O F3C С = С (СOOС2H5)2 1,1 -діетилкарбокси -2 -трифторметил - 2 - (уридил -1' -) -етилен ( продукт С, ІІІ стадія реакції ) 5 10 15 20 25 В ІЧ-спектрі синтезованої сполуки спостерігаються смуги поглинання, які характерні для -1 групи -CF3 в області 400, 415, 470, 560, 905, 995, 1180, 1230, 1295 см , для груп -ОСН3 та -1 ОС2Н5 в області 1050-1150 см . Частоти подвійних зв'язків С-С знаходяться в області 1315, -1 1600 см , -С=О в області 1710, 1715, 1735 см Положення смуг С-С гетероциклу спостерігається -1 -1 в області 1300-1600 см С-H в області 3010-3080 см , а також сигнали в характерній області СН -1 при 600-800 см . В ПМР-спектрі синтезованої сполуки спостерігаються сигнали: у вигляді триплету при 1.18 м. ч., який відповідає шести протонам двох груп -СH3 складноефірних фрагментів молекули, мультиилету при 3,737-4,315 м. ч. чотирьох протонів в фрагментах -ОСН2 складноефірних груп молекули, дублетів при 5,43 м. ч. 7.78 м. ч. протонів при -С(5)Н, 4 -С(6)Н відповідно та синглету при 8,57 м. ч. протону групи -N(з)Н. Таким чином, можна зробити висновок, що сполука з потенційними фізіологічними властивостями, аналогічно до відомих галоген(фтор)вмісних лікарських засобів може бути перспективною для подальшого вивчення як потенційно фізіологічно активна. Ознаки способу. Методика синтезу сполуки 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1'-)-етилен Приготування розчину № 1 (І Стадія реакції). 6,13 г натрію металевого (0,268 моль) розчиняють в 250 мл метанолу безводного, додають краплями через ділильну лійку 43,0 г діетилового ефіру малонової кислоти (40 мл, 0,268 моль) та 62,0 г трифтороцтової кислоти (40 мл, 0.543 моль) при перемішуванні реакційної суміші та нагріванні. Кип'ятять суміш протягом 6 годин, охолоджують до кімнатної температури, відганяють простою перегонкою розчинник. Залишок - скловидну масу білого кольору заливають діетиловим ефіром. Осад білого кольору (продукт А), що випадає фільтрують та використовують на наступній стадії реакції. Приготування розчину № 2 (ІІ Стадія реакції). 2 UA 108907 U 5 10 15 20 25 30 35 40 8.0 г (0,0287 моль) продукту А розчиняють в 55 мл сухого дихлоретану при кімнатній температурі додають 6 г (0,0287 моль) п'ятихлористого фосфору. Реакційна суміш гріється та набуває молочного забарвлення. Гарячий розчин перемішують з кип'ятінням 5 годин, охолоджують, осад, що утворився відфільтровують та промивають дихлоретаном, відганяють простою перегонкою розчинник. Залишок - масло, яке очищують перегонкою у вакуумі (продукт 25 В). Практичний вихід 6.31 г (80 %). Т. кип. 56-59 о С (25 мм рт. ст.), n D 1,3010. Приготування розчину № 3 (ІІІ Стадія реакції). До суміші 0.8 г (0.007 моль) урацилу, розчиненого в 30 мл диметилформаміду безводного та 0.71 г (0.94 мл, 0.007 моль) триетиламіну безводного додають по краплях 1.92 г (0.007 моль) продукту B y 10 мл ефіру діетилового безводного при перемішуванні реакційної суміші та нагріванні до 60-70 °C. Кип'ятять суміш протягом 2 годин (реакційна суміш темно-червоного забарвлення), фільтрують гарячий розчин та відділяють осад N(С 2Н5)3 х НСl, відганяють розчинники у вакуумі. Залишок - масло жовтого забарвлення заливають гексаном та кип'ятять, зливають гексан декантацією, заливають ацетоном, осад блідо-кремового забарвлення випадає із ацетону (продукт С). Практичний вихід 0.78 г (32 %). Тпл. 263-266 °C. Індивідуальність синтезованої сполуки контролювали методом тонкошарової хроматографії, склад підтверджували даними елементного аналізу. Спектр ПМР синтезованої сполуки (Фіг.) записували на приладах "Bruker WP-200" (виробник "Bruker", Switzerland), "Varian T-60" (виробник "Varian", USA) з робочою частотою 200-132 МГц у виді розчину ДМСО-D6 (внутрішній стандарт ТМС). ІЧ-спектр записували на спектрофотометрі UR-20 (виробник "Charles Ceise Hena", Germany). ТШХ виконували на пластинах Silufol-254. ГРХ визначали на газорідинному хроматографі "Perkin Elmer' з УФ-детектором (виробник "Perkin", Germany). Хроматограму, ІЧ-, ПМР-спектри кінцевого продукту ідентифікували у порівнянні з хроматограмами, ІЧ-, ПМР-спектрами вихідних сполук. Синтезована сполука - дрібнокристалічний осад блідо-кремового забарвлення. Дані елементного аналізу на С, Н, N синтезованої сполуки відповідають обчисленим значенням. В ІЧ-спектрі синтезованої сполуки ідентифіковано смуги поглинання, які характерні для -1 групи -CF3 в області 400, 415,470, 560, 905, 995, 1180, 1230, 1295 см , для груп -ОСН3 та -ОС2Н5 -1 -1 в області 1050-1150 см . Частоти подвійних зв'язків С=С знаходяться в області 1315, 1600см , -1 С=О в області 1710, 1715, 1735 см . -1 Положення смуг С-С гетероциклу спостерігається в області 1300-1600 см , С-H в області -1 -1 3010-3080 см ,а також сигнали в характерній області СН при 600-800 см . Співвідношення інтегральних інтенсивностей сигналів в ПМР - спектрі синтезованої сполуки підтверджує наявність в молекулі протонів двох груп -СH3 складноефірних фрагментів молекули у вигляді триплету при 1.18 м. ч., чотирьох протонів в фрагментах -OСH3 складноефірних груп молекули у вигляді мультиплету при 3.737-4.315 м. ч., протонів груп -С(5)Н, -С(6)Н при 5.43 м. ч. та 7.78 м. ч. у вигляді дублетів відповідно, протону групи -N(з)Н у вигляді синглету при 8.57 м. ч. Фізико-хімічні характеристики та дані елементного аналізу синтезованої сполуки наведено в таблиці 1. 45 3 UA 108907 U Таблиця 1 Фізико-хімічні характеристики та дані елементного аналізу сполуки. Знайдемо, в% Обчислено, в %, Брутто-формула С 10 15 N 44,43 5 Н 3,68 7,99 С C13H13O6N2F3 Н 44,59 3,74 ІЧ-спектр 1 (KBr), см C-Hal, Alk, N Heterocycl., С=О, С=С. 8,00 400,415,470, 560 (CF3), 600-800 (Heterocycl.), 905, 995, 1180, 1230, 1295 (CF3), 1050 -1150(ОСНз). (ОС2Н5). 13001600 (Heterocycl.), 1315. 1600 (ОС). 1710, 1715, 1735 (С=О), 3010-3080 (Heterocycl.). Спектр ПМР (ДМСО-D6 ТМС), , м. д.(J, Гц) 1.18 (6H, т., 3 J H.H 7,0 Гц. 2СН3), 3.7374.315 (4Н, м., 3 J H.H 7.0 Гц, 2ОСН2), 5.43 2 (1Н, д.,. J H.H, 10,0 Гц, С(5)Н (Heterocycl.)), 7.78 (1Н. д., 2 J H.H, 10.0 Гц С(6)Н (Heterocycl.)), 8.57 (1Н, с, N(3)11 (Heterocycl.)). Задачею винаходу є опис хімічної будови нової сполуки 1,1-діетилкарбокси-2трифторметил-2-(уридил-1’-)-етилен з потенційними фізіологічними властивостями, яка синтезована з метою отримання нового поліфункціонального фторвмісного синтону для подальшого вивчення її фізико-хімічних та біологічних властивостей. Джерела інформації: 1. Ягупольский Л.М. //Ароматические и гетероциклические соединения с фторсодержащими заместителями. - Киев: Наукова думка, 1988. - С. 90-105. 2. Соединения фтора. Синтез и применение. //Под ред. Н. Исикава. - М.: Мир, 1990. - Гл. 5. С. 183-265. 3. Герус И.И., Колычева М.Т., Ягупольский Ю.Л., Кухарь В.П. //ЖОрХ. - 1989. - Т. 25, Вып. 9. С. 2020-2021. 4. Крохтяк В.П., Ильченко А.Я. //ЖОрХ. - 1880. - Т. 16, Вып. 8. - С. 1694-1698. ’ 5. Вельчинська О.В. Спосіб отримання речовин з протипухлинною активністю 1,1 -(2"-бром2"-хлоретеніл)-біс-(5-фторурацил). Деклараційний патент на корисну модель. 6893. C07D 239/553, С07С 21/18, 21/185, А61K 33/16. Дата прийняття рішення 16.05.2005. Бюл. № 5. - С. 6893. 20 ФОРМУЛА КОРИСНОЇ МОДЕЛІ Сполука 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1'-)-етилен фізіологічними властивостями загальної формули: O HN N O 25 F3 C С = С (СOOС2H5)2 . 4 з потенційними UA 108907 U Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 239/553, C07C 21/18, A61K 33/16, C07C 21/185
Мітки: 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1'-)-етилен, сполука, фізіологічними, потенційними, властивостями
Код посилання
<a href="https://ua.patents.su/7-108907-spoluka-11-dietilkarboksi-2-triftormetil-2-uridil-1-etilen-z-potencijjnimi-fiziologichnimi-vlastivostyami.html" target="_blank" rel="follow" title="База патентів України">Сполука 1,1-діетилкарбокси-2-трифторметил-2-(уридил-1′-)-етилен з потенційними фізіологічними властивостями</a>
Попередній патент: Спосіб отримання сполуки з потенційними фізіологічними властивостями 1,1-діетилкарбокси-2-трифторметил-2-(5′-нітроуридил-1′-)-етилен
Наступний патент: Сполука 1,1-діетилкарбокси-2-трифторметил-2-(5′-нітроуридил-1′-)-етилен з потенційними фізіологічними властивостями
Випадковий патент: Комбікорм для нутрій з вмістом природного мінералу сапоніт











