Спосіб доставки реплікативних та інтегративних плазмідних днк у клітини штаму streptomyces echinatus
Номер патенту: 70091
Опубліковано: 25.05.2012
Автори: Климишин Дмитро олександрович, Федоренко Віктор Олександрович, Гончар Марія Андріївна, Колісник Ганна Василівна
Формула / Реферат
Спосіб уведення реплікативних та інтегративних плазмідних ДНК у штам Streptomyces echinatus, який базується на кон'югативному перенесенні ДНК у штам, який відрізняється тим, що як донор використовують штам кишкової палички Escherichia coli ET12567 (pUB307) із реплікативною плазмідою рКС1139 чи рКС1218Е або інтегративною плазмідою pSET152 чи pRT801, а транскон'югантів відбирають на агаризованому вівсяному середовищі.
Текст
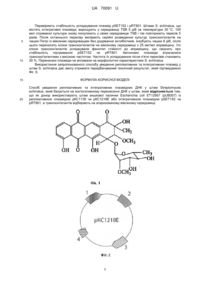
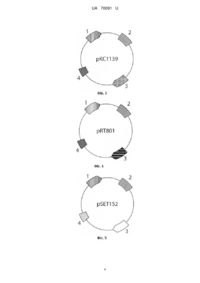
Реферат: Спосіб уведення реплікативних та інтегративних плазмідних ДНК у штам Streptomyces echinatus, який базується на кон'югативному перенесенні ДНК у штам, причому як донор використовують штам кишкової палички Escherichia coli ET12567 (pUB307) із реплікативною плазмідою рКС1139 чи рКС1218Е або інтегративною плазмідою pSET152 чи pRT801, а транскон'югантів відбирають на агаризованому вівсяному середовищі. UA 70091 U (12) UA 70091 U UA 70091 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до генетики та біотехнології мікроорганізмів і може бути використана для клонування генів у клітинах штаму Streptomyces echinatus, що продукує антрацикліновий антибіотик аранціаміцин. Відомий спосіб доставки плазмідних ДНК у клітини актиноміцетів за допомогою електропорації [Wang Y, Zhang S. High frequency transformation of the industrial erythromycinproducing bacterium Saccharopolyspora erythraea II Biotechnol Lett. - 2008. - Vol. 30, N2. - P. 357361]. Спосіб базується на збільшенні проникності клітинної мембрани бактерій під дією зовнішнього електричного поля за напруженості 10 кВ/см. Однак цей спосіб передбачає використання складної апаратури і його ефективність для представників роду Streptomyces є малоефективним через низьку частоту перенесення плазмід. Відомий спосіб, що включає отримання протопластів штамів стрептоміцетів та їхню подальшу трансформацію плазмідними ДНК за наявності поліетиленгліколю [Kieser Т., Bibb M.J., Buttner M.J., Chater K.F., Hopwood D.A. Practical Streptomyces genetics // John Innes Foundation, Norwich, United Kingdom. - 2000. - 613 p.]. Однак ефективність цього способу у різних видів стрептоміцетів сильно відрізняється. До того ж для кожного виду цих бактерій необхідно підбирати свої технічні умови виконання, що ускладнює його застосування. Найближчим за технічною суттю - прототипом є спосіб уведення ДНК у клітини Actinoplanes teichomyceticus за допомогою кон'югативних схрещувань із донорним штамом кишкової палички Escherichia coli ET12567 (pUB307), що містить у плазміді pUB307 tra-оперон, який і забезпечує перенесення корезидентних плазмід [ПУ № 54717. Осташ Б.О., Забуранний Н.В., Громико О.М., Федоренко В.О. Спосіб уведення реплікативних та інтегративних плазмід у штам Actinoplanes teichomyceticus]. Для проведення схрещувань A. teichomyceticus вирощували на вівсяному середовищі: вівсяне борошно - 30 г/л, агар - 18 г/л, вода водопровідна - до 1 л, рН до стерилізації - 7,0 протягом 8 діб за температури 30 °C, а донорну культуру - на середовищі LA: триптон - 10 г/л, дріжджовий екстракт - 5 г/л, NaCl - 5 г/л, агар - 16 г/л протягом 18 год. за температури 37 °C. Пророщену культуру А. teichomyceticus змішували із клітинами донора Е. coli ET12567 (pUB307) та висівали на агаризоване вівсяне середовище. Чашки інкубували протягом 18-20 год. за 30 °C, а потім заливали 1,5 мл дистильованої води, що містила налідиксову кислоту та апраміцин. Частоту появи транскон'югантів визначали через сім діб вирощування за температури 30 °C. Проте, у цьому способі не продемонстровано можливість уведення та стабільної підтримки у клітинах S. echinatus широкого кола реплікативних тa інтегративних плазмід. Також не розкрито впливу плазмід на рівень синтезу аранціаміцину та морфологічні характеристики бактерій. В основу корисної моделі поставлено задачу удосконалити спосіб доставки реплікативних та інтегративних плазмідних ДНК у клітини штаму Streptomyces echinatus шляхом використання широкого кола реплікативних та інтегративних плазмідних ДНК, що дасть змогу стабільно підтримувати їх у клітинах продуцента аранціаміцину. Поставлена задача вирішується так, що у способі доставки реплікативних та інтегративних плазмідних ДНК у клітини штаму Streptomyces echinatus, який базується на кон'югативному перенесенні ДНК у штам, де як донори використовують штам кишкової палички Escherichia coli ЕТ12567 (pUB307) Із реплікативною плазмідою рКС1139 чи рКС1218Е або інтегративною плазмідою pSET152 чи pRT801, а транскон'югантів відбирають на агаризованому вівсяному середовищі. З літературних джерел відомо, що Streptomyces echinatus DSM40730 є продуцентом антрациклінового антибіотика аранціаміцину [Luzhetskyy A, Almuth Mayer, Hoffmann J., Pelzer S. Cloning and Heterologous Expression of the Aranciamycin Biosynthetic Gene Cluster Revealed a New Flexible Glycosyltransferase // Chem. Bio. Chem. - 2008. - Vol. 8. - P. 599-602.]. Похідні цього антибіотика сьогодні успішно застосовуються як самостійно, так і у комплексі з іншими препаратами для терапії злоякісних новоутворень. З огляду на клінічний успіх аранціаміцинів невпинно зростає потреба у вивченні генетичного контролю біосинтезу аранціаміцинів та одержанні промислових надпродуцентів цих сполук. Для цього необхідно володіти ефективними способами перенесення рекомбінантних молекул ДНК у клітини S. echinatus. Авторами вперше запропоновано використати реплікативні плазміди рКС1139, рКС1218Е, що відрізняються своїми репліконами та інтегративні плазміди pSET152 і pRT801, що містять різні системи інтеграції, для перенесення у клітини S. echinatus. Запропоновані плазміди дозволяють значно розширити діапазон генетичних маніпуляцій із продуцентом аранціаміцину. Використання плазміди pSET152 чи pRT801 дозволяє інтегрувати екзогенну ДНК у кілька різних ділянок геному бактерій та забезпечити їхнє стабільне успадкування за відсутності селективного тиску. Плазміда рКС1139 містить температурочутливий реплікон, що дозволяє 1 UA 70091 U 5 10 15 20 25 30 35 40 45 50 55 використовувати її для генних нокаутів у S. echinatus. Плазміда рКС1218Е містить конститутивний промотор гена стійкості до еритроміцину ermЕр Saccharopolyspora erythraea, що спрощує її використання для експресії генів у клітинах S. echinatus. Запропонований спосіб є ширшим та ефективнішим порівняно з відомими способами. Цінністю запропонованого способу є те, що він дає змогу отримати рекомбінантні штами S. echinatus із широким спектром реплікативних та інтегративних плазмід. Також, перевагою є можливість використання дешевого вівсяного середовища для відбору рекомбінантних штамів S. echinatus. Фіг. 1 Хімічна будова аранціаміцину. Фіг. 2, 3, 4, 5 Схеми плазмід рКС1139, рКС1218Е, pSET152 і pRT801, де 1 - маркерний ген стійкості до апраміцину аас(3)IV; RK2 2 - ділянка ініціації кон′югативного перенесення ДНК orilT ; 3 - ділянки ініціації реплікації плазмід pSG5 та pSCP2 (у випадку рКС1139 та рКС1218Е, відповідно) або ділянка attP разом з геном інтегрази фага С31 або VWB (у випадку плазмід pSET152 і pRT801, відповідно); 4 - ділянка клонування чужорідної ДНК (полілінкер). Фіг. 6 Результати ПЛР-аналізу геномів траснкон'югантів S. echinatus, що містять інтегративні плазміди pSET152 і pRT801. Спосіб можна проілюструвати прикладами: Плазмідами рКС1139 чи рКС1218Е, або pSET152 чи pRT801 трансформують донорний штам Е. coli ET12567 (pUB307), який за рахунок (trа-генів плазміди pUB307 забезпечує кон'югативне перенесення плазмідних ДНК [Flett F., Mersinias V., Smith C.P. High efficiency intergeneric conjugal transfer of plasmid DNA from Escherichia coli to methyl-DNA-restricting Streptomycetes II FEMS Microbiol. Lett. - 1997. - V.I55. - P. 223-229]. Одну колонію культури E. coli засівають у 5 мл середовища LB: триптон - 10 г/л, дріжджовий екстракт - 5 г/л, NaCl - 5 г/л з 50 мкг/мл канаміцину. Культуру вирощують до оптичної густини OD 600=0,1, переносять у мікропробірки об'ємом 1,5 мл та осаджують центрифугуванням при 13 тис. об./хв. протягом 1 хв. Зливають супернантант та ресуспендують клітини у 100 мкл середовища LB. Отриману суспензію клітин охолоджують за температури 0±0,1 °C 5 хв., додають 1 мл 0,1 М розчину СаСl2 та інкубують 1 год. за температури 0±0,1 °C. Клітини осаджують центрифугуванням при 13 тис. об./хв. протягом 1 хв., зливають надосадову рідину та ресуспендують у 100 мкл 0,1 М розчину СаСl2. Інкубують 1 год. за температури 0±0,1 °C та додають розчин плазмідної ДНК. Інкубують 1 год. за температури 0±0,1 °C, після чого клітини піддають тепловому шоку протягом 1 хв. за температури 40 °C, охолоджують та додають 1 мл середовища LB. Інкубують 2 год. за температури 37 °C для індукції експресії генів стійкості та висівають на чашки з середовищем LA з 25 мкг/мл апраміцину та 50 мкг/мл канаміцину. Чашки інкубують за температури 37 °C після чого трансформанти пересівають на середовище LA з 25 мкг/мл апраміцину та 50 мкг/мл канаміцину. Плазміди рКС1139, рКС1218Е, pSET152 і pRT801 переносять в S. echinatus шляхом міжродової кон'югації з відповідним штамом Е. соlі ET12567 (pUB307). Суспензію спор штаму S. echinatus висівають на вівсяне середовище та вирощують 7 діб за температури 28 °C для отримання спорової суспензії для кон'югаційних схрещувань. Штам Е. coli ET12567 (pUB307) з плазмідами рКС1139, рКС1218Е, pSET152 i pRT801 висівають на чашку з середовищем LA з 25 мкг/мл апраміцину та 50 мкг/мл канаміцину та вирощують 18 год. за температури 37 °C. Готують суспензію клітин у 3-4 мл середовища LB. Одночасно готують суспензію спор штаму S. echinatus у 3-4 мл стерильного фізіологічного розчину. Суспензію клітин та спор стрептомiцетів осаджують центрифугуванням протягом 4 хв. при 13 тис. об./хв., зливають надосадову рідину, розчиняють у 100 мкл середовища LB, змішують між собою та висівають на чашки з вівсяним середовищем. Чашки інкубують 12-14 год. за температури 28 °C та заливають 1 мл водного розчину, що містить 25 мкг апраміцину та 50 мкг налідиксової кислоти. Частота появи транскон'югантів за наведених умов у середньому становить -3 (2,4±0,3)10 . Отримані транскон'юганти перевіряють на наявність плазміди за допомогою полімеразної ланцюгової реакції (ПЛР) та праймерів, комплементарних до промоторної ділянки маркерного гена стійкості до апраміцину aac(3)IV. Вирощують транскон'юганти у 50 мл рідкого середовища TSB (Merck Chemicals, Німеччина) та виділяють сумарну ДНК [Kieser Т., Bibb M.J., Buttner M.J., Chater K.F.,Hopwood D.A. Practical Streptomyces genetics // John Innes Foundation, Norwich, United Kingdom. - 2000. - 613 p], зразки якої використовують для ампліфікації промотора гена aac(S)IV. Факт ампліфікації фрагменту ДНК розміром 0,2 т.п.н., який відображено на Фiг. 6, свідчить про iнтеграцію плазмід pSET152 і pRT801 у геном S. echinatus. 2 UA 70091 U 5 10 15 20 Перевіряють стабільність успадкування плазмід pSET152 і pRT801. Штами S. echinatus, що містять інтегративні плазміди, вирощують у середовищі TSB 5 діб за температури 30 °C. 100 мкл отриманої культури знову інокулюють у свіже середовище TSB і так повторюють пересів 5 разів. Після останнього пересіву висівають серійні розведення культур транскон'югантів на чашки Петрі із вівсяним середовищем без додавання антибіотиків. Інкубують чашки 8 діб, після цього переносять клони транскон'югантів на вівсяному середовищі з 25 мкг/мл апраміцину. Усі клони транскон'югантів успадкували фенотип стійкості до апраміцину, що свідчить про стабільність підтримання pSET152 чи pRT801. Автономні плазміди втрачалися транскон'югантами з високою частотою. Частота їх успадкування після п'яти пересівів становить 30 %. Перенесені плазміди не впливали на морфологічні характеристики S. echinatus. Використання запропонованого способу уведення реплікативних та інтегративних плазмід у штам S. echinatus дає змогу отримати передбачуваний технічний результат, який підтверджено Фіг. 6. ФОРМУЛА КОРИСНОЇ МОДЕЛІ Спосіб уведення реплікативних та інтегративних плазмідних ДНК у штам Streptomyces echinatus, який базується на кон'югативному перенесенні ДНК у штам, який відрізняється тим, що як донор використовують штам кишкової палички Escherichia coli ET12567 (pUB307) із реплікативною плазмідою рКС1139 чи рКС1218Е або інтегративною плазмідою pSET152 чи pRT801, а транскон'югантів відбирають на агаризованому вівсяному середовищі. 3 UA 70091 U 4 UA 70091 U Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for introduction of replicative and integrative plasmid dna into the cells of strain streptomyces echinatus
Автори англійськоюKlymyshyn Dmytro Oleksandrovych, Fedorenko Viktor Oleksandrovych, Honchar Mariia Andriivna, Kolisnyk Hanna Vasylivna
Назва патенту російськоюСпособ доставки репликативных и интегративных плазмидных днк в клетки штамма streptomyces echinatus
Автори російськоюКлимишин Дмитрий Александрович, Федоренко Виктор Александрович, Гончар Мария Андреевна, Колесник Анна Васильевна
МПК / Мітки
МПК: C12N 15/03, C12N 15/67
Мітки: клітині, інтегративних, echinatus, штаму, днк, доставки, спосіб, реплікативних, плазмідних, streptomyces
Код посилання
<a href="https://ua.patents.su/7-70091-sposib-dostavki-replikativnikh-ta-integrativnikh-plazmidnikh-dnk-u-klitini-shtamu-streptomyces-echinatus.html" target="_blank" rel="follow" title="База патентів України">Спосіб доставки реплікативних та інтегративних плазмідних днк у клітини штаму streptomyces echinatus</a>
Попередній патент: Спосіб лазерного контролю ступеня структурної досконалості кристалічних матеріалів
Наступний патент: Спосіб переробки вакуумного газойлю
Випадковий патент: Спосіб оцінки генотипу бугаїв-плідників молочних порід по якості нащадків