Спосіб формування покриття з оксидів металів на електропровідній підкладці, активований катод, одержаний цим способом, та його застосування для електролізу водних розчинів хлоридів лужних металів
Номер патенту: 80610
Опубліковано: 10.10.2007
Автори: Андолфатто Франсуаз, Дюбеф Жерар, Жубер Філіпп
Формула / Реферат
1. Спосіб формування на електропровідній підкладці покриття з оксидів металів, принаймні один з яких є дорогоцінним металом VIII групи Періодичної системи елементів, який включає нанесення на електропровідну підкладку розчину принаймні однієї металоорганічної речовини з наступною термообробкою цієї речовини в оксид металу, який відрізняється тим, що використовують підкладку із заліза або сталі, на яку наносять безводний розчин ацетилкетонату металу або суміші ацетилкетонатів металів у відповідному розчиннику, здатному розчиняти ацетилкетонат, який вибирають з групи спиртів, кетонів, хлорметанів або суміші двох або більше вказаних розчинників.
2. Спосіб за п. 1, який відрізняється тим, що вказаний дорогоцінний метал використовують у поєднанні з титаном або цирконієм.
3. Спосіб за п. 1 або 2, який відрізняється тим, що дорогоцінний метал VIII групи Періодичної системи вибирають з групи: рутеній, родій, паладій, осмій, іридій та платина.
4. Спосіб за п. 3, який відрізняється тим, що дорогоцінним металом є рутеній або іридій.
5. Спосіб за п. 4, який відрізняється тим, що дорогоцінним металом є рутеній.
6. Спосіб за п. 1 або 2, який відрізняється тим, що спирт є етанолом або ізопропанолом.
7. Спосіб за п. 1 або 2, який відрізняється тим, що кетоном є ацетон.
8. Спосіб за п. 1 або 2, який відрізняється тим, що хлорметаном є хлороформ.
9. Спосіб за будь-яким з пп. 1-8, який відрізняється тим, що розчин ацетилкетонату металу одержують шляхом розчинення вказаного ацетилкетонату металу у відповідному розчиннику або суміші розчинників, що містить відповідний розчинник.
10. Спосіб за будь-яким з пп. 1-8, який відрізняється тим, що розчин, який містить суміш ацетилкетонатів металів одержують шляхом розчинення вказаних ацетилкетонатів металів у суміші відповідних розчинників, здатних розчиняти вказані ацетилкетонати, або шляхом окремого змішування розчинів кожного ацетилкетонату у відповідному розчиннику або суміші розчинників, що містить відповідний розчинник.
11. Спосіб за будь-яким з пп. 1-10, який відрізняється тим, що для одержання покриття з оксиду або оксидів металів на першому етапі підкладку зі сталі або заліза піддають попередній обробці, а на другому - наносять на оброблену підкладку розчин ацетилкетонату або суміші ацетилкетонатів металів з наступним висушуванням та випалом одержаного покриття.
12. Спосіб за п. 11, який відрізняється тим, що висушування здійснюють при температурі не вище 150 °С.
13. Спосіб за п. 11, який відрізняється тим, що підкладку з нанесеним ацетилкетонатом або сумішшю ацетилкетонатів металів піддають випалу у повітряному середовищі або середовищі інертного газу з додаванням кисню при температурі не нижче 300 °С, переважно при температурі від 400 до 600 °С, протягом періоду від 10 хвилин до 2 годин.
14. Спосіб за п. 11, який відрізняється тим, що другий етап повторюють принаймні 1 раз, переважно - від 2 до 6 разів.
15. Електропровідна підкладка зі сталі або заліза, що містить покриття з оксидів металів, яка одержана за способом за будь-яким з пп. 1-14.
16. Активований катод, який одержаний формуванням покриття на електропровідній підкладці способом за будь-яким з пп.1-14.
17. Застосування активованого катода за п. 16 для електролізу водних розчинів хлоридів лужних металів.
18. Застосування активованого катода за п. 17, яке відрізняється тим, що водним розчином хлориду лужного металу є водний розчин хлориду натрію.
19. Спосіб одержання хлору та гідроксиду лужного металу шляхом електролізу відповідного хлориду з використанням катода за п. 16.
20. Спосіб одержання хлоратів лужних металів шляхом електролізу відповідного хлориду з використанням катода за п. 16.
Текст
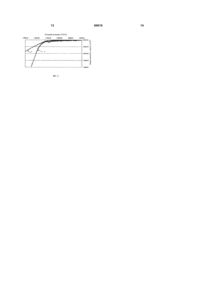
1. Спосіб формування на електропровідній підкладці покриття з оксидів металів, принаймні один з яких є дорогоцінним металом VIII групи Періодичної системи елементів, який включає нанесення на електропровідну підкладку розчину принаймні однієї металоорганічної речовини з наступною термообробкою цієї речовини в оксид металу, який відрізняється тим, що використовують підкладку із заліза або сталі, на яку наносять безводний розчин ацетилкетонату металу або суміші ацетилкетонатів металів у відповідному розчиннику, здатному розчиняти ацетилкетонат, який вибирають з групи спиртів, кетонів, хлорметанів або суміші двох або більше вказаних розчинників. 2. Спосіб за п. 1, який відрізняється тим, що вказаний дорогоцінний метал використовують у поєднанні з титаном або цирконієм. 3. Спосіб за п. 1 або 2, який відрізняється тим, що дорогоцінний метал VIII групи Періодичної системи вибирають з групи: рутеній, родій, паладій, осмій, іридій та платина. 4. Спосіб за п. 3, який відрізняється тим, що дорогоцінним металом є рутеній або іридій. 5. Спосіб за п. 4, який відрізняється тим, що дорогоцінним металом є рутеній. 6. Спосіб за п. 1 або 2, який відрізняється тим, що спирт є етанолом або ізопропанолом. 7. Спосіб за п. 1 або 2, який відрізняється тим, що кетоном є ацетон. 2 (19) 1 3 80610 4 17. Застосування активованого катода за п. 16 для електролізу водних розчинів хлоридів лужних металів. 18. Застосування активованого катода за п. 17, яке відрізняється тим, що водним розчином хлориду лужного металу є водний розчин хлориду натрію. 19. Спосіб одержання хлору та гідроксиду лужного металу шляхом електролізу відповідного хлориду з використанням катода за п. 16. 20. Спосіб одержання хлоратів лужних металів шляхом електролізу відповідного хлориду з використанням катода за п. 16. Винахід стосується способу формування на електропровідній підкладці покриття з оксидів металів, принаймні один з яких є дорогоцінним металом з VII групи періодичної системи, можливо асоційований з титаном та/або цирконієм. , Винахід також стосується активованого катода, що включає електропровідну підкладку з покриттям, отриманим відповідно до способу, що заявляється. Винахід, до того ж, стосується використання зазначеного активованого катода для електролізу, зокрема, водних розчинів хлоридів лужних металів з метою одержання хлору та гідроокису натрію, а також для одержання хлорату натрію. У промислових умовах хлор, гідроокис натрію та хлорид натрію отримують з використанням електролізних блоків, кожен з яких містить декілька сталевих катодів та декілька титанових анодів з покриттям із суміші оксидів титану та рутенію. Якщо йдеться про отримання хлору або лугу до блоків додають електролітичний розчин, що містить хлорид натрію у кількості від 200 до 300г/л. Для отримання хлорату натрію вміст хлориду натрію складає від 50 до 250г/л. Між тим, зазначені сталеві катоди мають відносно високі значення перенапруги як катоди для відновлення води, а їх стійкість до корозії розчиненим хлором є низькою. Під перенапругою слід розуміти різницю між термодинамічним потенціалом окислювальновідновлювальної пари (Н2О/Н2) по відношенню до порівняльного катода та реальним виміряним потенціалом в середовищі у співставленні з тим же порівняльним катодом. Отже, в подальшому ми будемо використовувати термін "перенапруга" для n значення абсолютної величини перенапруги на катоді. Для усунення цих недоліків були запропоновані численні конструкції катодів. Так, у [заявці Франції FR 2311108] описаний катод, основою якого є пластина з титану, цирконію, ніобію або сплаву цих металів, на яку нанесене покриття з оксиду металу, переважно з групи, що включає рутеній, родій, паладій, осмій та платину, а також, можливо, оксид одного чи декількох металів із групи, що включає кальцій, магній, стронцій, барій, цинк, хром, молібден, вольфрам, селен та телур. В [патенті US 4,100,049] описаний катод, який містить підкладку з нікелю, кобальту, заліза або їх сплаву, вкриту оксидом паладію та цирконію. В [заявці ЕР 209427] пропонується катод, електропровідна підкладка якого виготовлена з нікелю, нержавіючої сталі або м'якої сталі і вкрита декількома шарами оксидів металів; при цьому верхній шар виконаний з оксиду перехідного металу, тобто металу, вибраного з груп 4b, 5b та 6b періодичної системи, а проміжний шар - з оксиду дорогоцінного металу з VIII групи, а саме рутенію, родію, паладію, осмію, іридію або платини. Верхній та проміжні шари можуть бути виконані з чистого оксиду зазначених металів або зі змішаного оксиду, де другий метал міститься в незначній кількості. У патентній заявці того ж заявника [FR 2797646] запропонований активований катод, що містить електропровідну підкладку з титану або нікелю, вкриту проміжним шаром з оксидів титану або дорогоцінного метала з VIII групи періодичної системи, та верхнім шаром з оксидів титану, цирконію та одного дорогоцінного металу з VIII групи періодичної системи; це покриття одержують шляхом термічного розкладу розчину хлориду або оксихлориду цих металів в етанолі або ізопропанолі. Виходячи з економічних міркувань, все доцільнішим стає використання підкладок з більш дешевих матеріалів, а саме - сталі або заліза. Втім, заявник мав змогу пересвідчитись, що останній з описаних способів не дає змоги отримати тривке покриття на підкладці зі сталі або заліза. Заявник встановив також, що шляхом досконалого підбору металоорганічних компонентів та відповідних розчинників можливо отримати покриття з перелічених вище оксидів, що матиме чудову адгезію до підкладок зі сталі та заліза. Винахід, таким чином, спрямований на створення способу формування покриття з оксидів металів, що містять принаймні один дорогоцінний метал з VIII групи періодичної системи, можливо у сполученні з титаном і/або цирконієм, на електропровідній підкладці, який передбачає нанесення на зазначену підкладку розчину принаймні однієї металоорганічної сполуки з наступним перетворенням цієї (цих) сполуки (-ук) на оксид (-ди) металу (-ів) шляхом термічної обробки; при цьому, відповідно до винаходу, електропровідна підкладка виготовлена зі сталі або заліза, а розчин, що на неї наносять, є безводним розчином ацетилкетонату металу або розчином суміші ацетикетонатів металів у розчиннику або суміші розчинників, здатних розчиняти кожен з ацетилкетонатів та вибраних з групи спиртів, кетонів, хлорметанів. Відповідно до винаходу, під дорогоцінним металом з VIII групи періодичної системи слід розуміти рутеній, родій, паладій, осмій, іридій або платину. Оптимальним є 5 використання рутенію або іридію, а понад усе рутенію. Як приклад спирту, що може використовуватись, слід назвати етанол та ізопропанол. Як приклад кетонів, що можуть використовуватись, слід назвати ацетон та метилетилкетон. Як приклад хлорметанів, що можуть використовуватись, слід назвати хлорметилен та хлороформ. Відповідно до винаходу, розчин, що підлягає нанесенню на електропровідну підкладку, є розчином ацетилкетонату металу, обраного з групи: Ru, Rh, Pd, Os, Ir, Pt, Ts та Zr, або сумішшю двох або більше зазначених ацетилкетонатів. Технології приготування розчину ацетилкетонату (-ів) метала (-ів) для одержання покриття на електропровідній підкладці відповідно до винаходу можуть бути різними. Якщо розчин містить лише один ацетилкетонат металу, він може готуватись шляхом розчинення цього ацетилкетонату і відповідному розчиннику або суміші розчинників, до якої входить і згаданий розчинник. Якщо розчин містить декілька ацетилкетонатів, він може готуватись: або розчиненням зазначених ацетилкетонатів у суміші відповідних розчинників; або змішуванням розчинів окремих ацетилкетонатів, попередньо розчинених у відповідних розчинниках або суміші розчинників, яка містить відповідний розчинник. Розчинення бажано здійснювати в умовах перемішування, при кімнатній або дещо підвищеній температурі, що сприятиме розчиненню. Відповідно до винаходу, бажано використовувати концентровані розчини ацетилкетонатів, і фахівець, який їх готуватиме, має брати до уваги розчинність різних ацетилкетонатів у відповідних розчинниках або їх сумішах. Так, наприклад, при кімнатній температурі розчин ацетилакетонату рутенію (C5H7O2)3Ru в етанолі матиме концентрацію 0,25моль/літр, а розчин ацетилкетонату титану (С5Н7О2)2ТіО в ацетоні - 0,8моль/літр. В оптимальному варіанті реалізації, формування покриття з оксидів металів передбачає, на першому етапі, попередню обробку сталевої або залізної підкладки з метою надання їй певної шорсткості, з наступним, на другому етапі, нанесенням на підготовану поверхню розчину ацетилкетонату(-ів) металу(-ів), приготованого(-их), як зазначено вище, і, нарешті, фінальним сушінням та випалом. Цей другий етап - змочування/сушіння/випал в оптимальному варіанті може повторюватись декілька разів, завдяки чому і формується покриття. Як правило, його повторюють стільки разів, скільки необхідно для відкладання необхідної маси металу. Найчастіше, від 2 до 6 разів. 80610 6 Попередня обробка полягає, наприклад, у абразивній обробці підкладки з наступним промиванням кислотою або у травленні оксалатною кислотою, фтористоводневою кислотою, сумішшю фтористоводневої та азотної кислоти, сумішшю фтористоводневої кислоти та гліцерину, сумішшю фтористоводневої та азотної кислоти з гліцерином або сумішшю фтористоводневої кислоти, азотної кислоти та перекису водню, з наступним одним або декількома промиваннями демінералізованою та дегазованою водою. Підкладка може мати форму монолітної пластини, перфорованої пластини, металевої смуги або катодного кошика з металевої перфорованої смуги. Розчин на підготовлену підкладку можна наносити різними способами: розпиленням, змочуванням або у гелеподібній формі. Оптимальним є нанесення розчину на підкладку за допомогою пензля. Вкрита розчином підкладка повинна висохнути на повітрі або в печі, де температура не перевищуватиме 150°С. Після сушіння підкладку випалюють в повітрі або в інертному газі з добавкою кисню при температурі не нижче 300°С, бажано від 400°С до 600°С, протягом часу від 10 хвилин до 2 годин. Ця процедура дозволяє перетворити ацетилкетонат(-и) метала(ів) в покриття з металевого(-их) оксиду(-ів), щільне та з доброю адгезією до сталі або заліза. Покриття може бути нанесене на один бік катоду або на обидва боки. Питома маса відкладеного таким чином дорогоцінного металу, виражена у г/м2, складає щонайменше 2г/м2, найчастіше від 2 до 20г/м2, а переважно - від 5 до 10г/м2. Об'єктом винаходу є також так званий "активований" катод, виготовлений на підкладці з покриттям відповідно до винаходу. Катод, що заявляється, придатний перш за все для електролізу водних розчинів хлоридів лужних металів, зокрема водних розчинів NaCl. Використання катода, що заявляється, в сукупності з анодом дозволяє синтезувати електролітичним шляхом хлор та гідроксид лужного металу. Для цієї мети придатним є анод DSA (Dimesionally Stable Anode), виконаний на підкладці з титану, вкритої шаром оксидів титану та рутенію. Молярне співвідношення рутеній/титан в цьому покритті переважно складає від 0,4 до 2, 4. Перевагою катода, що заявляється, є низьке значення перенапруги, а також використання дешевих матеріалів для виготовлення підкладки. Подані нижче приклади ілюструють винахід. Приклад 1 Покриття на основі оксидів Ru, Ті та Zr Розчин для нанесення на підкладку готували шляхом розчинення 0,653г ацетилкетонату рутенію, 0,329г ацетилкетонату титану та 0,178г ацетикетонату цирконію в 10мл етанолу + 10мл ацетону + 10мл хлороформу, що забезпечує молярне співвідношення 45 Ru/45 Ті/10 Zr. 7 80610 Підкладка була виконана у вигляді монолітної пластинки з заліза (3,5x2,5см), до якої був приварений сталевий стрижень: повна поверхня становила 33см2. Підкладка була попередньо оброблена абразивом Corindon та промита ацетоном. Підкладку по всіх поверхні обробили розчином, поклали до печі з температурою 120°С на 15 хвилин, після чого витримали ще 15 хвилин при температурі 450°С. Таким чином отримали покриття масою 2,4г/м2. Цю обробку повторили 3 рази (всього 4 шари покриття), що дало змогу довести масу покриттядо 7,9г/м2, що еквівалентно масі 3,3г(Ru)/м2. Останній цикл термообробки здійснювали 30 хвилин при 450°С. Перед електролітичним випробуванням сталевий стрижень ізолювали тефлоновою стрічкою з метою обмежити поверхню до точно визначених розмірів. Підладку з отриманим покриттям вміщували до електролітичного блока, який містив 200мл електроліту з одномолярним вмістом катіонів Na та випробували як катод при кімнатній температурі. Використовували другий електрод - титановий анод, вкритий RuO2-TiO2, а також порівняльний каломельний електрод ECS, подовжений капілярною трубкою, заповненою насиченим розчином КСl. Електроди підключали до клем потенціостату (Solartron). Активність катоду визначали за поляризаційними кривими в умовах збільшення потенціалу 1,3 або 1,4 V/ECS зі швидкістю 1мВ/с. Після цього здійснювали етап активації шляхом подачі на катод струму 2 ампери протягом 1 години і знову визначали нову поляризаційну криву для оцінки змін у електрохімічних властивостях катоду. Процедуру активації повторювали до отримання сталої поляризаційної кривої, тобто такої, яка не відрізнялась від попередньої (як правило, 3 або 4 рази). У таблиці 1, поданій нижче, показані зміни катодного потенціалу для щільності струму 1,6кА/м2 в залежності від кількості етапів активації. Чим менший негативний потенціал і нижче значення перенапруги відновлення води, тим більш активованим є катод. Паралельно такі ж дослідження здійснювали щодо підкладки такої ж форми та складу, але без покриття. Приріст напруги - це різниця між потенціалом на активованому катоді і потенціалом на катоді з незахищеного заліза за тієї самої щільності струму (1,6кА/м2). Таблиця 1 Приріст напруги Екатпри 1,6 відносно катода кА/м2 (V/ECS) із заліза (V) Перша поляризація Друга поляризація Третя поляризація Приклад 2 -1,34 0,06 -1,25 0,15 -1,24 0,16 8 Покриття на основі оксидів Ru та Ті Розчин готували шляхом розчинення 0,500г ацетилкетонату рутенію та 0,329г ацетилкетонату титану в 10 мл етанолу + 10мл ацетону для отримання рівного молярного співвідношення Ru/Ti. Підкладка мала форму монолітної залізної пластинки (3,5x2,5см) з привареним сталевим стрижнем: повна поверхня становила 33см. Підкладка була попередньо оброблена абразивом Corindon та промита ацетоном. Підкладку по всіх поверхні обробили розчином, поклали до печі з температурою 120°С на 15 хвилин, після чого витримали ще 15 хвилин при температурі 450°С. Таким чином отримали покриття масою 2,2г/м2. Цю обробку повторили 3 рази (всього 4 шари покриття), що дало змогу довести масу покриття до 9,8г/м2, що еквівалентно масі 4,6г(Ru)/м2. Останній цикл термообробки здійснювали 30 хвилин при 450°С. Електрохімічні характеристики отриманого катоду досліджували таким же чином, як у прикладі 1. У таблиці 2 показані зміни катодного потенціалу та приріст напруги у співставленні з катодом із заліза. Таблиця 2 Приріст напруги Екатпри 1,6 відносно катода 2 кА/м (V/ECS) із заліза (V) Перша поляризація Друга поляризація Третя поляризація -1,34 0,06 -1,24 0,16 -1,23 0,17 У таких самих умовах було виготовлено більше 25 катодів з рівним молярним співвідношенням рутенію та титану, на основі залізних та сталевих монолітних або з металевої смуги пластинок, властивості яких були досліджені способом, описаним в прикладі 1. Приріст напруги у порівнянні з подібним катодом, але без покриття, складав в середньому 160±20мВ. Приклад 3 Покриття з оксиду Ru 100% Розчин готували шляхом розчинення 0,500г ацетилкетонату рутенію в 10мл етанолу + 10мл ацетону. Підкладка мала форму монолітної залізної пластинки (3,5х2,5см) з привареним сталевим стрижнем: повна поверхня становила 33см . Підкладка була попередньо оброблена абразивом Corindon та промита ацетоном. Підкладку по всіх поверхні обробили розчином, поклали до печі з температурою 120°С на 15 хвилин, після чого витримали ще 15 хвилин при температурі 450°С. Таким чином отримали покриття масою 1,9г/м2. Цю обробку повторили 2 рази (всього 3 шари покриття), що дало змогу довести масу покриття до 3,8г/м2, що еквівалентно масі 2,9г(Ru)/м2. Останній цикл термообробки здійснювали 30 хвилин при 450°С. 9 80610 Електрохімічні характеристики отриманого катода досліджували таким же чином, як у прикладі 1. У таблиці 3 показані зміни катодного потенціалу та приріст напруги у співставленні з катодом із заліза. Таблиця 3 Екатпри 1,6 кА/м2 (V/ECS) Перша поляризація Друга поляризація Третя поляризація Приріст напруги відносно катода із заліза (V) -1,24 0,16 -1,18 0,22 -117 0,23 Приклад 4 Покриття з оксиду Ru 100 % Розчин готували шляхом розчинення 0,500г ацетилкетонату рутенію в 10мл етанолу. Підкладка мала форму монолітної сталевої пластинки (3,5х2,5см) з привареним сталевим стрижнем: повна поверхня становила 33см2. Підкладка була попередньо оброблена абразивом Corindon та промита ацетоном. Підкладку по всіх поверхні обробили розчином, поклали до печі з температурою 120°С на 15 хвилин, після чого витримали ще 15 хвилин при температурі 450°С. Таким чином отримали покриття масою 2,1г/м2. Цю обробку повторили 3 рази (всього 4 шари покриття), що дало змогу довести масу покриття до 7,6г/м2, що еквівалентно масі 5,8г(Ru)/м2. Останній цикл термообробки здійснювали 30 хвилин при 450°С. Електрохімічні характеристики отриманого катоду досліджували таким же чином, як у прикладі 1. У таблиці 4 показані зміни катодного потенціалу та приріст напруги у співставленні з катодом зі сталі. Таблиця 4 Приріст напруги Екатпри 1,6 відносно катода зі кА/м2 (V/ECS) сталі (V) Перша поляризація Друга поляризація Третя поляризація -1,28 0,12 -1,20 0,20 -1,18 0,22 У таких самих умовах, що описані у прикладах 3 та 4, було виготовлено більше 25 катодів з покриттям з чистого оксиду RuO2 на основі залізних та сталевих монолітних або з металевої смуги пластинок, властивості яких були досліджені способом, описаним в прикладі 1. Приріст напруги у порівнянні з подібним катодом, але без покриття, складав в середньому 200 + 50мВ. Приклад 5 10 Дослідний лабораторний зразок катоду для електролізу хлоридно-натрієвих розчинів із застосуванням діафрагми Виготовляли активований катод площею 72см2 для лабораторного дослідного зразка електролізеру діафрагмового типу для обробки хлориду натрію. Підкладка мала форму сталевої сітки, яку застосовують у промислових електролізерах. Використовували покриття з рівним молярним співвідношенням Ru та Ті, нанесене на обидва боки підкладки способом, описаним у прикладі 2. Маса покриття, накладеного в 4 шари, складала 13,7г/м2, тобто 6,5г(Ru)/м2. Ніяких електрохімічних характеристик цього катода попередньо, до встановлення на дослідну установку, не досліджували через його розміри. Активований катод встановили на дослідну установку діафрагмового типу для електролізу хлоридно-натрієвого розчину, де була застосована діафрагма Poliramix®. Установка працювала в безперервному режимі 24 години 7 днів на тиждень. Спеціальне обладнання для відведення електроліту та подачі свіжого забезпечувало сталість складу електроліту в установці. Умови проведення електролізу були такими: 2,5кА/м2, 85°С, вміст натрію між 120 та 140г/л, анод з титанової смуги з покриттям RuO2-TiO2. Для порівняння використовували таку саму установку із залізним катодом без покриття, яка працювала в тих самих умовах. Графік 1 показує зміни потенціалу на цих двох катодах після експлуатації протягом 120 днів. На графіку позначкою α показано активований катод, а позначкою 0 - катод без покриття. Приріст напруги, тобто різниця між двома потенціалами, складав 180 мВ за період 20-120 днів роботи. Приклад 6 Використання активованого катода для електролізу хлорату натрію Готували активований катод площею 200см2 (5х40см) для дослідної установки, що здійснюватиме електроліз хлорату натрію. Підкладку із заліза вкривали з обох боків покриттям з рівним молярнім вмістом Ru та Ті, яке наносили за технологією, описаною у прикладі 2, але заключну термообробку здійснювали протягом 1 години при температурі 450°С. Маса відкладеного метала склала 10,3г/м2, тобто 4,9г(Ru)/м2. Виготовлений таким чином катод використовували в дослідній установці для електролізу хлорату натрію. Анод був виготовлений зі смуги титану, вкритого RuO2-TiO2. Умови роботи установки для електролізу хлорату натрію були такими: (NaCl) = 200г/л , (NaClO3) = 300г/л, (Na2Cr2O7,2H2O) = 4г/л, Τ=80°С, щільність струму 4кА/м2, безперервний режим роботи 24 години на добу, 7 днів на тиждень. Спеціальне обладнання для відведення електроліту та подачі свіжого забезпечувало сталість складу електроліту в установці. Такі ж дослідження паралельно проводились із залізним катодом без покриття. 11 80610 Обидві установки безперервно працювали протягом 500 годин, вимірювання напруги здійснювали кожні 50 годин. Протягом всього часу досліджень напруга на установці з активованим катодом була на 200+5мВ нижче від напруги на установці з катодом із заліза без покриття. Приклад 7 Вплив матеріалу підкладки На монолітну підкладку з нікелю та монолітну підкладку із заліза наносили покриття з RuO2-TiO2 в рівному молярному співвідношенні. Покриття наносили способом, описаним в прикладі 2. Операцію змочування/сушіння/випал здійснювали до формування покриття 9-10г/м2, що 2 еквівалентно 4,3-4,7г(Ru)/м . Останню термообробку здійснювали протягом 30 хвилин при температурі 450°С. На підкладці з нікелю довелося сформувати 6 шарів покриття, а на підкладці із заліза - лише 3, оскільки на нікель покриття лягає гірше. Електрохімічні властивості обох катодів визначали способом, описаним у прикладі 1. На графіку 2 показані поляризаційні криві після стабілізації обох катодів. Можна бачити, що катод на підкладці з нікелю (крива 1) має гірші характеристики, ніж катод на підкладці із заліза (крива 2); для однакової щільності струму потенціал на катоді з нікелю більш негативний, ніж на катоді із заліза. Приклад 8 Покриття з RuO2-TiO2 на підкладці з нікелю та підкладці із заліза, сформоване з розчинів на основі оксихлориду рутенію та окисхлориду титану Розчин для змочування з рівним молярним співвідношенням Ru/Ti готували шляхом розчинення 5,18г RuCl3,1,5H2O та 3,1мл ТіОСl2,2НСl (124,5г (Ті)/л) у 10мл чистого етанолу. Розчин збовтували для активізації розчинення. Перша підкладка була виконана у вигляді монолітної пластинки із заліза (3,5х2,5см), до якої був приварений сталевий стрижень: повна поверхня становила 33см2. Підкладка була попередньо оброблена абразивом Corindon та промита ацетоном. Друга підкладка була виконана у вигляді монолітної пластинки з нікелю (3,5х2,5см), до якої був приварений нікелевий стрижень: повна поверхня становила 33см2. Підкладка була попередньо оброблена абразивом Corindon та промита ацетоном. Кожну підкладку по всій поверхні обробили розчином, поклали до печі з температурою 120°С на 15 хвилин, після чого витримали ще 15 хвилин при температурі 450°С. Останню термообробку здійснювали протягом 30 хвилин при температурі 450°С. У таблиці 5 показані зміни маси покриття на кожній з цих підкладок, в залежності від кількості циклів змочування/сушіння/випал. Таблиця 5 Перший шар Другий шар Третій шар Підкладка із заліза 14,1г/м2 25,8г/м2 Підкладка з нікелю 6,2г/м2 12,4г/м2 18,5г/м2 12 Четвертий шар Колір покриття 21,2г/м2 коричневий чорний Дослідження електрохімічних властивостей електродів здійснювали способом, описаним у прикладі 1. У таблицях 6 та 7 показані зміни потенціалу на катоді із заліза та приріст напруги в порівнянні із залізним катодом без покриття (таблиця 6), а також зміни потенціалу на катоді з нікелю та приріст напруги в порівнянні із залізним катодом без покриття (таблиця 7). Таблиця 6 Катод із заліза Приріст напруги Екатпри 1,6 кА/м відносно кат катода (V/ECS) без покриття (В) 1-а поляризація 2-а поляризація -1,35 0,05 -1,40 0,0 В умовах інтенсивного газовиділення покриття на залізній підкладці відшаровується і властивості катода стають такими, як у катода без покриття. Забарвлення покриття після термообробки свідчить про наявність значного вмісту оксидів заліза Таблиця 7 Екат при 1,6 Катод з нікелю кА/м2 (V/ECS) 1-а поляризація 2-а поляризація 3-я поляризація -1,3 -1,17 -1,15 Приріст напруги відносно кат катода без покриття (В) 0,10 0,23 0,25 Навіть після численних етапів досліджень катод на підкладці з нікелю не зазнавав жодних ушкоджень, а приріст напруги у порівнянні із залізним катодом без покриття ставав все значнішим. 13 80610 14
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the coating of metal oxides formation on the electroconductive support, activated cathode, which is obtained by this method and its use for electrolysis of water solutions of alkali chlorides
Автори англійськоюANDOLFATTO, Francoise, JOUBERT, Philippe, DUBOEUF, Gerard
Назва патенту російськоюСпособ формирования покрытий из оксидов металлов на электропроводной подкладке, активированный катод, полученный этим способом, и его использование для электролиза водных растворов хлоридов щелочных металлов
Автори російськоюАндолфатто Франсуаз, Жубер Филипп, Дюбеф Жерар
МПК / Мітки
МПК: C25B 11/00, C23C 18/00
Мітки: застосування, цим, лужних, водних, одержаний, активованій, хлоридів, спосіб, розчинів, формування, електролізу, способом, катод, покриття, металів, електропровідний, підкладці, оксидів
Код посилання
<a href="https://ua.patents.su/7-80610-sposib-formuvannya-pokrittya-z-oksidiv-metaliv-na-elektroprovidnijj-pidkladci-aktivovanijj-katod-oderzhanijj-cim-sposobom-ta-jjogo-zastosuvannya-dlya-elektrolizu-vodnikh-rozchiniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб формування покриття з оксидів металів на електропровідній підкладці, активований катод, одержаний цим способом, та його застосування для електролізу водних розчинів хлоридів лужних металів</a>
Попередній патент: Пристрій для електрогідроімпульсного подрібнення
Наступний патент: Пристрій для транспортування і очистки коренебульбоплодів
Випадковий патент: Спосіб полегшення пологів