Рекомбінантна плазмідна днк psx70, що кодує синтез рекомбінантного людського гранулоцит-колонійстимулюючого фактора (г-ксф), штам escherichia coli sx70, спосіб одержання г-ксф людини та препарат на основі високоочищеного г-ксф
Номер патенту: 87054
Опубліковано: 10.06.2009
Автори: Яковєнко Андрєй Романовіч, Чувпіло Сєргєй Альбєртовіч, ЯРОЦКІЙ Сєргєй Вікторовіч, Могутов Міхаіл Алєксандровіч, Скрипін Васілій Івановіч
Формула / Реферат
1. Рекомбінантна плазмідна ДНК pSX70, що кодує синтез рекомбінантного людського гранулоцит-колонійстимулюючого фактора (Г-КСФ), має 4305 пар основ (п.о.) і характеризується наявністю наступних фрагментів: послідовність з 1 н. по 528 н. включає фрагмент ДНК розміром 529 п.о., що містить ген Г-КСФ з наступними нуклеотидними замінами: 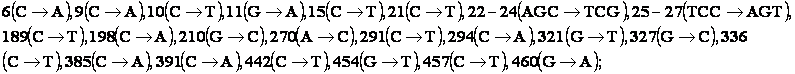 послідовність з 540 н. по 550 н., яка включає синтетичний фрагмент ДНК розміром 11 п.о., що містить синтетичний полілінкер;
послідовність з 540 н. по 550 н., яка включає синтетичний фрагмент ДНК розміром 11 п.о., що містить синтетичний полілінкер;
послідовність з 551 н. по 1070 н., яка включає в себе фрагмент плазміди pSX50, що містить послідовність строгого термінатора транскрипції rrnВТ1Т2;
послідовність з 1071 н. по 2802 н. включає фрагмент ДНК плазміди pUC19 з 885 н. по 1735 н. (ген - лактомази, що надає стійкості до ампіциліну - AmpR), в який по сайтах Sсal - BglІ вставлений ген стійкості до канаміцину - KanR, фрагмент плазміди pSX50 розміром 816 п.о.;
послідовність з 2803 по 4200 включає в себе фрагмент плазміди pSX50, що містить послідовність, відповідальну за реплікацію плазміди (оrі) та lac промотору ![]() ,
,
а також послідовність, що містить триптофановий промотор ![]() ;
;
послідовність з 4201 н. по 4305 н. містить промотор фага Т7 (РT7),
а також синтетичний полілінкер.
2. Штам бактерій Escherichia coli SX70, що містить плазміду pSX70, депонований у Всеросійській колекції промислових мікроорганізмів, ФГУП ДНДІ генетики (колекційний номер ВКПМ В-8842), продукуючий рекомбінантний гранулоцит-колоній, що стимулює фактор Г-КСФ людини.
3. Спосіб одержання рекомбінантного Г-КСФ людини, який відрізняється тим, що штам Escherichia coli SX70 культивують у живильному середовищі з постійним доданням субстратів у процесі біосинтезу, далі клітини мікроорганізму руйнують у проточному дезінтеграторі, відокремлюють розчинені клітинні мікроорганізми від нерозчинної форми Г-КСФ буферним розчином, що містить детергенти та сечовину, виділяють Г-КСФ за допомогою 8М сечовини, потім проводять його ренатурацію буферним розчином за присутності хаотропних агентів, далі тристадійну хроматографічну очистку Г-КСФ за допомогою обернено-фазової хроматографії на колонках FF High Sub, іонообмінної CM Sepharose Fast Flow та гель-фільтраційної хроматографії на колонці Superdex 75.
4. Спосіб за п. 3, де використання штаму Escherichia coli SX70 дозволяє одержувати при біосинтезі більшу кількість Г-КСФ з 1 л культурального середовища.
5. Спосіб за п. 3, де глибинне культивування штаму Escherichia coli SX70 проводять на живильному середовищі з пониженим вмістом триптофану при безперервному доданні живильних субстратів.
6. Спосіб за п. 3, де руйнування клітинної біомаси здійснюють механічно при високому тиску.
7. Спосіб за п. 3, де відокремлення розчинних клітинних компонентів (ДНК, РНК, білків, ліпополісахаридів) від нерозчинної форми Г-КСФ проводять промиванням нерозчинної форми Г-КСФ буферними розчинами, що містять детергенти (CHAPS, сечовини), при високому тиску.
8. Спосіб за п. 3, який дозволяє одержувати субстанцію Г-КСФ більше 98 % чистоти за даними ізоелектричного фокусування, RF HPLC і такою, що практично не містить пірогенів (LAL-тест).
9. Препарат на основі високоочищеного Г-КСФ, одержаний за п. 3, що містить стабілізуючу речовину - сорбітол, неіоногенну поверхнево-активну речовину полісорбат 80, буферну систему, що включає натрію ацетат для забезпечення рН розчину 3,8-4,2, і воду для ін'єкцій, при наступному співвідношенні компонентів:
Г-КСФ
30 млн. ОД/мл
оцтова кислота крижана
0,59 мг
натрію гідроксид ІN до рН
1,0-2,2 мкл
сорбітол
50 мг
полісорбат 80
0,04 мг
вода для ін'єкцій
до 1 мл.
Текст
1. Рекомбінантна плазмідна ДНК pSX70, що кодує синтез рекомбінантного людського гранулоцит-колонійстимулюючого фактора (Г-КСФ), має 4305 пар основ (п.о.) і характеризується наявністю наступних фрагментів: послідовність з 1 н. по 528 н. включає фрагмент ДНК розміром 529 п.о., що містить ген Г-КСФ з наступними нуклеотидними замінами: UA (21) a200711807 (22) 25.10.2007 (24) 10.06.2009 (31) 2006138034 (32) 30.10.2006 (33) RU (46) 10.06.2009, Бюл.№ 11, 2009 р. (72) ЯРОЦКІЙ СЄРГЄЙ ВІКТОРОВІЧ, RU, ЧУВПІЛО СЄРГЄЙ АЛЬБЄРТОВІЧ, RU, СКРИПІН ВАСІЛІЙ ІВАНОВІЧ, RU, МОГУТОВ МІХАІЛ АЛЄКСАНДРОВІЧ, RU, ЯКОВЄНКО АНДРЄЙ РОМАНОВІЧ, RU (73) ОБЩЄСТВО С ОГРАНІЧЄННОЙ ОТВЄТСТВЄННОСТЬЮ "ФАРМАПАРК" (56) RU C1 2113483, 20.06.1998. RU C2 2260049, 10.09.2005. RU C1 2091488, 27.09.1997. RU C2 2278870, 27.06.2006. RU C1 2271392, 10.03.2006. RU C2 2158303, 27.10.2000. RU C2 2201962, 10.04.2003. WO A1 2004/013175, 12.02.2004. 2 (19) 1 3 87054 4 дукуючий рекомбінантний гранулоцит-колоній, що стимулює фактор Г-КСФ людини. 3. Спосіб одержання рекомбінантного Г-КСФ людини, який відрізняється тим, що штам Escherichia coli SX70 культивують у живильному середовищі з постійним доданням субстратів у процесі біосинтезу, далі клітини мікроорганізму руйнують у проточному дезінтеграторі, відокремлюють розчинені клітинні мікроорганізми від нерозчинної форми Г-КСФ буферним розчином, що містить детергенти та сечовину, виділяють Г-КСФ за допомогою 8М сечовини, потім проводять його ренатурацію буферним розчином за присутності хаотропних агентів, далі тристадійну хроматографічну очистку Г-КСФ за допомогою оберненофазової хроматографії на колонках FF High Sub, іонообмінної CM Sepharose Fast Flow та гельфільтраційної хроматографії на колонці Superdex 75. 4. Спосіб за п. 3, де використання штаму Escherichia coli SX70 дозволяє одержувати при біосинтезі більшу кількість Г-КСФ з 1 л культурального середовища. 5. Спосіб за п. 3, де глибинне культивування штаму Escherichia coli SX70 проводять на живильному середовищі з пониженим вмістом триптофану при безперервному доданні живильних субстратів. 6. Спосіб за п. 3, де руйнування клітинної біомаси здійснюють механічно при високому тиску. 7. Спосіб за п. 3, де відокремлення розчинних клітинних компонентів (ДНК, РНК, білків, ліпополісахаридів) від нерозчинної форми Г-КСФ проводять промиванням нерозчинної форми Г-КСФ буферними розчинами, що містять детергенти (CHAPS, сечовини), при високому тиску. 8. Спосіб за п. 3, який дозволяє одержувати субстанцію Г-КСФ більше 98% чистоти за даними ізоелектричного фокусування, RF HPLC і такою, що практично не містить пірогенів (LAL-тест). 9. Препарат на основі високоочищеного Г-КСФ, одержаний за п. 3, що містить стабілізуючу речовину - сорбітол, неіоногенну поверхнево-активну речовину полісорбат 80, буферну систему, що включає натрію ацетат для забезпечення рН розчину 3,8-4,2, і воду для ін'єкцій, при наступному співвідношенні компонентів: Г-КСФ 30млн. ОД/мл оцтова кислота крижана 0,59мг натрію гідроксид ІN до рН 1,0-2,2мкл сорбітол 50мг полісорбат 80 0,04мг вода для ін'єкцій до 1мл. Винахід належить до біофармакології, а саме до способів промислового одержання рекомбінантного гранулоцит-колонійстимулюючого фактора людини медичного призначення (надалі Г-КСФ), а також до рекомбінантних штамів Escherichia coli (Е. соlі) та плазмід для його одержання. Гранулоцит-колонійстимулюючий фактор людини (Г-КСФ) являє собою глікопротеїд з молекулярною масою 19000Да. Г-КСФ, продукований моноцитами-макрофагами, фібробластами і ендотеліальними клітинами, індукує проліферацію колоній нейтралів та диференціацію клітинпопередників у нейтрофіли, а також стимулює активність зрілих нейтрофілів [1-4]. Лікарські форми Г-КСФ (синоніми - Нейпоген (Ф. Хоффманн-Ля Рош Лтд.) і Граноцит (Авентіс)) широко використовуються у медицині для терапії нейтропенії у хворих, що отримують цитостатичні засоби для лікування немієлоїдних злоякісних захворювань; для купірування побічних ефектів мієлосупресивної хіміотерапії; для терапії спадкової, періодичної і злоякісної нейтропенії; для скорочення тривалості періоду нейтропенії та її клінічних наслідків у хворих, підготовлюваних до трансплантації кісткового мозку. Відомі способи одержання Г-КСФ, засновані на використанні культуральної рідини клітинних ліній, продукуючих Г-КСФ [5-7], а також на експресії гена Г-КСФ у трансформованих вектором клітинах вищих еукаріотів COS, СНО, С-127 [1, 7, 8]. Недоліком цих способів є надзвичайно низький вихід цільового продукту і, як наслідок, висока вартість препаратів Г-КСФ. Тому значно більш перс пективним є спосіб одержання Г-КСФ мікробіологічним синтезом, який забезпечує можливість одержання продукту з більш високим виходом із порівняно недорогої вихідної сировини. Використання при цьому хімічного підходу дозволяє створити оптимальні для бактеріальної експресії варіанти структурного гена, а також регуляторних елементів, контролюючих його експресію. До того ж відомо, що полісахаридний ланцюг глікопротеїду не є необхідним для біологічної активності останнього [9]. Відомо спосіб одержання рекомбінантного ГКСФ, заснований на одержанні рекомбінантного ГКСФ у трансформованих дріжджових клітинах Saccharomyces cerevisiae [10]. При такому підході вдається одержати Г-КСФ людини у правильній конформації з доброю фізіологічною активністю. Недоліками цього способу є зниження виходу за рахунок деградації цільового білка внутрішньоклітинними протеазами. Відомий також спосіб одержання Г-КСФ, що включає експресію у клітинах Escherichia coli, який полягає у секреції клітинами бактерій рекомбінантного білка Г-КСФ у вигляді розчинного білка у периплазматичний простір [заявка РСТ WO 01/00549, МКВ: С 12 N 15/70, опубл. 2001]. Спосіб забезпечує можливість одержання правильної конформації білка без рефолдінгу. Недоліком є експресія Г-КСФ з додатковим пептидом на N-кінці для усунення токсичної дії білка, що робить необхідним відрізання специфічною протеазою цього пептиду. 5 Відомі найбільш близькі до заявленого способи одержання Г-КСФ, що включають експресію у клітинах Escherichia coli, яка полягають у швидкому біосинтезі клітинами бактерій рекомбінантного Г-КСФ у вигляді нерозчинних «тілець включення» [патент РФ №2113483, МКВ: С 12 N 15/27, опубл. 1/21 і патент РФ №2260049, МКВ: С 12 N 15/27, опубл. 1/21]. У цих способах проводять конструювання рекомбінантних плазмідних ДНК, кодуючих конститутивний синтез поліпептиду з властивостями Г-КСФ людини та штами Escherichia coli, що забезпечують синтез цього пептиду з рівнем експресії 10-30% сумарного клітинного білка. Разом з особливостями штамів, що використовуються, ефективність процесу багато в чому залежить від використовуваної технології виділення та очистки Г-КСФ. Задачею даного винаходу є конструювання рекомбінантого промислового штаму продуцента Е. coli, що має високий рівень біосинтезу Г-КСФ, і створення препарату Г-КСФ у формі водного розчину для ін'єкцій. Вказана задача вирішувалася створенням рекомбінантної плазмідної ДНК pSX70 та штаму Escherichia coli SX70, депонованих у Всеросійській колекції промислових мікроорганізмів (ВКПМ), ФГУП Держ. НДІ генетики, колекційний номер ВКПМ В-8842. Плазміда pSX70 має 4305 пар основ (п.о.) і характеризується наявністю наступних фрагментів: - Послідовність з 1н. по 528н. включає фрагмент ДНК розміром 529 п.о., що містить ген Г-КСФ з наступними нуклеотидними замінами: 6 (C®А), 9 (C®А), 10 (C®T), 11 (G®A), 15 (C®T), 21 (C®T), 22-24 (AGC®TCG), 25-27 (TCC®AGT), 189 (C®T), 198 (C®А), 210 (G®C), 270 (А®С), 291 (C®T), 294 (C®A), 321 (G®T), 327 (G®C), 336 (C®T), 385 (C®A), 391 (C®A), 442 (C®T), 454 (G®T); 457 (C®T), 460 (G®А); - Послідовність з 540н. по 550н. включає синтетичний фрагмент ДНК розміром 11 п.о., що містить синтетичний полілінкер; - Послідовність з 551 по 1070 включає в себе фрагмент плазміди pSX50, що містить послідовність строгого термінатора транскрипції rrnBT1T2; - Послідовність з 1071н. по 2802н. включає фрагмент ДНК плазміди pUC19 з 885н. по 1735н. (ген -лактамази, що надає стійкості до ампіциліну - AmpR), в який по сайтах Scal - Bgll вставлений ген стійкості до канаміцину - KanR, фрагмент плазміди pSX50 розміром 816 п.о.; - Послідовність з 2803 по 4200 включає в себе фрагмент плазміди pSX50, що містить послідовність, відповідальну за реплікацію плазміди (ori) та lac промотору (Рlас), а також послідовність, що містить триптофановий промотор (Ptrp); - Послідовність з 4201н. по 4305н. містить промотор фага Т7 (РT7)> а також синтетичний полілінкер. На Фіг.1 зображена фізична карта плазміди pSX70; на Фіг.2 - показана послідовність нуклеотидів гена Г-КСФ. Штам Escherichia coli SX70 одержаний трансформацією клітин Escherichia coli BL21 плазмідою 87054 6 pSX70 з використанням традиційної генноінженерної технології. Штам Е. coli SX70 характеризується наступними ознаками: Культурально-морфологічні ознаки Клітини дрібні, прямі, стовщеної паличкоподібної форми, грамнегативні, неспороносні. Клітини добре ростуть на простих живильних середовищах. При зростанні на агарі "Діфко" утворюються круглі, гладкі, опуклі, каламутні, блискучі, сірі колонії, з рівними краями. При зростанні у рідких середовищах (у мінімальному середовищі з глюкозою або у LB-бульйоні) утворюють інтенсивну рівну каламуть. Фізико-біологічні ознаки Аероб. Температурний діапазон зростання 442°С при оптимумі рН 6,5-7,5. За джерело азоту використовують як мінеральні солі в амонійній та нітратній формах, так і органічні сполуки у вигляді амінокислот, пептону, триптону, дріжджового екстракту і т.д. Як джерело вуглецю використовують амінокислоти, гліцерин, вуглеводи. Стійкість до антибіотиків. Клітини виявляють стійкість до канаміцину (до 100мкг/мл). Штам Escherichia coli SX70 - продуцент Г-КСФ. Спосіб, умови і склад середовища для зберігання штаму В L-aгapi з доданням канаміцину до концентрації 20мкг/мл під олією, в L-бульйоні, що містить 15% гліцерину, і відповідними антибіотиками в ампулах при температурі мінус 70°С, уліофілізованому стані в ампулах при температурі 4°С. Штам Escherichia coli SX70 ідентифікований за визначником Бергі (1974) як штам виду Escherichia coli. Особливістю способу, що заявляється, є розробка технології, яка дозволяє виділяти Г-КСФ людський рекомбінантний з нерозчинної форми, накопичуваної протягом ферментації, що дозволяє істотно спростити технологічну схему процесу виділення та підвищити вихід цільового продукту. Спосіб полягає у культивуванні в живильному середовищі штаму Escherichia coli SX70, руйнуванні клітин мікроорганізму у проточному дезінтеграторі при тиску 700 бар, виділенні та очистці нерозчинної форми Г-КСФ з використанням детергентів і подальшим центрифугуванням, розчиненням осаду у розчині гуанідин гідрохлориду і наступній ренатурації Г-КСФ. Одержаний ренатурований Г-КСФ піддають очистці за допомогою обернено-фазової хроматографії на феніл-сефарозі FF High Sub, іонообмінної хроматографії на іонообмінних смолах типу CM Sepharose Fast Flow і гель-фільтраційної хроматографії на смолах типу Superdex 75. Оптимальними умовами проведення окремих стадій одержання Г-КСФ є наступні: - ферментацію проводять при безперервному доданні субстратів протягом всього процесу, що зумовлює високий рівень експресії Г-КСФ; - руйнування клітин здійснюють у проточному дезінтеграторі при тиску не менше 700 бар; - вилучення розчинних клітинних компонентів (ДНК, РНК, білків, ліпополісахаридів і т.д.) прово 7 дять промиванням нерозчинної форми Г-КСФ буферними розчинами, що містять детергенти (CHAPS, сечовина і т.д.); - осад, що утворився, який містить Г-КСФ, розчиняють у буферному розчині 6М гуанідин гідрохлориду; - ренатурацію Г-КСФ проводять у фізіологічному буферному розчині, що містить хаотропні агенти; - тристадійну хроматографічну очистку Г-КСФ проводять на феніл-сефарозі FF High Sub, на катіонообмінній смолі CM Sepharose Fast Flow і гельфільтраційну хроматографію - на смолі типу Superdex 75; - після кожної хроматографічної очистки проводять стерилізувальну фільтрацію через апірогенні фільтри з розмірами пор 0.22 мікрона. Вихід Г-КСФ в результаті застосування описаного способу складає не менше 200мг чистого білка з 1л культурального середовища. Суттєвими відмінностями способу, що заявляється, від прототипу є: - використання конструкції штаму з більш високою продуктивністю, що дозволяє одержувати при біосинтезі більшу кількість Г-КСФ з 1л культурального середовища; - використання ефективного механічного руйнування клітинної біомаси, що дозволяє одержувати більш чистий екстракт нерозчинної форми ГКСФ за більш короткий час, з меншими втратами; - використання фізіологічних буферних розчинів при ренатурації за присутності хаотропних агентів дозволяє підвищити вихід коректно ренатурованої форми Г-КСФ; - тристадійна хроматографічна очистка Г-КСФ дозволяє одержувати субстанцію Г-КСФ більше 98% чистоти за даними ізоелектричного фокусування та RF HPLC і такою, що практично не містить пірогенів (LAL-тест). Суть і переваги групи винаходів, що заявляється, ілюструються наступними прикладами. Приклад 1. Конструювання рекомбінантної плазм іди pSX70 Спосіб конструювання плазміди pSX70 включає наступні етапи: - конструювання проміжної рекомбінантної плазміди рХХ1; - конструювання рекомбінантної плазміди pSX53 (4068 п.о.); - конструювання рекомбінантної плазміди pSX70 (4305 п.о.). Конструювання проміжної рекомбінантної плазміди рХХ1 Рекомбінантна плазміда рХХ1 являє собою вектор рСНЕrеР, в який по сайтах Clal і Sall клонований ген gcsf. 10мкг плазмідної ДНК pGSF(b) [11] обробляють послідовно рестриктазами Clal і Sall відповідно до методики, описаної у роботі [12], і з одержаного гідролізату виділяють у 1% гелілегкоплавкої агарози фрагмент довжиною 530 п.о., що містить ген gcsf. 10мкг плазмідної ДНК рСНЕrеР обробляють послідовно рестриктазами Clal і Sall, і з одержано 87054 8 го гідролізату виділяють векторну частину плазміди. Одержаний фрагмент та векторну частину плазміди рСНЕrеР зшивають за допомогою лігазної реакції у 50мкл буфера для лігування [12]. 10мкг реакційної суміші використовують для трансформації компетентних клітин Е. coli DH5a. Трансформанти висівають на LB-arap, що містить 75мкг/мл ампіциліну. Після інкубування протягом 12 годин при 37°С клони відсівають, виділяють плазмідну ДНК і аналізують рестрикційним аналізом. Відбирають ДНК, що містить потрібний набір рестрикційних фрагментів. В результаті одержують плазміду рХХ1. Конструювання рекомбінантної плазміди pSX53 Плазміда рSХ53 являє собою плазміду pSX50, послідовність якої з 1050н. по 1861н. замінена на фрагмент ДНК плазміди pUC19 з 885н. по 1735н. (ген -лактамази, що надає стійкості до ампіциліну - AmpR), в який потім по сайтах Scal - Bgll вставлений ген стійкості до канаміцину - KanR. Плазміду pSX53 одержують з проміжної плазміди pSX50-b введенням гена стійкості до канаміцину по сайтах Scal - Bgll. Для одержання плазміди pSX50-b проводять два раунди ампліфікації ДНК методом ПЛР (полімеразна ланцюгова реакція). В ході першого раунду, використовуючи ДНК плазміди pUC 19 як матрицю, проводять ампліфікацію фрагмента ДНК розміром 850 п.о., гена -лактамази, що надає стійкості до ампіциліну - AmpR) з використанням праймерів Amp1 і Аmp2 (фрагмент 1): Amp1 5'-ATG AGT ATT CAA C-3' Amp2 5' - ТТА CCA ATG CTT AAT C-3'. Цю і наступні ПЛР реакції проводять у наступних умовах: 20мМ трис-НСІ, рН 8.8,10мМ (NH4)2SO4, 10мМ KСl, 2мМ MgCl2, 0.1% Triton X100, 0.1мг/мл BSA, 0.2мМ кожного dNTP, 1.25од. Pfu ДНК полімерази, 100нг ДНК. Процес ампліфікації складається з наступних стадій: прогрівання при 95°С 5хв., 35 циклів ПЛР (30сек. 95°С, 30сек. 56°С, 2хв. 72°С) і інкубація 10хв. при 72°С. Після ампліфікації (і після наступних ампліфікацій) фрагмент ДНК очищають електрофоретично у 1% агарозному гелі. В ході другого раунду, використовуючи ДНК плазміди pSX50 як матрицю, проводять ампліфікацію фрагмента ДНК розміром 2402 п.о. (фрагмент 2) за допомогою праймерів S1 і S2: S1 5' – CTG TCA GAC CAA G-3' S2 5' - ACT CTT ССТ ТТТ ТСА АТ-3'. Одержані фрагменти (фрагмент 1 і фрагмент 2) зшивають за допомогою лігазної реакції у 50мкл буфера для лігування. 10мкг реакційної суміші використовують для трансформації компетентних клітин Е. coli DH5a. Трансформанти висівають на LB-aгap, що містить 75мкг/мл ампіциліну. Після інкубування протягом 12 годин при 37°С клони відсівають, виділяють плазмідну ДНК і аналізують рестрикційним аналізом. Відбирають ДНК, що містить потрібний набір рестрикційних фрагментів. В результаті одержують плазміду рХХ1. 10мкг плазмідної ДНК pSX50 обробляють послідовно рестриктазами Scal - Bgll, і з одержаного 9 гідролізату виділяють у 1% гелілегкоплавкої агарози фрагмент довжиною 816 п.о., що містить ген стійкості до Kаn. 10мкг плазмідної ДНК pSX50 обробляють послідовно рестриктазами Scal - Bgll, і з одержаного гідролізату виділяють векторну частину плазміди. Одержані фрагменти (фрагмент 1 і фрагмент 2) зшивають за допомогою лігазної реакції у 50мкл буфера для лігування. 10мкг реакційній суміші використовують для трансформації компетентних клітин Е. coli DH5a. Трансформанти висівають на LB-aгap, що містить 20мкг/мл канаміцину. Після інкубування протягом 12 годин при 37°С клони відсівають, виділяють плазмідну ДНК і аналізують рестрикційним аналізом. Відбирають ДНК, що містить потрібний набір рестрикційних фрагментів. В результаті одержують плазміду р8Х53. Конструювання векторної плазміди pSX70 10мкг плазмідної ДНК рХХ1 обробляють послідовно рестриктазами EcoRI і Hindlll, і з одержаного гідролізату виділяють у 1% гелі легкоплавкої агарози фрагмент довжиною 547 п.о., що містить промотор фата Т7 (РТ7), послідовність ШайноДальгарно і ген gсsf, що кодує Г-КСФ. 10мкг плазмідної ДНК pSX53 обробляють послідовно рестриктазами EcoRI і PstI, і з одержаного гідролізату виділяють векторну частину плазміди. Далі електрофоретично очищені фрагменти об'єднують, лігують ферментом лігаза фата Т4, ДНК трансформують у клітини штаму Е. coli DH5 і висівають на середовище LA, що містить 20мкг/мл канаміцину. Після інкубування протягом 12 годин при 37°С клони відсівають, виділяють плазмідну ДНК, проводять рестрикційний аналіз і визначають первинну структуру ДНК. В результаті одержують плазміду pSX70 розміром 4305 п.о. Цільова рекомбінантна плазміда pSX70 містить унікальні сайти упізнавання рестрикційними ендонуклеазами, що мають наступні координати: Приклад 2. Одержання штаму Е. coli SX70 продуцента Г-КСФ Штам продуцент інтерферону Е. coli SX70 одержують шляхом трансформації клітин штаму Е. coli BL21 рекомбінантною плазмідою pSX70. Штам продуцент Г-КСФ вирощують у 30л ферментері до оптичної густини 25,0-30,0 о.о. у середовищі М9, що містить 1% кислотного гідролізату казеїну, 1% глюкози, 40мкг/мл канаміцину, при температурі 38°С. У процесі ферментації проводять безперервне додання живильного субстрату, використовуючи гравітометричний контролер. Вміст Г-КСФ у біомасі клітин, одержуваних з 1л культури, складає, залежно від серії, 0.9-1.0г ГКСФ. Приклад 3. Спосіб виділення Г-КСФ з штаму Е. coli SX70 Одержання Г-КСФ проводили у 4 етапи: 1 етап. Культивування штаму Е. coli SX70 2 етап. Виділення та очистка нерозчинної форми Г-КСФ 3 етап. Розчинення та ренатурація Г-КСФ 4 етап. Хроматографічна очистка Г-КСФ. 1 етап. Культивування штаму Е. coli SX50 87054 10 Вирощений посівний матеріал штаму Е. coli SX70 в обсязі 3л багатого середовища LB протягом 12год. при 28°С асептично вносять у ферментер, що містить 27л стерильного середовища, яке має М9,1% кислотного гідролізату казеїну, 1% глюкози, 1мМ MgCl2, 0.1мМ СаCl2, 40мг/мл канаміцину. Культивування у ферментері проводять при температурі 38-39°С, підтримуючи рН 7±0,15 шляхом автоматичного підтитрування 12,5%-ним розчином аміаку. Концентрацію розчиненого кисню в діапазоні 50±10% від насичення підтримують шляхом зміни швидкості обертів мішалки від 100 до 800об/хв. і подачі повітря від 1 до 15л/хв. Концентрацію субстратів, зокрема глюкози, вимірюють протягом ферментації і підтримують їх концентрацію шляхом зміни швидкості подачі концентрованих розчинів через перистальтичні насоси, використовуючи гравіметричний контролер. Накопичення Г-КСФ у вигляді нерозчинної форми - "тілець включень" контролюють за допомогою фазово-контрастної мікроскопії. Ферментацію зупиняють по досягненні максимальної оптичної густини (~ 25-30 о.о.) і появі зрілих "тілець включень". По закінченні ферментації культуральну рідину відокремлюють центрифугуванням у проточному роторі при швидкості обертання 500010000об/хв. Біомасу фасують у поліетиленові пакети і заморожують при температурі мінус 70°С. 2 етап. Виділення та очистка нерозчинної форми Г-КСФ 100г замороженої біомаси штаму Е. coli SX70 суспендують у 0,8л буфера 1 (20мМ Tris-HCl, рН 8.0, 10мМ ЕДТА, 0.1% Triton X100). Суспензію пропускають через проточний дезінтегратор, підтримують тиск 700 бар і центрифугують у проточному роторі при 15000об/хв. Одержаний осад промивають в аналогічних умовах послідовно буферами 2 (20мМ Tris -НСl, рН 8.0, 1мМ ЕДТА, 2М сечовини), буфером 3 (20мМ Tris -НСl, рН 8.0, 1мМ ЕДТА, 3М сечовини) і буфером 4 (20мМ Tris - НСl, рН 8.0, 1мМ ЕДТА, 0,1% Triton X100) і остаточно осад ГКСФ ресуспендують у 150мл буфера 5 (20мМ Tris НСl, рН 8.0, 1мМ ЕДТА, 0,001М фенілметилсульфонілфториду). При цьому час виділення та очистки нерозчинної форми Г-КСФ складає не більше 5 годин. 3 етап. Розчинення та ренатурація Г-КСФ До одержаної на попередньому етапі суспензії нерозчинної форми Г-КСФ додають сухий гуанідин гідрохлорид до концентрації 6М і додають розчин дитіотреїтолу до концентрації 50мМ та інкубують при кімнатній температурі протягом 2год. Матеріал, що не розчинився, відокремлюють при стерилізувальній фільтрації через мембрани з діаметрами пор 0.22 мікрона. Додають 1мл концентрованого розчину 10% CHAPS. Ренатурацію Г-КСФ проводять шляхом повільного розбавлення одержаного розчину у 100 разів буфером 6 (20мМ Tris - НСl, рН 8.0, 20мМ NaCl, 0.1мМ ЕДТА, 1М сечовина, 0,1% CHAPS, 0,5мМ глутатіону окисленого і 0,5мМ глутатіону відновленого). Після чого ренатураційну суміш інкубують при постійному перемішуванні протягом 12-15 годин при температурі 4-8°С. Далі агрегований матеріал видаляють стерилізувальною фільтрацією 11 через мембранний фільтр з діаметром пор 0.22 мікрона. 4 етап. Хроматографічна очистка Г-КСФ Хроматографічну очистку Г-КСФ здійснюють у три стадії: 1. Одержаний ренатурований Г-КСФ на першому етапі піддають очистці за допомогою обернено-фазової хроматографії на феніл-сефарозі FF High Sub (GE Healthcare). Для цього розчин Г-КСФ наносять на колону з феніл-сефарозою FF High Sub і зв'язаний матеріал елююють буфером 0.025М ацетату натрію рН 4,5 та 0,001М ЕДТА. 2. На другій стадії хроматографічної очистки розчин Г-КСФ наносять на катіонообмінну смолу типу CM Sepharose Fast Flow (GE Healthcare) і зв'язаний матеріал елююють градієнтом розчинів (0.0-0.5М NaCl) у буфері 50мМ Na(CH3COO) рН 4,5. 3. Очистку мономерної форми Г-КСФ від залишків полімерних форм проводять на третій стадії очистки Г-КСФ - гель-фільтрації на смолі типу Superdex 75 (GE Healthcare). Хроматографію проводять у буфері 10мМ Nа(СН3СОО) рН 5.0, що містить 5% сорбітолу та 0,004% полісорбату 80. Описаний спосіб виділення та очистки Г-КСФ дозволяє одержати 5-6г високоочищеного Г-КСФ за один цикл виділення протягом 7-10 днів з біомаси, одержаної із 30л культурального середовища. Якість одержуваного Г-КСФ повною мірою відповідає наступним вимогам: - Вміст правильно ренатурованої форми ГКСФ не менше 95% за даними RF HPLC; - Ізоелектрична точка виділеного Г-КСФ знаходиться в районі рН 5.8-6.3; - Вміст бактеріальних ендотоксинів не більше 100ME на 1мг інтерферону. На основі високоочищеного Г-КСФ, одержаного за описаних умов, приготовляється композиція складу препарату, що містить стабілізуючу речовину сорбітол, неіоногенну поверхнево-активну речовину полісорбат 80, буферну систему, що включає натрію ацетат для забезпечення рН розчину 3.8-4.2, і воду для ін'єкцій. Спосіб приготування Для приготування вказаного розчину змішують 1400мл води для ін'єкцій, 500мл концентрованого розчину 20% сорбітолу і вносять 1,2мл крижаної оцтової кислоти. Доводять рН до 4,0 за допомогою 2М розчину гідроксиду натрію і вносять 0,8мл концентрованого розчину 10% Полісорбату 80 при безперервному перемішуванні. Доводять обсяг до 2л водою для ін'єкцій і перемішують. Розчин охо 87054 12 лоджують до 4°С, після чого до нього додають розчин субстанції Г-КСФ до концентрації 30мл ЕД/мл у 2л кінцевого розчину. Одержаний розчин доводять до 2л водою для ін'єкцій, піддають стерилізувальній фільтрації на мембранному фільтрі 0,22мкм і розливають по 1мл у флакони місткістю 2мл. Одержаний розчин стабільний при зберіганні при 2-8°С протягом 24 місяців. Як випливає з наведених прикладів, група винаходів, що заявляється, дозволяє одержувати ГКСФ з високим виходом при відносно простій та надійній технології і готувати на його основі препарат у формі водного розчину для ін'єкцій. Джерела інформації: 1. Nagata S., Tsuchiya M., Asano S., Kaziro Y., Yamazaki Т., Yamamoto O., Hirata Y., Kubota N., Oheda M., Nomura H., Ono M.// Nature, 1986, v.319, №6052, p.415-418. 2. Nagata S., Tsuhiya M., Asano S., Yamamoto О., Hirata Y., Jubota N., Oheda M., Nomura H., Yamazaki Т.// ЕМВО J., 1986, v.5, p.575-581. 3. Souza L.M., Boone T.C., Gabrilove J., Lai P.H., Zsebo K.M., Mudrock D.C., Chazin V.R., Bruszewski J., Kenneth H.L., Chen K.K., Barendt J., Platzer E., Moore M.A.S. Mertelsmann R., Welte K.// Science, 1986, v.232,. 4746, p.61-65. 4. Cohen A.M., Zsebo K.M., Inoue H., Hines D., Boone T.C., Chazin V.R., Tsai L., Ritch Т., Soyza L.M.// Proc. Natl. Acad. Sci, USA, 1987, v.87, №8, p.2484-2288. 5. Патент США №4833127, Кл. Ф 61 К 37/02, 1989. 6. Nomura H., Imazeki I., Oheda M., Kubota N.. et al. // EMBO J., 1986, v. 5, p.871-876. 7. Європейський патент №215126, кл. С 12 N 15/00,1987. 8. Європейський патент №220520, кл. С 12 N 15/00, 1987. 9. Oheda М., Hasegawa М., Hattori К., Kuboniwa Н., Kojima Т., Orita Т., Tomonou К., Yamazaki Т., Ochi N.// J.Biol.Chem., 1990, v.265, №20, p. 1143211435. 10. Gillis S., Urdal D.L., Clevenger W., Klinke R., Sassenfeld H., Price V., Cosman D.// Behring Inst. Mitt., 1988, p. 1-7. 11. Кашьяп С.П., Быстрое H.C., Болдырева Е.Ф., Полякова И.А., Северцова И.В., Коробко В.Г. // Биоорган, химия, 1992, т. 18, №1, с. 71-77. 12. Sambrook J., Fritsch E.F., Maniatis T. // Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989. 13 Комп’ютерна верстка М. Ломалова 87054 Підписне 14 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюRecombinant plasmid dna psx70, coding the synthesis of recombinant human granulocyte colony-stimulating factor (g-csf) the strain of escherichia coli sx70, the method for obtainment of human g-csf, and the preparation based on highly purified g-csf
Автори англійськоюYAROTSKII Serhiei Viktorovich, CHUVPILO Sierhiei Albiertovich, Skrypin Vasilii Ivanovich, Mohutov Mikhail Alieksandrovich, Yakovienko Andriei Romanovich
Назва патенту російськоюРекомбинантная плазмидная днк psx70, кодирующая синтез рекомбинантного человеческого гранулоцит-колониестимулирующего фактора (г-ксф), штамм escherichia coli sx70, способ получение г-ксф человека и препарат на основе высокоочищенного г-ксф
Автори російськоюЯРОЦКИЙ Сергей Викторович, ЧУВПИЛО Сергей Альбертович, Скрыпин Василий Иванович, Могутов Михаил Александрович, Яковенко Андрей Романович
МПК / Мітки
МПК: C12P 21/02, C12N 15/72, C07K 14/53, A61K 38/19, C12N 15/27
Мітки: основі, г-ксф, спосіб, плазмідна, фактора, рекомбінантного, людини, високоочищеного, psx70, днк, рекомбінантна, синтез, людського, кодує, штам, препарат, одержання, escherichia, sx70, гранулоцит-колонійстимулюючого
Код посилання
<a href="https://ua.patents.su/7-87054-rekombinantna-plazmidna-dnk-psx70-shho-kodueh-sintez-rekombinantnogo-lyudskogo-granulocit-kolonijjstimulyuyuchogo-faktora-g-ksf-shtam-escherichia-coli-sx70-sposib-oderzhannya-g-ksf.html" target="_blank" rel="follow" title="База патентів України">Рекомбінантна плазмідна днк psx70, що кодує синтез рекомбінантного людського гранулоцит-колонійстимулюючого фактора (г-ксф), штам escherichia coli sx70, спосіб одержання г-ксф людини та препарат на основі високоочищеного г-ксф</a>
Попередній патент: Спосіб дифузійного з’єднання металевих деталей через прошарок
Наступний патент: Установка для очищення забрудненої води електроерозійною коагуляцією
Випадковий патент: Спосіб розливання сталі в зливки











