Пестицидні композиції
Номер патенту: 112761
Опубліковано: 25.10.2016
Автори: Еккельбарджер Джозеф Д., Траллінгер Тоні К., Хантер Рікі, Бебкок Джонатан М., Адельфінская Єлєна, Паркер Маршалл Х., Яп Моріс К. Х., Байсс Енн М., Гаріці Негар, Самарітоні Джек Джено
Формула / Реферат
1. Сполука за формулою 1:
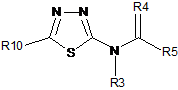 , формула 1
, формула 1
де
R10 являє собою
 ;
;
R1 вибирають з Н, F, Cl, Br, I або заміщеного або незаміщеного C1-С6алкілу,
де кожний вказаний R1, який є заміщеним, має один або більше замісників, вибраних з F, Cl, Br або I;
R2 являє собою Н, F, Cl, Br, I або заміщений або незаміщений C1-С6алкіл,
де кожний вказаний R2, який є заміщеним, має один або більше замісників, вибраних з F, Cl, Br або I;
R3 являє собою Н або заміщений або незаміщений C1-С6алкіл;
R4 являє собою О, S;
R5 являє собою (C1-C6алкіл)S(O)n(C1-C12алкіл) або (C1-C12алкіл)O(C1-C12алкіл),
R7 являє собою Н, F, Cl, Br, I або заміщений або незаміщений C1-С6алкіл,
де кожний вказаний R7, який є заміщеним, має один або більше замісників, вибраних з F, Cl, Br або I;
R8 являє собою Н, F, Cl, Br або I, або заміщений або незаміщений C1-С6алкіл,
де кожний вказаний R8, який є заміщеним, має один або більше замісників, вибраних з F, Cl, Br або I; і
n являє собою (кожний незалежно) 0, 1 або 2.
2. Сполука за п. 1, що має одну з наступних структур:
сполука №
структура
1
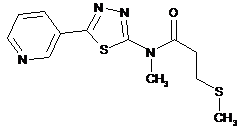
2
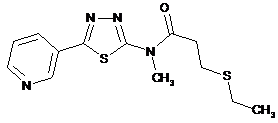
3
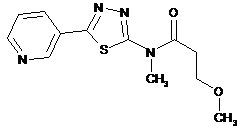
4
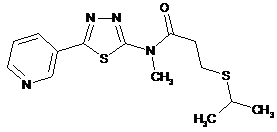
6
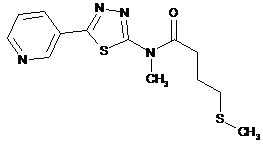
8
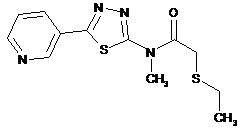
9
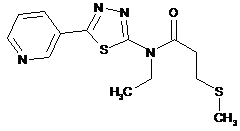
13
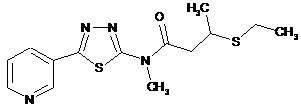
17
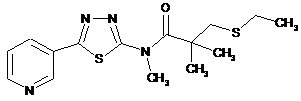
18
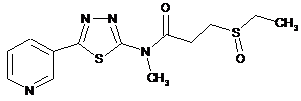
20
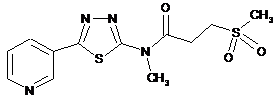
24
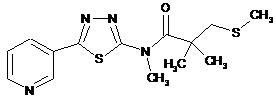
28
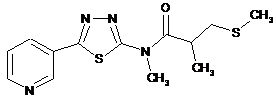
29
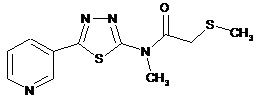
32
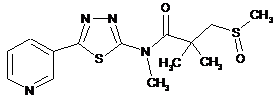
33
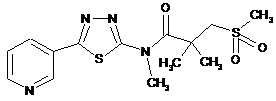
37
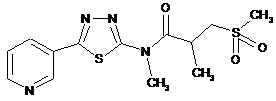
67
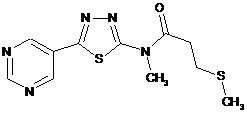
3. Спосіб боротьби з сільськогосподарськими шкідниками, що включає нанесення сполуки за п. 1 на поверхню в кількості, достатній для боротьби з такими сільськогосподарськими шкідниками.
Текст
Реферат: Сполука за формулою один та спосіб боротьби з сільськогосподарськими шкідниками. N R10 R4 N S N R3 Формула 1 R5 UA 112761 C2 (12) UA 112761 C2 UA 112761 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресні посилання на споріднені заявки По даній заявці запитується пріоритет згідно з попередньо поданою в США заявкою 61/378528 від 31 серпня 2010. Повний зміст цієї попередньої заявки даним включений в дану заявку шляхом посилання. Галузь техніки, до якої належить винахід Винахід, розкритий в цьому документі, стосується галузі способів отримання молекул, які можуть застосовуватися як пестициди (наприклад, акарициди, інсектициди, молюскоциди і нематоциди), таких молекул і способів застосування таких молекул для боротьби з сільськогосподарськими шкідниками. Рівень техніки винаходу Сільськогосподарські шкідники є причиною смерті мільйонів людей по всьому світу кожний рік. Більше того, існує більше десяти тисяч видів сільськогосподарських шкідників, які викликають загибель сільськогосподарських культур. Втрати сільськогосподарських культур по всьому світу обчислюються мільярдами доларів США щорічно. Терміти наносять шкоду всім типам приватних і державних споруд. Втрати внаслідок пошкоджуючої дії термітів по всьому світу обчислюються мільярдами доларів США по всьому світу щорічно. Амбарний шкідники поїдають і пошкоджують запаси продовольства. Втрати запасів продовольства по всьому світу обчислюються мільярдами доларів США щорічно, але, що найбільш важливо, позбавляють людей необхідної їжі. Існує гостра потреба в нових пестицидах. Нинішні сільськогосподарські шкідники виробляють стійкість до пестицидів, які застосовуються в даний час. Сотні видів шкідників стійкі до одного або декількох пестицидів. Формування стійкості до деяких з найстаріших пестицидів, таких як ДДТ, карбамати і фосфорорганічні пестициди, добре відоме. Але стійкість вже вироблена навіть до новіших пестицидів. Внаслідок цього, по ряду причин, включаючи причини, вказані вище, існує потреба в нових пестицидах. Визначення Приклади, приведені у визначеннях, в основному неповні і не повинні бути неправильно витлумачені, як що обмежують винахід, розкритий в даному документі. Само собою розуміється, що замісник повинен відповідати правилам хімічного зв'язку і вимогам стеричної сумісності відносно певної молекули, до якої він приєднується. «Група Акарицидів» охарактеризована під заголовком «АКАРИЦИДИ». «AI Група» охарактеризована після ділянки тексту, де охарактеризована «Група Гербіцидів». «Алкеніл» означає ациклічний, ненасичений (щонайменше один вуглець-вуглецевий подвійний зв'язок), розгалужений або нерозгалужений замісник, що містить вуглець і водень, наприклад, вінільний, алільний, бутенільний, пентенільний і гексенільний. «Алкенілокси» означає алкенільний замісник, що додатково містить одинарний зв'язок вуглець-кисень, наприклад, алілокси, бутенілокси, пентенілокси, гексенілокси. «Алкокси» означає алкільний замісник, що додатково містить одинарний зв'язок вуглецькисень, наприклад, метокси, етокси, пропокси, ізопропокси, бутокси, ізобутокси, і трет-бутокси. «Алкіл» означає ациклічний, насичений, розгалужений або нерозгалужений, замісник, що містить вуглець і водень, наприклад, метил, етил, пропіл, ізопропіл, бутил і трет-бутил. «Алкініл» означає ациклічний, ненасичений (щонайменше один вуглець-вуглецевий потрійний зв'язок), розгалужений або нерозгалужений замісник, що містить вуглець і водень, наприклад, етиніл, пропаргіл, бутиніл і пентиніл. «Алкінілокси» означає алкінільний замісник, що додатково містить одинарний зв'язок вуглець-кисень, наприклад, пентинілокси, гексинілокси, гептинілокси і октинілокси. «Арил» означає циклічний, ароматичний замісник, що містить водень і вуглець, наприклад, феніл, нафтил і біфеніл. «Циклоалкеніл» означає моноциклічний або поліциклічний, ненасичений (щонайменше один вуглець-вуглецевий подвійний зв'язок) замісник, що містить вуглець і водень, наприклад, циклобутеніл, циклопентеніл, циклогексеніл, норборненіл, біцикло[2.2.2]октеніл, тетрагідронафтил, гексагідронафтил і октагідронафтил. «Циклоалкенілокси» означає циклоалкенільний замісник, що додатково містить одинарний зв'язок вуглець-кисень, наприклад, циклобутенілокси, циклопентенілокси, норборненілокси і біцикло[2.2.2]октенілокси. «Циклоалкіл» означає моноциклічний або поліциклічний, насичений замісник, що містить вуглець і водень, наприклад, циклопропіл, циклобутил, циклопентил, норборніл, біцикло[2.2.2]октил і декагідронафтил. 1 UA 112761 C2 5 10 15 20 25 30 35 40 45 «Циклоалкокси» означає циклоалкільний замісник, що додатково містить одинарний зв'язок вуглець-кисень, наприклад, циклопропілокси, циклобутилокси, циклопентилокси, норборнілокси і біцикло[2.2.2]октилокси. «Група Фунгіцидів» охарактеризована під заголовком «ФУНГІЦИДИ». «Галоген» означає фтор-, хлор-, бром- і йод-замісники. «Галогеналкокси» означає алкокси замісник, що додатково містить від одного до максимально можливого числа однакових або різних галогенових замісників, наприклад, фторметокси, трифторметокси, 2,2-дифторпропокси, хлорметокси, трихлорметокси, 1,1,2,2тетрафторетокси і пентафторетокси. «Галоалкіл» означає алкільний замісник, що додатково містить від одного до максимально можливого числа однакових або різних, галогенових замісників, наприклад, фторметил, трифторметил, 2,2-дифторпропіл, хлорметил, трихлорметил і 1,1,2,2-тетрафторетил. «Група Гербіцидів» охарактеризована після заголовка «ГЕРБІЦИДИ». «Гетероцикліл» означає циклічний замісник, який може бути повністю насиченим, частково ненасиченим або повністю ненасиченим, де циклічна структура містить щонайменше один вуглець і щонайменше один гетероатом, де вказаний гетероатом являє собою азот, сірку або кисень. Приклади ароматичних гетероциклічних замісників включають, але не обмежуються, бензофураніл, бензоізотіазоліл, бензоізоксазоліл, бензоксазоліл, бензотієніл, бензотіазоліл цинолініл, фураніл, індазоліл, індоліл, імідазоліл, ізоіндоліл, ізохінолініл, ізотіазоліл, ізоксазолільним, оксадіазолільним, оксазолініл, оксазоліл, фталазиніл, піразиніл, піразолініл, піразоліл, піридазиніл, піридиніл, піримідиніл, піроліл, хіназолініл, хінолініл, хіноксалініл, тетразоліл, тіазолініл, тіазоліл, тієніл, триазиніл і триазоліл. Приклади повністю насичених гетероциклічних замісників включають, але не обмежуються, піперазиніл, піперидиніл, морфолініл, піролідиніл, тетрагідрофураніл і тетрагідропіраніл. Приклади частково ненасичених гетероциклічних замісників включають, але не обмежуються, 1,2,3,4-тетрагідрохінолініл, 4,5дигідрооксазоліл, 4,5-дигідро-1H-піразоліл, 4,5-дигідроізоксазоліл і 2,3-дигідро-[1,3,4]оксадіазоліл. «Група Інсектицидів» охарактеризована під заголовком «ІНСЕКТИЦИДИ». «Група Нематоцидів» охарактеризована під заголовком «НЕМАТОЦИДИ». «Група Синергістів» охарактеризована під заголовком «СУМІШІ СИНЕРГІСТІВ І СИНЕРГІСТИ». Докладний опис винаходу Даний документ розкриває молекули, що мають наступні формули ("Формула Один"): Формула Один, в якій R10 вибирається з наступних груп R1 вибирається з Н, F, Cl, Br, I, CN,NO2, заміщеного або незаміщеного C1-С6 алкілу, заміщеного або незаміщеного С2-С6 алкенілу, заміщеного або незаміщеного C1-С6 алкокси, заміщеного або незаміщеного С2-С6 алкенілокси, заміщеного або незаміщеного C3-C10 циклоалкілу, заміщеного або незаміщеного C3-C10 циклоалкенілу, заміщеного або незаміщеного С6-С20 арилу, заміщеного або незаміщеного C 1-C20 гетероциклілу, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9)2, N(R9)2, N(R9)C(=X1)R9, SR9, S(О) nOR9 або R9S(О)nR9, де кожний вказаний R1, який є заміщеним, має один або більше замісників, вибраних з F, Cl, Br, I, CN,NO2, C1-С6 алкілу, С2-С6 алкенілу, C1-С6 галогеналкілу, С2-С6 галогеналкенілу, C1-С6 галогеналкілокси, С2-С6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, S(О)nOR9, С6-С20 арилу або C1-C20 гетероциклілу, (кожний з яких може бути заміщеним, може бути необов'язково заміщеним R9); 2 UA 112761 C2 5 10 15 20 25 30 35 40 45 50 55 60 R2 являє собою Н, F, Cl, Br, I, CN,NO2, заміщений або незаміщений C1-С6 алкіл, заміщений або незаміщений С2-С6 алкеніл, заміщений або незаміщений C1-С6 алкокси, заміщений або незаміщений С2-С6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений С6-С20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9) 2, N(R9)2, N(R9)C(=X1)R9, SR9, S(О)nOR9 або R9S(О)nR9, де кожний вказаний R2, який є заміщеним, має один або більше замісників, вибраних з F, Cl, Br, I, CN,NO2, C1-С6 алкілу, С2-С6 алкенілу, C1-С6 галогеналкілу, С2-С6 галогеналкенілу, C1-С6 галогеналкілокси, С2-С6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкіл, C3-C10 галогенциклоалкенілу, OR9, S(О)nOR9, С6-С20 арилу або C1-C20 гетероциклілу, (кожний з яких може бути заміщеним, може бути необов'язково заміщеним R9); R3 являє собою Н, заміщений або незаміщений C1-С6 алкіл, заміщений або незаміщений С2С6 алкеніл, заміщений або незаміщений C1-С6 алкокси, заміщений або незаміщений С2-С6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений С 6-С20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9) 2, N(R9)2, N(R9)C(=X1)R9, SR9, S(О)nOR9, R9S(О)nR9, C1-С6 алкіл, С6-С20 арил (де алкіл і арил можуть бути незалежно заміщеними або незаміщеними), С(=X2)R9, C(=X1)X2R9, R9X2C(=X1)R9, R9X2R9, С(=О)(C 1-С6 алкіл)S(О)n(C1-С6 алкіл), С(=О)(C1-С6 алкіл)С(=О)О(C1-С6 алкіл), (C1-С6 алкіл)OC(=О)(С6-С20 арил), (C1-С6 алкіл)OC(=О)(C1-С6 алкіл), C1-С6 алкіл-(C3-C10 циклогалогеналкіл), або (C1-С6 алкеніл)С(=О)О(C1-С6 алкіл) або R9X2C(=X1)X2R9; де кожний вказаний R3, який є заміщеним, має один або більше замісників, вибраних з F, Cl, Br, I, CN,NO2, C1-С6 алкілу, С2-С6 алкенілу, C1-С6 галоалкілу, С2-С6 галогеналкенілу, C1-С6 галогеналкілокси, С2-С6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галоциклоалкілу, C3-C10 галоциклоалкенілу, OR9, S(О) nOR9, С6-С20 арилу або C1-C20 гетероциклілу, (кожний з яких може бути заміщеним, може бути необов'язково заміщеним R9); R4 являє собою О, S, NR9 або NOR9; R5 являє собою (C1-C12 алкеніл)S(О)n(C1-C12 алкіл), (C1-C12 алкіл(R6))S(О)n(C1-C12 алкіл), (C1-C12 алкіл)(S(C1-C12 алкіл (кожний незалежно від іншого)))2, (C1-C12 алкіл)С(=NO(C1-C12 алкіл))(C1-C12 алкіл), (C1-C12 алкіл)С(=О)(C1-C12 алкіл), (C1-C12 алкіл)С(=О)О(C1-C12 алкіл), (C1-C12 алкіл)N(R9)2, (C1-C12 алкіл)N(R9)С(=О)О(C1-C12 алкіл), (C1-C12 алкіл)N(R9)С(=О)О(C1-C12 алкіл)R6, (C1-C12 алкіл)О(C1-C12 алкіл), (C1-C12 алкіл)OC(=О)(C1-C12 алкіл)S(О)n(C1-C12 алкіл), (C1-C12 алкіл)OSi(C1-C12 алкіл)3 кожний незалежно від іншого), (C1-C12 алкіл)S(О)n(C1-C12 галогеналкіл), (C1-C12 алкіл)S(О)n(=NCN)(C1-C12 алкіл), (C1-C12 алкіл)S(О)n(C1-C12 алкеніл), (C1-C12 алкіл)S(О)n(C1-C12 алкіл), (C3-C12 циклоалкіл)(C1-C12 алкіл)(S(О)n(C1-C12 алкіл), (C1-C12 алкіл)S(О)n(C1-C12 алкіл)R6, (C1-C12 алкіл)S(О)n(С6-С20 арил), (C1-C12 алкіл)S(О)nR6, (C1-C12 алкіл)S(О)nC(=О)(C1-C12 алкіл), (C1-C12 алкілCN)S(О)n(C1-C12 алкіл), (C1-C12 алкілN(R9)2)S(О)n(C1-C12 алкіл), N(R9)(C1-C12 алкіл)О(C1-C12 алкіл), N(R9)(C1-C12 алкіл)S(О)n(C1-C12 алкіл), О(C1-C12 алкіл), О(C1-C12 алкіл)О(C1-C12 алкіл), О(C1-C12 алкіл)S(О)n(C1-C12 алкіл), або S(О)n(C1-C12 алкіл); R6 являє собою Н, заміщений або незаміщений С6-С20 арил, заміщений або незаміщений C1-C20 гетероцикліл; R7 являє собою Н, F, Cl, Br, I, CN,NO2, заміщений або незаміщений C1-С6 алкіл, заміщений 3 UA 112761 C2 5 10 15 20 25 30 35 40 45 50 або незаміщений С2-С6 алкеніл, заміщений або незаміщений C1-С6 алкокси, заміщений або незаміщений С2-С6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений С6-С20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9) 2, N(R9)2, N(R9)C(=X1)R9, SR9, S(О)nOR9, або R9S(О)nR9, де кожний вказаний R7, який є заміщеним, має один або більше замісників, вибраних з F, Cl, Br, I, CN,NO2, C1-С6 алкілу, С2-С6 алкенілу, C1-С6 галогеналкілу, С2-С6 галогеналкенілу, C1-С6 галогеналкілокси, С2-С6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галоциклоалкілу, C3-C10 галоциклоалкенілу, OR9, S(О)nOR9, С6-С20 арилу, або C1-C20 гетероциклілу, (кожний з яких може бути заміщеним, може бути необов'язково заміщеним R9); R8 являє собою Н, F, Cl, Br, I, CN,NO2, заміщений або незаміщений C1-С6 алкіл, заміщений або незаміщений С2-С6 алкеніл, заміщений або незаміщений C1-С6 алкокси, заміщений або незаміщений С2-С6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений С6-С20 арил, заміщений або незаміщений C1-C20 гетероцикліл, OR9, C(=X1)R9, C(=X1)OR9, C(=X1)N(R9) 2, N(R9)2, N(R9)C(=X1)R9, SR9, S(О)nOR9 або R9S(О)nR9, де кожний вказаний R8, який є заміщеним, має один або більше замісників, вибраних з F, Cl, Br, I, CN,NO2, C1-С6 алкілу, С2-С6 алкенілу, C1-С6 галогеналкілу, С2-С6 галогеналкенілу, C1-С6 галогеналкілокси, С2-С6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OR9, S(О)nOR9, С6-С20 арилу або C1-C20 гетероциклілу, (кожний з яких може бути заміщеним, може бути необов'язково заміщеним R9); R9 (кожний незалежно) являє собою Н, CN, заміщений або незаміщений C 1-С6 алкіл, заміщений або незаміщений С2-С6 алкеніл, заміщений або незаміщений C1-С6 алкокси, заміщений або незаміщений С2-С6 алкенілокси, заміщений або незаміщений C3-C10 циклоалкіл, заміщений або незаміщений C3-C10 циклоалкеніл, заміщений або незаміщений С6-С20 арил, заміщений або незаміщений C1-C20 гетероцикліл, S(О)nC1-С6 алкіл, N(C1-С6 алкіл)2; де кожний вказаний R9, який є заміщеним, має один або більше замісників, вибраних з F, Cl, Br, I, CN,NO2, C1-С6 алкілу, С2-С6 алкенілу, C1-С6 галогеналкілу, С2-С6 галогеналкенілу, C1-С6 галогеналкілокси, С2-С6 галогеналкенілокси, C3-C10 циклоалкілу, C3-C10 циклоалкенілу, C3-C10 галогенциклоалкілу, C3-C10 галогенциклоалкенілу, OC1-С6 алкілу, OC1-С6 галогеналкілу, S(О)nC1С6 алкілу, S(О)nOC1-С6 алкілу, С6-С20 арилу або C1-C20 гетероциклілу; X1 являє собою (кожний незалежно) О або S; X2 являє собою (кожний незалежно) О, S, =NR9 або =NOR9; і n являє собою (кожний незалежно) 0, 1 або 2. У іншому варіанті здійснення R1 являє собою Н або C1-С6 галогеналкіл. У іншому варіанті здійснення R2 являє собою Н або Cl. У іншому варіанті здійснення R3 являє собою Н, незаміщений C 1-С6 алкіл, незаміщений С6С20 арил, або R9S(О)nR9. У іншому варіанті здійснення R3 являє собою Н, незаміщений C 1-С6 алкіл, феніл або (C1-С6 алкіл)S(О)n(C1-С6 алкіл). У іншому варіанті здійснення R4 являє собою О або S. У іншому варіанті здійснення R5 являє собою (C1-C12 алкіл)S(О)n(C1-C12 алкіл). У іншому варіанті здійснення R6 являє собою Н або феніл. У іншому варіанті здійснення R7 являє собою Н, F, Cl, незаміщений C 1-С6 алкіл, C1-С6 галогеналкіл або N(R9)2. У іншому варіанті здійснення R8 являє собою Н або Cl. У іншому варіанті здійснення R10 являє собою Молекули Формули Один будуть в основному мати молекулярну масу від близько 100 Дальтон до близько 1200 Дальтон. Однак в основному переважним є, якщо молекулярна маса знаходиться в межах від близько 120 Дальтон до близько 900 Дальтон, і навіть більш переважно, якщо молекулярна маса знаходиться в межах від близько 140 Дальтон до близько 600 Дальтон. У приведених нижче схемах, 4 UA 112761 C2 або 5 10 Приведена нижче схема ілюструє способи отримання 2-аміно-1,3,4-тіадіазолів. На стадії а схеми I, обробка відповідної карбонової кислоти формули IIa тіосемікарбазидом формули III в кислоті, такій як сірчана кислота або поліфосфорна кислота, приводила до утворення 2-аміно1,3,4-тіадіазолів формули IV, які були згодом перетворені в броміди через діазонієву проміжну сполуку на стадії b схеми I. 2-Аміно-1,3,4-тіадіазол може також бути перетворений в хлорид по реакції діазонієвої проміжної сполуки і міді в хлористоводневої кислоті. Отримані галогентіадіазоли вступають в реакцію з відповідними амінами на стадії з для отримання 2аміно-1,3,4-тіадіазолів формули Va в схемі I. Схема I і 15 20 25 30 На схемі II приведений ще один спосіб отримання 2-аміно-1,3,4-тіадіазолів. На стадії а схеми II відповідний карбоксальдегід формули IIb може конденсуватися з тіосемікарбазидом формули VI в полярному апротонному розчиннику, такому як диметилсульфоксид, для отримання сполук формули VII. На стадії b сполуки формули VII були згодом циклізовані за допомогою окиснювального реагенту, такого як хлорид заліза (III) гексагідрат, в полярному протонному розчиннику, такому як етанол, з отриманням 2-аміно-1,3,4-тіадіазолу формули Vb в схемі II. Схема II На стадії а схеми III, сполуки формули Vc можуть бути оброблені хлорангідридом формули VIII в присутності основи, такої як N,N-диметиламінопіридин, в полярному апротонному розчиннику, такому як дихлоретан, з отриманням сполуки формули Ia. У контексті даного документа хлорангідриди, що застосовуються в реакції ацилювання, є або комерційно доступними, або можуть бути синтезовані фахівцями в даній галузі техніки. Схема III На стадії а і b схеми IV, сечовини, тіосечовини, карбамати і тіокарбамати отримані з 2-аміно1,3,4-тіадіазолів формули Vd. Сполукам формули Vd, в яких R1, R2 і R3 визначені раніше, дають прореагувати з фосгеном або тіофосгеном для отримання проміжних карбамоїлхлоридів або тіокарбамоїлхлоридів, відповідно. Крім того, сполуки формули Vd можуть бути оброблені хлороформіатом, таким як метилхлороформіат, і основою, такою як триетіламін, в апротонному розчиннику, такому як дихлорметан, для отримання карбамату формули Ic, як на стадії c. На стадії е схеми IV сполуки Формули 1b обробляється аміном для отримання сечовини або 5 UA 112761 C2 5 10 15 тіосечовини формули Id, де R4=О або S, відповідно. Алкілування атома азоту сечовини сполук формули Id, де R4=О алкілгалогенідом, таким як йодметан, в присутності основи, такої як гідрид натрію, і в полярному апротонному розчиннику, такому як ДМФА, приводить до отримання сполук формули If, де R4=О, як показано на стадії g схеми IV. На стадії d і f схеми IV карбамоїл хлорид обробляється спиртом або тіолом для отримання карбамату формули Ic або тіокарбамату формули Ie, відповідно. Схема IV Окиснення сульфіду до сульфоксиду або сульфону здійснюється, як в схемі V. Сульфід формули Ig, де X, R1, R2 і R3 описані раніше, обробляється окисником, таким як перборат натрію тетрагідрат, в полярному протонному розчиннику, такому як «крижана» оцтова кислота для отримання сульфоксиду формули Ih на стадії а схеми V. Сульфоксид формули Ih може бути згодом окиснений до сульфону формули Ii за допомогою перборату натрію тетрагідрату в полярному протонному розчиннику, такому як «крижана» оцтова кислота, як на стадії b схеми V. Як альтернатива, сульфон формули Ii може бути отриманий в результаті одностадійної реакції з сульфіду формули Ig, використовуючи раніше згадані умови с ≥ 2 еквівалентами перборату натрію тетрагідрату, як на стадії з схеми V. 6 UA 112761 C2 Схема V 5 10 15 20 25 30 Приклади Приклади приведені з метою ілюстрації і не повинні бути інтерпретовані, як обмежуючі винахід, розкритий в даному документі, до варіантів здійснення, описаних в цих прикладах. Вихідні речовини, реактиви і розчинники, які були отримані з комерційних джерел, використовувалися без подальшого очищення. Безводні розчинники були придбані під торговою маркою Sure/Seal™ в компанії Aldrich і використовувалися в тому вигляді, в якому були отримані. Температури плавлення визначали на капілярному приладі для визначення температури плавлення Thomas Hoover Unimelt або за допомогою автоматизованої системи для визначення температури плавлення OptiMelt з Stanford Research Systems і не коректувалися. Молекулам давалися їх загальновизнані назви, назви відповідно до програм, які привласнюють назви, такими як ISIS Draw, ChemDraw або ACD Name Pro. Якщо дані програми спромоглися не привласнити назву молекулі, молекула називалася відповідно до 1 загальноприйнятих правил найменування. Спектральні дані H ЯМР приведені в міліонних 13 частках () і були отримані при 300, 400 або 600 МГц, і спектральні дані C ЯМР приведені в міліонних частках () і були отримані при 75, 100 або 150 МГц, якщо не вказано інше. Приклад 1: Отримання 5-піридин-3-іл-[1,3,4]тіадіазол-2-іламіну 5-придин-3-іл-[1,3,4]тіадіазол-2-іламін був отриманий, як описано в Turner et al. J. Med. Chem. 1988, 31, 898. Нікотинову кислоту (30 г, 0,24 моль) додавали порціями до поліфосфорної кислоти (60 мл) при механічному перемішуванні. Після перемішування протягом 5 хвилин, порціями додавали тіосемікарбазид (22,2 г, 0,24 моль). Отриману реакційну суміш нагрівали до 90°С протягом 6 годин, охолоджували до кімнатної температури протягом 14 годин і наново нагрівали до 40°С, щоб розплавився твердий жовтий осад. Воду додавали по краплях (50 мл) за допомогою піпетки Пастера при перемішуванні. Розчин охолоджували до 0°С, NH 4OH (29% розчин, приблизно 250 мл) додавали по краплях протягом 2,5 годин, щоб довести pH до 14. Тверді речовини збирали фільтруванням, промивали водою (150 мл) і висушували у вакуумі при 65°С протягом 16 годин, щоб отримати вказану в заголовку сполуку у вигляді твердої речовини -1 1 з бежеватим забарвленням (21,7 г, 50%): тп 201-211°С; ІЧ (тонка плівка KBr) 1508 см ; H ЯМР (300 МГц, ДМСО-d6) 8,95 (д, J=2,1 Гц, 1H), 8,62 (дд, J=4,5, 0,9 Гц, 1H), 8,14 (дт, J=8,4, 1,5 Гц, + 1H), 7,51 (дд, J=8,1, 1,5 Гц, 1H); ЕСІМС m/z 179 ([M+H] ). Приклад 2: Отримання 2-аміно-5-(3-піридил)-1,3,4-тіадіазол 7 UA 112761 C2 5 10 15 20 25 30 35 40 Суміш тіосемікарбазиду (1,01 г, 4,34 ммоль) в 5 мл концентрованої сірчаної кислоти нагрівали до 100°С протягом 3 год. Отриману реакційну суміш охолоджували до 23°С і додавали 50% водний розчин гідроксиду натрію для досягнення pH≈9. Тверду речовину збирали, промивали водою, і сушили на повітрі для отримання 620 мг 2-аміно-5-(3-піридил)1,3,4-тіадіазолу. Фільтрат екстрагували етилацетатом. Етилацетатні екстракти об'єднували, висушували над MgSO4, і концентрували досуха для отримання 0,120 г 2-аміно-5-(3-піридил)1,3,4-тіадіазолу. Партії були об'єднані з отриманням (0,738 г, 95%) 2-аміно-5-(3-піридил)-1,3,41 тіадіазолу: H ЯМР (300 МГц, ДМСО-d6) 8,9 (д, 1H), 8,6 (дд, 1H), 8,1 (тд, 1H), 7,57 (с, 2H), 7,5 (м, 1H). Приклад 3: Отримання N-феніл-5-(піридин-3-іл)-1,3,4-тіадіазол-2-аміну Отримання (Е)-4-феніл-1-(піридин-3-ілметилен)-тіосемікарбазиду: 4- фенілтіосемікарбазид (890 мг, 5,3 ммоль, 1,0 еквівалент) додавали до перемішуваного розчину нікотинальдегіду (500 мкл, 5,3 ммоль, 1,0 еквівалент) в метанолі (2,5 мл) при 23°С. Отриманий блідо-жовтий розчин нагрівали до 65°С і перемішували протягом 3 год. Охолоджену реакційну суміш концентрували у вакуумі. Отриманий залишок промивали холодним етилацетатом і піддавали вакуумному фільтруванню для отримання вказаної в заголовку сполуки у вигляді сірувато-білих кристалів (1,3 г, 93%): тп 208-210°С; ІЧ (тонка плівка KBr) 3442 (w), 3298 (m), 3125 (w), 2940 (w), 2791 (w), -1 1 1594 (s), 1532 (s) см ; H ЯМР (300 МГц, ДМСО-d6) 11,98 (с, 1H), 10,22 (с, 1H), 9,03 (д, J=2 Гц, 1H), 8,59 5 (дд, J=5, 2 Гц, 1H), 8,38 (дт, J=8, 2 Гц, 1H), 8,18 (с, 1H), 7,55 (м, 2H), 7,45 (дд, J=8, 5 + Гц, 1H), 7,21 (м, 1H); ЕСІМС m/z 257 ([M+H] ). Отримання N-феніл-5-(піридин-3-іл)-1,3,4-тіадіазол-2-аміну Порошкоподібний хлорид заліза (III) гексагідрат (5,1 г, 19 ммоль, 4,0 еквіваленти) додавали до перемішуваної суспензії (Е)-4феніл-1-(піридин-3-ілметилен)тіосемікарбазиду (1,2 г, 4,7 ммоль, 1,0 еквівалент) в абсолютному етанолі (47 мл) при 23°С. Отриману темно-коричневу суспензію нагрівали до 95°С і перемішували протягом 2 год. Охолоджену реакційну суміш концентрували роторним випаровуванням. Отриманий залишок розбавляли в 1M розчині гідроксиду натрію (200 мл) і екстрагували дихлорометаном (8(75 мл). Об'єднані органічні шари висушували (Na 2SО4), безнапірно фільтрували і концентрували роторним випаровуванням для отримання вказаної в заголовку сполуки у вигляді жовтувато-коричневої твердої речовини (300 мг, 25%): тп 252255°С; ІЧ (тонка плівка KBr) 3460 (w), 3260 (w), 3198 (w), 2921 (w), 2851 (w), 2788 (w), 1620 (m), 1 ), 1566 (m), 1501 (s) cm-1; H ЯМР (300 МГц, ДМСО-d6) 10,65 (с, 1H 9,05 (д, J=2 Гц, 1H), 8,67 (дд, J=5, 2 Гц, 1H), 7,66 (м, 2H), 7,56 (дд, J=8, 5 Гц, 1H), 7,38 (м, 2H), 7,05 (м, 1H); ЕСІМС m/z 255 + ([M+H] ). Прекурсори N-метил-5-[4-(трифторметил)піридин-3-іл]-1,3,4-тіадіазол-2-амін, N-метил-5-[4(трифторметил)піридин-3-іл]-1,3,4-тіадіазол-2-амін, N-метил-5-піримідин-5-іл-1,3,4-тіадіазол-2амін, 5-(6-хлорпіридин-3-іл)-N-метил-1,3,4-тіадіазол-2-амін, 5-(5-фторпіридин-3-іл)-N-метил1,3,4-тіадіазол-2-амін, 5-(5-хлорпіридин-3-іл)-N-метил-1,3,4-тіадіазол-2-амін, N-метил-5-(2метилпіримідин-5-іл)-1,3,4-тіадіазол-2-амін, N,N-диметил-5-[5-(метиламіно)-1,3,4-тіадіазол-2 8 UA 112761 C2 іл]піримідин-2-амін, N-метил-5-[5-(трифторметил)піридин-3-іл]-1,3,4-тіадіазол-2-амін, N-метил-5піридин-4-іл-1,3,4-тіадіазол-2-амін і N-метил-5-(5-метилпіридин-3-іл)-1,3,4-тіадіазол-2-амін були отримані, як описано в прикладі 3. Приклад 4: Отримання гідроброміду 3-(5-бромо-[1,3,4]тіадіазол-2-іл)піридин 5 10 15 20 25 30 35 До розчину водної бромистоводневої кислоти (48%, 17 мл) при 5°С в крижаній бані додавали 5-піридин-3-іл-[1,3,4]тіадіазол-2-іламін (6 г, 33 ммоль) з подальшим додаванням брому (12,8 мл, 0,24 моль) з такою швидкістю, щоб температура реакційної суміші залишалася нижчою ніж 11°С. Розчин нітриту натрію (6 г, 85 ммоль) у воді (8,5 мл) додавали з такою швидкістю, щоб температура реакційної суміші підтримувалася близько 5°С. Реакційну суміш витримували при 2°С протягом 2 годин, і потім підлуговували до pH 8,9 за допомогою розбавленого NaOH зі швидкістю, яка потрібно для підтримування температури в межах від 5°С до 15°С. Отримані тверді речовини збирали фільтруванням, промивали крижаною водою (200 мл) доти, доки фільтрат не ставав кислим (pH 4) і висушували у вакуумі при 35°С для отримання вказаної в заголовку сполуки у вигляді оранжевого порошку (8,68 г, 80%): тп 124-1 1 129°С; ІЧ (тонка плівка KBr) 1374, 1026 см ; H ЯМР (300 МГц, ДМСО-d6) 9,17 (д, J=1,8 Гц, 1H), 8,80 (дд, J=4,5, 0,9 Гц, 1H), 8,42 (дт, J=8,4, 1,8 Гц, 1H), 7,67 (ддд, J=7,2, 4,8, 0,9 Гц, 1H); ЕСІМС m/z 244 (M+2). Приклад 5: Отримання 2-хлор-5-(3-піридил)-[1,3,4]-тіадіазолу До суміші 5-піридин-3-іл-[1,3,4]тіадіазол-2-іламіну (5,5 г, 30,9 ммоль) і порошку міді (0,335 г, 5,27 ммоль) в розчині «крижаної» оцтової кислоти (93 мл) і концентрованої хлористоводневої кислоти (19 мл) при 0°С по краплях додавали розчин нітриту натрію (10,67 г, 154,6 ммоль), розчиненого у воді (13 мл). Після цього реакційній суміші давали нагрітися до 23°С і залишали на ніч. Отриману реакційну суміш розбавляли 300 г льоду, отримуючи емульсію, і екстрагували дихлорметаном (3×200 мл). Емульсію потім пропускали через металокерамічну скляну лійку середньої пористості, що містить целіт. Фільтраційний осад перемішували і добре промивали хлороформом. Фільтрат об'єднували з органічними екстрактами. Потім органічну фазу сушили над MgSO4 і концентрували досуха для отримання вказаної в заголовку сполуки у вигляді 1 жовтої твердої речовини (4,42 г, 72%): H ЯМР (300 МГц, CDCl3) 9,08 (ушир. с, 1H), 8,78 (ушир. с, 1H), 8,29 (дт, J=8, 2 Гц, 1H), 7,49 (дд, J=8, 5 Гц, 1H). Приклад 6 Отримання N-етил-5-піридин-3-іл-1,3,4-тіадіазол-2-аміну N-етил-5-піридин-3-іл-1,3,4-тіадіазол-2-амін може бути отриманий з 2-хлор-5-(3-піридил)[1,3,4]-тіадіазолу, як описано в Chapleo et al. в J. Med. Chem, 1987, 30(5), 951. Приклад 6A Отримання N-(циклопропілметил)-5-(3-піридил)-l, 3,4-тіадіазол-2-аміну 9 UA 112761 C2 5 10 15 20 25 30 35 40 Суспензію гідроброміду циклопропілметанаміну (0,528 г, 0,743 ммоль), 2-бром-5-(3-піридил)1,3,4-тіадіазолу (0,2 г, 0,619 ммоль) і триетіламіну (0,3 мл, 2,16 ммоль) в етанолі (20 мл) нагрівали до 125°С протягом 42 хвилин в мікрохвильовому реакторі, охолоджували до кімнатної температури, концентрували при зниженому тиску і ресуспензували в 2:1 насиченому водному розчині бікарбонату натрію:етилацетату (100 мл). Суспензію сильно трусили, а органічний екстракт збирали і промивали водою (50 мл) і концентрованим сольовим розчином (30 мл) перед висушуванням сульфатом магнію. Отриманий розчин концентрували при зниженому тиску і очищали за допомогою колонкової хроматографії з силікагелевим наповнювачем, елююючи градієнтом метанолу і етилацетату. Фракцію, що повільніше елююється, концентрували при зниженому тиску, щоб отримати вказану в заголовку сполуку у вигляді жовтої твердої речовини (38 мг, 26%): тп 162-165°С; ІЧ (порушене повне відображення) 1573(s), -1 1 1549(s), 1464(m), 1063(m) см ; H ЯМР (400 МГц, CDCl3) 8,97 (д, J=1,6 Гц, 1H), 8,63 (дд, J=4,8, 1,6 Гц, 1H), 8,18 (ддд, J=8,0, 2,2, 1,7 Гц, 1H), 7,38 (ддд, J=8,0, 4,8, 0,7 Гц, 1H), 5,68 (с, 1H), 3,29 13 (д, J=7,1 Гц, 2H), 1,26-1,09 (м, 1H), 0,72-0,53 (м, 2H), 0,42-0,25 (м, 2H); C ЯМР (101 МГц, CDCl3) 170,01, 154,19, 150,61, 147,94, 133,64, 127,47, 123,76, 52,20, 10,76, 3,73; ЕСІМС m/z 231,8 ([MH] ). Приклад 7: Отримання N-2-диметил-3-(метилтіо)-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2іл)пропанаміду (Сполука 28) Оксалілхлорид (980 мкл, 11 ммоль, 1,5 еквівалента) і N,N-диметилформамід (29 мкл, 0,37 ммоль, 0,05 еквівалента) почергово додавали до перемішуваної суспензії 2-метил-3(метилтіо)пропанової кислоти (1,0 г, 7,5 ммоль, 1,0 еквівалент) в дихлорметані (13 мл) при 23°С. Отриманий пінистий жовтий розчин перемішували при 23°С протягом 2 год. Реакційну суміш концентрували роторним випаровуванням. Частина отриманого продукту реакції, 2-метил-3(метилтіо)пропаноїлхлориду (120 мг, 0,79 ммоль, 1,5 еквіваленти) додавали до перемішуваної суспензії N-метил-5-(піридин-3-іл)-1,3,4-тіадіазол-2-аміну (100 мг, 0,52 ммоль, 1,0 еквівалент) і 4-диметиламінопіридину (130 мг, 1,1 ммоль, 2,0 еквівалента) в 1,2-дихлоретані (3,0 мл) при 23°С. Отриманий жовтий розчин нагрівали до 75°С протягом 3 год. Охолоджену реакційну суміш розбавляли насиченим розчином бікарбонату натрію (50 мл) і екстрагували етилацетатом (3×40 мл). Об'єднані органічні шари висушували (MgSO 4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Отриманий залишок очищали за допомогою колонкової хроматографії з силікагелем (етилацетат), щоб отримати коричневу напівтверду -1 1 речовину (70 мг, 44%): ІЧ (тонка плівка KBr) 2975 (w), 2917 (w), 1667 (m) см ; H ЯМР (300 МГц, CDCl3) 9,15 (д, J=2 Гц, 1H), 8,69 (дд, J=5, 2 Гц, 1H), 8,28 (дт, J=8, 2 Гц, 1H), 7,42 (дд, J=8, 5 Гц, 1H), 3,94 (с, 3H), 3,33 (м, 1H), 3,01 (дд, J=13, 8 Гц, 1H), 2,69 (дд, J=13, 6 Гц, 1H), 2,15 (с, 3H), 1,37 + (д, J=7 Гц, 3H); ЕСІМС m/z 309 ([M+H] ). Приклад 8: Отримання N-2,2-триметил-3-(метилтіо)-N-(5-(піридин-3-іл)- l, 3,4-тіадіазол-2іл)пропанаміду (Сполука 24) Оксалілхлорид (500 мкл, 5,8 ммоль, 1,5 еквіваленти) і N,N-диметилформамід (15 мкл, 0,19 10 UA 112761 C2 5 10 15 20 25 30 35 40 45 ммоль, 0,05 еквівалента) почергово додавали до перемішуваної суспензії 2,2-диметил-3(метилтіо)пропанової кислоти (570 мг, 3,8 ммоль, 1,0 еквівалент) в дихлорметані (13 мл) при 23°С. Отриманий пінистий жовтий розчин перемішували при 23°С протягом 1,5 год. Реакційну суміш концентрували роторним випаровуванням. Частину отриманого продукту реакції, 2,2диметил-3-(метилтіо)пропаноїлхлориду (110 мг, 0,66 ммоль, 1,3 еквівалента) додавали до перемішуваної суспензії N-метил-5-(піридин-3-іл)-1,3,4-тіадіазол-2-аміну (100 мг, 0,52 ммоль, 1,0 еквівалент) і 4-диметиламінпіридину (95 мг, 0,78 ммоль, 1,5 еквіваленти) в 1,2-дихлорметані (3,0 мл) при 23°С. Отриманий жовтий розчин нагрівали до 75°С протягом 17 год. Охолоджену реакційну суміш розбавляли насиченим розчином бікарбонату натрію (40 мл) і екстрагували етилацетатом (3×30 мл). Об'єднані органічні шари сушили (МgSO 4), піддавали безнапірному фільтруванню і концентрували за допомогою роторного випаровування. Отриманий залишок очищали колонковою хроматографією з силікагелем (етилацетат), щоб отримати блідо-жовті 1 кристали (140 мг, 82%): тп 89-91°С; H ЯМР (300 МГц, CDCl3) 9,13 (д, J=2 Гц, 1H), 8,66 (дд, J=5, 2 Гц, 1H), 8,25 (дт, J=8, 2 Гц, 1H), 7,40 (дд, J=8, 5 Гц, 1H), 3,95 (с, 3H), 2,95 (с, 2H), 2,15 (с, 3H), + 1,54 (с, 6H); ЕСІМС m/z 323 ([M+H] ). Сполуки 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 17, 19, 24, 29, 30, 31, 34, 35, 44, 47, 49, 53, 57, 58, 60, 62, 64, 66, 67, 70, 71, 72, 73, 74, 75, 81, 84, 88, 90, 91, 92, 93, 94 і 96 були отримані, як описано в прикладі 8. Приклад 9: Отримання метил-4-(метил-(5-(піридин-3-іл)-1,3,4-тіадіазол-2-іл)аміно)-4оксобутаноату (Сполука 56) 4-метокси-4-оксобутанову кислоту (69 мг, 0,52 ммоль, 2,0 еквівалента) і 4диметиламінопіридин (64 мг, 0,52 ммоль, 2,0 еквівалента) почергово додавали до перемішуваної суспензії N-метил-5-(піридин-3-іл)-1,3,4-тіадіазол-2-аміну (50 мг, 0,26 ммоль, 1,0 еквівалент) і гідрохлориду 1-етил-3-(3-диметиламінопропіл)-карбодііміду (200 мг, 1,0 ммоль, 4,0 еквівалента) в 1,2-дихлоретані (2,6 мл) при 23°С. Отриманий оранжевий розчин перемішували при 23°С протягом 18 год. Потім отриману реакційну суміш піддавали колонковій хроматографїі з силікагелем (етилацетат), щоб отримати сірувато-білий порошок (59 мг, 74% вихід): тп 152-1 1 154°С; ІЧ (KBr тонка плівка) 3032 (w), 2951 (w), 1737 (s), 1667 (s) см ; H ЯМР (300 МГц, CDCl3), 9,14 (дд, 1H, J=2, 1 Гц), 8,69 (дд, 1H, J=5, 2 Гц), 8,28 (м, 1H), 7,42 (ддд, 1H, J=8, 5, 1 Гц), 3,90 (с, + 3H), 3,74 (с, 3H), 3,03 (дд, 2H, J=8, 6 Гц), 2,83 (дд, 2H, J=8, 6 Гц); ЕСІМС m/z 307 ([M+H] ). Сполуки 38, 59, 61, 63, 65, 68, 69, 97 і 98 були отримані, як описано в прикладі 9. Приклад 10: Отримання N-метил-3-(метилсульфініл)-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2іл)пропанаміду (Сполука 18) Перборат натрію тетрагідрат (52 мг, 0,34 ммоль, 1,0 еквівалент) додавали до перемішуваного розчину N-метил-3-(метилтіо)-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2іл)пропанаміду (100 мг, 0,34 ммоль, 1,0 еквівалент) в «крижаній» оцтовій кислоті (1,8 мл) при 23°С. Отриману суспензію перемішували при 23°С протягом 3 год. Отриману реакційну суміш розбавляли насиченим розчином бікарбонату натрію (50 мл) і екстрагували дихлорметаном (5×20 мл). Зібрані органічні шари висушували (Na2SО4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Отриманий залишок промивали холодним етилацетатом і піддавали вакуумному фільтруванню, щоб отримати вказану в заголовку 1 сполуку у вигляді сірувато-білого порошку (82 мг, 78% вихід): тп 138-140°С; H ЯМР (300 МГц, ДМСО-d6) 9,12 (д, J=2 Гц, 1H), 8,71 (дд, J=5, 2 Гц, 1H), 8,34 (м, 1H), 7,56 (дд, J=8, 5 Гц, 1H), + 3,80 (с, 3H), 2,90-3,30 (м, 3H), 2,62 (с, 3H); ЕСІМС m/z 311 ([M+H] ). Сполуки 32, 45, 51 і 77 були 11 UA 112761 C2 отримані, як описано в прикладі 10. Приклад 11: Отримання N-метил-3-(метилсульфоніл)-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2іл)пропанаміду (Сполука 20) 5 10 15 20 25 30 35 40 Перборат натрію тетрагідрат (130 мг, 0,84 ммоль, 2,4 еквівалент) додавали до перемішуваного розчину N-метил-3-(метилтіо)-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2іл)пропанаміду (100 мг, 0,34 ммоль, 1,0 еквівалент) в «крижаній» оцтовій кислоті (1,8 мл) при 23°С. Отриману жовту суспензію нагрівали до 60°С протягом 15 год. Охолоджену реакційну суміш розбавляли насиченим розчином бікарбонату натрію (50 мл) і екстрагували дихлорметаном (3×30 мл). Зібрані органічні шари висушували (сульфат натрію), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Отриманий залишок промивали холодним етилацетатом і піддавали вакуумному фільтруванню, щоб отримати вказану в заголовку сполуку у вигляді сірувато-білого порошку (90 мг, 82% вихід): тп 199-201°С; 1 H ЯМР (300 МГц, ДМСО-d6) 9,15 (д, J=2 Гц, 1H), 8,73 (дд, J=6, 2 Гц, 1H), 8,32 (дт, J=8, 2 Гц, 1H), 7,46 (дд, J=8, 5 Гц, 1H), 3,94 (с, 3H), 3,59 (т, J=7 Гц, 2H), 3,33 (т, J=7 Гц, 2H), 3,09 (с, 3H); + ЕСІМС m/z 327 ([M+H] ). Сполуки 33, 36, 37, 40, 43, 46, 52, 76 були отримані, як описано в прикладі 11. Приклад 12: Отримання 2-(метилтіо)етилметил(5-(піридин-3-іл)-1,3,4-тіадіазол-2іл)карбамату (Сполука 50) 2-Метилтіоетанол (100 мкл, 1,2 ммоль, 1,5 еквівалента) додавали до 20% переміщуваного розчину фосгену в толуолі (1,2 мл, 2,3 ммоль, 30 еквівалентів) при 0°С. Отриманому безбарвному розчину давали нагрітися до 23°С і перемішували протягом 1,5 год. Реакційну суміш концентрували за допомогою роторного випаровування. Отриманий залишок додавали до перемішуваної суспензії N-метил-5-(піридин-3-іл)-1,3,4-тіадіазол-2-аміну (150 мг, 0,78 ммоль, 1,0 еквівалент) і 4-диметиламінопіридину (190 мг, 1,6 ммоль, 2,0 еквівалента) в 1,2-дихлоретані (7,8 мл) при 23°С. Отриманий жовтий розчин нагрівали до 75°С протягом 18 год. Охолоджену реакційну суміш розбавляли насиченим розчином бікарбонату натрію (50 мл) і екстрагували етилацетатом (3×40 мл). Об'єднані органічні шари висушували (МgSO 4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Отриманий залишок очищали за допомогою колонкової хроматографії з силікагелем (етилацетат), щоб отримати вказану в заголовку сполуку у вигляді білого порошку (190 мг, 79%): тп 126-128°С; ІЧ (KBr тонка -1 1 плівка) 3044 (w), 2958 (w), 2910 (w), 1700 (s), 1572 (w) см ; H ЯМР (300 МГц, CDCl3) 9,12 ( ушир. с, 1H), 8,70 (д, J=5 Гц, 1H), 8,27 (дт, J=8, 2 Гц, 1H), 7,42 (дд, J=8, 5 Гц, 1H), 4,51 (т, J=7 Гц, + 2H), 3,75 (с, 3H), 2,87 (т, J=7 Гц, 2H), 2,21 (с, 3H); ЕСІМС m/z 311 ([M+H] ). Сполуки 14, 15 і 16 були отримані, як описано в прикладі 12. Приклад 13: Отримання 2-метилсульфанілетилового ефіру [5-(5-фторпіридин-3-іл)[1,3,4][тіадіазол-2-іл]-метилкарбамінової кислоти (Сполука 78) Розчин фосгену (20%, 0,39 мл, 0,8 ммоль) в толуолі додавали піпеткою по краплях в 12 UA 112761 C2 5 10 15 20 25 30 35 40 45 суспензію метил-[5-(5-фторпіридин-3-іл)-[1,3,4]тіадіазол-2-іл]-аміну (0,15 г, 0,7 ммоль) в дихлоретані (10 мл) при 1°С, перемішували протягом 5 хвилин, і обробляли розчином 4-N,Nдиметиламінопіридину (0,192 г, 1,6 ммоль) в дихлоретані (3 мл). Крижану баню прибирали після 30 хвилин. Реакційну суміш перемішували при 23°С протягом 90 хвилин, нагрівали до температури кипіння із зворотним холодильником в атмосфері азоту протягом 14 годин, охолоджували до 0°С і піддавали реакції з 2-метилтіоетанолом (0,033 г, 0,35 ммоль). Крижану баню прибирали після 10 хвилин. Реакційну суміш перемішували при 23°С протягом 1 години, нагрівали до температури кипіння із зворотним холодильником протягом 1 години, охолоджували і розбавляли дихлоретаном (30 мл). Отриману реакційну суміш промивали розбавленою хлористоводневої кислотою (0,1 Н, 2 × 20 мл), насиченим водним NaHCO 3 (40 мл) і концентрованим сольовим розчином (30 мл), а потім висушували над МgSO 4 і проводили колонкову хроматографію з силікагелем, щоб отримати вказану в заголовку сполуку у вигляді 1 білої твердої речовини (0,125 г, 53%): тп 104-106°С; H ЯМР (400 МГц, CDCl3) 8,90 (ушир. т, 1H, 8,56 (д, J=2,8 Гц, 1H), 8,04 (ддд, J=9,1, 2,5, 1,0 Гц, 1H), 4,52 (т, J=6,8 Гц, 2H), 3,75 (с, 3H), + 2,87 (т, J=6,8 Гц, 2H), 2,21 (с, 3H); ЕСІМС m/z 329 ([M+H] ). Приклад 14: Отримання метилтіометилметил(5-(піридин-3-іл)-1,3,4-тіадіазол-2-іл)карбамату (Сполука 54) 37% водний розчин формальдегіду (400 мкл, 4,8 ммоль, 6,0 еквівалентів) додавали до переміщуваного розчину метанетіолату натрію (170 мг, 2,4 ммоль, 3,0 еквівалента) у воді (2,0 мл) при 23°С. Отриманий безбарвний розчин помішували при 23°С протягом 2 год. Реакційну суміш екстрагували діетиловим ефіром (3×2 мл). Об'єднані органічні шари висушували (магнію сульфат) і піддавали безнапірному фільтруванню. Додавали піридин (320 мкл, 3,9 ммоль, 5,0 еквівалентів) і отриманий розчин додавали до 20% переміщуваного розчину фосгену в толуолі (4,0 мл, 7,8 ммоль, 10 еквівалентів) при 0°С. Отриманій білій суміші давали нагрітися до 23°С і перемішували протягом 2 год. Реакційну суміш піддавали безнапірному фільтруванню і концентрували у вакуумі. Отриманий залишок додавали до перемішуваної суспензії N-метил-5(піридин-3-іл)-1,3,4-тіадіазол-2-аміну (150 мг, 0,78 ммоль, 1,0 еквівалент) і 4диметиламінопіридину (290 мг, 2,4 ммоль, 3,0 еквівалента) в 1,2-дихлоретані (7,8 мл) при 23°С. Отриманий жовтий розчин нагрівали до 75°С протягом 18 год прохолоджену реакційну суміш розбавляли насиченим розчином бікарбонату натрію (50 мл) і екстрагували етилацетатом (3×40 мл). Об'єднані органічні шари висушували (MgSO 4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Отриманий залишок очищали колонковою хроматографією з силікагелем (етилацетат), щоб отримати вказану в заголовку сполуку у -1 1 вигляді жовтої плівки (27 мг, 12%): ІЧ (KBr тонка плівка) 2919 (w), 1647 (s), 1570 (w) см ; H ЯМР (300 МГц, CDCl3) 8,89 (ушир. с, 1H), 8,64 (ушир. с, 1H), 7,97 (дт, J=8, 2 Гц, 1H), 7,37 (дд, J=8, 5 Гц, 1H), 5,12 (с, 2H), 3,14 (с, 3H), 2,32 (с, 3H). Приклад 15: Отримання S-метилметил(5-(піридин-3-іл)-1,3,4-тіадіазол-2-іл)карбамотіоату (Сполука 55) 4-Диметиламінопіридин (81 мг, 0,66 ммоль, 1,5 еквівалента) і метилхлортіолформіат (50 мкл, 0,57 ммоль, 1,3 еквіваленти) почергово додавали до перемішуваної суспензії N-метил-5(піридин-3-іл)-1,3,4-тіадіазол-2-аміну (85 мг, 0,44 ммоль, 1,0 еквівалент) в дихлоретані (3,4 мл) при 23°С. Отриманий розчин нагрівали до 75°С і перемішували протягом 72 год. Охолоджену реакційну суміш відразу ж піддавали колонковій хроматографїі з силікагелем (55% етилацетату в гексані з додаванням 5% триетіламіну), щоб отримати вказану в заголовку сполуку у вигляді 13 UA 112761 C2 5 10 15 20 25 30 35 40 45 сірувато-білого порошку (100 мг, 83%): тп 192-194°С; ІЧ (KBr тонка плівка) 2931 (w), 1727 (w), -1 1 1634 (s), 1570 (w) см ; H ЯМР (300 МГц, CDCl3) 9,13 (д, J=2 Гц, 1H), 8,70 (дд, J=5, 2 Гц, 1H), + 8,28 (дт, J=8, 2 Гц, 1H), 7,43 (дд, J=8, 5 Гц, 1H), 3,86 (с, 3H), 2,53 (с, 3H); ЕСІМС m/z 267 ([M+H] ). Сполука 87 була отримана, як описано в прикладі 15. Приклад 16: Отримання 2-метилсульфанілетилового ефіру [5-(5-фторпіридин-3-іл)[1,3,4][тіадіазол-2-іл]-метилтіокарбамінової кислоти - (Сполука 85) Розчин тіофосгену (0,086 г, 0,7 ммоль) в дихлоретані (1 мл) додавали піпеткою по краплях в крижану суспензію метил-[5-(5-фторпіридин-3-іл)-[1,3,4]тіадіазол-2-іл]-аміну (0,15 г, 0,7 ммоль) в дихлоретані (1 мл), перемішували протягом 10 хвилин і обробляли розчином 4-N,Nдиметиламінопіридину (0,105 г, 0,8 ммоль) в дихлоретані (1 мл). Крижану баню прибирали після 10 хвилин і після перемішування при кімнатній температурі протягом 30 хвилин реакційну суміш нагрівали до температури кипіння із зворотним холодильником в атмосфері азоту протягом 2 годин. Потім реакційну суміш охолоджували до 0°С і давали вступити в реакцію з розчином 2метилтіоетанолу (0,072 г, 0,8 ммоль) в дихлоретані (1 мл). Після перемішування реакційної суміші протягом 10 хвилин за допомогою піпетки додавали розчин N,N-диметиламінопіридину (0,105 г, 0,8 ммоль) в дихлоретані (1 мл). Крижану баню прибирали після 10 хвилин. Реакційну суміш перемішували при кімнатній температурі протягом 15 хвилин, нагрівали до температури кипіння із зворотним холодильником в атмосфері азоту протягом 14 годин, охолоджували, концентрували при зниженому тиску і очищали за допомогою обернено-фазної хроматографії, щоб отримати вказану в заголовку сполуку у вигляді жовтої твердої речовини (0,043 г, 17%): тп 1 150-152°С; H ЯМР (400 МГц, CDCl3,) 8,91 (с, 1H), 8,57 (д, J=2,5 Гц, 1H), 8,05 (ддд, J=8,8, 2,8, + 1,8 Гц, 1H), 3,86 (с, 3H), 3,33-3,30 (м, 2H), 2,84-2,80 (м, 2H), 2,22 (с, 3H); ЕСІМС m/z 345 ([M+H] ). Приклад 17: Отримання етилового ефіру [5-(5-фторпіридин-3-іл)][-[1,3,4][тіадіазол-2-іл]метилтіокарбамінової кислоти (Сполука 80) 20% розчин фосгену в толуолі (0,26 мл, 0,5 ммоль) додавали піпеткою по краплях в крижану суспензію метил-[5-(5-фторпіридин-3-іл)-[1,3,4]тіадіазол-2-іл]-аміну (0,1 г, 0,5 ммоль) в дихлоретані (3 мл), перемішували протягом 10 хвилин обробляли розчином N,Nдиметиламінопіридину (0,128 г, 1 ммоль) в дихлоретані (2 мл). Крижану баню прибирали після 10 хвилин і після помішування при кімнатній температурі протягом 30 хвилин, реакційну суміш нагрівали до температури кипіння із зворотним холодильником в атмосфері азоту протягом 2 годин, охолоджували до 1°С і давали прореагувати з чистим етантіолом (0,031 г, 0,5 ммоль). Крижану баню прибирали після 10 хвилин і після помішування при кімнатній температурі протягом 30 хвилин, реакційну суміш нагрівали до температури кипіння із зворотним холодильником в атмосфері азоту протягом 9 годин, охолоджували до кімнатної температури і розбавляли дихлоретаном (40 мл). Реакційну суміш промивали розбавленою хлористоводневою кислотою (0,1 Н, 2х20 мл), насиченим водним бікарбонатом натрію (50 мл), концентрованим сольовим розчином (30 мл), висушували над MgSO 4 і проводили хроматографію з використанням силікагелю, щоб отримати вказану в заголовку сполуку у 1 вигляді білої твердої речовини (0,154 г, 100%): H ЯМР (CDCl3, 400 МГц) 8,91 (с, 1H), 8,56 (д, J=2,8 Гц, 1H), 8,06 (ддд, J=8,8, 2,8, 1,8 Гц, 1H), 3,84 (с, 3H), 3,10 (кв, J=7,4 Гц, 2H), 1,41 (т, J=7,4 + Гц, 2H); ЕСІМС m/z 299 ([M+H] ). Приклад 18: Отримання 1-[5(5фторпіридин-3-іл)-[1,3,4]тіадіазол-2-іл]-1-метил-3-(2метилсульфанілетил)-тіосечовини - (Сполука 86) 14 UA 112761 C2 5 10 15 20 25 30 35 40 Розчин тіофосгену (0,13 мл, 1,7 ммоль) в дихлоретані (1 мл) додавали піпеткою по краплях в охолоджену до 0°С суспензію метил-[5-(5-фторпіридин-3-іл)-[1,3,4]тіадіазол-2-іл]-аміну (0,319 г, 1,5 ммоль) в дихлоретані (5 мл). Реакційну суміш перемішували протягом 10 хвилин і обробляли розчином 4-N,N-диметиламінопіридину (0,222 г, 1,8 ммоль) в дихлоретані (2 мл). Крижану баню прибирали після 15 хвилин. Реакційну суміш перемішували при кімнатній температурі протягом 20 хвилин, нагрівали до температури кипіння із зворотним холодильником в атмосфері азоту протягом 4 годин, охолоджували до 0°С і обробляли розчином 2метилсульфанілетіламіну (0,145 г, 1,6 ммоль) в дихлоретані (1 мл). Реакційну суміш перемішували протягом 5 хвилин до додавання розчину 4-N,N-диметиламінопіридину (0,222 г, 1,8 ммоль) в дихлоретані (2 мл), з подальшим видаленням крижаної бані через 15 хвилин. Отриману реакційну суміш перемішували при кімнатній температурі протягом 20 хвилин, нагрівали до температури кипіння із зворотним холодильником в атмосфері азоту протягом 14 годин, охолоджували, концентрували при зниженому тиску і очищали за допомогою оберненофазної високоефективної рідинної хроматографії, щоб отримати вказану в заголовку сполуку у 1 вигляді коричневої склоподібної речовини (0,051 г, 10%): H ЯМР (400 МГц, ДМСО-d6) 9,22 (т, J=5,3 Гц, 1H), 8,98 (с, 1H), 8,72 (д, J=2,8 Гц, 1H), 8,26 (дт, J=9,4, 2,3 Гц, 1H), 3,88 (с, 3H), 3,83+ 3,78 (м, 2H), 2,77 (т, J=7,3 Гц, 2H), 2,14 (с, 3H); ЕСІМС m/z 344 ([M+H] ). Сполуки 95 була отримана, як описано в прикладі 18. Приклад 19: Отримання 1-[5-(5-фторпіридин-3-іл)-[1,3,4]тіадіазол-2-іл]-1-метил-3-(2метилсульфанілетил)-сечовини - (Сполука 79) Суспензію метил-[5-(5-фторпіридин-3-іл)-[1,3,4]тіадіазол-2-іл]-аміну (0,2 г, 0,9 ммоль) в крижаному дихлоретані (3 мл) обробляли 20% розчином фосгену в толуолі (0,52 мл, 1 ммоль) і перемішували протягом 10 хвилин до додавання розчину 4-N,N-диметиламінопіридину (0,256 г, 2,1 ммоль) в дихлоретані (2 мл). Охолоджуючу баню прибирали після 10 хвилин. Реакційну суміш перемішували при кімнатній температурі протягом 30 хвилин, нагрівали до температури кипіння із зворотним холодильником в атмосфері азоту протягом 2 годин, охолоджували до 1°С і обробляли за допомогою піпетки по краплях розчином 2-метилсульфанілетіламіну (91 мг, 1 ммоль) в дихлоретані (3 мл). Крижану баню прибирали після 10 хвилин і після перемішування протягом 30 хвилин при кімнатній температурі, реакційну суміш нагрівали до температури кипіння із зворотним холодильником в атмосфері азоту протягом 3 годин, охолоджували і розбавляли дихлоретаном (30 мл). Отриману реакційну суміш промивали розбавленою хлористоводневої кислотою (0,1 Н, 2 × 15 мл), насиченим водним бікарбонатом натрію (30 мл), насиченим концентрованим сольовим розчином (20 мл), а потім висушували над MgSO 4 і піддавали хроматографії з силікагелем, щоб отримати вказану в заголовку сполуку у вигляді 1 білої твердої речовини (0,26 г, 84%): тп 100-104°С; H ЯМР (400 МГц, CDCl3) 8,88 (с, 1H), 8,55 (д, J=2,8 Гц, 1H), 8,02 (ддд, J=8,9, 2,7, 1,7 Гц, 1H), 6,92 (ушир., 1H), 3,71 (с, 3H), 3,65-3,59 (м, 2H), + 2,76 (т, J=6,6 Гц, 2H), 2,16 (с, 3H); ЕСІМС m/z 328 ([M+H] ). Приклад 20: Отримання 1-[5-(5-фторпіридин-3-іл)-[1,3,4]тіадіазол-2-іл]-1,3-диметил-3-(2метилсульфанілетил)-сечовини (Сполука 83) 15 UA 112761 C2 5 10 15 20 25 30 35 40 Крижаний розчин 1-[5-(5-фторпіридин-3-іл)-[1,3,4]тіадіазол-2-іл]-1-метил-3-(2метилсульфанілетил)-сечовини (0,132 г, 0,4 ммоль) в N,N-діетилформаміді (0,6 мл) обробляли гідридом натрію (60% в мінеральному маслі, 0,018 г, 0,4 ммоль) і перемішували протягом 5 хвилин до додавання розчину йодометану (0,063 г, 0,4 ммоль) в N,N-диметилформаміді (0,1 мл). Крижану баню прибирали після 5 хвилин. Реакційну суміш перемішували при кімнатній температурі протягом 14 годин, розбавляли водою (30 мл) і екстрагували етилацетатом (3×20 мл). Об'єднані органічні екстракти промивали насиченим концентрованим сольовим розчином (20 мл), висушували над MgSO4, очищали за допомогою нормальної і обернено-фазної хроматографії, щоб отримати вказану в заголовку сполуку у вигляді безбарвної смоли (0,027 г, -1 1 20%): ІЧ (KBr тонка плівка) 1658 см ; H ЯМР (400 МГц, CDCl3) 8,87 (с, 1H), 8,53 (д, J=3,2 Гц, 1H), 8,02 (ддд, J=9,1, 4,5, 1,7 Гц, 1H), 3,66 (с, 3H), 3,59 (т, J=6,8 Гц, 2H), 3,06 (с, 3H), 2,78 (т, J=7,1 Гц, 2H), 2,14 (с, 3H); ЕСІМС m/z 342 [M+Н]+). Приклад 21: Синтез N-метил-4-оксо-N-[5-(3-піридил)-1,3,4-тіадіазол-2-іл]пентаміду (Сполука 49) 4-оксопентаноїлхлорид (0,378 г, 2,8 ммоль) додавали до суспензії N-метил-5-(3-піридил)1,3,4-тіадіазол-2-аміну (0,3 г, 1,6 ммоль) і 4-N,N-диметиламінопіридину (0,229 г, 1,9 ммоль) в дихлоретані (5 мл), перемішували в атмосфері азоту при кімнатній температурі протягом 30 хвилин, нагрівали до температури кипіння із зворотним холодильником протягом 14 годин, охолоджували, розбавляли дихлоретаном (50 мл) і промивали насиченим водним бікарбонатом натрію (70 мл). Водний шар екстрагували дихлоретаном (30 мл), і об'єднані органічні шари висушували над MgSO4, адсорбували на силікагелі, використовували колонку Michel-Miller і елюювали сумішшю 9:1 етилацетат/гексан. Найбільшу фракцію збирали і перекристалізовували з етилацетату/гексану, щоб отримати жовті голчаті кристали. Вихід 0,21 г (46%): тп 146-147°С; -1 1 , ІЧ (KBr, тонка плівка) 1701, 1659 см ; H ЯМР (400 МГц CDCl3) 9,13 (д, J=1,8 Гц, 1H), 8,69 (дд, J=4,8, 1,5 Гц, 1H), 8,28 (дт, J=6,2, 1,9 Гц, 1H), 7,42 (дд, J=8,0, 5,1 Гц, 1H), 3,90 (с, 3H), 2,96 + (ушир., 4H), 2,29 (с, 3H); ЕСІМС m/z 291 ([M+H] ). Приклад 22: Отримання 3-(ціаноамін)-N-метил-N-[5-(3-піридил)-1,3,4-тіадіазол-2іл]пропанаміду (Сполука 23) Ціанамід (42 мг, 1,0 ммоль) і N-метил-3-метилсульфаніл-N-[5-(3-піридил)-1,3,4-тіадіазол-2іл]пропанамід (294 мг, 1,0 ммоль) суспендували в ТГФ і охолоджували в бані при -10°C. Додавали діацетат йодобензолу (322 мг, 1,0 ммоль) і отриману суспензію перемішували протягом 4 год. Реакційну суміш концентрували при зниженому тиску і очищали оберненофазною хроматографією з силікагелем, елююючи рухомою фазою водного ацетонітрилу, з 1 отриманням білої твердої речовини (84 мг, 29%): тп 155-159°С; H ЯМР (300 МГц, CDCl3) 9,15 (м, 1H), 8,72 (м, 1H), 8,35 (м, 1H), 7,45 (м, 1H), 4,70 (ушир., 1H), 3,90 (с, 3H), 3,55 (м, 2H), 3,05 (м, + 2H); ЕСІМС m/z 289 ([M+H] ). Приклад 23: Отримання метил-(5-піридин-3-іл-[1,3,4] тіадіазол-2-іл)-аміду 4-[(Е)метоксііміно]пентанової кислоти (Сполука 48) 16 UA 112761 C2 5 10 15 20 25 30 35 40 Метил-(5-піридин-3-іл-[1,3,4]тіадіазол-2-іл)-амід 4-[(Е)-метоксііміно]пентанової кислоти був отриманий, як описано в Keana et al. in J. Org. Chem., 1985, 50, 2346. Суспензію гідрохлориду Ометилгідроксіламіну (0,065 г, 0,9 ммоль), метил-(5-піридин-3-іл-[1,3,4]тіадіазол-2-іл)аміду 4оксопентанової кислоти (0,18 г, 0,6 ммоль) і ацетату натрію (0,076 г, 0,9 ммоль) в безводному етанолі нагрівали до температури кипіння із зворотним холодильником в атмосфері азоту протягом 14 годин, охолоджували, концентрували при зниженому тиску і хроматографували на силікагелі, щоб отримати вказану в заголовку сполуку у вигляді аморфної жовтої речовини 1 (0,071 г, 36%): тп 114-121°С; H ЯМР (400 МГц, CDCl3) 9,15 (д, J=1,8 Гц, 1H), 8,70 (дд, J=4,8, 1,8 Гц, 1H), 8,29 (дт, J=5,9, 1,8 Гц, 1H), 7,43 (дд, J=7,7, 5,2 Гц, 1H), 3,92 (с, 3H), 3,86, 3,83 і 3,77 (всі с, 1H), 2,95 (кв, J=7,0 Гц, 2H), 2,71 (кв, J=7,4 Гц, 2H), 2,11, 1,98 і 1,89 (всі с, 3H); ЕСІМС m/z 320 [M+Н]+). Приклад 24: Отримання (Е)-N-метил-3-(метилтіо)-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2іл)акриламіду (Сполука 21) N-хлорсукцинімід (100 мг, 0,75 ммоль, 1,1 еквівалента) додавали до переміщуваного розчину N-метил-3-(метилтіо)-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2-іл)пропанаміду (200 мг, 0,68 ммоль, 1,0 еквівалент) в бензолі (3,3 мл) при 23°С. Отриманий каламутно жовтий розчин перемішували при 23°С протягом 30 хвилин. Додавали триетіламін (210 мкл, 1,5 ммоль, 2,2 еквівалента) і отриману світло-жовту суміш перемішували при 23°С протягом 24 год. Реакційну суміш відразу ж піддавали колонковій хроматографїі з силікагелем(етилацетат), щоб отримати 1 вказану в заголовку сполуку у вигляді жовтувато коричневого порошку (80 мг, 40%): H ЯМР (300 МГц, ДМСО-d6) 9,14 (ушир. с, IH), 8,67 (м, 1H), 8,27 (м, 1H), 8,11 (д, J=14 Гц, 1H), 7,41 (м, + 1H), 6,30 (д, J=14 Гц, 1H), 3,91 (с, 3H), 2,46 (с, 3H); ЕСІМС m/z 293 ([M+H] ). Приклад 25: Отримання N-метил-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2-іл)-3-(тритилтіо) пропанаміду (Сполука 22) Оксалілхлорид (380 мкл, 4,3 ммоль, 1,5 еквівалента) і N-диметилформамід (11 мкл, 0,14 ммоль, 0,05 еквівалента) були послідовно додані до перемішуваної суспензії 3(тритилтіо)пропанової кислоти (1,0 г, 2,9 ммоль, 1,0 еквівалент) в толуолі (10 мл) при 23°С. Отриману пінисту білу суспензію перемішували при 23°С протягом 17 год. Реакційну суміш концентрували роторним випаровуванням. Частину отриманого продукту реакції, 3(тритилтіо)пропаноїлхлориду (400 мг, 1,1 ммоль, 1,1 еквівалента), додавали до перемішуваної суспензії N-метил-5-(піридин-3-іл)-1,3,4-тіадіазол-2-аміну (190 мг, 1,0 ммоль, 1,0 еквівалент) і 4диметиламінопіридину (150 мг, 1,2 ммоль, 1,2 еквівалента) в дихлорметані (3,0 мл) при 23°С. Отриманий жовтий розчин перемішували при 23°С протягом 15 год. Реакційну суміш розбавляли насиченим розчином бікарбонату натрію (40 мл) і екстрагували етилацетатом (3×30 мл). Об'єднані органічні шари висушували (Na2SO4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Отриманий залишок очищали колонковою хроматографією з силікагелем (етилацетат), щоб отримати вказану в заголовку сполуку у 17 UA 112761 C2 5 10 15 20 25 30 35 40 вигляді білої піни (450 мг, 87%): тп 60-75°С; ІЧ (KBr тонка плівка) 3438 (w), 3024 (w), 2909 (w), -1 1 2742 (w), 2649 (w), 2565 (w), 1701 (s) см ; H ЯМР (300 МГц, CDCl3) 9,12 (д, J=2 Гц, 1H), 8,67 (дд, J=5, 2 Гц, 1H), 8,25 (дт, J=8, 2 Гц, 1H), 7,18-7,50 (м, 16H), 3,58 (с, 3H), 2,73 (т, J=7 Гц, 2H), + 2,34 (т, J=7 Гц, 2H); ЕСІМС m/z 523 ([M+H] ). Приклад 26: Отримання 3-меркапто-N-метил-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2іл)пропанаміду (Сполука 25) Триетилсилан (76 мкл, 0,48 ммоль, 5,0 еквівалентів) і трифтороцтову кислоту (710 мкл, 5,7 ммоль, 100 еквівалентів) почергово додавали до перемішуваного розчину N-метил-N-(5(піридин-3-іл)-1,3,4-тіадіазол-2-іл)-3-(тритилтіо)пропанаміду (50 мг, 0,096 ммоль, 1,0 еквівалент) в дихлорметані (1,3 мл) при 23°С. Отриманий розчин перемішували при 23°С протягом 30 хвилин. Реакційну суміш розбавляли насиченим розчином бікарбонату натрію (40 мл) і екстрагували етилацетатом (3×30 мл). Об'єднані органічні шари висушували (Na 2SO4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Тверду речовину очищали колонковою хроматографією з силікагелем (етилацетат), щоб отримати 1 вказану в заголовку сполуку у вигляді білого порошку (23 мг, 85%): тп 149-151°С; H ЯМР (300 МГц, CDCl3) 9,17 (ушир. с, 1H), 8,71 (м, 1H), 8,29 (м, 1H), 7,44 (дд, J=8, 5 Гц, 1H), 3,87 (с, 3H), + 2,91-3,10 (м, 4H), 1,87 (т, J=8 Гц, 1H); ЕСІМС m/z 281 ([M+H] ). Приклад 27: Отримання S-3-(метил(5-(піридин-3-іл)-1,3,4-тіадіазол-2-іл)аміно)-3оксопропілетантіолату (Сполука 26) Триетиламін (12 мкл, 0,086 ммоль, 1,2 еквівалента) і ацетилхлорид (6 мкл, 0,08 ммоль, 1 еквівалент) почергово додавали до перемішуваного розчину 3-меркапто-N-метил-N-(5-(піридин3-іла)-1,3,4-тіадіазол-2-іл)пропанаміду (20 мг, 0,071 ммоль, 1,0 еквівалент) в 1,2-дихлоретані (1,4 мл) при 23°С. Отриманий блідо-жовтий розчин перемішували при 23°С протягом 16 год. Реакційну суміш відразу ж піддавали колонковій хроматографїі з силікагелем (етилацетат), щоб отримати вказану в заголовку сполуку у вигляді білого порошку (23 мг, 99%): тп 133-135°С; 1Н ЯМР (300 МГц, CDCl3) 9,14 (д, J=2 Гц, 1H), 8,69 (дд, J=5, 2 Гц, 1H), 8,27 (дт, J=8, 2 Гц, 1H), 7,42 (дд, J=8, 5 Гц, 1H), 3,82 (с, 3H), 3,26 (т, J=7 Гц, 2H), 3,03 (т, J=7 Гц, 2H), 2,36 (с, 3H); ЕСІМС m/z + 323 ([M+H] ). Приклад 28: Отримання N-метил-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2-іл)-3(трифторметилтіо) пропанаміду (Сполука 27) 2M розчин гідроксиду натрію (40 мкл, 0,078 ммоль, 1,1 еквівалента) додавали до перемішуваної суспензії 3-меркапто-N-метил-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2-іл)пропанаміду (20 мг, 0,071 ммоль, 1,0 еквівалент) в ацетонітрилі (2,1 мл) при 23°С. Газоподібний трифторметилйодид барботували через отриманий розчин на постійній швидкості протягом 5 хвилин. Скляну реакційну посудину щільно закривали, і отриманий каламутний блідо-жовтий розчин опромінювали лампою сонячного світла Sylvania на відстані ~6 дюймів протягом 2 год. Реакційну суміш розбавляли водою (20 мл) і екстрагували етилацетатом (3×20 мл). Об'єднані 18 UA 112761 C2 5 10 15 20 25 30 35 40 органічні шари висушували (MgSO4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Отриманий залишок очищали колонковою хроматографією з 1 силікагелем (етилацетат), щоб отримати жовту плівку (6 мг, 24% вихід): H ЯМР (300 МГц, CDCl3) 9,15 (д, J=2 Гц, 1H), 8,70 (дд, J=5, 2 Гц, 1H), 8,28 (дт, J=8, 2 Гц, 1H), 7,43 (дд, 1H, J=8, 5 + Гц, 1H), 3,86 (с, 3H), 3,30 (т, J=7 Гц, 2H), 3,16 (т, J=7 Гц, 2H); ЕСІМС m/z 349 ([M+H] ). Приклад 29: Отримання N-2,2-триметил-3-(метил-N-ціано-сульфілімініл)-N-(5-(піридин-3-іл)1,3,4-тіадіазол-2-іл)пропанамід (Сполука 39) Цианамід (8 мг, 0,19 ммоль, 1,2 еквівалента) і йодобензолдіацетат (55 мг, 0,17 ммоль, 1,1 еквівалента) почергово додавали до перемішуваного розчину N, 2,2-триметил-3-(метилтіо)-N-(5(піридин-3-іл)-1,3,4-тіадіазол-2-іл)пропанаміду (50 мг, 0,16 ммоль, 1,0 еквівалент) в 1,4-діоксані (2,0 мл) при 23°С. Отриманий розчин перемішували при 23°С протягом 3 год. Реакційну суміш розбавляли насиченим розчином бікарбонату натрію (40 мл) і екстрагували дихлорметаном (3×30 мл). Об'єднані органічні шари висушували (Na 2SO4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Отриманий залишок розчиняли в ацетонітрилі (30 мл) і промивали гексаном (5×20 мл). Ацетонітрильний шар концентрували роторним випаровуванням, щоб отримати вказану в заголовку сполуку у вигляді білої піни (56 -1 мг, 99%): тп 42-52°С; ІЧ (KBr тонка плівка) 2994 (w), 2143 (s), 1638 (m) см ; 1Н ЯМР (300 МГц, J CDCl3) 9,13 (д, =2 Гц, 1H), 8,72 (дд, J=5, 2 Гц, 1H), 8,31 (дт, J=8, 2 Гц, 1H), 7,44 (дд, J=8, 5 Гц, 1H), 4,00 (с, 3H), 3,59 (д, J=13 Гц, 1H), 3,24 (д, J=13 Гц, 1H), 3,09 (с, 3H), 1,88 (с, 3H), 1,66 (с, 3H); + ЕСІМС m/z 363 ([M+H] ). Приклад 30: Отримання 2-(амінометил)-N-[5-(5-фтор-3-піридил)-1,3,4-тіадіазол-2-іл]-N, 2диметил-3-метилсульфаніїл-пропанаміду (Сполука 89) Суспензію 2-ціано-N-[5-(5-фтор-3-піридил)-1,3,4-тіадіазол-2-іл]-N, 2-диметил-3метилсульфанілпропанаміду (157 мг, 0,4 ммоль) і оксиду платини (131 мг, 0,6 ммоль) в «крижаній» оцтовій кислоті (8 мл) відновлювали у водні при 45 psi при кімнатній температурі протягом 16 годин, фільтрували через целіт і концентрували при зниженому тиску. Тверду речовину обробляли насиченим водним бікарбонатом натрію (30 мл) і екстрагували етилацетатом (3×50 мл). Органічні екстракти концентрували при зниженому тиску і очищали обернено-фазною хроматографією з силікагелем, елююючи рухомою фазою водного -1 1 ацетоїтрилу. Вихід 33 мг (21%): тп 154-157°С; ІЧ (KBr тонка плівка) 1656, 1383 см ; H ЯМР (400 МГц, CDCl3) 11,17 (ушир., 1H), 9,02 (т, J=1,6 Гц, 1H), 8,43 (д, J=2,8 Гц, 1H), 8,11 (ддд, J=9,8, 2,8, 1,8 Гц, 1H), 3,87 (д, J=2,9 Гц 1H), 3,48 (с, 3H), 3,47 (д, J=2,9 Гц, 1H), 2,99 (д, J=12,7 Гц, 1H), 2,78 + (д, J=13,6 Гц, 1H), 2,20 (с, 3H), 1,41 (с, 3H); ЕСІМС (m/z) 356 [M+Н] . Приклад 31: Отримання 3-аміно-N-метил-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2-іл)пропанаміду (Сполука 41) Триетилсилан (530 мкл, 3,3 ммоль, 5,0 еквівалентів) і трифтороцтову кислоту (4,9 мл, 66 ммоль, 100 еквівалентів) почергово додавали до перемішуваного розчину трет-бутил-3(метил(5-(піридин-3-іл)-1,3,4-тіадіазол-2-іл)аміно)-3-оксопропілкарбамату (240 мг, 0,66 ммоль, 1,0 еквівалент) в дихлорметані (8,8 мл) при 23°С. Отриманий безбарвний розчин перемішували 19 UA 112761 C2 5 10 15 20 25 30 35 40 при 23°С протягом 30 хвилин. Отриману реакційну суміш концентрували роторним випаровуванням. Сухий залишок розбавляли насиченим розчином бікарбонату натрію (80 мл) і екстрагували дихлорметаном (8×50 мл). Об'єднані органічні шари висушували (Na2SО4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням, щоб отримати вказану в заголовку сполуку у вигляді жовтувато-коричневого порошку (86 мг, 49%): тп -1 110-112°С; ІЧ (KBr тонка плівка) 3047 (w), 2926 (w), 1682 (s), 1591 (m) см ; 1Н ЯМР (300 МГц, CDCl3) 9,15 (д, J=2 Гц, 1H), 8,69 (дд, J=5, 2 Гц, 1H), 8,28 (дт, J=8, 2 Гц, 1H), 7.43 (дд, J=8, 5 Гц, + 1H), 3,86 (с, 3H), 3,17 (м, 2H), 2,86 (т, J=6 Гц, 2H); ЕСІМС m/z 264 ([M+H] ). Приклад 32: Отримання N-2,2-триметил-3-(метил-N-ціано-сульфонімініл)-N-(5-(піридин-3-іл)1,3,4-тіадіазол-2-іл)пропанаміду (Сполука 42) Розчин N, 2,2-триметил-3-(метилN-ціаносульфілімініл)-N-(5-(піридин-3-іл)-1,3,4-тіадіазол-2іл)пропанаміду (100 мг, 0,29 ммоль, 1,0 еквівалент) в абсолютному етанолі (2,0 мл) додавали до переміщуваної суспензії порошкоподібного карбонату калію (87 мг, 0,63 ммоль, 2,2 еквівалента) і мета-хлорпероксибензойної кислоти (73 мг, 0,32 ммоль, 1,1 еквівалента) у воді (1,0 мл) при 23°С. Отриманий жовтий розчин перемішували при 23°С протягом 1 год. Отриману реакційну суміш розбавляли насиченим розчином бікарбонату натрію (40 мл) і екстрагували дихлорметаном (3×30 мл). Об'єднані органічні шари висушували (Na 2SO4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Отриманий залишок очищали колонковою хроматографією з використанням силікагелю (етилацетат), щоб отримати вказану в заголовку сполуку у вигляді білої піни (36 мг, 33%): ІЧ (KBr тонка плівка) 2992 (w), 2926 -1 1 (w), 2192 (s), 1649 (s) см ; H ЯМР (300 МГц, CDCl3) 9,12 (ушир. с, 1H), 8,70 (дд, J=5 Гц, 1H), 8,29 (дт, J=8, 2 Гц, 1H), 7,43 (дд, J=8, 5 Гц, 1H), 4,21 (д, J=14 Гц, 1H), 3,97 (с, 3H), 3,68 (д, J=14 + Гц, 1H), 3,53 (с, 3H), 1,92 (s, 3H), 1,63 (с, 3H); ЕСІМС m/z 379 ([M+H] ). Приклад 33: Отримання 2-(метилтіометил)-3-фенілпропанової кислоти Отримання діетил-2-бензил-2-(метилтіометил)малонату - Хлорметилметилсульфід (1,4 мл, 17 ммоль, 1,0 еквівалент) і 60% гідрид натрію в мінеральному маслі (750 мг, 19 ммоль, 1,1 еквівалента) почергово додавали до перемішуваного розчину діетил-2-бензилмалонату (4,0 мл, 17 ммоль, 1,0 еквівалент) в N-диметилформаміді (34 мл) при 0°С. Отриману суміш нагрівали до 23°С і перемішували протягом 18 год. Реакційну суміш концентрували у вакуумі. Отриманий залишок розбавляли водою (150 мл) і екстрагували діетиловим ефіром (4×70 мл). Об'єднані органічні шари висушували (MgSO4), піддавали безнапірному фільтруванню і концентрували 1 роторним випаровуванням, щоб отримати жовту маслянисту рідину (5,3 г, 99%): H ЯМР (300 МГц, CDCl3) 7,13-7,30 (м, 5H), 4,22 (кв, J=7 Гц, 4H), 3,36 (с, 2H), 2,94 (с, 2H), 2,11 (с, 3H), 1,27 (т, J=7 Гц, 6H). Отримання 2-бензил-2-(метилтіометил)малонової кислоти - Порошкоподібний гідроксид калію (4,8 г, 86 ммоль, 5,0 еквівалентів) додавали до перемішуваного розчину діетил-2-бензил2-(метилтіометил)малонату (5,3 г, 17 ммоль, 1,0 еквівалент) в 3:1 суміші метанол:вода (28 мл) при 23°С. Отриману блідо-жовту суспензію нагрівали до 100°С і перемішували протягом 4 год. 20 UA 112761 C2 5 10 15 20 25 30 35 Охолоджену реакційну суміш підкислювали до pH≈9 концентрованою хлористоводневої кислотою і промивали діетиловим ефіром (4×50 мл). Водний шар підкислювали до pH≈1 концентрованою хлористоводневою кислотою і екстрагували дихлорметаном (4×60 мл). Об'єднані органічні шари висушували (Na2SO4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням, щоб отримати вказану в заголовку сполуку у вигляді 1 білого порошку (3,1 г, 72%): H ЯМР (300 МГц, ДМСО-d6) 7,13-7,34 (м, 5H), 3,15 (с, 2H), 2,73 (с, 2H), 2,08 (с, 3H). Отримання 2-(метилтіометил)-3-фенілпропанової кислоти 2-бензил-2(метилтіометил)малонову кислоту (3,1 г, 12 ммоль, 1,0 еквівалент) вміщували в 50 мл круглодонну колбу і нагрівали до 170°С за допомогою колбонагрівача. Отриману рідину акуратно нагрівали протягом 1 год, доки бурління не припинялося. Отриманий залишок охолоджували, щоб отримати вказану в заголовку сполуку у вигляді сірувато-білого порошку 1 (2,6 г, 99%): H ЯМР (300 МГц, ДМСО-d6) 12,36 (ушир. с, 1H), 7,16-7,33 (м, 5H), 2,74-2,88 (м, 3H), 2,52-2,69 (м, 2H), 2,04 (с, 3H). Приклад 34: Отримання 1-(метилтіометил)циклопропанкарбоксильної кислоти Отримання етил-1-(гідроксиметил)циклопропанкарбоксилату - 1M розчин три-третбутоксигідриду літію-алюмінію в тетрагідрофурані (12 мл, 12 ммоль, 2,2 еквівалента) додавали до перемішуваного розчину діетилциклопропану-1,1'-дикарбоксилату (1,0 мл, 5,7 ммоль, 1,0 еквівалент) в тетрагідрофурані (19 мл) при 23°С. Отриманий розчин нагрівали до 65°С і перемішували протягом 24 год. Охолоджену реакційну суміш розбавляли за допомогою 10% розчину бісульфату натрію (100 мл) і екстрагували етилацетатом (4×50 мл). Об'єднані органічні шари висушували (MgSO 4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням, щоб отримати вказану в заголовку сполуку у вигляді блідо-жовтої маслянистої 1 рідини (850 мг, 88%): H ЯМР (300 МГц, CDCl3) 4,16 (кв, J=7 Гц, 2H), 3,62 (с, 2H), 2,60 (ушир. с, 1H), 1,22-1,30 (м, 5H), 0,87 (дд, J=7, 4 Гц, 2H). Отримання етил 1-((метилсульфонілокси)метил)циклопропанкарбоксилату Триетиламін (990 мкл, 7,1 ммоль, 1,2 еквіваленти) і метансульфонілхлорид (500 мкл, 6,5 ммоль, 1,1 еквівалента) почергово додавали до перемішуваного розчину етил-1(гідроксиметил)циклопропанкарбоксилату (840 мг, 5,7 ммоль, 1,0 еквівалент) в дихлорметані (15 мл) при 23°С. Отриманий світло-жовтий розчин перемішували при 23°С протягом 20 год. Реакційну суміш розбавляли водою (100 мл) і екстрагували дихлорметаном (3×50 мл). Об'єднані органічні шари висушували (MgSO 4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням, щоб отримати вказану в заголовку сполуку у вигляді 1 коричневої маслянистої рідини (1,1 г, 85%): H ЯМР (300 МГц, CDCl3) 4,33 (с, 2H), 4,16 (кв, J=7 Гц, 2H), 3,08 (с, 3H), 1,43 (дд, J=7, 4 Гц, 2H), 1,26 (т, J=7 Гц, 3H), 1,04 (дд, J=7, 4 Гц, 2H). 21 UA 112761 C2 5 10 15 20 25 30 35 Отримання етил-1-(метилтіометил)циклопропанкарбоксилату - Метантіолат натрію (700 мг, 9,9 ммоль, 2,0 еквівалента) додавали до перемішуваного розчину етил-1((метилсульфонілокси)метил)циклопропанкарбоксилату (1,1 г, 4,9 ммоль, 1,0 еквівалент) в N,Nдиметилформаміді (10 мл) при 23°С. Отриману коричневу суспензію перемішували при 23°С протягом 18 год. Реакційну суміш розбавляли водою (500 мл) і екстрагували діетиловим ефіром (4×100 мл). Об'єднані органічні шари висушували (MgSO 4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням, щоб отримати вказану в заголовку 1 сполуку у вигляді коричневої маслянистої рідини (860 мг, 99%): H ЯМР (300 МГц, CDCl3) 4,14 (кв, J=7 Гц, 2H), 2,83 (с, 2H), 2,16 (с, 3H), 1,31 (дд, J=7, 4 Гц, 2H), 1,25 (т, J=7 Гц, 3H), 0,89 (дд, J=7, 4 Гц, 2H). Отримання 1-(метилтіометил)циклопропанкарбонової кислоти - 50% розчин гідроксиду натрію (2,0 мл, 38 ммоль, 7,8 еквівалента) додавали до перемішуваного розчину етил 1(метилтіометил)циклопропанкарбоксилату (860 мг, 4,9 ммоль, 1,0 еквівалент) в абсолютному етанолі (10 мл) при 23°С. Отриманий розчин перемішували при 23°С протягом 20 год. Реакційну суміш розбавляли 0,5 M розчином гідроксиду натрію (100 мл) і промивали дихлорметаном (3×100 мл). Водний шар підкислювали до pH≈1 концентрованою хлористоводневою кислотою і екстрагували дихлорметаном (4×100 мл). Об'єднані органічні шари висушували (Na 2SO4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням, щоб 1 отримати світло-коричневу маслянисту рідину (420 мг, 58%): H ЯМР (300 МГц, CDCl3) 2,82 (с, 2H), 2,17 (с, 3H), 1,41 (дд, J=7, 4 Гц, 2H), 0,99 (дд, J=7, 4 Гц, 2H). 2-етил-2-[(метилтіо)метил]бутанову кислоту отримували, як описано в прикладі 34. Приклад 35: Отримання 2-метил-3-(метилтіо)пропанової кислоти Порошокоподібний гідроксид калію (1,0 г, 18 ммоль, 2,2 еквівалента) і йодометан (570 мкл, 9,2 ммоль, 1,1 еквівалента) почергово додавали до перемішуваного розчину 3-меркапто-2метилпропанової кислоти (1,0 г, 8,3 ммоль, 1,0 еквівалент) в метанолі (3,7 мл) при 23°С. Отриману білу суспензію нагрівали до 65°С і перемішували протягом 2 год. Охолоджену реакційну суміш розбавляли 1 M розчином хлористоводневої кислоти (50 мл) і екстрагували етилацетатом (2×50 мл). Об'єднані органічні шари висушували (Na2SO4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням, щоб отримати вказану 1 в заголовку сполуку у вигляді жовтої маслянистої рідини (1,0 г, 91%): H ЯМР (300 МГц, CDCl3) 2,70-2,89 (м, 2H), 2,57 (дд, J=12, 6 Гц, 1H), 2,13 (с, 3H), 1,30 (д, J=7 Гц, 3H). Приклад 36: Отримання 2,2-диметил-3-(метилтіо)пропанової кислоти 22 UA 112761 C2 5 10 15 20 25 Метантіолат натрію (1,0 г, 14 ммоль, 2,0 еквівалента) додавали до перемішуваного розчину 3-хлор-2,2-диметилпропанової кислоти (1,0 г, 7,2 ммоль, 1,0 еквівалент) в N-диметилформаміді (3,7 мл) при 0°С. Отриманій коричневій суспензії давали нагрітися до 23°С і перемішували протягом 24 год. Реакційну суміш розбавляли насиченим розчином бікарбонату натрію (300 мл) і промивали діетиловим ефіром (3×75 мл). Водний шар підкислювали до pH≈1 концентрованою хлористоводневої кислотою і екстрагували діетиловим ефіром (3×75 мл). Об'єднані органічні шари висушували (Na2SO4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням, щоб отримати вказану в заголовку сполуку у вигляді безбарвної маслянистої 1 рідини (1,2 г, 99%): H ЯМР (300 МГц, CDCl3) 2,76 (с, 2H), 2,16 (с, 3H), 1,30 (с, 6H). Приклад 37: Отримання 3-(тритилтіо)пропанової кислоти Трифенілметилхлорид (2,7 г, 9,5 ммоль, 1,0 еквівалент) додавали до перемішуваного розчину 3-тіопропанової кислоти (1,0 г, 9,5 ммоль, 1,0 еквівалент) в N,N-диметилформаміді (15 мл) при 23°С. Отриманий безбарвний розчин перемішували при 23°С протягом 17 год. Реакційну суміш розбавляли водою (300 мл) і екстрагували діетиловим ефіром (4×150 мл). Об'єднані органічні шари розбавляли дихлорметаном (100 мл) і метанолом (100 мл) для того, щоб розчинити всі тверді частинки, висушували (MgSO 4), піддавали безнапірному фільтруванню і концентрували роторним випаровуванням. Отриманий залишок промивали дихлорметаном і фільтрували у вакуумі, щоб отримати вказану в заголовку сполуку у вигляді білих кристалів (2,9 г, 88%): тп 205-208°С; ІЧ (KBr тонка плівка) 3438 (w), 3024 (w), 2909 (w), 2742 (w), 2649 (w), 2565 -1 1 (w), 1701 (s) см ; H ЯМР (300 МГц, ДМСО-d6) 12,24 (ушир. с, 1H), 7,20-7,40 (м, 15H), 2,28 (т, J=7 Гц, 2H), 2,16 (т, J=7 Гц, 2H); ЕСІМС m/z 347 ([M-H] ). Приклад 38: Отримання 3-(трет-бутилдиметилсиланілокси)-2,2-диметилпропіонової кислоти 30 3-(трет-бутилдиметилсиланілокси)-2,2-диметилпропіонову кислоту можна отримати з 3гідрокси-2,2-диметилпропанової кислоти, як описано в Bioorganic & Medicinal Chemistry Letters. 2004,14(12), 3231. Приклад 39: Отримання 3-{[2,2-диметил-3-(метилтіо)пропаноїл]окси}-2,2-диметилпропанової кислоти 35 3-{[2,2-диметил-3-(метилтіо)пропаноїл]окси}-2,2-диметилпропанова кислота була отримана з 3-гідрокси-2,2-диметилпропанової кислоти, як описано в Goel, et al. опублікованій патентній заявці США 2005/101572 A1. Приклад 40: Отримання 4-оксопентаноїлхлориду 23 UA 112761 C2 5 10 15 20 25 30 35 40 45 4-оксопентаноїлхлорид отримували з 4-оксопентанової кислоти, як описано в Tanaka et al. Biochim Biophys Acta, 1993, 1166, 264. Необхідний продукт реакції був виділений у вигляді 1 жовтої рідини з 92% виходом: H ЯМР (300 МГц, CDCl3) 3,00-2,92 (м, 1H), 2,77-2,71 (м, 1H), + 2,66-2,59 (м, 1H), 2,46-2,39 (м, 1H), 2,07 (с, 3H); ЕИМС m/z 131 ([M+H] ). Приклад 41: Отримання етил 2-ціано-2-метил-3-метилсульфанілпропаноату n-Бутиллітій (24,2 мл, 60 ммоль, 2,5 M розчин в гексані) додавали до розчину ізопропіламіну (8,1 мл, 58 ммоль) в сухому ефірі (70 мл) в атмосфері азоту при швидкості, яка потрібна, щоб встановити температуру нижчу ніж -60°C. По завершенні, реакційній суміші давали нагрітися до 10°С, наново охолоджували до -78°С перед додаванням етил-2-ціанопропаноату (7 г, 55 ммоль). Після перемішування при -78°С протягом 90 хвилин додавали хлорметилсульфід (4,61 мл, 55 ммоль) і суміш нагрівали до кімнатної температури протягом 14 годин, розбавляли ефіром (350 мл), промивали водою (100 мл), концентрованим сольовим розчином (100 мл), висушували над MgSO4, концентрували при зниженому тиску і очищали перегонкою при 0,04 мм -1 1 рт. ст. Отримували жовту рідину 3,95 м. (38%): тк 145°С; ІЧ (KBr тонка плівка) 1751 см ; H ЯМР (400 МГц, CDCl3) 4,30 (кв, J=7,1 Гц, 2H), 3,08 (д, J=13,9 Гц, 1H), 2,91 (д, J=13,9 Гц, 1H), 2,30 (с, 3H), 1,67 (с, 3H), 1,35 (т, J=7,4 Гц, 3H); ЕІМС m/z 187. Приклад 42: Отримання 2-ціано-2-метил-3-метилсульфаніл-пропанової кислоти Етил 2-ціано-2-метил-3-метилсульфанілпропаноат (2,3 г, 12,3 ммоль) додавали в крижаний гідроксид натрію (5 мл, 2 Н) при перемішуванні. Додавали метанол (10 мл) і крижану баню прибирали через 1 годину. Після 45 хвилин при кімнатній температурі леткі компоненти видаляли при зниженому тиску і сухий залишок розбавляли водою (20 мл). Домішки видаляли ефірною екстракцією (2×30 мл). Водний шар охолоджували у льоду, підкислювали до pH 3 розбавленої HCl і екстрагували етилацетатом (3×30 мл). Об'єднані органічні екстракти висушували над MgSO4 і концентрували при зниженому тиску, щоб отримати коричневу смолу. -1 1 Вихід 1,32 г (68%): ІЧ (KBr тонка плівка) 1735 см ; H ЯМР (400 МГц, CDCl3) 10,19 (ушир., 1H), 3,10 (д, J=14,2 Гц, 1H), 2,94 (д, J=13,9 Гц, 1H), 2,33 (с, 3H), 1,73 (с, 3H); 13C ЯМР (400 МГц, CDCl3) 173,33, 118,82, 45,86, 41,66, 23,05, 17,62. 3-Алілсульфаніл-2-метилпропанову кислоту отримували, як описано в Zhou et al. J. Org. Chem. 2004, 69, 7072. Крижану суміш 2-метил-3-сульфананілпропанової кислоти (5 г, 42 ммоль) і гідроксиду натрію (3,33 г, 83 ммоль) у воді (50 мл) обробляли розчином алілброміду (5,98 г, 49 ммоль) в етанолі (100 мл) протягом 30 хвилин. Крижану баню прибирали після 45 хвилин, і після 14 годин при кімнатній температурі леткі компоненти видаляли при зниженому тиску. Отриманий залишок охолоджували у льоду, підкислювали до pH 6 за допомогою 1 Н HCl і екстрагували етилацетатом, промивали водою, висушували над MgSO 4, концентрували при зниженому тиску і висушували у вакуумі при кімнатній температурі протягом 14 годин, щоб отримати прозору рідину. Підкислення водного шару до pH 4 приводило до додатковим 2,7 г -1 1 речовини. Загальний вихід 4,44 г (74%): ІЧ (KBr тонка плівка) 1708 см ; H ЯМР (400 МГц, CDCl3) 5,83-5,73 (м, 1H), 5,14-5,13 (м, 1H), 5,10-5,09 (м, 1H), 3,15 (д, J=7,3 Гц, 2H), 2,80 (дд, J=13,2, 7,0 13 Гц, 2H), 2,69 (секстет, J=7,1 Гц, 1H), 2,53 (дд, J=12,8, 6,5 Гц, 1H), 1,28 (д, J=7,1 Гц, 3H); C ЯМР (400 МГц, CDCl3) 179,01, 131,63, 114,92, 37,38, 32,72, 31,00, 14,19; ЕІМС m/z 160. Приклад 44: Отримання 3-((бензилоксикарбоніл)(метил)аміно)пропанової кислоти 24 UA 112761 C2 5 10 15 20 25 30 35 40 45 50 3-((бензилоксикарбоніл)(метил)аміно)пропанову кислоту отримували з 3(бензилоксикарбоніламіно)пропанової кислоти, як описано в Lerchen et al., PCT Int. Appl. 2007/WO2007093328 A1. Персикова зелена тля (MYZUPE) являє собою один з самих істотних видів сільськогосподарських шкідників персикових дерев серед тлі, спричиняючи зменшення росту, в'янення листя і відмирання різних тканин. Також цей вид тлі є дуже небезпечним через те, що є переносником вірусів рослин, таких як Y-вірус картоплі і вірус скручування листя картоплі, для рослин сімейства пасльонових/картоплі Solanaceae і різних мозаїчних вірусів для багатьох інших продовольчих культур. MYZUPE серед інших рослин атакує такі рослини, як броколі, лопух, капуста, морква, цвітна капуста, дайкон, баклажан, стручкова квасоля, лук-латук, макадамія, папайя, перець, солодка картопля, помідори, гірчиця і цукіні. MYZUPE також атакує і декоративні культури, такі як садова гвоздика, хризантема, квітуча білокачанна капуста, молочай і троянди. MYZUPE виробив резистентність до багатьох пестицидів. Деякі молекули, описані в цьому документі, тестувалися проти MYZUPE по методиках, описаних в наступному прикладі. Для викладу результатів була використана таблиця «Оцінна таблиця MYZUPE, APHIGO і BEMITA» (див. розділ таблиць). Як тестована рослина використовувалися саджанці капусти, вирощені в 3-дюймових горщиках, з 2-3 маленькими (3-5 см) справжніми листками. Саджанці заражали 20-50 личинками зеленої персикової тлі (безкрилі дорослі особини і личинки) за один день до хімічної обробки. Для кожної обробки використовувалися чотири горщики з окремими саджанцями. Сполуки (2 мг) розчиняли в 2 мл розчинника ацетон/метанол (1:1), отримуючи вихідний розчин в 1000 ч/млн (ppm). Вихідні розчини розводили в 5 разів 0,025% Твіном в H 2O, щоб отримати тестований розчин в 200 ч/млн (ppm). Для розпилення розчину до повної витрати на обидві сторони листка капуста використовували ручний розпилювач Devilbiss. Контрольні рослини (перевірка розчинника) обприскували тільки розчинником. Оброблені рослини поміщалися в кімнату для зберігання на 3 дні при температурі приблизно 25°С і 40% відносної вологості (ВВ) до проведення оцінки. Оцінку проводили підрахунком числа живих личинок на одну рослину під мікроскопом. Дані по інсектицидній активності, представлені в таблиці 3, були отримані за допомогою поправної формули Ебботта: Приведений % контролю = 100*(X-Y)/X, де X = кількість живих личинок на рослинах, оброблені розчинником, Y = кількість живих личинок на оброблених рослинах Приклад 46: Інсектицидний тест на бавовняну тлю (Aphis gossypii) методом обприскування листя Гарбузову або бавовняну розсаду з повністю розвиненим сім’ядольним листям підрізали, залишаючи один сім’ядольний листок на рослину і заражалися безкрилими дорослими і німфами бавовняної тлі (APHIGO) за один день до застосування хімікатів, щоб забезпечити однорідне зараження (приблизно 30-70 комахами тлі на рослину). Сполуки (2 мг) розчиняли в 2 мл розчинника ацетон/метанол (1:1), отримували вихідні розчини 1000 ч/млн. Вихідні розчини розбавляли в 5 разів 0,025% Твіном в H2O, щоб отримати розчин з 200 ч/млн. Для розпилення розчинів до повної витрати на обидві сторони сім’ядольного листя гарбуза використовували ручний розпилювач аспіраторного типу Devilbiss. Для кожної концентрації кожної сполуки використовували чотири рослини (4 повторності). Контрольні рослини (перевірка розчинника) обприскували тільки розчинником. Оброблені рослини вміщувалися в кімнату для зберігання на 3 дні при температурі приблизно 25°С і 40% ВВ до підрахунку кількості живих комах тлі на кожній рослині. Дані інсектицидної активності, представлені в таблиці 3, були отримані за допомогою поправної формули Ебботта: приведений % контролю = 100*(X-Y)/X, де X = кількість живих комах тлі на рослинах, оброблені розчинником, Y = кількість живих личинок на оброблених рослинах Приклад 47: Інсектицидний тест на білокрилок солодкої картоплі (Bemisia tabaci) методом обприскування листя 25 UA 112761 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як тестована рослина використовували рослини бавовни і вирощували їх в 3-дюймових горщиках і обрізали, залишаючи тільки 1 маленький (3-5 см) справжній листок. Потім рослини поміщали в кімнату з дорослими комахами білокрилки (BEMITA) і давали заразитися їх яйцями. Після 2-3 денного періоду відкладання яєць, рослини прибирали з кімнати з дорослими комахами білокрилки і видаляли дорослих особин з листя за допомогою стиснутого повітря, що отримується за допомогою ручного розпилювача Devilbiss (23 psi). Рослини, заражені яйцями (100-300 яєць на рослину), переносили в кімнату з контрольованими умовами на 5-6 днів при 82°F і 50% ВВ до виведення приблизно 50% яєць. Для кожної обробки використовували чотири рослини (4 повторності). Сполуки (2 мг) розчиняли в 1 мл розчинника ацетону, отримуючи вихідні розчини в 2000 ч/млн. Вихідні розчини розводили в 10 разів 0,025% Твіном в H2O, щоб отримати тестований розчин в 200 ч/млн. Для розпилення розчину до повної витрати на обидві сторони листя бавовни використовувався ручний розпилювач Devilbiss. Контрольні рослини обприскували тільки розчинником (перевірка розчинника). Оброблені рослини переносили в кімнату для зберігання на 8-9 днів при приблизно 82°F і 50% ВВ до моменту оцінки. Оцінку проводили підрахунком числа живих личинок на одну рослину під мікроскопом. Дані по інсектицидній активності, представлені в таблиці 3, були отримані за допомогою поправної формули Ебботта: приведений % контролю = 100*(X-Y)/X, де X = кількість живих личинок на рослинах, оброблені розчинником, Y = кількість живих личинок на оброблених рослинах Прийнятні для пестицидної обробки кислотноадитивні солі, похідні солей, сольвати, ефірні похідні, поліморфи, ізотопи і радіонукліди Молекули Формули Один можуть бути отримані у вигляді кислотноадитивних солей прийнятних для пестицидної обробки. Як необмежувальний приклад амінна функціональна група може утворювати солі з хлористоводневої, бромистоводневої, сірчаної, фосфорної, оцтової, бензойної, лимонної, малонової, саліцилової, яблучної, фумарової, щавлевої, бурштинової, виннокам’яної, молочної, глюконової, аскорбінової, малеїнової, аспарагінової, бензолсульфонової, метансульфонової, етансульфонової, гідроксиметансульфонової і гідроксіетансульфонової кислотами. Крім того, як необмежувальний приклад, кислотна функціональна група може утворювати солі, включаючи похідні лужних і лужноземельних металів і похідні амонію і амінів. Приклади переважних катіонів включають в себе натрій, калій і магній. Молекули Формули Один можуть бути отримані у вигляді похідних солей. Як необмежувальний приклад, похідні солей можуть бути отримані при взаємодії вільної основи з достатньою кількістю кислоти необхідної для отримання солі. Вільну основу можна отримати при обробці солі відповідним розбавленим водним розчином основи, таким як розбавлений водний гідроксид натрію (NaOH), карбонат калію, амонію і бікарбонат натрію. Наприклад, у множині випадків, пестицид, такий як 2,4-Д, роблять більш водорозчинним, перетворюючи його в його диметиламінову сіль. Молекули Формули Один можуть бути отримані у вигляді стабільних комплексів з розчинником, так що комплекс залишається незайманим після видалення незакомплексованого розчинника. Такі комплекси часто називають «сольватами». Однак особливо бажаним є утворення стабільних гідратів з водою як розчинник. Молекули Формули Один можуть бути отримані у вигляді ефірних похідних. Ці ефірні похідні потім можуть застосовуватися точно також, як застосовується винахід, розкритий в цьому документі. Молекули Формули Один можуть бути отримані у вигляді різних кристалічних поліморфів. Поліморфізм дуже важливий в розробці агрохімікатів, оскільки різні кристалічні поліморфи або структури тих же молекул можуть мати надто різні фізичні властивості і біологічні характеристики. Молекули Формули Один можуть бути отримані із застосуванням різних ізотопів. Особливо важливими є молекули, що містять 2H (також відомий як дейтерій) замість 1Н. Молекули ФормулиОдин можуть бути отримані із застосуванням різних радіонуклідів. Особливо важливими є молекули, що містять 14C. Стереоізомери Молекули Формули Один можуть існувати у вигляді одного або більше стереоізомерів. Таким чином, деякі молекули можуть бути отримані у вигляді рацемічних сумішей. Буде особливо цінним для фахівців в даній галузі, що один стереоізомер може бути активнішим, ніж інші стереоізомери. Окремі стереоізомери можуть бути отримані за допомогою відомих селективних синтетичних підходів, загальноприйнятих синтетичних підходів, застосовуючи 26 UA 112761 C2 5 10 15 20 25 30 35 40 45 50 55 60 дозволені вихідні матеріали або за допомогою загальноприйнятих дозволених підходів. Інсектициди Молекули Формули Один можуть також застосовуватися в комбінації (наприклад, у композиційній суміші або застосовуватися одночасно або послідовно) з одним або більше із приведених нижче інсектицидів - 1,2-дихлормпропан, абамектин, ацефат, ацетаміприд, ацетіон, ацетопрол, акринатрин, акрилонітрил, аланікарб, алдикарб, алдоксикарб, алдрин, алетрин, алосамідин, аліксикарб, альфа-циперметрин, альфа-екдизон, альфа-ендосульфан, амідитіон, амінокарб, амітон, оксалат амітону, амітраз, анабазин, атидатіон, азадирактин, азаметіофос, азинфос-етил, азинфос-метил, азотоат, гексафторсилікат барію, бартрин, бендіокарб, бенфуракарб, бенсултап, бета-кифлутрин, бета-циперметрин, біфентрин, біоалетрин, біоетанометрин, біоперметрин, бістрифлурон, бура, борна кислота, бромфенвінфос, бромоциклен, бромо-ДДТ, бромофос, бромофос-етил, буфенкарб, бупрофезин, бутакарб, бутатіофос, бутокарбоксим, бутонат, бутоксикарбоксим, кадусафос, арсенат кальцію, полісульфід кальцію, камфехлор, карбанолат, карбарил, карбофуран, дисульфід вуглецю, тетрахлорид вуглецю, карбофенотіон, карбосульфан, картап, гідрохлорид картапу, хлорантраніліпрол, хлорбіциклен, хлордан, хлордекон, хлордимеформ, гідрохлорид хлордимеформу, хлоретоксифос, хлорфенапір, хлорфенвінфос, хлорфлуазурон, хлормефос, хлороформ, хлоропікрин, хлорфоксим, хлорпразофос, хлорпірифос, хлорпірифос-метил, хлортіофос, хромафенозид, цинерин I, цинерин II, цинерини, цисметрин, клоетокарб, клосантел, клотіанідин, ацетоарсеніт міді, арсенат міді, нафтенат міді, олеат міді, кумафос, кумітоат, кротамітон, кротоксифос, круфомат, кріоліт, ціанофенфос, ціанофос, ціантоат, ціантраніліпрол, циклетрин, циклопротрин, цифлутрин, цигалотрин, циперметрин, цифенотрин, циромазин, цитіоат, ДДТ, декарбофуран, дельтаметрин, демефіон, демефіон-O, демефіон-S, деметон, деметон-метил, деметон-O, деметон-О-метил, деметон-S, деметон-S-метил, деметон-Sметилсульфон, діафентіурон, діаліфос, діатоміт, діазинон, дикаптон, дихлофентіон, дихлофос, дикрезил, дикротофос, дицикланіл, дієлдрин, дифлубензурон, дилор, димефлутрин, димефокс, диметан, диметоат, диметрин, диметилвінфос, диметилан, динекс, динекс-диклексин, динопроп, диносам, динотефуран, діофенолан, діоксабензофос, діоксакарб, діоксатіон, дисульфотон, дитикрофос, d-лимонен, ДНОК, ДНОК-амоній, ДНОК-калій, ДНОК-натрій, дорамектин, екдистерон, емамектин, бензоат емамектину, ЕМФК, емпентрин, ендосульфан, ендотіон, ендрин, ЕФН, епофенонан, еприномектин, есдепалетрин, есфенвалерат, етафос, етіофенкарб, етіон, етипрол, етоат-метил, етопрофос, етил форміат, етил-ДДД, етилен дибромід, етилен дихлорид, етилен оксид, етофенпрокс, етримфос, диксантоген, фамфур, фенаміфос, феназафлор, фенхлофос, фенетакарб, фенфлутрин, фенітротіон, фенобукарб, феноксакрим, феноксикарб, фенпіритрин, фенпропатрин, фенсульфотіон, фентіон, фентіонетил, фенвалерат, фіпроніл, флонікамід, флубендіамід (його додатково дозволені ізомери), флукофурон, флуциклоксурон, флуцитринат, флуфенерим, флуфеноксурон, флуфенпрокс, флувалінат, фонофос, форметанат, гідрохлорид форметанату, формотіон, формпаранат, формпаранату гідрохлорид, фосметилан, фоспірат, фостіетан, фуфенозид, фуратіокарб, фуретрин, гамма-цигалотрин, гамма-ГХЦГ, галфенпрокс, галофенозид, ГХЦГ, ХЕОД, гептахлор, гептенофос, гетерофос, гексафлумурон, ХХДН, гідраметилнон, водню ціанід, гідропрен, хіквінкарб, імідаклоприд, іміпротрин, індоксакарб, йодометан, ІПСФ, ісазофос, ізобензан, ізокарбофос, ізодрин, ізофенфос, ізофенфос-метил, ізопрокарб, ізопротіолан, ізотіоат, ізоксатіон, івермектин, жасмолін I, жасмолін II, йодофенфос, ювенільний гормон I, ювенільний гормон II, ювенільний гормон III, келеван, кінопрен, лямбда-цигалотрин, свинцю арсенат, лепімектин, лептофос, ліндан, ліримфос, луфенурон, літидатіон, малатіон, малонобен, мазидокс, мекарбам, мекарфон, менозон, меперфлутрин, мефосфолан, хлорид ртуті, месульфенфос, метафлумізон, метакрифос, метамідофос, метидатіон, метіокарб, метокротофос, метоміл, метопрен, метотрин, метоксихлор, метоксифенозид, метоксифенозид, бромистий метил, метилізотіоціанат, метилхлороформ, метиленхлорид, метофлутрин, метолкарб, метоксадіазон, мевінфос, мексакарбат, мілбемектин, оксим мілбеміцину, міпафокс, мірекс, молосултап, монокротофос, мономехіпо, моносултап, морфотіон, моксидектин, нафталофос, налед, нафталін, нікотин, ніфлуридид, нітенпірам, нітіазин, нітрилакарб, новалурон, новіфлумурон, ометоат, оксаміл, оксидеметон-метил, оксидепрофос, оксидисульфотон, пара-дихлорбензол, паратіон, паратіон-метил, пенфлурон, пентахлорфенол, перметрин, фенкаптон, фенотрин, фентоат, форат, фозалон, фосфолан, фосмет, фосніхлор, фосфамідон, фосфін, фоксим, фоксим-метил, піриметафос, піримікарб, піриміфос-етил, піриміфос-метил, арсеніт калію, тіоціанат калію, рр'-ДДТ, пралетрин, прекоцен I, прекоцен II, прекоцен III, примідофос, профенофос, профлуралін, профлутрин, промацил, промекарб, пропафос, пропетамфос, пропоксур, протидатпон, протіофос, протоат, протрифенбут, 27 UA 112761 C2 5 10 15 20 25 30 35 40 45 50 55 60 піметрозин, піраклофос, пірафлупрол, піразофос, піресметрин, піретрин I, піретрин II, піретрини, піридабен, піридаліл, піридафентіон, пірифлуквіназон, піримідифен, піримітат, пірипрол, пірипроксифен, касія, квіналфос, квіналфос-метил, квінотіон, рафоксанід, ресметрин, ротенон, ріаніа, сабадила, шрадан, селамектин, силафлуофен, силікагель, арсеніт натрію, фторид натрію, гексафторсилікат натрію, роданід натрію, софамід, спінеторам, спіносад, спіромесифен, спіротетрамат, сулкофурон, сулкофурон-натрій, сулфурамід, сулфотеп, сулфоксафлор, фторид сірки, сулпрофос, тау-флувалінат, тазимкарб, ТДЕ, тебуфенозид, тебуфенпірад, тебупіримфос, тефлубензурон, тефлутрин, темефос, ТЕПФ, тералетрин, тербуфос, тетрахлоретан, тетрахлорвінфос, тетраметрин, тетраметилфлутрин, тета-циперметрин, тіаклоприд, тіаметоксам, тикрофос, тіокарбоксим, тіоциклам, тіоцикламу оксалат, тіодикарб, тіофанокс, тіометон, тіосултап, тіосултап-динатрій, тіосултап-натрій, турингієнсин, толфенпірад, тралометрин, трансфлутрину, трансперметрин, триаратрен, триазамат, триазофос, трихлорофон, трихлорметафос-3, трихлоронат, трифенофос, трифлуморон, триметакарб, трипрен, вамідотіон, ваніліпрол, КМК, ксилілкарб, зета-циперметрин і золапрофос (у сукупності ці розповсюджені інсектициди виділені в «Групу Інсектицидів»). Акарициди Молекули Формули Один можуть також застосовуватися в комбінації (наприклад, композиційної суміші або застосовуватися одночасно або послідовно) з одним або більше з наступних акарицидів - ацехіноцил, амідофлумет, миш’яковистий оксид, азобензол, азоциклотин, беноміл, беноксафос, бензоксимат, бензилбензоат, біфеназат, бінапакрил, бромопропілат, хінометионат, хлорбензид, хлорфенетол, хлорфенсон, хлорфенсульфід, хлорбензилат, хлормебуформ, хлорметіурон, хлорпропілат, клофентезин, цієнопірафен, цифлуметофен, цигексатин, дихлофлуанід, дикофол, дієнохлор, дифловідазин, динобутон, динокап, динокап-4, динокап-6, диноктон, динопентон, диносульфон, динотербон, дифеніл сульфон, дисульфірам, дофенапін, етоксазол, феназаквін, оксид фенбутатину, фенотіокарб, фенпіроксимат, фенсон, фентрифаніл, флуакрипірим, флуазурон, флубензимін, флунетил, флуметрин, флуорбензид, гекситіазокс, месульфен, МНАФ, нікоміцини, проклонол, пропаргіт, квінтіофос, спіродиклофен, сульфірам, сірка, тетрадифон, тетранактин, тетрасул і тіоквінокс (у сукупності ці розповсюджені акарициди виділені в «Групу Акарицидів»). Нематоциди Молекули Формули Один можуть також застосовуватися в комбінації (наприклад, композиційної суміші або застосовуватися одночасно або послідовно) з одним або більше з наступних нематоцидів - 1,3-дихлорпропен, бенклотіаз, дазомет, дазомет-натрій, ДБХП, ДХІП, діамідуфос, флуенсульфон, фостіазат, фурфурол, іміціафос, ізамідофос, ізазофос, метам, метам-амоній, метам-калій, метам-натрій, фосфокарб і тіоназин (у сукупності ці розповсюджені нематоциди виділені в «Групу Нематoцидів»). Фунгіциди Молекули Формули Один можуть також застосовуватися в комбінації (наприклад, композиційної суміші або застосовуватися одночасно або послідовно) з одним або більше з наступних фунгіцидів - (3-етоксипропіл) бромід ртуті, 2-метоксіетилртуті хлорид, 2-фенілфенол, 8-оксихіноліну сульфат, 8-фенілртуті оксихінолін, ацибензолар, ацибензолар-S-метил, аципетакс, аципетакс-мідь, аципетакс-цинк, алдиморф, аліловий спирт, аметоктрадин, амісульбром, ампропілфос, анілазин, аурофунгін, азаконазол, азитирам, азоксистробін, полісульфід барію, беналаксил, беналаксил-M, баноданіл, беноміл, бенквінокс, банталурон, бентіавалікарб, бентіавалікарб-ізопропіл, хлорид бензалконію, бензамікрил, бензамакрилізобутил, бензаморф, бензогідроксамова кислота, бентоксазин, бінапакрил, дифеніл, бітертанол, бітіонол, біксафен, бластицидин-S, Бордоська рідина, боскалід, бромуконазол, бупіримат, Бургундська рідина, бутіобат, бутиламін, полісульфід кальцію, каптафол, каптан, карбаморф, карбендазим, карбоксин, карпорамід, карвон, суміш Чешанта, хінометіонат, хлобентіазон, хлораніформетан, хлораніл, хлорфеназол, хлординітронафталін, хлоронеб, хлорпікрин, хлороталоніл, хлорквінокс, хлозолінат, клімбазол, клотримазол, ацетат міді, карбонат міді основний, гідроксид міді, нафтенат міді, олеат міді, оксихлорид міді, силікат міді, сульфат міді, хромат міді цинку, крезол, куфранеб, купробам, оксид міді, ціазофамід, циклафурамід, циклогексимід, цифлуфенамід, цимоксаніл, ципендазол, ципроконазол, ципродиніл, дазомет, дазомет-натрій, ДБХП, дебакарб, декафентин, дегідрацетова кислота, дихлофлуанід, дихлон, дихлорофен, дихлозолін, диклобутразол, диклоцимет, дикломезин, дикломезин-натрій, диклоран, діетофенкарб, діетилпірокарбонат, дифеноконазол, дифлуметорим, диметиримол, диметоморф, димоксистробін, диніконазол, диніконазол-M, динобутон, динокап, динокап-4, динокап-6, диноктон, динопентон, диносульфон, динотербон, дифеніламін, дипіритіон, дисульфірам, диталімфос, дитіанон, ДНОК, ДНОК-амоній, ДНОк-калій, 28
ДивитисяДодаткова інформація
Автори англійськоюParker, Marshall, H., Yap, Maurice, C., H., Eckelbarger, Joseph, D., Buysse, Ann, M., Babcock, Jonathan, M., Hunter, Ricky, Adelfinskaya, Yelena, Samaritoni, Jack, Geno, Garizi, Negar, Trullinger, Tony, K.
Автори російськоюПаркер Маршалл Х., Ян Морис К. Х., Эккельбарджер Джозеф Д., Байсс Энн М., Бебкок Джонатан М., Хантер Рики, Адэльфинская Елена, Самаритони Джэк Джэно, Гарици Нэгар, Траллингер Тони К.
МПК / Мітки
МПК: A01N 47/12, A01N 43/824, C07D 417/04, A01N 47/40, A01N 53/12, A01N 47/18
Мітки: композиції, пестицидні
Код посилання
<a href="https://ua.patents.su/71-112761-pesticidni-kompozici.html" target="_blank" rel="follow" title="База патентів України">Пестицидні композиції</a>
Попередній патент: Теобромін у комбінації з гвайфенезином для лікування кашлю
Наступний патент: Гальмова колодка
Випадковий патент: Спосіб захисту посівів міскантусу від бур'янів












