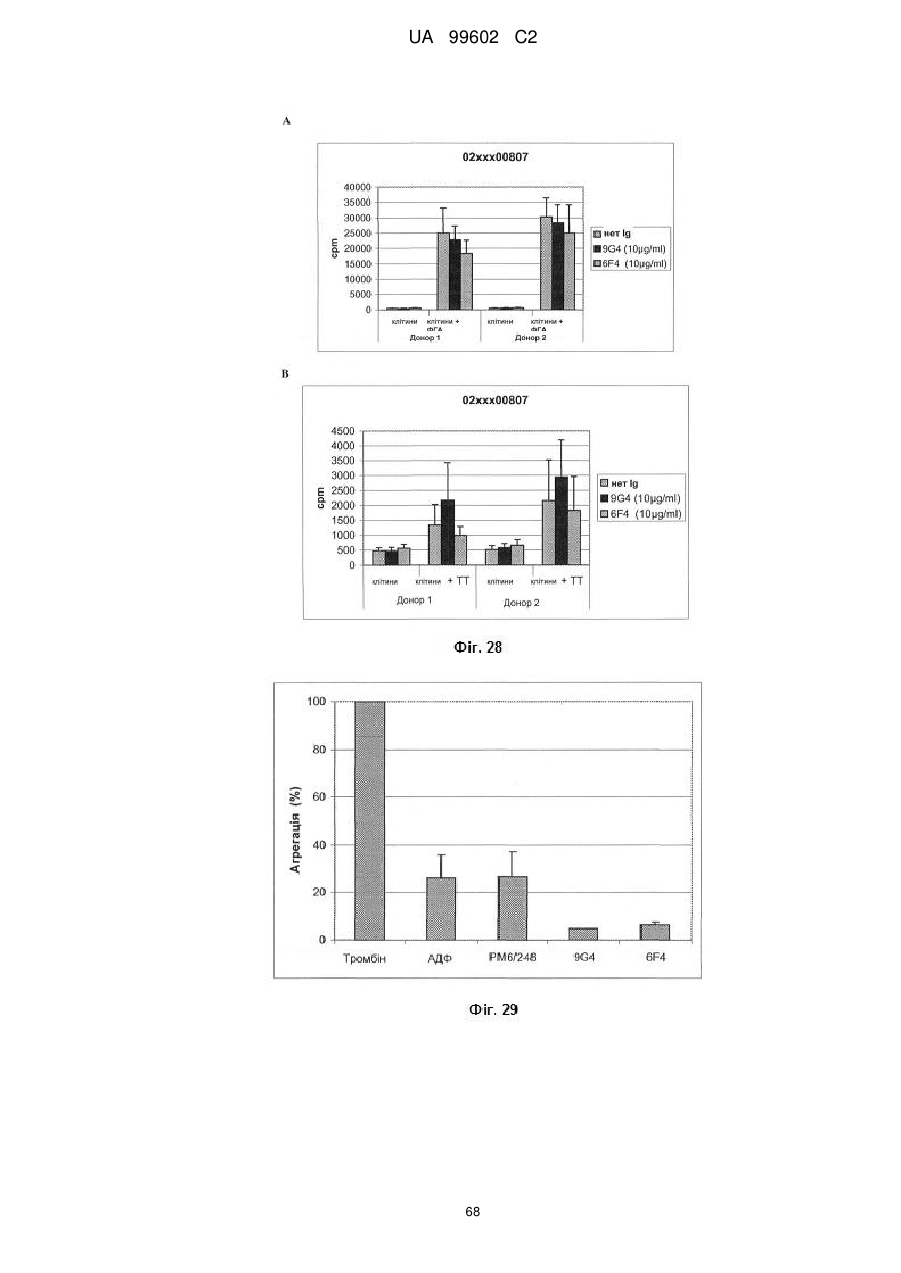
Антитіло, яке специфiчно зв’язується з jam-a, здатне інгібувати проліферацію пухлинних клітин
Номер патенту: 99602
Опубліковано: 10.09.2012
Автори: Бес Седрік, Гьотш Ліліан, Корва Наталі, Хьов Жан-Франсуа
Формула / Реферат
1. Ізольоване антитіло, яке специфічно зв'язується з JAM-A, або його функціональний фрагмент, здатне інгібувати проліферацію пухлинних клітин in vitro і/або in vivo, яке характеризується тим, що
містить важкий ланцюг з CDR-H1 послідовності SEQ ID № 7, CDR-H2 послідовності SEQ ID № 4 та CDR-Н3 послідовності SEQ ID № 12; та
містить легкий ланцюг, який містить CDR-L1 послідовності SEQ ID № 1, CDR-L2 послідовності SEQ ID № 3 та CDR-L3 послідовності SEQ ID № 5.
2. Антитіло або його функціональний фрагмент за п. 1, яке характеризується тим, що воно містить послідовність легкого ланцюга, який містить амінокислотну послідовність SEQ ID № 13, а також тим, що воно містить послідовність важкого ланцюга, який містить амінокислотну послідовність SEQ ID № 14.
3. Антитіло або його функціональний фрагмент за п. 1, яке є гуманізованим та характеризується тим, що зазначена послідовність легкого ланцюга містить амінокислотну послідовність SEQ ID № 17, а також тим, що воно містить послідовність важкого ланцюга, який містить амінокислотну послідовність SEQ ID № 18 або 19.
4. Антитіло або його функціональний фрагмент за п. 1, яке характеризується тим, що вказаний функціональний фрагмент вибраний серед фрагментів Fv, Fab, (Fab')2, Fab', scFv, scFv-Fс та димерних антитіл або будь-якого фрагмента, час напівжиття якого збільшений, такого як ПЕГильовані фрагменти.
5. Антитіло або його функціональний фрагмент за п. 1, яке характеризується тим, що вказане антитіло є мишачим антитілом, і тим, що воно містить легкий ланцюг амінокислотної послідовності SEQ ID № 15, а також важкий ланцюг амінокислотної послідовності SEQ ID № 16.
6. Антитіло або його функціональний фрагмент за п. 1 або п. 2, яке характеризується тим, що вказане антитіло є химерним антитілом, яке містить константні ділянки легкого ланцюга і важкого ланцюга, одержані з антитіла від виду, гетерологічного миші.
7. Химерне антитіло або його функціональний фрагмент за п. 6, яке характеризується тим, що вказаний гетерологічний вид є людиною.
8. Гуманізоване антитіло або його функціональний фрагмент за п. 7, яке характеризується тим, що константні ділянки легкого ланцюга і важкого ланцюга, одержані з людського антитіла, є лямбда- або каппа- і гамма-1, гамма-2 або гамма-4 ділянками відповідно.
9. Мишача гібридома, депонована в CNCM 6 червня 2006 під номером I-3646, яка продукує антитіло за п. 1, яке специфічно зв'язується з JAM-A та інгібує проліферацію пухлинних клітин.
10. Антитіло або його функціональний фрагмент за п. 1, яке характеризується тим, що Kd для білка JAM-A становить від приблизно 1 нМ до 1 пМ.
11. Ізольована нуклеїнова кислота, яка характеризується тим, що вона вибрана серед наступних нуклеїнових кислот:
а) нуклеїнової кислоти, ДНК або РНК, що кодує антитіло або його функціональний фрагмент за п. 1; та
b) нуклеїнової кислоти, комплементарної нуклеїновій кислоті, визначеній в пункті а).
12. Вектор, який складається з нуклеїнової кислоти за п. 11.
13. Клітина-хазяїн, яка містить вектор за п. 12.
14. Спосіб одержання антитіла або його функціонального фрагмента за п. 1, який характеризується наявністю наступних етапів:
а) культивування клітини-хазяїна за п. 13 в середовищі і в культуральних умовах, підходящих для вказаної клітини-хазяїна; та
b) виділення одержаного таким чином вказаного антитіла або одного з його функціональних фрагментів з культурального середовища або з вказаних культивованих клітин.
15. Антитіло або його функціональний фрагмент за п. 1 для застосування як ліків.
16. Композиція, яка містить як активний інгредієнт сполуку, яка складається з антитіла або його функціонального фрагмента за п. 1.
17. Композиція за п. 16, яка характеризується тим, що вона як комбінований продукт для застосування в одночасній, роздільній або відстроченій формі також містить протипухлинне антитіло, інше, ніж антитіло, направлене проти білка JAM-A.
18. Композиція за п. 16, яка характеризується тим, що вона як комбінований продукт для застосування в одночасній, роздільній або відстроченій формі також містить цитотоксичний/цитостатичний агент.
19. Композиція за п. 18, яка характеризується тим, що вказаний цитотоксичний/цитостатичний агент хімічно зв'язаний щонайменше з одним з елементів вказаної композиції для одночасного застосування.
20. Композиція за п. 16, яка характеризується тим, що щонайменше одне з вказаних антитіл або їх функціональних фрагментів кон'юговане з клітинним токсином і/або радіоізотопом.
21. Композиція за п. 16 для застосування як ліків.
22. Застосування антитіла або його функціонального фрагмента за п. 1, або композиції за п. 16 для виготовлення ліків для профілактики або лікування захворювання, пов'язаного з проліферацією пухлинних клітин.
23. Застосування за п. 22 для виготовлення ліків для профілактики або лікування раку.
24. Застосування за п. 23, яке характеризується тим, що вказаний рак є раком, вибраним серед раку простати, остеосаркоми, раку легенів, раку молочної залози, раку ендометрія, множинної мієломи, раку яєчників, раку підшлункової залози і раку товстої кишки.
25. Застосування за п. 24, яке характеризується тим, що вказаний рак є раком, вибраним серед естрогензалежного раку молочної залози, недрібноклітинного раку легені, раку товстої кишки і раку підшлункової залози.
Текст
Реферат: Винахід належить до антитіла або його функціонального фрагмента, яке специфічно зв’язується з JAM-A (антитіла, позначеного як 6F4), здатного інгібувати проліферацію пухлинних клітин in vitro і/або in vivo, нуклеїнової кислоти, що його кодує, вектора, клітинихазяїна, способу одержання антитіла, мишачої гібридоми, яка продукує антитіло, депонованої в CNCM під номером І-3646, а також до гуманізованого антитіла, одержаного з вихідного мишачого антитіла. Винахід також належить до композиції, що містить дане антитіло, та застосування антитіла для виготовлення ліків для профілактики або лікування захворювання, пов’язаного з проліферацією клітин. UA 99602 C2 (12) UA 99602 C2 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується нових антитіл, зокрема мишачих моноклональних антитіл, химерних і гуманізованих, які здатні інгібувати пухлинний ріст, а також амінокислотних і нуклеїновокислотних послідовностей, що кодують такі антитіла. В одному аспекті винахід стосується нових антитіл, похідних сполук або функціональних фрагментів, які здатні інгібувати проліферацію пухлинних клітин. Винахід також включає застосування таких антитіл як ліків для профілактичного і/або терапевтичного лікування ракових захворювань, а також в процедурах або наборах, пов'язаних із діагностикою раку. Нарешті, винахід включає композиції, які містять такі антитіла в комбінації з іншими протипухлинними сполуками, такими як антитіла, або в кон'югації з токсинами, а також їх застосування в профілактиці і/або лікуванні деяких видів раку. Як правило, критерієм вибору для продукції моноклональних антитіл, є розпізнавання імуногену, визначеного як потенційна ціль впливу. На практиці, мишей імунізують рекомбінантним білком, який відповідає імуногенну, а потім одержані за допомогою мишей моноклональні антитіла виділяють і піддають першому скринінгу на їх здатність розпізнавати імуноген специфічним чином. На другому етапі антитіла, відібрані таким чином, тестують in vivo та in vitro для того, щоб визначити їх активність, а також їх властивості і/або механізми дії. Цей «традиційний» підхід, навіть якщо він дає можливість дізнатися робочу мету із самого початку, часто породжує велику кількість антитіл, які, поза сумнівом, здатні специфічно розпізнавати дану мету, але які in vivo не проявляють значної біологічної активності. В галузі раку дійсно відомо, що навіть якщо антитіло дає гарні результати in vitro, це не обов'язково означає, що потім таке антитіло буде демонструвати реальну протипухлинну активність in vivo. Даний винахід відрізняється від цього способу виробництва і навіть йде проти нього, оскільки він оснований на «функціональному» підході, і особливо при первинному скринінгу грунтується на функції шуканого антитіла, а не на розпізнаванні антигену. Зокрема, винахідники вибрали дану функцію а саме інгібування базальної проліферації клітин, а не їх індукування, як параметр для вибору антитіла. Використовуваний спосіб продукції буде описаний детальніше в прикладах нижче. Дивним чином при цьому функціональному підході винахідники розробили і вибрали антитіло, здатне в значній мірі інгібувати проліферацію пухлинних клітин in vitro і/або in vivo. Відповідно до першого аспекту винахід стосується виділеного антитіла або його деривату або функціонального фрагмента, здатного інгібувати проліферацію пухлинних клітин in vitro і/або in vivo; вказане антитіло або його дериват або функціональний фрагмент, який містить щонайменше один CDR, вибраний серед ділянок, які визначають комплементарність зв’язування (CDR), які мають послідовності SEQ ID № 1, 2, 3, 4, 5 або 6, або щонайменше один CDR, послідовність якого щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 %, ідентична послідовностям SEQ ID № 1, 2, 3, 4, 5 або 6 при оптимальному вирівнюванні. «Функціональний фрагмент» антитіла означає, зокрема, фрагмент антитіла, такий як фрагменти Fv, scFv (sc=простий ланцюг), Fab, F(ab') 2, Fab', scFv-Fс або димерні антитіла або будь-який фрагмент, час напівжиття якого збільшений. Такі функціональні фрагменти будуть детально описані в даному описі нижче. «Дериват» антитіла означає, зокрема, зв'язуючий білок, який складається з пептидного остову та щонайменше одного CDR з первинного антитіла для того, щоб зберегти свою здатність бути розпізнаним. Такі деривати, добре відомі фахівцям в даній галузі, будуть описані детальніше в даному описі нижче. Більш переважний винахід включає антитіла, їх деривати або їх функціональні фрагменти відповідно до даного винаходу, зокрема химерні або гуманізовані, одержані шляхом генетичної рекомбінації або хімічного синтезу. Відповідно до переважного втілення антитіло згідно винаходу або його деривати або функціональні фрагменти характеризуються тим, що складаються з моноклонального антитіла. Під «моноклональним антитілом» слід розуміти антитіло, яке утворюється з майже гомогенної популяції антитіла. Зокрема, окремі антитіла популяції є ідентичними, за винятком декількох можливих природно одержаних мутацій, які можна знайти в мінімальних пропорціях. Іншими словами, моноклональне антитіло складається з гомогенного антитіла, яке утворюється при рості одного клону клітин (наприклад, гібридоми, коли еукаріотичну приймаючу клітину (клітину-хазяїна) трансфікують молекулою ДНК, що кодує гомогенне антитіло, прокаріотичну приймаючу клітину трансфікують молекулою ДНК, що кодує гомогенне антитіло і так далі) і в цілому характеризується важкими ланцюгами одного і лише одного класу і підкласу, легкими ланцюгами лише одного типу. Моноклональні антитіла високоспецифічні і направлені проти одного антигену. Крім того, на відміну від препаратів поліклональних антитіл, які, як правило, включають різні антитіла, направлені проти різних детермінант або епітопів, кожне моноклональне антитіло направлене проти одного епітопу антигену. 1 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 Необхідно розуміти, що винахід не стосується антитіл в природному вигляді, тобто вони взяті не з їх природного середовища, а виділені або одержані шляхом очищення з природних джерел або одержані шляхом генетичної рекомбінації або хімічного синтезу, і, таким чином, вони можуть нести неприродні амінокислоти, що буде описане нижче. Зокрема, відповідно до переважного втілення винаходу антитіло або його деривати або функціональні фрагменти характеризуються тим, що містять легкий ланцюг, який містить щонайменше один CDR, вибраний серед CDR, які мають амінокислотні послідовності SEQ ID № 1, 3 або 5, або щонайменше один CDR, послідовність якого щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентична послідовностям SEQ ID № 1, 3 або 5 при оптимальному вирівнюванні; або вони містять важкий ланцюг, що містить щонайменше один CDR, вибраний серед CDR, які мають амінокислотні послідовності SEQ ID № 2, 4 або 6, або щонайменше один CDR, послідовність якого щонайменше на 80 %, переважно, на 85 %, 90 % 95 % та 98 % ідентична послідовностям SEQ ID № 2, 4 або 6 при оптимальному вирівнюванні. Зокрема, антитіла винаходу або один з їх дериватів або функціональних фрагментів характеризуються тим, що містять важкий ланцюг, який містить щонайменше один з трьох CDR, які мають послідовності SEQ ID № 2, 4 та 6, або щонайменше одну послідовність, ідентичну щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % послідовностям SEQ ID № 2, 4 або 6 при оптимальному вирівнюванні. Ще більш переважно, антитіла винаходу або один з їх дериватів або функціональних фрагментів характеризуються тим, що містять важкий ланцюг з наступними трьома CDR, відповідно CDR-H1, CDR-H2 та CDR-H3, де: - CDR-H1 містить послідовність SEQ ID № 2, 7 або 9, або послідовність, ідентичну послідовності SEQ ID № 2, 7 або 9 щонайменше на 80 % при оптимальному вирівнюванні; - CDR-H2 містить послідовність SEQ ID № 4 або 11, або послідовність, ідентичну послідовності SEQ ID № 4 або 11 щонайменше на 80 % при оптимальному вирівнюванні; а - CDR-H3 містить послідовність SEQ ID № 6 або 12, або послідовність, ідентичну послідовності SEQ ID № 6 або 12 щонайменше на 80 % при оптимальному вирівнюванні. Відповідно до частинного втілення антитіла або один з їх дериватів або функціональних фрагментів характеризуються тим, що містять важкий ланцюг з CDR-H1 послідовності SEQ ID № 7, CDR-H2 послідовності SEQ ID № 4 та CDR-Н3 послідовності SEQ ID № 12. Відповідно до іншого частинного втілення антитіла або один з їх дериватів або функціональних фрагментів характеризуються тим, що вони містять важкий ланцюг з CDR-H1 послідовності SEQ ID № 9, CDR-H2 послідовності SEQ ID № 11 та CDR-Н3 послідовності SEQ ID № 6. Відповідно до іншого втілення антитіла винаходу або один з їх дериватів або функціональних фрагментів характеризуються тим, що вони містять легкий ланцюг щонайменше з одним з трьох CDR послідовності SEQ ID № 1, 3 та 5, або щонайменше з однією послідовністю, ідентичною послідовностям SEQ ID № 1, 3 або 5 щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % при оптимальному вирівнюванні. У переважному випадку антитіла винаходу або один з їх дериватів або функціональних фрагментів характеризуються тим, що вони містять легкий ланцюг з наступними трьома CDR, відповідно CDR-L1, CDR-L2 та CDR-L3, де: - CDR-L1 містить послідовність SEQ ID № 1 або 8, або послідовність, ідентичну послідовності SEQ ID № 1 або 8 щонайменше на 80 % при оптимальному вирівнюванні; - CDR-L2 містить послідовність SEQ ID № 3 або 10, або послідовність, ідентичну послідовності SEQ ID № 3 або 10 щонайменше на 80 % при оптимальному вирівнюванні; і - CDR-L3 містить послідовність SEQ ID № 5, або послідовність, ідентичну послідовності SEQ ID № 5 щонайменше на 80 % при оптимальному вирівнюванні. Відповідно до частинного втілення антитіла або один з їх дериватів або функціональних фрагментів характеризуються тим, що вони містять легкий ланцюг з CDR-L1 послідовності SEQ ID № 1, CDR-L2 послідовності SEQ ID № 3 та CDR-L3 послідовності SEQ ID № 5. Відповідно до іншого частинного втілення антитіла або один з їх дериватів або функціональних фрагментів характеризуються тим, що вони містять легкий ланцюг з CDR-L1 послідовності SEQ ID № 8, CDR-L2 послідовності SEQ ID № 10 та CDR-L3 послідовності SEQ ID № 5. У даному описі терміни «поліпептиди», «поліпептидні послідовності», «пептиди» і «білки, приєднані до сполук антитіла або до їх послідовностей» є взаємозамінними. Тут слід розуміти, що винахід не стосується антитіл в природній формі, тобто вони взяті не з їх природного середовища, а виділені або одержані шляхом очищення з природних джерел або одержані шляхом генетичної рекомбінації або хімічного синтезу, і, таким чином вони можуть 2 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 нести неприродні амінокислоти, що буде описане нижче. У першому втіленні ділянка, яка визначає комплементарність зв’язування, або CDR, означає гіперваріабельні ділянки важких і легких ланцюгів імуноглобулінів відповідно до визначення th Кабата і ін. (Kabat et al., Sequences of proteins of immunological interest, 5 Ed., U.S. Department of Health and Human Services, NIH, 1991, і подальші видання). Існують три CDR важких ланцюгів і три CDR легких ланцюгів. В даному випадку термін «CDR» використовується для позначення, залежно від ситуації, одного або більше, або навіть всіх ділянок, які містять більшість амінокислотних залишків, відповідальних за афінне зв'язування антитіла з антигеном або епітопом, який розпізнається. У другому втіленні під CDR-ділянками або CDR(s) розуміються гіперваріабельні ділянки важких і легких ланцюгів імуноглобулінів відповідно до визначення IMGT. Унікальна нумерація IMGT була створена для порівняння варіабельних доменів незалежно від антигенного рецептора, типу ланцюга або видів [Lefranc M.-P., Immunology Today 18, 509 (1997) / Lefranc M.-P., The Immunologist, 7, 132-136 (1999) / Lefranc, M.-P., Pommié, C, Ruiz, M., Giudicelli, V., Foulquier, E., Truong, L., Thouvenin-Contet, V. and Lefranc, Dev. Comp. Immunol, 27, 55-77 (2003)]. В унікальній нумерації IMGT консервативні амінокислоти завжди знаходяться в такій самій позиції, наприклад цистеїн 23 (1-ий CYS), триптофан 41 (КОНСЕРВАТИВНИЙ-TRP), гідрофобна амінокислота 89, цистеїн 104 (2-й CYS), фенілаланін або триптофан 118 (J-PHE або J-TRP). Унікальна нумерація IMGT передбачає стандартизоване розмежування каркасних ділянок (FR1-IMGT: позиції з 1 по 26, FR2-IMGT: з 39 по 55, FR3-IMGT: з 66 по 104 та FR4-IMGT: з 118 по 128) і ділянок, які визначають комплементарність зв’язування: CDR1-IMGT: з 27 по 38, CDR2-IMGT: з 56 по 65 та CDR3-IMGT: з 105 по 117. Пропуски, які являють собою незаняті позиції, і довжини CDR-IMGT (показані в квадратних дужках і розділені крапками, наприклад [8.8.13]) стають важливою інформацією. Унікальна нумерація IMGT використовується в 2Dграфічному представленні, розробленому як IMGT Colliers de Perles [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002) / Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007)], а також в 3D-структурах в IMGT/3Dstructure-DB [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004)]. Існують три CDR важкого ланцюга і три CDR легкого ланцюга. Термін CDR використовується в даному документі для позначення, залежно від випадку, одного або декількох з цих ділянок або навіть всіх цих ділянок, які містять більшість амінокислотних залишків, відповідальних за афінне зв’язування антитіла з антигеном або епітопом, який розпізнається. Для більшої чіткості, слід розуміти, що в подальшому описі, і зокрема в таблиці 2 та 3, CDR будуть визначені відповідно до нумерації IMGT, нумерації Кабата і загальної нумерації. Загальна нумерація об'єднує частину залишків кожного CDR, які є загальними для CDR відповідно до визначення систем нумерації IMGT і Кабата. Система нумерації IMGT визначає CDR відповідно до системи IMGT, визначеної вище, у той час система нумерації Кабата визначає CDR відповідно до системи Кабата, визначеної вище. Зокрема, CDR-L1 складається з SEQ ID № 1 (QDINNY) в загальній і IMGT системах нумерації і SEQ ID № 8 (KASQDINNYIA) в системі нумерації Кабата. Відносно CDR-L2, він складається з SEQ ID № 3 (YTS) в загальній і IMGT системах нумерації і SEQ ID № 10 (YTSTLQA) в системі нумерації Кабата. CDR-L3 складається з SEQ ID № 5 (LQYDNLWT) в кожній з трьох систем нумерації. Для важкого ланцюга CDR-H1 складається з SEQ ID № 2 (TDYS) в загальній системі нумерації, SEQ ID № 7 (GYSFTDYS) в системі нумерації IMGT і SEQ ID № 9 (TDYSMY) в системі нумерації Кабата. CDR-H2 складається з SEQ ID № 4 (IDPYNGGT) в загальній і IMGT системах нумерації і SEQ ID № 11 (YIDPYNGGTRYNQKFKG) в системі нумерації Кабата. Нарешті, CDR-H3 складається з SEQ ID № 6 (QTDYFDY) в загальній і системі нумерації Кабата, в той час як в системі нумерації IMGT він складається з SEQ ID № 12 (ARQTDYFDY). У контексті даного винаходу «відсоткова ідентичність» двох нуклеїновокислотних або амінокислотних послідовностей означає відсоток ідентичних нуклеотидів або амінокислотних залишків між двома порівнюваними послідовностями, одержаний при оптимальному вирівнюванні, цей відсоток є чисто статистичним, і відмінності між двома послідовностями розподіляються випадковим чином по всій їх довжині. Порівняння двох амінокислотних або нуклеїновокислотних послідовностей звичайно здійснюються шляхом порівняння послідовностей після їх оптимального узгодження, воно може бути проведене по сегментах або за допомогою «вікна узгодження». Оптимальне узгодження послідовностей для порівняння може бути здійснене додатково до порівняння вручну, за допомогою алгоритму локальної гомології Сміта-Вотермана (1981) [Ad. App. Math. 2:482], за допомогою алгоритму локальної 3 UA 99602 C2 5 10 15 20 25 30 35 гомології Нідлмана-Вунша (1970) [J. MOI. Biol. 48:443] за допомогою подібного способу дослідження Пірсона і Ліпмана (1988) [Proc. Natl. Acad. Sci. USA 85:2444] або за допомогою комп'ютерного програмного забезпечення з використанням цих алгоритмів (GAP, BESTFIT, FASTA і TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI, або за допомогою програмного забезпечення для порівняння BLAST NR або BLAST P). Відсоткова ідентичність двох нуклеїновокислотних або амінокислотних послідовностей визначається шляхом порівняння двох оптимально узгоджених послідовностей, в яких порівнювана нуклеїновокислотна або амінокислотна послідовність може мати домішки або делеції в порівнянні з вихідною послідовністю для оптимальної відповідності між двома послідовностями. Відсоткова ідентичність розраховується шляхом визначення числа позицій, в яких амінокислотні або нуклеотидні залишки ідентичні в двох послідовностях, ділення числа ідентичних позицій на загальне число позицій у вікні узгодження і множення результату на 100 для одержання відсоткової ідентичності двох послідовностей. Наприклад, програма BLAST «BLAST 2 sequences» (Tatusova et al., «Blast 2 sequences - a new tool for comparing protein and nucleotide sequences», FEMS Microbiol, 1999, Lett. 174:247250), доступна на сайті http://www.ncbi.nlm.nih.gov/gorf/bl2.html, може бути використана з параметрами за умовчанням (зокрема, з параметрами «штраф за відкриття делеції»: 5 і «штраф за подовження делеції»: 2; вибраною матрицею буде, наприклад, матриця «BLOSUM 62», запропонована в програмі); відсоткова ідентичність двох послідовностей для порівняння розраховується безпосередньо в програмі. Для амінокислотної послідовності, яка демонструє ідентичність з вихідною амінокислотною послідовністю щонайменше 80 %, переважно, 85 %, 90 %, 95 % та 98 %, переважні приклади включають ті, які містять вихідну послідовність з визначеними модифікаціями, зокрема делецією, домішкою або заміною щонайменше однієї амінокислоти, розривом або подовженням. У випадку заміни однієї або більше послідовних або непослідовних амінокислот переважними є ті заміни, при яких замінювана амінокислота замінюється «еквівалентною» амінокислотою. Тут вираз «еквівалентні амінокислоти» застосовується для позначення будьяких амінокислот, які можуть замінити одну із структурних амінокислот без модифікації біологічної активності відповідних антитіл, а також тих конкретних прикладів, які наведені нижче. Еквівалентні амінокислоти можуть бути визначені або за їх структурною гомологією з амінокислотами, які вони будуть замінювати, або за результатами порівняльних тестів біологічної активності різних антитіл, які можуть бути одержані. Як необмежувальний приклад, в таблиці 1 нижче наводиться інформація про можливі заміни, які можуть бути проведені без значної модифікації біологічної активності відповідного зміненого антитіла; зворотні заміни природно можливі в тих самих умовах. Таблиця 1 Вихідний залишок Ala (A) Arg (R) Asn (N) Asp (D) Cys (C) Gln (Q) Glu (G) Gly (G) His (H) Ile (I) Leu (L) Lys (K) Met (M) Phe (F) Pro (P) Ser (S) Thr (T) Trp (W) Tyr (Y) Val (V) Заміна (и) Val, Gly, Pro Lys, His Gln Glu Ser Asn Asp Ala Arg Leu Ile, Val, Met Arg Leu Tyr Ala Thr, Cys Ser Tyr Phe, Trp Leu, Ala Фахівцям в даній галузі відомо, що в даній структурі найбільша варіабельність (довжини і 4 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 складу) серед шести CDR спостерігається в трьох CDR важкого ланцюга і, зокрема, в CDR-H3 цього важкого ланцюга. Отже, є очевидним, що переважними CDR антитіл винаходу або одного з їх дериватів або функціональних фрагментів будуть три CDR з важкого ланцюга, тобто CDR, закодовані послідовностями SEQ ID №№. 2, 4 та 6 відповідно, а ще більш переважний CDR, відповідний CDR-H3 закодований послідовністю SEQ ID № 6. У конкретному втіленні даний винахід стосується мишачого антитіла або його похідних сполук або функціональних фрагментів. Інше втілення винаходу розкриває антитіло або його деривати або функціональні фрагменти, які містять легкий ланцюг з наступними трьома CDR: CDR-L1 з послідовності SEQ ID № 1 або з послідовності, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 1 при оптимальному вирівнюванні; CDR-L2 з послідовності SEQ ID № 3 або послідовності, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 3 при оптимальному вирівнюванні; і CDR-L3 з послідовності SEQ ID № 5 або послідовності, щонайменше на 80 % переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 5 при оптимальному вирівнюванні, а також важкий ланцюг з наступними трьома CDR: CDR-H1 з послідовності SEQ ID № 7 або послідовності щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 7 при оптимальному вирівнюванні; CDR-H2 з послідовності SEQ ID № 4 або послідовності щонайменше на 80 %, переважно, на 85 % 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 4 при оптимальному вирівнюванні; і CDR-Н3 з послідовності SEQ ID № 12 або послідовності щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 12 при оптимальному вирівнюванні. Ще одне втілення винаходу розкриває антитіло або його дериват або функціональний фрагмент, який містить легкий ланцюг з наступними трьома CDR: - CDR-L1 з послідовності SEQ ID № 8 або послідовності, щонайменше на 80 % ідентичної послідовності SEQ ID № 8 при оптимальному вирівнюванні; - CDR-L2 з послідовності SEQ ID № 10 або послідовності щонайменше на 80 % ідентичної послідовності SEQ ID № 10 при оптимальному вирівнюванні; і - CDR-L3 з послідовності SEQ ID № 5 або послідовності, щонайменше на 80 % ідентичної послідовності SEQ ID № 5 при оптимальному вирівнюванні а також важкий ланцюг з наступними трьома CDR: - CDR-H1 з послідовності SEQ ID № 9 або послідовності, щонайменше на 80 % ідентичної послідовності SEQ ID № 9 при оптимальному вирівнюванні; - CDR-H2 з послідовності SEQ ID № 11 або послідовності щонайменше на 80 % ідентичної послідовності SEQ ID № 11 при оптимальному вирівнюванні; і - CDR-Н3 з послідовності SEQ ID № 6 або послідовності, щонайменше на 80 % ідентичної послідовності SEQ ID № 6 при оптимальному вирівнюванні. Відповідно до ще одного втілення антитіло винаходу або його деривати або функціональні фрагменти характеризуються тим, що містять послідовність легкого ланцюга з амінокислотною послідовністю SEQ ID № 13 або послідовністю, щонайменше на 80 %, переважно, на 85 %, 90 % 95 % та 98 % ідентичною послідовності SEQ ID № 13 при оптимальному вирівнюванні; і тим, що містять послідовність важкого ланцюга з амінокислотною послідовністю SEQ ID № 14 або послідовністю, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичною послідовності SEQ ID № 14 при оптимальному вирівнюванні. Винахід також розкриває гуманізоване антитіло або його дериват або функціональний фрагмент, яке характеризується тим, що містить послідовність легкого ланцюга з амінокислотною послідовністю SEQ ID № 17 або з послідовністю, щонайменше на 80 % ідентичною послідовності SEQ ID № 17 при оптимальному вирівнюванні, і тим, що містить послідовність важкого ланцюга з амінокислотною послідовністю SEQ ID № 18 або 19 або з послідовністю, щонайменше на 80 % ідентичною послідовності SEQ ID № 18 або 19 при оптимальному вирівнюванні. Як вказано вище, винахід також стосується будь-якого деривату, одержаного з антитіла, як описано у винаході. Зокрема, антитіло винаходу або його деривати або функціональні фрагменти характеризуються тим, що вказаний дериват складається із зв'язуючого білка, який містить 5 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 пептидний остов, до якого прищеплений щонайменше один CDR таким чином, щоб зберегти всі або частину властивостей первинного антитіла з розпізнавання паратопів. Одна або більше послідовностей з шести CDR послідовностей, описаних в даному винаході, також можуть бути присутніми в різних білкових остовах імуноглобулінів. В цьому випадку послідовність білка дозволяє відтворити пептидний скелет, сприятливий для згортання прищеплених CDR, що дозволяє їх паратопам зберегти свої антиген-розпізнавальні властивості. Як правило, фахівцям в даній галузі відомо, як визначити тип білкового остову, до якого прищеплюють щонайменше один з CDR, взятих з вихідного антитіла. Зокрема, відомо, що такі вибрані остови повинні відповідати найбільшій кількості наступних критеріїв (Skerra A., J. MoI. Recogn., 2000, 13:167-187): - хороше збереження філогенезу; - відома тривимірна структура (наприклад, одержана за допомогою кристалографії, ЯМРспектроскопії або будь-якої іншої методики, відомої фахівцеві в даній галузі); - невеликий розмір; - невелика кількість або відсутність посттранскрипційних змін; і/або - простота продукції, експресії та очищення. Такі білкові остови можуть мати походження із структур, вибраних серед: фібронектину і, переважно, домену 10 фібронектину III типу, ліпокаліну, антикаліну (Skerra A., J. Biotechnol., 2001, 74(4):257-75), білка Z, одержаного з домену В білка А Staphylococcus аureus, тіоредоксину А або білків з мотивом, що повторюється, таким як «анкіриновий повтор» (Kohl et al., PNAS, 2003, vol. 100, No. 4, 1700-1705), «повтор Армадила», «багатий лейцином повтор» і «тетратрикопептидний повтор», але не обмежуються ними. Також потрібно згадати остови, одержані з токсинів, таких як, наприклад, токсини від скорпіонів, комах, рослин, молюсків і так далі, і білки-інгібітори нейрональної NО-синтази (PIN). Не обмежувальним прикладом таких гібридних конструкцій є вставка CDR-H1 (важкий ланцюг) антиCD4-антитіла, а саме 13B8.2, в одну з петель в PIN; таким чином, новий зв'язуючий білок зберігає такі самі зв'язуючі властивості, як у вихідного антитіла (Bes et al., Biochem. Biophys. Res. Commun., 2006, 343(1), 334-344). На чисто ілюстративному також можна згадати прищеплення CDR-H3 (важкий ланцюг) анти-лізоцим-VHH-антитіла в одну з петель неокарциностатину (Nicaise et al., Protein Science, 2004, 13(7):1882-1891). Нарешті, як говорилося вище, такі пептидні остови можуть містити від одного до шести CDR, що походять з вихідного антитіла. Фахівець в даній галузі, переважно, але не обов'язково, буде вибирати щонайменше один CDR з важкого ланцюга, про який відомо що він насамперед відповідає за специфічність антитіла. Вибір одного або декількох релевантних CDR очевидний фахівцеві в даній галузі, який потім буде вибирати підходящу з відомих методик (Bes et al., FEBS letters 508, 2001, 67-74). Специфічний аспект даного винаходу стосується способу вибору сполуки, одержаної з антитіла відповідно до винаходу, причому вказаний дериват здатний інгібувати ріст пухлинних клітин in vitro і/або in vivo і містить пептидний остов, до якого прищеплений щонайменше один CDR антитіла; даний спосіб характеризується тим, що включає наступні етапи: а) приведення in vitro сполуки, яка містить пептидний остов, до якого прищеплений щонайменше один CDR антитіла, в контакт з біологічним зразком, що містить здатні до росту пухлинні клітини, і в умовах, що дозволяють зростати цим клітинам; і b) відбір вказаної сполуки, якщо вказана сполука здатна інгібувати ріст цих пухлинних клітин, а також характеризується тим, що вказаний щонайменше один прищеплений CDR вибраний серед наступних CDR: - CDR з послідовності SEQ ID № 1, 8 або послідовності, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 1, 8 при оптимальному вирівнюванні; - CDR з послідовності SEQ ID № 3, 10 або послідовності, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 3, 10 при оптимальному вирівнюванні; - CDR з послідовності SEQ ID № 5 або послідовності, щонайменше на 80 %, переважно, на 85 %, 90 % 95 % та 98 % ідентичної послідовності SEQ ID № 5 при оптимальному вирівнюванні; - CDR з послідовності SEQ ID № 2, 7, 9 або послідовності, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 2, 7, 9 при оптимальному вирівнюванні; - CDR з послідовності SEQ ID № 4, 11 або послідовності, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 4, 11 при оптимальному 6 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 вирівнюванні; і - CDR з послідовності SEQ ID № 6, 12 або послідовності, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 6, 12 при оптимальному вирівнюванні. Відповідно до переважного варіанта спосіб може включати в етапі а) приведення в контакт in vitro сполуки, що містить пептидний остов, до якого прищеплені щонайменше два або три CDR антитіла. Відповідно до ще найбільш переважного варіанта даного способу пептидний остов вибирають серед остовів або зв'язуючих білків, структури яких були згадані вище. Очевидно, що ці приклади аж ніяк не є обмежувальними, і будь-які інші структури, відомі та очевидні фахівцям в даній галузі, повинні розглядатися як такі, що охоплюються даною патентною заявкою. Даний винахід, таким чином, стосується антитіла або його похідних сполук або функціональних фрагментів, які характеризуються тим, що пептидний остов вибраний серед білків, які є а) такими, що філогенетично добре збереглися, b) жорсткої структури, с) з відомою 3-D молекулярною організацією, d) невеликих розмірів і/або е) такими, що містять ділянки, які можуть бути модифіковані шляхом делеції і/або вставки без зміни властивостей стабільності. Відповідно до переважного втілення антитіло винаходу або його деривати або функціональні фрагменти характеризується тим, що вказаний пептидний остов вибраний серед i) остовів, одержаних з фібронектину, переважно, 10 домену 3 типу фібронектину, ліпокаліну, антикаліну, білка Z, що походить з домену В білка А Staphylococcus аureus, тіоредоксину А або білків з мотивами, що повторюються, такими як «анкіриновий повтор» (Kohl et ah, PNAS, 2003, vol. 100, No. 4, 1700-1705), «повтор Армадило», «багатий лейцином повтор» і «тетратрикопептидний повтор», або iii) білків-інгібіторів нейрональної NО-синтази (PIN). Інший аспект винаходу стосується функціональних фрагментів антитіла, описаних вище. Зокрема, винахід направлений на антитіло або його деривати або функціональні фрагменти, які характеризуються тим, що вказаний функціональний фрагмент вибирають серед фрагментів Fv, Fab, (Fab')2, Fab', scFv, scFv-Fс і димерних антитіл або будь-якого фрагмента, час напівжиття якого збільшений, такого як ПЕГільовані фрагменти. Такі функціональні фрагменти антитіла відповідно до винаходу складаються, наприклад, з фрагментів Fv, scFv (sc=простий ланцюг), Fab, F(ab') 2, Fab', scFv-Fc або димерних антитіл або з будь-якого фрагмента, час напівжиття якого збільшений або шляхом хімічної модифікації, такої як додавання поліалкіленгліколю, наприклад поліетиленгліколю (ПЕГілювання) (ПЕГільовані фрагменти називаються Fv-ПЕГ, scFv-ПЕГ, Fab-ПЕГ, F(ab')2-ПЕГ та Fab'-ПЕГ), або шляхом вставляння в ліпосому, мікросфери або PLGA вказаних фрагментів, які містять щонайменше один з характерних CDR винаходу, який перш за все здатний проявляти загальний вид активності, навіть частковий, того антитіла, від якого він походить. Переважно вказані функціональні фрагменти містять або включають часткову послідовність варіабельної ділянки важкого або легкого ланцюга антитіла, з якого вони були одержані, при цьому вказана часткова послідовність має бути достатньою для збереження такої самої специфічності зв’язування, як і антитіло, з якого вона походила, і достатньої афінності, переважно, яка дорівнює щонайменше 1/100, більш переважно, щонайменше 1/10 від афінності антитіла, з якого вона походила. Такий функціональний фрагмент буде містити щонайменше п'ять амінокислот, переважно, 6, 7, 8, 10, 15, 25, 50 або 100 послідовних амінокислот з послідовності антитіла, з якої вони походять. Переважно, ці функціональні фрагменти будуть типів Fv, scFv, Fab, F(ab') 2, F(ab'), scFv-Fc або димерних антитіл, які, як правило, мають таку саму специфічність зв’язування, як і антитіло, з якого вони походять. Відповідно до даного винаходу фрагменти антитіла винаходу можуть бути одержані з антитіл описаними вище способами, такими як ферментне розщеплювання, у тому числі пепсином або папаїном, і/або шляхом розщеплювання дисульфідних містків при хімічному відновленні. Фрагменти антитіла також можуть бути одержані за допомогою відомих фахівцям в даній галузі методик рекомбінантної генетики, або шляхом пептидного синтезу, наприклад за допомогою автоматичних пептидних синтезаторів, таких як ті, які продає Applied Biosystems тощо. Винахід також направлений на вихідне мишаче антитіло, а саме на антитіло відповідно до винаходу, або його деривати або функціональні фрагменти, які характеризуються тим, що вказане антитіло є мишачим антитілом, і тим, що воно містить легкий ланцюг амінокислотної послідовності SEQ ID № 15 або послідовності, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 15 при оптимальному вирівнюванні, а також 7 UA 99602 C2 5 важкий ланцюг амінокислотної послідовності SEQ ID № 16 або послідовності, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичної послідовності SEQ ID № 16 при оптимальному вирівнюванні. Для більшої чіткості нижче в таблиці 2 наведені різні амінокислотні послідовності, які відповідають антитілам винаходу. Таблиця 2 (де Mu. = мишаче, а Hu. = гуманізоване) Таблиця 2 Антитіло Нумерація CDR Загальна IMGT Важкий ланцюг Легкий ланцюг CDR-L1 CDR-L2 CDR-L3 CDR-H1 CDR-H2 CDR-H3 CDR-L1 CDR-L2 CDR-L3 CDR-H1 CDR-H2 CDR-H3 CDR-L1 CDR-L2 CDR-L3 6F4 Кабата CDR-H1 CDR-H2 CDR-H3 Mu. варіабельний домен Mu. варіабельний домен Mu. ціла Mu. ціла Hu.варіабельний домен Hu.Варіабельний домен (V1) Hu.Варіабельний домен (V2) 10 15 20 25 SEQ ID № 1 3 5 2 4 6 1 3 5 7 4 12 8 10 5 9 11 6 13 14 15 16 17 18 19 Інший конкретний аспект даного винаходу стосується химерного антитіла або його похідних сполук або функціональних фрагментів, які характеризується тим, що вказане антитіло також містить константні ділянки легкого ланцюга і важкого ланцюга, одержані з антитіла від видів, гетерологічних миші, зокрема від людини. Ще один конкретний аспект даного винаходу стосується гуманізованого антитіла або його похідних сполук або функціональних фрагментів, які характеризуються тим, що константні ділянки легкого ланцюга і важкого ланцюга, одержані з людського антитіла, є відповідно лямбда- та каппа-ділянками, і гамма-1, гамма-2 або гамма-4 ділянками. Згідно з іншим аспектом винахід стосується мишачої гібридоми, здатної секретувати моноклональне антитіло відповідно до винаходу, зокрема до гібридоми мишачого походження, зареєстрованої в Національній колекції культур мікроорганізмів (CNCM, Інститут Пастера, Париж, Франція) 6 липня 2006 під номером I-3646. Вказана гібридома була одержана шляхом злиття імунізованих мишачих спленоцитів Balb/С з клітинами мієломи Sp 2/O-Ag 14 ліній. Моноклональне антитіло, позначене тут як 6F4, або його деривати або функціональні фрагменти, які характеризуються тим, що вказане антитіло секретується гібридомою, зареєстрованою в CNCM 4 липня 2006 під номером 1-3646, безумовно є частиною даного винаходу. Антитіло винаходу також містить химерні або гуманізовані антитіла. Химерним антитілом є антитіло, яке містить природну варіабельну ділянку (легкого і важкого ланцюга), одержане з антитіла даного виду, в комбінації з константними ділянками легкого 8 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 ланцюга і важкого ланцюга антитіла від виду, гетерологічного вказаному даному виду. Антитіла або їх химерні фрагменти можуть бути одержані з використанням методик рекомбінантної генетики. Наприклад, химерне антитіло може бути вироблене шляхом клонування рекомбінантної ДНК, яка містить промотор і послідовність, що кодує варіабельну ділянку нелюдського моноклонального антитіла винаходу, зокрема мишачого, а також послідовність, що кодує константну ділянку людського антитіла. Химерне антитіло відповідно до винаходу, закодоване одним з таких рекомбінантних генів, може бути, наприклад, мишачолюдською химерою, специфічність цього антитіла визначається варіабельною ділянкою, одержаною з мишачої ДНК, а його ізотип визначається константною ділянкою, одержаною з людської ДНК. Дане посилання на способи одержання химерних антитіл в Verhoeyn et al. (BioEssays, 8:74, 1988). Термін «гуманізовані антитіла» означає, що антитіло містить ділянки CDR, одержані з антитіла нелюдського походження, а інші частини молекули антитіла одержані з одного (або декількох) людських антитіл. Крім того, деякі із залишків каркасного сегменту (який називається FR), можуть бути модифіковані з метою збереження зв'язуючої афінності (Jones et al., Nature, 321:522-525, 1986; Verhoeyen et al., Science, 239:1534-1536, 1988; Riechmann et al., Nature, 332:323-327, 1988). Гуманізовані антитіла винаходу або їх фрагменти можуть бути одержані за допомогою методик, відомих фахівцям в даній галузі (таких як, наприклад, ті, які описані в документах Singer et al., J. Immun., 150:2844-2857, 1992; Mountain et al., Biotechnol. Genet. Eng. Rev., 10:1142, 1992; і Bebbington et al., Bio/Technology, 10:169-175, 1992). Такі гуманізовані антитіла є переважними для їх використання в способах, які включають діагностику in vitro або профілактичне і/або терапевтичне лікування in vivo. Інші методики гуманізації, також відомі спеціалістам в даній галузі, такі як, наприклад, методика «CDR-прищеплення», описані PDL в Європейських патентах 0 451 261, 0 682 040, 0 939 127, 0 566 647 або в патентах США 5530101, 6180370, 5585089 та 5693761. Також можуть бути процитовані патенти США 5639641 або 6054297, 5886152 та 5877293. Крім того, винахід також стосується гуманізованих антитіл, які походять з мишачих антитіл, описаних вище. Зокрема, спосіб гуманізації для антитіла 6F4 детально описаний в прикладах 2 та 3 для легкого і важкого ланцюга відповідно. У переважному способі константні галузі легкого ланцюга і важкого ланцюга, одержані з людського антитіла, є відповідно лямбда- або каппа- і гамма-1, гамма-2 або гамма-4 ділянки. У втіленні, відповідному IgG1 ізотипу IgG1, додатковою характеристикою антитіла є прояв ефекторних функцій, таких як антитіло-залежна клітинна цитотоксичність (ADCC) і/або комплемент-залежна цитотоксичність (CDC). В іншому аспекті винаходу заявник також виявив антиген, розпізнаний антитілом відповідно до винаходу. Спосіб, що використовується для досягнення цього, детально описаний нижче в прикладі 4. JAM-A являє собою мембранний білок, який належить до суперсімейства імуноглобулінів (IgSF), в якому він стосується сімейства сполучних молекул адгезії (JAM). У людини сімейство JAM складається з декількох членів у тому числі білків JAM-A, JAM-B, JAM-C, А33 та С34. Серед представників сімейства JAM, JAM-A має найбільш високу гомологію з JAM-B та JAM-C, з ідентичністю по амінокислотах приблизно 35 % послідовностей і схожістю цих двох білків 45 %. Білок JAM-A також називають JAM A, F11R, F11 рецептор, JAM-1, JAM 1, PAM-1 або CD321. Були виявлені дві ізоформи попередника JAM, різні за довжиною позаклітинної ділянки: - ізоформа а: 299 амінокислот (SEQ ID № 61) - ізоформа b: 259 амінокислот (SEQ ID № 63). Нуклеотидні послідовності цих двох ізоформ представлені з SEQ ID № 62 для ізоформи а і SEQ ID № 64 для ізоформи b. Білок, експресований на поверхні людських клітин, має один поліпептидний ланцюг з внутрішньоклітинним С-кінцевим доменом, один трансмембранний домен (21 амінокислота) і Nкінцеву позаклітинну ділянку, яка містить два «Ig-подібних» домени. JAM-A має сайт N-глікозилювання, залишок Asn у позиції 185 для ізоформи а і 145 для ізоформи b, два дисульфідних містка: один між залишками Cys 50 та 109 в N-кінцевому домені Ig і один між залишками Cys 153 та 212 в другому домені Ig. Наявність двох позаклітинних Ig-подібних доменів була підтверджена за допомогою кристалографії (Kostrewa et al., 2001, EMBO J. 16:4391-4398; Prota et al., 2003, Proc. Natl. Acad. Sci. USA, 100:5366-5371). Ці два домени зв'язані трипептидним лінкером (послідовність VLV [127-129], ізоформа A). Ці структурні дослідження також підтвердили участь JAM-A в 9 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 гемофільних взаємодіях на поверхні клітини, що залучають позаклітинну ділянку; ця ділянка, що виробляється в рекомбінантній формі і здатна формувати гомодимери в розчині (Bazzoni et al, 2000, J. Biol. Chem. 275:30970-30976), також робить можливим визначення амінокислот, які беруть участь в цих взаємодіях: Arg 59, GIu 61, Lys 63, Leu 72, Tyr 75, Met 110, GIu 114, Tyr 119 та GIu 121. Трипептид RVE [59-61] відносно зберігається в сімействі JAM (RLE для JAM-B, RIE для JAM-C) і являє собою мінімальний мотив для формування гомодимеру (Kostrewa et al., 2001, EMBO J. 16:4391-4398). В епітеліальних та ендотеліальних клітинах JAM-А в основному міститься в щільних сполуках (Liu et al, 2000, J. Cell Sci., 113:2363-2374). Цитоплазматична ділянка містить домен PDZ типу II в С-кінцевій позиції (послідовність FLV [298-300], ізоформа а), який відповідає за взаємодію JAM-A з різними цитозольними білками, які асоціюються із щільною сполукою, які також містять PDZ-домен, такий як ZO-I, AF-6, MUPP-I та PAR-3 (Ebnet et al, 2000, J. Biol. Chem., 275:27979-27988; Itoh et al., 2001, J. Cell Biol, 154:491-498; Hamazaki et al., 2002, J. Biol. Chem., 277:455-461). Мишачі антитіла, направлені проти цієї ділянки [111-123], беруть участь у формуванні димерів, так званих антитіл J3f.1 та J10.4, які здатні інгібувати гомодимеризацію JAM-А і відновлювати епітеліальний бар'єр in vitro (Mandell et al., 2004, J. Biol. Chem., 279:1625416262). JAM-A взаємодіє з інтегрином ανβ3 і бере участь в міграції клітин ендотелію на вітронектин, ліганд інтегрину ανβ3 (Naik and Naik, 2005, J. Cell Sci. 119:490-499). АнтиJAM-А антитіло J3F.1 таким саме чином, як анти-ανβ3 антитіло, інгібує міграцію ендотеліальних клітин та ангіогенез, індукований bFGF in vitro (Naik et al., 2003, Blood, 102:2108-2114). В ендотеліальних клітинах були продемонстровані різні сигнальні шляхи: MAP-кіназі, PI3-кіназа та PKC (Naik et Naik, 2005, J. Cell Sci., 119:490-499; Naik et al., 2003, Blood, 102:2108-2114; Naik et al., 2003, Artherioscler. Thromb. Vasс. Biol., 23:2165-2171). JAM-A також експресується в моноцитах, лімфоцитах, нейтрофілах і тромбоцитах (Williams et al., 1999, MOI. Immunol., 36:1175-1188). Проте білок JAM-A спочатку був ідентифікований як рецептор антитіла F11, здатного активувати тромбоцити та індукувати їх агрегацію (Naik et al., 1995, Biochem. J., 310:155-162; Sobocka et al., 2000, Blood, 95:2600-2609). Пептиди [28-60] та [97-109] відносяться до епітопу антитіла F11 і беруть участь у феномені активації та агрегації тромбоцитів і в гомодимеризації (Babinska et al., 2002, Thromb. Haemost., 87:712-721). Щуряче антитіло BV11, направлене проти мишачої форми JAM-A, інгібує трансендотеліальну міграцію моноцитів in vitro та in vivo (Del Maschio et al., 1999, J. Exp. Med., 190:1351-1356). Ostermann і колеги (2002, Nature Immunol., 3:151-158) показали, що JAM-A був лігандом інтегрину αLβ2 або LFA-1 (лімфоцитарний функціональний антиген 1), який надекспресується у відповідь на визначені хемокіни під час розвитку протизапальної відповіді і необхідний для діапедеза або міграцій лейкоцитів до місця запалення. JAM-A, через другий Igподібний домен сприяє адгезії і трансендотеліальній міграції Т-лімфоцитів і нейтрофілів (Ostermann et al., 2002, Nature Immunol, 3:151-158), і таким чином відіграє важливу роль в залученні лейкоцитів до місця запалення. JAM- білок також має відношення до феномену вірусної інфекції. JAM-A насправді є рецептором реовірусу (вірусу, відповідального за певні типи енцефаліту) шляхом взаємодії з білком приєднання σ1 (Barton et al., 2001, Cell 104:441-451). Анти-JAM-А антитіло J10.4 інгібує зв’язування реовірусу з JAM-A (Forrest et al., 2003, J. Biol. Chem., 278:48434-48444). На сьогоднішній день жодне із згаданих вище антитіл, направлених проти людської форми JAM-A, не проявляє активність in vivo, а тим більше протипухлинну активність. Такі антитіла використовуються лише як дослідницькі засоби. Таким чином, раніше в даній галузі дійсно були відсутніми протипухлинні антитіла, активні in vitro та in vivo. Відповідно до конкретного аспекту антитіло винаходу або його деривати або функціональні фрагменти характеризуються тим, що вони здатні специфічно зв'язуватися з білком JAM-А (відповідно до англійської номенклатури «Сполучні молекули адгезії»). Відповідно до ще одного аспекту антитіло винаходу або його деривати або функціональні фрагменти характеризуються тим, що вони демонструють KD для JAM-А між приблизно 1 нМ і приблизно 1 пМ. Більш переважно, вказаний KD для JAM-A знаходиться в діапазоні між приблизно 10 нМ і приблизно 40 пМ. Вираз «KD» стосується константи дисоціації даного комплексу антитіло-антиген. KD=Kоff/Kon, де Kоff означає «коефіцієнт оff» константу для дисоціації антитіла з комплексу антитіло-антиген, а Kon означає рівень, на якому антитіло зв’язується з антигеном (Chen Y. et al., 1999, J.Mol.Biol, 293:865-881). Новий аспект даного винаходу стосується виділеної нуклеїнової кислоти, яка характеризується тим, що вона вибрана серед наступних нуклеїнових кислот (включаючи будь 10 UA 99602 C2 5 10 15 який вироджений генетичний код): а) нуклеїнова кислота, ДНК або РНК, що кодує антитіло відповідно до винаходу, або один з його дериватів або функціональних фрагментів; b) нуклеїнова кислота, комплементарна нуклеїновій кислоті, визначеній в пункті а); с) нуклеїнова кислота щонайменше з 18 нуклеотидів, здатна до гібридизації в дуже жорстких умовах щонайменше з одним з CDR з нуклеїновокислотних послідовностей SEQ ID №№ 20-31, або з послідовністю, щонайменше на 80 %, переважно, на 85 %, 90 %, 95 % та 98 % ідентичною послідовності SEQ ID №№ 20-31 при оптимальному вирівнюванні; і d) нуклеїнова кислота щонайменше з 18 нуклеотидів, здатна до гібридизації в дуже жорстких умовах щонайменше з легким ланцюгом нуклеїновокислотної послідовності SEQ ID № 32 або 36 і/або важким ланцюгом нуклеїновокислотної послідовності SEQ ID № 33, 37 або 38, або з послідовністю, щонайменше на 80 % ідентичною послідовності SEQ ID № 32 або 36 і/або 33, 37 або 38 при оптимальному вирівнюванні. У таблиці 3 нижче наведені різні нуклеотидні послідовності, що відносяться до антитіла винаходу. Таблиця 3 Антитіло Нумерація CDR Важкий ланцюг Легкий ланцюг CDR-L1 SEQ ID № 20 CDR-L2 CDR-L3 Загальна 22 24 21 23 25 20 22 24 26 23 27 28 29 24 30 31 25 CDR-H1 CDR-H2 CDR-H3 IMGT CDR-L1 CDR-L2 CDR-L3 CDR-H1 CDR-H2 CDR-H3 CDR-L1 CDR-L2 CDR-L3 6F4 Кабата CDR-H1 CDR-H2 CDR-H3 Mu. варіабельний домен Mu. варіабельний домен Mu. ціла Mu. ціла Hu.варіабельний домен Hu.Варіабельний домен (V1) Hu.Варіабельний домен (V2) 20 25 32 33 34 35 36 37 38 Терміни «нуклеїнова кислота», «нуклеїнова послідовність», «нуклеїновокислотна послідовність», «полінуклеотид», «олігонуклеотид», «полінуклеотидна послідовність» і «нуклеотидна послідовність», що використовуються взаємозамінно в даному описі, означають точну послідовність нуклеотидів, модифіковану або ні, яка визначає фрагмент або ділянку нуклеїнової кислоти, що містить або не містить неприродні нуклеотиди і є або дволанцюжковою ДНК, або одноланцюжковою ДНК, або транскрипційними продуктами вказаних ДНК. Також тут слід сказати, що даний винахід стосується нуклеотидних послідовностей в їх природному хромосомальному середовищі, тобто в їх природному стані. Послідовності даного винаходу були виділені і/або очищені, тобто вони були відібрані прямо або побічно, наприклад, шляхом копіювання, і їх навколишнє середовище щонайменше частково було змінене. Також 11 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 тут повинні бути згадані виділені нуклеїнові кислоти, одержані шляхом рекомбінантної генетики, наприклад за допомогою приймаючих клітин (клітин-хазяїнів), або шляхом хімічного синтезу. «Нуклеїнові послідовності, які демонструють відсоткову ідентичність переважної послідовності щонайменше 80 %, переважно, 85 %, 90 %, 95 % та 98 % при оптимальному вирівнюванні» означає нуклеїнові послідовності, які мають визначені зміни, в порівнянні з вихідною нуклеїновою послідовністю, такі як, зокрема, делецію, усікання, подовження, химерне злиття і/або заміну, зокрема, точкові. Переважно, це такі послідовності, які кодують такі самі амінокислотні послідовності, як і вихідна послідовність, і пов'язані із виродженням генетичного коду, або комплементарні послідовності, які можуть специфічно гібридизуватися з вихідними послідовностями, переважно, в дуже жорстких умовах, зокрема таких, які визначені нижче. Гібридизація в дуже жорстких умовах означає, що умови, пов'язані з температурою та іонною силою, вибираються таким чином, що вони дозволяють гібридизацію між двома комплементарними фрагментами ДНК. На чисто ілюстративній підставі дуже жорсткі умови етапу гібридизації з метою визначення полінуклеотидних фрагментів, описаних вище, вигідні в наступному. ДНК-ДНК або Днк-рнк-гібридизація здійснюється в два етапи: (1) передгібридизація при 42°С протягом трьох годин у фосфатному буфері (20 мМ, рН 7,5), який містить 5X SSC (1X SSC відповідає розчину 0,15 M NaCl + 0,015 М цитрату натрію), 50 % формамід, 7 % додецилсульфат натрію сульфату (SDS), 10X розчин Денхардта, 5 % декстрану сульфат та 1 % ДНК сперми лосося; (2) первина гібридизація протягом 20 годин при температурі, яка залежить від довжини зонда (наприклад: 42°C для зонда довжиною більше 100 нуклеотидів), а потім два 20-хвилинних відмивання при 20°C в 2X SSC + 2 % SDS, одне 20-хвилинне відмивання при 20°C в 0,1X SSC + 0,1 % SDS. Останнє відмивання здійснюється в 0,1X SSC + 0,1 % SDS протягом 30 хвилин при температурі 60°C для зонда довжиною більше 100 нуклеотидів. Описані вище жорсткі умови гібридизації для полінуклеотиду визначених розмірів можуть бути адаптовані фахівцем в даній галузі для довших або коротших олігонуклеотидів відповідно до процедур, описаних в Sambrook, et al. (Molecular cloning: a laboratory manual, Cold Spring Harbor Laboratory; 3rd edition, 2001). Винахід також стосується вектора, який містить нуклеїнову кислоту, описану у винаході. Винахід особливо направлений на клонуючі вектори і/або вектори експресії, які містять таку нуклеотидну послідовність. Вектори винаходу, переважно, містять елементи, які дозволяють експресувати і/або секретувати нуклеотидні послідовності даною приймаючою клітиною. Вектор, таким чином, повинен містити промотор, сигнали ініціації та термінації трансляції, а також підходящі ділянки регуляції транскрипції. Він повинен мати можливість зберігатися в стабільній формі в приймаючій клітини і може додатково мати специфічні сигнали, які визначають секрецію трансльованого білка. Ці різні елементи відбираються і оптимізуються фахівцями в даній галузі відповідно до приймаючої клітини, що використовується. Для цієї мети нуклеотидні послідовності можуть бути вставлені в векторах, що самореплікуються, у вибраного хазяїна або можуть бути інтеграційними векторами вибраного хазяїна. Такі вектори виготовляють, як правило, способами, що використовуються фахівцями в даній галузі, і одержані в результаті клони можуть бути введені у підходящого хазяїна шляхом стандартних способів, таких як ліпофекція, електропорація, тепловий шок або хімічні способи. Вектори є, наприклад векторами плазмідного або вірусного походження. Вони використовуються для трансформації приймаючих клітин для клонування або експресії нуклеотидних послідовностей винаходу. Винахід також містить приймаючі клітини, які трансформовані за допомогою або містять вектор, описаний в даному винаході. Приймаюча клітина може бути вибрана серед прокаріотичних або еукаріотичних систем, таких як, наприклад, бактерійні клітини, а також дріжджові клітини або клітини тварин, зокрема клітини ссавців. Також можуть бути використані клітини комах або рослин. Винахід також стосується тварин, відмінних від людини, які мають трансформовану клітину відповідно до винаходу. Інший аспект винаходу стосується способу виготовлення антитіла відповідно до винаходу, або одного з його функціональних фрагментів, який характеризується тим, що включає наступні етапи: а) культивування в середовищі і в культуральних умовах, підходящих для приймаючої клітини відповідно до винаходу; і b) виділення вказаного антитіла або одного з його функціональних фрагментів, одержаних таким чином, з культурального середовища або вказаних культивованих клітин. 12 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 Трансформовані клітини відповідно до винаходу використовуються в способах одержання рекомбінантних поліпептидів відповідно до винаходу. У даний винахід також входять способи одержання поліпептиду відповідно до винаходу в рекомбінантній формі, які характеризуються тим, що використовують вектор і/або клітину, трансформовану за допомогою вектора відповідно до винаходу. Переважно, клітину, трансформовану за допомогою вектора відповідно до винаходу, культивують в умовах, які роблять можливою експресію вищезгаданого поліпептиду, і відновлюють вказаний рекомбінантний пептид. Як уже згадувалося, приймаюча клітина може бути вибрана серед прокаріотичних або еукаріотичних систем. Зокрема, можна визначити нуклеотидні послідовності винаходу, якіполегшують секрецію в такій прокаріотичній або еукаріотичній системі. Вектор відповідно до винаходу, що несе таку послідовність, може бути вигідно використаний для продукції рекомбінантних білків, що секретуються. Дійсно, очищенню цих рекомбінантних цільових білків буде сприяти той факт, що вони присутні в супернатанті клітинної культури, а не усередині приймаючих клітин. Поліпептиди винаходу можуть також бути одержані шляхом хімічного синтезу. Один такий спосіб одержання також є об'єктом винаходу. Фахівцям в даній галузі відомі способи хімічного синтезу, такі як твердофазні методики (див. зокрема Steward et al., 1984, Solid phase peptides synthesis, Pierce Chem. Company, Rockford, 111, 2nd ed.) або часткові твердофазні методики, шляхом конденсації фрагментів або шляхом звичайного синтезу в розчині. У винахід також входять поліпептиди, які одержані шляхом хімічного синтезу і можуть містити відповідні неприродні амінокислоти. Антитіла або їх деривати або функціональні фрагменти можуть бути одержані за допомогою способу винаходу, який також входить в даний винахід. Відповідно до ще одного аспекту даний винахід стосується антитіла, описаного вище, яке характеризується тим, що воно крім того здатне специфічно зв'язуватися з рецептором сімейства людської тирозинкінази і/або може специфічно інгібувати тирозинкіназну активність такого рецептора. Відповідно до нового втілення винахід стосується антитіла або його похідних сполук або функціональних фрагментів, що складаються з антитіла, яке є біспецифічним в тому значенні, що включає другий мотив, здатний взаємодіяти з будь-яким рецептором причетним до розвитку пухлин, таким як, наприклад, VEGFR, VEGF, EGFR, IGF-1R, HER2neu, HGF, cMET, FGF, тетраспаніни, інтегрини, CXCR4 або CXCR2. Відповідно до першого втілення одне таке антитіло складається з біспецифічного антитіла і містить другий мотив, який специфічно інгібує зв’язування ЕФР з рецептором людського епідермального фактора росту (EGFR) і/або специфічно інгібує тирозинкіназну активність вказаного EGFR. Відповідно до ще більш переважного аспекту винаходу вказаний другий антиEGFR мотив походить з моноклонального антитіла цетукисмаб (C225 або ербітукс), матузумаб, huR3, HuMax-EGFR або панітумумаб. Відповідно до другого втілення антитіло відповідно до винаходу складається з біспецифічного антитіла і містить другий мотив, який специфічно інгібує активність, модулюючи рецептор HER2/neu, і/або специфічно інгібує тирозинкіназну активність вказаного рецептора HER2/neu. Зокрема, вказаний другий мотив антиHER2/neu походить з мишачого моноклонального антитіла 4D5 або 2C4 або з гуманізованого антитіла трастузумаб або пертузумаб. Відповідно до третього втілення антитіло відповідно до винаходу складається з біспецифічного антитіла і містить другий мотив, який специфічно інгібує зв’язування фактора росту гепатоцитів (HGF) з cMET-рецептором і/або специфічно інгібує тирозинкіназну активність вказаного рецептора cMET. Відповідно до четвертого втілення антитіло відповідно до винаходу складається з біспецифічного антитіла і містить другий мотив, який специфічно інгібує активність, модулюючи рецептор IGF-1R, і/або специфічно інгібує тирозинкіназну активність вказаного рецептора IGFIR. Зокрема, вказаний другий антиIGF-LR мотив походить з мишачого моноклонального антитіла 7C10, з відповідного гуманізованого антитіла h7C10 (Goetsch et al., міжнародна патентна заявка WO 03/059951), з антитіл hEM164 (Maloney et al., Cancer Res., 2003, 63 (16):5073-5083), з антиlGF-1R антитіл, одержаних Abgenix (см. патентну заявку США 2005/281812) або з Mab 39, 1H7 (Li et al., Cancer Immunol. Immunother., 2000, 49(4-5):243-252) або 4G11 (Jackson-Booth et al., Horm. Metab. Res., 2003, 35(11-12):850-856). Нарешті, відповідно до останнього втілення антитіло винаходу складається з біспецифічного антитіла і містить другий мотив, здатний взаємодіяти з рецепторами будь-якого типу, причетними до розвитку пухлини, наприклад з такими як VEGFR, VEGF, FGF (фактор росту 13 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 фібробластів) або будь-яким членом сімейства CXCR (хемокінових рецепторів), таким як CXCR2 або CXCR4, але не обмежується цими прикладами. Також підходящими для згадування є антиCD20-антитіла, такі як ритуксимаб, ібритумомаб або тозитумомаб; антиCD33-антитіла, такі як гемтузумаб або лінтузумаб; антиCD22-антитіла, такі як епратузумаб; антиCD52-антитіла, такі як алемтузумаб; антиEpCAM-антитіла, такі як едреколомаб Ch 17-1А або IGN-101; антитіла антиCTP21 або 16, такі як Xactin; антиДНК-Ag131 антитіла, такі як I-Cotara ТNТ-1; антиMUC1-антитіла, такі як пемтумомаб або R1150; антиMUC18-антитіла, такі як ABX-МА1; антиGD3-антитіла, такі як мітумомаб; антиECA-антитіла, такі як Cea Vac або лабетузумаб; антиCA125-антитіла, такі як OvaRex; антиHLA-DR-антитіла, такі як аполізумаб; антиCTLA4-антитіла, такі як MDX-010; антиPSMA-антитіла, такі як MDX-070, 111 90 177 In і Y-J591, Lu J591, J591-DM1; анти-Льюіс Y-антитіла, такі як IGN311; антиангіогенні антитіла, такі як AS1405 і 90YmuBC1; антиTrail-R1-антитіла, такі, як TRAIL R1mAb або TRAIL R2mAb. Біспецифічні або біфункціональні антитіла являють собою друге покоління моноклональних антитіл, в яких дві різних варіабельних ділянки об'єднані в одній молекулі (Hollinger and Bohlen, 1999, Cancer and metastasis, rev. 18:411-419). І у діагностичній, і в терапевтичній сферах була продемонстрована їх користь відносно їх здатності приваблювати нові ефекторні функції або направляти деякі молекули на поверхню пухлинних клітин; такі антитіла можуть бути одержані хімічними способами (Glennie MJ et al., 1987, J. Immunol. 139, 2367-2375; Repp R. et al., 1995, J. Hemat., 377-382) або соматичними способами (Staerz U.D. and Bevan M.J., 1986, PNAS 83, 14531457; Suresh M.R. et al., 1986, Method Enzymol, 121 :210-228), а також, переважно, генетичними інженерними методиками, які роблять можливою гетеродимеризацію і тим самим полегшують очищення бажаного антитіла (Merchand et al., 1998, Nature Biotech., 16:677-681). Ці біспецифічні антитіла можуть бути сконструйовані як цілі IgG, біспецифічні Fab'2, Fab'ПЕГ, димерні антитіла або біспецифічні scFv, а також як тетравалентні біспецифічні антитіла, в яких для кожного цільового антигену є два зв'язуючих сайти (Park et al., 2000, Mol. Immunol., 37(18):1123-30), або як їх фрагменти, описані вище. Окрім економічної переваги, обумовленої тим, що виготовлення і введення біспецифічного антитіла дешевше, ніж виготовлення двох специфічних антитіл, використання таких біспецифічних антитіл також має перевагу, пов'язану із зниженням токсичності лікування. Дійсно, використання біспецифічного антитіла дозволяє зменшити загальну кількість циркулюючих антитіл і, отже, можливу токсичність. У переважному втіленні винаходу біспецифічне антитіло є двовалентним або тетравалентним. Нарешті, даний винахід стосується описаного вище антитіла або його похідних сполук або функціональних фрагментів для застосування як ліків. Винахід також стосується фармацевтичної композиції, яка містить як активний інгредієнт сполуку, яка складається з антитіла винаходу або одного з його дериватів або функціональних фрагментів. Переважно, вказане антитіло доповнюють ексципієнтом і/або фармацевтично прийнятним носієм. Відповідно до ще одного втілення даний винахід також стосується описаної вище фармацевтичної композиції, яка містить щонайменше другу протипухлинну сполуку, вибрану серед сполук, здатних специфічно інгібувати тирозинкіназну активність рецепторів, таких як IGFIR, EGFR, HER2/neu, cMET, VEGFR або VEGF, або будь-яких інших протипухлинних сполук, відомих фахівцям в даній галузі. У другому переважному аспекті винаходу вказана друга сполуку може бути вибрана серед виділених антитіл антиEGFR, антиIGF-IR, антиHER2/neu, антиcMET, VEGFR, VEGF і так далі або їх функціональних фрагментів і дериватів, здатних інгібувати проліферативну і/або антиапоптотичну і/або ангіогенну і/або індуктивну активність метастатичної дисемінації, якій сприяють вказані рецептори. Відповідно до ще одного втілення винаходу композиція як комбінований продукт для застосування в одночасній, роздільній або подовженій формі, містить також щонайменше один інгібітор тирозинкіназної активності рецепторів, таких як IGF-IR, EGFR, HER2/neu, cMET та VEGFR. В іншому переважному втіленні вказаний інгібітор тирозинкіназної активності цих рецепторів вибраний з групи, яка містить похідні природні агенти, діанілінофталіміди, піразоло- або піролопіридопіримідини або хіназоліни. Такі інгібуючі агенти відомі фахівцям в даній галузі описані в літературі (Ciardiello F., Drugs 2000, Suppl. 1, 25-32). Інше втілення додатково до винаходу включає композицію, описану вище, яка, як комбінований продукт для застосування в одночасній, роздільній або подовженій формі, містить також цитотоксичний/цитостатичний агент. 14 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 «Одночасне застосування» означає введення в єдиній лікарській формі обох сполук, які входять в композицію. «Роздільне застосування» означає одночасне введення обох сполук, які входять в композицію, в різних лікарських формах. «Відстрочене застосування» означає послідовне введення обох сполук композиції, кожна з яких входить в різні лікарські форми. Звичайно композиція відповідно до винаходу значно підвищує ефективність лікування раку. Іншими словами, терапевтичний ефект антитіла винаходу посилюється несподіваним чином шляхом введення цитотоксичного агента. Ще однією важливою подальшою перевагою, одержаною за допомогою композиції винаходу, є можливість використання більшнизьких ефективних доз активного інгредієнта, завдяки чому можна уникнути або зменшити ризик виникнення побічних ефектів, зокрема ефекту цитотоксичного агента. Крім того, ця композиція дозволяє досягти очікуваного терапевтичного ефекту в коротші терміни. Термін «терапевтичний протипухлинний агент» або «цитотоксичний агент» означає речовину, яка при введенні його пацієнту лікує або запобігає розвитку у пацієнта раку. Необмежувальні приклади таких агентів включають «алкілуючі» агенти, антиметаболіти, протипухлинні антибіотики, мітотичні інгібітори, інгібітори хроматинового функціонування, антиангіогенні агенти, антиестрогени, антиандрогени та імуномодулятори. Такі агенти наведені, наприклад, в VIDAL, на сторінці, присвяченій сполукам, пов'язаним з онкологією і гематологією, під заголовком «Цитотоксичні»; цитотоксичні сполуки, наведені за допомогою посилання на цей документ, наводяться в даному документі як переважні цитотоксичні агенти. Термін «алкілуючий агент» означає будь-яку речовину, яка може ковалентно зв'язатися або може алкілувати будь-яку молекулу, переважно нуклеїнову кислоту (наприклад, ДНК) в клітини. Приклади таких алкілуючих агентів включають азотні аналоги гірчичного газу, такі як мехлоретамін, хлорамбуцил мелфалан, хлоргідрат, піпоброман, преднімустин, гідрофосфат натрію або естрамустин; оксазафосфорини, такі як циклофосфамід, алтретамін, трофосфамід, сульфофосфамід або іфосфамід; азиридини або етиленіміни, такі як тіотепа, триетиленамін або альтретамін; похідні нітрозосечовини, такі як кармустін, стрептозоцин, фотемустин або ломустин; алкілсульфонати, такі як бусульфан, треосульфан або імпросульфан; триазени, такі як дакарбазин; або платинові комплекси такі як цисплатин, оксаліплатин або карбоплатин. Термін «антиметаболіт» означає речовину, яка блокує ріст і/або клітинний метаболізм шляхом втручання у визначені види активності, звичайно в синтез ДНК. Приклади антиметаболітів включають метотрексат, 5-фторурацил, флоксуридин, 5-фтордезоксиуридин, капецитабін, цитарабін, флударабін цитозин-арабінозид, 6-меркаптопурин (6-МП), 6-тіогуанін (6ТГ), хлордезоксіаденозин, 5-азацитидин, гемцитабін, кладрибін, дезоксикоформіцин і пентостатин. Термін «протипухлинний антибіотик» означає сполуку, яка може запобігти або інгібувати синтез ДНК, РНК і/або білків. Приклади таких протипухлинних антибіотиків включають доксорубіцин, даунорубіцин, ідарубіцин, вальбруцин, мітоксантрон, дактиноміцин, мітраміцин, плікаміцин, мітоміцин C блеоміцин і прокарбазин. «Мітотичні інгібітори» перешкоджають нормальній прогресії клітинного циклу і мітозу. Звичайно інгібітори мікротрубочок або «таксоїди», такі як паклітаксел і доцетаксел, здатні інгібувати мітоз. Алкалоїди Вінка, такі як вінбластин, вінкристин, віндезин і вінорелбін також здатні інгібувати мітоз. «Інгібіторами хроматину» або «інгібіторами топоізомерази» є речовини, які перешкоджають нормальному функціонуванню білків, що формують хроматин, таких як топоізомерази I та II. Приклади таких інгібіторів включають топоізомеразу I, камптотецин і його похідні, такі як іринотекан або топотекан; топоізомеразу II, етопозид, етопозиду фосфат і теніпозид. «Антиагіогенний агент» являє собою будь-які ліки, сполуки, речовину або агент, який інгібує ріст кровоносних судин. Приклади антиагіогенних агентів включають разоксин, маримастат, батимастат, приномастат, таномастат, іломастат, CGS-27023A, галофугінон, COL-3, неовастат, BMS-275291 талідомід, CDC 501, DMXAA, L-651582, скваламін, ендостатин, SU5416, SU6668, інтерферон-альфа, EMD 121974, інтерлейкін-12, IM862, ангіостатин і вітаксин, але не обмежуються ними. Терміни «антиестроген» або «естрогеновий антагоніст» означають будь-яку речовину, яка зменшує, є антагоністом або інгібує дію естрогену. Прикладами таких агентів є тамоксифен, тореміфен, ралоксифен, дролоксифен, іодоксифен, анастрозол, летрозол та екземестан. Терміни «антиандроген» або «андрогенний антагоніст» означають будь-яку речовину, яка зменшує, є антагоністом або інгібує дію андрогенів. Приклади антиандрогенів включають 15 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 флутамід, нілутамід, бікалутамід, спіронолактон, ципротерон ацетат, фінастерид і цимітидин. Імуномодулятори являють собою речовини, які стимулюють імунну систему. Приклади імуномодуляторів включають інтерферон, інтерлейкіни, такі як альдеслейкін, ОСТ-43, денілейкін дифтитокс або інтерлейкін-2, фактори некрозу пухлини, такі як тазонермін, або інші типи імуномодуляторів, такі як лентинан, сизофіран, рокінімекс, підотимод, пегадемаз, тимопентин, полі I:С або левамізол у поєднанні з 5-фторурацилом. Для одержання докладнішої інформації, фахівець в даній галузі може звернутися до керівництва, опублікованого Французькою асоціацією вчителів терапевтичної хімії під назвою «Therapeutic chemistry, vol. 6, Antitumor drugs and perspectives in the treatment of cancer, TEC and DOC edition, 2003 [in French]». У частинному переважному втіленні вказана композиція винаходу як комбінований продукт характеризується тим, що вказаний цитотоксичний агент хімічно пов'язаний з вказаним антитілом для одночасного використання. У частинному переважному втіленні вказана композиція характеризується тим, що вказаний цитотоксичний/цитостатичний агент вибраний серед інгібіторів веретена ділення або стабілізаторів, переважно вінорелбін і/або вінфлюнін і/або вінкристин. Для того, щоб полегшити зв’язування вказаного цитотоксичного агента з антитілом відповідно до винаходу, між двома сполуками, що зв'язуються, можна ввести спейсерні молекули, такі як полі(алкілен)гліколь поліетиленгліколь, або амінокислоти; або в іншому втіленні можна використовувати активні похідні вказаних цитотоксичних агентів, в яких були введені функціональні групи, здатні реагувати з вказаним антитілом. Ці методики зв’язування добре відомі фахівцям в даній галузі і не будуть обговорюватися детальніше в даному описі. Інші інгібітори EGFR включають моноклональні антитіла C225 та антиEGFR 22Mab (ImClone Systems Incorporated), ABX-EGF (Abgenix/Cell Genesys), EMD-7200 (Merck KgaA) або сполуки ZD-1834, ZD-1838 і ZD-1839 (AstraZeneca), PKI- 166 (Novartis), PKI- 166/CGP-75166 (Novartis), PTK 787 (Novartis), CP 701 (Cephalon), флуномід (Pharmacia/Sugen), CI-1033 (Warner Lambert Parke Davis), CI-1033/PD 183, 805 (Warner Lambert Parke Davis), CL-387, 785 (Wyeth-Ayerst), BBR-1611 (Boehringer Mannheim GMBH/Roche), Naamidine A (Bristol-board Myers Squibb), RC3940-II (Pharmacia), BIBX-1382 (Boehringer Ingelheim), OLX-103 (Merck & Co), VRCTC-310 (Ventech Research), ЕФР-зв’язуючий токсин (Seragen Inc.), DAB-389 (Seragen/Lilgand), ZM252808 (Imperial Cancer Research Fund), RG-50864 (INSERM), LFM-A12 (Parker Hughes Center Cancer), WHI-P97 (Parker Hughes Center Cancer), GW-282974 (Glaxo), KT-8391 (Kyowa Hakko) або «EGFR-вакцину» (York Medical/Centro of Immunologia Molecular), але не обмежуються ними. Інший аспект винаходу стосується композиції, яка характеризується тим, що щонайменше одне з вказаних антитіл або його дериватів або функціональних фрагментів кон'юговане з клітинним токсином і/або радіоізотопом. Переважно вказаний токсин або вказаний радіоізотоп здатний запобігти росту або проліферації пухлинної клітини, зокрема повністю інактивувати вказану пухлинну клітину. Також, переважно, вказаний токсин є токсином ентеробактерій, зокрема екзотоксином А від Pseudomonas. Радіоізотопи, переважно, комбіновані з терапевтичними антитілами, є радіоізотопами, які 131 90 199 100 67 217 випромінюють гамма-промені, переважно йод , ітрій , золото , паладій , мідь , вісмут і 211 сурьма . Також в терапії можуть використовуватися радіоізотопи, випромінюючі альфа- і бетапромені. «Токсин або радіоізотоп, комбінований щонайменше з одним антитілом винаходу або його функціональним фрагментом» означає будь-який засіб, який дозволяє зв'язати вказаний токсин або вказаний радіоізотоп щонайменше з одним антитілом, зокрема шляхом ковалентного зв’язування двох сполук, з або без введення зв'язуючої молекули. Приклади агентів, які забезпечують хімічне (ковалентне), електростатичне або нековалентне зв’язування всього кон'югата або частини його елементів, включають зокрема бензохінон, карбодіїмід і особливо EDC (1-етил-3-[3-диметил-амінопропіл]-карбодіїмід-гідрохлорид), дималеїмід дитіобіс-нітробензойна (DTNB) кислота, N-сукцинімідил S-ацетил-тіоацетат (SATA), зв'язуючі агенти з однією або більше групами, з однією або більше фенілазидними групами, що реагують з ультрафіолетовими (УФ) променями, найбільш переважно, N-[4(азидосаліциламіно)бутил]-3'-(2'-піридилдитіо)-пропіонамід (APDP), N-сукцинімід-іл-3-(2піридилдитіо)пропіонат (SPDP) і 6-гідразино-нікотинамід (HYNIC). Інша форма зв’язування, зокрема для радіоізотопів, може включати використання біфункціональних іонних хелатуючих агентів. Приклади таких хелатуючих агентів включають хелатуючі агенти, одержані з ЕДТА (етилендіамінтетраоцтова кислота) або ДТПК (діетилентриамінпентаоцтова кислота) які були 16 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 розроблені для зв’язування металів, зокрема радіоактивних металів, з імуноглобулінами. Таким чином, ДТПК та її похідні можуть бути замінені на вуглецевий ланцюг різними групами так, щоб підвищити стабільність і жорсткість комплексу ліганд-метал (Krejcarek et al., 1977; Brechbiel et al., 1991; Gansow, 1991; патент США 4831175). Наприклад, ДТПК (діетилентриамінпентаоцтова кислота) та її похідні, які вже давно широко використовуються в ліках і біології або в своїй вільній формі, або в комплексі з іоном металу, мають відмітну характеристику формування стабільних хелатів з іонами металів, які можуть бути зв'язані з білками терапевтичного або діагностичного інтересу, наприклад антитілами, утворюючи радіо-імунокон'югати для терапії раку (Meases et al., 1984; Gansow et al., 1990). Також переважно, щоб вказане щонайменше одне антитіло винаходу, яке формує вказаний кон'югат, було вибране серед його функціональних фрагментів, зокрема фрагментів, які втратили свої Fc-компоненти, таких як scFv-фрагменти. Даний винахід також містить застосування композиції для виготовлення ліків, призначених для профілактики і лікування раку. Даний винахід стосується застосування антитіла або його деривату або функціонального фрагмента, переважно гуманізованого і/або композиції відповідно до винаходу для виготовлення ліків для інгібування росту пухлинних клітин. Звичайно даний винахід стосується застосування антитіла або його деривату або функціонального фрагмента, переважно гуманізованого, і/або композиції для виготовлення ліків для профілактики і лікування раку. Переважні ракові захворювання, яким можуть запобігти і/або які можуть бути вилікувані, включають рак простати, остеосаркому, рак легенів, рак молочної залози, рак ендометрія, рак товстої кишки, множинну мієлому, рак яєчників, рак підшлункової залози або будь-який інший рак. У переважному способі вказаний рак є раком, вибраним серед естроген-залежного раку молочної залози, недрібноклітинного раку легені, раку товстої кишки і/або раку підшлункової залози. Інший аспект даного винаходу стосується застосування антитіла в описаному способі діагностики переважно in vitro, захворювань, пов'язаних з рівнем експресії JAM-A. Переважно вказаними захворюваннями, пов'язаними з білком JAM-А, у вказаному діагностичному способі є ракові захворювання. Таким чином, антитіла винаходу або їх деривати або функціональні фрагменти можуть бути використані в способі виявлення і/або кількісної оцінки білка JAM-A в біологічному зразку in vitro, зокрема в діагностиці захворювань, пов'язаних з аномальною експресією цього білка, таких як ракові захворювання, де вказаний спосіб включає наступні етапи: а) розміщення біологічних зразків у контакті з антитілом відповідно до винаходу або з його дериватом або функціональним фрагментом, b) демонстрація можливо сформованого комплексу антиген-антитіло. Таким чином, даний винахід також містить набори і допоміжні матеріали для здійснення описаного способу (для виявлення експресії гена Legionella pneumophila штаму Paris або асоційованого організму або для виявлення і/або визначення бактерії Legionella pneumophila штаму Paris або асоційованих мікроорганізмів), включаючи наступні елементи: а) поліклональне або моноклональне антитіло винаходу; б) додатково реагенти для утворення середовища, сприятливого для імунологічних реакцій; с) додатково реагенти, які показують комплекси антиген-антитіло, одержані за допомогою імунологічної реакції. Вигідно, що антитіла або їх функціональні фрагменти можуть бути імобілізовані на підкладці, зокрема на білковому чіпі. Один з таких білкових чіпів є об'єктом винаходу. Вигідно, що білкові чіпи можуть використовуватися в наборах або допоміжних матеріалах необхідних для виявлення і/або кількісної оцінки білка JAM-A в біологічному зразку. Необхідно вказати, що термін «біологічний зразок» стосується в даному документі зразків, взятих з живого організму (зокрема крові, тканини, органу або інших зразків, взятих від ссавців, зокрема від людини), або будь-яких зразків, які ймовірно містять один такий JAM-А -білок (наприклад, зразок клітин, трансформованих у разі необхідності). Вказане антитіло або його функціональний фрагмент може знаходитися у формі імунокон'югата або поміченого антитіла для того, щоб одержати сигнал, який може бути виявлений і/або кількісно оцінений. Мічені антитіла винаходу або їх функціональні фрагменти включають, наприклад, кон'югати антитіла (імунокон'югати), які можна комбінувати, наприклад, з ферментами, такими як пероксидаза, лужна фосфатаза α-D-галактозидаза, глюкозооксидаза, глюкоамілаза, карбоангідраза, ацетилхолінестераза лізоцим, малатдегідрогеназа або глюкозо-6-фосфат 17 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 дегідрогеназа, або з молекулами, такими як біотин, дигоксигенін або 5-бромдезоксіуридин. Флуоресцентні мітки можна також комбінувати з антитілами винаходу або їх функціональними фрагментами, включаючи, зокрема, флуоресцеїн і його похідні, флюорохром, родамін і його похідні, зелений флуоресцентний білок (GFP), дансил, умбеліферон і так далі. У таких кон'югатах антитіла винаходу або їх функціональні фрагменти можуть бути виготовлені за допомогою способів, відомих фахівцям в даній галузі. Вони можуть бути зв'язані з ферментами або флуоресцентними мітками безпосередньо; через спейсерну групу або зв'язуючу групу, таку як поліальдегід, глутаральдегід, етилендіамінтетраоцтова кислота (ЕДТА) або діетилентриамінпентаоцтова кислоти (ДТПК); або у присутності зв'язуючих агентів, таких як згадані вище терапевтичні кон'югати. Кон'югати, що несуть флуоресцентні мітки, можуть бути виготовлені шляхом реакції з ізотіоціанатом. Інші кон'югати можуть також включати хемілюмінесцентні мітки, такі як люмінол і діоксетан, 123 біолюмінесцентні мітки, такі як люциферазу і люциферин, або радіоактивні мітки, такі як йод , 125 126 133 77 99m 111 113m 67 68 95 97 йод , йод , йод , бром , технецій , індій , індій , галій , галій , рутеній , рутеній , 103 105 107 203 99m 101 105 47 121m рутеній , рутеній , ртуть , ртуть , реній , реній , реній , скандій , телурій , 122m 125m 165 167 168 18 199 131 телурій , телурій , тулій , тулій , тулій , фтор , ітрій і йод . Існуючі і відомі фахівцям в даній галузі способи зв’язування радіоізотопів з антитілами, або безпосередньо, або через хелатуючий агент, такий як зазначена вище ЕДТА або ДТПК, можуть використовуватися 125 для діагностичних радіоізотопів. Таким чином, слід зазначити маркування [I ]Na за допомогою техніки хлорамін-T [Hunter W.M. and Greenwood F.C. (1962) Nature 194:495]; маркування 99m технецієм , описане Crockford et al. (патент США 4424200) або зв’язування через ДТПК, описане Hnatowich (патент США 4479930). Винахід також стосується застосування антитіла відповідно до винаходу для виготовлення ліків для специфічного наведення сполуки, яка біологічно активна по відношенню до клітин, які експресують або надекспресують білок JAM-A. За змістом даного опису «біологічно активна сполука» являє собою будь-яку сполуку, здатну модулювати, зокрема інгібувати, клітинну активність, зокрема ріст, проліферацію, транскрипція і генну трансляцію. Винахід також стосується діагностичного реагенту in vivo, що складається з антитіла відповідно до винаходу або його функціонального фрагмента, переважно, поміченого радіоактивним ізотопом, і його застосування в медичних цілях, зокрема для виявлення ракових захворювань, пов'язаних з клітинною експресією або надекспресією білка JAM-A. Винахід також стосується композиції як комбінованого продукту або кон'югату анти- JAMA/токсин або радіоізотопу відповідно до винаходу, який використовується як ліки. Переважно, вказана композиція у вигляді комбінованого продукту або вказаний кон'югат буде доповнений ексципієнтом і/або фармацевтичним носієм. У даному описі «фармацевтичний носій» означає сполуку або комбінацію сполук, що входять у фармацевтичну композицію, які не викликають вторинних реакцій, і які наприклад полегшують введення активних сполук, збільшують час їх життя і/або ефективності в організмі, підвищують їх розчинність в розчині або покращують їх зберігання. Такі фармацевтичні носії добре відомі фахівцям в даній галузі і можуть бути адаптовані відповідно до характеру і шляхом введення вибраних активних сполук. Переважно, такі сполуки будуть вводитися системним шляхом, зокрема внутрішньовенним, внутрішньом'язовим, внутрішньошкірним, внутрішньочеревинним, підшкірним або оральним шляхом. Більш переважно, композиція, яка складається з антитіла відповідно до винаходу, буде вводитися декількома дозами через рівні проміжки часу. Шляхи їх введення, графіки дозування та оптимальні галенові форми можуть бути визначені відповідно до критеріїв, які звичайно беруться до уваги при встановленні підходящого пацієнту лікування, такими як, наприклад, вік пацієнта і маса тіла, серйозність його загального стану, його переносимість лікування і можливі побічні ефекти. Таким чином, винахід стосується застосування антитіла або одного з його функціональних фрагментів для виготовлення ліків для специфічної дії сполуки, яка біологічно активна по відношенню до клітин, що експресують або надекспресують JAM-A. Інші характеристики і переваги винаходу представлені далі в описі з прикладами і малюнками, легенди до яких наведені нижче. ЛЕГЕНДИ ДО ГРАФІЧНИХ МАТЕРІАЛІВ На фіг. 1 показані відповідні послідовності важкого і легкого ланцюгів мишачого 6F4 антитіла. CDR підкреслені або виділені жирним шрифтом (відповідно до нумерації Кабата). Фіг. 2А та 2В представляють відповідні узгодження ділянок V (фіг. 2А) та J (фіг. 2В) мишачого антитіла 6F4 і вибраної мишачої клітинної лінії, а саме IGKV19-93*01 (SEQ ID № 39) 18 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 для ділянки V та IGKJ1*01 (SEQ ID № 40) для ділянки J. Фіг. 3А та 3В представляють відповідні узгодження ділянок V (фіг. 3А) та J (фіг. 3В) мишачого антитіла 6F4 і вибраної людської клітинної лінії, а саме: IGKV1-33*01 (SEQ ID № 41) для ділянки V та IGKJ1*01 (SEQ ID № 42) для ділянки J. Фіг. 4 представляє білкову послідовність легкого ланцюга антитіла 6F4 із посиланням на відповідні системи нумерації Кабата та IMGT. Фіг. 5А, 5В та 5С представляють відповідні узгодження ділянок V (фіг. 5А), D (фіг. 5В) та J (фіг. 5С) мишачого антитіла 6F4 і вибраної мишачої клітинної лінії, а саме IGHV1S135*01 (SEQ ID № 43) для ділянки V, IgHDST4*01 (SEQ ID № 44) для ділянки D та IgHJ2*01 (SEQ ID № 45) для ділянки J. Фіг. 6A, 6B та 6C представляють відповідні узгодження ділянок V (фіг. 6А), D (фіг.6В) та J (фіг. 6С) мишачого антитіла 6F4 і вибраної людської клітинної лінії, а саме IGHV1-f*01 (SEQ ID № 46) для ділянки V, IGHD1-1*01 (SEQ ID № 47) для ділянки D та IGHJ4*01 (SEQ ID № 48) для ділянки J. Фіг. 7 є білковою послідовністю важкого ланцюга антитіла 6F4 із посиланням на відповідні системи нумерації Кабата та IMGT. Фіг. 8А та 8В представляють 6F4-сефарозне імуноочищення антигену 6F4 від HТ-29 клітинних мембран. Також представлений аналіз зібраних фракцій за допомогою електрофорезу в поліакриламідному гелі у присутності додецилсульфату натрію (SDS-PAGE) (фіг. 8А) і вестерн-блотінгу (фіг. 8B). Фіг. 9А та 9В представляють аналіз за допомогою електрофорезу SDS-PAGE (фіг. 9А) і вестерн-блотінгу (фіг. 9В) імуноочищеного білка. Два очищення (№ 1 та № 2) були проведені і проаналізовані у відновлюваних і невідновлюваних умовах. Фіг. 10 представляє аналіз за допомогою мас-спектрометрії MALDI-TOF суміші пептидів, виділених після триптичного гідролізу. Фіг. 11А та 11В включає підтвердження білка, визначеного за допомогою вестерн-блотінгу (у невідновлювальних умовах): показано використовуване антитіло 6F4 (фіг. 11А) і протилюдське поліклональне антитіло JAM-A (фіг. 11В). Фіг. 12 показує специфічність антитіла 6F4 для людського білка JAM-A. Об'єми, в яких зберігають кожен білок, становлять 250 нг, 25 нг та 10 нг. Фіг. 13 представляє сенсограми, одержані через 2 хвилини після введення (подвійна стрілка) антитіла 6F4 при 100 нм в HBS-EP буфер з мишачим Fc-білком JAM1 (проточна кювета № 1, нижній графік) і з мишачим Fc-білком JAM1 (проточна кювета № 2, верхній графік) з часом дисоціації 5 хвилин при 25°С і швидкостях потоку 30 мкл/хв (CM4: m-JAM1-Fс 501,6 RU (Fс1) та 511,5 RU (Fс2)). Фіг. 14 представляє сенсограми, одержані з подвійним контролем (Fc2-Fс1)6F4(Fс2Fс1)HBS-EP. Крива побудована з використанням сорбційної моделі A+В Ленгмюра. Розрахунок 5 -1 -1 кінетичних параметрів (чорна крива) полягають в наступному: ka = (1,38 ± 0,001)*10 M с ; kd = -6 -1 2 (0,25 ± 1,58)*10 с ; Rmax (загальний підбір) = 371 RU; κ = 0,853. Фіг. 15 ілюструє протипухлинну активність антитіла 6F4 в ксенотрансплантантній моделі клітин MCF-7 на швейцарських голих (Swiss nude) мишах. Антитіло 6F4 тестували за допомогою інтраперитонеальної системи в неочищеній формі (перитонеальна порожнинна рідина), при теоретичній дозі 250 мкг/миша двічі в тиждень. Антитіло 9G4 є антитілом того самого ізотипу (IgG1), нехарактерним в плані вимірюваної активності. Фіг. 16 ілюструє експресію білка JAM-A, що розпізнається моноклональним антитілом 6F4 на поверхні клітин різних пухлинних ліній. Фіг. 17 представляє послідовність гуманізованого 6F4 VL-домену, де: * відповідає амінокислотам, зміненим de facto по відношенню до їх людських аналогів, 1 відповідає амінокислотам, що аналізуються на предмет їх здатності бути гуманізованими, людський залишок позначений внизу знаком, а 2 відповідає амінокислотам, які залишаються мишачими в гуманізованому 6F4 VL-домені. Фіг. 18 є послідовністю гуманізованого 6F4 VH-домену, де: * відповідає амінокислотам, зміненим de facto по відношенню до їх людських аналогів, 1 відповідає амінокислотам, що аналізуються на предмет їх здатності бути гуманізованими, людський залишок позначений внизу знаком, а 2 відповідає амінокислотам, які залишаються мишачими в гуманізованому 6F4 VН-домені. Фіг. 19 ілюструє зворотну регуляцію JAM-A in vitro, викликану моноклональним антитілом 6F4. Фіг. 20 ілюструє інгібування проліферації пухлинних клітин in vivo, викликане моноклональним антитілом 6F4. 19 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 21 представляє зворотну регуляцію JAM-A in vivo викликану моноклональним антитілом 6F4. Фіг. 22 представляє криві порівняння 6F4 та його F(ab')2-фрагмента на моделі in vivo MCF-7. Фіг. 23 ілюструє порівняння нормальної і пухлинної експресії JAM-A в тканинах щитовидної залози. Фіг. 24 ілюструє порівняння нормальної і пухлинної експресії JAM-A в легеневих тканинах. Фіг. 25 ілюструє порівняння нормальної і пухлинної експресії JAM-A в тканинах молочної залози. Фіг. 26 представляє криві, що ілюструють активність in vivo 6F4 на лінії А431 ксенотрансплантантної епідермоїдної карциноми у голих (nude) мишах. Фіг. 27 ілюструє вплив антитіла 6F4 на а) неспецифічну лімпофпроліферацію, індуковану ФГА, і b) процес представлення антигену. Перший експеримент з двома незалежними донорами. Фіг. 28 ілюструє вплив антитіла 6F4 на а) неспецифічну лімпофпроліферацію, індуковану ФГА, і b) процес представлення антигену. Другий експеримент з двома незалежними донорами. Фіг. 29 ілюструє агрегацію тромбоцитів у 10 нормальних людських донорів. Результати виражені як meаn+/- sd (середнє значення +/- стандартне відхилення). Фіг. 30 представляє вивільнення серотоніну у 10 нормальних людських донорів. Результати виражені як meаn+/- sd. Фіг. 31 представляє узгодження 6F4 VН-домену та IGHV 1-03*01 зародкового гена (SEQ ID № 49). ПРИКЛАДИ Приклад 1: Створення антитіла 6F4 Для одержання мишачого моноклонального антитіла (Мab), миші BALB/C були імунізовані з 6 7 використанням 5x10 клітин MCF-7 з ATCC. Після останньої повторної ін'єкції 10 клітин MCF-7, провели злиття клітин з лімфатичних вузлів миші з мієломними клітинами Sp2/O-Ag14, використовуючи методики, класично описані Кохлером і Мілштейном. Супернатанти від гібридом, одержаних при злитті, потім перевірили на функціональну активність, а саме на інгібування проліферації клітин MCF-7 in vitro. 3 Для цієї перевірки клітини MCF-7 культивували в 96-лункових культуральних платах (5x10 клітин/лунка) в 100 мкл середовища від гібридоми без фетальної телячої сироватки. Плати інкубували протягом 24 годин при 37°С в атмосфері з 5 % СО 2. Через 24 години 50 мкл супернатанта від гібридом, що перевіряються, додавали до кожної лунки. Останній ряд в платі займав контроль: - три лунки заповнили 50 мкл супернатанта від гібридоми, яка не рельовантна в плані бажаної активності і яку культивували в такому саме культуральному середовищі, яке використовувалася при злитті клітин. Ці лунки використовували для калібрування дії неактивного супернатанта на вбудовування поміченого тритієм тимідину; - три лунки заповнили 50 мкл гібридомному культуральному середовищі. 3 Приблизно через 52 години культивування кожну лунку заповнили 0,25 мкКі [ H]тимідину і 3 знову інкубували протягом 20 годин при 37°С. Вбудовування [ H]тимідину в ДНК, що означає клітинну проліферацію, підраховували шляхом вимірювання рідинної сцинтиляції. Фоновий шум і порогові значення були визначені для кожної плати як функція контрольних лунок, що містять лише середовище і супернатант нерельовантної гібридоми. Відповідно до даного способу після першого скринінгу були відібрані 43 гібридоми, які секретували антитіла, що інгібують ріст клітин MCF-7. В одинадцяти з цих 43 гібридом ріст був слабким або взагалі відсутнім, і від них відмовилися. Під час аналізу проліферації, проведеного після збільшення і клонування гібридом, були відібрані лише ті гібридоми, супернатант яких інгібував проліферацію клітин MCF-7 не менше, ніж на 20 %. В кінці процесу клонування/селекції з'ясувалося, що лише один клон має необхідні властивості, клон 6F4. Приклад 2: Процес гуманізації шляхом СDR-прищеплення варіабельної ділянки легкого ланцюга антитіла 6F4 (6F4 VL) а) Порівняння нуклеотидної послідовності 6F4 VL з послідовностями всіх відомих мишачих клітинних ліній Як попередній крок в гуманізації шляхом CDR-прищеплення, нуклеотидна послідовність 6F4 VL спочатку була порівняна з послідовностями всіх мишачих клітинних ліній, присутніх в базі даних IMGT (Інтернет-адреса: http://imgt.cines.fr). Були виявлені ділянки V та J мишачих клітинних ліній, які мають ідентичність послідовностей 98,56 % для V-ділянки та 100 % для J-ділянки, відповідно IGKV19-93*01 (SEQ ID № 39, номенклатура EMBL: AJ235935) та IGKJ1*01 (SEQ ID № 40, номенклатура EMBL: 20 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 V00777). Враховуючи ці відсотки ідентичності, було вирішено використовувати безпосередньо послідовність 6F4 VL. Ці узгодження представлені на фіг. 2А для V-ділянки і на фіг. 2В для J-ділянки. b) Порівняння нуклеотидної послідовності 6F4 VL з послідовностями всіх відомих людських клітинних ліній Для виявлення кращого людського кандидата для CDR-прищеплення, проводився пошук зародкової лінії людського походження з максимально можливою ідентичністю з 6F4 VL. Для цієї мети нуклеотидну послідовність мишачої 6F4 VL порівняли з послідовностями всіх людських клітинних ліній, присутніх в базі даних IMGT. Були виявлені ділянки V та J клітинних ліній людського походження, які мають ідентичність послідовностей 81.36 % для V-ділянки, а саме IGKV1-33*01 (SEQ ID № 41, номенклатура EMBL: M64856) та 86,84 % для J-ділянки, а саме IGKJ1*01 (SEQ ID № 42, номенклатури EMBL: J00242). Клітинні лінії IGKV1-33*01 для V-ділянки та IGKJ1*01 для J-ділянки були таким чином вибрані як послідовності людських рецепторів до CDR мишачої 6F4 VL. Ці узгодження представлені на фіг. 3A для V-ділянки і на фіг. 3B для J-ділянки. с) Гуманізовані версії 6F4 VL. Наступний етап процесу гуманізації полягає в об'єднанні послідовностей клітинних ліній IGKV1-33*01 та IGKJ1*01, а потім в приєднанні CDR мишачої 6F4 VL до матричних ділянок цих самих зародкових ліній. Ця стадія процесу молекулярного моделювання мишачих 6F4 Fv-ділянок буде особливо корисна при виборі мишачих залишків, які будуть збережені, тому що вони можуть відігравати певну роль або в підтримці молекулярної тривимірної структури (обов'язкова структура CDR, межі VH/VL тощо) або в зв’язуванні антигену. У матричних ділянках кожна відмінність між мишачими (6F4 VL) і людськими (IGKVL-33*01/IGKJl*01) нуклеотидами буде розглядатися дуже уважно. Для більшого розуміння в подальшому фіг. 4 представляє послідовність 6F4VL із посиланням на класифікації Кабата та IMGT. Були виявлені три мишачі залишки, які повинні бути збережені. Залишок 33 (Ile) бере участь в CDR1-заякорюванні відповідно до IMGT і є частиною CDR1 відповідно до Кабата. Залишок 49 (His) бере участь в CDR2-заякорюванні відповідно до IMGT, бере участь в межі VH/VL і належить до зони Верн’є. Залишок 53 (Thr) бере участь в CDR2-заякорюванні відповідно до IMGT і є частиною CDR2 відповідно до Кабата. По-перше, будуть вивчені три зміни в матричних ділянках IGKV1-33*01 та IGKJ1*01. Ці зміни стосуються залишків 24, 69 та 71 (номенклатура IMGT). Звичайно, слід розуміти, що ці три зміни будуть вивчатися незалежно одна від одної, а також в різних поєднаннях. Мета полягає в тому, щоб мати в своєму розпорядженні всі можливі мутанти для того, щоб протестувати їх і вибрати мутант, який зберіг кращі зв'язуючі властивості. Зв'язуючі тести ELISA/ BIAcore, таким чином, будуть проводитися для кожного мутанта. Залишок 24 (Lys/Gln) знаходиться поблизу CDR1 і в результаті може мати вирішальне значення для збереження структури, що робить можливим належне представлення CDR1. Зокрема, цей залишок може взаємодіяти із залишками 69-70 в зоні Верн’є. Lys лише трохи представлений в людських VL, але є частиною CDR1 відповідно до Кабата. Хоча залишок 69 (Arg/Тhr) знаходиться в зоні Верн’є і таким чином безпосередньо бере участь в обов'язковій структурі CDR1, в людському VL це завжди Thr. Хоча залишок 71 (Tyr/Phe) безпосередньо бере участь в обов'язковій структурі CDR1, в людському VL це завжди Phe. По-друге, може бути розглянута зміна залишку 56 (Ala) на Thr. Цей залишок, хоча і поза CDR відповідно до IMGT, належить до CDR2 відповідно до Кабата. Нарешті, по-третє, можуть бути зроблені дві додаткові зміни в залишках 34 та 55 (номенклатура IMGT). Два залишки поза CDR, визначені відповідно до IMGT, включені в CDR за визначенням Кабата. Залишок 34 (Ala/Asn) належить CDR1 відповідно до Кабата і бере участь в VH/VL межі. Така мутація зберігає релевантність не дивлячись на значне представлення Ala у людини. Залишок 55 (Gln/Glu) є частиною CDR2 відповідно до Кабата і також бере участь в VH/VL межі. Така мутація також зберігає релевантність не дивлячись на значне представлення Gln у людини. 21 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як було вказано вище, ці три мутації можуть бути протестовані незалежно одна від одної або в різних поєднаннях. Приклад 3: Процес гуманізації шляхом CDR-прищеплення варіабельної ділянки важкого ланцюга антитіла 6F4 (6F4 VH) а) Порівняння нуклеотидної послідовності 6F4 VH з послідовностями всіх відомих мишачих клітинних ліній Як попередній крок в гуманізації шляхом CDR-прищеплення, нуклеотидна послідовність 6F4 VH спочатку була порівняна з послідовностями всіх мишачих клітинних ліній, присутніх в базі даних IMGT (Інтернет-адреса: http://imgt.cines.fr). Були виявлені ділянки V, D та J мишачих клітинних ліній, які мають ідентичність послідовностей 99,30 % для V-ділянки (IGHV1S135*01; SEQ ID № 43; номенклатура EMBL: AF304556), 80 % для D-ділянки (IgHD-ST4*01; SEQ ID № 44; номенклатура EMBL: M23243) та 100 % для J-ділянки (IgHJ2*01; SEQ ID № 45; номенклатура EMBL: V00770). Ці узгодження представлені на фіг. 5А для V-ділянки, на фіг. 5В для D-ділянки і на фіг. 5С для J-ділянки. Враховуючи ці відсотки ідентичності, було вирішено використовувати безпосередньо послідовність 6F4 VH, як це було у випадку з 6F4 VL. b) Порівняння нуклеотидної послідовності 6F4 VH з послідовностями всіх відомих людських клітинних ліній Для виявлення кращого людського кандидата для CDR-прищеплення, проводився пошук зародкової лінії людського походження з максимально можливою ідентичністю з кожної з трьох ділянок V, D та J з 6F4 VH. Для цієї мети нуклеотидну послідовність мишачої 6F4 VH порівняли з послідовностями всіх людських клітинних ліній, присутніх в базі даних IMGT. Були виявлені зародкові лінії людського походження, які мають ідентичність послідовностей 75,34 % для V-ділянки (IGHV1-f*01; SEQ ID № 46; номенклатура EMBL: Z12305), 71,42 % для Dділянки (IGHD1-1*01; SEQ ID № 47; номенклатура EMBL: X97051) та 87,51 % для J-ділянки (IGHJ4*01; SEQ ID № 48, номенклатура EMBL: J00256). Вказані вище зародкові лінії були вибрані для кожної з ділянок V, D та J і розподілені між ними. Ці узгодження представлені на фіг. 6А для V-ділянки, фіг. 6В для D-ділянки і фіг. 6С для Jділянки. с) Гуманізовані версії 6F4 VH. Наступний етап в процесі гуманізації полягає в об'єднанні послідовностей клітинних ліній IGHV1-f*01, IGHD1-1*01 та IGHJ4*01, а потім в приєднанні CDR мишачої 6F4 VH до матричних ділянок цих самих зародкових ліній. Ця стадія процесу молекулярного моделювання мишачих 6F4 Fv-ділянок буде особливо корисна при виборі мишачих залишків, які будуть збережені, тому що вони можуть відігравати певну роль або в підтримці молекулярної тривимірної структури (обов'язкова структура CDR, межі VH/VL і так далі) або в зв’язуванні антигену. У матричних ділянках кожна відмінність між мишачими (6F4 VH) і людськими (IGHV1-f*01, IGHD1-1*01 та IGHJ4*01) нуклеотидами будуть розглядатися дуже уважно. Для більшого розуміння в подальшому фіг. 7 представляє послідовність 6F4VH із посиланням на класифікації Кабата та IMGT. Як і у випадку з легким ланцюгом, були виявлені чотири мишачі залишки, які повинні бути збережені незмінними. Залишок 2 (Ile) є частиною зони Верн’є і бере участь в CDR3-структуруванні. Залишок 35 (Tyr) бере участь в CDR1-заякорюванні відповідно до IMGT, є частиною CDR1 відповідно до Кабата, а також бере участь в VH/VL межі і взаємодіє з CDR3. Залишок 50 (Tyr) бере участь в CDR2-заякорювання відповідно до IMGT, є частиною CDR2 відповідно до Кабата, також є частиною зони Верн’є і також бере участь в межі VH/VL. Залишок 59 (Arg) бере участь в CDR2-заякорюванні відповідно до IMGT є частиною CDR2 відповідно до Кабата і бере участь в межі VH/VL. По-перше, гуманізована версія зможе включати три мутації в залишках 61, 62 та 65, відповідно (класифікація IMGT). Ці три залишки знаходяться в CDR2 відповідно до Кабата і беруть участь в межі VH/VL. Залишок 61 (Asn/Ala) безпосередньо не бере участь в розпізнаванні антигену. Його мутації можуть бути розглянуті. Залишок 62 (Gln/Glu) і залишок 65 (Lys/Gln). По-друге, будуть оцінені дві додаткові зміни. Ці дві зміни зв'язані із залишками 48 і 74 (номенклатура IMGT). 22 UA 99602 C2 5 Залишок 48 (Ile/Met), що належить до матричної ділянки, бере участь в межі VH/VL. Залишок 74 (Lys/Thr) входить до складу зони Верн’є і може брати участь в CDR2структуровані. Нарешті, по-третє, може бути розглянутий третій ряд мутацій, а саме зміна залишку 9 (Pro/Ala) та 41 (His/ Pro). Мета цього полягає в тому, щоб за аналогією з мутаціями, запланованими для 6F4 VL, наблизитися до людської зародкової лінії настільки близько, наскільки це можливо без зміни CDR-заякорювання. Лише для підсумовування результатів в таблицях 4 та 5 нижче перелічені використовувані клітинні лінії, а також, відповідно, номера їх амінокислотних і нуклеотидних послідовностей. 10 Таблиця 4 Зародкові лінії (див. EMBL) IGKV19-93*01 (AJ235935) IGKJ1*01 (V00777) IGKV1-33*01 (M64856) IGKJ1*01 (J00242) IGHV1S135*01 (AF304556) IgHD-ST4*01 (M23243) IgHJ2*01 (V00770) IGHV1-f*01 (Z12305) IGHD1-1*01 (X97051) IGHJ4*01 (J00256) IGHV1-2*02 (X62106) SEQ ID № 39 40 41 42 43 44 45 46 47 48 49 Таблиця 5 Зародкові лінії (див. EMBL) IGKV19-93*01 (AJ235935) IGKJ1*01 (V00777) IGKV1-33*01 (M64856) IGKJ1*01 (J00242) IGHV1S135*01 (AF304556) IgHD-ST4*01 (M23243) IgHJ2*01 (V00770) IGHV1-f*01 (Z12305) IGHD1-1*01 (X97051) IGHJ4*01 (J00256) IGHV1-2*02 (X62106) 15 20 25 30 SEQ ID № 50 51 52 53 54 55 56 57 58 59 60 Приклад 4: Очищення та ідентифікація антигену, цільового для антитіла 6F4 Очищення за допомогою імуноафінності Цільовий антиген антитіла 6F4 очищають від мембранної фракції, збагаченої HТ-29 клітинами. Після розчинення в 50 мМ тріс/HCl буфері, рН 7,4, який містить 150 мМ NaCl, Тритон Х-100 та IGEPAL, мембранні білки інкубують у присутності антитіла 6F4, імобілізованого на сефарозних гранулах, протягом ночі при +4°C в умовах м'якого перемішування. Комплекс 6F4Ag, сформований на гранулах, потім промивають різними розчинами, які містять детергенти, для того, щоб видалити неспецифічні адсорбовані білки. Цільовий антиген 6F4 елюювали з 6F4сефарозної підкладки за допомогою 0,1 М Gly/HCl буфера, рН 2,7. Зібрані фракції аналізували за допомогою SDS-PAGE електрофорезу (10 % гель, невідновлювальні умови) і вестернблотінгу після перенесення на мембрану нітроцелюлози (первинне антитіло 6F4 використовується в 05 мкг/мл, виявлення шляхом хемілюмінісценції) для того, щоб відібрати фракції, збагачені антигеном, що цікавить, (фіг. 8А та 8В). Аналізом за допомогою вестернблотінгу підтверджують відсутність білка, що цікавить, в невідібраних фракціях і відмиваннях, а також специфічним елююванням останніх в умовах кислої рН. Збагачені фракції, одержані після двох очищень, потім були проаналізовані шляхом SDSPAGE електрофорезу (10 % гель) і вестерн-блотінгу в умовах, описаних раніше. Антиген, розпізнаний антитілом 6F4 при венстерн-блотінгу, мав уявну молекулярну масу 35 кДа після аналізу в відновлювальних умовах (фіг. 9А та 9В). Різницю в уявній молекулярній масі можна 23 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 відзначити при електрофорезі, що виконується в невідновлювальних умовах: у таких умовах уявна молекулярна маса дійсно трохи нижче, ніж та, що спостерігається у відновлювальних умовах. Ідентифікація цільового антигену Після SDS-PAGE електрофорезу (10 % гель) білки забарвлюють колоїдним синім, використовуючи спосіб, сумісний з аналізом мас-спектрометрії (фіг. 10). Смугу, що цікавить, яка відповідає білку, виявленому при вестерн-блотінгу, розрізають за допомогою скальпеля а потім позбавляють забарвлення шляхом інкубації в 25 мМ розчині бікарбонату амонію. Після відновлення (дитіотриетол, DTT) /алкілування (йодацетамід) і гідролізу «в гелі» (протягом ночі при 37°С) білка трипсином (Promega), протеолітичним ферментом, який гідролізує білки у залишків лізину та аргініну і таким чином вивільняє пептиди, які мають залишок лізин або аргініну в С-концевій позиції, утворені пептиди виділяють за допомогою суміші ацетонітрилу/води (70/30 в об'ємних частках) у присутності мурашиної кислоти. Потім їх наносять на установку MALDI в суміші з матрицею (альфа-ціано-4-гідроксикоричною кислотою, Bruker Daltonics) і у присутності ATFA, а потім аналізують за допомогою MALDI-TOF масспектрометрії (Autoflex, Bruker Daltonics). Одержаний мас-спектр представлений на фіг. 10. Список пептидів, виведених за допомогою цього аналізу, використовується для ідентифікації білка шляхом пошуку в базах даних за допомогою пошукової системи Mascot (Matrix Sciences). Результати пошуку в базі даних Ncbinr, обмежені білками людського походження, свідчать про те, що три білки мають значну вагу (вага > 64): 1. Кристалічна структура людської сполучної адгезійної молекули типу 1 Вага = 116 Цей білок відповідає позаклітинному домену білка F11R/JAM-A, що використовувався для структурних досліджень. 2. F11-рецептор (Homo Sapiens) Вага = 116 Цей білок відповідає попереднику білка F11R/ізоформа a. 3. F11-рецептор ізоформа b (Homo Sapiens) Вага = 65 Є попередником ізоформи b білка F11R з двома делеціями 20 амінокислот у порівнянні з ізоформою a. Ідентифікований за допомогою цього підходу білок називається, таким чином, F11R або F11рецептор. Це фактично є офіційною назвою білка, яка була прийнята, коли його вперше описали як рецептор до так званого F11-антитіла (Naik et al., 1995, Biochem. J., 310, 155-162). Цей білок більш відомий в наш час під назвою JAM-A або «сполучна адгезійна молекула А», а також під назвами JAM1, PAM-1, CD321 або антиген 106. Серед пептидів, вивільнених в результаті триптичного гідролізу і проаналізованих за допомогою мас-спектрометрії, дев'ять пептидів мали експериментальну молекулярну масу, яка відповідає, в межах 0,1 Да, пептидам, одержаним при теоретичному гідролізі людської форми JAM-А/ізоформи а. Ці дев'ять пептидів охопили 37 % білкової первинної послідовності. Крім того, теоретична молекулярна маса попередника JAM-А (приблизно 32,9 кДа) узгоджується з уявною молекулярною масою, визначеною експериментальним шляхом за допомогою SDSPAGE. Підтвердження цілі, ідентифікованої за допомогою вестерн-блотінгу Ідентифікацію JAM-А шляхом протеомічного підходу потім підтверджували за допомогою вестерн-блотінгу (10 % SDS-PAGE гель, в невідновлювальних умовах, антитіло 6F4 в 0,5 мкг/мл, виявлення шляхом хемілюмінесценції). Як показано на фіг. 11А, антитіло 6F4 розпізнає природний білок JAM-А в HТ-29 мембранному екстракті і у фракції, збагаченій за допомогою імуноочищення (уявна молекулярна маса = 35 кДа), а також димерний рекомбінантний білок JAM-A/Fc (R&D Systems, див. 1103-JM уявна молекулярна маса приблизно 120 кДа). Це розпізнавання рівнозначне розпізнаванню комерційного протилюдського JAM-А козиного поліклонального антитіла (R&D Systems, див. AFl 103), розрідженого до 1/1000 (фіг. 11В). Приклад 5: Специфічність антитіла 6F4 до людського JAM-A Специфічність антитіла 6F4 визначали за допомогою вестерн-блотінгу в умовах, описаних вище. Фіг. 12 показує, що антитіло 6F4 специфічно до людської форми JAM-А, оскільки воно розпізнає рекомбінантний білок hJAM-A/Fc (R&D Systems, див. 1103-JM), але не розпізнає ні людські форми JAM-B та JAM-C (рекомбінантні білки hJAM-B/Fc та hJAM-C/Fc, R&D Systems, див. 1074-VJ та 1189-J3), ні мишачу форму JAM-A (рекомбінантний білок mJAM-A/Fc, R&D 24 UA 99602 C2 5 10 15 20 25 30 35 40 45 Systems, див. 1077-JM). Приклад 6: Вимірювання афінності антитіла 6F4 за допомогою BIAcore (поверхневий плазмонний резонанс) Принцип Використовуючи BIAcore, константа афінності КD (М) антитіла6F4 до розчинного білка JAM1-Fc (позаклітинного домену, сплавленого з Fc-фрагментом антитіла і виготовленого в рекомбінантній формі в клітинах NS0), може бути розрахована шляхом визначення кінетики асоціації (ka) (1/m.s) і кінетики дисоціації (k d) (1/s) відповідно до формули КD=kd/kа (Rich and Myszka, J. MoI. Recog., 2005, 18, 431). Матеріали і методи Використовуваний інструмент: BIAcore Х і програмне забезпечення BIAevaluation 3.1 Х (Uppsala, SW) Реагенти: - Мишаче моноклональне антитіло 6F4: 1,3 мг/мл - Людський JAM-1-Fс (див. 1103- JM R&D Systems): 50 мкг без носія - Мишачий JAM-1-Fс (див. 1077- JM R&D Systems): 50 мкг без носія - Робочий буфер: HBS-EP (BIAcore) - Зв'язуючий набір: «Amine» (BIAcore) - Зв'язуючий буфер: ацетат рН 5,0 (BIAcore) - Перше (захоплююче) антитіло: козиний протилюдський IgG Fc (= GAH, goat anti-human) (Bioscience) - Регенераційний буфер: Гліцин, HCl рН 1,5 протягом 30 секунд (BIAcore). Обговорення і висновки Дані на фіг. 13 показують, що мишаче антитіло 6F4 зв'язане з позаклітинною частиною людського білка JAM-1, але не з позаклітинною частиною мишачого білка JAM-1. Дані на фіг. 14 дозволяють обчислити КD 22 пМ антитіла 6F4 до людського білка JAM-1 в цих експериментальних умовах. Повільна кінетика дисоціації вказує на залучення феномену авідності антитіла до антигену (бівалентна аналітична модель). Приклад 7: Активність антитіла 6F4 in vivo на ксенотрансплантній моделі MCF-7 Тестування антитіла 6F4, неочищеного і введеного інтраперитонеально в дозі 250 мкг/миша, показує, що це антитіла значно інгібує ріст MCF-7 клітин in vivo з відсотком інгібування, що досягає 56 %, в порівнянні з мишами, яким вводили PBS (фіг. 15). Нерельовантне антитіло 9G4, що використовується як контрольний ізотип IgG1, як і очікувалося, не мало протипухлинної активності. Приклад 8: Вивчення розподілу антигену, розпізнаного 6F4 на панелі пухлинних клітин В цілях визначення потенційних показань для антитіла 6F4, за допомогою методу проточної цитометрії були вивчені чотири типи пухлин в плані виразності мембранної експресії. Вибраними клітинними лініями є MCF-7 (естроген-залежний рак молочної залози), A549 (недрібноклітинний рак легені) HТ29 та Colo 205 (рак товстої кишки) і BxPC3 (рак підшлункової залози). На мічених клітинах був протестований діапазон доз (10 мкг/мл, 5 мкг/мл, 1 мкг/мл, 0,5 мкг/мл, 0,25 мкг/мл та 0,125 мкг/мл). Результати, представлені на фіг. 16, показують, що антитіло 6F4 розпізнає антиген, значно експресований на поверхні всіх протестованих клітин. Одержане маркування є насичуваним, що свідчить про його специфічність. Було одержане насичення сайтів при концентрації антитіла від 1 мкг/мл, що свідчить про те, що антитіло 6F4 має високу афінність до антигену JAM-A. Приклад 9: Гуманізація шляхом CDR-прищеплення варіабельної ділянки легкого ланцюга антитіла 6F4 (6F4 VL) - Резюме імуногенетичного аналізу; 50 Резюме результатів: V-ГЕН і алель J-ГЕН і алель Довжини CDR-IMGT і амінокислотна сполука Продуктивна перебудована послідовність IGK (без стоп-кодона і в рамці сполуки) Ідентичність = 81,36 % IGKV1-33*01 вага = 922 (227/279 нуклеотидів) Ідентичність = 86,49 % IGKJ1*01 вага = 140 (32/37 нуклеотидів) [6,3,8] CLQYDNLWTF 25 UA 99602 C2 - Докладні дані про найближчий ідентифікований людський V-ген Найближчі V-ділянки (оцінюються з першого нуклеотиду V-ділянки до 2-CYS кодону плюс 15 нуклеотидів з CDR3-IMGT) Вага M64856 IGKV1-33*01 922 81,36 % (227/279 нуклеотидів) M64855 IGKV1D-33*01 922 81,36 % (227/279 нуклеотидів) X63398 IGKV1-27*01 868 79,21 % (221/279 нуклеотидів) Y14865 IGKVL-NL1*01 841 78,14 % (218/279 нуклеотидів) X72817 IGKV1D-43*01 5 Ідентичність 841 78,14 % (218/279 нуклеотидів) - Докладні дані про найближчий ідентифікований людський J-ген Найближчі J-ДІЛЯНКИ: Вага Ідентичність J00242 IGKJl*01 30 113 78,38 % (29/37 нуклеотидів) 104 75,68 % (28/37 нуклеотидів) Z46620 IGKJ2*04 25 81,08 % (30/37 нуклеотидів) Z70260 IGKJ2*02 20 122 J00242 IGKJ4*01 15 86,49 % (32/37 нуклеотидів) AF103571 IGKJ4*02 10 140 95 72,97 % (27/37 нуклеотидів) - Ідентифікація критичних залишків У визначення і класифікацію зовнішніх критичних CDR-залишків залучено декілька критеріїв. Вони включають щонайменше відому участь залишку в VH/VL межі, в зв’язуванні антигену або в CDR-структурі, амінокислотний клас, який відрізняється між мишачими і людськими залишками, локалізацію залишків в 3D-структурі варіабельного домену тощо. У VL-домені 6F4 та V-гені найближчої людської зародкової лінії IGKVL-33*01, розрізняється 21 амінокислота, і всі вони знаходяться поза CDR-залишків. З цього 21 залишку аналіз вищевикладених параметрів призвів до ідентифікації 9 залишків, які потенційно вносять найбільший вклад. Ці мишачі залишки є K24, I39, A40, H55, T66, Q68, A69, R85 та Y87. З цих 9 залишків 3 повинні бути ще більш важливими, оскільки вони будуть зберігати своє мишаче походження в гуманізованій формі. Цими залишками є I39 і H55 і T66, розташовані в CDR1- та CDR2-якорях відповідно. Нарешті, 6 амінокислот будуть проаналізовані в індивідуальному порядку і/або в комбінації для того, щоб визначити, чи можуть вони бути гуманізованими або чи повинні вони зберегти своє мишаче походження. Дивлячись на незалучення J-ділянки в зв’язування антигену і структуризацію V-ділянки, було вирішено використовувати ген природної людської зародкової лінії IGKJ1*01. У спроектованій послідовності гуманізованого VL-домену 6F4, зображеній на фіг. 17: * відповідає амінокислотам, зміненим de facto на їх людські аналоги 1 відповідає амінокислотам, аналізованим на їх здатність бути гуманізованими, людський залишок позначений нижче 2 відповідає амінокислотам, які залишаються мишачими в гуманізованому VH-домені 6F4 Приклад 10: Перша версія гуманізації шляхом CDR-прищеплення варіабельної ділянки важкого ланцюга антитіла 6F4 (6F4 VH) - Резюме імуногенетичного аналізу Резюме результатів: V-ГЕН і алель J-ГЕН і алель Довжини CDR-IMGT та амінокислотна сполука Продуктивна перебудована послідовність IGK (без стоп-кодона і в рамці сполуки) IGHV1-f*01 Вага= 796 Ідентичність = 75,35 % (217/28 нуклеотидів) IGHJ4*01 Вага = 181 Ідентичність = 87,23 % (41/47 нуклеотидів) [8,8,9] CARQTDYFDYW D-ген строго належить до CDR3-ділянки в VН-домені. Процес гуманізації оснований на підході «CDR-прищеплення». Аналіз найближчих людських D-генів не є потрібним в цій 26 UA 99602 C2 стратегії. - Докладні дані про ідентифікацію найближчого людського V-гена Найближчі V-ділянки (оцінюються з першого нуклеотиду V-ділянки до 2-го Cys-кодона) Вага Ідентичність M64856 IGHV1-f*01 796 75,35 % (217/288 нуклеотидів) X62106 IGHV1-2*02 787 75,00 % (216/288 нуклеотидів) X92208 IGHV1-2*03 782 74,65 % (215/288 нуклеотидів) Z12310 IGHV1-2*04 778 74,65 % (215/288 нуклеотидів) M99642 IGHV1-24*01 760 73,96 % (213/288 нуклеотидів) - Докладні дані про ідентифікації найближчого людського J-гена 5 Найближчі J-ДІЛЯНКИ: Вага J00256 IGHJ4*01 30 85,11 % (40/47 нуклеотидів) 172 85,11 % (40/47 нуклеотидів) 138 74,51 % (38/51 нуклеотидів) J00256 IGHJ5*01 25 172 J00256 IGHJl*01 20 87,23 % (41/47 нуклеотидів) M25625 IGHJ4*03 15 181 X86355 IGHJ4*02 10 Ідентичність 133 74,00 % (37/50 нуклеотидів) - Ідентифікація критичних залишків У визначення і класифікацію зовнішніх критичних CDR-залишків залучено декілька критеріїв. Вони включають щонайменше відому участь залишку в VH/VL межі, в зв’язуванні антигену або в CDR-структурі, амінокислотний клас, який відрізняється між мишачими і людськими залишками, локалізацію залишку в 3D-структурі варіабельного домену тощо. У VН-домені 6F4 та V-гені найближчої людської зародкової лінії IGHV1-f*01 розрізняється 31 амінокислота, і всі вони знаходяться поза CDR-залишків. З цього 31 залишку аналіз за вищевикладеними параметрами привів до ідентифікації 9 залишків, які потенційно вносять найбільший вклад. Ці мишачі залишки являють собою I2, Y40, I53, Y55, R66, N68, Q69, K72 та K82. З цих 9 залишків 2 повинні бути ще більш важливими, оскільки вони будуть зберігати своє мишаче походження в гуманізованій формі. Цими залишками є Y55 та R66, розташовані в CDR2-якорях. Нарешті, 7 амінокислот будуть проаналізовані в індивідуальному порядку і/або в комбінації для того, щоб визначити, чи можуть вони бути гуманізованими або чи повинні вони зберегти своє мишаче походження. Враховуючи незалучення J-ділянки в зв’язування антигену і структуризацію V-ділянки, було вирішено використовувати ген природної людської зародкової лінії IGHJ4*01. У спроектованій послідовності гуманізованого VН-домену 6F4, зображеній на фіг. 18: * відповідає амінокислотам, зміненим de facto на їх людські аналоги 1 відповідає амінокислотам, аналізованим на їх здатність бути гуманізованими, людський залишок позначений нижче 2 відповідає амінокислотам, які залишаються мишачими в гуманізованому домені VH 6F4 Приклад 11: Друга версія гуманізації шляхом CDR-прищеплення варіабельної ділянки важкого ланцюга антитіла 6F4 (6F4 VH) В іншому способі для того, щоб ідентифікувати людський V-ген, який є кандидатом на CDRприщеплення, були розглянуті людські гомологи на амінокислотному рівні з використанням інструменту IMGT/DomainGapAlign. - Результати імуногенетичного аналізу IMGT/DomainGapAlign підсумовані нижче: Алель IGHV13*01 Вид Homo Sapiens Домен 1 Вага СмітаВатермана 451 Відсоток ідентичності 64,3 Зона перекриття 98 35 40 - Ідентифікація критичних залишків в гені зародкової лінії IGHV1-03*01 (SEQ ID № 49, номенклатура EMBL: X62109). Узгодження домену VH 6F4 і білкових послідовностей IGHV1-3*01 представлене на фіг. 31. Відбір і класифікація цих залишків основані на диференціальному критерії на підставі відносної важливості кожної окремої позиції відповідно до її структурної релевантності, її 27 UA 99602 C2 5 10 15 20 25 30 35 40 45 50 55 60 відомими структурно-функціональними відношеннями, релевантності зміни амінокислотного класу, якщо це відбувається, а також при цьому вигідно використовують результати, одержані в ході першого процесу гуманізації. При першому задумі всі різні амінокислоти «поза CDR» були замінені на свої людські аналоги, за винятком залишків Y55 та R66, які обидва строго залучені в зв’язування як CDR2якорі встановлених залишків. Здатність до гуманізації цих двох залишків буде вивчатися в кінці процесу, після того як будуть виконані всі інші описані нижче аналізи. Більше того, як наслідок, необхідно буде поліпшити відновлення повної активності батьківського антитіла, повторно гуманізованого VН-домену 6F4 Hz2; процес «дегуманізації» буде полягати, у разі необхідності, у зворотній мутації цих амінокислот в їх мишачі аналоги: Перша група залишків, а саме E1Q, K43R та K75R, представляє строгу комбінацію критеріїв і відповідає першій позиції, «дегуманізація» якої буде оцінюватися при пошуку переваг. Далі, залишки з групи 2, а саме K48Q, S49R, F88Y та H90R, є хімічно релевантними мутаціями, проте структурно є трохи менш передбачуваними ключовими залишками і будуть протестовані в ході другого етапу експерименту. Шість залишків з третьої групи є імовірно більш залученими в загальні і/або центральноорієнтовані залишки і, таким чином, повинні бути менш залучені у зв’язування і тому при необхідності будуть вивчатися на третьому етапі поліпшення. Залишки з групи 4 повинні бути менш змінені в плані структури і/або релевантного амінокислотного класу, і для них «дегуманізація» буде вивчена пізніше. Нарешті, наступні шість залишків, I2V, Y40H, I53M, N68S, K72Q та K82T, які відповідають амінокислотам, які не були гуманізовані щонайменше в цій початковій комбінації, змінюють зв'язуючу активність гуманізованого в першу чергу VН-домену. «Дегуманізація» цих залишків буде здійснюватися на останньому етапі поліпшення. D-ген строго належить CDR3-ділянки VН-домену. Процес гуманізації оснований на підході «CDR-прищеплення». Аналіз найближчого людського D-гена не є потрібним в цій стратегії. Враховуючи незалучення J-ділянки в зв’язування антигену і структуризацію V-ділянки, було вирішено використовувати ген природної людської зародкової лінії IGHJ4*01. - Експериментальні дані, одержані для повторної гуманізації антитіла 6F4 В наступних експериментах повторна гуманізація стосується лише важкого ланцюга, легкий ланцюг, який завжди відповідає QTY/AET гуманізованому 6F4 VL-домену, вибраному в прикладі 9 як приклад цього останнього гуманізованого VL-домену, демонструє анти-JAM-а зв'язуючу активність, аналогічну тій, яку має рекомбінантне химерне антитіло 6F4. Аналогічним чином, аналіз поліпшення повторно гуманізованої версії проводили в порівнянні з анти-JAM-а зв'язуючою активністю рекомбінантного химерного антитіла 6F4, визначеною в аналізі ІФА (дані не показані). Приклад 12: Зворотна регуляція експресії JAM-А моноклональним антитілом 6F4 in vitro Для визначення впливу моноклонального антитіла 6F4 на експресію JAM-А були відібрані клітинні лінії MCF-7, HT29 та A549. Описуючи коротко, клітини поміщали в матраци об'ємом 75 2 см та інкубували при 37°С в атмосфері з 5 % CO 2 протягом 24 годин в середовищі, доповненому 10 % фетальною телячою сироваткою (FCS). Потім клітини промивали 3 рази з PBS та інкубували ще один день в середовищі без сироватки. Після цієї другої інкубації середовище без сироватки видаляли і замінювали лише свіжим середовищем без сироватки або свіжим середовищем без сироватки, що містить або 6F4, або ізотипічний контроль IgG1, описаний як 9G4. Через 5 або 16 годин інкубації додавали холодний лізуючий буфер (10 мМ буфер Тріс-HCl, рН 7,5, 15 % NaCl 1 M (Sigma Chemical Co.), 10 % детергентна суміш (10 мМ тріс-HCl, 10 % лізисний буфер Igepal) (Sigma Chemical Co.), 5 % дезоксихолат натрію (Sigma Chemical Co.), 1 повний коктейль інгібіторів протеаз TM tablet (Roche) та 1 % інгібітор фосфатази Cocktail Set II (Calbiochem), рН 7,5) і руйнували клітини на льоду. Лізати очищали шляхом центрифугування при 4°С. Білок кількісно оцінювали за допомогою білкового аналізу BCA, і 25 мкг білка занурювали в кожну смужку 4-12 % біс-тріс-гелю Biorad. Зразки нагрівали протягом 5 хвилин при температурі 100°С і зберігали при -20°C або завантажували безпосередньо в 4-12 % гель SDS-PAGE і переносили на мембрану нітроцелюлози. Блоти спочатку блокували 5 % BSA для всіх антитіл. Протягом 2 годин виконували інкубацію специфічного анти-JAMA первинного антитіла при кімнатній температурі. Фільтри промивали в TBST-буфері та інкубували з відповідними HRP- зв'язаними (зв'язаними з пероксидазою хрону) вторинними антитілами протягом 1 години при кімнатній температурі. Мембрани промивали в TBST, а потім візуалізували білки за допомогою набору ECL (Amersham). Як показано на фіг. 19, значна зворотна регуляція JAM-A була відмічена в трьох клітинних лініях, оброблених моноклональним антитілом 6F4. MCF-7 представляється найбільш чутливою 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibody that specifically binds to jam-a, capable of inhibiting the proliferation of tumor cells
Автори англійськоюGoetsch, Liliane, Corvaia, Nathalie, Haeuw, Jean-Francois, Bes, Cedric
Назва патенту російськоюАнтитело, специфически связывающееся с jam-a, способное ингибировать пролиферацию опухолевых клеток
Автори російськоюГётш Лилиан, Корва Натали, Хёв Жан-Франсуа, Бес Седрик
МПК / Мітки
МПК: A61K 39/395, A61P 35/00, C12N 5/20, C07K 16/28, C12P 21/08, C12N 15/13
Мітки: здатне, клітин, jam-a, антитіло, пухлинних, проліферацію, яке, специфічно, інгібувати, зв'язується
Код посилання
<a href="https://ua.patents.su/71-99602-antitilo-yake-specifichno-zvyazuehtsya-z-jam-a-zdatne-ingibuvati-proliferaciyu-pukhlinnikh-klitin.html" target="_blank" rel="follow" title="База патентів України">Антитіло, яке специфiчно зв’язується з jam-a, здатне інгібувати проліферацію пухлинних клітин</a>
Попередній патент: Застосування антитіла до cd151 для лікування первинних пухлин
Наступний патент: Установка для видалення золи і спосіб роботи цієї установки
Випадковий патент: Спосіб підготовки товстокишкового трансплантата до проведення езофагопластики