Ін’єкційна композиція ацетоніду триамцинолону для лікування болю
Номер патенту: 111162
Опубліковано: 11.04.2016
Автори: Кумар Анджалі, Бодік Ніл, Моран Марк, Клейман Майкл Д., Бленкс Роберт К.
Формула / Реферат
1. Ін'єкційна композиція, яка включає мікрочастинки контрольованого або уповільненого вивільнення, що включають матрицю ацетоніду триамцинолону (ТСА) та полі(молочної-ко-гліколевої) кислоти (PLGA), де ТСА становить від 22 до 28 % мікрочастинок, та де PLGA має наступні характеристики: (і) молекулярна маса в діапазоні приблизно від 40 до 70 кДа та (іі) молярне співвідношення лактид:гліколід від 80:20 до 60:40.
2. Ін'єкційна композиція за п. 1, у якій мікрочастинки мають середній діаметр від 10 до 100 мкм.
3. Ін'єкційна композиція за п. 1 або п. 2, у якій мікрочастинки додатково включають поліетиленгліколевий (PEG) залишок, причому масова частка PEG-залишку становить до 25 % мас. мікрочастинки.
4. Ін'єкційна композиція за будь-яким з пп. 1-3, у якій ТСА здатний вивільнятися з ін'єкційної композиції протягом періоду від 14 до 90 днів.
5. Ін'єкційна композиція за п. 1, у якій співполімер молочної-гліколевої кислот має питому в'язкість у діапазоні від 0,3 до 0,5 дл/г.
6. Ін'єкційна композиція за п. 1, у якій від 22 до 28 % ТСА в мікрочастинках співполімеру молочної та гліколевої кислот становить загальну дозу завантаження ТСА у кількості від 10 до 50 мг.
7. Ін'єкційна композиція за будь-яким з пп. 1-6, де молярне співвідношення молочна кислота:гліколева кислота у PLGA становить 75:25.
8. Спосіб лікування болю або запалення у пацієнта, який включає введення пацієнтові терапевтично ефективної кількості ін'єкційної композиції за будь-яким з пп. 1-7.
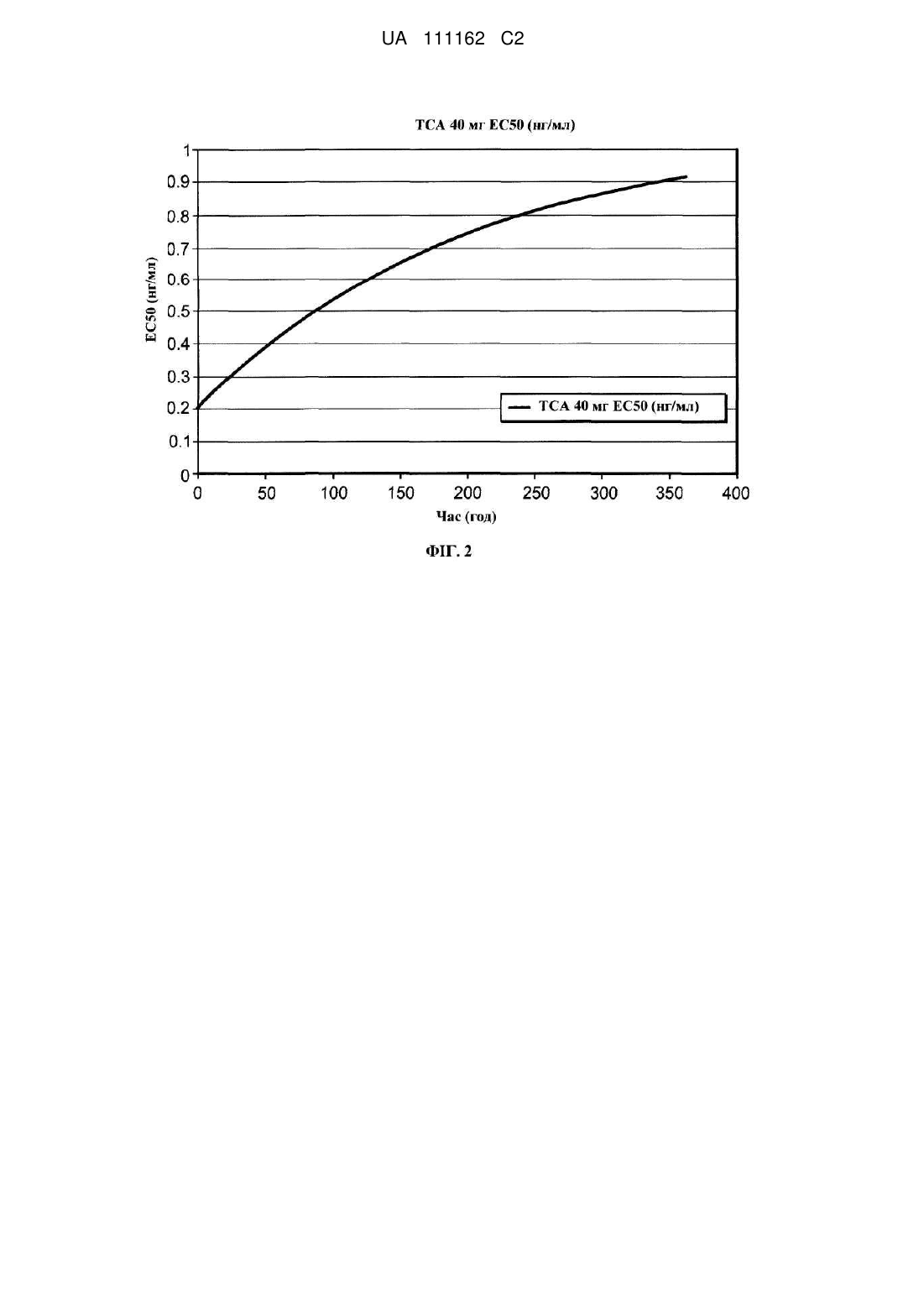
9. Спосіб за п. 8, у якому ін'єкційна композиція вивільнює кортикостероїд впродовж принаймні 14 днів зі швидкістю, яка не викликає несприятливого пригнічення гіпоталамо-гіпофізарно-надниркової осі (НРА-осі).
10. Спосіб за п. 8 або п. 9, у якому ін'єкційну композицію вводять однією або декількома ін'єкціями.
11. Спосіб за будь-яким з пп. 8-10, у якому пацієнт хворіє на остеоартрит, ревматоїдний артрит, гострий подагричний артрит або синовіт.
12. Спосіб уповільнення, затримки або реверсування прогресуючого структурного пошкодження тканин, пов'язаного з хронічною запальною хворобою у пацієнта, який включає введення пацієнтові терапевтично ефективної кількості ін'єкційної композиції за будь-яким з пп. 1-7.
13. Спосіб за п. 12, у якому ін'єкційна композиція вивільнює кортикостероїд впродовж принаймні 14 днів зі швидкістю, яка не викликає несприятливого пригнічення гіпоталамо-гіпофізарно-надниркової осі (НРА-осі).
14. Спосіб за п. 12 або п. 13, у якому ін'єкційну композицію вводять однією або кількома ін'єкціями.
15. Спосіб за будь-яким з пп. 12-14, у якому пацієнт хворіє на остеоартрит, ревматоїдний артрит, гострий подагричний артрит або синовіт.
16. Спосіб виготовлення ін'єкційної композиції за будь-яким з пп. 1-7, у якому для виготовлення композиції ацетоніду триамцинолону (ТСА) мікрочастинки виготовляють, застосовуючи процес випарювання розчинника, де ТСА є диспергованим в органічному розчині співполімеру молочної-гліколевої кислот, а суміш піддають обробці для видалення з неї розчинника, таким чином одержуючи мікрочастинки.
17. Спосіб за п. 16, у якому процес випарювання розчинника передбачає застосування рoзпилювaльного висушування або пристрою з псевдозрідженим шаром для видалення розчинника та утворення мікрочастинок.
18. Спосіб за п. 16, у якому процес випарювання розчинника передбачає застосування обертального диска.
Текст
Реферат: Винахід стосується ін'єкційної композиції, яка включає мікрочастинки контрольованого або уповільненого вивільнення, що включають матрицю ацетоніду триамцинолону (ТСА) та полі(молочної-ко-гліколевої) кислоти (PLGA), де ТСА становить від 22 до 28 % мікрочастинок, та де PLGA має наступні характеристики: (і) молекулярна маса в діапазоні приблизно від 40 до 70 кДа та (іі) молярне співвідношення лактид:гліколід від 80:20 до 60:40; способу її виготовлення та застосування при лікуванні болю або запалення. UA 111162 C2 (12) UA 111162 C2 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 СПОРІДНЕНІ ЗАЯВКИ Ця заявка заявляє пріоритет попередньої заявки США № 61/370,666, поданої 4 серпня 2010 р. Зміст цієї заявки включено до цього опису шляхом посилання у повному обсязі. ГАЛУЗЬ ВИНАХОДУ Даний винахід стосується застосування кортикостероїди для лікування від болю, включаючи біль, викликаний запальними хворобами, такими, як остеоартрит або ревматоїдний артрит, і для уповільнення, затримки або реверсування структурного пошкодження тканин, викликаного запальною хворобою, наприклад, пошкодження суглобних та/або навколосуглобних тканин, викликаного остеоартритом або ревматоїдним артритом. Більш конкретно, кортикостероїд вводять за місцем як дозовану форму уповільненого вивільнення (з компонентом негайного вивільнення або без нього), в результаті чого забезпечується ефективність при клінічно незначному впливі на ендогенне продукування кортизолу або за відсутності вимірного впливу. РІВЕНЬ ТЕХНІКИ Кортикостероїди впливають на всі тканини організму і мають різний вплив на клітини. Ці стероїди регулюють біосинтез та метаболізм вуглеводів, ліпідів та білків і водний та електролітичний баланс. Кортикостероїди, які впливають на клітинний біосинтез або метаболізм, називаються глюкокортикоїдами, а ті, що впливають на водний та електролітичний баланс, є мінералокортикоїдами. І глюкокортикоїди, і мінералокортикоїди вивільнюються з кори надниркової залози. Введення кортикостероїдів, зокрема, протягом тривалих періодів часу, можуть мати багато небажаних побічних ефектів. Механізм взаємозалежного зворотного зв'язку між гіпоталамусом, який відповідає за секрецію фактора вивільнення кортикотропіну, гіпофізом, який відповідає за секрецію адренокортикотропного гормону, та корою надниркової залози, яка секретує кортизол, називається гіпоталамо-гіпофізарно-наднирковою (HPA) віссю. HPA-вісь може пригнічуватися через введення кортикостероїдів, що призводить до різних небажаних побічних ефектів. Відповідно, існує медична потреба у подовженні місцевої тривалості дії кортикостероїдів при зменшенні системних побічних ефектів, пов'язаних з цим введенням. Таким чином, у галузі існує потреба у способах та композиціях для тривалого місцевого лікування болю та запалення, наприклад, болю у суглобах, з застосуванням кортикостероїдів, яке б давало клінічно незначне пригнічення HPA-осі, або не давало б вимірного пригнічення. Крім того, існує медична потреба в уповільненні, затримці, реверсуванні або іншому стримуванні структурного пошкодження тканин, викликаного запальними хворобами, такого, як пошкодження суглобних тканин в результаті остеоартриту або ревматоїдного артриту. КОРОТКИЙ ОПИС ВИНАХОДУ У даній заявці описуються композиції та способи лікування від болю та запалення з застосуванням кортикостероїдів. Запропоновані композиції та способи передбачають застосування одного або кількох кортикостероїдів у мікрочастинковій композиції. Мікрочастинкові композиції кортикостероїдів, які пропонуються авторами, є ефективними для лікування від болю та/або запалення з мінімальними довготерміновими побічними ефектами введення кортикостероїдів, включаючи, наприклад, тривале пригнічення HPA-осі. Мікрочастинкові композиції кортикостероїдів є прийнятними для введення, наприклад, місцевого введення шляхом ін'єкції у місце або поблизу від місця болю та/або запалення у пацієнта. Мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, є ефективними для уповільнення, затримки, реверсування або іншого стримування структурного пошкодження тканин, пов'язаного з прогресуванням хвороби, з мінімальними довготерміновими побічними ефектами введення кортикостероїдів, включаючи, наприклад, тривале пригнічення HPA-осі. Мікрочастинкові композиції кортикостероїдів є прийнятними для введення, наприклад, місцевого введення шляхом ін'єкції у місце або поблизу від місця структурного пошкодження тканини. У контексті даного опису "тривале" пригнічення HPA-осі означає пригнічення рівня кортизолу, більше за 35 %, до 14-го дня після введення, наприклад, після ін'єкції. Мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, доставляють кортикостероїд у такій дозі і у такий спосіб контрольованого або уповільненого вивільнення, щоб рівень пригнічення кортизолу був на рівні або нижчим за 35 % до 14-го дня після введення, наприклад, після ін'єкції. У деяких варіантах втілення мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, доставляють кортикостероїд у такій дозі і у такий спосіб контрольованого або уповільненого вивільнення, щоб рівень пригнічення кортизолу був незначним і/або не виявлявся до 14-го дня після введення, наприклад, після ін'єкції. У деяких варіантах втілення мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, доставляють кортикостероїд у такій дозі і у такий спосіб контрольованого або уповільненого вивільнення, щоб рівень пригнічення кортизолу був 1 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 незначним у будь-який час після ін'єкції. Таким чином, мікрочастинкові композиції кортикостероїдів у цих варіантах втілення є ефективними за відсутності будь-якого значного пригнічення HPA-осі. Введення мікрочастинкових композицій кортикостероїдів, які пропонуються даним винаходом, може призводити до початкового "прориву" пригнічення HPA-осі, наприклад, протягом перших кількох днів, протягом перших двох днів та/або протягом перших 24 годин після ін'єкції, але до 14-го дня після ін'єкції пригнічення HPA-осі становить менше за 35 %. У деяких варіантах втілення форму уповільненого вивільнення кортикостероїдів вводять за місцем для лікування від болю та запалення. Місцеве введення мікрочастинкової композиції кортикостероїдів може здійснюватися, наприклад, шляхом ін'єкції у внутрішньосуглобний простір, навколосуглобний простір, м'які тканини, пошкодження, епідуральний простір, периневральний простір або форамінальний простір у місці або поблизу від місця болю у пацієнта. У деяких варіантах втілення композиція додатково містить компонент негайного вивільнення. У деяких оптимальних варіантах втілення винаходу форму уповільненого вивільнення кортикостероїдів вводять (наприклад, шляхом одиничної ін'єкції або послідовними ін'єкціями) у внутрішньосуглобний простір для лікування від болю, наприклад, через остеоартрит, ревматоїдний артрит, подагричний артрит, бурсит, теносиновіт, епікондиліт, синовіт або інше порушення суглобів. У деяких оптимальних варіантах втілення винаходу форму уповільненого вивільнення кортикостероїдів вводять (наприклад, шляхом одиничної ін'єкції або послідовними ін'єкціями) у м'які тканини або пошкодження для лікування від запальних порушень, наприклад, запальних та сверблячих проявів реагуючих на кортикостероїди ревматозів, таких, як псоріаз. У деяких оптимальних варіантах втілення винаходу форму уповільненого вивільнення кортикостероїдів вводять (наприклад, шляхом одиничної ін'єкції або послідовними ін'єкціями) в епідуральний простір, периневральний простір, форамінальний простір або інший спінальний простір для лікування від реагуючих на кортикостероїди дегенеративних кістково-м'язових порушень, таких, як нейрогенна переміжна кульгавість. У деяких оптимальних варіантах втілення винаходу форму уповільненого вивільнення кортикостероїдів вводять (наприклад, шляхом одиничної ін'єкції або послідовними ін'єкціями) у внутрішньосуглобний простір або у м'які тканини для уповільнення, затримки, реверсування або іншого стримування структурного пошкодження тканин, пов'язаного з прогресуванням хвороби, такої, як, наприклад, пошкодження хряща, пов'язане з прогресуванням остеоартриту. У деяких варіантах втілення винаходу вводять комбінацію форми негайного вивільнення та форми уповільненого вивільнення кортикостероїдів (наприклад, шляхом одиничної ін'єкції або послідовними ін'єкціями) у внутрішньосуглобний простір для лікування від болю, наприклад, через остеоартрит, ревматоїдний артрит або інші порушення суглобів. У деяких варіантах втілення винаходу вводять комбінацію форми негайного вивільнення та форми уповільненого вивільнення кортикостероїдів (наприклад, шляхом одиничної ін'єкції або послідовними ін'єкціями) у внутрішньосуглобний простір або у м'які тканини для уповільнення, затримки, реверсування або іншого стримування структурного пошкодження тканин, пов'язаного з прогресуванням хвороби, такої, як, наприклад, пошкодження хряща, пов'язане з прогресуванням остеоартриту. Композиції та способи втілення винаходу дозволяють досягати негайного послаблення гострих симптомів (наприклад, болю та запалення) цих хвороб або станів і додатково забезпечують стійку або довготермінову терапію (наприклад, уповільнення, затримку, реверсування або інше стримування структурного пошкодження тканин, пов'язаного з прогресуванням хвороби) при уникненні довготермінових системних побічних ефектів, пов'язаних з введенням кортикостероїдів, включаючи пригнічення HPA. В одному аспекті забезпечується композиція, в якій мікрочастинкова матриця (така, як PLGA, PLA, гідрогелі, гіалуронова кислота і т. ін.) включає кортикостероїд, і мікрочастинкова композиція кортикостероїду забезпечує принаймні двотижневе, в оптимальному варіанті – принаймні тритижневе, включаючи період до 30 днів і більше, або 60 днів, або 90 днів уповільненого стійкого вивільнення кортикостероїду. В одному аспекті забезпечується композиція, в якій мікрочастинкова матриця (така, як PLGA, PLA, гідрогелі, гіалуронова кислота і т. ін.) включає кортикостероїд, і мікрочастинкова композиція кортикостероїду забезпечує принаймні двотижневе, в оптимальному варіанті – принаймні тритижневе, включаючи період до 30 днів і більше, або 60 днів, або 90 днів уповільненого стійкого вивільнення кортикостероїду зі швидкістю, яка не викликає несприятливого пригнічення HPA-осі. Мікрочастинкова композиція кортикостероїду зберігає тривалу ефективність навіть після того, як кортикостероїд залишає місце введення, наприклад, у внутрішньосуглобному просторі, і/або після того, як кортикостероїд перестає виявлятись у великому колі кровообігу. Мікрочастинкова композиція кортикостероїду зберігає тривалу ефективність навіть після того, як 2 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 мікрочастинкова композиція кортикостероїду залишає місце введення, наприклад, у внутрішньосуглобному просторі, і/або мікрочастинкова композиція кортикостероїду перестає виявлятись у великому колі кровообігу. Мікрочастинкова композиція кортикостероїду зберігає тривалу ефективність навіть після того, як мікрочастинкова композиція кортикостероїду перестає вивільнювати терапевтично ефективну кількість кортикостероїду. Наприклад, у деяких варіантах втілення кортикостероїд, вивільнений мікрочастинковою композицією, зберігає ефективність протягом принаймні одного тижня, принаймні двох тижнів, принаймні трьох тижнів, принаймні чотирьох тижнів, принаймні п'яти тижнів, принаймні шести тижнів, принаймні семи тижнів, принаймні восьми тижнів, принаймні дев'яти тижнів, принаймні десяти тижнів або понад дванадцять тижнів після введення. У деяких варіантах втілення кортикостероїд, вивільнений мікрочастинковою композицією, зберігає ефективність протягом періоду часу, який принаймні вдвічі перевищує, принаймні втричі перевищує або більш, ніж утричі перевищує період утримання кортикостероїду та/або мікрочастинкової композиції кортикостероїду. У деяких варіантах втілення уповільнене, стійке вивільнення кортикостероїду не викликає несприятливого пригнічення HPA-осі. У деяких варіантах втілення забезпечується композиція контрольованого або уповільненого вивільнення, у якій мікрочастинкова матриця (така, як PLGA, гідрогелі, гіалуронова кислота і т. ін.) включає кортикостероїд, і композиція може необов'язково демонструвати початково швидке вивільнення, яке також називається початковим "проривом" кортикостероїду протягом першого відрізка часу від 0 до 14 днів, наприклад, від початку 1-го дня до кінця 14-го дня, додатково до уповільненого, стійкого вивільнення кортикостероїду протягом другого відрізка часу принаймні у два тижні, в оптимальному варіанті – принаймні тритижневого, включаючи період до 30 днів і більше, або 60 днів, або 90 днів. Слід зазначити, що у разі, коли рівень кортикостероїдів вимірюють in vitro, може спостерігатися випадковий початковий прорив вивільнення кортикостероїду з мікрочастинкової композиції, але цей початковий прорив не обов'язково спостерігається in vivo. В іншому варіанті втілення забезпечується композиція контрольованого або уповільненого вивільнення, у якій мікрочастинкова матриця (така, як PLGA, гідрогелі, гіалуронова кислота і т. ін.) включає кортикостероїд, і композиція може необов'язково демонструвати початково швидке вивільнення, яке також називається початковим "проривом" кортикостероїду протягом першого відрізка часу від 0 до 14 днів, наприклад, від початку 1-го дня до кінця 14-го дня, додатково до уповільненого, стійкого вивільнення кортикостероїду протягом другого відрізка часу принаймні у два тижні, в оптимальному варіанті принаймні тритижневого, включаючи період до 30 днів і більше, або 60 днів, або 90 днів, причому уповільнене, стійке вивільнення кортикостероїду відбувається зі швидкістю, яка не пригнічує HPA-вісь на рівні, вищому за 50 %, на 14-йь день після введення. У деяких варіантах втілення уповільнене, стійке вивільнення кортикостероїду не викликає несприятливого пригнічення HPA-осі, наприклад, рівень пригнічення HPA-осі дорівнює або є меншим за 35 %, до 14-го дня після введення. У деяких варіантах втілення уповільнене, стійке вивільнення кортикостероїду не викликає значного пригнічення HPA-осі, наприклад, рівень пригнічення HPA-осі є незначним і/або не виявляється на 14-й день після ін'єкції. У деяких варіантах втілення уповільнене, стійке вивільнення кортикостероїду не викликає значного пригнічення HPA-осі, наприклад, рівень пригнічення HPA-осі є незначним у будь-який час після ін'єкції. У деяких варіантах втілення тривалість уповільненого вивільнення становить від 21 дня до 90 днів. У деяких варіантах втілення тривалість уповільненого вивільнення становить від 21 дня до 60 днів. У деяких варіантах втілення тривалість уповільненого вивільнення становить від 14 днів до 30 днів. У деяких варіантах втілення тривалість початкового "прориву" компонента становить від 0 до 10 днів, наприклад, від початку 1-го дня до кінця 10-го дня. У деяких варіантах втілення тривалість початкового "прориву" компонента становить від 0 до 6 днів, наприклад, від початку 1-го дня до кінця 6-го дня. У деяких варіантах втілення тривалість початкового "прориву" компонента становить від 0 до 2 днів, наприклад, від початку 1-го дня до кінця 2-го дня. У деяких варіантах втілення тривалість початкового "прориву" компонента становить від 0 до 1 дня, наприклад, від початку 1-го дня до кінця 1-го дня. Мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, можуть застосовуватись у комбінації з будь-якими з-поміж різних терапевтичних засобів, що також відомо під назвою "котерапія". Наприклад, мікрочастинкові композиції кортикостероїдів можуть застосовуватись у комбінації з розчином або суспензією кортикостероїду негайного вивільнення, що забезпечує інтенсивну місцеву дію з 1-го по 14-й дні після введення і створює системний вплив, який може бути пов'язаний з тимчасовим пригніченням HPA-осі. Наприклад, очікується, що 40 мг ацетоніду триамцинолону негайного вивільнення, який вводять спільно з мікрочастинковою композиція кортикостероїду у внутрішньосуглобний простір, створюватиме 3 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 високу місцеву концентрацію, яка триватиме приблизно 12 днів. Ця висока місцева концентрація має бути пов'язана з піковою концентрацією ацетоніду триамцинолону у плазмі приблизно 10 нг/мл у 1-й день, і протягом перших 12 днів вивільнення ацетоніду триамцинолону з внутрішньосуглобного простору має бути пов'язана з тимчасовим пригніченням HPA-осі з максимальним ефектом приблизно 60 % пригнічення кортизолу у 1-2 дні (Derendorf et al., "Pharmacokinetics and pharmacodynamics of glucocorticoid suspensions after intra-articular administration.” Clin Pharmacol Ther. 39(3) (1986): 313-7). До 12-го дня частка компонента негайного вивільнення у концентрації у плазмі має бути малою, меншою за 0,1 нг/мл, а частка компонента негайного вивільнення у внутрішньосуглобній концентрації також має бути малою. Однак на 12-й день і далі мікрочастинкова композиція кортикостероїду має продовжувати вивільнення кортикостероїду у внутрішньосуглобний простір зі швидкістю, яка подовжує тривалість терапевтичного ефекту і не пригнічує HPA-вісь. У деяких варіантах втілення один кортикостероїд застосовують у компонентах як негайного вивільнення, так і уповільненого вивільнення. У деяких варіантах втілення компонент негайного вивільнення містить кортикостероїд, який є відмінним від кортикостероїду компонента уповільненого вивільнення. У деяких варіантах втілення уповільнене, стійке вивільнення кортикостероїду не викликає несприятливого пригнічення HPA-осі. У деяких варіантах втілення період уповільненого вивільнення становить від 21 дня до 90 днів. У деяких варіантах втілення період уповільненого вивільнення становить від 21 дня до 60 днів. У деяких варіантах втілення період уповільненого вивільнення становить від 14 днів до 30 днів. У деяких варіантах втілення інтенсивна місцева дія, зумовлена компонентом негайного вивільнення, триває з 1-го по 14-й дні. У деяких варіантах втілення інтенсивна місцева дія, зумовлена компонентом негайного вивільнення, триває від 1 дня до 10 днів. У деяких варіантах втілення інтенсивна місцева дія, зумовлена компонентом негайного вивільнення, триває від 1 дня до 8 днів. У деяких варіантах втілення інтенсивна місцева дія, зумовлена компонентом негайного вивільнення, триває від 1 дня до 6 днів. У деяких варіантах втілення інтенсивна місцева дія, зумовлена компонентом негайного вивільнення, триває від 1 дня до 4 днів. Після введення мікрочастинкова композиція кортикостероїду може забезпечувати початкове вивільнення кортикостероїду у місці введення, наприклад, у внутрішньосуглобному просторі та/або навколосуглобному просторі. Відразу після зниження початкового вивільнення кортикостероїду контрольоване або уповільнене вивільнення мікрочастинкових композицій кортикостероїдів продовжує забезпечувати терапевтичну (наприклад, внутрішньосуглобну та/або навколосуглобну) концентрацію кортикостероїду для пригнічення запалення, підтримання знеболювання та/або уповільнення, затримки або реверсування структурного пошкодження тканин протягом додаткового періоду терапії після введення (Фіг. 1, верхні криві). Однак системний вплив, пов'язаний з компонентом уповільненого вивільнення не пригнічує HPA-вісь (Фіг. 1, нижні криві). Таким чином, винахід охоплює способи терапії та композиції, які можуть демонструвати початкове вивільнення кортикостероїду з наступним контрольованим або уповільненим вивільненням, причому терапія включає період терапії, протягом якого кортикостероїд вивільнюється з компонента уповільненого вивільнення, і рівень кортикостероїду у плазмі не викликає несприятливого пригнічення HPA-осі. У деяких варіантах втілення тривалість уповільненого вивільнення становить від 21 дня до 90 днів. У деяких варіантах втілення тривалість уповільненого вивільнення становить від 21 дня до 60 днів. У деяких варіантах втілення тривалість уповільненого вивільнення становить від 14 днів до 30 днів. У деяких варіантах втілення тривалість вивільнення форми негайного вивільнення становить від 1 дня до 14 днів. У деяких варіантах втілення тривалість вивільнення форми негайного вивільнення становить 1 дня до 10 днів. У деяких варіантах втілення тривалість вивільнення форми негайного вивільнення становить 1 дня до 8 днів. У деяких варіантах втілення тривалість вивільнення форми негайного вивільнення становить від 1 дня до 6 днів. У деяких варіантах втілення тривалість вивільнення форми негайного вивільнення становить 1 дня до 4 днів. Винахід забезпечує популяції мікрочастинок, які включають кортикостероїд класу B або його фармацевтично прийнятну сіль, включені, домішані, інкапсульовані або іншим чином пов'язані зі співполімерною матрицею молочної кислоти – гліколевої кислоти, де кортикостероїд класу B складає від 22 % до 28 % мікрочастинок. Винахід також забезпечує препарат кортикостероїду класу B контрольованого або уповільненого вивільнення, який включає мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які містять кортикостероїд класу B, де кортикостероїд класу B складає від 22 % до 28 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти. Винахід також забезпечує композиції, які включають (a) мікрочастинки контрольованого або 4 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 уповільненого вивільнення, які включають кортикостероїд класу B та співполімерну матрицю з молочної кислоти – гліколевої кислоти, де кортикостероїд класу B складає від 22 % до 28 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (i) молекулярну масу в діапазоні приблизно від 40 до 70 кДа; (ii) питому в'язкість у діапазоні від 0,3 до 0,5 дл/г; (iii) молярне співвідношення лактиду:гліколіду від 80:20 до 60:40; та/або (iv) співполімер молочної кислоти – гліколевої кислоти має карбоновокислотну кінцеву групу. У деяких варіантах втілення цих популяцій, препаратів та/або композицій співполімер піддається біологічному розкладові. У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти є співполімером молочної та гліколевої кислот (PLGA). У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти має молярне співвідношення молочної кислоти: гліколевої кислоти у діапазоні приблизно від 80:20 до 60:40. У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти має молярне співвідношення молочної кислоти: гліколевої кислоти 75:25. Винахід також забезпечує популяції мікрочастинок, які включають кортикостероїд класу B або його фармацевтично прийнятну сіль, включені, домішані, інкапсульовані або іншим чином пов'язані зі співполімерною матрицею з молочної кислоти – гліколевої кислоти зі змішаною молекулярною масою, де кортикостероїд класу B складає від 12 % до 28 % мікрочастинок. У деяких варіантах втілення мікрочастинкова композиція кортикостероїду включає кортикостероїд класу B та мікрочастинку, одержану з застосуванням 75:25 композиції PLGA з двома PLGAполімерами, один з яких має низьку молекулярну масу, і один має високу молекулярну масу, у співвідношенні два до одного, відповідно. PLGA з низькою молекулярною масою має молекулярну масу у діапазоні 15-35 кДа та питому в'язкість у діапазоні від 0,2 до 0,35 дл/г, а PLGA з високою молекулярною масою має діапазон 70-95 кДа та питому в'язкість у діапазоні від 0,5 до 0,70 дл/г. У цих мікрочастинкових композиціях кортикостероїдів TCA/75:25 PLGA мікрочастинки мають середній діаметр у діапазоні 10-100 мкM. У деяких варіантах втілення мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. Винахід також забезпечує популяції мікрочастинок, які включають кортикостероїд класу B або його фармацевтично прийнятну сіль, включені, домішані, інкапсульовані або іншим чином пов'язані зі співполімерною матрицею молочної кислоти – гліколевої кислоти, яка містить 1020 % триблокспівполімеру (PEG–PLGA-PEG), який має питому в'язкість у діапазоні від 0,6 до 0,8 дл/г, де кортикостероїд класу B складає від 22 % до 28 % мікрочастинок. У деяких варіантах втілення мікрочастинкова композиція кортикостероїду включає кортикостероїд класу B та мікрочастинку, яка одержується з застосуванням 75:25 композиції PLGA і містить 10-20 % триблокспівполімеру (PEG–PLGA-PEG), який має питому в'язкість у діапазоні від 0,6 до 0,8 дл/г. У цих мікрочастинкових композиціях кортикостероїдів TCA/75:25 PLGA мікрочастинки мають середній діаметр у діапазоні 10-100 мкM. У деяких варіантах втілення мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. Ці мікрочастинкові композиції препарати та популяції кортикостероїдів класу B при введенні пацієнтові демонструють меншу кількість небажаних побічних ефектів для пацієнта, наприклад, небажаних ефектів для хрящів або інших структурних тканин пацієнта, порівняно з введенням, наприклад, введенням у внутрішньосуглобний простір суглоба, рівноцінної кількості кортикостероїду класу B без будь-яких мікрочастинок або іншого типу включення, домішування або інкапсуляції. У деяких варіантах втілення кортикостероїдом класу B є ацетонід триамцинолону або його хімічний аналог або фармацевтично прийнятна сіль промислового виробництва. У деяких варіантах втілення загальна доза кортикостероїду, який міститься у мікрочастинках, перебуває у діапазоні 10-90 мг, причому кортикостероїд класу B складає 12-28 % мікрочастинки, наприклад, 22-28 % мікрочастинки (тобто, якщо кортикостероїд складає 28 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 35,7-321,4 мг, і т. д. для всіх значень у межах 22-28 % ударної дози, якщо кортикостероїд складає 25 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 40-360 мг, якщо кортикостероїд складає 22 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 45,5-409,1 мг, якщо кортикостероїд складає 12 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 83,3-750 мг, і т. д. для всіх значень у межах 12-28 % 5 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 ударної дози). У деяких варіантах втілення кортикостероїд класу B, який міститься у мікрочастинках, складає 12-28 % мікрочастинки, наприклад, 22-28 % мікрочастинки, і загальна доза кортикостероїду перебуває у діапазоні, вибраному з-поміж 10-80 мг, 10-70 мг, 10-60 мг, 1050 мг, 10-40 мг, 10-30 мг, 10-20 мг, 20-90 мг, 20-80 мг, 20-70 мг, 20-60 мг, 20-50 мг, 20-40 мг, 2030 мг, 30-90 мг, 30-80 мг, 30-70 мг, 30-60 мг, 30-50 мг, 30-40 мг, 40-90 мг, 40-80 мг, 40-70 мг, 4060 мг, 40-50 мг, 50-90 мг, 50-80 мг, 50-70 мг, 50-60 мг, 60-90 мг, 60-80 мг, 60-70 мг, 70-90 мг, 7080 мг та 80-90 мг. У деяких варіантах втілення кортикостероїд класу B вивільнюється протягом періоду від 14 днів до 90 днів. У деяких варіантах втілення мікрочастинки мають середній діаметр від 10 мкм до 100 мкм, наприклад, мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. У деяких варіантах втілення мікрочастинки також включають поліетиленгліколеву (PEG) частину, причому PEG-частина включає від 25 % до 0 % масових відсотків мікрочастинки. У деяких варіантах втілення мікрочастинок, які включають PEG-частину, популяції, препарати та/або композиції згідно з винаходом не потребують присутності PEG для того, щоб демонструвати потрібну кінетику уповільненого вивільнення кортикостероїду та потрібний профіль біодоступності. В одному варіанті втілення цих популяцій, препаратів та/або композицій мікрочастинкова композиція кортикостероїду включає ацетонід триамцинолону (TCA) та мікрочастинку, одержану з застосуванням 75:25 композиції PLGA, яка має питому в'язкість у діапазоні від 0,3 до 0,5 дл/г та/або молекулярну масу у діапазоні 40-70 кДа, наприклад, 50-60 кДа. У цих мікрочастинкових композиціях кортикостероїдів TCA/75:25 PLGA мікрочастинки мають середній діаметр у діапазоні 10-100 мкM. У деяких варіантах втілення мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будьякої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. Для мікрочастинкових композицій TCA/75:25 PLGA діапазон відсотка вмісту TCA становить 22-28 %. В одному варіанті втілення відсоток вмісту TCA у мікрочастинках становить 25 %. Мікрочастинки у мікрочастинкових композиціях TCA/PLGA можуть бути рецептовані з застосуванням PLGA-полімерів, які мають діапазон молекулярних мас від 40 до 70 кДа, у найкращому варіанті – від 50 до 60 кДа, і діапазон характеристичної в'язкості від 0,5 до 0,5 дл/г, у найкращому варіанті – від 0,38 до 0,42 дл/г. Для мікрочастинкових композицій TCA/75:25 PLGA загальна доза кортикостероїду, який міститься у мікрочастинках, перебуває у діапазоні 10-90 мг, причому TCA складає 22-28 % мікрочастинки (тобто, якщо TCA складає 25 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 40-360 мг, якщо TCA складає 22 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 45,5-409,1 мг, якщо TCA складає 28 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 35,7-321,4 мг, і т. д. для всіх значень у межах 22-28 % ударної дози). У деяких варіантах втілення загальна доза кортикостероїду, який міститься у мікрочастинках, перебуває у діапазоні, вибраному з-поміж 10-80 мг, 10-70 мг, 10-60 мг, 10-50 мг, 10-40 мг, 10-30 мг, 10-20 мг, 20-90 мг, 20-80 мг, 20-70 мг, 20-60 мг, 20-50 мг, 20-40 мг, 20-30 мг, 30-90 мг, 30-80 мг, 30-70 мг, 30-60 мг, 30-50 мг, 30-40 мг, 40-90 мг, 40-80 мг, 40-70 мг, 40-60 мг, 40-50 мг, 50-90 мг, 50-80 мг, 50-70 мг, 50-60 мг, 60-90 мг, 60-80 мг, 60-70 мг, 70-90 мг, 70-80 мг та 80-90 мг. У деяких варіантах втілення мікрочастинкових композицій TCA/75:25 PLGA мікрочастинки також включають поліетиленгліколеву (PEG) частину, причому PEG-частина включає від 25 % до 0 % масових відсотків мікрочастинки. У деяких варіантах втілення мікрочастинок, які включають PEG-частину, популяції, препарати та/або композиції згідно з винаходом не потребують присутності PEG для того, щоб демонструвати потрібну кінетику уповільненого вивільнення кортикостероїду та потрібний профіль біодоступності. В одному варіанті втілення цих популяцій, препаратів та/або композицій мікрочастинкова композиція кортикостероїду включає ацетонід триамцинолону (TCA) та мікрочастинку, яка одержується з застосуванням 75:25 композиції PLGA і містить 10-20 % триблокспівполімеру (PEG–PLGA-PEG), який має питому в'язкість у діапазоні від 0,6 до 0,8 дл/г. У цих мікрочастинкових композиціях кортикостероїдів TCA/75:25 PLGA мікрочастинки мають середній діаметр у діапазоні 10-100 мкM. У деяких варіантах втілення мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. 6 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. В одному варіанті втілення цих популяцій, препаратів та/або композицій мікрочастинкова композиція кортикостероїду включає ацетонід триамцинолону (TCA) та мікрочастинку, яка одержується з застосуванням 75:25 композиції PLGA з двома PLGA-полімерами, один з яких має низьку молекулярну масу, і один має високу молекулярну масу,у співвідношенні два до одного, відповідно. PLGA з низькою молекулярною масою має молекулярну масу у діапазоні 1535 кДа та питому в'язкість у діапазоні від 0,2 до 0,35 дл/г, а PLGA з високою молекулярною масою має діапазон 70-95 кДа та питому в'язкість у діапазоні від 0,5 до 0,70 дл/г. У цих мікрочастинкових композиціях кортикостероїдів TCA/75:25 PLGA мікрочастинки мають середній діаметр у діапазоні 10-100 мкM. У деяких варіантах втілення мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. Ці мікрочастинкові композиції, препарати TCA та їх популяції при введенні пацієнтові демонструють меншу кількість небажаних побічних ефектів для пацієнта, наприклад, небажаних ефектів для хрящів або інших структурних тканин пацієнта, порівняно з введенням, наприклад, введенням у внутрішньосуглобний простір суглоба, рівноцінної кількості TCA без будь-яких мікрочастинок або іншого типу включення, домішування або інкапсуляції. В іншому варіанті втілення мікрочастинкова композиція кортикостероїду включає кортикостероїд класу A, C або D та мікрочастинку, одержану з застосуванням 50:50 композиції PLGA. Наприклад, у деяких варіантах втілення кортикостероїдом класу A є преднізолон. У деяких варіантах втілення кортикостероїдом класу C є бетаметазон. У деяких варіантах втілення кортикостероїдом класу D є флутиказон або пропіонат флутиказону. У цих мікрочастинкових композиціях кортикостероїдів класів A, C або D мікрочастинки мають середній діаметр у діапазоні 10-100 мкM. У деяких варіантах втілення мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. Для мікрочастинкових композицій PLGA класу A та/або класу C діапазон відсоткового вмісту кортикостероїду становить 10-40 %, наприклад, 15 % - 30 %. Для мікрочастинкових композицій PLGA класу D діапазон відсоткового вмісту кортикостероїду становить 8-20 %. Мікрочастинки у мікрочастинкових композиціях PLGA класів A, C або D можуть бути рецептовані з застосуванням PLGA-полімерів, які мають діапазон характеристичної в'язкості від 0,35 до 0,5 дл/г та приблизну молекулярну масу від 40 кДа до 70 кДа. Ці мікрочастинкові композиції, препарати кортикостероїдів класів A, C або D та їх популяції при введенні пацієнтові демонструють меншу кількість небажаних побічних ефектів для пацієнта, наприклад, небажаних ефектів для хрящів або інших структурних тканин пацієнта, порівняно з введенням, наприклад, введенням у внутрішньосуглобний простір суглоба, рівноцінної кількості кортикостероїду класів A, C або D без будь-яких мікрочастинок або іншого типу включення, домішування або інкапсуляції. Винахід забезпечує популяції мікрочастинок, які включають кортикостероїд класу A або його фармацевтично прийнятну сіль, включені, домішані, інкапсульовані або іншим чином пов'язані зі співполімерною матрицею з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу A складає від 15 % до 30 % мікрочастинок. Винахід також забезпечує препарати контрольованого або уповільненого вивільнення кортикостероїду класу A, які включають мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які включають кортикостероїд класу A, причому кортикостероїд класу A складає від 10 % до 40 %, наприклад, від 15 % до 30 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти. Винахід забезпечує композиції, які включають (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу A та співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу A складає від 15 % до 30 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (i) молекулярну масу в діапазоні приблизно від 40 до 70 кДа; (ii) питому в'язкість у діапазоні від 0,35 до 0,5 дл/г; (iii) молярне співвідношення лактиду:гліколіду від 60:40 до 45:55; та/або (iv) співполімер молочної кислоти – гліколевої кислоти має карбоновокислотну кінцеву групу. 7 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах втілення співполімер піддається біологічному розкладові. У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти є співполімером молочної та гліколевої кислот (PLGA). У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти має молярне співвідношення молочної кислоти: гліколевої кислоти у діапазоні приблизно від 60:40 до 45:55. У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти має молярне співвідношення молочної кислоти: гліколевої кислоти 50:50. У деяких варіантах втілення кортикостероїдом класу A є преднізолон або його хімічний аналог або фармацевтично прийнятна сіль промислового виробництва. У деяких варіантах втілення загальна доза кортикостероїду класу A, який міститься у мікрочастинках, перебуває у діапазоні, вибраному з-поміж 10-250 мг, причому кортикостероїд класу A складає 10-40 %, наприклад, 15-30 % мікрочастинки (тобто, якщо кортикостероїд складає 10 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 100-2500 мг, якщо кортикостероїд складає 15 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 66,7-1666,7 мг, якщо кортикостероїд складає 20 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 50-1250 мг, якщо кортикостероїд складає 25 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 40-1000 мг, якщо кортикостероїд складає 30 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 33,3-833,3 мг, якщо кортикостероїд складає 40 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 25-625 мг, і т. д., для всіх значень 10-40 % ударної дози). Наприклад, у деяких варіантах втілення загальна доза кортикостероїду перебуває у діапазоні 10-225 мг, 10-200 мг, 10-175 мг, 10-150 мг, 10-120 мг, 10-100 мг, 10-75 мг, 10-50 мг, 10-25 мг, 20-250 мг, 20-225 мг, 20200 мг, 20-175 мг, 20-150 мг, 20-125 мг, 20-100 мг, 20-75 мг, 20-50 мг, 30-250 мг, 30-225 мг, 30200 мг, 30-175 мг, 30-150 мг, 30-120 мг, 30-100 мг, 30-75 мг, 30-50 мг, 40-250 мг, 40-225 мг, 40200 мг, 40-175 мг, 40-150 мг, 40-120 мг, 40-100 мг, 40-75 мг, 50-250 мг, 50-225 мг, 50-200 мг, 50175 мг, 50-150 мг, 50-120 мг, 50-100 мг, 50-75 мг, 60-250 мг, 60-225 мг, 60-200 мг, 60-175 мг, 60150 мг, 60-120 мг, 60-100 мг, 60-75 мг, 70-250 мг, 70-225 мг, 70-200 мг, 70-175 мг, 70-150 мг, 70120 мг, 70-100 мг, 80-250 мг, 80-225 мг, 80-200 мг, 80-175 мг, 80-150 мг, 80-120 мг, 80-100 мг, 90250 мг, 90-225 мг, 90-200 мг, 90-175 мг, 90-150 мг або 90-120 мг. У деяких варіантах втілення кортикостероїд класу A вивільнюється протягом періоду від 14 днів до 90 днів. У деяких варіантах втілення мікрочастинки мають середній діаметр від 10 мкм до 100 мкм, наприклад, мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. У деяких варіантах втілення мікрочастинки також включають поліетиленгліколеву (PEG) частину, причому PEG-частина включає від 25 % до 0 % масових відсотків мікрочастинки. У деяких варіантах втілення мікрочастинок, які включають PEG-частину, популяції, препарати та/або композиції згідно з винаходом не потребують присутності PEG для того, щоб демонструвати потрібну кінетику уповільненого вивільнення кортикостероїду та потрібний профіль біодоступності. В одному варіанті втілення цих популяцій, препаратів та/або композицій мікрочастинкова композиція кортикостероїду включає преднізолон та мікрочастинку, одержану з застосуванням 50:50 композиції PLGA, яка має молекулярну масу у діапазоні від 40 кДа до 70 кДа. У цих мікрочастинкових композиціях кортикостероїдів з преднізолону/50:50 PLGA мікрочастинки мають середній діаметр у діапазоні 10-100 мкM. У деяких варіантах втілення мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Для мікрочастинкових композицій з преднізолону/50:50 PLGA діапазон відсоткового вмісту преднізолону становить 10-40 %, наприклад, 15-30 %. У деяких варіантах втілення мікрочастинкових композицій з преднізолону/50:50 PLGA мікрочастинки також включають поліетиленгліколеву (PEG) частину, причому PEG-частина включає від 25 % до 0 % масових відсотків мікрочастинки. У деяких варіантах втілення мікрочастинок, які включають PEG-частину, популяції, препарати та/або композиції згідно з винаходом не потребують присутності PEG для того, щоб демонструвати потрібну кінетику уповільненого вивільнення кортикостероїду та потрібний профіль біодоступності. Винахід забезпечує популяції мікрочастинок, які включають кортикостероїд класу C або його фармацевтично прийнятну сіль, включені, домішані, інкапсульовані або іншим чином пов'язані зі співполімерною матрицею з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу C складає від 10 % до 40 % мікрочастинок, наприклад, від 15 % до 30 % мікрочастинок. Винахід також забезпечує препарати кортикостероїду класу C контрольованого або 8 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 уповільненого вивільнення, які включають мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які включають кортикостероїд класу C, причому кортикостероїд класу C складає від 15 % до 30 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти. Винахід забезпечує композиції, які включають (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу C та співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу C складає від 15 % до 30 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (i) молекулярну масу в діапазоні приблизно від 40 до 70 кДа; (ii) питому в'язкість у діапазоні від 0,35 до 0,5 дл/г; (iii) молярне співвідношення лактиду:гліколіду від 60:40 до 45:55; та/або (iv) співполімер молочної кислоти – гліколевої кислоти має карбоновокислотну кінцеву групу. В одному варіанті втілення цих популяцій, препаратів та/або композицій, співполімер піддається біологічному розкладові. У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти є співполімером молочної та гліколевої кислот (PLGA). У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти має молярне співвідношення молочної кислоти: гліколевої кислоти у діапазоні приблизно від 60:40 до 45:55. У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти має молярне співвідношення молочної кислоти: гліколевої кислоти 50:50. У деяких варіантах втілення кортикостероїдом класу C є бетаметазон або його хімічний аналог або фармацевтично прийнятна сіль промислового виробництва. У деяких варіантах втілення загальна доза кортикостероїду класу C, який міститься у мікрочастинках, перебуває у діапазоні, вибраному з-поміж 2-250 мг, причому кортикостероїд класу C складає 10-40 %, наприклад, 15-30 % мікрочастинки (тобто, якщо кортикостероїд складає 10 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 20-2500 мг, якщо кортикостероїд складає 15 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 13,3-1666,7 мг, якщо кортикостероїд складає 20 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 10-1250 мг, якщо кортикостероїд складає 25 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 8-1000 мг, якщо кортикостероїд складає 30 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 6,67-833,3 мг, якщо кортикостероїд складає 40 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 5-625 мг, і т. д., для всіх значень 10-40 % ударної дози). Наприклад, у деяких варіантах втілення загальна доза кортикостероїду перебуває у діапазоні 2-225 мг, 2-200 мг, 2175 мг, 2-150 мг, 2-120 мг, 2-100 мг, 2-75 мг, 2-60 мг, 2-55 мг, 2-50 мг, 2-45 мг, 2-40 мг, 2-35 мг, 230 мг, 2-25 мг, 2-20 мг, 2-15 мг, 2-10 мг, 4-225 мг, 4-200 мг, 4-175 мг, 4-150 мг, 4-120 мг, 4-100 мг, 4-75 мг, 4-60 мг, 4-55 мг, 4-50 мг, 4-45 мг, 4-40 мг, 4-35 мг, 4-30 мг, 4-25 мг, 4-20 мг, 4-15 мг, 4-10 мг, 5-225 мг, 5-200 мг, 5-175 мг, 5-150 мг, 5-120 мг, 5-100 мг, 5-75 мг, 5-60 мг, 5-55 мг, 5-50 мг, 545 мг, 5-40 мг, 5-35 мг, 5-30 мг, 5-25 мг, 5-20 мг, 5-15 мг, 5-10 мг, 6-225 мг, 6-200 мг, 6-175 мг, 6150 мг, 6-120 мг, 6-100 мг, 6-75 мг, 6-60 мг, 6-55 мг, 6-50 мг, 6-45 мг, 6-40 мг, 6-35 мг, 6-30 мг, 625 мг, 6-20 мг, 6-15 мг, 6-10 мг, 8-225 мг, 8-200 мг, 8-175 мг, 8-150 мг, 8-120 мг, 8-100 мг, 8-75 мг, 8-60 мг, 8-55 мг, 8-50 мг, 8-45 мг, 8-40 мг, 8-35 мг, 8-30 мг, 8-25 мг, 8-20 мг, 8-15 мг, 8-10 мг, 10225 мг, 10-200 мг, 10-175 мг, 10-150 мг, 10-120 мг, 10-100 мг, 10-75 мг, 10-50 мг, 10-25 мг, 20-250 мг, 20-225 мг, 20-200 мг, 20-175 мг, 20-150 мг, 20-125 мг, 20-100 мг, 20-75 мг, 20-50 мг, 30-250 мг, 30-225 мг, 30-200 мг, 30-175 мг, 30-150 мг, 30-120 мг, 30-100 мг, 30-75 мг, 30-50 мг, 40-250 мг, 40-225 мг, 40-200 мг, 40-175 мг, 40-150 мг, 40-120 мг, 40-100 мг, 40-75 мг, 50-250 мг, 50-225 мг, 50-200 мг, 50-175 мг, 50-150 мг, 50-120 мг, 50-100 мг, 50-75 мг, 60-250 мг, 60-225 мг, 60-200 мг, 60-175 мг, 60-150 мг, 60-120 мг, 60-100 мг, 60-75 мг, 70-250 мг, 70-225 мг, 70-200 мг, 70-175 мг, 70-150 мг, 70-120 мг, 70-100 мг, 80-250 мг, 80-225 мг, 80-200 мг, 80-175 мг, 80-150 мг, 80-120 мг, 80-100 мг, 90-250 мг, 90-225 мг, 90-200 мг, 90-175 мг, 90-150 мг або 90-120 мг. У деяких варіантах втілення кортикостероїд класу C вивільнюється протягом періоду від 14 днів до 90 днів. У деяких варіантах втілення мікрочастинки мають середній діаметр від 10 мкм до 100 мкм, наприклад, мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. У деяких варіантах втілення мікрочастинки також включають поліетиленгліколеву (PEG) частину, причому PEG-частина включає від 25 % до 0 % масових відсотків мікрочастинки. У деяких варіантах втілення мікрочастинок, які включають PEG-частину, популяції, препарати та/або композиції згідно з винаходом не потребують присутності PEG для того, щоб демонструвати потрібну кінетику уповільненого вивільнення кортикостероїду та потрібний 9 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 профіль біодоступності. В одному варіанті втілення цих популяцій, препаратів та/або композицій мікрочастинкова композиція кортикостероїду включає бетаметазон та мікрочастинку, що зроблена з застосуванням 50:50 композиції PLGA, яка має молекулярну масу у діапазоні від 40 кДа до 70 кДа. У цих мікрочастинкових композиціях кортикостероїдів з бетаметазоном/50:50 PLGA мікрочастинки мають середній діаметр у діапазоні 10-100 мкM. У деяких варіантах втілення мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. Для мікрочастинкових композицій з бетаметазону/50:50 PLGA діапазон відсоткового вмісту преднізолону становить 10-40 %, наприклад, 15-30 %. У деяких варіантах втілення мікрочастинкових композицій з бетаметазону/50:50 PLGA мікрочастинки також включають поліетиленгліколеву (PEG) частину, причому PEG-частина включає від 25 % до 0 % масових відсотків мікрочастинки. У деяких варіантах втілення мікрочастинок, які включають PEG-частину, популяції, препарати та/або композиції згідно з винаходом не потребують присутності PEG для того, щоб демонструвати потрібну кінетику уповільненого вивільнення кортикостероїду та потрібний профіль біодоступності. Винахід забезпечує популяції мікрочастинок, які включають кортикостероїд класу D або його фармацевтично прийнятну сіль, включені, домішані, інкапсульовані або іншим чином пов'язані зі співполімерною матрицею з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу D складає від 8 % до 20 % мікрочастинок, наприклад, від 10 % до 20 % мікрочастинок. Винахід також забезпечує препарат контрольованого або уповільненого вивільнення кортикостероїду класу D, який включає мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які включають кортикостероїд класу D, причому кортикостероїд класу D складає від 8 % до 20 %, наприклад, від 10 % до 20 % мікрочастинок співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти. Винахід забезпечує композиції, які включають (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу D та співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу D складає від 8 % до 20 % мікрочастинок, наприклад, від 10 % до 20 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (i) молекулярну масу в діапазоні приблизно від 40 до 70 кДа; (ii) питому в'язкість у діапазоні від 0,35 до 0,5 дл/г; (iii) молярне співвідношення лактиду:гліколіду від 60:40 до 45:55; та/або (iv) співполімер молочної кислоти – гліколевої кислоти має карбоновокислотну кінцеву групу. В одному варіанті втілення цих популяцій, препаратів та/або композицій, співполімер піддається біологічному розкладові. У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти є співполімером молочної та гліколевої кислот (PLGA). У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти має молярне співвідношення молочної кислоти: гліколевої кислоти у діапазоні приблизно від 60:40 до 45:55. У деяких варіантах втілення співполімер молочної кислоти – гліколевої кислоти має молярне співвідношення молочної кислоти: гліколевої кислоти 50:50. У деяких варіантах втілення кортикостероїдом класу D є пропіонат флутиказону, флутиказон, або його хімічний аналог або фармацевтично прийнятна сіль промислового виробництва. У деяких варіантах втілення загальна доза кортикостероїду класу D, який міститься у мікрочастинках, перебуває у діапазоні, вибраному з-поміж 1-250 мг, причому кортикостероїд класу D складає 8-20 % мікрочастинки (тобто, якщо кортикостероїд складає 8 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 12,5-3125 мг, якщо кортикостероїд складає 10 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 10-2500 мг, якщо кортикостероїд складає 15 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 6,671666,7 мг, якщо кортикостероїд складає 20 % мікрочастинки, маса мікрочастинки перебуває у діапазоні 5-1250 мг, і т. д. для всіх значень у межах 10-20 % ударної дози). Наприклад, у деяких варіантах втілення загальна доза кортикостероїду перебуває у діапазоні 1-225 мг, 1-200 мг, 1175 мг, 1-150 мг, 1-120 мг, 1-100 мг, 1-75 мг, 1-60 мг, 1-55 мг, 1-50 мг, 1-45 мг, 1-40 мг, 1-35 мг, 130 мг, 1-25 мг, 1-20 мг, 1-15 мг, 1-10 мг, 2-225 мг, 2-200 мг, 2-175 мг, 2-150 мг, 2-120 мг, 2-100 мг, 2-75 мг, 2-60 мг, 2-55 мг, 2-50 мг, 2-45 мг, 2-40 мг, 2-35 мг, 2-30 мг, 2-25 мг, 2-20 мг, 2-15 мг, 2-10 мг, 3-225 мг, 3-200 мг, 3-175 мг, 3-150 мг, 3-120 мг, 3-100 мг, 3-75 мг, 3-60 мг, 3-55 мг, 3-50 мг, 345 мг, 3-40 мг, 3-35 мг, 3-30 мг, 3-25 мг, 3-20 мг, 3-15 мг, 3-10 мг, 4-225 мг, 4-200 мг, 4-175 мг, 4150 мг, 4-120 мг, 4-100 мг, 4-75 мг, 4-60 мг, 4-55 мг, 4-50 мг, 4-45 мг, 4-40 мг, 4-35 мг, 4-30 мг, 425 мг, 4-20 мг, 4-15 мг, 4-10 мг, 5-225 мг, 5-200 мг, 5-175 мг, 5-150 мг, 5-120 мг, 5-100 мг, 5-75 мг, 10 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 5-60 мг, 5-55 мг, 5-50 мг, 5-45 мг, 5-40 мг, 5-35 мг, 5-30 мг, 5-25 мг, 5-20 мг, 5-15 мг, 5-10 мг, 6225 мг, 6-200 мг, 6-175 мг, 6-150 мг, 6-120 мг, 6-100 мг, 6-75 мг, 6-60 мг, 6-55 мг, 6-50 мг, 6-45 мг, 6-40 мг, 6-35 мг, 6-30 мг, 6-25 мг, 6-20 мг, 6-15 мг, 6-10 мг, 8-225 мг, 8-200 мг, 8-175 мг, 8-150 мг, 8-120 мг, 8-100 мг, 8-75 мг, 8-60 мг, 8-55 мг, 8-50 мг, 8-45 мг, 8-40 мг, 8-35 мг, 8-30 мг, 8-25 мг, 820 мг, 8-15 мг, 8-10 мг, 10-225 мг, 10-200 мг, 10-175 мг, 10-150 мг, 10-120 мг, 10-100 мг, 10-75 мг, 10-50 мг, 10-25 мг, 20-250 мг, 20-225 мг, 20-200 мг, 20-175 мг, 20-150 мг, 20-125 мг, 20-100 мг, 20-75 мг, 20-50 мг, 30-250 мг, 30-225 мг, 30-200 мг, 30-175 мг, 30-150 мг, 30-120 мг, 30-100 мг, 30-75 мг, 30-50 мг, 40-250 мг, 40-225 мг, 40-200 мг, 40-175 мг, 40-150 мг, 40-120 мг, 40-100 мг, 40-75 мг, 50-250 мг, 50-225 мг, 50-200 мг, 50-175 мг, 50-150 мг, 50-120 мг, 50-100 мг, 50-75 мг, 60-250 мг, 60-225 мг, 60-200 мг, 60-175 мг, 60-150 мг, 60-120 мг, 60-100 мг, 60-75 мг, 70-250 мг, 70-225 мг, 70-200 мг, 70-175 мг, 70-150 мг, 70-120 мг, 70-100 мг, 80-250 мг, 80-225 мг, 80-200 мг, 80-175 мг, 80-150 мг, 80-120 мг, 80-100 мг, 90-250 мг, 90-225 мг, 90-200 мг, 90-175 мг, 90-150 мг або 90-120 мг. У деяких варіантах втілення кортикостероїд класу D вивільнюється протягом періоду від 14 днів до 90 днів. У деяких варіантах втілення мікрочастинки мають середній діаметр від 10 мкм до 100 мкм, наприклад, мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. У деяких варіантах втілення мікрочастинки також включають поліетиленгліколеву (PEG) частину, причому PEG-частина включає від 25 % до 0 % масових відсотків мікрочастинки. У деяких варіантах втілення мікрочастинок, які включають PEG-частину, популяції, препарати та/або композиції згідно з винаходом не потребують присутності PEG для того, щоб демонструвати потрібну кінетику уповільненого вивільнення кортикостероїду та потрібний профіль біодоступності. В одному варіанті втілення цих популяцій, препаратів та/або композицій мікрочастинкова композиція кортикостероїду включає пропіонат флутиказону або флутиказон та мікрочастинку, одержану з застосуванням 50:50 композиції PLGA, яка має молекулярну масу у діапазоні від 40 кДа до 70 кДа. У цих мікрочастинкових композиціях кортикостероїдів з флутиказону або пропіонату флутиказону/50:50 PLGA мікрочастинки мають середній діаметр у діапазоні 10-100 мкM. У деяких варіантах втілення мікрочастинки мають середній діаметр у діапазоні 20-100 мкM, 20-90 мкM, 30-100 мкM, 30-90 мкM або 10-90 мкM. Слід розуміти, що ці діапазони стосуються середнього діаметра всіх мікрочастинок у даній популяції. Діаметр будь-якої окремої мікрочастинки може бути у межах стандартної похибки у більший або менший бік від середнього діаметра. Для мікрочастинкових композицій з флутиказону або пропіонату флутиказону/50:50 PLGA діапазон відсоткового вмісту преднізолону становить 10-20 %. У деяких варіантах втілення мікрочастинкових композицій з флутиказону або пропіонату флутиказону/50:50 PLGA мікрочастинки також включають поліетиленгліколеву (PEG) частину, причому PEG-частина включає від 25 % до 0 % масових відсотків мікрочастинки. У деяких варіантах втілення мікрочастинок, які включають PEG-частину, популяції, препарати та/або композиції згідно з винаходом не потребують присутності PEG для того, щоб демонструвати потрібну кінетику уповільненого вивільнення кортикостероїду та потрібний профіль біодоступності. Ці варіанти втілення мікрочастинкових композицій кортикостероїдів було вибрано через те, що комбінація класу кортикостероїду, типу мікрочастинки, молекулярної маси полімерів, які застосовують для створення мікрочастинок, молярного співвідношення лактиду:гліколіду та/або відсоток вмісту кортикостероїду демонструють потрібну кінетику вивільнення. Ці варіанти втілення також демонструють потрібну кінетику вивільнення з мінімальним тривалим пригніченням HPA-осі. Винахід забезпечує способи лікування від болю або запалення у пацієнта, які включають введення вищезгаданому пацієнтові терапевтично ефективної кількості популяції мікрочастинок, вибраної з-поміж популяцій, до яких належать: (i) популяція мікрочастинок, які включають кортикостероїд класу B або його фармацевтично прийнятну сіль, включені у співполімерну матрицю з молочної кислоти – гліколевої кислоти, де кортикостероїд класу B складає від 22 % до 28 % мікрочастинок; (ii) популяція мікрочастинок, які включають кортикостероїд класу A або його фармацевтично прийнятну сіль, включені у співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу A включає від 15 % до 30 % мікрочастинок; (iii) популяція мікрочастинок, які включають кортикостероїд класу C або його фармацевтично прийнятну сіль, включені у співполімерну матрицю з молочної кислоти 11 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 – гліколевої кислоти, причому кортикостероїд класу C включає від 15 % до 30 % мікрочастинок; та (iv) популяція мікрочастинок, які включають кортикостероїд класу D або його фармацевтично прийнятну сіль, включені у співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу D включає від 8 % до 20 % мікрочастинок. У деяких варіантах втілення популяція мікрочастинок вивільнює кортикостероїд протягом принаймні 14 днів зі швидкістю, яка не викликає несприятливого пригнічення гіпоталамо-гіпофізарно-надниркової осі (HPA-осі). У деяких варіантах втілення популяція мікрочастинок контрольовано або уповільнено вивільнює кортикостероїд, таким чином, що рівень пригнічення кортизолу дорівнює або є нижчим за 35 % до 14-го дня після введення. У деяких варіантах втілення популяція мікрочастинок контрольовано або уповільнено вивільнює кортикостероїд, таким чином, що пригнічення кортизолу є незначним і/або не виявляється до 14-го дня після введення. У деяких варіантах втілення популяція мікрочастинок контрольовано або уповільнено вивільнює кортикостероїд, таким чином, що пригнічення кортизолу є незначним у будь-який час після введення. Винахід забезпечує способи лікування від болю або запалення у пацієнта, які включають введення вищезгаданому пацієнтові терапевтично ефективної кількості препарату контрольованого або уповільненого вивільнення, вибраного з-поміж препаратів, до яких належать: (i) препарат кортикостероїду класу B контрольованого або уповільненого вивільнення, який включає мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які містять кортикостероїд класу B, де кортикостероїд класу B складає від 22 % до 28 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти; (ii) препарат контрольованого або уповільненого вивільнення кортикостероїду класу A, який включає мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які включають кортикостероїд класу A, причому кортикостероїд класу A включає від 15 % до 30 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти; (iii) препарат контрольованого або уповільненого вивільнення кортикостероїду класу C, який включає мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які включають кортикостероїд класу C, причому кортикостероїд класу C включає від 15 % до 30 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти; та (iv) препарат контрольованого або уповільненого вивільнення кортикостероїду класу D, який включає мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які включають кортикостероїд класу D, причому кортикостероїд класу D включає від 8 % до 20 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти. У деяких варіантах втілення препарат контрольованого або уповільненого вивільнення вивільнює кортикостероїд протягом принаймні 14 днів зі швидкістю, яка не викликає несприятливого пригнічення гіпоталамо-гіпофізарно-надниркової осі (HPA-осі). У деяких варіантах втілення препарат контрольованого або уповільненого вивільнення контрольовано або уповільнено вивільнює кортикостероїд, таким чином, що рівень пригнічення кортизолу дорівнює або є нижчим за 35 % до 14-го дня після введення. У деяких варіантах втілення препарат контрольованого або уповільненого вивільнення контрольовано або уповільнено вивільнює кортикостероїд, таким чином, що пригнічення кортизолу є незначним і/або не виявляється до 14-го дня після введення. У деяких варіантах втілення препарат контрольованого або уповільненого вивільнення контрольовано або уповільнено вивільнює кортикостероїд, таким чином, що пригнічення кортизолу є незначним у будь-який час після введення. Винахід забезпечує способи лікування від болю або запалення у пацієнта, які включають введення вищезгаданому пацієнтові терапевтично ефективної кількості композиції, вибраної зпоміж препаратів, до яких належать: (i) композиція, яка включає (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу B та співполімерну матрицю з молочної кислоти – гліколевої кислоти, де кортикостероїд класу B складає від 22 % до 28 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (1) молекулярна маса у діапазоні приблизно від 40 до 70 кДа; (2) питома в'язкість у діапазоні від 0,5 до 0,5 дл/г; або (3) молярне співвідношення лактиду:гліколіду від 80:20 до 60:40; (ii) композиція, яка включає (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу A та співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу A включає від 15 % до 30 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (1) молекулярна маса у діапазоні приблизно від 40 до 70 кДа; (2) питома в'язкість у діапазоні від 0,35 до 0,5 дл/г; або (3) молярне співвідношення лактиду:гліколіду від 60:40 до 45:55; (iii) композиція, яка включає (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу C та 12 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу C включає від 15 % до 30 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (1) молекулярна маса у діапазоні приблизно від 40 до 70 кДа; (2) питома в'язкість у діапазоні від 0,35 до 0,5 дл/г; або (3) молярне співвідношення лактиду:гліколіду від 60:40 до 45:55; та (iv) композиція, яка включає (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу D та співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу D включає від 8 % до 20 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (1) молекулярна маса у діапазоні приблизно від 40 до 70 кДа; (2) питома в'язкість у діапазоні від 0,35 до 0,5 дл/г; або (3) молярне співвідношення лактиду:гліколіду від 60:40 до 45:55. У деяких варіантах втілення композиція вивільнює кортикостероїд протягом принаймні 14 днів зі швидкістю, яка не викликає несприятливого пригнічення гіпоталамо-гіпофізарно-надниркової осі (HPA-осі). У деяких варіантах втілення композиція контрольовано або уповільнено вивільнює кортикостероїд, таким чином, що рівень пригнічення кортизолу дорівнює або є нижчим за 35 % до 14-го дня після введення. У деяких варіантах втілення композиція контрольовано або уповільнено вивільнює кортикостероїд, таким чином, що пригнічення кортизолу є незначним і/або не виявляється до 14-го дня після введення. У деяких варіантах втілення композиція контрольовано або уповільнено вивільнює кортикостероїд, таким чином, що пригнічення кортизолу є незначним у будь-який час після введення. У деяких варіантах втілення популяцію мікрочастинок, препарат або композицію контрольованого або уповільненого вивільнення вводять однією або кількома внутрішньосуглобними ін'єкціями. У деяких варіантах втілення пацієнт хворіє на остеоартрит, ревматоїдний артрит, гострий подагричний артрит та синовіт. У деяких варіантах втілення пацієнт хворіє на гострий бурсит, підгострий бурсит, гострий неспецифічний теносиновіт або епікондиліт. В одному аспекті забезпечується спосіб лікування від болю та/або запалення у суглобі пацієнта, який включає внутрішньосуглобне введення (наприклад, однією або кількома ін'єкціями) пацієнтові з хворобою суглобів (наприклад, остеоартритом або ревматоїдним артритом) композиції, яка містить один або кілька кортикостероїдів, таких, як описані авторами композиції. Терапевтично ефективна кількість одного або кількох кортикостероїдів вивільнюється протягом періоду часу зі швидкістю, яка не пригнічує (наприклад, несприятливо і/або вимірно) HPA-вісь. В іншому аспекті забезпечується спосіб лікування від болю та/або запалення у суглобі пацієнта, який включає внутрішньосуглобне введення (наприклад, однією або кількома ін'єкціями) терапевтично ефективної кількості одного або кількох кортикостероїдів у композиції пацієнтові з хворобою суглобів (наприклад, остеоартритом або ревматоїдним артритом). Композиція має мікрочастинкову композицію уповільненого вивільнення, яка може вивільнювати або не вивільнювати помітний рівень кортикостероїду протягом певного періоду часу після введення і вивільнює помітну кількість кортикостероїду(ів) після введення, причому інтенсивність вивільнення кортикостероїду з мікрочастинкової композиції уповільненого вивільнення не викликає несприятливого пригнічення HPA-осі. У деяких варіантах втілення кортикостероїд, який вивільнюється з мікрочастинкової композиції уповільненого вивільнення, не викликає вимірного пригнічення HPA-осі. Згідно з певними варіантами втілення вищезазначених способів, композиція включає популяцію полімерних мікрочастинок, які піддаються біологічному розкладові і містять кортикостероїди. У деяких варіантах втілення кортикостероїди складають від 2 % до 75 % (маса/маса) мікрочастинок, в оптимальному варіанті – приблизно від 5 % до 50 % (маса/маса) мікрочастинок, у ще кращому варіанті – від 5 % до 40 % або від 10 % до 30 % (маса/маса) мікрочастинок. У деяких варіантах втілення мікрочастинки мають масовий середній діаметр від 10 мкм до 100 мкм. У деяких варіантах втілення мікрочастинки утворюються з гідрогелю, гіалуронової кислоти, PLA або PLGA. Наприклад, мікрочастинки утворюються з PLGA зі співвідношенням лактиду та гліколідного співполімеру від приблизно 45:55 до приблизно 80:20. У деяких варіантах втілення кортикостероїд являє собою бетаметазон, дексаметазон, ацетонід триамцинолону, гексацетонід триамцинолону, преднізолон, метилпреднізолон, буденозид, мометазон, циклезонід, флутиказон, їх солі, їх естери або їх комбінації. У ще одному аспекті забезпечується композиція, яка включає популяцію полімерних мікрочастинок, які піддаються біологічному розкладові і містять кортикостероїд(и). Наприклад, кортикостероїд являє собою бетаметазон, дексаметазон, ацетонід триамцинолону, гексацетонід триамцинолону, преднізолон, метилпреднізолон, буденозид, мометазон, циклезонід, 13 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 флутиказон, їх солі, їх естери або їх комбінації. Якщо композицію вводять внутрішньосуглобно (наприклад, однією або кількома ін'єкціями), терапевтично ефективна кількість кортикостероїду(ів) вивільнюється протягом певного періоду часу зі швидкістю, яка не пригнічує HPA-вісь. У деяких варіантах втілення вивільнений(і) кортикостероїд(и) не викликає(ють) несприятливого пригнічення HPA-осі. У деяких варіантах втілення вивільнений(і) кортикостероїд(и) не викликає(ють) вимірного пригнічення HPA-осі. У ще одному аспекті забезпечується композиція, яка включає популяцію полімерних мікрочастинок, які піддаються біологічному розкладові і містять кортикостероїд(и). Наприклад, кортикостероїд являє собою бетаметазон, дексаметазон, ацетонід триамцинолону, гексацетонід триамцинолону, преднізолон, метилпреднізолон, буденозид, мометазон, циклезонід, флутиказон, їх солі, їх естери або їх комбінації. Якщо композицію вводять внутрішньосуглобно (наприклад, однією або кількома ін'єкціями), терапевтично ефективна кількість кортикостероїду(ів) вивільнюється після введення з першого компонента протягом першого періоду часу і з компонента уповільненого вивільнення протягом другого періоду часу. Крім того, інтенсивність вивільнення кортикостероїду(ів) з компонента уповільненого вивільнення не пригнічує HPA-вісь. У деяких варіантах втілення кортикостероїд(и), вивільнений(і) з компонента уповільненого вивільнення протягом другого періоду часу, не викликає(ють) несприятливого пригнічення HPA-осі. У деяких варіантах втілення кортикостероїд(и), вивільнений(і) з компонента уповільненого вивільнення протягом другого періоду часу не викликає вимірного пригнічення HPA-осі. У деяких варіантах втілення перший компонент включає кортикостероїд, який містить розчин або суспензію. У деяких варіантах втілення перший компонент містить a кортикостероїд, який є відмінним від кортикостероїду компонента уповільненого вивільнення. В інших варіантах втілення один кортикостероїд застосовують як перший компонент і як компонент уповільненого вивільнення. Згідно з певними варіантами втілення вищезазначених композицій кортикостероїди складають від 2 % до 75 % (маса/маса) мікрочастинок, в оптимальному варіанті приблизно від 5 % до 50 % (маса/маса) мікрочастинок, у ще кращому варіанті – від 5 % до 40 % (маса/маса) мікрочастинок. У деяких варіантах втілення мікрочастинки мають масовий середній діаметр від 10 мкм до 100 мкм. У деяких варіантах втілення мікрочастинки утворюються з гідрогелю, гіалуронової кислоти, PLA або PLGA. Наприклад, мікрочастинки утворюються з PLGA зі співвідношенням лактиду та гліколідного співполімеру від приблизно 45:55 до приблизно 80:20. У деяких варіантах втілення композиції також включають кортикостероїд, який містить розчин або суспензію. У деяких варіантах втілення кортикостероїд, який містить розчин або суспензію, містить кортикостероїд, відмінний від того, що міститься у мікрочастинках. Винахід також забезпечує способи уповільнення, затримки або реверсування прогресуючого структурного пошкодження тканин, пов'язаного з хронічною запальною хворобою у пацієнта, які включають введення вищезгаданому пацієнтові терапевтично ефективної кількості популяції мікрочастинок, вибраної з-поміж популяцій, до яких належать: (i) популяція мікрочастинок, які включають кортикостероїд класу B або його фармацевтично прийнятну сіль, включені у співполімерну матрицю з молочної кислоти – гліколевої кислоти, де кортикостероїд класу B складає від 22 % до 28 % мікрочастинок; (ii) популяція мікрочастинок, які включають кортикостероїд класу A або його фармацевтично прийнятну сіль, включені у співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу A включає від 15 % до 30 % мікрочастинок; (iii) популяція мікрочастинок, які включають кортикостероїд класу C або його фармацевтично прийнятну сіль, включені у співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу C включає від 15 % до 30 % мікрочастинок; та (iv) популяція мікрочастинок, які включають кортикостероїд класу D або його фармацевтично прийнятну сіль, включені у співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу D включає від 8 % до 20 % мікрочастинок. У деяких варіантах втілення популяція мікрочастинок вивільнює кортикостероїд протягом принаймні 14 днів зі швидкістю, яка не викликає несприятливого пригнічення гіпоталамо-гіпофізарно-надниркової осі (HPA-осі). Винахід також забезпечує способи уповільнення, затримки або реверсування прогресуючого структурного пошкодження тканин, пов'язаного з хронічною запальною хворобою у пацієнта, які включають введення вищезгаданому пацієнтові терапевтично ефективної кількості препарату контрольованого або уповільненого вивільнення, вибраного з-поміж препаратів, до яких належать: (i) препарат кортикостероїду класу B контрольованого або уповільненого вивільнення, який включає мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які містять кортикостероїд класу B, де кортикостероїд класу B складає від 22 % до 28 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти; (ii) препарат 14 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 контрольованого або уповільненого вивільнення кортикостероїду класу A, який включає мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які включають кортикостероїд класу A, причому кортикостероїд класу A включає від 15 % до 30 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти; (iii) препарат контрольованого або уповільненого вивільнення кортикостероїду класу C, який включає мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які включають кортикостероїд класу C, причому кортикостероїд класу C включає від 15 % до 30 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти; та (iv) препарат контрольованого або уповільненого вивільнення кортикостероїду класу D, який включає мікрочастинки співполімеру молочної кислоти – гліколевої кислоти, які включають кортикостероїд класу D, причому кортикостероїд класу D включає від 8 % до 20 % співполімерної мікрочастинкової матриці з молочної кислоти – гліколевої кислоти. У деяких варіантах втілення препарат контрольованого або уповільненого вивільнення вивільнює кортикостероїд протягом принаймні 14 днів зі швидкістю, яка не викликає несприятливого пригнічення гіпоталамо-гіпофізарно-надниркової осі (HPA-осі). Винахід також забезпечує способи уповільнення, затримки або реверсування прогресуючого структурного пошкодження тканин, пов'язаного з хронічною запальною хворобою у пацієнта, які включають введення вищезгаданому пацієнтові терапевтично ефективної кількості композиції, вибраної з-поміж препаратів, до яких належать: (i) композиція, яка включає (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу B та співполімерну матрицю з молочної кислоти – гліколевої кислоти, де кортикостероїд класу B складає від 22 % до 28 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (1) молекулярна маса у діапазоні приблизно від 40 до 70 кДа; (2) питома в'язкість у діапазоні від 0,3 до 0,5 дл/г; або (3) молярне співвідношення лактиду:гліколіду від 80:20 до 60:40; (ii) композиція, яка включає (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу A та співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу A включає від 15 % до 30 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (1) молекулярна маса у діапазоні приблизно від 40 до 70 кДа; (2) питома в'язкість у діапазоні від 0,35 до 0,5 дл/г; або (3) молярне співвідношення лактиду:гліколіду від 60:40 до 50:50; (iii) композиція, яка включає (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу C та співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу C включає від 15 % до 30 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (1) молекулярна маса у діапазоні приблизно від 40 до 70 кДа; (2) питома в'язкість у діапазоні від 0,35 до 0,5 дл/г; або (3) молярне співвідношення лактиду:гліколіду від 60:40 до 50:50; та (iv) композиція, яка включає (a) мікрочастинки контрольованого або уповільненого вивільнення, які включають кортикостероїд класу D та співполімерну матрицю з молочної кислоти – гліколевої кислоти, причому кортикостероїд класу D включає від 8 % до 20 % мікрочастинок, і співполімер молочної кислоти – гліколевої кислоти має одну або кілька з таких характеристик: (1) молекулярна маса у діапазоні приблизно від 40 до 70 кДа; (2) питома в'язкість у діапазоні від 0,35 до 0,5 дл/г; або (3) молярне співвідношення лактиду:гліколіду від 60:40 до 50:50. У деяких варіантах втілення композиція вивільнює кортикостероїд протягом принаймні 14 днів зі швидкістю, яка не викликає несприятливого пригнічення гіпоталамо-гіпофізарно-надниркової осі (HPA-осі). У деяких варіантах втілення популяцію мікрочастинок, препарат або композицію контрольованого або уповільненого вивільнення вводять однією або кількома внутрішньосуглобними ін'єкціями. У деяких варіантах втілення пацієнт хворіє на остеоартрит, ревматоїдний артрит, гострий подагричний артрит та синовіт. У деяких варіантах втілення пацієнт хворіє на гострий бурсит, підгострий бурсит, гострий неспецифічний теносиновіт або епікондиліт. Винахід також забезпечує способи уповільнення, затримки, реверсування або іншого пригнічення прогресуючого структурного пошкодження тканин, пов'язаного з хронічною запальною хворобою, наприклад, пошкодження хряща, пов'язаного з остеоартритом. В одному варіанті втілення спосіб включає введення пацієнтові, наприклад, місцеве введення, терапевтично ефективної кількості одного або кількох кортикостероїдів у композиції, причому композиція вивільнює кортикостероїд(и) протягом принаймні 14 днів зі швидкістю, яка не викликає несприятливого пригнічення гіпоталамо-гіпофізарно-надниркової осі (HPA-осі). Способи оцінки впливу композицій кортикостероїдів на прогресування хвороби включають контрольовані клінічні дослідження, в яких оцінюються клінічні результати і/або застосовуються 15 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 технології візуалізації, такі, як, наприклад, магнітно-резонансна візуалізація (MRI), для дослідження впливу на структуру у хронічно запалених тканинах, наприклад, вплив на об'єм хряща та інші суглобні та навколосуглобні структури при остеоартриті та ревматоїдному артриті (див., наприклад, публікації Eckstein F, et al. "Magnetic resonance imaging (MRI) of articular cartilage in knee osteoarthritis (OA): morphological assessment.” Osteoarthritis Cartilage 14 Suppl A (2006): A46-75; Lo GH, et al. "Bone marrow lesions in the knee are associated with increased local bone density.” Arthritis Rheum 52 (2005): 2814-21; та Lo GH, et al. "The ratio of medial to lateral tibial plateau bone mineral density and compartment-specific tibiofemoral osteoarthritis.” Osteoarthritis Cartilage 14 (2006): 984-90, зміст кожної з яких включено до цього опису шляхом посилання у повному обсязі). Мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, не демонструють або майже не демонструють несприятливого впливу, наприклад, структурного пошкодження тканин, і за попередніми даними та дослідженнями, описаними нижче у Прикладах, ці мікрочастинкові композиції кортикостероїдів мають позитивний вплив, наприклад, уповільнюють, затримують або реверсують структурне пошкодження тканин. Винахід також забезпечує способи лікування пацієнта від болю та/або запалення шляхом введення пацієнтові терапевтично ефективної кількості одного або кількох кортикостероїдів у композиції, причому композиція вивільнює кортикостероїд(и) протягом принаймні 14 днів зі швидкістю, яка не викликає несприятливого пригнічення гіпоталамо-гіпофізарно-надниркової осі (HPA-осі). Винахід також забезпечує способи виготовлення мікрочастинкових композицій кортикостероїдів. Мікрочастинкові композиції, які пропонуються даним винаходом, можуть виготовлятися з застосуванням будь-якого з різних прийнятних способів. Якщо йдеться про мікрочастинкові композиції кортикостероїдів класу B, у деяких варіантах втілення мікрочастинки виготовляють, як описано у представлених нижче Прикладах. Якщо йдеться про мікрочастинкові композиції кортикостероїдів класу B, у деяких варіантах втілення мікрочастинки виготовляють, як описано у Патенті США № 7,261,529 та Патенті США № 7,758,778, зміст кожного з яких включено до цього опису шляхом посилання у повному обсязі. Наприклад, мікрочастинки виготовляють, застосовуючи процес випарювання розчинника, при якому кортикостероїд класу B диспергують в органічному розчині співполімеру молочної кислоти – гліколевої кислоти і суміш піддають обробці для видалення з суміші розчинника, таким чином, одержуючи мікрочастинки. У деяких варіантах втілення процес випарювання розчинника передбачає застосування розпилювального висушування або пристрою з псевдорозрідженим шаром для видалення розчинника та утворення мікрочастинок. У деяких варіантах втілення процес випарювання розчинника передбачає застосування обертального диска. Наприклад, обертальний диск може бути обертальним диском, описаним у Патенті США № 7,261,529 та Патенті США № 7,758,778. Якщо йдеться про мікрочастинкові композиції кортикостероїдів класу B, у деяких варіантах втілення, у яких кортикостероїд класу B являє собою TCA, мікрочастинки виготовляють, застосовуючи процес з використанням емульсії "тверда речовина в олії у воді", при якому TCA диспергують в органічному розчині співполімеру молочної кислоти – гліколевої кислоти і додають до водного розчинника для утворення мікрочастинок. У разі мікрочастинкових композицій кортикостероїдів класів A, C та/або D, у деяких варіантах втілення мікрочастинки виготовляють як описано у представлених нижче Прикладах. У разі композицій кортикостероїдів класів A, C та/або D у деяких варіантах втілення мікрочастинки виготовляють, як описано у публікації PCT № WO 95/13799, зміст якої включено до цього опису шляхом посилання у повному обсязі. Наприклад, мікрочастинки виготовляють, застосовуючи процес з використанням емульсії "тверда речовина в олії у воді", при якому кортикостероїд класу A, кортикостероїд класу C та/або кортикостероїд класу D диспергують в органічному розчині співполімеру молочної кислоти – гліколевої кислоти і додають до водного розчинника для утворення мікрочастинок. Передбачається, що у відповідних випадках будь-який варіант втілення даного винаходу може комбінуватися з одним або кількома іншими варіантами втілення даного винаходу, навіть якщо варіанти втілення описуються в різних аспектах даного винаходу. КОРОТКИЙ ОПИС ФІГУР Фігура 1 є графіком, який показує внутрішньосуглобну концентрацію (верхня суцільна лінія) та системну концентрацію (нижня суцільна лінія) глюкокортикоїду, який вводили згідно з певними варіантами втілення даного винаходу після внутрішньосуглобної ін'єкції. Системну концентрацію глюкокортикоїду, пов'язану з клінічно значущим пригніченням HPA-осі, показано нижньою пунктирною лінією. Верхня пунктирна лінія представляє мінімальну внутрішньосуглобну концентрацію, необхідну для підтримання ефективності (вираженої через 16 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 послаблення болю та запалення або уповільнення, затримку або реверсування структурного пошкодження тканин, спричиненого запальними хворобами. Уповільнене вивільнення кортикостероїду забезпечує достатню внутрішньосуглобну концентрацію для підтримання більш тривалої ефективності і має тимчасовий, клінічно незначний вплив на HPA-вісь. Фігура 2 є графіком, який показує зміну у часі чутливості до пригнічення ендогенного продукування кортизолу (EC50 (нг/мл) залежно від часу) для 40 мг ацетоніду триамцинолону, який вводили внутрішньосуглобно. Фігура 3 є графіком, який показує зміну у часі чутливості до пригнічення ендогенного продукування кортизолу (EC50 (нг/мл) залежно від часу) для різних кортикостероїдів, які вводили через одиничну внутрішньосуглобну ін'єкцію у зазначеній дозі. Фігура 4 є графіком, який показує зміну у часі рівня ендогенного кортизолу у плазмі, без (Колонка 1) поправки на зміну чутливості HPA-осі після внутрішньосуглобного введення кортикостероїдів і з поправкою (Колонка 2) на зміну чутливості HPA-осі після внутрішньосуглобного введення кортикостероїдів. Ці дані демонструють, що чутливість HPA-осі змінюється залежно від кортикостероїду, дози та часу, причому клінічно значущим вважається вибір доз для пролонгованого доставлення у внутрішньосуглобний простір. Фігура 5 є графіком, який показує сумарний відсоток вивільнення номінальних 25 % (маса/маса) ацетоніду триамцинолону у мікрочастинках PLGA 75:25. Фігура 6 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення кортизолу з використанням номінальних 25 % мікрочастинок TCA PLGA 75:25. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 7 є графіком, який показує розраховану дозу для людини, яка не впливає на HPAвісь, менш, ніж 35 % пригнічення кортизолу з використанням номінальних 25 % мікрочастинок TCA PLGA 75:25. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 8 є графіком, який показує сумарний відсоток вивільнення другого препарату номінального 25 % ацетоніду триамцинолону у мікрочастинках PLGA 75:25 з застосуванням альтернативного препарату. Фігура 9 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення кортизолу з застосуванням другого препарату номінальних 25 % мікрочастинок TCA PLGA 75:25, що забезпечується альтернативним препаратом. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 10 є графіком, який показує: розраховану дозу для людини, яка не впливає на HPAвісь, менш, ніж 35 % пригнічення кортизолу з застосуванням другого препарату номінальних 25 % мікрочастинок TCA PLGA 75:25, що забезпечується альтернативним препаратом. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 11 є графіком, який показує сумарний відсоток вивільнення номінального 25 % ацетоніду триамцинолону у мікрочастинках 5 % PEG 1450/PLGA 75:25. Фігура 12 є графіком, який показує сумарний відсоток вивільнення номінального 25 % ацетоніду триамцинолону у мікрочастинках 10 % PEG 3350/PLGA 75:25. Фігура 13 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення кортизолу з використанням номінальних 25 % TCA мікрочастинках 5 % PEG 1450/PLGA 75:25. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 14 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення кортизолу з використанням номінальних 25 % TCA мікрочастинках 10 % PEG 3350/PLGA 75:25. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 15 є графіком, який показує розраховану дозу для людини, яка не впливає на HPA 17 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 вісь, менш, ніж 35 % пригнічення кортизолу з використанням номінальних 25 % TCA мікрочастинках 5 % PEG 1450/PLGA 75:25. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 16 є графіком, який показує розраховану дозу для людини, яка не впливає на HPAвісь, менш, ніж 35 % пригнічення кортизолу з використанням номінальних 25 % TCA мікрочастинках 10 % PEG 3350/PLGA 75:25. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 17 є графіком, який показує сумарний відсоток вивільнення ацетоніду триамцинолону номінальних 40 %, 25 % 20 %, 15 % та 10 % TCA, які містять мікрочастинки PLGA 75:25. Фігура 18 є графіком, який показує сумарний відсоток вивільнення номінальних 25 % TCA PLGA 75:25 (29 кДа) та PLGA 75:25 (54 кДа), які містять мікрочастинки. Фігура 19 є графіком, який показує сумарний відсоток вивільнення ацетоніду триамцинолону у мікрочастинкових композиціях PLGA 50:50. Фігура 20 є графіком, який показує сумарний відсоток вивільнення номінальних 28,6 % ацетоніду триамцинолону у мікрочастинкових композиціях PLGA 75:25 плюс триблокспівполімер. Фігура 21 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 28,6 % мікрочастинок TCA 10 % триблокспівполімеру / PLGA 75:25. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 22 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 28,6 % мікрочастинок TCA 20 % триблокспівполімеру / PLGA 75:25. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 23 є графіком, який показує розраховану дозу для людини, яка не впливає на HPAвісь, менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 28,6 % мікрочастинок TCA 10 % триблокспівполімеру / PLGA 75:25. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 24 є графіком, який показує розраховану дозу для людини, яка не впливає на HPAвісь, менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 28,6 % мікрочастинок TCA 20 % триблокспівполімеру / PLGA 75:25. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 25 є графіком, який показує сумарний відсоток вивільнення номінальних 16,7 % ацетоніду триамцинолону у мікрочастинкових композиціях PLGA 75:25 змішаної молекулярної маси. Фігура 26 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 16,7 % мікрочастинок TCA PLGA 75:25 змішаної молекулярної маси. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 27 є графіком, який показує розраховану дозу для людини, яка не впливає на HPAвісь, менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 16,7 % TCA мікрочастинок PLGA 75:25 змішаної молекулярної маси. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 28 є графіком, який показує сумарний відсоток вивільнення номінальних 28,6 % ацетоніду триамцинолону у мікрочастинкових композиціях різних полімерів. Фігура 29 є графіком, який показує сумарний відсоток вивільнення номінальних 28,6 % преднізолону у мікрочастинковій композиції PLGA 50:50. Фігура 30 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення 18 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 кортизолу з застосуванням номінальних 28,6 % мікрочастинок PRED PLGA 50:50. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 31 є графіком, який показує розраховану дозу для людини, яка не впливає на HPAвісь, менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 28,6 % мікрочастинок PRED PLGA 50:50. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 32 є графіком, який показує сумарний відсоток вивільнення номінальних 28,6 % мікрочастинкової композиції бетаметазону PLGA 50:50. Фігура 33 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 28,6 % мікрочастинок BETA PLGA 50:50. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 34 є графіком, який показує розраховану дозу для людини, яка не впливає на HPAвісь, менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 28,6 % мікрочастинок BETA PLGA 50:50. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 35 є графіком, який показує сумарний відсоток вивільнення номінальних 16,7 % мікрочастинкової композиції пропіонату флутиказону PLGA 50:50. Фігура 36 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 16,7 % мікрочастинок FLUT PLGA 50:50. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 37 є графіком, який показує розраховану дозу для людини, яка не впливає на HPAвісь, менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 16,7 % мікрочастинок FLUT PLGA 50:50. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігура 38 є графіком, який показує сумарний відсоток вивільнення різних мікрочастинкових композицій пропіонату флутиказону PLGA. Фігура 39 є графіком, який показує сумарний відсоток вивільнення номінальних 28,6 % мікрочастинкової композиції DEX PLGA 50:50. Фігура 40 є графіком, який показує розраховану дозу для людини для досягнення тимчасового пригнічення кортизолу та досягнення протягом 14 днів менш, ніж 35 % пригнічення кортизолу, без впливу на HPA-вісь, менш, ніж 35 % пригнічення кортизолу з застосуванням номінальних 28,6 % мікрочастинок DEX PLGA 50:50. Пунктирні лінії представляють, з верхньої до нижньої частини графіка, 50 % інгібуючу дозу кортизолу, 40 % інгібуючу дозу кортизолу, 35 % інгібуючу дозу кортизолу та 5 % інгібуючу дозу кортизолу. Фігури 41A-41D є серією графіків, які показують середні профілі концентрації-часу різних доз TCA IR та FX006 у плазмі щура після одиничних внутрішньосуглобних доз. Мікрочастинкова композиція TCA у мікрочастинках композиції 75:25 PLGA під назвою FX006 у дозі 1,125 мг в результаті забезпечувала дуже повільне поглинання TCA у велике коло кровообігу та помітно нижчий показник Cmax порівняно з TCA IR. Концентрацію за перші 72 год. представлено на Фігурах 41C та 41D у більшому масштабі часу. Фігура 42 є графіком, який показує кортикостероїдне інгібування та відновлення за допомогою TCA IR (негайного вивільнення) та FX006 (мікрочастинкова композиція) у щурів. Фігура 43 є графіком, який показує зв'язок фармакокінетики / фармакодинаміки (PK/PD) системного рівня TCA та інгібування кортикостероном. Фігури 44A-44C є серією графіків, які показують показники аналізів ходи, індикатор болю, у щурів, які шляхом ін'єкції отримували дози ацетоніду триамцинолону негайного вивільнення (TCA IR) або мікрочастинки TCA (FX006), модель остеоартриту. На Фігурі 44A FX006 при 0,28, 0,12 та 0,03 мг (дози TCA) виражено як концентрацію TCA дозуючої композиції (4,67, 2 та 0,5 мг/мл). На Фігурі 44B, FX006 при 0,28 мг (доза TCA) виражено як концентрацію TCA дозуючої композиції (4,67 мг/мл). Подібним чином TCA IR при 0,03 мг виражено як триамцинолон при 0,5 мг/мл. На Фігурі 44C FX006 при 0,28, 0,12 та 0,03 мг (дози TCA) виражено як концентрацію TCA дозуючої композиції (4,67, 2 та 0,5 мг/мл). Подібним чином TCA IR при 0,06 та 0,03 мг виражено 19 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 як триамцинолон при 1 та 0,5 мг/мл. Фігура 45 є графіком, який показує пікову больову реакцію після повторюваних реактивацій артриту у правому коліні. Усі лікарські засоби вводили як єдину IA-дозу у праве коліно у День 0. Фігура 46 є графіком, який показує перебіг у часі відновлення кортикостерону для різних груп у дослідженні моделі остеоартриту на щурах. Фігури 47A-47B є серією графіків, які показують дані залежності концентрації TCA у плазмі від часу для різних груп у дослідженні моделі остеоартриту на щурах. На Фігурі 47B показано лише групи, які отримували ін'єкції мікрочастинок TCA (FX006-групи) у збільшеному масштабі. Фігура 48 є графіком, який показує гістопатологічні показники наприкінці дослідження для різних досліджуваних груп у дослідженні моделі остеоартриту на щурах. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Винахід забезпечує композиції та способи лікування від болю та запалення з застосуванням кортикостероїдів. Композиції та способи, які пропонуються даним винаходом, передбачають застосування одного або кількох кортикостероїдів у мікрочастинковій композиції. Мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, є ефективними для лікування від болю та/або запалення з мінімальним тривалим пригніченням HPA-осі та/або іншими довготерміновими побічними ефектами введення кортикостероїдів. Мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, є ефективними для уповільнення, затримки, реверсування або іншого стримування структурного пошкодження тканин, пов'язаного з прогресуванням хвороби, з мінімальним тривалим пригніченням HPA-осі та/або іншими довготерміновими побічними ефектами введення кортикостероїдів. Мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, доставляють кортикостероїд у такій дозі й у такому режимі уповільненого вивільнення, що рівень пригнічення кортизолу дорівнює або є нижчим за 35 % на 14 день після ін'єкції. У деяких варіантах втілення мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, доставляють кортикостероїд у такій дозі і у такий спосіб контрольованого або уповільненого вивільнення, щоб рівень пригнічення кортизолу був незначним і/або не виявлявся на 14 день після ін'єкції. Таким чином, мікрочастинкові композиції кортикостероїдів у цих варіантах втілення є ефективними за відсутності будь-якого значного пригнічення HPA-осі. Введення мікрочастинкових композицій кортикостероїдів, які пропонуються даним винаходом, може призводити до початкового "прориву" пригнічення HPA-осі, наприклад, протягом перших кількох днів, протягом перших двох днів та/або протягом перших 24 годин після ін'єкції, але до 14-го дня після ін'єкції пригнічення HPA-осі становить менше за 35 %. Застосування мікрочастинок для введення кортикостероїдів є відомим (див., наприклад, публікацію патентної заявки США № 20080317805). Крім того, відомо, що кортикостероїди є корисними для симптоматичного лікування від запалення та болю. Нові дані також свідчать, що синовіт може бути пов'язаним зі структурним пошкодженням, наприклад, руйнуванням хряща та іншої навколосуглобної тканини, пов'язаним з прогресуванням остеоартриту та ревматоїдного артриту (див., наприклад, Hill CL, et al. "Synovitis detected on magnetic resonance imaging and its relation to pain and cartilage loss in knee osteoarthritis.” Ann Rheum Dis 66 (2007):1599-603; van den Berg WB, et al. "Synovial mediators of cartilage damage and repair in osteoarthritis.” In: Brandt KD, Doherty M, Lohmander LS, eds. Osteoarthritis. Second ed. Oxford: Oxford University Press (2003):147-55; Ayral X, et al. "Synovitis: a potential predictive factor of structural progression of medial tibiofemoral knee osteoarthritis -- results of a 1 year longitudinal arthroscopic study in 422 patients.” Osteoarthritis Cartilage 13 (2005):361-7; та Kirwan JR, et al. "Effects of glucocorticoids on radiological progression in rheumatoid arthritis.” Cochrane Database Syst Rev 2007:CD006356). Введення кортикостероїдів, особливо протягом тривалих періодів часу, може мати багато небажаних побічних ефектів. HPA-вісь, механізм взаємозалежного зворотного зв'язку між гіпоталамусом, гіпофізом та корою надниркової залози, може пригнічуватися через введення кортикостероїдів, що призводить до різних небажаних побічних ефектів. Міра пригнічення HPAосі та пов'язаного з ним інгібування ендогенного продукування кортизолу зумовлюється ефективністю кортикостероїду, дозою, системною концентрацією, зв'язуванням білка, швидкістю виведення (Meibohm et al. "Mechanism-based PK/PD model for the lymphocytopenia induced by endogenous and exogenous corticosteroids.” Int J Clin Pharmacol Ther. 37(8) (1999):367-76) та, для одного кортикостероїду, зміною чутливості HPA-осі (Derendorf et al. "Clinical PK/PD modelling as a tool in drug development of corticosteroids.” Int J Clin Pharmacol Ther. 35(10) 1997: 481-8). Крім того, внутрішньосуглобні дози кортикостероїдів, пов'язані з лише обмеженим протизапальною і короткотерміновою знеболювальною перевагою (Hepper et al. "The efficacy and duration of intraarticular corticosteroid injection for knee osteoarthritis: a systematic review of level I studies.” J Am 20 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Acad Orthop Surg. 17(10) 2009: 638-46), були пов'язані з пригніченням HPA-осі (Habib, "Systemic effects of intra-articular corticosteroids.” Clin Rheumatol. 28(7) (2009): 749-56). Виникаючі з часом зміни у чутливості до впливу кортикостероїду потребують зміни клінічного дозування стероїду, але до даного винаходу цього розуміння не було. Деталі одного або кількох варіантів втілення винаходу викладено нижче у супровідному описі. Хоча у практичному втіленні або випробуванні даного винаходу можуть застосовуватися будь-які способи та матеріали, подібні або рівноцінні описаним авторами цього винаходу, способи та матеріали все ж описуються. Інші особливості, цілі та переваги винаходу стануть зрозумілими з опису. В описі форми однини також включають множину, якщо контекст прямо не передбачає іншого. Якщо немає іншого визначення, всі вжиті авторами технічні та наукові терміни мають однакові значення, загальноприйняті серед спеціалістів у галузі, до якої належить цей винахід. У разі протиріччя пріоритет має цей опис. Визначення Представлені нижче терміни мають нижченаведені значення, якщо спеціально не вказано іншого. Кількість кортикостероїду, яка не "пригнічує гіпоталамо-гіпофізарно-надниркову вісь (HPAвісь)”, означає кількість кортикостероїду уповільненого вивільнення, яку доставляють за місцем для ослаблення болю через запалення і яка забезпечує системну концентрацію, яка не викликає клінічно значущого ефекту або "несприятливого ефекту" для HPA-осі. Пригнічення HPA-осі зазвичай виявляється через зниження ендогенного продукування глюкокортикоїду. Його використовують для оцінки базового та посиленого продукування ендогенних глюкокортикоїдів. За звичайних, "нестресових" умов продукування глюкокортикоїду відбувається на нормальному, базовому рівні. Існує певне природне варіювання у продукуванні протягом 24годинного дня. За надзвичайних, "стресових" умов, пов'язаних, наприклад, з інфекцією або травмою і т. ін., відбувається посилене ендогенне продукування глюкокортикоїдів. Ендогенне продукування кортизолу може визначатися шляхом вимірювання концентрації глюкокортикоїду у плазмі, слині, сечі, або будь-яким іншим способом, відомим спеціалістам у даній галузі. Відомо, що системна концентрація кортикостероїдів може пригнічувати HPA-вісь. Наприклад, на 3-й день після внутрішньосуглобної ін'єкції 20 мг гексацетоніду триамцинолону спостерігається рівень у плазмі приблизно 3-4 нг/мл. Це веде до тимчасового, але дуже статистично значущого пригнічення 75 % HPA-осі (Derendorf et al., "Pharmacokinetics and pharmacodynamics of glucocorticoid suspensions after intra-articular administration.” Clin Pharmacol Ther. 39(3) (1986):3137), однак воно не обов'язково призводить до повного руйнування HPA (Habib, "Systemic effects of intra-articular corticosteroids.” Clin Rheumatol 28 (2009): 749–756, див. стор. 752, кол. 1, абз. 2, останнє речення). Хоча таке тимчасове пригнічення зазвичай вважають прийнятним без клінічно значущого ефекту, більш стійке пригнічення, тобто, протягом кількох тижнів, вважається клінічно шкідливим. У варіантах втілення даного винаходу введення композиції може вести до клінічно прийнятного пригнічення HPA, особливо під час періоду початкового вивільнення. У деяких варіантах втілення даного винаходу введення композиції не призводить до значного рівня пригнічення HPA, включаючи відсутність помітного пригнічення HPA, особливо під час періоду початкового вивільнення. Під час періоду наступного або уповільненого вивільнення у плазму може вивільнюватися додатковий кортикостероїд. Однак рівень у плазмі протягом цього періоду зазвичай є нижчим за рівень під час періоду початкового вивільнення, якщо відбувається будь-яке вивільнення кортикостероїду, і не є пов'язаним з пригніченням HPA-осі. Крім того, негативні явища, пов'язані з введенням екзогенного кортикостероїду, наприклад, гіперглікемія, гіпертонія, зміна настрою і т. ін., як правило, не спостерігаються. В оптимальному варіанті кількість клінічно несприятливих явищ протягом цього періоду суттєво не перевищує кількість, яка досягається однією композицією негайного вивільнення або препаратом TM KENALOG або його біологічним еквівалентом, і в оптимальному варіанті є меншою, ніж під час попереднього періоду початкового вивільнення у межах цієї терапії, якщо відбувається будь-яке вивільнення кортикостероїду. В альтернативному варіанті можна визначити пригнічення композицією HPA шляхом вимірювання ендогенного продукування кортизолу. Таким чином, композиція може вважатися такою, що дозволяє уникати клінічно значущого (або несприятливого) пригнічення HPA-осі, якщо рівень ендогенного кортизолу є практично таким самим, як у стійкому стані між групою пацієнтів, які отримують терапевтично сприятливу кількість композиції негайного вивільнення, та тими, що отримують терапевтично сприятливу кількість композиції уповільненого вивільнення. Така композиція вважається такою, що не має клінічно значущого впливу на HPA-вісь. В альтернативному або додатковому варіанті невелике, але вимірне зниження продукування глюкокортикоїду у стійкому стані, яке може бути результатом рецептування протягом періоду уповільненого вивільнення у межах терапії при 21 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 достатньому збереженні посиленої реакції на стрес, яка вимагається під час інфекції або травми, може вважатися клінічно незначущим пригніченням HPA-осі. Ендогенне продукування глюкокортикоїду може визначатися шляхом введення різних доз гормону адренокортикотропіну або через інші тести, відомі спеціалістам у даній галузі. Варіанти втілення даного винаходу забезпечують контроль над вивільненням кортикостероїду, який може бути бажаним, для досягнення відсутності вимірного впливу на ендогенне продукування глюкокортикоїду, або заданого або вимірного впливу, який не призводить до несприятливих клінічних наслідків. У цьому відношенні було виявлено, що внутрішньосуглобні дози кортикостероїдів, які пригнічують продукування кортизолу на 20-35 %, а часом і більше, забезпечують дуже корисну стійку протизапальну та знеболювальну дію. Ці переваги досягаються без великого ризику гіпоадреналізму і без надмірного ризику виникнення після тривалого внутрішньосуглобного дозування несприйнятливості надниркової залози під час стресу або розвитку вираженої надниркової недостатності. Як показується нижче, представлені в даному описі дослідження продемонстрували, що чутливість HPA-осі знижується залежно від часу, стероїду та дози. У цьому відношенні було визначено, що стандартні дози відомих кортикостероїдів, якщо розглядати з точки зору пригнічення HPA-осі у стійкому стані (тобто, після того, як відбулася десенсибілізація), забезпечують клінічно значущі контрольні точки. Наприклад, хоча пероральний преднізолон, який вводиться у дозі 20 мг QD, дає 73 % пригнічення кортизолу, навіть доза 5 мг QD (вважається "низькою дозою") викликає 40 % пригнічення ендогенного продукування кортизолу. Дози, які дорівнюють або є меншими за 5 мг преднізолону на день, зазвичай вважаються такими, що добре переносяться і не є пов'язаними з клінічно значущим пригніченням HPA-осі (La Rochelle et al., "Recovery of the hypothalamic-pituitary-adrenal (HPA) axis in patients with rheumatic diseases receiving low-dose prednisolone.” Am. J. Med. 95 (1993): 258-264). Отже, приблизно до 40 % пригнічення клінічно добре переноситься, і ймовірність викликання значних негативних клінічних явищ, таких, як гіпоадреналізм або зміни у м'яких тканинах або кістках або зміни обміну речовин, які свідчать про довготерміновий надлишок глюкокортикоїду, є низькою. "Пацієнт" означає людину, у якої було діагностовано хворобу або стан, які піддаються лікуванню згідно з описаним винаходом. У деяких варіантах втілення передбачається, що описані авторами композиції також можуть застосовуватися для лікування коней. "Доставлення" означає будь-які засоби, які застосовуються для поміщення медикаменту в організм пацієнта. До таких засобів, крім інших, можуть належати поміщення в організм пацієнта матриць, які вивільнюють медикамент у задану зону. Спеціалістові у даній галузі стане зрозуміло, що матриці можуть доставлятися різними способами, наприклад, шляхом ін'єкції через шприц, поміщення у місце просвердлювання, комплект катетера або канюлі, або упорскування за допомогою пристрою гарматного типу, або шляхом поміщення у хірургічну рану пацієнта під час операції. Термін "лікування" стосовно пацієнта означає зменшення, послаблення, припинення, блокування або запобігання симптомам болю та/або запалення у пацієнта. У контексті даного опису "лікування" включає часткове послаблення симптомів, а також повне послаблення симптомів протягом певного періоду часу. Період часу може вимірюватися годинами, днями, місяцями або навіть роками. Під "ефективною" кількістю або "терапевтично ефективною кількістю" медикаменту або фармакологічно активного агента слід розуміти нетоксичну, але достатню кількість медикаменту або агента для забезпечення потрібного ефекту, наприклад, знеболення. Прийнятна "ефективна" кількість у кожному окремому випадку може визначатися спеціалістом у даній галузі з застосуванням стандартних експериментів. "Осередок болю пацієнта" означає будь-яку ділянку організму, яка викликає біль, наприклад, колінний суглоб з остеоартритом, нервовий корінець, який викликає сідничний біль, нервові волокна, які розвиваються у кільцеві розриви у дисках, викликаючи біль у спині, біль у скроневонижньощелепному суглобі (TMJ), наприклад, Біль у TMJ, пов'язаний з порушенням скроневонижньощелепного суглоба (TMD), або біль, джерелом якого є епідуральний або периневральний простір. Біль, який відчуває пацієнт, може бути результатом запальної реакції, механічних подразників, хімічних подразників, термічних подразників, а також алодинії. Крім того, осередок болю пацієнта може включати один або кілька центрів у хребті, наприклад, між шийним, грудним або поперековим хребцями, або може включати один або кілька центрів, розташованих у межах безпосередньої ділянки запалених або пошкоджених суглобів, таких, як плечовий, тазостегновий або інші суглоби. "Біосумісний" матеріал означає матеріал, який є нетоксичним для людського організму, він не є канцерогенним і не викликає або викликає лише обмежене запалення у тканинах організму. 22 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 60 "Здатний до біологічного розкладу" матеріал означає матеріал, який розкладається через процеси, що відбуваються в організмі (наприклад, ферментні), до продуктів, які легко засвоюються організмом або поглинаються тканинами організму. Біологічно розкладені продукти також мають бути біосумісними з організмом. У контексті систем внутрішньосуглобного доставлення ліків для кортикостероїдів такі полімери можуть застосовуватися для виготовлення лікарських форм, до яких, крім інших, належать: мікрочастинки, мікросфери, матриці, матриці мікрочастинок, матриці мікросфер, капсули, гідрогелі, палички, капсули-імплантати, пігулки, ліпосоми, волокна, гранули або інші прийнятні композиції для доставлення фармацевтичних препаратів, які лікар може вводити у суглоб. Здатні до біологічного розкладу полімери розкладаються на нетоксичні залишки, які організм легко видаляє або повільно розщеплює або розчиняє, і виводяться з організму незмінними. Полімери можуть тверднути ex-vivo, утворюючи тверду матрицю, яка включає медикамент для контрольованого вивільнення у ділянку запалення. До прийнятних здатних до біологічного розкладу полімерів належить, крім іншого, природний або синтетичний біосумісний здатний до біологічного розкладу матеріал. До природних полімерів, крім інших, належать білки, такі, як альбумін, колаген, желатин, синтетичні полі(амінокислоти) та проламіни; глікозаміноглікани, такі, як гіалуронова кислота та гепарин; полісахариди, такі, як альгінати, хітозан, крохмаль та декстрани; та інші природні або хімічно модифіковані здатні до біологічного розкладу полімери. До синтетичних біосумісних здатних до біологічного розкладу матеріалів, крім інших, належать полі(лактид-ко-гліколід) (PLGA), полілактид (PLA), полігліколід (PG), полігідроксимасляна кислота, полі(триметиленкарбонат), полікапролактон (PCL), полівалеролактон, полі(альфа-гідроксикислоти), полі(лактони), полі(амінокислоти), полі(ангідриди), полікеталі полі(акрилати), полі(ортоестери), поліуретани, політіоестери, полі(ортокарбонати), полі(фосфоестери), полі(естер-ко-амід), полі(лактид-коуретан, поліетиленгліколь (PEG), полівініловий спирт (PVA), PVA-g-PLGA, співполімер PEGTPBT (поліактивний), метакрилати, полі(N-ізопропілакриламід), PEO-PPO-PEO (плюроніки), співполімери PEO-PPO-PAA та суміші PLGA-PEO-PLGA і їх співполімери та будь-які комбінації. Біосумісний здатний до біологічного розкладу матеріал може включати комбінацію біосумісних здатних до біологічного розкладу матеріалів. Наприклад, біосумісним здатним до біологічного розкладу матеріалом може бути триблокспівполімер або інше багатоблокове утворення, в якому біосумісні здатні до біологічного розкладу полімери поєднуються у комбінацію. Наприклад, триблокспівполімером може бути PLGA-PEG-PLGA. Хвороби, які піддаються лікуванню з застосуванням композицій згідно з цим винаходом Описи різних варіантів втілення винаходу представлено нижче. Хоча ці варіанти втілення наводяться з посиланням на лікування від болю в суглобах, пов'язаного з остеоартритом, ревматоїдним артритом та іншими порушеннями суглобів, це не означає, що винахід обмежується лише цими випадками застосування. Натомість передбачається, що варіанти втілення даного винаходу можуть застосовуватися для лікування інших форм болю у суглобах шляхом введення у суглобний та навколосуглобний простір. Крім того, слід розуміти, що для деяких варіантів втілення ін'єкція поблизу від суглоба може бути рівноцінною ін'єкціям у цей суглоб. Також передбачається, що варіанти втілення даного винаходу можуть застосовуватися для ін'єкції або введення у м'які тканини або пошкодження. Будь-які й усі конкретні слова та посилання застосовано лише для деталізації різних варіантів втілення даного винаходу. Місцеве введення мікрочастинкової композиції кортикостероїдів може здійснюватися, наприклад, шляхом ін'єкції у внутрішньосуглобний простір, навколосуглобний простір, м'які тканини, пошкодження, епідуральний простір, периневральний простір або форамінальний простір у місці або поблизу від місця болю у пацієнта та/або структурного пошкодження тканин. Місцева ін'єкція описаних авторами композицій у суглобний або навколосуглобний простір може застосовуватися для лікування, наприклад, ювенільного ревматоїдного артриту, ішіасу та інших форм радикуліту (наприклад, рук, шиї, попереку, грудної клітки), псоріатичного артриту, гострого подагричного артриту, невроми Мортона, гострого та підгострого бурситу, гострого та підгострого неспецифічного теносиновіту та епікондиліту, гострого ревматичного кардиту та анкілозуючого спондиліту. Описана авторами ін'єкція мікрочастинок у м'які тканини або пошкодження можуть застосовуватись у лікуванні, наприклад, гніздової алопеції, дискоїдного вовчака, еритематозу; келоїдів, локалізованого гіпертрофічного, інфільтрованого запального пошкодження анулярної гранульоми, червоного плаского лишаю, простого хронічного лишаю (нейродерматиту), псоріазу та псоріатичних бляшок; ліпоїдного некробіозу та псоріатичного артриту. Описана авторами ін'єкція мікрочастинок в епідуральний простір може застосовуватися для лікування, наприклад, нейрогенної переміжної кульгавості. Внутрішньом'язові ін'єкції або ін'єкції в інші м'які тканини або місця пошкоджень також можуть застосовуватися для забезпечення системного впливу, який є ефективним для контролю над викликаючими 23 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 55 непрацездатність алергічними станами (включаючи, крім інших, астму, атопічний дерматит, контактний дерматит, реакції надчутливості до ліків, сезонний або цілорічний алергічний риніт, сироваткова реакція, трансфузійні реакції), бульозним герпетиформним дерматитом, ексфоліативним дерматитом, фунгоїдним мікозом, пухирчаткою, важкою поліформною еритемою (синдромом Стівенса-Джонсона), первинною або вторинною недостатністю кори надниркової залози у поєднанні з мінералокортикоїдами у відповідних випадках; уродженою гіперплазією надниркової залози, гіперкальціємією, пов'язаною з раком, непідтримуючим тиреоїдитом, загостреннями регіонарного ентериту та виразкового коліту, набутою (аутоімунною) гемолітичною анемією, уродженою (еритроїдною) гіпопластичною анемією (анемією Даймонда-Блекфана), істинною еритроцитарною аплазією, окремими випадками вторинної тромбоцитопенії, трихінельозом з неврологічним або міокардальним ураженням, туберкульозним менінгітом та субарахноїдальним блоком або загрозою блока при застосуванні одночасно з відповідною протитуберкульозною хіміотерапією, паліативним лікуванням лейкозів та лімфом, загострення розсіяного склерозу, набряку головного мозку, пов'язаного з первинною або метастатичною пухлиною головного мозку або краніотомією, для викликання діурезу або ремісії протеїнурії при ідіопатичному нефротичному синдромі або для викликання діурезу або ремісії протеїнурії при червоному вовчаку, бериліозі, симптоматичному саркоїдозі, швидкоплинному або дисемінованому туберкульозі легенів (при застосуванні одночасно з відповідною протитуберкульозною хіміотерапією), ідіопатичній еозинофільній пневмонії, симптоматичному саркоїдозі, дерматоміозиті, поліміозиті та системному червоному вовчаку, післяопераційному болі та набряку. В одному варіанті втілення мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, можуть застосовуватися для лікування, послаблення симптомів, поліпшення стану та/або затримки прогресування ішіасу. В одному варіанті втілення мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, можуть застосовуватися для лікування, послаблення симптомів, поліпшення стану та/або затримки прогресування порушення скронево-нижньощелепного суглоба (TMD). В одному варіанті втілення, мікрочастинкові композиції кортикостероїдів, які пропонуються даним винаходом, можуть застосовуватися для лікування, послаблення симптомів, поліпшення стану та/або затримки прогресування нейрогенної переміжної кульгавості на тлі поперекового спінального стенозу (LSS). LSS включає звуження хребтового каналу з можливою наступною невральною компресією (класифікується за анатомією або етіологією). Нейрогенна переміжна кульгавість (NC) є характерним симптомом поперекового стенозу, при якому стовп спинного мозку (або канали, які захищають нервові корінці) звужується у нижньому відділі спини. Це звуження також може відбуватись у просторах між хребцями, де нерви залишають хребет для переміщення до інших частин тіла. Мікрочастинки згідно з винаходом застосовують для лікування, послаблення симптомів, поліпшення стану та/або затримки прогресування у пацієнтів, які страждають від NC на тлі LSS. Мікрочастинкові композиції кортикостероїдів можуть вводитись, наприклад, шляхом епідуральної стероїдної ін'єкції (ESI). Введення мікрочастинкової композиції кортикостероїдів, наприклад, мікрочастинкової композиції TCA, пацієнтові, який страждає від запальної хвороби, такої, як остеоартрит або ревматоїдний артрит, вважається успішним, якщо досягається будь-який з різних лабораторних або клінічних результатів. Наприклад, введення мікрочастинкової композиції кортикостероїдів вважається успішним, якщо один або кілька симптомів, пов'язаних з хворобою, послаблюються, знижуються, пригнічуються або не прогресують до наступного, тобто, гіршого стану. Введення мікрочастинкової композиції кортикостероїдів вважається успішним, якщо хвороба, наприклад, артритна або інша запальна хвороба, переходить у період ремісії або не прогресує до наступного, тобто, гіршого стану. Крім того, будь-які й усі зміни та подальші модифікації винаходу, які можуть траплятися спеціалістам у даній галузі, охоплюються обсягом винаходу. Вибір кортикостероїдів та дозування медикаменту Кортикостероїди, пов'язані з варіантами втілення даного винаходу, можуть бути будь-якими природними або синтетичними стероїдними гормонами. Природні кортикостероїди секретуються корою надниркової залози або організмом людини в цілому. Молекули кортикостероїдів мають таку основну структуру: 24 UA 111162 C2 5 10 15 20 25 30 35 40 45 50 (I) Кортикостероїди класифікуються по чотирьох різних групах (A, B, C та D) (див., наприклад, Foti et al. "Contact Allergy to Topical Corticosteroids: Update and Review on Cross-Sensitization.” Recent Patents on Inflammation & Allergy Drug Discovery 3 (2009): 33-39; Coopman et al., "Identification of cross-reaction patterns in allergic contact dermatitis to topical corticosteroids.” Br J Dermatol 121 (1989): 27-34). Кортикостероїди класу A належать до типу гідрокортизону без модифікацій D кільця або C20-C21 або коротколанцюгових естерів на C20-C21. Головними прикладами кортикостероїдів класу A є преднізолон, гідрокортизон та метилпреднізолон та їхні ацетат естеру, фосфат та сукцинат натрію, кортизон, преднізон та півалат тиксокортолу. Кортикостероїдами класу B є типи ацетоніду триамцинолону (TCA) з цис/кетальними або діольними модифікаціями на C16-C17. Головними прикладами кортикостероїдів класу B є ацетонід триамцинолону (TCA), ацетонід флуоцинолону, амцинонід, дезонід, флуоцинонід, галцинонід, будезонід та флунізолід. Кортикостероїдами класу C є типи бетаметазону з -CH3мутацією на C16, але без естерифікації на C17-C21. Головними прикладами кортикостероїдів класу C є бетаметазон, дексаметазон, дезоксиметазон, флуокортолон та галометазон. Кортикостероїдами класу D є естерифіковані типи клобетазону або гідрокортизону з довгим ланцюгом на C17 та/або C21 і без метильної групи на C16. Головними прикладами кортикостероїдів D є флутиказон, клобетазон бутират, пропіонат клобетазолу, гідрокортизон-17ацепонат, гідрокортизон-17-бутират, дипропіонат беклометазону, бетаметазон-17-валерат, дипропіонат бетаметазону, ацепонат метилпреднізолону та преднікарбат. Для даного винаходу необмежувальні приклади кортикостероїдів можуть включати: бетаметазон, ацетат бетаметазону, дипропіонат бетаметазону, 17-валерат бетаметазону, кортивазол, дексаметазон, ацетат дексаметазону, фосфат натрію дексаметазону, гідрокортизон, ацепонат гідрокортизону, ацетат гідрокортизону, бутират гідрокортизону, ципіонат гідрокортизону, пробутат гідрокортизону, фосфат натрію гідрокортизону, сукцинат натрію гідрокортизону, валерат гідрокортизону, метилпреднізолон, ацепонат метилпреднізолону, ацетат метилпреднізолону, сукцинат натрію метилпреднізолону, преднізолон, ацетат преднізолону, метасульфобензоат преднізолону, фосфат натрію преднізолону, стеаглат преднізолону, тебутат преднізолону, триамцинолон, ацетонід триамцинолону, 21-пальмітат ацетонід триамцинолону, бенетонід триамцинолону, діацетат триамцинолону, гексацетонід триамцинолону, аклометазон, дипропіонат аклометазону, амцинонід, амелометазон, беклометазон, дипропіонат беклометазону, дипропіонат моногідрат беклометазону, будезонід, бутиксокорт, пропіонат бутиксокорту, циклезонід, ципроцинонід, клобетазол, пропіонат клобетазолу, клокортолон, клобетазон, бутират клобетазону, півалат клокортолону, клопреднол, кортизон, ацетат кортизону, дефлазакорт, домопреднат, депродон, пропіонат депродону, дезонід, дезоксиметазон, дезоксикортон, ацетат дезоксикортону, диклоризон, дифлогазон, діацетат дифлогазону, дифлукортолон, дифлупреднат, флуклоролон, ацетонід флуклоролону, флудрокортизон, ацетат флудрокортизону, флудроксикортид, флуметазон, півалат флуметазону, флунізолід, флуцинолон, ацетонід флуоцинолону, флуокортин, флуокортолон, фторометолон, флутиказон, фуроат флутиказону, пропіонат флутиказону, ацетат фторометолону, флуаксиместерон, флуперолон, флупредніден, ацетат флупреднідену, флупреднізолон, формокортал, галцинонід, пропіонат галобетазолу, галометазон, галопредон, ацетат галопредону, гідрокортамат, ізофлупредон, ацетат ізофлупредону, ітроцинонід, етабонат лотепреднолу, мазипредон, меклоризон, меклоризон дибутират, медризон, мепреднізон, мометазон, фуроат мометазону, моногідрат фуроату мометазону, нівакортол, параметазон, ацетат параметазону, предназолін, преднікарбат, преднізолон, предніліден, процинонід, рофлепонід, римексолон, тимобезон, типредан, тиксокортол, півалат тиксокортолу та тралонід. Варіанти втілення винаходу включають застосування кортикостероїду уповільненого вивільнення, який вводять для лікування від болю у дозах, які не викликають небажаного 25 UA 111162 C2 5 10 15 пригнічення HPA-осі. Така кількість, доставлена за місцем для послаблення болю через запалення, забезпечує системну концентрацію, яка не має вимірного несприятливого впливу на HPA-вісь (відмінності, якщо існують, не є значними, оскільки будь-які подібні відмінності перебувають у межах нормальної варіативності результатів аналізів) або, якщо потрібно, може мати вимірний, але клінічно незначний вплив на HPA-вісь (базовий кортизол пригнічується до певного вимірного ступеня, але стресові реакції належною мірою зберігаються). Інші варіанти втілення винаходу включають дози протягом другого періоду часу, вибраного для поправки на зміну чутливості HPA-осі до пригнічення після впливу кортикостероїду протягом першого періоду часу (Фігура 1). Додаткові варіанти втілення включають дози протягом першого та/або другого періоду часу, вибраного для поправки на специфічні до кортикостероїду (або специфічні до кортикостероїду та потенційно специфічні до дози) зміни ступеня зміни чутливості HPA-осі до пригнічення, які починаються при початковій дії. Для клінічно ефективних кортикостероїдів ступінь зміни чутливості HPA-осі до екзогенних кортикостероїдів є нерівномірним і нелінійним (Фігура 2). Ступінь та характер зміни такої чутливості можуть бути різними у широких межах, залежно від суглобного вибраного кортикостероїду (Фігура 3). І нарешті, можна належним чином математично охарактеризувати зміну чутливості у часі як (нелінійний, експоненціальний) "спад" чутливості з початкового до кінцевого показника, причому параметри спаду (Таблиця 1) визначали на основі описаних нижче даних. 20 Таблиця 1 Параметр спаду зміни чутливості HPA-осі залежно від кортикостероїду та дози* Параметр спаду (час ) 0,024 0,005 0,070 -1 Кортикостероїд Фосфат/ацетат бетаметазону (7 мг) Ацетонід триамцинолону (40 мг) Гексацетонід триамцинолону (20 мг) 25 30 35 40 * Інгібування синтезу ендогенного кортизолу може бути пов'язане з концентрацією екзогенного кортикостероїду через такі рівняння: n n n 1. E = (EmaxC )/[(EC50) +C ], де E = ефект, Emax = максимальний ефект, C = концентрація екзогенного кортикостероїду, EC50 = концентрація при ½ Emax, і n = коефіцієнт Хілла ("форма" або "нахил"); та (-час) 2. EC50 – кінц. = EC50 – початк. + [EC50 – кінц. - EC50 – початк.] [1 – e ] Застосування цього підходу дозволяє визначати "", параметр, який описує експоненціальний спад з початкового до кінцевого EC50. Мінімізацію різниці найменших квадратів використовували для одержання оптимального . Ці нові дані стосовно ступеня та характеру зміни чутливості до інгібування та брак прогнозованості таких ступеня та характеру на основі, наприклад, ефективності стероїду, мають значні наслідки для належного з клінічної точки зору вибору дози. Спеціалістам у даній галузі стане зрозумілими значення зміни чутливості до пригнічення HPA-осі, а також складність та суперечливі аспекти деяких із цих нових даних (Таблиця 1). На основі цих клінічних даних визначали діапазон доз для досягнення клінічно значущого знеболення при мінімальній або контрольованій модуляції HPA-осі при різній концентрації кортикостероїдів у стійкому стані (Таблиця 2). Зокрема, було виявлено, що денні дози кортикостероїдів при стійкій концентрації є приблизно у 3-7 разів більшими, ніж прогнозувалося згідно з існуючим рівнем техніки (Meibohm, 1999). 26 UA 111162 C2 Таблиця 2 Доза (мг/д), з поправкою на індивідуальні характеристики внутрішньосуглобного кортикостероїду, на очікуване пригнічення ендогенного продукування кортизолу у стійкому стані Кортикостероїд бетаметазон (мг/д) будезонід (мг/д) дес-циклезонід (мг/д) дексаметазон (мг/д) флунізонід (мг/д) флутиказон (мг/д) мометазон (мг/д) метилпреднізолон (мг/д) преднізолон (мг/д) ацетонід триамцинолону (мг/д) гексацетонід триамцинолону (мг/д) 5% 0,1 0,1 3,0 0,1 0,3 0,1 0,2 0,3 0,4 0,2 0,1 Інгібування кортизолу (%) 10 % 20 % 35 % 0,2 0,5 1,0 0,2 0,6 1,2 6,3 14,3 30,7 0,2 0,4 0,9 0,5 1,2 2,6 0,1 0,3 0,6 0,4 0,9 2,0 0,7 1,6 3,5 0,8 1,9 4,0 0,4 0,8 1,7 0,2 0,4 0,9 50 % 1,8 2,2 57,0 1,6 4,8 1,1 3,7 6,5 7,5 3,2 1,6 Таблиця 2A Загальна введена доза (мг/місяць), поправкою на індивідуальні характеристики внутрішньосуглобного кортикостероїду, на очікуване пригнічення ендогенного продукування кортизолу у стійкому стані Кортикостероїд бетаметазон будезонід дес-циклезонід дексаметазон флунізонід флутиказон мометазон метилпреднізолон преднізолон ацетонід триамцинолону гексацетонід триамцинолону 5 10 15 20 Інгібування кортизолу (%) 10 % 20 % 35 % 6,0 15,0 30,0 6,0 18,0 36,0 189,0 429,0 921,0 6,0 12,0 27,0 15,0 36,0 78,0 3,0 9,0 18,0 12,0 27,0 60,0 21,0 48,0 105,0 24,0 57,0 120,0 12,0 24,0 51,0 6,0 12,0 27,0 5% 3,0 3,0 90,0 3,0 9,0 3,0 6,0 9,0 12,0 6,0 3,0 50 % 54,0 66,0 1710,0 48,0 144,0 33,0 111,0 195,0 225,0 96,0 48,0 Те, що більш високі дози кортикостероїдів можуть успішно вводитися шляхом внутрішньосуглобної ін'єкції, що збільшує ймовірність протизапальних та знеболювальних реакцій при мінімізації або усуненні негативних явищ через пригнічення HPA-осі або інший надмірний вплив на тканину, має глибокі клінічні наслідки для поліпшення лікування пацієнтів з артритом. Крім того, при цьому безперервному щоденному введенні внутрішньосуглобних доз кортикостероїдів існує можливість визначення відповідного системного рівня концентрації у плазмі (Таблиця 3), який забезпечує задане, але не більше, інгібування кортизолу при збереженні клінічно значущої протизапальної та знеболювальної дії у суглобах. Ці показники концентрації у плазмі прогнозувалися на основі даних короткотермінового (тобто, коротшого за 8 днів) впливу кортикостероїдів. При більш тривалому впливі кортикостероїдів "спад" (тобто, зниження) чутливості до кортикостероїдів може тривати, що може призводити до результатів, вищих за перелічені у Таблиці 3. Значення, розраховані у Таблиці 3, були суто гіпотетичними розрахунками на основі відомих з літератури даних про рівень негайного вивільнення доз в організмі людини. У разі доз уповільненого вивільнення може бути доставлена більша кількість медикаменту без підвищення рівня інгібування кортизолу після періоду початкового прориву. Даний рівень концентрації у плазмі фактично може забезпечувати менше інгібування, ніж могло б бути спрогнозовано або розраховано на основі відомих з літератури даних про рівень IR у людини. 27 UA 111162 C2 Таблиця 3 Концентрація кортикостероїдів у плазмі, пов'язана з заданим рівнем інгібування кортизолу у стійкому стані Кортикостероїд бетаметазон (нг/мл) будезонід (нг/мл) дес-циклезонід (нг/мл) дексаметазон (нг/мл) флунізонід (нг/мл) флутиказон (нг/мл) мометазон (нг/мл) метилпреднізолон (нг/мл) преднізолон (нг/мл) ацетонід триамцинолону (нг/мл) гексацетонід триамцинолону (нг/мл) 5 10 15 20 25 Концентрація кортикостероїду у плазмі (нг/мл), пов'язана з заданим рівнем інгібування кортизолу (%) 5% 10 % 20 % 35 % 50 % 0,33 0,70 1,57 3,38 6,27 0,60 1,27 2,85 6,14 11,40 0,55 1,16 2,61 5,63 10,45 0,21 0,44 1,00 2,15 3,99 0,18 0,38 0,86 1,84 3,42 0,04 0,08 0,19 0,41 0,76 0,15 0,32 0,71 1,54 2,85 0,68 1,44 3,23 6,96 12,92 1,64 3,46 7,79 16,79 31,16 0,19 0,40 0,90 1,95 3,61 0,10 0,21 0,48 1,02 1,90 Представлені авторами дослідження вперше продемонстрували виявлену динаміку змін у чутливості HPA-осі до екзогенних кортикостероїдів. Крім того, середні дози та середній рівень у плазмі, показані вище у Таблицях 2 та 3, є показниками після досягнення стійкого стану, що вимагає приблизно від 4 до 24 днів, залежно від даного кортикостероїду. Супутні тимчасові показники після введення дози, але до досягнення стійкого стану для кількох кортикостероїдів показано на Фігурах 2, 3 та 4. Також важливо зазначити, що дані вказують на те, що уважно контрольовані переваги внутрішньосуглобного уповільненого вивільнення потрібного кортикостероїду зберігаються, поки триває вивільнення. В одному оптимальному варіанті втілення однокомпонентна композиція уповільненого вивільнення вивільнює дозу (у мг/день), яка пригнічує HPA-вісь не більше, ніж на 5 – 40 % у стійкому стані, як показано у Таблиці 2, у ще кращому варіанті – не більше, ніж на 10 – 35 % у стійкому стані, як показано у Таблиці 2. Ці дози є терапевтично ефективними без негативних побічних ефектів. В іншому оптимальному варіанті втілення однокомпонентна композиція уповільненого вивільнення вивільнює дозу (у мг/день), яка не викликає вимірного пригнічення HPA-осі у стійкому стані. Ці дози є терапевтично ефективними без негативних побічних ефектів. В іншому варіанті втілення, в якому є присутніми компоненти композиції як негайного вивільнення, так і уповільненого вивільнення, доза негайного вивільнення має бути такою, як показано у Таблиці 4, а доза уповільненого вивільнення має бути дозою (у мг/день), яка пригнічує HPA-вісь не більше, ніж на 5 – 40 %, як показано у Таблиці 2, у ще кращому варіанті – не більше, ніж на 10 – 35 %, як показано у Таблиці 2. Крім того, очікується, що описані вище дози уповільненого вивільнення ідуть за дозами негайного вивільнення, як показано у Таблиці 4. Таблиця 4 Відносні дози негайного вивільнення (мг) Кортикостероїд 1 бетаметазон 2 будезонід 2 дес-циклезонід 2 дексаметазон 2 флунізонід 2 флутиказон 2 мометазон 1 метилпреднізолон 1 преднізолон 1 ацетонід триамцинолону 1 гексацетонід триамцинолону Доза негайного вивільнення (мг) 5-20 7-28 177-713 5-20 15-60 3-12 11-44 40-160 25-100 10-40 10-40 28
ДивитисяДодаткова інформація
Назва патенту англійськоюInjection composition of acetonide triamcinolon for treating pain
Автори англійськоюBodick, Neil, Blanks, Robert, C., Kumar, Anjali, Clayman, Michael, D., Moran, Mark
Назва патенту російськоюИнъекционная композиция ацетонида триамцинолона для лечения боли
Автори російськоюБодик Нил, Блэнкс Роберт К., Кумар Анджали, Клэйман Майкл Д., Моран Марк
МПК / Мітки
МПК: A61K 47/30, A61P 29/00, A61K 9/50, A61K 31/573, A61K 9/14
Мітки: триамцинолону, ацетоніду, композиція, лікування, ін'єкційна, болю
Код посилання
<a href="https://ua.patents.su/75-111162-inehkcijjna-kompoziciya-acetonidu-triamcinolonu-dlya-likuvannya-bolyu.html" target="_blank" rel="follow" title="База патентів України">Ін’єкційна композиція ацетоніду триамцинолону для лікування болю</a>
Попередній патент: Похідна фталазинонкетону, спосіб її одержання та її фармацевтичне застосування
Наступний патент: Способи й сполуки для лікування вірусних інфекцій paramyxoviridae
Випадковий патент: Склепіння мартенівської печі