Спосіб лікування від болю та фармацевтична композиція
Номер патенту: 73331
Опубліковано: 15.07.2005
Автори: Макларен Френсіс Марі, Урбанек Ребекка Енн, Мерфі Меґан, Елфорд Вернон, Бер Томас Майкл, Сяо Венхуа, Браун Дін Ґордон
Формула / Реферат
1. Спосіб лікування пацієнта, що страждає від болю, який полягає у введенні ефективної полегшуючої біль кількості будь-якої сполуки структурної формули І:
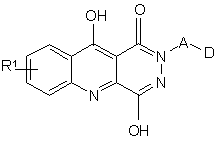 I,
I,
де А - (CH2)n, а n = 0, 1, 2, 3 або 4, і
D - 5- або 6-членне гетероарильне угруповання або його бензопохідне, яке має у кільці 1, 2 або 3 атоми оксигену або нітрогену, або сульфуру, і
R1 - галоген.
2. Спосіб за п. 1, який відрізняється тим, що полягає у введенні ефективної полегшуючої біль кількості сполуки структурної формули І, у якій
D вибрано з групи, яку складають піридил, хіноліл, піразиніл, пірадизиніл, фураніл, бенз[b]фураніл, імідазоліл, оксазоліл, тієніл, бенз[b]тієніл і тіазоліл.
3. Спосіб за п. 1, який відрізняється тим, що полягає у введенні ефективної полегшуючої біль кількості сполуки структурної формули II:
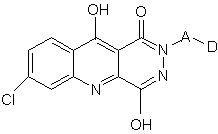 II.
II.
4. Спосіб за п. 3, який відрізняється тим, що полягає у введенні ефективної полегшуючої біль кількості сполуки структурної формули II, де
D вибрано з групи, яку складають піридил, хіноліл, піразиніл, пірадизиніл, фураніл, бенз[b]фураніл, імідазоліл, оксазоліл, тієніл, бенз[b]тієніл і тіазоліл.
5. Спосіб за п. 3, який відрізняється тим, що полягає у введенні ефективної полегшуючої біль кількості сполуки, вибраної з групи, яку утворюють
7-хлор-4-гідрокси-2-(4-піридилметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(3-піридилметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(2-піридилметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-бензо[d]фуран-2-ілметил-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(хінолін-4-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-диметилкарбамоїл-2-піридин-4-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(піразин-2-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(5-ізоксазоліно)метил-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(піримидин-2-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]-хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(фуран-2-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(3-фурилметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(тієн-2-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(тієн-3-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(бензо[b]тієн-2-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон,
7-хлор-4-гідрокси-2-(1,3-тіазо-2-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон і
7-хлор-4-гідрокси-2-(імідазол-2-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон.
6. Фармацевтична композиція, яка містить ефективну полегшуючу біль кількість сполуки структурної формули І разом з фармацевтично прийнятним наповнювачем або розріджувачем;
 , I
, I
де
А - (СН2)n і n має значення 0, 1, 2, 3 або 4,
D - 5- або 6-членне гетероарильне угрупування або його бензопохідне, яке має у кільці 1, 2 або 3 атоми оксигену або нітрогену, або сульфуру, і
R1 - галоген.
Текст
Винахід стосується лікування від болю або ноцицепції. Біль є сенсорним відчуттям, відмінним від відчуття дотику, тиску, тепла і холоду. Він характеризується тими, хто страждає від нього, як гострий, тупий, колючий, ріжучий або пекучий і звичайно включає як саме відчуття, так і реакцію на нього. Такий діапазон відчуттів, а також різне сприйняття болю різними особами, робить важким визначення болю, однак, є багато осіб, що страждають від сильних і тривалих болів. Біль, що спричиняється пошкодженням нейронних структур, часто проявляє себе як надчутливість або гіпералгезія і її часто називають "нейропатичним". Біль може також "спричинятись" стимулюванням ноцицептичних рецепторів і передаватисть через непошкоджені нейронні шляхи. Такий біль називають ноцицептичним. Рівень стимуляції, при якому біль стає помітним, називають "больовим порогом". Аналгетики є фармацевтичними агентами, які полегшують біль підняттям больового порогу без втрати свідомості. Після введення аналгетичних ліків відчуття болю стає помітним лише після більш інтенсивного або тривалішого стимулювання. У тих, хто страждає від гіпералгезії, аналгетик може викликати антигіпералгезію. На відміну від аналгетиків такі агенти, як локальні анестетики, блокують передачу у периферійному нервовому волокні і цим блокують відчуття болю. Загальні анестетики знижують відчуття болю через втрату свідомості. Були повідомлення про те, що антагоністи тахикініну викликають антиноцицепцію у тварин, яка, як вважають, є аналогом аналгезії у людини (Maggi et al., J. Auton. Pharmacol, 1993, 13, 23-93). Зокрема, було показано, що непептидні антагоністи рецептора NK-1 викликають таку аналгезію. Наприклад, антагоніст RP 67580 рецептора NK-1 викликав аналгезію, за рівнем близьку до морфіну (Garret et al., Proc. Natl. Acad. Sci. USA, 1993, 88,. 10208-10212). Опіоїдні аналгетики є добре відомим класом аналгетичних агентів з морфіноподібною дією.Синтетичні і напівсинтетичні опіоїдні аналгетики є похідними п'яти хімічних класів сполук: фенантренів, фенілгептиламінів, фенілпіперидинів, морфінанів і бензоморфанів. Ці сполуки мають різну фармакологічну активність: деякі з них є сильними агоністами у опіодних рецепторах (наприклад, морфін), інші є слабкими або помірними агоністами (наприклад, кодеїн) або проявляють змішану агоністичну-антагоністичну активність (наприклад нальбуфін), або є частковими агоністами (наприклад, налорфін). Хоча такий опіоїдний частковий агоніст, як налорфін (Nалкільний аналог морфіну), антагонізує аналгетичну дію морфіну, введений як єдиний, він може бути сильним аналгетиком. Серед опіоїдних аналгетиків морфін має найбільш широке застосування, але, поряд з терапевтичними якостіми, він має ряд вад, включаючи респираторну депресію, зниження шлунково-кишкової перистальтики, нудоту і блювання. Толерантність і фізична залежність також обмежують клінічне застосування опіоїдних сполук. Аспірин і інші саліцилатні сполуки часто використовуються у терапії для переривання підсилення запалювального процесу при ревматичних захворюваннях і артритах і для тимчасового зменшення болю. Інші лікувальні сполуки, призначені для цього, включають такі похідні фенілпропіонової кислоти, як ібупрофен і напроксен, суліндак, фенілбутазон, кортикостероїди, антималярийні препарати, наприклад, хлорохін і гідроксихлорохінсульфат, і фенемати (J. Hosp. Pharm., 36:622 (Травень 1979). Ці сполуки, однак, є малоефективними проти невропатичного болю. Існуюча терапія проти болю також має вади. Деякі терапевтичні агенти вимагають тривалого використання перед тим, як пацієнт відчує їх дію. Інші ліки викликають серйозні побічні явища у певних пацієнтів, які мають бути під пильним наглядом, щоб своєчасно відвернути появу таких явищ. Більшість існуючих ліків лише тимчасово полегшують біль і потребують постійного щоденного або щотижневого вживання. Якщо захворювання прогресує, кількість ліків, необхідних для полегшення болю, часто зростає, підвищуючи можливість появи шкідливих побічних явищ. Рецептори NDMA визначаються зв'язуванням N-метил-D-аспартату і включають рецептор/іонний канальний комплекс з кількома різними зв'язуючими доменами. Молекула NDMA структурно подібна до глютамату (Glu), який зв'язує у глютаматному сайті, і є високоселективним і потужним активатором рецептора NDMA (Watkins (1987), Olney (1989)). Відомо, що деякі сполуки можуть зв'язувати у зв'язувальному сайті NDMA/Glu (наприклад, СРР, DCCP-ен, CGP 40116, CGP 37849, CGS 19755, NPC 12636, NPC 17742, D-АР5, D-AP7, CGP 39551, CGP-43487, MDL100,452, LY-274614, LY-233536 і LY233053). Інші сполуки, які називають неконкурентними антагоністами NDMA, зв'язують у інших сайтах рецепторного комплекса NDMA (прикладами є фенциклідин, дизоцилпін, кетамін, тілетамін, CNS 1102, декстрометорфан, мемантин, кінуренова кислота, CNQX, DNQX, 6,7-DCQX, 6,7DCHQC, R(+)-HA-966, 7-хлоркінуренова кислота, 5,7-DCKA, 5-іод-7- хлор-кінуренова кислота, MDL-28,469, MDL-100,748, MGL-29,951, L-689,560, L-687,414, ACPC, ACPCM, ACPCE, аркаїн, діетилентріамін, 1,10діамінодекан, 1,12-діамінододекан, іфен-продил і SL-82.0715). Ці сполуки були детально розглянуті Rogawski (1992) і Nassieu et al. (1993) і у наведених тут роботах. На додаток до фізіологічних функцій глютамат (Glu) може бути нейротоксином. Його нейротоксичність називають "екзитотоксичністю", оскільки медіатором його як нейротоксичної, так і лікувальної дії є процес збудження (ОІnеу (1990), Choi (1992)). Звичайно коли Glu вивільняється на синаптичному рецепторі, від зв'язує лише тимчасово і потім швидко видаляється з рецептора процесом, який переносить його назад у клітину. За ненормальних умов, наприклад, удару, епілепсії і травми ЦНС, видалення Glu не відбувається і він накопичується у рецепторі, зумовлюючи цим постійне збудження електрохімічної активності, яка вбиває нейрон, що має рецептори Glu. У ЦНС численні нейрони мають рецептори Glu і тому екзитотоксичність може спричинити дуже значні пошкодження ЦНС. Гостра екзитотоксична травма може виникнути як результат ішемії, гіпоксиї, травми головного або спинного мозку, деяких харчових отруєнь, пов'язаних з такою екзитотоксичною отрутою, як домоїнова кислота, дегенерації нейронів, викликаної судорогою, яка може бути результатом постійної епілептичної судорожної активності (status epilepticus). Значна кількість даних підтверджує те, що рецептор NDMA є одним субтипом рецепторів, через які Glu стає медіатором численних травм ЦНС, і що антагоністи NDMA ефективно захищають нейрони ЦНС від екзитотоксичної дегенерації при цих гострих травматичних синдромах ЦНС (Choi (1988), Olney (1990)). На додаток до пошкодження нейронів, спричиненого гострими інсультами, надмірна активація рецепторів Glu може сприяти більш поступовому нейродегенеративному процесу, який призводить до смерті клітин при різних хронічних нейродегенеративних хворобах, включаючи хворобу Альцгеймера, аміотрофічний вторинний склероз, пов'язане з СНІД слабоумство, хворобу Паркінсона і хворобу Хантингтона (Olney (1990)). Вважається, що антагоністи NDMA можуть бути корисними у терапії таких хронічних захворювань. У 1980р. було виявлено, що РСР (відомий також як "янгольський пил") діє як "сайт впізнавання РСР" у іонному каналі рецептора NDMA Glu. РСР діє як неконкурентний антагоніст, який блокує потік іонів через іонний канал NDMA. Пізніше було виявлено, що ліки, які діють у сайті РСР як неконкурентні антагоністю NDMA, можуть створювати психотоміметичні бічні ефекти. Крім того, було виявлено, що певні конкурентні і неконкурентні антагоністи NDMA можуть викликати подібні патоморфологічні зміни у мозку щура (Olney et al. (1991), Hargreaves et al. (1993)). Такі сполуки також мають психотоміметичну дію на мозок людини (Kristensen et al. (1992), Herrling (1994), Grotta (1994)). Гліциновий зв'язувальний сайт рецепторного комплекса NDMA може бути розрізнений від зв'язувальних сайтів Glu і РСР. Крім того, нещодавно було виявлено, що рецептори NDMA існують у вигляді кількох субтипів, які відрізняються особливостями гліцинових зв'язувальних сайтів рецептора. Сполуки, що зв'язують у гліциновому сайті рецептора NDMA і можуть бути використані для лікування удару і нейродегенеративних станів, описані у патентах США 5 604 227, 5 733 910, 5 599 814, 5 593 133, 5 744 471, 5 837 705 і 6 103 721. Було виявлено, що певні сполуки, здатні приєднуватись до гліцинового сайту рецептора NDMA, можуть полегшувати біль, зокрема, нейропатичний біль. Отже, об'єктом винаходу є спосіб лікування від болю, який полягає у введенні для полегшення болю ефективної кількості будь-якої сполуки структурної формули І: де А - (СН2)n (n має значення 0, 1, 2, 3 або 4), D - 5- або 6-членне гетероарильне угруповання або його бензопохідне, яке має у кільці 1, 2 або 3 атоми оксигену або нітрогену, або сульфуру, a R1 - галоген. У конкретних втіленнях спосіб згідно з винаходом полягає у введенні ефективної полегшуючої біль кількості сполуки структурної формули І, у якій D обрано з групи, яку складають піридил, хінолілі, піразиніл, пірадизиніл, фураніл, бенз[b]фураніл, імідазоліл, оксазоліл, тієніл, бенз[b]тієніл і тіазоліл. У одному з втілень спосіб згідно з винаходом полягає у введенні ефективної полегшуючої біль кількості сполуки структурної формули II: Деякі втілення винаходу включають спосіб лікування сполуками структурної формули II, у яких D обрано з групи, яку складають піридил, хінолілі, піразиніл, пірадизиніл, фураніл, бенз[b]фураніл, імідазоліл, оксазоліл, тієніл, бенз[b]тієніл і тіазоліл. Окремі втілення винаходу включають спосіб лікування типовою описаною тут сполукою. Іншими об'єктами винаходу є фармацевтичні композиції, які містять сполуку структурної формули І; використання сполук структурної формули І для приготування медикаментів і фармацевтичних композицій; і спосіб приєднання сполуки згідно з винаходом до гліцинового сайту рецептора NDMA теплокровної тварини, наприклад, людини, для лікувального інгібування активності рецептора NDMA. Сполуками згідно з винаходом є ті, що описані у описі і, зокрема, ті, що відзначені як типові. Придатні фармацевтично прийнятні солі сполук винаходу включають такі солі приєднання кислот, як метансульфонат, фумарат, гідрохлорид, гідробромід, цитрат, трис(гідроксиметил)амінометан, малеат і солі фосфорної у сульфуроваї кислот. У інших втіленнях придатними є такі основні солі, як солі лужних металів, наприклад, натрію, лужноземельних металів, наприклад, кальцію або магнію, органічні амінні солі, наприклад, тріетиламін, морфолін, N-метилпіперидин, N-етилпіперидин, прокаїн, дибензиламін, холін, Ν,Νдибензилетиламін або амінокислоти, наприклад, лізини. Ще одним об'єктом винаходу є спосіб приготування сполук згідно з винаходом, який включає операції: а) приготування Вос-захищеного гідразину згідно з процедурою за такою схемою: X = СІ, Вr або OMs; R = Η або алкіл б) приєднання зазначеного Вос-захищеного гідразину і циклювання продукта згідно з наведеною далі схемою для формування сполуки структурної формули І: де ЦМК - мето-р-толуолсульфонат 1-циклогексил-3-(2-морфолінетил)карбодііміду; група R/H/D угруповання -A-D структурної формули І; R1 - така, як визначена для структурної формули І. Для використання сполуки згідно з винаходом або її фармацевтично прийнятної солі для лікування або профілактики болю у ссавців, включаючи людину, цю сполуку можна ввести у фармацевтичну композицію згідно з стандартною фармацевтичною практикою. Фармацевтичні композиції, що містять сполуку винаходу, можна вводити звичайними шляхами, наприклад, орально, локально, парентерально, під'язично, назально, вагінально або ректально, або інгаляцією. Для цього сполуки згідно з винаходом можуть бути виготовлені у вигляді, наприклад, таблеток, капсуль, водних або масляних розчинів, суспензій, емульсій, кремів, мазей, желе, носових вприскувань, супозиторіїв, тонкодисперсних порошків або аерозолів для інгаляції, і стерильні водні або масляні розчини або стерильні суспензії або емульсії для парентерального введення (включаючи внутрішньовенне, внутрішньом'язове або інфузійне). Бажаним способом введення є оральний таблеткою або капсулою. Крім сполуки винаходу фармацевтична композиція згідно з винаходом може містити один або кілька інших фармакологічно активних агентів, або такі фармацевтичні композиції можна одночасно або у послідовності вводити разом з одним або кількома іншими фармакологічно активними агентами. Фармацевтичні композиції згідно з винаходом мають вводитись пацієнту ефективно полегшуючими біль денними дозами. Денну дозу, якщо необхідно, можна розділити на окремі дози, причому точна кількість сполуки при прийомі і спосіб введення залежить від маси, віку і статі пацієнта, що одержує лікування, і від конкретної стадії захворювання, згідно з відомими принципами. Бажаним є одноразовий щоденний прийом. Ще одне втілення винаходу включає фармацевтичну композицію, яка містить сполуку структурної формули І, визначеної вище, або її фармацевтично прийнятну сіль разом з фармацевтично прийнятною добавкою, наприклад, наповнювачем або носієм. Інше втілення винаходу передбачає використання сполуки структурної формули І, або її фармацевтично прийнятної солі для приготування медикаменту, призначеного для приєднання до гліцинового сайту рецептора NDMA у теплокровних тварин, наприклад, людини. Одне з втілень винаходу включає спосіб приєднання сполуки винаходу до гліцинового сайту рецептора NDMA у теплокровних тварин, наприклад, людини, що потребують лікування від болю, який передбачає введення цій тварині ефективної кількості сполуки структурної формули l або її фармацевтично прийнятної солі. Визначення Термін "алкіл" тут включає прості і розгалужені ланцюгові алкільні групи, але індивідуальним алкільним групам, наприклад, "пропілу" відповідають прості ланцюгові угруповання. Галогени включають фтор, хлор, бром і іод. Термін "алил" тут включає ненасичене карбонове кільце або його банзопохідну. Зокрема, арил означає феніл, нафтил або біфеніл, найчастіше феніл. Термін "гетероарил" або "гетероарильне кільце", якщо не зумовлено інше, означає моно-, бі- або трициклічне (5-15)-членне ненасичене або частково ненасичене кільце, яке містить до 5 гетероатомів, обраних з нітрогену, оксигену і сульфуру, причому група -СН2- може бути, як варіант, заміщена -С(О)-, а атом нітрогену у кільці може бути, як варіант, окиснений для формування N-оксиду. Прикладами таких гетероарилів можуть бути тієніл, фурил, піраніл, піроліл, імідазоліл, піразоліл, тіазоліл, оксазоліл, ізоксазоліл, піридил, піридил-Nоксид, оксопіридил, оксохіноліл, піримидиніл, піразиніл, оксопіразиніл, піридазиніл, індолініл, бензофураніл, бензимідазоліл, бензотіазоліл, хіноліл, ізохінолініл, хіназолініл, ксантеніл, хіноксалініл, індазоліл, бензофураніл і цинолініл. Термін "гетероцикл" або "гетероциклічне кільце" якщо не зумовлено інше, означає моно-, бі- або трициклічне (5-15)-членне повністю насичене кільце, яке містить до 5 гетероатомів, обраних з нітрогену, оксигену і сульфуру, причому група -СН2- може бути, як варіант, заміщена -С(О)-. Прикладами таких гетероциклів можуть бути морфолініл, піролідиніл, імідазолідиніл, піразолідиніл, піперидиніл, піперазиніл, гомопіперидиніл, гомопіперазиніл і хінуклідиніл. Якщо необов'язкові замісники обираються з "однієї або більше" груп, це включає сполуки, де всі замісники обрані з однієї з визначених груп, і сполуки, де замісники обрані з однієї або кількох з визначених груп. Взагалі у наведених тут способах, процесах і прикладах: концентрація здійснюється відцентровим випаровуванням in vacuo; операції проводяться при зовнішній температурі, що лежить у межах 18-26°С у атмосфері нітрогену; колонна хроматографія (флеш-процедура), якщо не зумовлено інше, виконується на кремнеземі Merck Kieselgel (Art. 9385); виходи наведені лише для ілюстрації і не відповідають максимально можливим; структура кінцевих продуктів формули І звичайно визначаються за допомогою ЯМР і мас-спектрографії, протонний магнітний резонанс визначається у ДМСО-d 6 з використанням спектрометра Varian Gemini 2000, що працює у полі 300МГц; хімічні зсуви наведені у частинках на мільйон нижче від тетраметилсилану як внутрішнього стандарту (шкала δ). Пікові мультиплети позначені таким чином: s - синглет, bs - широкий синглет, d - дублет, АВ або dd - подвійний дублет, t - триплет, dt - подвійний триплет, m - мультиплет, bm широкий мультиплет. Mac-спектрографічні дані при бомбардування швидкими атомами (FAB) одержуються спектрометром Platform від Micromass у електронному промені, причому, були зібрані дані про позитивні і негативні іони, у даному випадку наведено (М+Н)+. Дані інфрачервоного спектра одержуються за допомогою Nicolet Avatar 360 FT-IR. Проміжні сполуки звичайно не характеризуються повністю, а чистота визначається мас-спектрографією або аналізом ЯМР. У подальшому використані такі абревіатури і визначення: CDCI 3 - дейтерований хлороформ; ЦМК -1 -циклогексил-3-(морфолінетил)карбодіімід-мето-р-толуолсульфонат; ДХМ -дихлорметан; ДХЛМ - дихлормочевина; ДЦК - 1,3-дициклогексилкарбодіімід; ДМАП - 4-(диметиламіно)піридин; ДМФ - Ν,Ν-диметилформамід; ДМСО - диметилсульфоксид; m/s - мас-спектрографія; ΝΜΠ - N-метилпіролідон; ЯМР - ядерно-магнітний резонанс; ТГФ - тетрагідрофуран; Наведені приклади і тести ілюструють винахід, не обмежуючи його. Приклади Приклад 1. Метансульфонат 7-хлор-4-гідрокси-2-(2-піридилметил)-1,2,5,10-тетрагідропіридазин[4.5b]хінолін-1.10-діону (Tреm-бутокси)-N-[(4-піридилметил)аміно]карбоксамід До перемішаного розчину mpem-бутилкарбазату (175г, 1,36моль) і сухого ДМФ (400мл) у атмосфері нітрогену додають триетиламін (108мл, 0,78моль) і потім 4-піколілхлоридгідрохлорид (40,0г, 0,243моль). Реакційну суміш гріють 5год. при 75°С і залишають охолонути до кімнатної температури, після чого розводять водою (2л) і екстрагують етилацетатом (4´500мл). Об'єднані етилацетатні екстракти концентрують під зниженим тиском і залишок розчиняють у діетилетері. Одержаний розчин промивають водою (3´400мл) і розсолом (400мл) і висушують над Na2SO4, який потім відфільтровують, фільтрат концентрують під зниженим тиском і одержують бурштинове масло (130,4г). Цей продукт очищують флеш-хроматографією на силікагелі з елюентом гексан/етилацетат (1:1) і одержують кінцеву сполуку у вигляді твердої білуватої піни (24,46г, 45%). 1 Н ЯМР (300МГц, ДMCO-d6): δ 1,36 (s, 9H), 3,90 (d, 2H, J = 4,0Гц); 5,04 (d, 1H, J = 4,5Гц); 8,48 (d, 1H, J = 4,5Гц). Диметил-7-хлор-4-гідроксихінолін-2,3-дикарбоксилат Перемішану суміш метил-2-аміно-4-хлорбензоату (2,50г, 13,5ммоль) і диметилацетилендикарбоксилату (2,05г, 14,4ммоль) у mpem-бутанолі (22мл) витримують під зворотним холодильником 7год. у атмосфері нітрогену. Після додання ще диметилацетилендикарбоксилату (1,16г, 8,13ммоль) і витримання під зворотним холодильником протягом ще 2,5год. реакційну суміш залишають охолонути до кімнатної температури і додають mpem-бутоксид калію (1,56г, 13,9ммоль). Після утворення осаду суміш витримують під зворотним холодильником 1,5год., після чого охолоджують до кімнатної температури і фільтрують для відділення твердої речовини, яку промивають mpem-бутанолом і діетилетером, розчиняють у воді і підкислюють 1N сульфуровою кислотою для формування осаду. Суміш екстрагують ДХМ і об'єднані екстракти промивають водою і розсолом, висушують над MgSO4, фільтрують і концентрують, одержуючи зелену тверду речовину. Рекристалізація цього матеріалу з метанолу дає кінцеву сполуку (1,15г, 47%) у вигляді білуватої твердої речовини, темп, плавл. 232-233°С. МС (СІ): 296 (М+Н). Аналіз для C13H10CINO5 За розрахунком: С, 52,81; Н, 3,41; N 4,34; Одержано: С, 52,75; Н, 3,47; N 4,69. 3-карбометокси-7-хлор-4-гідроксихінолін-2-карбонова кислота До перемішаної суспензії диметил-7-хлор-4-гідроксихінолін-2,3-дикарбоксилату (1,0г, 3,38ммоль) у воді (20мл) додають водний розчин гідроксиду натрію (0,27г, 6,75ммоль). Після додання суспензія розчиняється. Реакційну суміш протягом 1год. розігрівають до 65°С, після чого охолоджують до кімнатної температури і підкислюють концентрованою гідрохлоридною кислотою. Продукт екстрагують у діетилетер і етилацетат. Органічні екстракти висушують над MgSO4, фільтрують і концентрують у вакуумі, одержуючи твердий кінцевий продукт (900мг), який очищують рекристалізацією з співрозчинникової системи етилацетат/гексан і одержують бажану сполуку (571г, 60%) у вигляді твердої речовини, темп. пл. 296 (розклад.). МС (СІ): 238 (М+Н). Аналіз для С12Н8 NО5СІ·0,45СН3СО2СН2СН3·0,1Н2О: За розрахунком: С, 51,30; Н, 3,68; N 4,34; Одержано: С, 51,28; Н, 3,62; N 3,97; 1 Н ЯМР 8,22 (d, J = 8,7Гц, 1Н); 7,92 (d, 1Н, J = 1,8Гц); 7,28 (dd, 1H, J = 8,7, 1,8Гц); 3,90 (s,3H). 3-карбометокси-2-піролідинкарбамід-7-хлор-4-гідроксихінолін До суспензії 3-карбометокси-7-хлор-4-гідроксихінолін-2-карбонової кислоти (2,25г, 8,0ммоль) у ТГФ (20мл) при кімнатній температурі у атмосфері нітрогену додають ДЦК (1,65г, 8,0ммоль) і піролідин (0,596г, 8,4ммоль). Реакцію перемішують 15год. при кімнатній температурі, після чого фільтруванням видаляють мочевину. Продукт очищують флеш-хроматографією на колонці з елюентом метанол(5%) у хлороформі, і одержують кінцевий продукт (2,52г, 94,3%) у вигляді світлокоричневої твердої речовини, темп, плавл. 215°С. МС (СІ): 335 (М+Н). 1 Н ЯМР (300МГц, ДМСО-d6): δ 8,12 (d, J = 8,7Гц, 1Н), 7,60 (d, 1H, J = 1,8Гц); 7,47 (dd, 1H, J = 8,8, 2,0Гц); 3,69 (s, 3Н), 3,40-3,49 (m, 2H), 3,27-3,33 (m,2H), 1,80-1,96 (m, 4H). 7-хлор-4-оксо-2-(піролідинілкарбоніл)-гідроксихінолін-3-карбонова кислота До суспензії 3-карбометокси-2-піролідинкарбамід-7-хлор-4-гідроксихіноліну (2,52г, 7,5ммоль) у деіонізованій воді (40мл) додають краплями водний розчин (20мл) гідроксиду калію (882мг, 15,75ммоль), після чого реакцію розігрівають до 60°С і через 3год. фільтрують для видалення нерозчинного матеріалу. Фільтрат підкислюють до рН=1 і одержують білий осад, який відділяють вакуумним фільтруванням, промивають водою, сушать при 30°С у вакуумі 16год. і одержують кінцеву сполуку (1,5г, 64%) у вигляді білої твердої речовини, темп. пл. 225-8°С. МС(СІ): 321 (М+Н). 1 Н ЯМР (300МГц, ДМСО-d6): δ 8,28 (d, J = 8,8Гц, 1Н), 7,77 (s, 1H); 7,64 (d, 1H, J = 8,7Гц); 3,52-3,57 (m, 2H), 3,17-3,19 (m,2H), 1,83-1,98 (m, 4H). N-[(mреm-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідинілкарбоніл)-(гідроксихіноліл]-N-(4піридилметил)карбоксамід До перемішаної суміші 7-хлор-4-оксо-2-(піролідинілкарбоніл)-гідроксихінолін-3-карбонової кислоти (24,29г, 75,73ммоль) і сухого ТГФ (1175мл) у атмосфері нітрогену додають ЦМК (50,55г, 119,34ммоль) порціями (по 35г, а через 10хвил. по 15,55г). Після перемішування суміші протягом 20хвил. швидко додають розчин mреmбутокси-N-[(піридилметил)аміно]карбоксаміду (22,0г, 98,5ммоль) і ТГФ (580мл) і суміш перемішують протягом ночі, після чого фільтрують і фільтрувальний брикет промивають ДХМ (300мл). Фільтрат і промивки об'єднують і додають ще ДХМ (800мл). Одержаний розчин промивають водою (2´500мл) і висушують над Na2SO4, фільтрують під зниженим тиском і одержують жовту піну. Піну обробляють діетилетером (800мл), суміш перемішують і потім фільтрують. Фільтрувальний брикет висушують при 45°С у вакуумі і одержують кінцеву сполуку (24,3г, 61%) у вигляді жовтого порошку. Метансульфонат 7-хлор-4-гідрокси-2-(4-піридилметил-1,2,5,10-тетрагідропіридазин-[4,5-b]хінолін-1,10діону До пермішаної суміші N-[(mpem-бутокси)карбонтаміно][7-хлор-4-оксо-2-(піролідинілкарбоніл)(гідроксихіноліл]-N-(4-піридилметил)карбоксаміду (24,0г, 45,62ммоль) і сухого ТГФ (960мл) у атмосфері нітрогену додають метансульфонову кислоту (120мл, 177,7г, 1,85моль). Суміш перемішують протягом ночі, фільтрують і тверду речовину промивають ТГФ (2´100мл), метанолом (2´50мл) і діетилетером (100мл). Фільтрувальний брикет (13,4г) суспендують у метанолі (250мл), суміш обробляють ультразвуком і фільтрують. Зібрану тверду речовину промивають метанолом (2´100мл) і діетилетером (100мл), висушують при 45°С у вакуумі і одержують кінцеву сполуку (12,1г, 59%) у вигляді жовтого порошку, темп. пл. >250°С. 1 Н ЯМР (300МГц, ДMCO-d6): δ 2,32 (s, 3Н), 5,36 (s, 2H); 7,49 (dd, 1H, J = 8,1Гц, 2,1Гц), 7,86 (d, 1Н, J = 6,6Гц); 8,06 (d, 1Н, J = 2,1Гц); 8,12 (d, 1H, J = 8,1Гц); 8,82 (d, 1H, J = 6,6Гц); 12,6 (br s, 1H), 12,84 (br s, 1H). За розрахунком для C17H11CIN4O5·CH3SO3H·0,8H2O: С, 46,47; Н, 3,60; N, 12,04. Одержано: С, 46,39; Н, 3,65; N, 11,98. Приклад 2. Метансульфонат 7-хлор-4-гідрокси-2-(3-піридилметил)-1,2,5,10-тетрагідропіридазин[4,5b]хінолін-1,10-діону Tреm-бутокси-N-[3-піридилметил)аміно]карбоксамід До розчину mpem-бутилкарбазату (203,6г, 1,54моль) і сухого ДМФ (300мл) у атмосфері нітрогену додають тріетиламін (128мл, 0,92моль) і потім суспензію 3-піколілхлоридгідрохлориду (50,0г, 0,30моль) у ДМФ (300мл). Реакційну суміш гріють 3год. при 75°С, охолоджують до кімнатної температури і розводять водою (2,4л), після чого екстрагують діетилетером (3´800мл). Водний шар насичують сіллю і екстрагують діетилетером (3´800мл). Об'єднані екстракти промивають водою (1л), розсолом (1л) і висушують над Na2SO4, який потім відфільтровують і фільтрат концентрують під зниженим тиском. Продукт очищують флеш-хроматографією на силікагелі з елюентом діетилетером і одержують кінцеву сполуку (23,3г, 34%) у вигляді білуватої твердої речовини. 1 Н ЯМР (300МГц, ДМСО-d6): δ 1,36 (s, 9Н), 3,88 (d, 2Н, J = 4,0Гц), 7,96 (d, 1H, J = 4,0Гц); 7,33 (dd, 1H, J = 7,7Гц, 4,8Гц); 7,71 (d, 1H, J = 7,7Гц); 7,44 (d, 1H, J = 4,7Гц); 8,49 (s,1H). N-[(mреm-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідинілкарбоніл)(3-гідроксихіноліл)-N-(4піридилметил)карбоксамід До перемішаної суміші 7-хлор-4-оксо-2-(піролідинілкарбоніл)-гідроксихінолін-3-карбонової кислоти Прикладу 1 (20г, 62,4ммоль) і ТГФ (800мл) у атмосфері нітрогену додають ЦМК (40,0г, 94,4ммоль) і потім швидко додають розчин (mреm-бутокси)-N-[(3-піридилметил)аміно]карбоксаміду (20,9г, 93,6ммоль) і ТГФ (450мл) і суміш перемішують протягом ночі, після чого фільтрують і фільтрувальний брикет промивають ДХМ (300мл) і суспендують у ДХМ і фільтрують. Фільтрати об'єднують і випаровують під зниженим тиском. Залишок розчиняють у ДХМ, висушують над Na2SO4, фільтрують під зниженим тиском і одержують піну. Піну обробляють діетилетером (200мл) і фільтрують. Фільтрувальний брикет обробляють ультразвуком, промивають діетилетером, висушують при 40°С у вакуумі і одержують кінцеву сполуку (32,8г, 100%) у вигляді білуватого порошку. Метансульфонат 7-хлор-4-гідрокси-2-(3-піридилметил)-1,2,5,10-тетрагідро-піридазин[4,5-b]хінолін-1,10діону До розчину N-[(mреm-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідинілкарбоніл)(3-гідроксихіноліл)]-N(4-піридилметил)карбоксаміду (32,8моль) і ТГФ (1л) у атмосфері нітрогену додають метансульфонову кислоту (150мл, 222г, 2,31моль) протягом 10хвил. Суміш перемішують протягом ночі, фільтрують і тверду речовину промивають ТГФ. Фільтрувальний брикет (13,4г) суспендують у метанолі (250мл), суміш обробляють ультразвуком (30хвил.) і фільтрують. Тверду речовину ресуспендують у метанолі, обробляють ультразвуком (30хвил.) і фільтрують, потім промивають метанолом, висушують при 100°С у вакуумі і одержують кінцеву сполуку (19,4г, 66%) у вигляді білої твердої речовини, темп. пл. >300°С. 1 Н ЯМР (300МГц, ДMCO-d6): δ 2,33 (s, 3Н), 5,29 (s, 2H); 7,46 (dd, 1H, J = 9,0Гц, 2,1Гц), 7,94 (d, 1H, J = 9,0Гц, 5,6Гц); 8,04 (d, 1H, J = 1,8Гц); 8,16 (d, 1H, J = 8,7Гц); 8,37 (d, 1Н, J = 8,1Гц); 8,82 (d, 1H, J = 4,8Гц); 8,89 (s, 1H). За розрахунком для C17H11CIN4О3·CH3SO3·H2O: С, 46,11; Н, 3,66; N, 11,95. Одержано: С, 46,34; Н, 3,61; N, 11,94. Приклад 3. Метансульфонат 7-хлор-4-гідрокси-2-(2-піридилметил)-1,2,5,10-тетрагідропіридазин[4,5b]хінолін-1,10-діону Tреm-бутокси-N-[2-піридилметил)аміно]карбоксамід До розчину mpem-бутилкарбазату (174г, 0,94моль) і сухого ДМФ (400мл) у атмосфері нітрогену додають тріетиламін (128мл, 0,92моль) і потім 3-піколіл-хлоридгідрохлорид (54,0г, 0,33моль). Реакційну суміш на 1год. залишають перемішуватись при кімнатній температурі, гріють 3год. при 70°С і залишають охолоджуватись до кімнатної температури. Потім суміш розводять сумішшю етилацетат/діетилетер (1:1), промивають розсолом і екстрагують. Водний шар аналізують ТШХ (елюент - 100%-й діетилетер) і екстрагують кілька разів етилацетатом (200мл) до непомітності продукта. Об'єднані органічні екстракти промивають розсолом, висушують над Na2SO4 і фільтрують. Фільтрат концентрують під зниженим тиском і одержують бурштинове масло (прибл. 100г), яке кристалізують. Продукт перетирають з діетиетер/гексанами (1:1), фільтрують, висушують під зниженим тиском і одержують кінцеву сполуку (33,4г, 45%) у вигляді білуватої твердої речовини. 1 Н ЯМР (300МГц, ДМСО-d6): δ 1,38 (s, 9Н); 3,96 (d, 2Н, J = 4,0Гц), 4,98 (d, 1H, J = 4,0Гц), 7,24 (dd, 1H, J = 7,8Гц, 7,8Гц); 7,48 (d, 1H); 7,74 (dd, 1H, J = 7,5Гц, 7,8Гц); 8,32 (s, br, 1H), 8,47 (d,1H, J=4,8ΓΜ). N-[(mpem-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідинілкарбоніл)(3-гідроксихіноліл)]-N-(2піридилметил)карбоксамід До перемішаної суміші 7-хлор-4-оксо-2-(піролідинілкарбоніл)гідроксихінолін-3-карбонової кислоти Прикладу 1 (17,5г, 54,7ммоль) і сухого ТГФ (900мл) у атмосфері нітрогену додають ЦМК (35,7г, 81,2ммоль) порціями (по 25,0г, і через 10хвил. - по 10,7г). Після одногодинного перемішування до реакційної суміші додають розчин (mpem-бутокси)-N-[(3-піридилметил)аміно]карбоксаміду (16,5г, 73,9ммоль) і ТГФ (400мл) і суміш перемішують протягом ночі. Реакцію контролюють ТШХ (метанол(10%)/ДХМ) і визначають її завершення, після чого фільтрують і зібрану тверду речовину промивають ТГФ. Фільтрат і промивки об'єднують і концентрують під зниженим тиском. Залишок суспендують у водному розчині бікарбонату і розсолі і екстрагують ДХМ (3´300мл). Екстракти об'єднують з раніше концентрованими органічними екстрактами і промивають бікарбонатом і розсолом (тричі) і висушують над Na2SO4. Na2SO4 відфільтровують і фільтрат концентрують під зниженим тиском, одержуючи залишок, який очищують флеш-хроматографією на силікагелі (елюент - ізопропанол(5%)/хлороформ). Після концентрації бажаних фракцій у вакуумі одержують кінцеву сполуку (24,3г, 61%) у вигляді світлокоричневого порошку. Метансульфонат 7-хлор-4-гідрокси-2-(2-піридилметил)-1,2,5,10-тетрагідро-піридазин[4,5-b]хінолін-1,10діону До розчину N-[(mреm-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідинілкарбоніл)(3-гідроксихіноліл)]-N(2-піридилметил)карбоксаміду (24,0г, 0,045моль) і сухого ТГФ (800мл) у атмосфері нітрогену додають метансульфонову кислоту (100мл, 148г, 1,54моль) протягом 10хвил. Суміш перемішують протягом ночі, фільтрують і тверду речовину промивають ТГФ (2´100мл). Фільтрувальний брикет (15,8г) суспендують у метанолі (250мл), суміш обробляють ультразвуком (30хвил.) і фільтрують. Тверду речовину промивають метанолом (2´100мл) і діетилетером (100мл), висушують при 35°С у вакуумі і одержують кінцеву сполуку (12,1г, 59%) у вигляді оранжевого порошку, темп. пл. >300°С. 1 Η ЯМР (300МГц, ДМСО-d6): δ 2,33 (s, 3Н), 5,35 (s, 2H); 7,46 (d, 1H, J = 8,7Гц), 7,64 (d, 1H, J = 7,8Гц); 7,68 (dd, 1H, J =4,8Гц, 6,6Гц); 8,02 (s, 1H), 8,14 (d, 1H, J = 8,7Гц); 8,19 (dd, 1Н, J = 6,6Гц, 7,8Гц); 8,73 (d, 1Н, J = 4,8Гц); 10,06 (s, br, 1Н), 12,84 (s, br, 1H). За розрахунком для C17H11CIN4O3·CH3SO3H: С, 47,95; Η, 3,35; Ν, 12,43. Одержано: С, 47,93; Η, 3,42; Ν, 12,01. Приклад 4. 7-хлор-4-гідрокси-2-бензо[d]фуран-2-ілметил-1,2,5,10-тетрагідро-піридазин[4,5-b]хінолін-1,10діон, N-(1-аза-2-бензо[d]фуран-2-ілвініл)(mpem-бутокси)карбоксамід До розчину бензофуран-2-карбоксальдегіду (5,0г, 34ммоль) у ТГФ (200мл) з перемішуванням додають mpem-бутилкарбазат (4,5г, 34ммоль) і потім концентровану НСІ (10 крапель) при кімнатній температурі. Реакцію перемішують 24год., видаляючи при цьому ТГФ у вакуумі, тверду речовину перетирають з гексанами і фільтруванням одержують кінцеву сполуку (9г, 100%) у вигляді білої твердої речовини. 1 Н ЯМР (300МГц, ДМСО-d6): δ 11,12 (br s, 1H), 8,02 (s, 1H), 7,67 (d, 1H, J = 7,6Гц); 7,62 (d, 1H, J = 8,5Гц); 7,37 (dd, 1H, J = 7,6Гц, 7,6Гц); 7,27 (dd, 1H, J = 7,6Гц, 7,6Гц); 7,21 (s, 1H), 1,48 (S, 9H). N-[(бензо[d]фуран-2-ілметил)аміно](mреm-бутокси)карбоксамід До розчину N-(1-аза-2-бензо[d]фуран-2-ілвініл)(mреm-бутокси)карбоксаміду (4,0г, 15ммоль) у метанолі (75мл) додають ціаноборгідрид натрію (7,2г, 115ммоль) і оцтову кислоту (10мл). Суміш гріють 4год. при 65°С. Якщо аналіз ТШХ (гексани/етилацетат (1:1)) показує залишки вихідного матеріалу, додають ще ціаноборгідриду натрію (прибл. 2г). Через 2год. вихідний матеріал зникає і реакцію охолоджують до кімнатної температури і метанол видаляють у вакуумі. Залишок розчиняють у етилацетаті і промивають насиченим водним NaHCO3, потім водою і розсолом і висушують над Na2SO4. Суміш фільтрують і концентрацією одержують кінцеву сполуку (3,4г, 13ммоль, 85%) у вигляді білої твердої речовини, яку без очищення використовують у подальших операціях. 1 Н ЯМР (300МГц, ДМСО-d6): δ 8,36 (s, 1Н), 7,57 (d, 1Н, J = 7,0Гц); 7,51 (d, 1H, J = 7,7Гц); 7,22 (m, 2Н), 6,74 (s, 1Н), 5,01 (br s, 1H); 4,00 (s, 2H), 1,37 (s, 9H). N-{N-(бензо[d]фуран-2-ілметил)][7-хлор-4-оксо-2-(піролідинілкарбоніл)(3гідрохіноліл]карбоніламіно}(mреm-бутокси)карбоксамід До суспензії 7-хлор-4-оксо-2-(піролідинілкарбоніл)-гідроксихінолін-3-карбонової кислоти Прикладу 1 (4,1г, 13ммоль) у ТГФ (75мл) додають 1-циклогексил-3-(2-морфолінетил)карбодіімід-мето-р-толуолсульфонат (10,8г, 26ммоль). До цієї яскраво-жовтої суміші додають розчин N-[(бензо[d]фуран-2-ілметил)аміно](mреm-бутокси)карбоксаміду (3,3г, 13ммоль) і Ν,Ν-диметиламінопіридину (230мг, 1,9ммоль) у ТГФ (25мл) з перемішуванням. Суміш витримують під зворотним холодильником у атмосфері нітрогену 4год., потім охолоджують і фільтрують. Фільтрат концентрують і одержують жовту тверду піну, яку хроматографують на силікагелі (метанол(10%)/СН2СІ 2) і одержують кінцеву сполуку у вигляді блідожовтої твердої речовини, яку використовують у подальшому без характеризації. 7-хлор-4-гідрокси-2-бензо[d]фуран-2-ілметил-1,2,5,10-тетрагідро-піридазин[4,5-b]хінолін-1,10-діон До суміші N-{N-(бензо[d]фуран-2-ілметил)][7-хлор-4-оксо-2-(піролідинілкарбоніл)(3гідрохіноліл]карбоніламіно}(mpem-бутокси)карбоксаміду (6,2г, 11ммоль) у ТГФ (150мл) при кімнатній температурі додають розчин метансульфонової кислоти (29мл, 44ммоль) у ТГФ (70мл). Суміш перемішують протягом ночі і потім додають воду (прибл. 500мл), щоб викликати осадження продукта. Тверду речовину кремового кольору збирають і промивають водою і діетилетером, після чого висушують при 30°С і 500мкм рт. ст. протягом ночі і одержують кінцеву речовину у вигляді білуватої твердої речовини. 1 Н ЯМР (300МГц, ДМСО-d6): δ 12,74 (br s, 1H), 11,96 (br s, 1H); 8,15 (d, 1H, J = 8,8Гц), 8,04 (d, 1H, J = 1,6Гц); 7,59 (d, 1H, J = 7,7Гц); 7,53 (d, 1H, J = 8,1Гц), 7,44 (dd, 1H, J = 2,0Гц, 8,9Гц); 7,25 (m, 2H), 6,84 (s, 1H); 5,27 (s, 2H). За розрахунком для С20Н12 N3CІ·0,1Н2О·0,3СН3SО3Н: С, 57,45; Η, 3,18; Ν, 9,90. Одержано: С, 57,61; Η, 3,20; Ν, 9,91. Приклад 5. 7-хлор-4-гідрокси-2-(хінолін-4-ілметил)-1,2,5,10-тетрагідро-піридазин[4,5-b]хінолін-1,10-діон Цю сполуку синтезують яку Прикладі 4, використовуючи як вихідний матеріал хінолін-4-карбоксальдегід. 1 Н ЯМР (300МГц, ДMCO-d6): δ 12,87 (br s, 1 Η), 12,10 (br s, 1H); 9,16 (d, 1H, J = 5,4Гц), 8,61 (d, 1H, J = 8,4Гц); 8,30 (d, 1H, J = 8,4Гц); 8,19-8,15 (m, 2H), 8,08 (d, 1H, J = 1,8Гц), 8,01 (dd, 1H, J = 7,5Гц, 7,8Гц); 7,74 (d, 2H, J = 5,4Гц), 7,47 (dd, 1H, J = 1,8Гц, 8,7Гц); 5,84 (s,1 Η). Приклад 6. МетансульФонат 7-хлор-4-гідрокси-2-(піразин-4-ілметил)-1,2,5,10-тетрагідропіридазин[4,5b]хінолін-1,10-діону 2-хлорметилпіперазин 2-метилпіразин (1,0мл, 22ммоль) у тетрахлориді карбону (80мл) обробляють Ν-хлорсукцинимідом (4,27 7, 31,5ммоль) і бензоїлпероксидом (0,26г, 1,1ммоль). Суміш гріють під зворотним холодильником 7год. і потім охолоджують до кімнатної температури. Тверду речовину відфільтровують через діатомову землю і промивають ДХМ. Фільтрат промивають насиченим водним тіосульфатом натрію, насиченим водним бікарбонатом натрію і насиченим водним хлоридом натрію. Органічний шар висушують над Na2SO4, фільтрують, концентрують під зниженим тиском і використовують у наступній реакції. 1 Н ЯМР (300МГц, ДMCO-d6): δ 4,88 (s, 2Н), 12,10 (br s, 1H); 9,16 (d, 1H, J = 5,4Гц), 8,65-8,68 (m, 2H); 8,85 (s, 1H). (Tреm-бутокси)-N-[піразин-2-ілметил)аміно]карбоксамід До розчину 2-хлорметилпіразину (1,2г, 93ммоль) і сухого ДМФ (16мл) у метанолі (75мл) додають mpem бутилкарбазат (6,3г, 48ммоль) і тріетиламін (2,6мл, 19ммоль) у атмосфері нітрогену. Суміш гріють 17год. при 75°С і охолоджують до кімнатної температури, розводять водою і екстрагують діетилетером (5х). Об'єднані екстракти промивають розсолом і висушують над Na2SO4, який потім відфільтровують. Фільтрат концентрують під зниженим тиском і одержують коричневе масло (1г), яке флеш-хроматографують (силікагель, 2-5%-ий градієнт метанолу у ДХМ) і одержують кінцеву сполуку (1,64г, 79%) у вигляді коричневої віскоподібної твердої речовини. 1 Н ЯМР (300МГц, ДMCO-d6, TFA струшування): δ 1,44 (s, 9H), 4,53 (s, 2H); 8,71-8,78 (m, 2H); 8,81 (s, 1H). N-[(mреm-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідинілкарбоніл)(3-гідроксихіноліл)]-N-(піразин-2ілметил)карбоксамід До перемішаної суміші 7-хлор-4-оксо-2-(піролідинілкарбоніл)гідрохінолін-3-карбонової кислоти Прикладу 1 (2,3г, 7,2ммоль) і сухого ТГФ (100мл) у атмосфері нітрогену додають ЦМК (4,56г, 10,8ммоль). Після 20хвилинного перемішування реакційну суміш обробляють розчином (mреm-бутокси)-N-[(3-піразин-2ілметил)аміно]карбоксаміду (1,6г, 7,1ммоль) і ДМАП (46мг, 0,4мл) у ТГФ (10мл). Суміш перемішують під зворотним холодильником протягом 2 днів і потім охолоджують до кімнатної температури, після чого фільтрують і фільтрувальний брикет промивають ТГФ. Об'єднані фільтрати і промивки концентрують і одержують коричневу піну, яку хроматографують (силікагель, метанол(2%)/ДХМ) і одержують кінцеву сполуку (3,1г, 82%). Метансульфонат7-хлор-4-гідрокси-2-(піразин-2-ілметил)-1,2,5,10-тетрагідро-піридазин[4,5-b]хінолін-1,10діону До перемішаної суміші N-[(mреm-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідинілкарбоніл)(3гідрохіноліл)]-N-(4-піразин-2-ілметил)карбоксаміду (3,1г, 5,9ммоль) і сухого ТГФ (100мл) у атмосфері нітрогену додають метансульфонову кислоту (13,5мл, 0,21моль). Суміш перемішують протягом ночі, фільтрують і тверду речовину промивають ТГФ, після чого обробляють метанолом і ультразвуком (1год.). Тверду речовину збирають фільтруванням, промивають метанолом, висушують при 50°С у вакуумі і одержують кінцеву сполуку (2,0г, 80%) у вигляді білого порошку, темп. пл. 235-245°С. 1 Н ЯМР (300МГц, ДМСО-d6): δ 2,38 (СН3СО2, s, 3Н), 5,27 (s, 2H); 7,44 (dd, 1H, J = 1,8Гц, 8,7Гц), 8,04 (d, 1H, J = 1,8Гц); 8,14 (d, 1H, J = 8,7Гц); 8,58 (dd, 1H, J = 2,4Гц, 7,5Гц); 8,63 (s, 1Η). За розрахунком для С16Н10СlN5О3·СН3SО3Н·Н2О: С, 43,46; Н, 3,43; Ν,14,90. Одержано: С, 43,28; Н, 3,34; Ν, 15,17. Приклад 7. 7-хлор-4-гідрокси-2-(5-ізоксалін)метил-1,2,5,10-тетрагідро-піридазин[4,5-b]хінолін-1,10-діон Tреm-бутиловий естер N¢-ізоксазол-5-ілметилгідразинкарбонової кислоти Суміш 5-бромметилізоксазолу (1,62г, 10ммоль), mpem-бутилкарбазату (5,29г, 40ммоль) і карбонату натрію (2,76г, 20ммоль) у ДМФ (25мл) розігрівають до 80°С у атмосфері нітрогену протягом 6год. Суміш охолоджують і розділяють між етилацетатом (100мл) і водою (200мл). Органічний шар промивають розсолом (3´50мл) і висушують над MgSO4. Розчинник видаляють відцентровим випаровуванням. Залишки ДМФ і mpemбутилкарбазату видаляють вакуумною дистиляцією (50мкм рт. ст., 80°С). Залишок хроматографують (силікагель, етилацетат/гексан (1:1)) і одержують кінцеву сполуку у вигляді білої твердої речовини (1,01г, 46%). 1 Н ЯМР (300МГц, ДMCO-d6): δ 1,38 (s, 9H), 4,01 (s, 2H); 5,13 (bs, 1H), 6,38 (s, 1H); 8,38 (s, 1 Η); 8,48 (s, 1H). Tpem-бутиловий естер N¢-7-хлор-4-гідрокси-2-(піролідин-1-карбоніл)хінолін-3-карбоксил]-N¢-ізоксазол-5ілметилгідразинкарбонової кислоти До перемішаної суспензії 7-хлор-4-оксо-2-(піролідинілкарбоніл)гідрохінолін-3-карбонової кислоти Прикладу 1 (1,51г, 4,7ммоль) у ТГФ (50мл) додають ЦМК (4,24г, 10ммоль) і реакцію перемішують 5хвил. Додають розчин mpem-бутилового естеру N¢-ізоксазол-5-ілметилгідразинкарбонової кислоти (1,0г, 4,7ммоль) і ДМАП (0,06г, 0,5ммоль у ТГФ (10мл). Суміш гріють під зворотним холодильником 3год., потім витримують при кімнатній температурі 16год. Тверду речовину відфільтровують і промивають ДХМ (2´50мл). Об'єднаний фільтрат випаровують до сухості відцентровим випаровуванням. Твердий залишок хроматографують (силікагель, метанол/ДХМ (1:9)) і одержують кінцеву сполуку у вигляді білуватої піни (2,09г, 86%). МС (СІ) m/z 514/516. 7-хлор-4-гідрокси-2-(5-ізоксалін)метил-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон До розчину mpem-бутилового естеру N'-[7-хлор-4-гідрокси-2-(піролідин-1-карбоніл)-хінолін-3-карбоксил]-N¢ізоксазол-5-ілметилгідразинкарбонової кислоти у ТГФ (50мл) додають метансульфонову кислоту (5,2мл). Через 18год. розчин видаляють випаровуванням і продукт осаджують доданням води (100мл). Тверду речовину збирають вакуумним фільтруванням, промивають водою (2´50мл), висушують у вакуумі (500мкм рт. ст., 30°С), суспендують у діетилетері (45мл) і метанолі (5мл) і обробляють ультразвуком (10хвил.). Тверду речовину збирають вакуумним фільтруванням, промивають діетилетером (2´30мл) і сушать у вакуумі (500мкм рт. ст., 30°С) протягом 18год. Це дає кінцеву сполуку у вигляді жовтої твердої речовини (0,54г, 81%). 1 Н ЯМР (300МГц, ДМСО-d6): δ 5,27 (s, 2Н); 6,44 (s, 1Н), 7,45 (dd, 1Н, Jo = 8,7Гц, Jm = 1,8Гц), 8,03 (d, 1Н, Jm = 1,8Гц); 8,15 (d, 1Н, J0 = 8,7Гц); 8,53 (s, 1H, Jm = 1,8Гц); 11,9 (s, 1Η), 12,82 (s, 1Η). За розрахунком для C15H9CIN4O4·0,4H2O: С, 51,20; Η, 2,81; Ν, 15,92. Одержано: С, 51,48-51,33; Η, 2,79; Ν, 15,60-15,57. Приклад 8. 7-хлор-4-гідрокси-2-(піримідин-2-ілметил)-1,2,5,10-тетрагідро-піридазин-[4,5-b]хінолін-1,10-діон Цю сполуку синтезують, як у Прикладі 7, використовуючи як вихідну сполуку 4-хлорметилпіримідин, який одержують, як це описано у Barnes J.H. et al., Eur. J. Med. Chem. Chim. Ther., 1988, 23, 211-216. 1 H ЯМР (300МГц, ДMCO-d6): δ 12,77 (br s, 1H); 9,12 (d, 1H, J = 1,2Гц), 8,74 (d, 1H, J = 5,4Гц); 8,05 (d, 1H, J = 1,8Гц); 7,45 (dd, 1H, J = 2,1Гц, 8,7Гц); 7,40 (d, 1H, J = 5,1Гц); 5,20 (s, 2H). Приклад 9. 7-хлор-4-гідрокси-2-(фуран-2-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон N-(1-аза-2-(2-фураніл)вініл)(mреm-бутокси)карбоксамід До перемішаної суспензії mреm-бутилкарбазату (131,5г, 0,99моль) у гексані додають 2-фуральдегід (91,9г, 0,95моль) і потім витримують 2,5год. під зворотним холодильником і охолоджують до кімнатної температури. Одержану світлокоричневу тверду речовину фільтрують, висушують і використовують у подальшому без очищення. 1 Н ЯМР (300МГц, ДMCO-d6): δ 1,52 (s, 9H), 6,45 (dd, 1H, J = 3,3Гц, 1,2Гц); 6,71 (d, 1Н, J = 3,3Гц); 7,91 (s, 9H). (Tреm-бутокси)-N-[(фуранілметил)аміно]карбоксамід Однолітрову тригорлу круглодонну колбу обладнують додатковим патрубком, входом для нітрогену і механічним перемішувачем. Апарат висушують у вакуумі і продувають нітрогеном. У колбу вносять алюмогідрид літію (7,75г, 0,20моль) і ТГФ (30мл). N-(1-a3a-2-(2-фураніл)вініл)(mреm-бутокси)карбоксамід (20г, 0,095моль) розчиняють у ТГФ (250мл) і повільно протягом 30хвил. додають до перемішаної суспензії алюмогідриду літію. Матеріал, що залишився у патрубку, змивають у колбу ТГФ (2´30мл). Реакцію перемішують протягом ночі, охолоджують у льодяній ванні і обережно гасять насиченим водним розчином Na2SO4. Одержану суміш фільтрують і фільтрат промивають ТГФ. Об'єднані фільтрат і промивки концентрують до масла, яке потім перемішують 18год. з гексанами (прибл. 600мл). Суміш фільтрують, фільтрат концентрують і одержують бажану сполуку у вигляді жовтого масла (10,0г, 50%). 1 Н ЯМР (300МГц, ДMCO-d6): δ 1,46 (s, 9Н), 3,99 (d, 2Н, J = 4,9Гц); 4,21 (br s, 1H), 6,17 (brs, 1H), 6,24 (d, 1H, J = 3,0Гц); 6,32 (dd, 1H, J = 3,0Гц, 1,2Гц). (+/-)-N-[(mреm-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідинілкарбоніл)(3-гідрохіноліл)]-N-(2фуранілметил)карбоксамід До перемішаної суспензії 7-хлор-4-оксо-2-(піролідинілкарбоніл)гідрохінолін-3-карбонової кислоти Прикладу 1 (26,99г, 84,3ммоль) у ТГФ (1300мл) додають діізопропілкарбодіімід (13,94г, 110ммоль). Після 10-хвилинного перемішування до реакційної суміші краплями додають розчин (mреm-бутокси)-N-[(2фуранілметил)аміно]карбоксамід (22,9г, 103ммоль) у ТГФ (200мл). Суміш перемішують 18год., потім концентрують до коричневої смоли, яку перетирають з хлороформом, фільтрують, промивають хлороформом і висушують. Цей матеріал (прибл. 30г) використовують у подальшому без очищення. 7-хлор-4-гідрокси-2-(2-фуранілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон До розчину (+/-)-N-[(mреm-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідиніл-карбоніл)(3-гідрохіноліл)]-N(2-фуранілметил)карбоксаміду (29,00г, 56,3ммоль) у ТГФ (1000мл) додають метансульфонову кислоту (118мл) і реакцію перемішують 18год. при кімнатній температурі, Суміш вливають у 3л льодяної води і фільтруванням одержують білувату тверду речовину, яку розчиняють у гарячому ТГФ (прибл. 1л) і потім концентрують до пів об’єму. Одержану суспензію вливають у 2л льодяної води і через 20хвил. фільтрують. Після висушування цього матеріалу одержують кінцеву сполуку у вигляді білої твердої речовини (14,4г, 74%), темп. пл. >265°С. 1 Н ЯМР (300МГц, ДМСО-d6): δ 5,08 (s, 2Н); 6,37 (d, 1Н, J = 3,0Гц), 6,42 (dd, 1H, J = 3,0Гц, 1,5Гц), 7,43 (d, 1Н, J = 7,8Гц), 7,54 (s, 1Н), 8,00 (d, 1Н, J = 1,5Гц); 8,14 (d, 1Н, J0 = 8, Гц). За розрахунком для C16H10CIN3O4: С, 55,91; Н, 2,93; N, 12,23. Одержано: С, 56,10; Н, 2,98; N, 12,03. Приклад 10. 7-хлор-4-гідрокси-2-(фуран-3-ілметил)-1,2,5,10-тетрагідропіридазин-[4,5-b]хінолін-1,10-діон N-(1-аза-2-(3-фурил)вініл)(mреm-бутокси)карбоксамід До розчину фуран-3-карбоксальдегіду (2,0г, 21ммоль) додають mpem-бутилкарбазат (2,8г, 21ммоль) і конц. НСІ (5 крапель). Розчин перемішують 6год. і концентрують. Одержану тверду речовину перетирають з гексанами і одержують кінцеву сполуку (4,2г, 20ммоль, 97%) у вигляді твердої речовини персикового кольору. 1 Н ЯМР (300МГц, ДМСО-d6): δ 10,77 (br s, 1H), 8,02 (s, 1H), 7,94 (s, 1H), 7,71 (dd, 1H, J = 1,5Гц, 1,5Гц); 6,77 (d, 1H, J = 1,5Гц); 1,45 (s, 9H). (Tpem-бутокси)-N-[(3-фурилметил)аміно]карбоксамід До розчину N-(1-аза-2-(3-фурил)вініл)(треm-бутокси)карбоксаміду (2,0г, 9,5ммоль) у метанолі (50мл) додають ціаноборгідрид натрію (3,0г, 48ммоль) і оцтову кислоту (6мл). Розчин розігрівають до 65°С протягом 1год., потім охолоджують до кімнатної температури, гасять водою і видаляють метанол у вакуумі. Залишок вносять у етилацетат і промивають насиченим бікарбонатом натрію, водою і розсолом і висушують над Na2SO4, потім фільтрують і концентрують. Залишок очищують хроматографією на силікагелі (гексани/етилацетат (4:1)) і одержують кінцеву сполуку (930мг, 4,4ммоль, 46%) у вигляді прозорого масла. 1 Н ЯМР (300МГц, ДМСО-d6): δ 8,26 (br s, 1H), 7,58 (dd, 1H, J = 1,5Гц, 1,5Гц), 7,53 (s, 1H), 6,42(d, 1H, J = 1,2Гц); 4,64 (brs, 1H), 3,69 (s, 2H); 1,39 (s, 9H). (Tpem-бутoкcи)-N-{[7-xлop-4-oкco-2-(піролідинілкарбоніл)(3-гідрохіноліл)]-N-3(фурилметил)карбоніламіно)карбоксамід До перемішаної суспензії 7-хлор-4-оксо-2-(піролідинілкарбоніл)-гідрохінолін-3-карбонової кислоти Прикладу 1 (1,4г, 4,4ммоль) у ТГФ (25мл) додають ЦМК (3,7г, 8,8ммоль). До цієї яскравожовтої суміші додають розчин (mpem-бутокси)-N-{[3-фурилметил)аміно}карбоксаміду (930мг, 4,4ммоль) і Ν,Ν-диметиламінопіридину (80мг, 660мкмоль) у ТГФ (20мл) з перемішуванням. Суміш витримують під зворотним холодильником у атмосфері нітрогену 3год., потім охолоджують і фільтрують. Фільтрат концентрують і одержують жовту тверду піну, яку хроматографують на силікагелі (метанол(10%)/СН2СІ 2) і одержують кінцеву сполуку у вигляді блідожовтої твердої речовини, яку використовують у подальшому безпосередньо. 7-хлор-4-гідрокси-2-(фуран-3-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон До суміші (mpem-бутокси)-N-{[7-хлор-4-оксо-2-(піролідинілкарбоніл)(3-гідрохіноліл)]-N-3(фурилметил)карбоніламіно}карбоксаміду (1,4г, 2,8ммоль) у ТГФ (30мл) при кімнатній температурі додають розчин метансульфонової кислоти (7,2мл, 110ммоль) у ТГФ (25мл). Розчин перемішують протягом ночі, додаючи при цьому воду, щоб викликати осадження. Тверду речовину збирають, промивають водою і діетилетером і обробляють ультразвуком (15хвил.) у метанолі (10%) у діетилетеровому розчині. Одержану жовту тверду речовину збирають, промивають діетилетером і сушать при 30°С і 50мкм рт. ст. протягом 3год. і одержують кінцеву речовину (750мг, 2,1ммоль, 75%) у вигляді блідожовтої твердої речовини. 1 Н ЯМР (300МГц, ДМСО-d6): δ 12,63 (br s, 1H), 11,91 (s, 1H); 8,13 (d, 1H, J = 8,7Гц), 8,02 (d, 1H, J = 1,5Гц); 7,65 (s, 1H), 7,61 (d, 1H, J = 1,5Гц); 7,43 (dd, 1H, J = 1,8Гц, 8,7Гц), 6,46 (s, 1H); 4,92 (s, 2H). За розрахунком для С16Н10 N3О4CІ·0,1Н2О: С, 55,62; Н, 2,98; N,12,16. Одержано: С, 55,67; Н, 3,15; N, 11,77. Приклад 11. 7-хлор-4-гідрокси-2-(тіен-3-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон Цю сполуку синтезують, як у Прикладі 4, використовуючи як вихідний матеріал тіофен-2-карбоксальдегід. 1 Н ЯМР (300МГц, ДМСО-d6): δ 12,71 (brs, 1H), 11,91 (s, 1H); 8,14 (d, 1H, J = 8,7Гц), 8,02 (s, 1H); 7,42-7,45 (m, 2H); 7,10 (d, 1H, J = 3,0Гц); 6,98 (dd, 1H, J = 5,1Гц), 5,23 (s, 2H). Приклад 12. 7-хлор-4-гідрокси-2-(тіен-3-ілметил)-1,2,5,10-тетрагідропіридазин[4,5-b]хінолін-1,10-діон Цю сполуку синтезують, як у Прикладі 4, використовуючи як вихідний матеріал тіофен-2-карбоксальдегід. 1 Н ЯМР (300МГц, ДМСО-d6): δ 12,64 (br s, 1Н), 11,92 (br s, 1H); 8,14 (d, 1H, J = 8,7Гц), 8,02 (d, 1H, J = 1,5Гц); 7,48-7,54 (m, 1H); 7,43 (dd, 1H, J = 1,2Гц, 8,7Гц), 7,37 (s, 1H), 7,08 (d, 1H, J = 4,5Гц), 5,08 (s, 2H). Приклад 13. 7-хлор-4-гідрокси-2-(бензо[b]тієн-3-ілметил)-1,2,5,10-тетрагідро-піридазин[4,5-b]хінолін-1,10діон Бензо[b]тіофен-2-карбальдегід До розчину бензо[b]тіофену (10г, 74,5ммоль) у сухому ТГФ (12мл) при -78°С додають 65мл 1,6М nбутиллітію у гексанах і через 10хвил. додають ДМФ (23мл, 298ммоль). Реакцію нагрівають до кімнатної температури і витримують 3год. під зворотним холодильником. ТГФ випаровують, а залишок вливають у 1N НСІ з льодом. Розчин екстрагують діетилетером (двічі), комбінований етеровий екстракт промивають 1N НСІ (тричі), насиченим NaHCO3 і розсолом і висушують з MgSO4, який потім відфільтровують. Фільтрат концентрують до масла, яке обробляють NaHCO3. Утворену тверду речовину висушують над MgSO4 і випаровуванням одержують кінцеву сполуку у вигляді жовтого масла (3,2г, 26%). 1 Н ЯМР (300МГц, CDCI 3): δ 7,44 (dd, 1H, J = 6,9Гц, 7,2Гц), 7,51 (dd, 1H, J = 6,9Гц, 8,1Гц); 7,91 (d, 1Н, J = 8,1Гц), 7,95 (d, 1Н, J = 7,8Гц), 8,04 (s, 1 Η), 10,12 (s, 1H). (Tреm-бутокси)-N-1-аза-2-бензо[b]тієн-2-ілвініл)карбоксамід До розчину бензо[b]тіофен-2-карбальдегіду (3,2г, 19,7ммоль) і mpem-бутилкарбазату (2,6г, 19,7ммоль) у етанолі (20мл) додають 3 краплі концентрованої НСІ. Через 30хвил. суміш фільтрують, тверду речовину промивають діетилетером і після висушування у вакуумі одержують кінцеву сполуку (3,8г, 70%). 1 Н ЯМР (300МГц, CDCI 3): δ 1,54 (s, 9H), 7,30-7,36 (m, 1H); 7,40 (s, 1H), 7,71-7,74 (m, 1H), 7,89 (s,1 Η), 8,31 (br s,1H). (Tреm-бутокси)-N-[(бензо[b]тієн-2-ілметил)аміно]карбоксамід До суспензії (mреm-бутокси)-N-1-аза-2-бензо[b]тієн-2-ілвініл)карбоксаміду (1,8г, 6,5ммоль) у ТГФ (6мл) додають ціаноборгідрид натрію (0,75г, 11,9ммоль). Краплями додають розчин р-толуолсульфонової кислоти (1,86г, 9,8ммоль) у ТГФ (6мл). Після перемішування протягом ночі реакцію розводять етилацетатом і промивають насиченим NаНСО3 і насиченим NaCI. Етилацетатний розчин висушують над К2СО3, який потім відфільтровують і фільтрат концентрують під зниженим тиском. Одержану тверду речовину обробляють насиченим NaHCO3 протягом ночі і екстрагують ДХМ. Розчин ДХМ висушують над Na2SO4, який потім відфільтровують, а фільтрат концентрують, одержуючи кінцеву сполуку у вигляді білої твердої речовини (1,7г, 76%). 1 Н ЯМР (300МГц, CDCI 3): δ 1,44 (s, 9H), 4,68 (s, 2H), 7,36-7,45 (m, 2H); 7,45 (s, 1H), 7,78-7,86 (m, 2H). Tреm-бутиловий естер N'-[(бензо[b]тієн-2-ілметил)-N'-[7-хлор-4-оксо-2-(піролідин-1-карбоніл)-1,4дигідрохінолін-3-карбоніл]-гідразинкарбонової кислоти До перемішаної суміші 7-хлор-4-оксо-2-(піролідинілкарбоніл)-гідроксихінолін-3-карбонової кислоти Прикладу 1 (1,59г, 5,0ммоль) в сухого ТГФ (60мл) у атмосфері нітрогену додають ЦМК (3,19г, 7,0ммоль) і після цього ще розчин (mpem-бутокси)-N-[(бензо[b]тієн-2-ілметил)аміно]карбоксаміду (1,37г, 5,0ммоль) і диметиламінопіридину (27,8г, 0,21ммоль) у ТГФ (15мл). Реакцію гріють протягом ночі під зворотним холодильником і суміш фільтрують. Концентрований фільтрат очищують хроматографією (МеОН/СН2СІ 2 - 5:95 (об'єм/об'єм)) на силікагелі і одержують кінцеву сполуку у вигляді жовтої твердої речовини (771мг, 24%). 7-хлор-4-гідрокси-2-(бензо[b]тіен-3-ілметил)-1,2,5,10-тетрагідро-піридазин[4,5-b]хінолін-1,10-діон До перемішаної суміші mpem-бутилового естеру N'-[(бензо[b]тієн-2-ілметил)-N'-[7-хлор-4-оксо-2-(піролідин1-карбоніл)-1,4-дигідрохінолін-3-карбоніл]-гідразинкарбонової кислоти (760мг, 1,3ммоль) і сухого ТГФ (16мл) при 0°С у атмосфері нітрогену додають метансульфонову кислоту (3,0мл, 4,44г, 46,2ммоль). Після перемішування протягом ночі випаровують ТГФ і залишок охолоджують у льодяній ванні. Додають воду і збирають осад, обробляють ультразвуком у метанолі, висушують у вакуумі і одержують кінцеву сполуку у вигляді білуватої твердої речовини (470мг, 88%), темп. пл. >300°С. 1 Н ЯМР (300МГц, ДМСО-d6): δ 5,38 (s, 2Н); 7,30-7,38 (m, 2Н), 7,40 (s, 1H), 7,44 (d, 1Н, J = 8,7Гц); 7,90 (d, 1H, J = 7,2Гц); 7,82 (d, 1H, J = 7,2Гц); 7,82 (d, 1H, J = 7,2Гц); 8,06 (s, 1H), 8,15 (d, 1Η,J = 8,7Гц). За розрахунком для C20H12CIN3О3S: С, 58,61; Η, 2,95; Ν, 10,25. Одержано: С, 58,42; Η, 3,19; Ν, 10,20. Приклад 14. 7-хлор-4-гідрокси-2-(1,3-тіазо-2-ілметил)-1,2,5,10-тетрагідропіридазин-[4,5-b]хінолін-1,10-діон (Tреm-бутокси)-N-[(бензо[b]тієн-2-ілметил)аміно]карбоксамід До розчину тіазол-2-карбальдегіду (0,95г, 8,42ммоль) і mpem-бутилкарбазату (1,17г, 8,87ммоль) у етанолі (15мл) додають 1,10мл льодяної оцтової кислоти і потім ціаноборгідрид натрію (2,18г, 34,7ммоль). Реакційну суміш розігрівають до 50°С і перемішують 72год. Реакцію гасять 2Ν NaOH (30мл) і розчин екстрагують етилацетатом (3´30мл). Об'єднані органічні шари промивають розсолом (40мл) і висушують над Na2SO4, який потім відфільтровують і фільтрат очищують хроматографією (етилацетат/ДХМ (25:75)) на силікагелі, одержуючи кінцеву сполуку у вигляді білуватої твердої речовини (0,62г, 32%). 1 Н ЯМР (300МГц, ДМСО-d6): δ 1,38 (s, 9Н); 4,15 (d, 2Н, J = 3,9Гц); 5,34 (d, 1H, J = 3,9Гц); 7,63 (d, 1Н, J = 3,3Гц); 7,70 (d, 1Н, J = 3,3Гц); 8,42 (br s, 1H). N-[(mpem-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідинілкарбоніл)(3-гідрохіноліл)]-N-(1,3-тіазол-2ілметил)карбоксамід До перемішаної суміші 7-хлор-4-оксо-2-(піролідинілкарбоніл)гідрохінолін-3-карбонової кислоти Прикладу 1 (0,90г, 2,80ммоль) і сухого ТГФ (60мл) у атмосфері нітрогену додають ЦМК (1,45г, 3,42ммоль) і потім розчин (mpem-бутокси)-N-[(1,3-тіазол-2-ілметил)аміно]карбоксаміду (0,5г, 2,20ммоль) і диметиламінопіридину *79,1г, 0,65ммоль) у ТГФ (15мл). Реакційну суміш гріють під зворотним холодильником протягом ночі і після охолодження фільтрують. Концентрований фільтрат очищують хроматографією (МеОН/СН2СІ 2 - 5:95 (об'єм/об'єм)) на силікагелі і одержують кінцеву сполуку у вигляді жовтої твердої речовини (0,97г, 83%). 7-хлор-4-гідрокси-2-(1,3-тіазо-2-ілметил)-1,2,5,10-тетрагідропіридазин-[4,5-b]хінолін-1,10-діон До перемішаної суміші N-[(mpem-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідиніл-карбоніл)(3гідрохіноліл)]-N-(1,3-тіазол-2-ілметил)карбоксаміду (760мг, 1,3ммоль) і сухого ТГФ при 0°С у атмосфері нітрогену додають метансульфонову кислоту (5,4мл, 7,99г, 83,2ммоль). Після перемішування протягом ночі випаровують ТГФ і залишок охолоджують у льодяній ванні. Додають воду і збирають осад і обробляють ультразвуком у метанолі. Тверду речовину збирають всмоктувальною фільтрацією, висушують у вакуумі і одержують кінцеву сполуку у вигляді білуватої твердої речовини (648мг, 78%), темп. пл. >300°С. 1 H ЯМР (300МГц, ДМСО-d6): δ 5,38 (s, 2Н); 7,45 (d, 1Н, J = 8,7Гц); 7,90 (d, 1H, J = 8,7Гц); 7,70 (d, 1H, J = 3,3Гц); 7,76 (d, 1H, J = 3,3Гц); 8,04 (s, 1H), 8,15 (d, 1H, J = 8,7Гц). За розрахунком для С15Н10СlN3О4S·Н2ОН3СSО3Н: С, 40,38; Н, 3,39; N, 11,77. Одержано: С, 40,63; Н, 2,98; N, 11,39. Приклад 15. 7-хлор-4-гідрокси-2-(імідазол-2-ілметил)-1,2,5,10-тетрагідропіридазин-[4,5-b]хінолін-1,10-діон N-(1-аза-2-імідазол-2-ілвініл)(mpem-бутокси)карбоксамід До розчину 2-імідазолкарбоксальдегід (10,2г, 106ммоль) додають mpem-бутилкарбазат (2,8г, 21ммоль) і конц. НСІ. Розчин перемішують протягом ночі, концентрують і перетирають з гексанами, одержуючи кінцеву сполуку (22г, 99%) у вигляді білої твердої речовини. 1 Н ЯМР (300МГц, ДMCO-d6): δ 1,47 (s, 9Н), 7,08 (s, 2Н), 7,92 (s, 1Н), 10,93 (br s, 1H), 12,58 (brs, 1H). (Tреm-бутокси)-N-[(імідазол-2-ілметил)аміно]карбоксамід Суміш 10%-го паладію на карбоні і N-(1-аза-2-імідазол-2-ілвініл)(mpem-бутокси)-карбоксаміду (3,0г, 14ммоль) у метанолі і концентрованій НСІ (1,15мл, 14,0ммоль) гідрогенують (40 фунтів/кв. дюйм - 2,6ат) при кімнатній температурі протягом 18год. Реакцію фільтрують через діатомову землю, фільтрат випаровують під зниженим тиском і одержують масло, яке нейтралізують доданням гідроксиду натрію (5N, 2,8мл) і розводять етилацетатом. Етилацетатний шар промивають водою (20мл) і водним насиченим хлоридом натрію (20мл) і висушують над Na2SO4. Етилацетат видаляють і одержують кінцеву сполуку у вигляді масла (2,42г, 80%). 1 Н ЯМР (300МГц, ДМСО-d6): δ 1,36 (s, 9Н); 3,84 (d, 1Н, J = 4,2Гц); 4,82 (br s, 1H), 6,91 (s, 2H), 8,25 (br s, 1Η), 11,84 (br s, 1H). N-[(mpem-бутокси)карбоніламіно]7-хлор-4-оксо-2-(піролідинілкарбоніл)-(гідрохіноліл]-N-(імідазол-2ілметил)карбоксамід Суміш 7-хлор-4-оксо-2-(піролідинілкарбоніл)гідроксихінолін-3-карбонової кислоти Прикладу 1 (2,42г, 7,54ммоль), (mpem-бутокси)-N-[(імідазол-2-ілметил)аміно]-карбоксаміду (2,0г, 9,43ммоль) у сухому ТГФ (50мл) витримують під зворотним холодильником 18год. Реакцію фільтрують, тверду речовину збирають і промивають водою і потім діетилетером. Цей матеріал висушують у вакуумі і одержують кінцеву сполуку у вигляді білої твердої речовини (1,0г, 25%). 7-хлор-4-гідрокси-2-(імідазол-2-ілметил)-1,2,5,10-тетрагідропіридазин-[4,5-b]хінолін-1,10-діон До розчину N-[(mреm-бутокси)карбоніламіно][7-хлор-4-оксо-2-(піролідинілкарбоніл)-(гідрохіноліл]-N(імідазол-2-ілметил)карбоксаміду (1,0г, 1,94ммоль) у ТГФ (30мл) додають метансульфонову кислоту (5мл) і реакцію перемішують протягом ночі. Леткі компоненти видаляють у вакуумі і до масляного залишку додають діетилетер (200мл). Суміш пермішують 10хвил. і залишають для утворення двох шарів - етерного шару і шару коричневого масла. Етер декантують, а до коричневого масла додають воду (5мл). Через короткий час утворюється осад, який збирають вакуумним фільтруванням, промивають діетилетером (3´20мл) і обробляють ультразвуком (15 хвил.) у суміші діетилетеру і метилового спирту (10:1). Матеріал фільтрують, промивають діетилетером, висушують у вакуумі і одержують кінцеву сполуку (0,24г, 25%). 1 Н ЯМР (300МГц, ДМСО-d6): δ 2,31 (CH3SO3H); 5,41 (s, 2H), 7,42 (d, 1H, J = 8,7Гц); 7,67 (s, 2H); 7,99 (s, 1H); 8,15 (d, 1H, J = 8,7Гц); 12,7 (br s, 1H), 11,98 (br s), 12,93 (br s, 1H), 14,28 (brs, 1H). За розрахунком для С15Н10СlN4О3·1,6СН3СSО3Н: С, 40,08; Η, 3,32; Ν, 14,08. Одержано: С, 40,37; Η, 3,12; Ν, 14,34. Випробування біологічних функцій Тест А: Інгібування зв'язування [3Η]ΜDL105,519 Зв'язування сполук з гліциновим сайтом рецептора NDMA можна оцінити, вимірюючи здатність сполуки інгібувати зв'язування тритійованого MDL105.519 з мозковими мембранами, що мають цей рецептор. Мозкові мембрани щура, які використовувались у експериментах, були одержані від Analytical Biological Services Inc і були приготовлені згідно з методом В.М. Baron et al., J. Pharmacol. Exp. Then, 250, 162 (1989). Свіжу мозкову тканину щурів Sprague-Dawley, що включала церебральну кору і гіпокамп, гомогенізували у 0,32М сахарозі і центрифугували з малою швидкістю, щоб відокремити клітинні мембрани від інших компонентів клітини. Мембрани тричі промивали деіонізованою водою і потім обробляли 0,04%-м Triton X-100, після чого промивали 6 разів у 50мМ Tris-цитратному буфері, рН 7,4 і заморожували при -80°С для подальшого використання. [3H]MDL105,519 був придбаний від Amersham, холодний MDL105.519 - від Sigma/RBI. Аналіз на зв'язування виконували згідно з В.М. Baron et al., J. Pharmacol. Exp. Then, 279, 62 (1996), як це описано далі. У день експеримента мозкові мембрани були розморожені і при кімнатній температурі суспендовані у 50мМ tris-ацетатному буфері, рН 7,4 ("ТАВ"). Для конкурентного зв'язування був використаний протеїн (75мкг/мл) з забарвлювачем BioRad. Експерименти були проведені на 96-гніздових платах. Мембрани інкубували з 20мкл сполук різної концентрації і 1,2нМ [3H]MDL105,519 протягом 30хвил. при кімнатній температурі у об'ємі 250 мкл. Неспецифічне зв'язування визначали, використовуючи 100мкМ неміченого MDL105.519. Немічений MDL105.519 і сполуки розчиняли як основні 12,5мМ розчини у ДМСО. Кінцева концентрація ДМСО у кожному гнізді підтримували на рівні нижче 1%, оскільки було виявлено, що така концентрація не впливає на результати зв'язування. Після інкубації незв'язаний [3H]MDL105,519 був видалений фільтруванням у плати GF/B Unifilter з використанням збиральника Packard. Фільтри промивали 4 рази льодяним ТАВ (повна кількість буфера 1,2мл). Плати сушили протягом ночі при кімнатній температурі і зв'язану радіоактивнисть виміряли лічильником Packard TopCount після додання 45мкл у кожне гніздо MICROSCINT О. Мозкові мембрани людини були одержані від Analytical Biological Services Inc. і були приготовлені, як це було описано для мембран щура. Аналіз даних був виконаний з використанням програмних пакетів Microsoft Exel і GraphPad Prizm, а дієвість сполук виміряли у Кі (нм). Тест В. Формаліновий тест Формаліновий тест використовують для оцінювання здатності сполуки інгібувати індуковану формаліном ноцицептичну поведінку у щурів (D. Dubuisson et al., Pain 4, 161-174 (1977); Η. Wheeler-Aceto et al., Psychopharmacology 104, 35-44 (1991); T.J. Coderre et al., Pain 54, 43-50 (1993)). У цьому тесті спостерігають дві різні фази індукованої формаліном поведінки. Перша фаза реакції, спричиненої гострою ноцицепцією у відповідь ін'єкцію їдкої хімічної речовини (формаліну) у лапу, триває 0-5хвил. Після ін'єкції протягом 5-15хвил. триває період заспокоювання. Після цього через 15хвил. починається і триває до 60хвил. друга фаза реакції, зумовлена сенсибілізацією центральних нейронів у дорсальному розі. Сенсибілізація центральних спинних нейронів підсилює аферентний подразнюючий вхід і спричиняє передачу підсиленого болю у мозок. Отже, інгібуванням другої фази реакції визначається центральний механізм дії ліків. Процедура формалінового тесту така: самців щура розміщують у камері з оргскла і спостерігають 3045хвил. основні особливості їх поведінки. Тваринам вводять носій (контр. група) або різні дози сполуки, що випробовується, за три год. до ін'єкції 0,05мл стерильного 1%-го формаліну під дорсальну шкіру задньої лапи. Кількість сіпань лапи (реакцій) протягом першої (0-5хвил.) і другої (20-35хвил.) фаз підраховували і реєстрували. Сіпальну реакцію порівнювали з середньою відповідною кількістю у контрольній групі (соляний розчин) і обчислювали як інгібування у %%. EDso - доза сполуки, яка дає 50%-не інгібування ноцицептивної реакції у першій або другій фазі. Перша фаза реакції може бути інгібована сполуками, які діють периферійно і сполуками, які діють центрально. Друга фаза реакції може бути інгібована сполуками, які мають центральну дію. інгібування ноцицептивної реакції (%) = 100 ´ (кількість реакцій у групі сполук)/ (кількість реакцій у контрольній групі) Для визначення статистичної значущості дії сполуку був використаний тест Стьюдента. Дані наведені у %% інгібування. Тест С Модель нейропатичного болю (Хронічне Стискання) Антигіпералгезійні якості сполуки можуть бути випробувані на моделі Хронічного стискання (ССІ). Тест є моделлю нейропатичного болю, повязаного з пошкодженнями нерва, що безпосередно походять від травми або стискання або є непрямим наслідком таких захворювань, як інфекція, рак, метаболічні порушення, токсини, недостатнє живлення, імунологічна дисфункція і м'язово-скелетні зміни. У цій моделі унілатеральна периферійна гіпералгезія у щурів створюється накладанням лігатури на нерв (G.J. Bennett et al., Pain 33, 87107 (1988)). Згідно з процедурою, щурів Sprague-Dawley (250-350г) анестезують пентобарбіталом натрію і оголяють спільний сідничний нерв на рівні середини стегна розрізом через biceps femoris. Частину нерва (прибл. 7мм) вивільняють від тканин і у чотирьох місцях з інтервалом 1мм накладають лігатуру хромовим кетгутом. Розріз закривають шарами і тварин залишають рекуперувати. Термальну гіпералгезію виміряють тестом на відсмикування лапи (К. Hargreaves et al., Pain 32, 77-88 (1988)). Перед проведенням тесту тварин призвичаюють до піднятої скляної підлоги. Тепловий промінь від джерела спрямовують на область сідничного нерва на задній лапі через скляну підлогу періодами 20с, щоб уникнути травмування шкіри. Латентності відсмикувального рефлекса у обох задніх лапах виміряють. Травмовані лапи з лігатурами нерва показують коротші латентності відсмикування лапи порівняно з нетравмованими лапами. Реакції на сполуки, що проходять тести, оцінювались у різні часи після орального введення для визначення початку і тривалості дії сполуки. При виконанні тесту групи щурів ССІ приймали носій або сполуку орально тричі на день протягом 5 днів. Латентності відсмикування лапи виміряли кожного дня за 10хвил. до і через 2 або 3год. після першої денної дози. Ефективність сполуки оцінювали як середнє зниження у %% гіпералгезії порівняно з контрольною групою тварин як 100 ´(середнє у контр. групі - середнє у групі сполук)/ (середнє у контр. групі) Аналіз даних був виконаний через тест порівняння множинних середніх (тест Дане-та) і його результати і потентності сполук були представлені як МЕД (мінімальна ефективна доза) у мг/кг/день, що визначає статистично значуще зниження (у %%) гіпералгезії. Табл. 1 містить результати тестів А, В і С для деяких сполук винаходу. Відсутність даних у табл. означає, що тест не проводили. Таблиця 1 Тест А Кі (нм) Експеримент 1 Експеримент 2 Експеримент 3 Експеримент 4 Експеримент 5 Тест В Перша фаза Доза (% інгібув.) Тест В Друга фаза Доза (% інгібув.) Тест С МЕД (% інгібув.) 79 99 146 44 371 70 (52%) 200 (74%) 70 (56%) 70 (57%) 200 (71%) 200 (46%) 30 (71%) 30 (59%) 30 (31%) 30 (44%) Експеримент 6 Експеримент 7 Експеримент 8 Експеримент 9 Експеримент 10 Експеримент 11 Експеримент 12 Експеримент 13 Експеримент 14 Експеримент 15 189 39 513 61 24 29 34 56 128 103 30 (64%) 15 (49%) 200 (56%) 200 (46%) 15 (49%) 30 (41%) 15 (-17%) 15 (17%) 15 (1%) 30 (26%)
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for the treatment of pain and a pharmaceutical composition
Назва патенту російськоюСпособ лечения от боли и фармацевтическая композиция
МПК / Мітки
МПК: A61K 31/5377, A61P 25/02, A61K 31/422, A61K 31/503, C07D 471/04, A61K 31/541, A61K 31/5025, A61K 31/427
Мітки: лікування, болю, композиція, спосіб, фармацевтична
Код посилання
<a href="https://ua.patents.su/13-73331-sposib-likuvannya-vid-bolyu-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Спосіб лікування від болю та фармацевтична композиція</a>
Попередній патент: Спосіб біологічного очищення стічної води
Наступний патент: Сполука, спосіб лікування від болю (варіанти) та фармацевтична композиція (варіанти)
Випадковий патент: Переносний пристрій для підйому і опускання деталей на контактній мережі при ремонтних роботах












