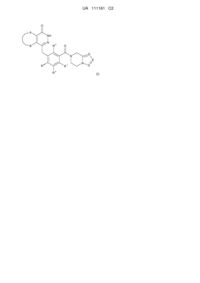
Похідна фталазинонкетону, спосіб її одержання та її фармацевтичне застосування
Номер патенту: 111161
Опубліковано: 11.04.2016
Автори: Чен Янг, Жу Же, Лі Ксянгквін, Ванг Бін, Танг Пенгчо, Лі Ксін
Формула / Реферат
1. Сполуки формули (І) або їх фармацевтично прийнятні солі:
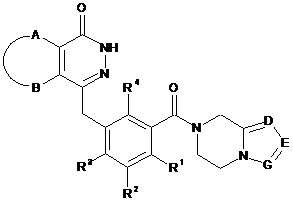 , (I)
, (I)
де:
А та В, взяті разом з приєднаними атомами вуглецю, утворюють циклоалкіл, гетероцикліл, арил або гетероарил, де згадані циклоалкіл, гетероцикліл, арил або гетероарил кожний незалежно і необов'язково заміщений однією або більше групами, вибраними з групи, що включає алкіл, галоген, гідрокси, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, -C(O)OR5, -OC(O)R5, -O(CH2)nC(O)OR5, -C(O)R5, -NHC(O)R5, -NR6R7, -OC(O)NR6R7 та -C(O)NR6R7;
R1, R2, R3 або R4 кожний незалежно вибраний з групи, що включає водень, галоген, алкіл, ціано та алкокси, де згадані алкіл або алкокси кожний незалежно і необов'язково заміщений однією або більше групами, вибраними з групи, що включає галоген, гідрокси, алкіл та алкокси;
D, Е або G кожний незалежно вибраний з групи, що включає атом азоту і C(R8);
R5 вибраний з групи, що включає водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де згадані алкіл, циклоалкіл, гетероцикліл, арил або гетероарил кожний незалежно і необов'язково заміщений однією або більше групами, вибраними з групи, що включає алкіл, галоген, гідрокси, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбокси та алкоксикарбоніл;
R6 або R7 кожний незалежно вибраний з групи, що включає водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де згадані алкіл, циклоалкіл, гетероцикліл, арил або гетероарил кожний незалежно і необов'язково заміщений однією або більше групами, вибраними з групи, що включає алкіл, галоген, гідрокси, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбокси та алкоксикарбоніл;
або, R6 і R7, взяті разом з приєднаним атомом N, утворюють гетероцикліл, де згаданий гетероцикліл містить один або більше N-, О- або S(O)m-гетероатомів і згаданий гетероцикліл необов'язково заміщений однією або більше групами, вибраними з групи, що включає алкіл, галоген, гідрокси, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбокси та алкоксикарбоніл;
R8 вибраний з групи, що включає водень, алкіл, галоген, гідрокси, ціано, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, бензил, -C(O)OR5, -OC(O)R5, O(CH2)nC(O)OR5, -(CH2)nNR6R7, -C(O)R5, -NHC(O)R5, -NR6R7, -OC(O)NR6R7 та -C(O)NR6R7, де згадані алкіл, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил або бензил кожний незалежно і необов'язково заміщений однією або більше групами, вибраними з групи, що включає алкіл, галоген, гідрокси, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, оксо, -C(O)OR5, -OC(O)R5, -O(CH2)nC(O)OR5, -C(O)R5, -NHC(O)R5, -NR6R7, -OC(O)NR6R7 та -C(O)NR6R7;
m вибраний з групи, що включає 0, 1 і 2; і
n вибраний з групи, що включає 0, 1 і 2.
2. Сполуки формули (І) або їх фармацевтично прийнятні солі за п. 1, де А та В, взяті разом з приєднаними атомами вуглецю, утворюють арил, переважним чином арил є фенілом.
3. Сполуки формули (І) або їх фармацевтично прийнятні солі за п. 1, де R1 є воднем.
4. Сполуки формули (I) або їх фармацевтично прийнятні солі за п. 1, де R1 є галогеном, переважно атомом фтору.
5. Сполуки формули (І) або їх фармацевтично прийнятні солі за п. 1, де R8 вибирають з групи, що включає водень, алкіл, галоген, ціано, -C(O)OR5, -(CH2)nNR6R7 та -C(O)NR6R7, де згаданий алкіл необов'язково заміщений одним або більше атомами галогену.
6. Сполуки або їх фармацевтично прийнятні солі за п. 5, де R8 є трифторметилом.
7. Сполуки формули (І) або їх фармацевтично прийнятні солі за п. 1, де кожен з R1, R2, R3 або R4 є незалежно воднем.
8. Сполуки формули (І) або їх фармацевтично прийнятні солі за п. 1, де кожен з R2, R3 або R4 є незалежно воднем, R1 є галогеном, переважно атомом фтору.
9. Сполуки формули (І) або їх фармацевтично прийнятні солі за будь-яким одним з пунктів 1-8, де сполуки вибирають з групи, що включає:
,
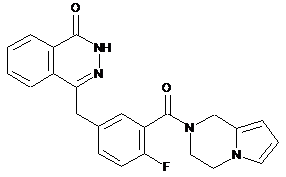 ,
,
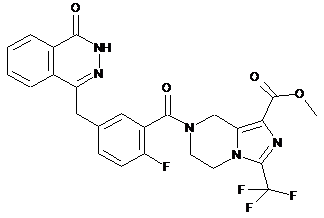 ,
,
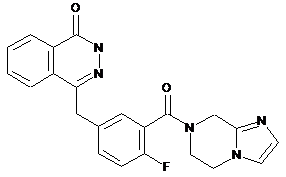 ,
,
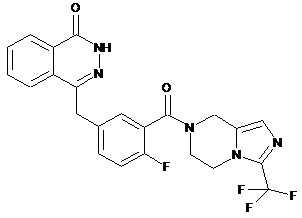 ,
,
 ,
,
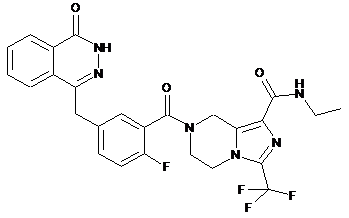 ,
,
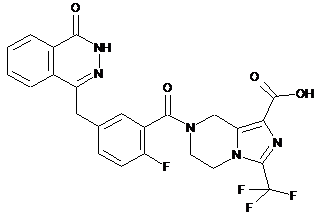 ,
,
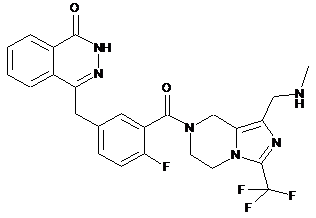 ,
,
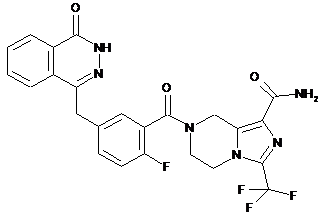 ,
,
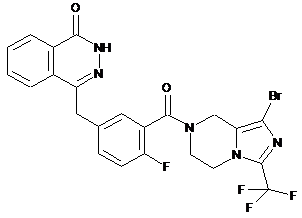 ,
,
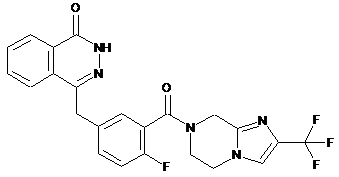 ,
,
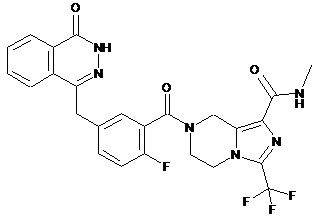 ,
,
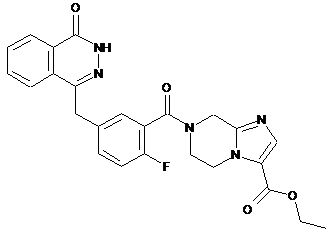 ,
,
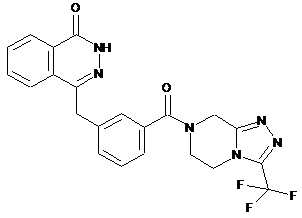 ,
,
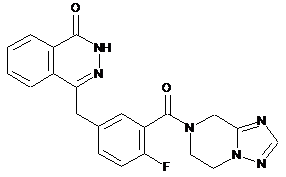 ,
,
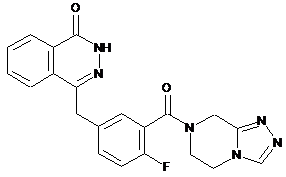 ,
,
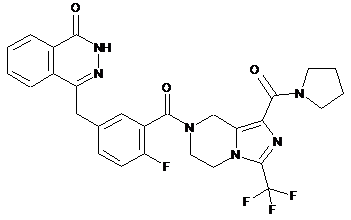 ,
,
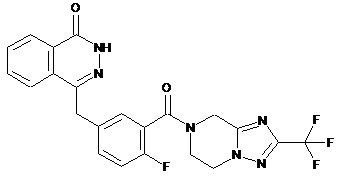 ,
,
 ,
,
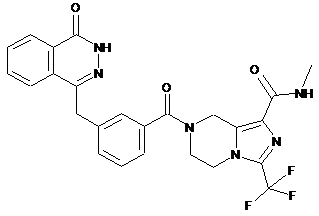 ,
,
 ,
,
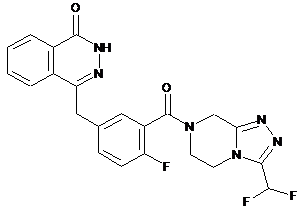 ,
,
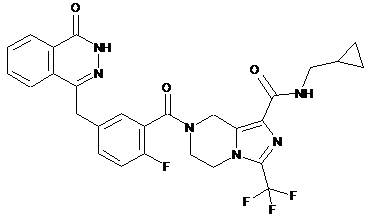 ,
,
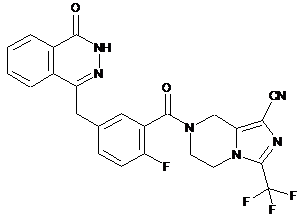
або 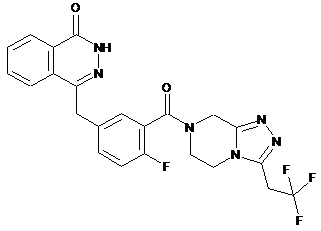 .
.
10. Спосіб одержання сполук формули (І) або їх фармацевтично прийнятних солей відповідно до пункту 1, де згаданий спосіб включає стадії:
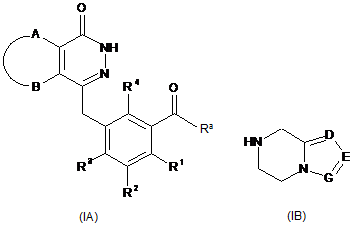
необов'язково гідроліз сполуки формули (ІА) з одержанням карбонової кислоти, взаємодію карбонової кислоти зі сполукою формули (IB) або її сіллю, одержуючи сполуку формули (І);
де:
Ra вибирають з групи, що включає галоген, гідрокси та алкокси;
А, В, D, Е, G і R1-R4 мають значення, як ті, що зазначені у пункті 1.
11. Фармацевтична композиція, що містить терапевтично ефективну кількість сполук формули (І) або їх фармацевтично прийнятних солей відповідно до будь-якого одного з пунктів 1-9 і фармацевтично прийнятний носій або ексципієнт.
12. Застосування сполук формули (І) або їх фармацевтично прийнятних солей відповідно до будь-якого одного з пунктів 1-9 або фармацевтичної композиції відповідно до пункту 11 в одержанні інгібітора ПАРП.
13. Спосіб інгібування ПАРП, що включає введення суб'єктові, який цього потребує, терапевтично ефективної кількості сполук формули (І) або їх фармацевтично прийнятних солей відповідно до будь-якого одного з пунктів 1-9 або фармацевтичної композиції відповідно до пункту 11.
14. Застосування сполук формули (І) або їх фармацевтично прийнятних солей відповідно до будь-якого одного з пунктів 1-9 або фармацевтичної композиції відповідно до пункту 11 в одержанні ад'юванту для лікування раку або медикаменту, що викликає чутливість пухлинних клітин до іонізуючого випромінювання або хіміотерапії.
15. Застосування сполук формули (І) або їх фармацевтично прийнятних солей відповідно до будь-якого одного з пунктів 1-9 або застосування фармацевтичної композиції відповідно до пункту 11 в одержанні медикаменту для лікування раку, де згаданий рак вибирають з групи, що включає рак молочної залози, рак яєчників, рак підшлункової залози, рак простати, ректальний рак, рак печінки та рак товстого кишечнику.
16. Спосіб лікування раку, який включає введення суб'єктові, який цього потребує, терапевтично ефективної кількості сполук формули (І) або їх фармацевтично прийнятних солей відповідно до будь-якого одного з пунктів 1-9 або фармацевтичної композиції відповідно до пункту 11.
17. Застосування за будь-яким одним з пунктів 12, 14 або 15, де медикамент додатково вводять сумісно з терапевтично ефективною кількістю лікарського препарату, який вибирають з групи, що включає темозоломід, адріаміцин, таксол, цисплатин, карбоплатин, дакарбазин, топотекан, іринотекан, гемцитабін та бевацизумаб.
Текст
Реферат: Похідна фталазинонкетону, що представлена формулою (І), спосіб її одержання, фармацевтична композиція, що містить похідну, її використання як інгібітора полі(АДФрибоза)полімерази (ПАРП) та спосіб лікування нею раку. UA 111161 C2 (12) UA 111161 C2 O A NH N B R 4 O D N R 3 R R 1 N E G 2 (I) UA 111161 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Представлений винахід стосується нової похідної фталазинонкетону, що представлена формулою (I), способів її одержання, фармацевтичної композиції, що містить похідну, та її застосування як терапевтичного агента, особливо як інгібітора полі (АДФ-рибоза) полімерази (ПАРП). Передумови створення винаходу Хіміотерапія і променева терапія являють собою стандартні способи лікування раку. Обидві терапії можуть викликати одноланцюжковий та/або дволанцюжковий розрив ДНК, викликаючи цитотоксичність, після чого, в результаті ушкодження хромосом, буде відбуватись загибель цільових пухлинних клітин. Важливим результатом у відповідь на сигнал ушкодження ДНК є активація сигналу клітинного циклу на сайті регуляції, спрямована на зупинення поділу клітин у випадку ушкодження ДНК, в результаті, запобігаючи ушкодженню клітин. У більшості випадків, пухлинні клітини проявляють порушення сигналу регуляції у клітинному циклі і мають високий ступінь проліферації. Таким чином, можна стверджувати, що пухлинні клітини мають специфічні відновлюючі ДНК механізми, які можуть швидко реагувати, відновлюючи ушкоджені хромосоми, що мають відношення до регуляції проліферації, таким чином, зберігаючи їх від цитотоксичної дії певного лікування, і підтримуючи їх живими. У клінічному застосуванні, ефективна концентрація хіміотерапевтичного препарату або інтенсивність терапевтичного опромінювання можуть діяти проти цих відновлюючих ДНК механізмів, забезпечуючи знищуючу дію на пухлинні клітини-мішені. Однак, пухлинні клітини можуть виробляти толерантність до лікування, підсиленням відновлюючих ушкоджену ДНК механізмів, і зберігаючи ДНК від летального ушкодження. Для подолання толерантності, як правило, необхідно підвищити дозування лікарського препарату або інтенсивність опромінювання. Такий підхід призведе до побічних ефектів відносно нормальних тканин, що знаходяться поблизу місця ураження, і таким чином ускладнить курс лікування серйозними побічними ефектами, таким чином, підвищуючи ризик лікування. Поряд з цим, постійно зростаюча толерантність буде знижувати терапевтичний ефект, таким чином можна зробити висновок, що цитотоксичні ушкоджуючі ДНК агенти можуть бути покращені через специфічність пухлинних клітин шляхом регулювання механізму відновлення, стимульованого сигналом ушкодженої ДНК. ПАРПи (Полі (АДФ-рибоза)полімерази), що характеризуються полі АДФ-рибозилювальною активністю, складаються з суперродини 18 ядерних і цитоплазматичних ферментів. Такий полі АДФ-рибозилювальний ефект може коригувати активність цільового білку і взаємодію між білками, та регулювати багато інших найважливіших біологічних процесів, включаючи відновлення ДНК та загибель клітин. На додаток, геномна стабільність також пов'язана з полі АДФ-рибозилюванням (дивіться D`Amours et al. Biochem. J, 1999, 342, 249). Активність ПАРП-1 складає приблизно 80 % від загальної клітинної активності ПАРП (PARP). ПАРП-1, разом з ПАРП-2, що є найбільш подібною до ПАРП-1, належать до членів, що мають здатність до відновлювання ушкодженої ДНК в родині ПАРП. Як сенсор і сигнальний білок ушкодженої ДНК, ПАРП-1 може швидко виявляти місця ушкодження ДНК і безпосередньо з ними зв'язуватись, і потім індукувати агрегацію різноманітних білків, необхідних для відновлення ДНК, таким чином, забезпечуючи можливість ушкодженій ДНК відновитись. Якщо клітини позбавлені ПАРП-1, то замість ПАРП-1, відновлення ушкодженої ДНК може здійснити ПАРП-2. Дослідження продемонстрували, що у порівнянні з нормальними клітинами, експресія білка ПАРП у солідних пухлинах, як правило, є підвищеною. Крім того, пухлини (такі як рак молочної залози і рак яєчників), в яких відсутній ген, який стосується відновлення ДНК (такий як BRCA-1 або BRCA-2), демонструють надзвичайну чутливість по відношенню до інгібіторів ПАРП-1. Це вказує на потенційне використання інгібіторів ПАРП як окремого агента при лікуванні пухлини, яка може бути названа тричі негативним раком молочної залози (дивіться Plummer, E. R. Curr. Opin. Pharmacol. 2006, 6, 364; Ratnam, et al; Clin. Cancer Res. 2007, 13, 1383). Поряд з цим, оскільки механізм відновлення ушкодженої ДНК є важливим механізмом відповіді клітинних пухлин на толерантність, продуковану лікуванням хіміотерапевтичними препаратами та іонізуючого випромінювання, вважають, що ПАРП-1 є ефективною мішенню для дослідження нових способів терапії проти раку. + Інгібітори ПАРП раніше розробили і сконструювали, використовуючи нікотинамід NAD , що може використовуватись як каталітичний субстрат ПАРП, як матрицю для розробки їх аналогів. + + Як конкуруючі інгібітори NAD , ці інгібітори конкурують з NAD за каталітичні сайти ПАРП, таким чином, запобігаючи синтезу ланцюга полі (АДФ-рибози). ПАРП з відсутністю полі (АДФрибоз)илювальної модифікації не може бути відщеплена від місць ушкодження ДНК, що 1 UA 111161 C2 5 10 15 20 25 30 приведе до того, що інші білки, залучені у відновлення, не зможуть приєднатись до місця ушкодження, таким чином, запобігаючи здійсненню процесу відновлення. Таким чином, при дії цитотоксичних препаратів або опромінювання, інгібітор ПАРП, в результаті, знищить пухлинні клітини з ушкодженою ДНК. + Крім того, NAD , який використовується як каталітичний субстрат ПАРП, є суттєвим фактором у процесі синтезу АТФ клітин. При високому рівні активності ПАРП, + внутрішньоклітинні рівні NAD будуть значно зменшуватись, таким чином, діючи на внутрішньоклітинний рівень АТФ. Через відсутність внутрішньоклітинного вмісту АТФ, клітини не можуть здійснити процес запрограмованої АТФ-залежної клітинної загибелі, а може відбутися тільки некроз, специфічний процес апоптозу. Протягом некрозу, багато з запалювальних цитокинів будуть вивільнені, таким чином, продукуючи токсичну дію на органи і тканини (Horvath EM et al. Drug News Perspect, 2007, 20, 171-181). Таким чином, інгібітори ПАРП можуть також використовуватись для лікування різноманітних захворювань, обумовлених цим механізмом, включаючи нейродегенеративні захворювання (такі як хвороба Альцгеймера, хвороба Хантінгтона, хвороба Паркінсона), діабет, конкуруючі захворювання при ішемії або ішемічнореперфузійному процесі, такі як інфаркт міокарда і гостра ниркова недостатність, хвороби системи кровообігу, такі як септичний шок та запальні захворювання, такі як хронічний ревматизм і т. д. (дивіться Tentori L, et al. Pharmacol. Res., 2002, 45, 73-85; Horvath EM et al. Drug News Perspect., 2007, 20, 171.; Faro R, et al. Ann. Thorac. Surg., 2002, 73, 575.; Kumaran D, et al. Brain Res., 2008,192, 178.) Насьогодні, існують серії патентних заявок, що розкривають фталазинонкетон, інгібітор ПАРП, включаючи WO2002036576, WO2004080976 та WO2006021801. Хоча, ряд інгібіторів ПАРП для лікування пухлин розкритий, до сих пір існує потреба у розробці нових сполук з кращою ефективністю та фармакокинетичними результатами. Після тривалих зусиль, у представленому винаході створено ряд сполук формули (I) і знайдено, що сполука, що має таку структуру, демонструє надзвичайну ефективність та фунціональність. Скорочений опис винаходу Представлений винахід спрямований на забезпечення похідних фталазинонкетону формули (I) і таутомерів, енантіомеру, діастереомерів, рацематів та їх фармацевтично прийнятних солей, також як їх метаболітів, метаболічного прекурсору або проліків: O A NH N B R 4 O D N R 3 R R 1 N E G 2 (I) 35 40 45 50 де: A та B, взяті разом з приєднаними атомами вуглецю, утворюють циклоалкіл, гетероцикліл, арил або гетероарил, де згадані циклоалкіл, гетероцикліл, арил або гетеро арил, кожний незалежно і необов'язково заміщений однією або більше групами, вибраними з групи, що включає алкіл, галоген, гідрокси, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, 5 5 5 5 5 6 7 6 7 6 7 C(O)OR , -OC(O)R , -O(CH2)nC(O)OR , -C(O)R , -NHC(O)R , -NR R , -OC(O)NR R та -C(O)NR R ; 1 2 3 4 R , R , R або R кожний, незалежно вибраний з групи, що включає водень, галоген, алкіл, ціано та алкокси, де згадані алкіл або алкокси, кожний незалежно і необов'язково заміщений однією або більше групами, вибраними з групи, що включає галоген, гідрокси, алкіл та алкокси; 8 D, E або G кожний, незалежно вибраний з групи, що включає атом азоту і C(R ); 5 R вибраний з групи, що включає водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де згадані алкіл, циклоалкіл, гетероцикліл, арил або гетероарил, кожний незалежно і необов'язково заміщений однією або більше групами, вибраними з групи, що включає алкіл, галоген, гідрокси, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбокси та алкоксикарбоніл; 6 7 R або R кожний, незалежно вибраний з групи, що включає водень, алкіл, циклоалкіл, гетероцикліл, арил і гетероарил, де згадані алкіл, циклоалкіл, гетероцикліл, арил або гетероарил, кожний незалежно і необов'язково заміщений однією або більше групами, 2 UA 111161 C2 5 10 15 20 25 30 35 40 вибраними з групи, що включає алкіл, галоген, гідрокси, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбокси та алкоксикарбоніл; 6 7 або R і R , взяті разом з приєднаним атомом N, утворюють гетероцикліл, де згаданий гетероцикліл містить один або більше N, O або S(O) m гетероатомів, і згаданий гетероцикліл необов'язково заміщений однією або більше групами, вибраними з групи, що включає алкіл, галоген, гідрокси, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил, карбокси та алкоксикарбоніл; 8 R вибраний з групи, що включає водень, алкіл, галоген, гідрокси, ціано, алкокси, циклоалкіл, 5 5 5 6 7 гетероцикліл, арил, гетероарил, бензил, -C(O)OR , -OC(O)R , -O(CH2)nC(O)OR , -(CH2)nNR R , 5 5 6 7 6 7 6 7 C(O)R , -NHC(O)R , -NR R , -OC(O)NR R та -C(O)NR R , де згадані алкіл, алкокси, циклоалкіл, гетероцикліл, арил, гетероарил або бензил, кожний, незалежно і необов'язково заміщений однією або більше групами, вибраними з групи, що включає алкіл, галоген, гідрокси, алкокси, 5 5 5 циклоалкіл, гетероцикліл, арил, гетероарил, оксо, -C(O)OR , -OC(O)R , -O(CH2)nC(O)OR , 5 5 6 7 6 7 6 7 C(O)R , -NHC(O)R , -NR R , -OC(O)NR R та -C(O)NR R ; m вибраний з групи, що включає 0, 1 і 2; і n вибраний з групи, що включає 0, 1 і 2. У переважному втіленні винаходу, сполука формули (I) або її фармацевтично прийнятна сіль, де A і B взяті разом з приєднаними атомами вуглецю, утворюють арил, переважним чином згаданий арил є фенілом. 1 Переважно, сполуки формули (I) або її фармацевтично прийнятної солі, де R є воднем. 1 Переважно, сполуки формули (I) або її фармацевтично прийнятної солі, де R є галогеном, переважно атомом фтору. 1 Переважно, сполуки формули (I) або її фармацевтично прийнятної солі, де R є галогеном, переважно атомом фтору. 1 2 3 4 Переважно, сполуки формули (I) або її фармацевтично прийнятної солі, де R , R , R або R кожний, незалежно вибраний з атому водню. 8 Переважно, сполуки формули (I) або її фармацевтично прийнятної солі, де R вибраний з 5 6 7 6 7 групи, що включає водень, алкіл, галоген, ціано, -C(O)OR , -(CH2)nNR R та -C(O)NR R , де згаданий алкіл необов'язково заміщений одним або більше атомів галогенів. 8 Переважно, сполуки формули (I) або її фармацевтично прийнятної солі, де R є трифторметилом. Сполука формули (I) може містить асиметричні атоми вуглецю, таким чином вона може існувати у формі оптично чистого діастереомеру, діастереомерної суміші, діастереомерного рацемату, суміші діастереомерного рацемату або як мезо-сполука. Представлений винахід включає всі ці форми. Діастереомерна суміш, діастереомерний рацемат або суміш діастереомерного рацемату можуть бути розділені за допомогою стандартних способів, таких як колоночна хроматографія, тонкошарова хроматографія та високо ефективна рідинна хроматографія. В той же час для фахівця даної галузі буде зрозуміло, що сполука формули (I) може також мати таутомери. Таутомерні форми сполуки (I) включають, але не обмежені структурою, представленою наступною формулою (II): OH A N N B R 4 O N R 3 R R 1 D N G 2 ( II ) 45 Сполуки винаходу включають, але не обмежені наступними: 3 E UA 111161 C2 Приклад № Структура і Найменування O NH N O N N 1 N N F F F F 4-[[4-фтор-3-[3-(трифторметил)-6,8-дигідро-5H-[1,2,4]триазолo[4,3-a] карбоніл]феніл]метил]-2H-фталазин-1-он піразин-7 O NH N O 2 N N F 4-[[3-(3,4-дигідро-1H-піролo[1,2-a]піразин-2-карбоніл)-4-фторфеніл]метил]-2Hфталазин-1-он O NH N O O N 3 N N F O F F F метил 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)6,8-дигідро-5H-імідазо[1,5-a]піразин-1-карбоксилат O N N O 4 N N N F 4-[[3-(6,8-дигідро-5H-імідазо[1,2-a]піразин-7-карбоніл)-4-фторфеніл]метил]-2Hфталазин-1-он O NH N O N 5 N N F F F F 4-[[4-фтор-3-[3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он O NH N 6 O OH N F N F F N F 4-[[4-фтор-3-[1-(гідроксиметил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5a]піразин-7-карбоніл]феніл]метил]-2H-фталазин-1-он 4 UA 111161 C2 Приклад № Структура і Найменування O NH N N 7 H N O O N N F F F F N-етил-7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)6,8-дигідро-5H-імідазо[1,5-a]піразин-1-карбоксамід O NH N O O OH N 8 N N F F F F 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8дигідро-5H-імідазо[1,5-a]піразин-1-карбонова кислота O NH N O N H N 9 N N F F F F 4-[[4-фтор-3-[1-(метиламінометил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5a]піразин-7-карбоніл]феніл]метил]-2H-фталазин-1-он O NH N O O N 10 N N F NH2 F F F 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8дигідро-5H-імідазо[1,5-a]піразин-1-карбоксамід O NH N O Br N 11 N N F F F F 4-[[3-[1-бром-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоніл]4-фторфеніл]метил]-2H-фталазин-1-он O NH N O 12 N N F N F F F 4-[[4-фтор-3-[2-(трифторметил)-6,8-дигідро-5H-імідазо[1,2-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он 5 UA 111161 C2 Приклад № Структура і Найменування O NH N O O N H N 13 N N F F F F 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-N-метил-3(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-1-карбоксамід O NH N O N N 14 N F O O етил 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-6,8-дигідро-5Hімідазо[1,2-a]піразин-3-карбоксилат O NH N O N N 15 N N F F F 4-[[3-[3-(трифторметил)-6,8-дигідро-5H-[1,2,4]триазолo[4,3-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он O NH N O 16 N N N N F 4-[[3-(6,8-дигідро-5H-[1,2,4]триазолo[1,5-a]піразин-7-карбоніл)-4фторфеніл]метил]-2H-фталазин-1-он O NH N O 17 N N N N F 4-[[3-(6,8-дигідро-5H-[1,2,4]триазолo[4,3-a]піразин-7-карбоніл)-4фторфеніл]метил]-2H-фталазин-1-он O NH N O O N 18 F N N N F F F 4-[[4-фтор-3-[1-(піролідин-1-карбоніл)-3-(трифторметил)-6,8-дигідро-5Hімідазо[1,5-a]піразин-7-карбоніл]феніл]метил]-2H-фталазин-1-он 6 UA 111161 C2 Приклад № Структура і Найменування O NH N O 19 N F N N F N F F 4-[[4-фтор-3-[2-(трифторметил)-6,8-дигідро-5H-[1,2,4]триазолo[1,5-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он O NH N O O N 20 N N F O N F F F 4-[[4-фтор-3-[1-(морфолін-4-карбоніл)-3-(трифторметил)-6,8-дигідро-5Hімідазо[1,5-a]піразин-7-карбоніл]феніл]метил]-2H-фталазин-1-он O NH N O O NH N 21 N N F F F N-метил-7-[3-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8дигідро-5H-імідазо[1,5-a]піразин-1-карбоксамід O NH N O O N 22 N N F N F F F 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-N, N-диметил(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-1-карбоксамід 3 O NH N O N N 23 N N F F F 4-[[3-[3-(дифторметил)-6,8-дигідро-5H-[1,2,4]триазолo[4,3-a]піразин-7-карбоніл]4-фторфеніл]метил]-2H-фталазин-1-он O NH N O O N 24 F N NH N F F F N-(циклопропілметил)-7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-1-карбоксамід 7 UA 111161 C2 Приклад № Структура і Найменування O NH N O CN N 25 N N F F F F 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8дигідро-5H-імідазо[1,5-a]піразин-1-карбонітрил O NH N 26 O N N N N F F F F 4-[[4-фтор-3-[3-(2,2,2-трифторетил)-6,8-дигідро-5H-[1,2,4]триазолo[4,3-a]піразин7-карбоніл]феніл]метил]-2H-фталазин-1-он або їх фармацевтично прийнятні солі. Даний винахід стосується способу одержання сполуки формули (I) або її фармацевтично прийнятної солі, що включає стадії: 5 O A NH N B R 4 O R a D HN R 3 R R 15 20 25 N 2 E G (IB) ( IA ) 10 1 необов'язковий гідроліз сполуки формули (IA) до карбонової кислоти, взаємодію карбонової кислоти з сполукою формули (IB) або її сіллю у присутності конденсувального агента, такого як гексафторфосфат бензотриазол-N, N, N', N'-тетраметилуронію за умов лужного середовища, одержуючи сполуку формули (I); де: a R вибирають з групи, що включає гідрокси, галоген та алкокси; 1 4 A, B, Д, E, G та R -R мають ті ж самі значення, як у формулі (I). В іншому аспекті, даний представлений винахід стосується використання сполук формули (I) або їх фармацевтично прийнятних солей в одержанні інгібіторів ПАРП. В іншому аспекті, даний представлений винахід стосується способу інгібування ПАРП, який включає введення суб'єктові, який цього потребує, терапевтично ефективної кількості сполук формули (I) або їх фармацевтично прийнятних солей. В іншому аспекті, даний представлений винахід стосується використання сполук формули (I) або їх фармацевтично прийнятних солей в одержанні а'дюванта при лікуванні раку або медикаменту, що викликає чутливість пухлинних клітин до іонізуючого випромінювання або хіміотерапії. В іншому аспекті, даний представлений винахід стосується сполук формули (I) або їх фармацевтично прийнятних солей, для використання як ад'юванта при лікуванні раку або викликання чутливості пухлинних клітин до іонізуючого випромінювання або хіміотерапії. В іншому аспекті, даний представлений винахід стосується сполук формули (I) або їх фармацевтично прийнятних солей, для використання як інгібіторів ПАРП. 8 UA 111161 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому аспекті, даний представлений винахід стосується використання сполук формули (I) або їх фармацевтично прийнятних солей в одержання медикаменту для лікування раку, де згаданий рак вибирають з групи, що включає рак молочної залози, рак яєчників, рак підшлункової залози, рак простати, рак печінки та рак товстого кишечнику, де згаданий медикамент додатково вводять сумісно з терапевтично ефективною кількістю лікарського препарату, вибраного з групи, що включає темозоломід, адріаміцин, таксол, цисплатин, карбоплатин, дакарбазин, топотекан, іринотекан, гемцитабін та бевацизумаб. В іншому аспекті, даний представлений винахід стосується способів лікування раку, що включає введення суб'єктові, який цього потребує, терапевтично ефективної кількості сполук формули (I) або їх фармацевтично прийнятних солей, де згаданий рак вибирають з групи, що включає рак молочної залози, рак яєчників, рак підшлункової залози, рак простати, рак печінки та рак товстого кишечнику, де згадану сполуку формули (I) або її фармацевтично прийнятну сіль додатково вводять сумісно з терапевтично ефективною кількістю лікарського препарату, вибраного з групи, що включає темозоломід, адріаміцин, таксол, цисплатин, карбоплатин, дакарбазин, топотекан, іринотекан, гемцитабін та бевацизумаб. В іншому аспекті, даний представлений винахід стосується сполук формули (I) або їх фармацевтично прийнятних солей, для використання як медикаменту для лікування раку, де згаданий рак вибирають з групи, що включає рак молочної залози, рак яєчників, рак підшлункової залози, рак простати, рак печінки та рак товстого кишечнику, де згаданий медикамент додатково вводять сумісно з терапевтично ефективною кількістю лікарського препарату, вибраного з групи, що включає темозоломід, адріаміцин, таксол, цисплатин, карбоплатин, дакарбазин, топотекан, іринотекан, гемцитабін та бевацизумаб. Крім того, представлений винахід також стосується фармацевтичної композиції, що містить терапевтично ефективну кількість сполук формули (I) або їх фармацевтично прийнятних солей відповідно до представленого винаходу, та фармацевтично прийнятний носій або ексціпієнт. Також представлений винахід стосується згаданої фармацевтичної композиції для використання як інгібітора ПАРП або як ад'юванта в лікуванні раку, або медикаменту, що викликає чутливість пухлинних клітин до іонізуючого випромінювання або хіміотерапії, або як медикаменту для лікування раку. Також представлений винахід стосується використання згаданої фармацевтичної композиції в одержанні інгібітора ПАРП. Також представлений винахід стосується використання згаданої фармацевтичної композиції в одержанні ад'юванта в лікуванні раку або медикаменту, що викликає чутливість пухлинних клітин до іонізуючого випромінювання або хіміотерапії. Також представлений винахід стосується використання згаданої фармацевтичної композиції в одержання медикаменту для лікування раку, де згаданий рак вибирають з групи, що включає рак молочної залози, рак яєчників, рак підшлункової залози, рак простати, рак печінки та рак товстого кишечнику, де згадану фармацевтичну композицію вводять додатково сумісно з терапевтично ефективною кількістю лікарського препарату, вибраного з групи, що включає темозоломід, адріаміцин, таксол, цисплатин, карбоплатин, дакарбазин, топотекан, іринотекан, гемцитабін та бевацизумаб. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ Якщо не встановлено інше, використовувані в описі та формулі винаходу терміни мають значення, наведені нижче. Термін "алкіл" стосується насиченої аліфатичної вуглеводневої групи, що включає нерозгалужені і розгалужені групи з 1-20 атомами вуглецю. Переважно, алкільна група є алкілом, що має 1-12 атомів вуглецю. Типові приклади включають, але не обмежуються ними, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, втор-бутил, н-пентил, 1,1диметилпропіл, 1,2-диметилпропіл, 2,2-диметилпропіл, 1-етилпропіл, 2-метилбутил, 3метилбутил, н-гексил, 1-етил-2-метилпропіл, 1,1,2-триметилпропіл, 1,1-диметилбутил, 1,2диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-етилбутил, 2-метилпентил, 3метилпентил, 4-метилпентил, 2,3-диметилбутил, н-гептил, 2-метилгексил, 3-метилгексил, 4метилгексил, 5-метилгексил, 2,3-диметилпентил, 2,4-диметилпентил, 2,2-диметилпентил, 3,3диметилпентил, 2-етилпентил, 3-етилпентил, н-октил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилгексил, 3,3-диметилгексил, 4,4-диметилгексил, 2-етилгексил, 3етилгексил, 4-етилгексил, 2-метил-2-етилпентил, 2-метил-3-етилпентил, н-ноніл, 2-метил-2етилгексил, 2-метил-3-етилгексил, 2,2-діетилпентил, н-децил, 3,3-діетилгексил, 2,2-діетилгексил та їх ізомери з розгалуженим ланцюгом. Більш переважно алкільна група єнижчим алкілом, що має 1-6 атомів вуглецю. Типові приклади включають, але не обмежуються ними, метил, етил, нпропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметилпропіл, 1,2диметилпропіл, 2,2-диметилпропіл, 1-етилпропіл, 2-метилбутил, 3-метилбутил, н-гексил, 1-етил2-метилпропіл, 1,1,2-триметилпропіл, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 9 UA 111161 C2 5 10 15 20 25 1,3-диметилбутил, 2-етилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3диметилбутил і т. д… Алкільна група може бути заміщеною або незаміщеною. Коли заміщена, група(и)-замісник(и) може бути заміщена у будь-якій доступній точці приєднання, переважно група(и)-замісник(и) є однією або більше групами незалежно вибраними з групи, що включає алкіл, алкеніл, алкініл, алкоксил, алкілсульфо, алкіламіно, галоген, тіол, гідрокси, нітро, ціано, циклоалкіл, гетероциклічний алкіл, арил, гетероарил, циклоалкоксил, гетероциклоалкоксил, 5 5 5 5 циклоалкілтіо, гетероциклоалкілтіо, оксо, -C(O)OR , -OC(O)R , -O(CH2)nC(O)OR , -C(O)R , 5 6 7 6 7 6 7 NHC(O)R , -NR R , -OC(O)NR R та -C(O)NR R . Термін "циклоалкіл" стосується насиченої та/або частково ненасиченої моноциклічної або поліциклічної вуглеводневої групи і має 3-20 атомів вуглецю, переважно 3-12 атомів вуглецю, більш переважно 3-10 атомів вуглецю. Типові приклади моноциклічного циклоалкілу включають, але не обмежуються ними, циклопропіл, циклобутил, циклопентил, циклопентеніл, циклогексил, циклогексеніл, циклогексадієніл, циклогептил, циклогептатриєніл, циклооктил і т. д… Поліциклічний циклоалкіл включає циклоалкіл, що має спірокільце, конденсоване кільце та містковане кільце. Термін "спіроциклоалкіл" стосується 5-20 членної поліциклічної групи з кільцями, приєднаними через один спільний атом вуглецю (названий як спіроатом), де одне або більше кілець можуть містити один або більше подвійних зв'язків, але жодне з кілець не має повністю кон'югованої π-електронної системи. Переважно спіроциклоалкіл є 6-14 членним, більш переважно 7-10 членним. Відповідно до кількості спільних спіроатомів, спіроциклоалкіл поділяється на моно-спіроциклічне кільце, ди-спіроциклічне кільце або полі-спіроциклічне кільце, переважно стосується моно-спіроциклічного кільця або ди-спіроциклічного кільця. Більш переважно спіроциклоалкіл є 4-членним/4-членним, 4-членним/5-членним, 4-членним/6членним, 5-членним/5-членним, або 5-членним/6-членним моноциклічним спірокільцем. Типові приклади спіроциклоалкілу включають, але не обмежуються ними, наступні групи: та 30 35 . Термін "конденсований циклоалкіл" стосується 5-20 членних поліциклічних вуглеводневих груп, де кожне кільце в системі поділяє сусідню пару атомів вуглецю з іншим кільцем, де одне або більше кілець можуть містити один або більше подвійних зв'язків, але жодне з кілець не має повністю кон'югованої π-електронної системи. Переважно конденсована циклоалкільна група є 6-14 членною, більш переважно 7-10 членною. Відповідно до кількості членів у кільці, конденсований циклоалкіл поділяється на біциклічний, трициклічний, тетрациклічний або поліциклічний конденсований циклоалкіл, переважно є біциклічним або трициклічним конденсованим циклоалкілом. Більш переважно конденсований циклоалкіл є 5-членним/5членним або 5-членним/6-членним біциклічним конденсованим циклоалкілом. Типові приклади конденсованого циклоалкілу включають, але не обмежуються ними, наступні групи: та . 40 45 Термін "місткований циклоалкіл" стосується 5-20 членної поліциклічної вуглеводневої групи, де кожні два кільця в системі поділяють два не зв'язувальні атоми вуглецю. Згадані кільця можуть мати один або більше подвійних зв'язків, але не мають повністю кон'югованої πелектронної системи. Переважно місткований циклоалкіл є 6-14 членним, більш переважно 7-10 членним. Відповідно до кількості членів у кільці, місткований циклоалкіл поділяється на місткований біциклічний, трициклічний, тетрациклічний або поліциклічний, переважно біциклічниий, трициклічний або тетрациклічний місткований циклоалкіл, більш переважно 10 UA 111161 C2 біциклічний або трициклічний місткований циклоалкіл. Типові циклоалкілу включають, але не обмежуються ними, наступні групи: та приклади місткованого . 5 10 15 20 25 30 35 40 45 Згаданий циклоалкіл може бути приконденсованим до кільця арилу, гетероарилу або гетероциклічного алкілу, де кільце, приєднане до батьківської структури, є циклоалкілом. Типові приклади включають, але не обмежуються ними, інданіл, тетрагідронафталін, бензоциклогептил і т. д… Згаданий циклоалкіл може бути необов'язково заміщеним або незаміщеним. Коли заміщений, то група(и)-замісник(и) є переважно однією або більше групами, незалежно вибраними з групи, що включає алкіл, алкеніл, алкініл, алкоксил, алкілсульфо, алкіламіно, галоген, тіол, гідрокси, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, 5 циклоалкоксил, гетероциклоалкоксил, циклоалкілтіо, гетероциклоалкілтіо, оксо, -C(O)OR , 5 5 5 5 6 7 6 7 6 7 OC(O)R , -O(CH2)nC(O)OR , -C(O)R , -NHC(O)R , -NR R , -OC(O)NR R та -C(O)NR R . Термін "алкеніл" стосується алкілу, як зазначено вище, що має щонайменше 2 атоми вуглецю і щонайменше один вуглець-вуглецевий подвійний зв'язок. Наприклад, вініл, 1пропеніл, 2-пропеніл, 1-, 2- або 3-бутеніл і т. д… Алкенільна група може бути заміщеною або незаміщеною. Коли заміщена, то група(и)-замісник(и) є переважно однією або більше групами, незалежно вибраними з групи, що включає алкіл, алкеніл, алкініл, алкоксил, алкілсульфо, алкіламіно, галоген, тіол, гідрокси, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, 5 5 циклоалкоксил, гетероциклоалкоксил, циклоалкілтіо, гетероциклоалкілтіо, -C(O)OR , -OC(O)R , 5 5 5 6 7 6 7 6 7 O(CH2)nC(O)OR , -C(O)R , -NHC(O)R , -NR R , -OC(O)NR R та -C(O)NR R . Термін "алкініл" стосується алкілу, як визначено вище, що має щонайменше два атоми вуглецю і щонайменше один вуглець-вуглецевий потрійний зв'язок. Наприклад, етиніл, 1пропініл, 2-пропініл, 1-, 2- або 3-бутиніл і т. д… Алкінільна група може бути заміщеною або незаміщеною. Коли заміщена, то група(и)-замісник(и) є переважно однією або більше групами, незалежно вибраними з групи, що включає алкіл, алкеніл, алкініл, алкоксил, алкілсульфо, алкіламіно, галоген, тіол, гідрокси, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, 5 5 циклоалкоксил, гетероциклоалкоксил, циклоалкілтіо, гетероциклоалкілтіо, -C(O)OR , -OC(O)R , 5 5 5 6 7 6 7 6 7 O(CH2)nC(O)OR , -C(O)R , -NHC(O)R , -NR R , -OC(O)NR R та -C(O)NR R . Термін "гетероцикліл" стосується 3-20 членної насиченої та/або частково ненасиченої моноциклічної або поліциклічної вуглеводневої групи, що має один або більше гетероатомів, вибраних з групи, що включає N, O, або S(O)m (де m дорівнює 0, 1 або 2) як атоми кільця, за винятком -O-O-, -O-S- або -S-S- в кільці, атоми кільця, що залишились є C. Переважно, гетероцикліл є 3-12 членним, що має 1 – 4 згаданих гетероатомів; більш переважно 3-10 членним. Типові приклади моноциклічного гетероциклілу включають, але не обмежуються ними, піролiдил, піперидил, піперазиніл, морфолініл, сульфоморфолініл, гомопіперазиніл і т. д… Поліциклічний гетероцикліл включає гетероцикліл, що має спірокільце, конденсоване кільце та містковане кільце. "Спірогетероцикліл" стосується 5-20 членного поліциклічного гетероциклілу з кільцями, зв'язаними через один спільний атом вуглецю (названий як спіроатом), де згадані кільця мають один або більше гетероатомів, вибраних з групи, що включає N, O, і S(O)p (де p дорівнює 0,1 або 2) як атоми кільця, атоми кільця, що залишились є C, де одне або більше кілець можуть містити один або більше подвійних зв'язків, але жодне з кілець не має повністю кон'югованої π-електронної системи. Переважно спірогетероцикліл є 6-14 членним, більш переважно 7-10 членним. Відповідно до кількості спільних спіроатомів, спірогетероцикліл поділяється на моно-спірогетероцикліл, ди-спірогетероцикліл або полі-спірогетероцикліл, переважно є моно-спірогетероциклілом і ди-спірогетероциклілом. Більш переважно спірогетероцикліл є 4-членним/4-членним, 4-членним/5-членним, 4-членним/6-членним, 5 11 UA 111161 C2 членним/5-членним або 5-членним/6-членним моно-спірогетероциклілом. Типові приклади спірогетероциклілу включають, але не обмежуються ними, наступні групи: N N N N S O O N H . та O 5 10 15 Термін "конденсований гетероцикліл" стосується 5-20 членного поліциклічного гетероциклілу, де кожне кільце в системі поділяє сусідню пару атомів вуглецю з іншим кільцем, де одне або більше кілець можуть містити один або більше подвійних зв'язків, але жодне з кілець не має повністю кон'югованої π-електронної системи, і де згадані кільця мають один або більше гетероатомів, вибраних з групи, що включає N, O, і S(O) p (де p дорівнює 0, 1 або 2) як атоми кільця, атоми кільця, що залишились є C. Переважно конденсований гетероцикліл є 6-14 членним, більш переважно 7-10 членним. Відповідно до кількості членів у кільці, конденсований гетероцикліл поділяється на біциклічниий, трициклічний, тетрациклічний або поліциклічний конденсований гетероцикліл, переважно стосується біциклічного або трициклічного конденсованого гетероциклілу. Більш переважно конденсований гетероцикліл є 5-членним/5членним або 5-членним/6-членним біциклічним конденсованим гетероциклілом. Типові приклади конденсованого гетероциклілу включають, але не обмежуються ними, наступні групи: O N H O N H N N N N N N N 30 N та O . Термін "місткований гетероцикліл" стосується 5-14 членної поліциклічної гетероциклоалкільної групи, де кожні два кільця в системі, поділяють два не зв'язувальні атоми, згадані кільця можуть мати один або більше подвійних зв'язків, але не мають повністю кон'югованої π-електронної системи, і згадані кільця мають один або більше гетеро атомів, вибраних з групи, що включає N, O, і S (O) m (де m дорівнює 0, 1 або 2) як атоми кільця, атоми кільця, що залишились є C. Переважно, місткований гетероцикліл є 6-14 членним, більш переважно 7-10 членним. Відповідно до кількості членів у кільці, місткований гетероцикліл поділяється на біциклічний, трициклічний, тетрациклічний або поліциклічний місткований гетероцикліл, переважно стосується біциклічного, трициклічного або тетрациклічного місткованого гетероциклілу, більш переважно біциклічного або трициклічного місткованого гетероциклілу. Типові приклади місткованого гетероциклілу включають, але не обмежуються ними, наступні групи: N N H N N N 35 N O 20 25 N N N та N . Згадане кільце гетероциклілу може бути приконденсованим до кільця арилу, гетероарилу або циклоалкілу, де кільце, зв'язане з батьківською структурою є гетероциклілом. Типові приклади включають, але не обмежуються ними, наступні групи: 12 UA 111161 C2 H N 5 10 15 H N H N O O O N N N H N N 30 N H N H N O N O 25 , і т.д. Гетероцикліл може бути необов'язково заміщеним або незаміщеним. Коли заміщений, то група(и)-замісник(и) є переважно однією або більше групами, незалежно вибраними з групи, що включає алкіл, алкеніл, алкініл, алкоксил, алкілсульфо, алкіламіно, галоген, тіол, гідрокси, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, циклоалкоксил, гетероциклоалкоксил, 5 5 5 5 циклоалкілтіо, гетероциклоалкілтіо, оксо, -C(O)OR , -OC(O)R , -O(CH2)nC(O)OR , -C(O)R , 5 6 7 6 7 6 7 NHC(O)R , -NR R , -OC(O)NR R та -C(O)NR R . Термін "арил" стосується 6-14 членного повністю вуглецевого моноциклічного кільця або поліциклічного конденсованого кільця ("конденсоване" кільце системи означає, що кожне кільце в системі, поділяє сусідню пару атомів вуглецю з іншим кільцем в системі) групи, і має повністю кон'юговану π-електронну систему. Переважно арил є 6-10 членним, таким як феніл і нафтил. Згаданий арил може бути при конденсованим з кільцем гетероарилу, гетероциклілу або циклоалкілу, де кільце, зв'язане з батьківською структурою, є арилом. Типові приклади включають, але не обмежуються ними, наступні групи: O 20 S та O O O H N S H N N O N O та . Арильна група може бути заміщеною або незаміщеною. Коли заміщена, то група(и)замісник(и) є переважно однією або більше групами, незалежно вибраними з групи, що включає алкіл, алкеніл, алкініл, алкоксил, алкілсульфо, алкіламіно, галоген, тіол, гідрокси, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, циклоалкоксил, гетероциклоалкоксил, 5 5 5 5 5 циклоалкілтіо, гетероциклоалкілтіо, -C(O)OR , -OC(O)R , -O(CH2)nC(O)OR , -C(O)R , -NHC(O)R , 6 7 6 7 6 7 -NR R , -OC(O)NR R та -C(O)NR R . Термін "гетероарил" стосується гетероарильної системи, що має 1-4 гетероатомів, вибраних з групи, що включає O, S і N як кільцеві атоми, і що має 5-14 з'єднаних атомів. Переважно гетероарил є 5-10-членним. Більш переважно гетероарил є 5- або 6-членним. Приклади гетероарильних груп включають фурил, тієніл, піридил, піроліл, N-алкілпіроліл, піримідиніл, піразиніл, імідазоліл, тетразоліл, і т.і… Згаданий гетероарил може бути конденсованим до кільця арилу, гетероциклілу або циклоалкілу, де кільце, зв'язане з батьківською структурою є гетероарилом. Типові приклади включають, але не обмежуються ними, наступні групи, O N N N O N N H N N N N S N N O H N 35 40 N та . Гетероарильна група може бути заміщеною або незаміщеною. Коли заміщена, то група(и)замісник(и) є переважно однією або більше групами, незалежно вибраними з групи, що включає алкіл, алкеніл, алкініл, алкоксил, алкілсульфо, алкіламіно, галоген, тіол, гідрокси, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, циклоалкоксил, гетероциклоалкоксил, 5 5 5 5 5 циклоалкілтіо, гетероциклоалкілтіо, -C(O)OR , -OC(O)R , -O(CH2)nC(O)OR , -C(O)R , -NHC(O)R , 6 7 6 7 6 7 -NR R , -OC(O)NR R та -C(O)NR R . 13 UA 111161 C2 5 10 15 20 25 30 35 40 Термін "алкоксил" стосується обидвох як -O-(алкільної), так і -O-(незаміщеної циклоалкільної) групи, де алкіл є, як визначено вище. Типові приклади включають, але не обмежуються ними, метокси, етокси, пропокси, бутокси, циклопропілокси, циклобутилокси, циклопентилокси, циклогексилокси, і т.і… Алкоксил може бути необов'язково заміщеним або незаміщеним. Коли заміщений, то замісник є переважно однією або більше групами, незалежно вибраними з групи, що включає алкіл, алкеніл, алкініл, алкоксил, алкілсульфо, алкіламіно, галоген, тіол, гідрокси, нітро, ціано, циклоалкіл, гетероциклоалкіл, арил, гетероарил, 5 5 циклоалкоксил, гетероциклоалкоксил, циклоалкілтіо, гетероциклоалкілтіо, -C(O)OR , -OC(O)R , 5 5 5 6 7 6 7 6 7 O(CH2)nC(O)OR , -C(O)R , -NHC(O)R , -NR R , -OC(O)NR R та -C(O)NR R . "Гідрокси" стосується -OH групи. "Галоген" стосується атому фтору, хлору, брому або йоду. "Аміно" стосується -NH2 групи. "Ціано" стосується -CN групи. "Нітро" стосується -NO2 групи. "Бензил" стосується -CH2-(феніл) групи. "Оксо" стосується =O групи. "Карбоксил" стосується -C(O)OH групи. Термін "алкоксикарбоніл" стосується -C(O)O(алкільної) або (циклоалкільної) групи, де алкіл і циклоалкіл є, як визначено вище. Термін "необов'язковий" або "необов'язково" означає, що описані надалі подія або обставини у подальшому можуть здійснюватися або ні і, що опис включає приклади, де подія або обставини можуть здійснюватися або не здійснюватися. Наприклад, вираз "гетероциклічна група необов'язково заміщена алкілом" означає, що алкільна група може бути присутньою або ні, а опис включає випадки, де гетероциклічна група є заміщеною алкілом, і випадки, де гетероциклічна група не є заміщеною алкілом. Термін "заміщений" стосується одного або більше атомів водню в групі, переважно до 5, більш переважно 1-3 атомів водню, незалежно заміщених відповідною кількістю замісників. Зрозуміло, що замісники існують в їх можливому хімічному положенні. Фахівець в даній галузі здатний визначити можливо чи ні заміщення без надмірних зусиль, використовуючи дослідження або теорії. Наприклад, комбінація аміно або гідрокси групи, що має вільний водень, і атомів вуглецю, що мають ненасичені зв'язкі (такі як олефінові) можуть бути нестабільними. Термін "фармацевтична композиція" стосується суміші однієї або більше сполук, описаних в представленому винаході, або фізіологічно/фармацевтично прийнятних солей або їх пролікарських форм, та інших хімічних компонентів, таких як фізіологічно/фармацевтично прийнятні носії і ексціпієнти. Призначенням фармацевтичної композиції є полегшення введення сполуки до організму, яка сприяє поглинанню активного інгредієнта, таким чином проявляючи біологічну активність. 5 7 m, n і R -R мають ті ж самі значення, як зазначено для сполук формули (I). СПОСІБ СИНТЕЗУ СПОЛУКИ ПРЕДСТАВЛЕНОГО ВИНАХОДУ Для досягнення цілі винаходу, в представленому винаході використовується наступне технічне рішення: Спосіб одержання сполук формули (I) винаходу або їх фармацевтично прийнятних солей, що включає такі стадії: O A NH N B R 4 O R a D HN R 3 R R 45 50 1 N 2 E G (IB) ( IA ) необов'язково гідроліз сполуки формули (IA) до одержання карбонової кислоти, потім взаємодію карбонової кислоти з сполукою формули (IB) або її сіллю в присутності конденсувального реагента, такого як гексафторфосфат бензотриазол-N, N, N', N'тетраметилуронію, в умовах лужного середовища, одержуючи сполуку формули (I); 14 UA 111161 C2 5 10 15 20 25 30 35 40 45 50 55 60 де: a R вибирають з гідрокси, галогену або алкокси; 1 4 A, B, Д, E, G і R -R мають значення, як ті, що в формулі (I). Наведену вище реакцію конденсування здійснювали між кислотною сполукою та аміном у присутності конденсувального агента, за умов основного середовища, де конденсувальний агент вибирають з групи, що включає N, N'-дициклогексилкарбодіімід, N, N'діізопропілкарбодіімід та тетрафторборат O-(бензотриазол-1-іл)-N, N, N', N'-тетраметилуронію (TBTU), переважно тетрафторборат O-(бензотриазол-1-іл)-N, N, N', N'-тетраметилуронію (TBTU); лужні умови забезпечували, використовуючи органічну або неорганічну основу, де основу вибирають з групи, що включає діізопропілетиламін, піридин, триетиламін, гексагідропіридин, N-метилпіперазин, 4-диметиламінопіридин, і т.д., переважно діізопропілетиламін; де використовуваний розчинник вибирають з групи, що включає толуол, бензол, дихлорметан, тетрагідрофуран, хлорформ, N, N-диметилформамід, або суміш наведених вище розчинників, переважно N, N-диметилформамід; температуру реакційної суміші підтримували між -80 °C та 100 °C, переважно між 0 °C та 60 °C; час реакції, як правило підтримували між 1 хвилиною та 72 годинами, переважно між 15 хвилинами та 24 годинами. ПЕРЕВАЖНІ ВТІЛЕННЯ Наступні приклади призначені для ілюстрації винаходу, але приклади не повинні розглядатись як обмеження рамок винаходу. Приклади 1 Структури сполук підтверджували за допомогою ядерного магнітного резонансу ( H ЯМР) та 1 -6 1 масспектрометрії (МС). Хімічні зсуви H ЯМР (δ) наведені в млн.ч. (10 ). H ЯМР визначали на спектрометрі Bruker AVANCE-400. Розчинниками були дейтерований-диметилсульфоксид (ДМСО-d6), дейтерований-хлороформ (CDCl3) та дейтерований-метанол (CD3OD) з тетраметилсиланом (TMS) як внутрішнім стандартом. МС визначали на масспектрометрі FINNIGA N LCQ Ad (ESI) (виробник: Thermo, тип: Finnigan LCQ advantage MAX). ВЕРХ визначали на спектрометрі високо-ефективної рідинної хроматографії Agilent 1200DAD (хроматографічна колонка Sunfire C18 150×4,6 мм) та спектрометрі високо-ефективної рідинної хроматографії Waters 2695-2996 (хроматографічна колонка Gimini C18 150×4,6 мм). IC50 визначали за допомогою NovoStar ELIASA (BMG Co. German); Як силікагель для тонкошарової хроматографії використовували силікагелеві пластинки Yantai Huanghai HSGF254 або Qingdao GF254. Розмір пластинок, використовуваних у ТШХ складали 0,15-0,2 мм, а розмір пластинок, використовуваних у тонко-шаровій хроматографії для продукту очищення складали 0,4-0,5 мм. Як носій для колонкової хроматографії зазвичай використовували силікагель Yantai Huanghai 200-300 меш. Вихідний матеріал винаходу може бути одержаний за допомогою стандартного способу синтезу, відомого з попереднього рівня техніки, або придбаний у ABCR GmbH & Co. KG, Acros Organics, Aldrich Chemical Company, Accela ChemBio Inc або Dari chemical Company, і т.д. Якщо в прикладах не встановлено іншого, наступні реакції здійснювали в атмосфері аргону або атмосфері азоту. Термін "атмосфера аргону" або "атмосфера азоту" означає, що реакційна посудина оснащена балоном, що містить 1 л аргону або азоту. В реакціях гідрування, реакційну систему, як правило, вакуумували та заповнювали воднем, і наведену вище операцію повторювали три рази. Реакції мікрохвильового випромінювання здійснювали, використовуючи реактор мікрохвильового випромінювання CEM Discover-S 908860. Якщо в прикладах не встановлено іншого, розчин, використовуваний у наступних реакціях стосується водного розчину. Якщо в прикладах не встановлено іншого, температура реакційної суміші в наступних реакціях була кімнатною температурою. Найбільш прийнятною кімнатною температурою була кімнатна температура 20 °C-30 °C. Процес проходження реакції контролювали за допомогою тонкошарової хроматографії (ТШХ), хроматографічна система розчинників включала: A: систему дихлорметан і метанол, B: систему н-гексан і етилацетат, C: систему петролейний етер і етилацетат, D: ацетон. Співвідношення об'єму розчинника кориговали відповідно до полярності сполук. Елюююча система очищення сполук за допомогою колоночної хроматографії і тонкошарової хроматографії включала: A: систему дихлорметан і метанол, B: систему н-гексан і етилацетат, співвідношення об'єму розчинника кориговали відповідно до полярності сполук, та іноді також 15 UA 111161 C2 5 може бути додана невелика кількість лужного реагента, такого як триетиламін або кислотного реагента, такого як оцтова кислота. Приклад 1 4-[[4-фтор-3-[3-(трифторметил)-6,8-дигідро-5H-[1,2,4]триазолo[4,3-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он O NH N O N N N N F F F F O O NH N HCl 10 15 20 25 N N F F F F 1b F O N N + OH 1a N HN O NH N 1 N N F F F 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (150 мг, 0,50 ммоль, одержану відповідно до відомого способу, описаного "у міжнародній публікації патентної заявки WO2004080976") розчиняли в 2 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1-бензотриазоліл)-N, N, N′, N′-тетраметилуронію (284 мг, 0,75 ммоль), гідрохлориду 3-(трифторметил)-5,6,7,8-тетрагідро-[1,2,4]триазолo[4,3-a]піразину 1b (138 мг, 0,60 ммоль, одержаного відповідно до відомого способу, описаного "у міжнародній публікації патентної заявки WO2004080958") та N, N-діізопропілетиламіну (0,2 мл, 1 ммоль). Після перемішування протягом 12 годин, реакційну суміш концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи 4-[[4-фтор-3-[3-(трифторметил)-6,8-дигідро-5H[1,2,4]триазолo[4,3-a]піразин-7-карбоніл]феніл]метил]-2H-фталазин-1-он 1 (25 мг, вихід 10,6 %) у вигляді білої твердої речовини. МС m/z (ESI): 473,2 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 10,04 (ш. с, 1H), 8,48 (д, 1H), 7,80 (м, 3H), 7,55 (м, 1H), 7,40 (м, 1H), 7,15 (м, 1H), 4,29 (с, 2H), 4,23 (м, 2H), 3,74 (м, 2H), 3,20 (м, 2H) Приклад 2 4-[[3-(3,4-дигідро-1H-піролo[1,2-a]піразин-2-карбоніл)-4-фторфеніл]метил]-2H-фталазин-1-он O NH N O N F N O O HN N H стадія 1 N NH N + стадія 2 N NH N O 2a 2b N OH H2N 2c 1a 30 Стадія 1 2-пірол-1-іл-етанамін 16 F O стадія 3 F 2 N UA 111161 C2 5 10 15 20 25 30 Пірол 2a (12 г, 17,90 ммоль) розчиняли в 150 мл ацетoнітрилу, з наступним додаванням 2хлоретиламінгідрохлориду (24,60 г, 21,20 ммоль), гідроксиду натрію (0,50 г, 4 ммоль) і тетрабутиламонію гідросульфату (2,40 г, 7 ммоль). Після перемішування протягом 4 годин при кипінні зі зворотним холодильником, реакційну суміш нагрівали до 50 °C і піддавали взаємодії протягом 12 годин. Реакційну суміш концентрували при пониженому тиску, одержуючи 2-пірол1-іл-етанамін 2b (8 г, вихід 41,0 %) у вигляді світло-жовтої олії. Стадія 2 1,2,3,4-тетрагідропіролo[1,2-a]піразин 2-Пірол-1-іл-етанамін 2b (2 г, 18 ммоль) розчиняли в 40 мл етанолу, з наступним додаванням розчину формальдегіду (40 %, 1,5 мл, 18 ммоль) і повільним додаванням краплями 1 мл трифтороцтової кислоти. Реакційну суміш нагрівали до 50 °C протягом 15 хвилин, потім охолоджували при кімнатній температурі і перемішували протягом 12 годин. Реакційну суміш концентрували при пониженому тиску, з додаванням 50 мл етилацетату, промивали насиченим розчином бікарбонату натрію (50 мл), сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи 1,2,3,4-тетрагідропіролo[1,2a]піразин 2c (1,60 г, вихід 72,7 %) у вигляді світло-жовтої олії. Стадія 3 4-[[3-(3,4-дигідро-1H-піролo[1,2-a]піразин-2-карбоніл)-4-фторфеніл]метил]-2H-фталазин-1-он 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (300 мг, 1 ммоль) розчиняли в 3 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1бензотриазоліл)-N, N, N′, N′-тетраметилуронію (568 мг, 1,50 ммоль), 1,2,3,4тетрагідропіролo[1,2-a]піразину 2c (210 мг, 1,50 ммоль) і N, N-діізопропілетиламіну (350 мкл, 2 ммоль). Після перемішування протягом 12 годин, реакційну суміш концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи 4-[[3-(3,4-дигідро-1H- піролo[1,2-a]піразин-2карбоніл)-4-фторфеніл]метил]-2H-фталазин-1-он 2 (15 мг, вихід 3,7 %) у вигляді білої твердої речовини. МС m/z (ESI): 403,1 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 10,19 (ш. с, 1H), 8,51 (д, 1H), 7,82 (м, 3H), 7,41 (м, 2H), 7,13 (м, 1H), 6,65 (м, 1H), 6,24 (м, 1H), 5,81 (м, 1H), 4,97 (с, 1H), 4,59 (с, 1H), 4,33 (с, 2H), 4,13 (м, 1H), 4,00 (м, 1H), 3,71 (м, 1H), 2,85 (м, 1H) Приклад 3 метил 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8-дигідро5H-імідазо[1,5-a]піразин-1-карбоксилат 35 O NH N O O N F N O N F F F O O N F F 3a 45 N N стадія 1 F F F 3b NH N O O O HN N 40 O O O NH N N + N O F OH 1a F O O стадія 2 F 3 N F F O N F Стадія 1 метил 3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксилат O7-трет-бутил-O1-метил-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-1,7дикарбоксилат 3a (600 мг, 1,72 ммоль, одержаний відповідно до відомого способу, описаного "у міжнародній публікації патентної заявки WO2009082881") розчиняли в 20 мл розчину хлороводню в 1,4-діоксані (2 М). Після перемішування протягом 5 годин, реакційну суміш 17 UA 111161 C2 5 10 15 20 концентрували при пониженому тиску і з додаванням 50 мл дихлорметану. Насичений розчин бікарбонату натрію краплями додавали до реакційної суміші доки значення показника pH не ставав 8. Органічну фазу відокремлювали, сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи неочищений метил 3(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксилат 3b (430 мг) у вигляді білої твердої речовини. Продукт використовували в наступній реакції безпосередньо, без очищення. Стадія 2 метил 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8-дигідро5H-імідазо[1,5-a]піразин-1-карбоксилат 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (300 мг, 1 ммоль) розчиняли в 2 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1бензотриазоліл)-N, N, N′, N′-тетраметилуронію (568 мг, 1,50 ммоль), неочищеного метил 3(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин -1-карбоксилату 3b (300 мг, 1,50 ммоль) і N, N-діізопропілетиламіну (0,4 мл, 2 ммоль). Після перемішування протягом 12 годин, реакційну суміш концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи метил 7-[2-фтор5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5a]піразин-1-карбоксилат 3 (120 мг, вихід 23,0 %) у вигляді світло-жовтої твердої речовини. МС m/z (ESI): 530,1 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 10,48 (ш. с, 1H), 8,52 (д, 1H), 7,87 (м, 3H), 7,43 (м, 2H), 7,30 (м, 1H), 5,02 (м, 2H), 4,34 (с, 2H), 4,17 (м, 2H), 3,99 (м, 2H), 3,00 (с, 3H) Приклад 4 4-[[3-(6,8-дигідро-5H-імідазо[1,2-a]піразин-7-карбоніл)-4-фторфеніл]метил]-2H-фталазин-1-он O N N O N N N F 25 O O N N NH2 N N стадія 1 N N HN стадія 2 NH N N + NH N O OH O F 4a 30 35 40 45 4b 4c 1a N N стадія 3 N F 4 Стадія 1 імідазо[1,2-a]піразин Піразин-2-амін 4a (5 г, 52 ммоль) розчиняли в 40 % розчині 2-хлорацетальдегіду (15 мл, 78 ммоль), з наступним додаванням бікарбонату натрію (6,60 г, 78 ммоль). Після перемішування протягом 48 годин при 100 °C, реакційну суміш охолоджували при кімнатній температурі, з додаванням 100 мл насиченого розчину карбонату калію, і екстрагували дихлорметаном (100 мл×3). Органічну фазу об'єднували, сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи імідазо[1,2-a]піразин 4b (3 г, вихід 50,0 %) у вигляді коричневої твердої речовини. МС m/z (ESI): 120,1 [M+1] Стадія 2 5,6,7,8-тетрагідроімідазо[1,2-a]піразин Імідазо[1,2-a]піразин 4b (500 мг, 4,20 ммоль) розчиняли в 5 мл 2-метоксиетанолу, з наступним додаванням диоксиду платини (100 мг, 0,36 ммоль), і реактор три рази продували воднем. Після перемішування протягом 12 годин, реакційну суміш фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи 5,6,7,8-тетрагідроімідазо[1,2-a]піразин 4c (200 мг, вихід 38,7 %) у вигляді жовтої олії. МС m/z (ESI): 124,1 [M+1] 18 UA 111161 C2 5 10 15 Стадія 3 4-[[3-(6,8-дигідро-5H-імідазо[1,2-a]піразин-7-карбоніл)-4-фторфеніл]метил]-2H-фталазин-1-он 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (323 мг, 1,08 ммоль) розчиняли в 5 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1бензотриазоліл)-N, N, N′, N′-тетраметилуронію (614 мг, 1,63 ммоль), 5,6,7,8тетрагідроімідазо[1,2-a]піразину 4c (200 мг, 1,63 ммоль) та N, N-діізопропілетиламіну (0,4 мл, 2,16 ммоль). Після перемішування протягом 12 годин, реакційну суміш концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи 4-[[3-(6,8-дигідро-5H-імідазо[1,2-a]піразин-7карбоніл)-4-фторфеніл]метил]-2H-фталазин-1-он 4 (10 мг, вихід 2,3 %) у вигляді білої твердої речовини. МС m/z (ESI): 404,1 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 10,07 (ш. с, 1H), 8,53 (д, 1H), 7,96 (м, 1H), 7,83 (м, 3H), 7,51 (м, 1H), 7,30 (м, 2H), 6,01 (т, 1H), 4,73 (д, 2H), 4,35 (с, 2H), 1,60 (м, 2H), 1,34 (м, 2H) Приклад 5 4-[[4-фтор-3-[3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он O NH N O N F N N F F F O NH N O HN N 2HCl 20 25 30 35 5a F F N NH N + O N O F OH F 1a 5 F N F F N F 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (500 мг, 1,68 ммоль) розчиняли в 5 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1бензотриазоліл)-N, N, N", N’-тетраметилуронію (955 мг, 2,52 ммоль), гідрохлориду 3трифторметил-5,6,7,8-тетрагідроімідазо[1,5-a]піразину 5a (457 мг, 2 ммоль, одержаного відповідно до відомого способу, описаного "у міжнародній публікації патентної заявки WO2009082881") і N, N-діізопропілетиламіну (0,6 мл, 3,36 ммоль). Після перемішування протягом 12 годин, реакційну суміш концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи 4-[[4-фтор-3-[3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он 5 (400 мг, вихід 50,5 %) у вигляді білої твердої речовини. МС m/z (ESI): 472,1 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 10,81 (ш. с, 1H), 8,49 (м, 1H), 7,79 (м, 3H), 7,42 (м, 2H), 7,08 (м, 1H), 5,00 (м, 1H), 4,64 (м, 1H), 4,32 (м, 2H), 4,16 (м, 3H), 3,75 (м, 1H), 3,49 (с, 1H) Приклад 6 4-[[4-фтор-3-[1-(гідроксиметил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он 19 UA 111161 C2 O NH N O OH N N N F F F F O O O HN N F F 3b 5 10 15 20 25 30 OH O HN N стадія 1 F N F F 6a NH N + N NH N O F F F OH N стадія 2 OH 1a O 6 N F F N F Стадія 1 [3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-іл]метанол Метил 3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксилат 3b (315 мг, 1,26 ммоль) розчиняли в 10 мл етанолу, з наступним додаванням борогідриду натрію (240 мг, 6,33 ммоль). Після перемішування протягом 12 годин, до реакційної суміші краплями додавали 2 M хлорводневої кислоти до припинення утворення газу в реакційній суміші. Реакційну суміш концентрували при пониженому тиску, одержуючи неочищений [3-(трифторметил)-5,6,7,8тетрагідроімідазо[1,5-a]піразин-1-іл]метанол 6a (230 мг) у вигляді білої твердої речовини. Продукт використовували в наступній реакції безпосередньо, без очищення. Стадія 2 4-[[4-фтор-3-[1-(гідроксиметил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (372 мг, 1,25 ммоль) розчиняли в 5 мл N, N-диметилформаміду, з наступним додаванням N-гідроксибензотриазолу (85 мг, 0,63 ммоль), [3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-іл]метанолу 6a (277 мг, 1,25 ммоль), гідрохлориду 1-етил-(3-диметил-амінопропіл)карбодііміду (359 мг, 1,88 ммоль) і триетиламіну (0,3 мл, 2,5 ммоль). Після перемішування протягом 12 годин, реакційну суміш концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи 4-[[4-фтор-3-[1(гідроксиметил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоніл]феніл]метил]2H-фталазин-1-он 6 (400 мг, вихід 64,0 %) у вигляді білої твердої речовини. МС m/z (ESI): 502,2 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 10,81 (ш. с, 1H), 8,47 (с, 1H), 7,83-7,75 (м, 3H), 7,42-7,36 (м, 2H), 7,14-7,12 (м, 1H), 5,31 (с, 1H), 5,04 (с, 1H), 4,69 (д, 1H), 4,50 (с, 1H), 4,32-4,25 (м, 4H), 4,16-4,10 (м, 1H), 2,05 (с, 1H) Приклад 7 N-етил-7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8-дигідро5H-імідазо[1,5-a]піразин-1-карбоксамід O NH N N F N F F 20 H N O O N F UA 111161 C2 O O O HN N F F 3b 5 10 15 20 25 30 H N O O HN N + N N стадія 1 NH N N стадія 2 F F F 7 1a 7a N F F N F Стадія 1 N-етил-3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксамід Метил 3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксилат 3b (1 г, 4 ммоль) розчиняли в 40 мл розчину етиламіну (60 %). Після перемішування при 50 °C протягом 12 годин, реакційну суміш концентрували при пониженому тиску, одержуючи не очищений Nетил-3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксамід 7a (1,15 г) у вигляді білої твердої речовини. Продукт використовували в наступній реакції безпосередньо, без очищення. МС m/z (ESI): 263,1 [M+1] Стадія 2 N-етил-7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8-дигідро5H-імідазо[1,5-a]піразин-1-карбоксамід 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (250 мг, 0,84 ммоль) розчиняли в 20 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1бензотриазоліл)-N, N, N", N’-тетраметилуронію (480 мг, 1,26 ммоль), неочищеного N-етил-3(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксаміду 7a (242 мг, 0,92 ммоль) і N, N-діізопропілетиламіну (0,3 мл, 1,68 ммоль). Після перемішування протягом 12 годин, до реакційної суміші додавали 50 мл H2O, і екстрагували дихлорметаном (50 мл×3). Органічну фазу об'єднували, концентрували при пониженому тиску, додавали 100 мл етилацетату, промивали послідовно насиченим розчином бікарбонату натрію (40 мл), насиченим розчином хлориду натрію (40 мл), сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи N-етил-7-[2фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5a]піразин-1-карбоксамід 7 (200 мг, вихід 43,9 %) у вигляді білої твердої речовини. МС m/z (ESI): 543,2 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 11,38 (ш. с, 1H), 8,47 (м, 1H), 7,84 (м, 3H), 7,37 (м, 2H), 7,19 (м, 1H), 5,10 (с, 2H), 4,30 (с, 2H), 4,29 (м, 4H), 3,47 (м, 2H), 1,27 (м, 3H) Приклад 8 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8дигідро-5Hімідазо[1,5-a]піразин-1-карбонова кислота O NH N O O N F 35 H N O O O OH F F F NH N N N F F O OH F O NH N O O N N F F F NH N O O O N N F F 8 3 21 N F F OH N F UA 111161 C2 5 10 15 Метил 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8-дигідро5H-імідазо[1,5-a]піразин-1-карбоксилат 3 (30 мг, 0,057 ммоль) розчиняли в 1,5 мл суміші розчинників тетрагідрофурану, метанолу та води (О/О/О = 1:1:1), з наступним додаванням гідроксиду натрію (10 мг, 0,25 ммоль). Після перемішування протягом 12 годин, до реакційної суміші краплями додавали концентровану хлорводневу кислоту доки значення показника pH не досягало 2. Реакційну суміш екстрагували дихлорметаном (15 мл×2). Органічну фазу об'єднували, сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи 7-[2-фтор-5-[(4-оксо-3Hфталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-1карбонову кислоту 8 (10 мг, вихід 34,4 %) у вигляді світло-жовтої твердої речовини. МС m/z (ESI): 516,5 [M+1] 1 H ЯМР (400 MГц, CD3OD): δ 8,36 (д, 1H), 7,93 (д, 1H), 7,83 (м, 2H), 7,60 (д, 1H), 7,29 (м, 1H), 6,97 (т, 1H), 4,32 (с, 2H), 3,41 (м, 6H) Приклад 9 4-[[4-фтор-3-[1-(метиламінометил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он O NH N O N H N N F N F F O O NH N O OH N F 6 20 25 30 35 40 F N F F N O NH N O F F Cl N стадія 1 N F F 9a NH N O N стадія 2 N F F N H 9 N F F N F Стадія 1 4-[[3-[1-(хлорметил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоніл]-4фторфеніл]метил]-2H-фталазин-1-он 4-[[4-Фтор-3-[1-(гідроксиметил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он 6 (200 мг, 0,40 ммоль) розчиняли в 5 мл тіонілхлориду. Реакційну суміш нагрівали до кипіння зі зворотним холодильником протягом 4 годин. Реакційну суміш концентрували при пониженому тиску, з додаванням 10 мл H2O, екстрагували дихлорметаном (10 мл×3). Органічну фазу об'єднували, сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи 4-[[3-[1(хлорметил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоніл]-4фторфеніл]метил]-2H-фталазин-1-он 9a (200 мг, вихід 96,6 %) у вигляді жовтої твердої речовини. МС m/z (ESI): 520,1 [M+1] Стадія 2 4-[[4-фтор-3-[1-(метиламінометил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он 4-[[3-[1-(Хлорметил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоніл]-4фторфеніл]метил]-2H-фталазин-1-он 9a (372 мг, 1,25 ммоль) розчиняли в 5 мл ацетoнітрилу, з наступним додаванням 0,6 мл 2 M розчину метиламіну в тетрагідрофурані і карбонату калію (159 мг, 1,15 ммоль). Реакційну суміш нагрівали до кипіння зі зворотним холодильником протягом 6 годин. Реакційну суміш фільтрували. Фільтрат концентрували при пониженому тиску і очищували за допомогою тонкошарової хроматографії, з використанням елюлюючої системи A, одержуючи 4-[[4-фтор-3- [1-(метиламінометил)-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5 22 UA 111161 C2 5 a]піразин-7-карбоніл]феніл]метил]-2H-фталазин-1-он 9 (20 мг, вихід 10,1 %) у вигляді жовтої твердої речовини. МС m/z (ESI): 515,2 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 11,87 (ш. с, 1H), 8,35-8,42 (м, 1H), 7,72-7,81 (м, 3H), 7,35-7,43 (м, 1H), 6,96-7,06 (м, 1H), 5,01-5,02 (м, 1H), 3,99-4,28 (м, 6H), 3,71-3,72 (м, 1H), 3,47 (с, 1H), 2,74 (д, 3H), 2,03-2,05 (м, 1H) Приклад 10 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8дигідро-5Hімідазо[1,5-a]піразин-1-карбоксамід 10 O NH N O O N N F F F NH2 N F O O O HN стадія 1 F F 3b 15 20 25 30 35 40 HN N N O O F NH2 NH N N N O + F F 10a N NH F N стадія 2 OH F 10 NH2 N N F F 1a O O F F Стадія 1 3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксамід Метил 3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксилат 3b (250 мг, 1 ммоль) і 10 мл гідроксиду амонію додавали до 20 мл запаяної пробірки. Реакційну суміш нагрівали до 100 °C і піддавали взаємодії протягом 3 годин. Реакційну суміш концентрували при пониженому тиску, одержуючи неочищений 3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5a]піразин-1-карбоксамід 10a (240 мг) у вигляді білої твердої речовини. Продукт використовували в наступній реакції безпосередньо, без очищення. МС m/z (ESI): 235,1 [M+1] Стадія 2 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-3-(трифторметил)-6,8дигідро-5Hімідазо[1,5-a]піразин-1-карбоксамід 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (150 мг, 0,50 ммоль) розчиняли в 10 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1бензотриазоліл)-N, N, N", N’-тетраметилуронію (285 мг, 0,75 ммоль), неочищеного 3(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксаміду 10a (130 мг, 0,55 ммоль) та N, N-діізопропілетиламіну (0,2 мл, 1 ммоль). Після перемішування протягом 12 годин, до реакційної суміші додавали 50 мл H2O, екстрагували дихлорметаном (60 мл×3). Органічну фазу об'єднували, концентрували при пониженому тиску, з додаванням 100 мл етилацетату, промивали послідовно, використовуючи H2O (40 мл) і насичений розчин хлориду натрію (40 мл), сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи 7-[2-фтор-5-[(4-оксо-3H-фталазин-1іл)метил]бензоїл]- 3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-1-карбоксамід 10 (50 мг, вихід 20,0 %) у вигляді білої твердої речовини. МС m/z (ESI): 515,1 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 8,49 (м, 1H), 7,85 (м, 3H), 7,33 (м, 2H), 7,15 (м, 1H), 5,07 (с, 2H), 4,30 (с, 2H), 4,23 (м, 4H) Приклад 11 4-[[3-[1-бром-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоніл]-4фторфеніл]метил]-2H-фталазин-1-он 23 UA 111161 C2 O NH N O Br N N N F F F F O O O O HN N F F 2HCl 5a 5 10 15 20 25 30 35 40 45 O N F O N N стадія 1 11a F F N HN N N стадія 2 F Br Br F 11b F N N стадія 3 F HCl F F 11c NH N N + F NH N F Br N OH стадія 4 1a O O F 11 N F F Стадія 1 трет-бутил 3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоксилат Гідрохлорид 3-(Трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразину 5a (2,20 г, 8,30 ммоль) розчиняли в 20 мл дихлорметану, з наступним додаванням триетиламіну (4,6 мл, 33,20 ммоль) і ди-трет-бутилдикарбонат (2,70 г, 12,50 ммоль). Після перемішування протягом 12 годин, до реакційної суміші додавали 50 мл H2O, екстрагували дихлорметаном (50 мл×3). Органічну фазу об'єднували, промивали послідовно насиченим розчином хлориду амонію (40 мл) і насиченим розчином хлориду натрію (40 мл), сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи трет-бутил 3(трифторметил)-6,8- дигідро-5H-імідазо[1,5-a]піразин-7-карбоксилат 11a (2,20 г, вихід 91,7 %) у вигляді світло-коричневої твердої речовини. МС m/z (ESI): 292,1 [M+1] Стадія 2 трет-бутил 1-бром-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоксилат Трет-бутил 3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоксилат 11a (370 мг, 1,27 ммоль) розчиняли в 30 мл тетрагідрофурану, з наступним додаванням Nбромсукциніміду (453 мг, 2,54 ммоль) при -78 °C. Після перемішування протягом 1 години, реакційну суміш нагрівали при кімнатній температурі і піддавали взаємодії протягом 12 годин. До реакційної суміші додавали 50 мл H2O, екстрагували етилацетатом (60 мл×3). Органічну фазу об'єднували, промивали насиченим розчином хлориду натрію (40 мл), сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи неочищений трет-бутил 1-бром-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5a]піразин-7-карбоксилат 11b (510 мг) у вигляді світло-жовтої олії. Продукт використовували в наступній реакції безпосередньо, без очищення. МС m/z (ESI): 372,0 [M+1] Стадія 3 Гідрохлорид 1-бром-3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразину Неочищений трет-бутил 1-бром-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7карбоксилат 11b (470 мг, 1,27 ммоль) розчиняли в 50 мл 2 M розчину хлороводню в 1,4-діоксані. Після перемішування протягом 4 годин, реакційну суміш концентрували при пониженому тиску, одержуючи гідрохлорид 1-бром-3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразину 11c (220 мг, вихід 56,5 %) у вигляді світло-жовтої олії. Стадія 4 4-[[3-[1-бром-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоніл]-4фторфеніл]метил]-2H-фталазин-1-он 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (210 мг, 0,70 ммоль) розчиняли в 30 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1бензотриазоліл)-N, N, N", N’-тетраметилуронію (360 мг, 0,95 ммоль), гідрохлориду 1-бром-3(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразину 11c (214 мг, 0,70 ммоль) та N, Nдіізопропілетиламіну (0,4 мл, 2,10 ммоль). Після перемішування протягом 12 годин, до реакційної суміші додавали 50 мл H2O, екстрагували дихлорметаном (80 мл×3). Органічну фазу 24 N F UA 111161 C2 5 10 об'єднували, концентрували при пониженому тиску, з додаванням 100 мл етилацетату, промивали, послідовно використовуючи насичений розчин карбонату натрію (40 мл), H 2O (40 мл) і насичений розчин хлориду натрію (40 мл), сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи 4[[3-[1-бром-3-(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-7-карбоніл]-4фторфеніл]метил]-2H-фталазин-1-он 11 (185 мг, вихід 48,0 %) у вигляді білої твердої речовини. МС m/z (ESI): 552,0 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 8,48 (м, 1H), 7,73 (м, 3H), 7,31 (м, 2H), 7,11 (м, 1H), 4,89 (с, 2H), 4,49 (с, 2H), 4,48 (м, 4H) Приклад 12 4-[[4-фтор-3-[2-(трифторметил)-6,8-дигідро-5H-імідазо[1,2-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он O NH N O N N 15 N F F F F O O N N 4a 20 25 30 35 40 45 50 F NH2 + Br O 12a F F N N стадія 1 N F HN F F стадія 2 NH N F N F N F + NH N O стадія 3 12c 1a F N N OH 12b O F N F F F 12 Стадія 1 2-(трифторметил)імідазо[1,2-a]піразин Піразин-2-амін 4a (5,25 г, 55,20 ммоль) розчиняли в 120 мл етанолу, з наступним додаванням 3-бром-1,1,1-трифторпропан-2-он 12a (5,7 мл, 55,20 ммоль). Реакційну суміш нагрівали до кипіння зі зворотним холодильником протягом 16 годин. Реакційну суміш концентрували при пониженому тиску, з додаванням 100 мл етилацетату і 100 мл насиченого розчину бікарбонату натрію і розділяли. Водну фазу екстрагували етилацетатом (50 мл×3). Органічну фазу об'єднували, промивали насиченим розчином хлориду натрію (50 мл), сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і одержаний залишок очищували за допомогою колоночної хроматографії на силікагелі, використовуючи елююючу систему B, одержуючи 2-(трифторметил)імідазо[1,2-a]піразин 12b (2,40 г, вихід 22,8 %) у вигляді жовтої твердої речовини. МС m/z (ESI): 188,0 [M+1] Стадія 2 2-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,2-a]піразин 2-(Трифторметил)імідазо[1,2-a]піразин 12b (2,40 г, 12,55 ммоль) розчиняли в 100 мл метанолу, з наступним додаванням Pd-C (10 %, 480 мг), і реактор три рази продували воднем. Після перемішування протягом 12 годин, реакційну суміш фільтрували і осад на фільтрі промивали метанол. Фільтрат концентрували при пониженому тиску, одержуючи 2(трифторметил)-5,6,7,8-тетрагідроімідазо[1,2-a]піразин 12c (2,30 г, вихід 95,8 %) у вигляді жовтої олії. Стадія 3 4-[[4-фтор-3-[2-(трифторметил)-6,8-дигідро-5H-імідазо[1,2-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (500 мг, 1,68 ммоль) розчиняли в 10 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1бензотриазоліл)-N, N, N", N’-тетраметилуронію (830 мг, 2,52 ммоль), 2-(трифторметил)-5,6,7,8тетрагідроімідазо[1,2-a]піразину 12c (384 мг, 2 ммоль) і N, N-діізопропілетиламіну (1 мл, 5 ммоль). Після перемішування протягом 12 годин, одержаний залишок очищували за допомогою колоночної хроматографії на силікагелі, використовуючи елююючу систему A, одержуючи 4-[[4фтор-3-[2-(трифторметил)-6,8-дигідро-5H-імідазо[1,2-a]піразин-7-карбоніл]феніл]метил]-2Hфталазин-1-он 12 (200 мг, вихід 25,0 %) у вигляді білої твердої речовини. МС m/z (ESI): 472,1[M+1] 25 UA 111161 C2 1 5 H ЯМР (400 MГц, CDCl3): δ 10,29 (ш. с, 1H), 8,47 (м, 1H), 7,80 (м, 3H), 7,37 (м, 2H), 7,25 (м, 1H), 6,50 (м, 1H), 4,67 (с, 2H), 4,28 (м, 2H), 4,14 (м, 2H), 3,73 (м, 2H) Приклад 13 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-N-метил-3-(трифторметил)-6,8дигідро-5H-імідазо[1,5-a]піразин-1-карбоксамід O NH N O O N F N H N N F F F O O O HN N F F 3b 10 15 20 25 30 35 40 O O HN N стадія 1 N N H N NH N + NH N O F F 13a N F F F 1a N H стадія 2 OH F O O 13 N N F F F Стадія 1 N-метил-3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксамід Метил 3-(трифторметил)-5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1-карбоксилат 3b (500 мг, 2 ммоль) розчиняли в 8 мл розчину метиламіну (20 % - 30 %) додавали до 20 мл запаяної пробірки. Після перемішування при 60 °C протягом 6 годин, реакційну суміш концентрували при пониженому тиску, одержуючи не очищений N-метил-3-(трифторметил)-5,6,7,8тетрагідроімідазо[1,5-a]піразин-1-карбоксамід 13a (498 мг) у вигляді білої твердої речовини. Продукт використовували в наступній реакції безпосередньо, без очищення. МС m/z (ESI): 249,1 [M+1] Стадія 2 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-N-метил-3-(трифторметил)-6,8дигідро-5H-імідазо[1,5-a]піразин-1-карбоксамід 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (598 мг, 2 ммоль) розчиняли в 10 мл N, N-диметилформаміду, з наступним додаванням 1-гідроксибензотриазолу (135 мг, 1 ммоль), неочищеного N-метил-3-(трифторметил)- 5,6,7,8-тетрагідроімідазо[1,5-a]піразин-1карбоксаміду 13a (498 мг, 2 ммоль), гідрохлориду 1-етил-(3-диметиламінопропіл)карбодііміду (573 мг, 3 ммоль) та N, N-діізопропілетиламіну (774 мг, 6 ммоль). Після перемішування протягом 12 годин, реакційну суміш концентрували при пониженому тиску, з додаванням 30 мл H2O, екстрагували етилацетатом (50 мл×3). Органічну фазу об'єднували, сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-N-метил-3(трифторметил)-6,8-дигідро-5H-імідазо[1,5-a]піразин-1-карбоксамід 13 (650 мг, вихід 61,0 %) у вигляді білої твердої речовини. МС m/z (ESI): 529,1 [M+1] 1 H ЯМР (400 MГц, CD3OD): δ 8,36-8,34 (т, 1H), 7,96-7,94 (д, 1H), 7,86-7,81 (м, 2H), 7,50-7,45 (м, 2H), 7,22-7,15 (дд, 1H), 5,23 (с, 1H), 4,95 (с, 1H), 4,39 (д, 2H), 4,32 (д, 1H), 4,21 (с, 1H), 4,14 (с, 1H), 3,76 (с, 1H), 2,85 (д, 3H) Приклад 14 етил 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-6,8-дигідро-5H-імідазо[1,2a]піразин-3-карбоксилат 26 UA 111161 C2 O NH N O N N N F O O O O N N 4a 5 10 15 20 25 30 35 40 45 NH2 стадія 1 N N O 14a N HN N N NH N O O O + стадія 2 O NH N O F 14b 1a N N OH стадія 3 F 14 N O O Стадія 1 етилімідазо[1,2-a]піразин-3-карбоксилат Піразин-2-амін 4a (1 г, 10 ммоль) розчиняли в 50 мл диметилового етеру етиленгліколю, з наступним додаванням 50 мл метанолу і 3-бром-2-оксопропіонату (2,30 г, 12 ммоль). Після перемішування протягом 4 годин при кімнатній температурі, реакційну суміш охолоджували до 0 °C і перемішували протягом 30 хвилин, до осадження твердої речовини. Реакційну суміш фільтрували, і осад на фільтрі промивали ефіром (10 мл×3). Тверду речовину розчиняли в 50 мл безводного етанолу і розчин кип'ятили із зворотнім холодильником протягом 4 годин. Реакційну суміш концентрували при пониженому тиску, з додаванням 100 мл дихлорметану, промивали, послідовно використовуючи насичений розчин карбонату натрію (40 мл) і насичений розчин хлориду натрію (40 мл), сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску, одержуючи етилімідазо[1,2-a]піразин-3карбоксилат 14a (0,55 г, вихід 28,9 %) у вигляді коричневої твердої речовини. МС m/z (ESI): 192,1 [M+1] Стадія 2 етил 5,6,7,8-тетрагідроімідазо[1,2-a]піразин-3-карбоксилат Етилімідазо[1,2-a]піразин-3-карбоксилат 14a (550 мг, 2,76 ммоль) розчиняли в 30 мл метанолу, з наступним додаванням Pd-C (10 %, 100 мг) і реактор три рази продували воднем. Після перемішування протягом 3 годин, реакційну суміш фільтрували і фільтрат концентрували при пониженому тиску, одержуючи етил 5,6,7,8-тетрагідроімідазо[1,2-a]піразин-3-карбоксилат 14b (480 мг, вихід 87,6 %) у вигляді жовтої олії. МС m/z (ESI): 196,1 [M+1] Стадія 3 етил 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-6,8-дигідро-5H-імідазо[1,2a]піразин-3-карбоксилат 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (300 мг, 1 ммоль) розчиняли в 20 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1бензотриазоліл)-N, N, N", N’-тетраметилуронію (570 мг, 1,50 ммоль), етил 5,6,7,8тетрагідроімідазо[1,2-a]піразин-3-карбоксилату 14b (200 мг, 1 ммоль) та N, Nдіізопропілетиламіну (0,3 мл, 2 ммоль). Після перемішування протягом 12 годин, до реакційної суміші додавали 50 мл H2O, екстрагували дихлорметаном (80 мл×3). Органічну фазу об'єднували, концентрували при пониженому тиску, з додаванням 100 мл етилацетату, промивали, послідовно використовуючи насичений розчин карбонату натрію (40 мл), H 2O (40 мл), насичений розчин хлориду натрію (40 мл), сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи етил 7-[2-фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензоїл]-6,8-дигідро-5H-імідазо[1,2-a]піразин3-карбоксилат 14 (280 мг, вихід 58,6 %) у вигляді білої твердої речовини. МС m/z (ESI): 476,1 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 10,53 (ш. с, 1H), 8,46 (м, 1H), 7,76 (м, 3H), 7,59 (с, 1H), 7,36 (м, 2H), 7,08 (м, 1H), 4,69 (с, 2H), 4,37 (м, 2H), 4,31 (с, 2H), 4,27 (м, 4H), 1,26 (т, 3H) Приклад 15 27 UA 111161 C2 4-[[3-[3-(трифторметил)-6,8-дигідро-5H-[1,2,4]триазолo[4,3-a]піразин-7карбоніл]феніл]метил]-2H-фталазин-1-он O NH N O N N N F F N F O O NH N N HN HCl 10 15 20 N F 1b 15a 5 N N F F OH O N N + O NH N F F 15 N F 3-[(4-Оксо-3H-фталазин-1-іл)метил]бензойну кислоту 15a (300 мг, 1,07 ммоль, одержану відповідно до відомого способу, описаного "у міжнародній публікації патентної заявки WO2004080976") розчиняли в 10 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1-бензотриазоліл)-N, N, N", N’-тетраметилуронію (730 мг, 1,93 ммоль), гідрохлориду 3-(трифторметил)-5,6,7,8-тетрагідро-[1,2,4]триазолo[4,3-a]піразину 1b (269 мг, 1,40 ммоль) та N, N-діізопропілетиламіну (0,9 мл, 5,30 ммоль). Після перемішування протягом 12 годин, до реакційної суміші додавали 15 мл H2O, екстрагували етилацетатом (20 мл×3). Органічну фазу об'єднували, сушили над безводним сульфатом натрію і фільтрували. Фільтрат концентрували при пониженому тиску і одержаний залишок очищували за допомогою тонкошарової хроматографії, використовуючи елююючу систему A, одержуючи 4-[[3-[3(трифторметил)-6,8-дигідро-5H-[1,2,4]триазолo[4,3-a]піразин-7-карбоніл]феніл]метил]-2Hфталазин-1-он 15 (100 мг, вихід 20,6 %) у вигляді білої твердої речовини. МС m/z (ESI): 455,1 [M+1] 1 H ЯМР (400 MГц, CDCl3): δ 10,30 (ш. с, 1H), 8,49 (д, 1H), 8,02 (м, 1H), 7,78 (м, 3H), 7,43 (м, 3H), 5,31 (с, 2H), 4,35 (с, 2H), 4,21 (м, 2H), 4,12 (м, 2H) Приклад 16 4-[[3-(6,8-дигідро-5H-[1,2,4]триазолo[1,5-a]піразин-7-карбоніл)-4-фторфеніл]метил]-2Hфталазин-1-он 25 O NH N O N F N N N O O NH N + O HN NH N N O N N N OH 1a 30 F F 16a N N N 16 2-Фтор-5-[(4-оксо-3H-фталазин-1-іл)метил]бензойну кислоту 1a (360 мг, 1,20 ммоль) розчиняли в 10 мл N, N-диметилформаміду, з наступним додаванням гексафторфосфату O-(1бензотриазоліл)-N, N, N", N’-тетраметилуронію (600 мг, 1,80 ммоль), 5,6,7,8-тетрагідро[1,2,4]триазолo[1,5-a]піразину 16a (150 мг, 1,20 ммоль, одержаного відповідно до відомого 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPhthalazinone ketone derivative, process for the preparation thereof and pharmaceutical use thereof
Автори англійськоюTang, Pengcho, Li, Xin, Li, Xiangqin, Chen, Yang, Wang, Bin, Zhu, Zhe
Назва патенту російськоюПроизводное фталазинонкетона, способ его получения и его фармацевтическое применение
Автори російськоюТанг Пенгчо, Ли Ксин, Ли Ксянгквин, Чен Янг, Ванг Бин, Жу Же
МПК / Мітки
МПК: A61K 31/502, C07D 487/04, A61P 43/00, A61K 31/5025, C07D 403/12, A61P 35/00
Мітки: фармацевтичне, одержання, фталазинонкетону, спосіб, застосування, похідна
Код посилання
<a href="https://ua.patents.su/52-111161-pokhidna-ftalazinonketonu-sposib-oderzhannya-ta-farmacevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідна фталазинонкетону, спосіб її одержання та її фармацевтичне застосування</a>
Попередній патент: Спосіб оцінки віку і спосіб визначення статі
Наступний патент: Ін’єкційна композиція ацетоніду триамцинолону для лікування болю
Випадковий патент: Спосіб отримання ультрадисперсного металевого порошку