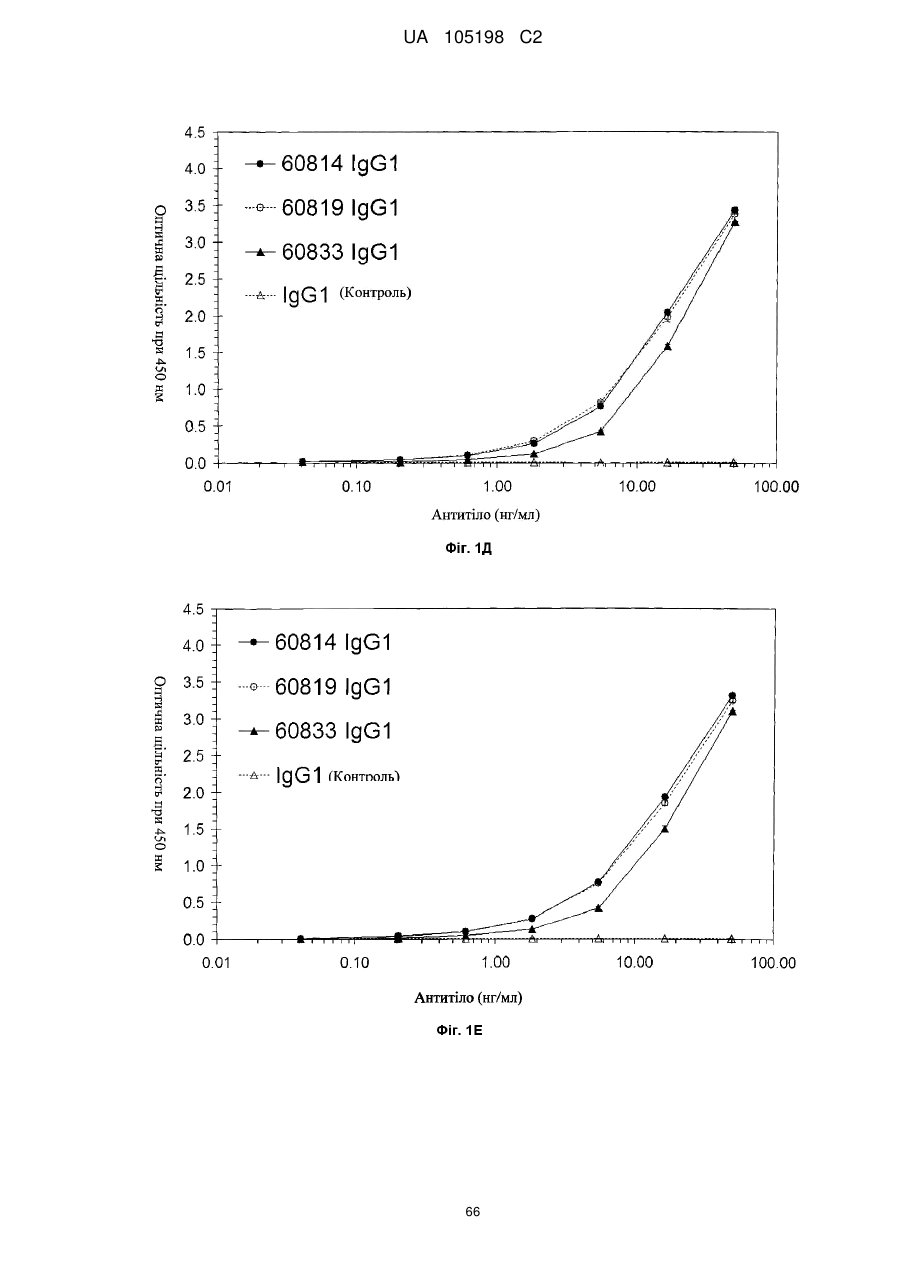
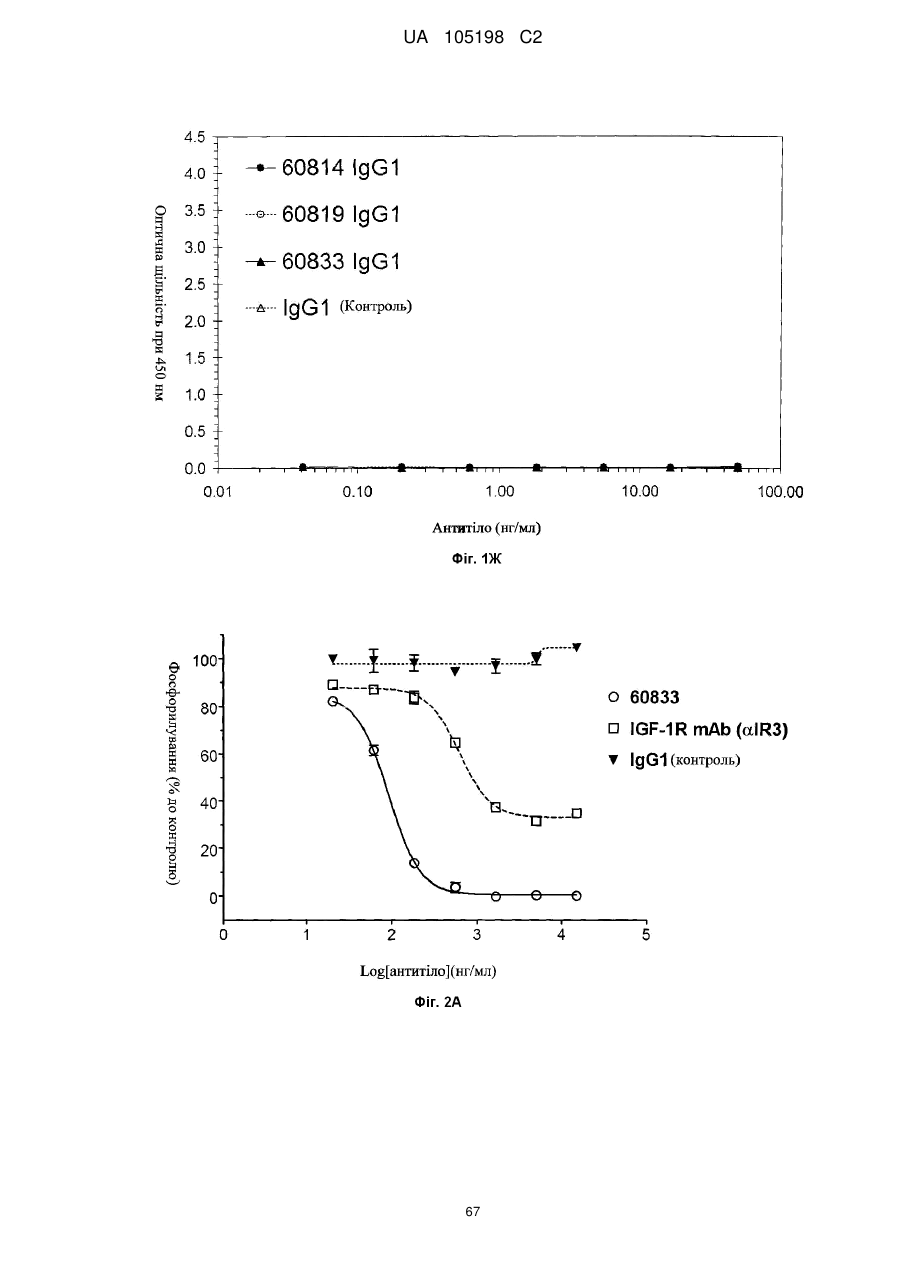
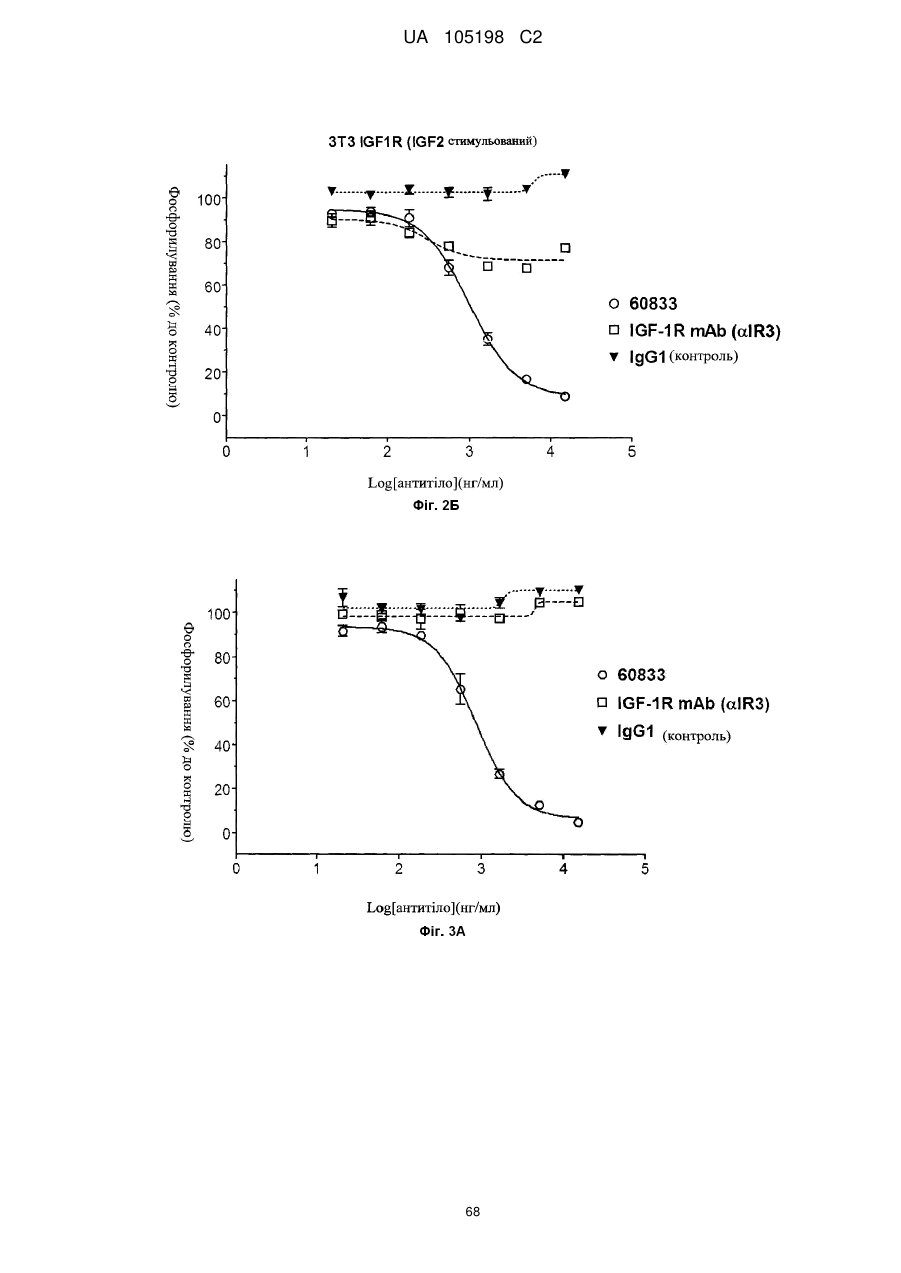
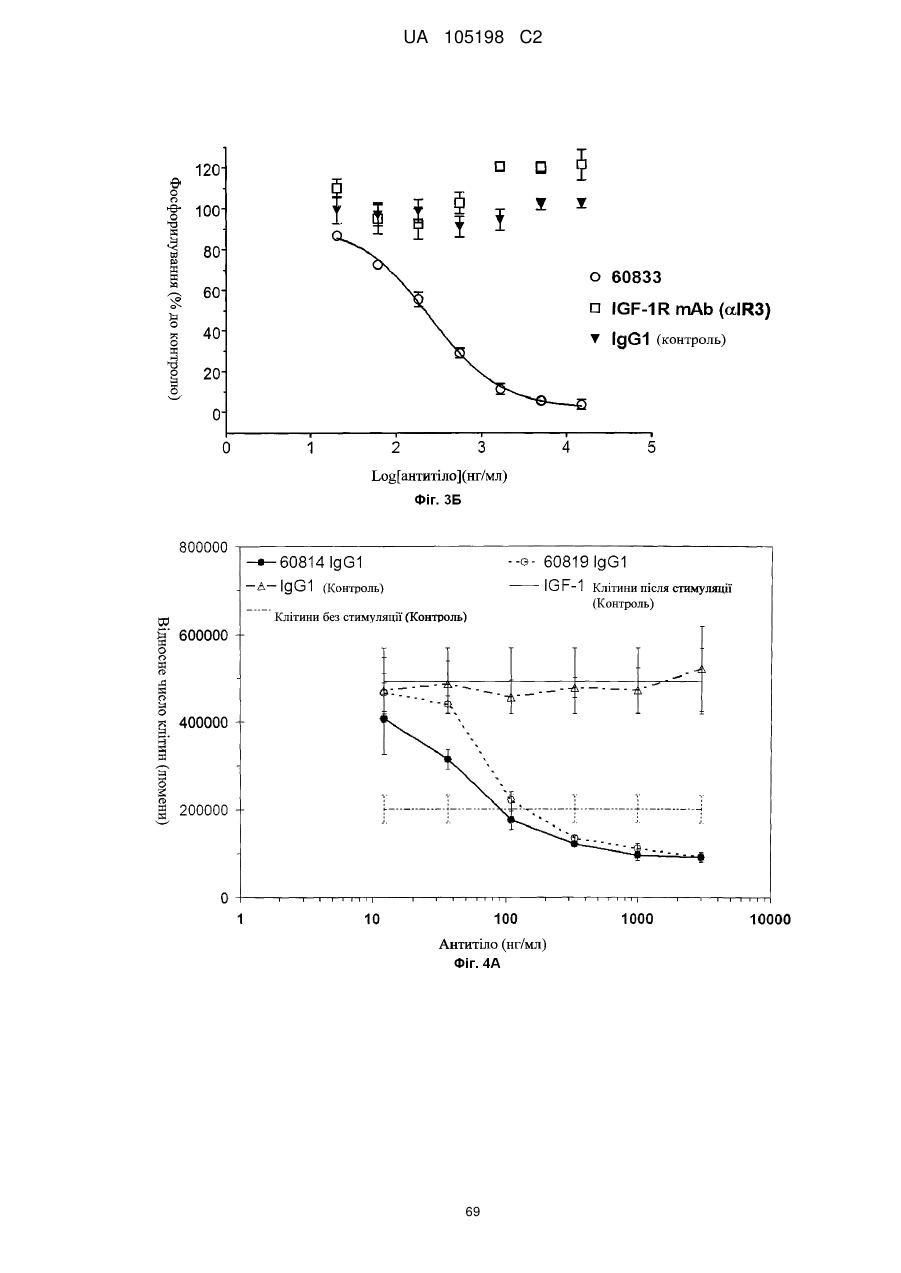
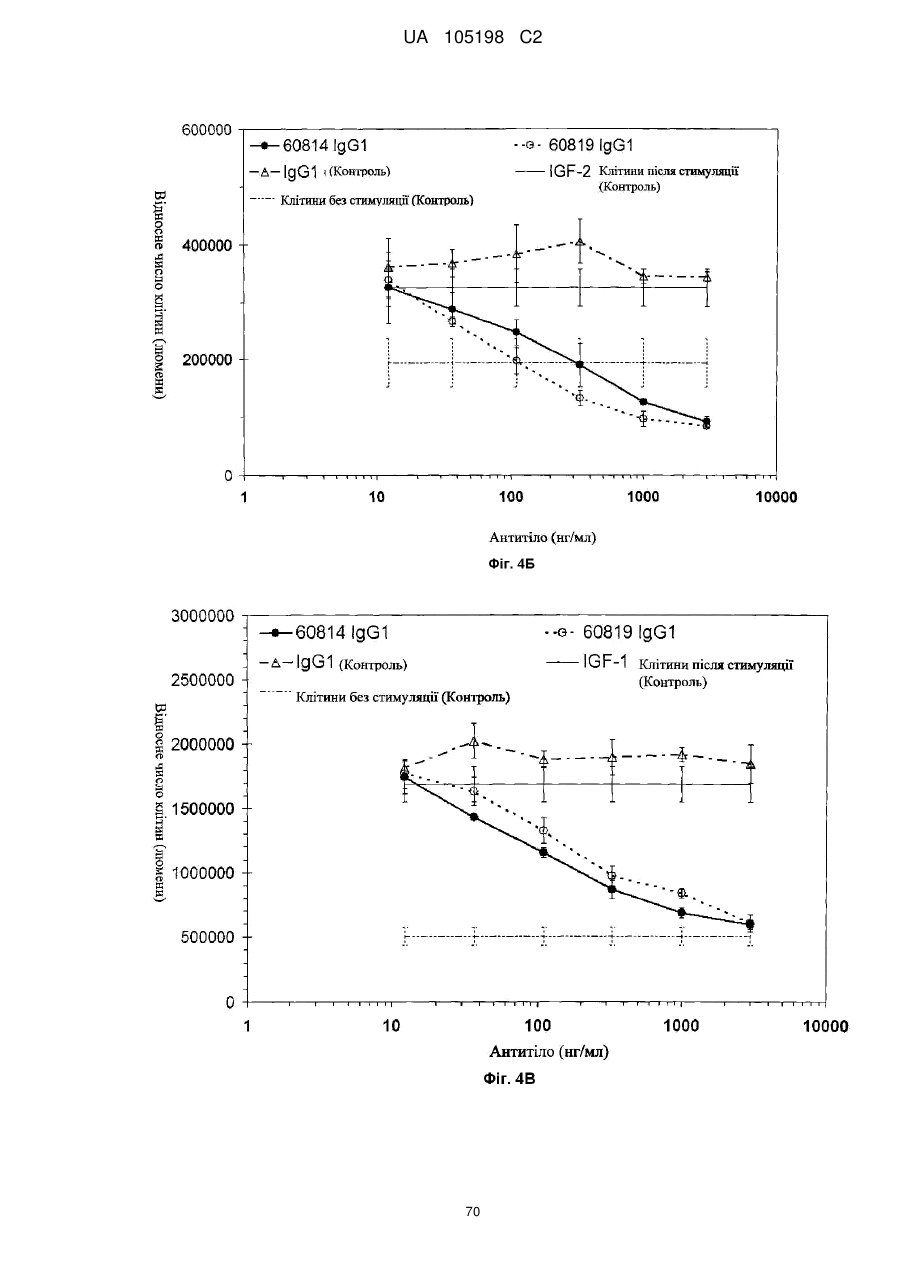
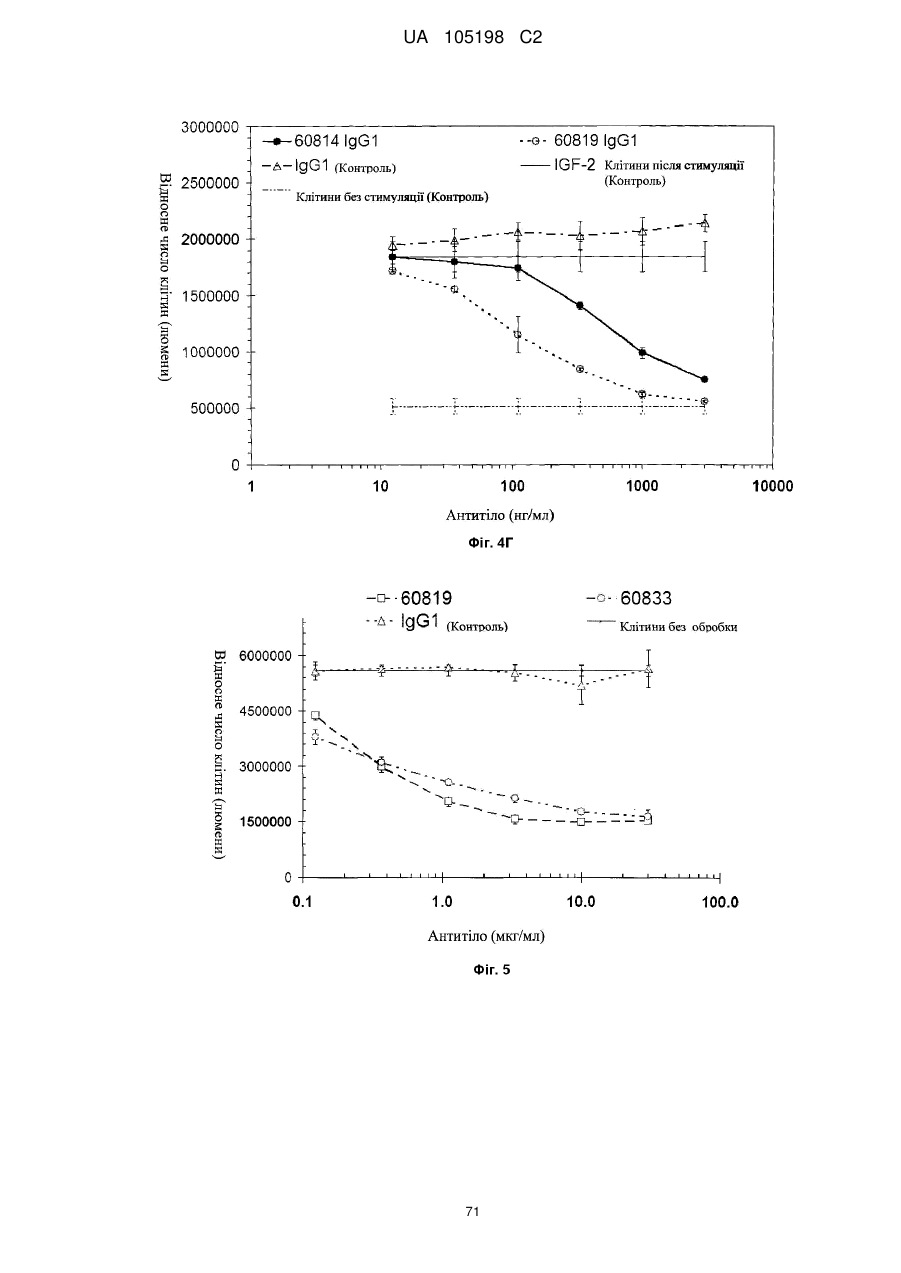
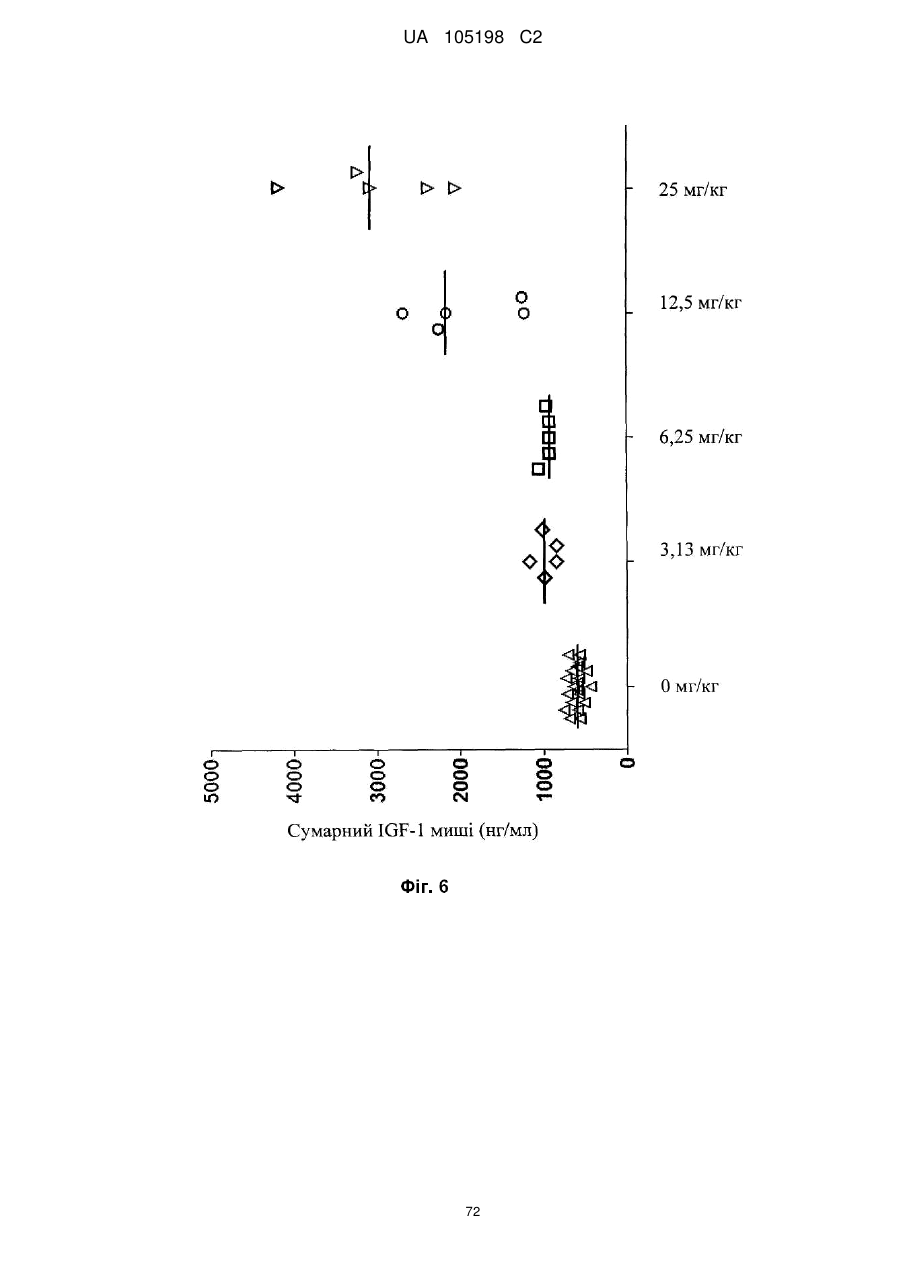
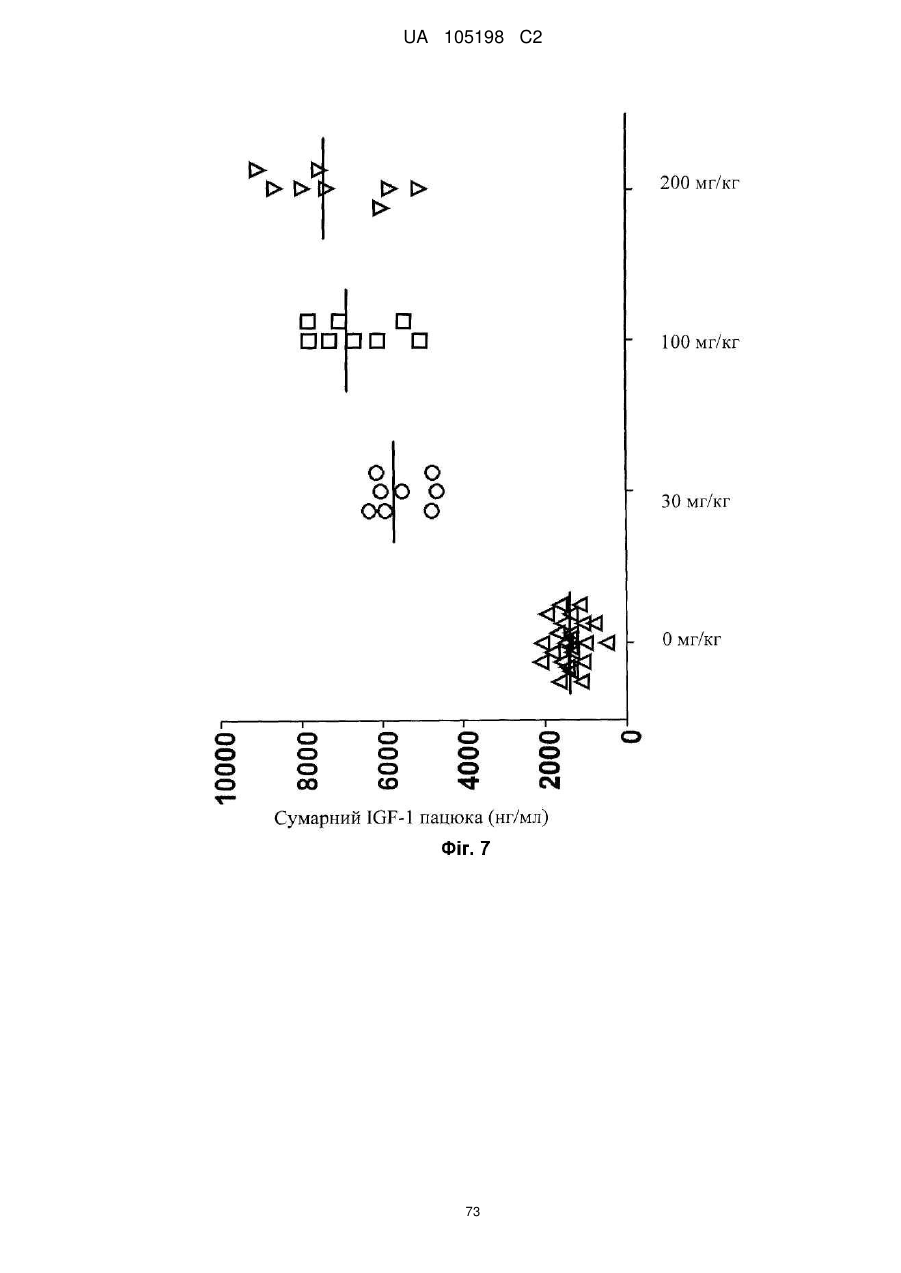
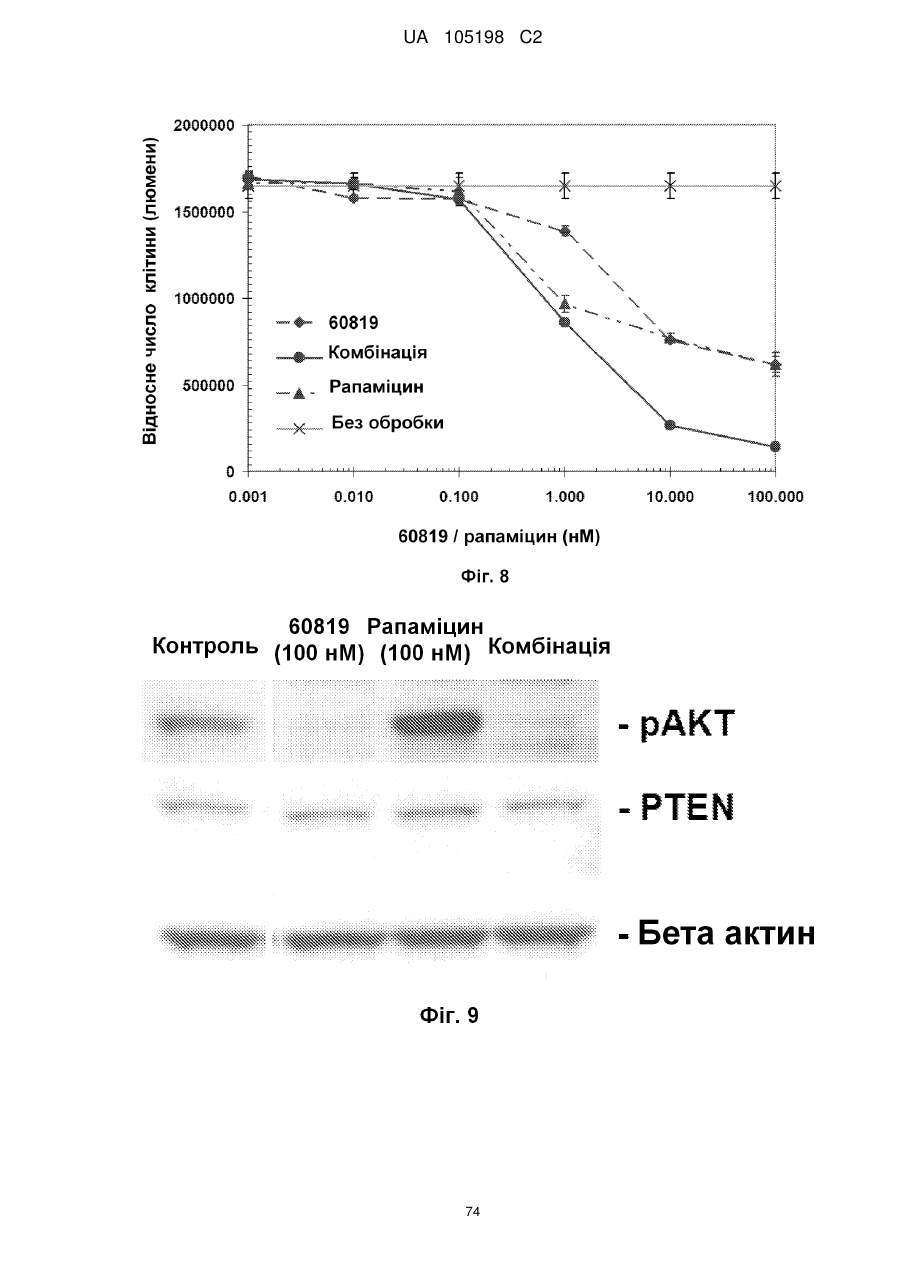
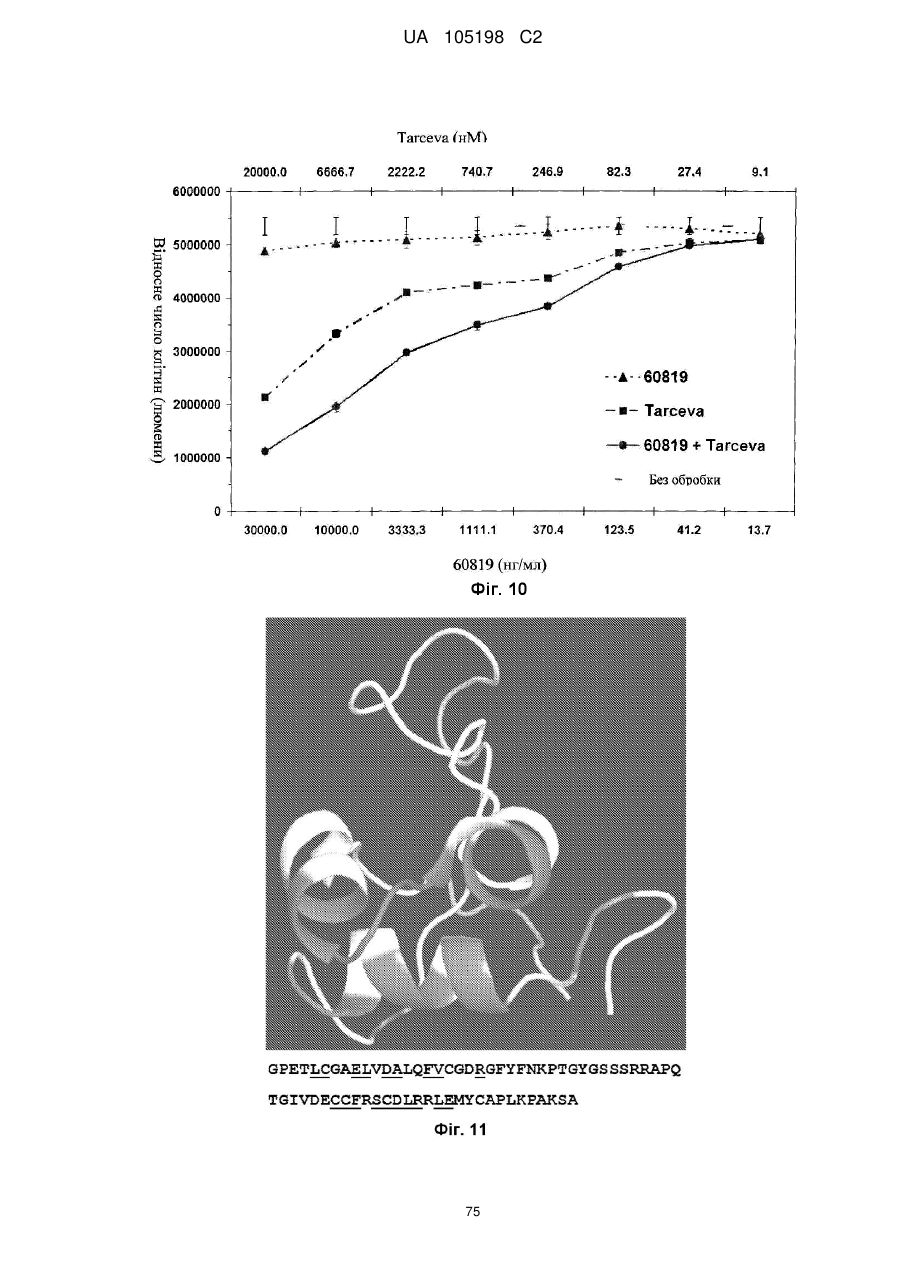
Антитіло проти інсуліноподібних факторів росту
Формула / Реферат
1. Виділена молекула антитіла людини, яка
а) зв'язується з інсуліноподібним фактором росту-1 (ІФР-1) та інсуліпоподібним фактором росту-2 (ІФР-2) таким чином, що
і) попереджується зв'язування ІФР-1 та ІФР-2 з рецептором ІФР-1, і
іі) придушується передача сигналу, опосередковувана рецептором ІФР-1,
б) зв'язується з ІФР-1 та ІФР-2 миші або пацюка,
в) не зв'язується з інсуліном людини;
причому зазначена молекула антитіла являє собою молекулу антитіла, яка містить області CDR важкого ланцюга, що включають амінокислотні послідовності SEQ ID NО:21 (CDR1), SEQ ID NO:22 (CDR2) і SEQ ID NO:23 (CDR3), і області CDR легкого ланцюга, що включають амінокислотні послідовності SEQ ID NO:24 (CDRl), SEQ ID NО:25 (CDR2) і SEQ ID NO:26 (CDR3).
2. Молекула анти-ІФР антитіла, де зазначена молекула антитіла містить області CDR важкого ланцюга, що включають амінокислотні послідовності SEQ ID NО:21 (CDRl), SEQ ID NO:22 (CDR2) і SEQ ID NO:23 (CDR3), і області CDR легкого ланцюга, що включають амінокислотні послідовності SEQ ID NО:24 (CDRl), SEQ ID NO:25 (CDR2) і SEQ ID NО:26 (CDR3).
3. Молекула антитіла за п. 1 або 2, яка містить варіабельний важкий ланцюг, що включає амінокислотну послідовність SEQ ID NО:28.
4. Молекула антитіла за п. 1 або 2, яка містить варіабельний легкий ланцюг, що включає амінокислотну послідовність SEQ ID NО:30.
5. Молекула антитіла за будь-яким з пп. 1-4, що включає константну область важкого ланцюга, вибрану з групи, що включає константні області IgG1, IgG2, IgG3, IgG4, IgM, IgA і IgE.
6. Молекула антитіла за п. 5, в якій зазначена константна область важкого ланцюга представлена константною областю IgGl, що включає амінокислотну послідовність SEQ ID NО:32.
7. Молекула антитіла за будь-яким з пп. 1-4, в якій константна область легкого ланцюга являє собою Igλ.
8. Молекула антитіла за п. 7, в якій константна область легкого ланцюга включає амінокислотну послідовність SEQ ID NO:34.
9. Молекула антитіла за п. 3 або п. 4, яка містить
а) важкий ланцюг, що включає амінокислотну послідовність SEQ ID NО:39, і
б) легкий ланцюг, що включає амінокислотну послідовність SEQ ID NО:40.
10. Молекула антитіла за будь-яким з пп. 1-4, що є Fab, F(ab')2 або одноланцюговим фрагментом Fv .
11. Молекула ДНК, яка кодує варіабельний важкий ланцюг або варіабельний легкий ланцюг молекули антитіла за будь-яким з пп. 1-10.
12. Молекула ДНК за п. 11, яка містить нуклеотидну послідовність SEQ ID NО:27, що кодує варіабельний важкий ланцюг антитіла, як визначено в п. 3.
13. Молекула ДНК за п. 11, яка містить нуклеотидну послідовність SEQ ID NО:29, що кодує варіабельний легкий ланцюг антитіла, як визначено в п. 4.
14. Вектор експресії, який містить молекулу ДНК, що включає нуклеотидну послідовність, яка кодує варіабельний важкий ланцюг і/або варіабельний легкий ланцюг молекули антитіла за будь-яким з пп. 1-10.
15. Вектор експресії за п. 14, який містить молекулу ДНК, що включає нуклеотидну послідовність SEQ ID NО:27 і/або SEQ ID NО:29.
16. Вектор експресії за п. 14 або п. 15, що включає, додатково, молекулу ДНК, яка кодує константний важкий ланцюг і/або константний легкий ланцюг, відповідно, зв'язану з молекулою ДНК, яка кодує варіабельний важкий ланцюг і/або варіабельний легкий ланцюг, відповідно.
17. Клітина-хазяїн, яка несе один або декілька векторів експресії за пп. 14, 15 або 16.
18. Клітина-хазяїн за п. 17, що є клітиною ссавця.
19. Спосіб одержання антитіла за будь-яким з пп. 1-10, що включає трансфектування клітини-хазяїна ссавця одним або декількома векторами за пп. 14-16, культивування клітини-хазяїна, виділення й очищення антитіла.
20. Спосіб одержання антитіла за будь-яким з пп. 1-10, що включає одержання клітини-хазяїна ссавця, що містить один або декілька векторів за пп. 14-16, і культивування клітини-хазяїна.
21. Спосіб за п. 20, що додатково включає виділення й очищення антитіла.
22. Молекула антитіла за будь-яким з пп. 1-10 для застосування у медицині.
23. Молекула антитіла за будь-яким з пп. 1-10 для застосування для лікування онкологічного захворювання, вибраного зі злоякісних захворювань системи кровотворення, що включає лейкози, лімфоми й мієломи; з раку шлунково-кишкового тракту, включаючи рак стравоходу, шлунка, товстої й прямої кишки, підшлункової залози, печінки, жовчного міхура й жовчних проток, зокрема гепатоклітинну карциному; з раку нирок, простати й сечового міхура; з гінекологічних злоякісних захворювань, включаючи рак грудей, яєчника, шийки матки й ендометрія; зі злоякісних захворювань шкіри, голови й шиї, включаючи злоякісні меланоми; з дитячих злоякісних захворювань, наприклад пухлини Вільмса, нейробластоми й
саркоми Юінга; зі злоякісних захворювань головного мозку, наприклад гліобластоми; із сарком, наприклад остеосаркоми, саркоми м'яких тканин, рабдоміосаркоми, гемангіосаркоми; з раку легень, зокрема недрібноклітинного раку легень; з мезотеліоми й раку щитовидки.
24. Молекула антитіла за п. 23, де лікарський засіб використовують у комбінації з хіміотерапією на основі платини, зокрема, з подвійною терапією паклітакселом/карбоплатином або гемцитабіном/цисплатином, сорафенібом або сполукою, вибраною з групи інгібіторів EGFR, VEGF, HER2-neu, AuroraB, Plkl, РІ3 кінази або mТоr.
25. Молекула антитіла за п. 24, де інгібітор mТоr являє собою рапаміцин, темсиролімус, дефороліміс або еверолімус.
26. Фармацевтична композиція, що включає молекулу антитіла за будь-яким з пп. 1-10, і фармацевтично прийнятний носій.
27. Фармацевтична композиція за п. 26, що додатково включає один або декілька терапевтичних агентів, вибраних із
а) агентів, що руйнують ДНК,
б) сполук терапевтичної дії, що придушують метаболічні шляхи сигнальної трансдукції або мітотичні контрольні точки у ракових клітинах,
в) антидіабетичних агентів.
28. Фармацевтична композиція за п. 27, в якій зазначена одна або декілька сполук із підпункту б) вибрана з групи інгібіторів EGFR, VEGF, HER2-neu, AuroraB, Plkl, РІ3 кінази або mТоr.
29. Фармацевтична композиція за будь-яким з пп. 26-28 для застосування для лікування онкологічного захворювання, вибраного зі злоякісних захворювань системи кровотворення, що включає лейкози, лімфоми й мієломи; з раку шлунково-кишкового тракту, включаючи рак стравоходу, шлунка, товстої й прямої кишки, підшлункової залози, печінки, жовчного міхура й жовчних проток, зокрема гепатоклітинну карциному; з раку нирок, простати й сечового міхура; з гінекологічних злоякісних захворювань, включаючи рак грудей, яєчника, шийки матки й ендометрія; зі злоякісних захворювань шкіри, голови й шиї, включаючи злоякісні меланоми; зі злоякісних захворювань дітей, наприклад пухлини Вільмса, нейробластоми й саркоми Юінга; зі злоякісних захворювань головного мозку, наприклад гліобластоми; зі сарком, наприклад остеосаркоми, саркоми м'яких тканин, рабдоміосаркоми, гемангіосаркоми; з раку легень, зокрема недрібноклітинного раку легень; з мезотеліоми й раку щитовидки.
30. Фармацевтична композиція за п. 29, яка додатково використовується у комбінації з хіміотерапією на основі платини, зокрема з подвійною платиновою терапією паклітакселом/карбоплатином або гемцитабіном/цисплатином, з сорафенібом, або зі сполукою, вибраною з групи інгібіторів EGFR, VEGF, HER2-neu, AuroraB, Plkl, РІ3 кінази або mТоr.
31. Спосіб придушення зв'язування ІФР-І та 1ФР-2 з рецептором ІФР-1 in vitro у клітинах ссавця, що включає введення у зазначені клітини молекули антитіла за будь-яким з пп. 1-10, відповідно до чого придушується передача сигналу, опосередкована рецептором ІФР-1, проліферація й анти-апоптоз, опосередковані ІФР-1 та ІФР-2.
32. Спосіб придушення зв'язування ІФР-2 з рецептором інсуліну ІР-А in vitro у клітинах ссавців, що включає введення у зазначені клітини молекули антитіла за будь-яким з пп. 1-10, при цьому придушується передача сигналу, опосередкована рецептором інсуліну ІР-А, і таким чином придушується проліферація й анти-апоптоз, опосередковані ІФР-2.
33. Спосіб моніторингу ефективності лікування хворого на рак молекулою антитіла, що зв'язується з ІФР-1 та ІФР-2, де зазначена молекула антитіла являє собою молекулу антитіла за будь-яким з пп. 1-10, де зазначений спосіб включає
(а) вимірювання у біологічному зразку зазначеного пацієнта рівня сумарного фактора ІФР-І,
(б) введення зазначеному пацієнтові зазначеної молекули анти-ІФР антитіла,
(в) вимірювання у біологічному зразку зазначеного пацієнта рівня сумарного фактора ІФР-1, причому величина підвищення рівня сумарного фактора ІФР-І, у порівнянні з рівнем сумарного фактора ІФР-1, вимірюваного на стадії (а), показує, до якого ступеня пацієнт відповідає на лікування зазначеною молекулою анти-ІФР антитіла.
Текст
і Glu (58) фактора ІФР-1 людини (SEQ ID NO:43), що випливає з результатів рентгеноструктурної кристалографії. Відповідний спосіб описаний у даному винаході у прикладі 9. Переважно молекула зазначеного антитіла містить області CDR важкого ланцюга, що включають амінокислотні послідовності SEQ ID NO:21 (CDR1), SEQ ID NO:22 (CDR2) і SEQ ID NO:23 (CDR3) і області CDR легкого ланцюга, що включають амінокислотні послідовності SEQ ID NO:24 (CDR1), SEQ ID NO:25 (CDR2) і SEQ ID NO:26 (CDR3). Зв'язування антитіла визначають у вигляді взаємодії через нековалентні зв'язки, які втримують антиген (або білок або його фрагмент, близький за структурою) із сайтом об'єднання з антитілом, тобто з областю імуноглобуліну, що поєднується з детермінантом відповідного антигену (або структурно близького білка). Спорідненість (тобто взаємодія між одним сайтом зв'язування антигену й одним епітопом) виражається константою асоціації (association constant) KA=kass/kdiss або константою дисоціації (dissociation constant) KD=kdiss/kass. В одному з об'єктів даного винаходу за пунктом a) антитіло зв'язується з кожним білком ІФР зі спорідненістю, обумовленою методом поверхневого плазмонного резонансу, з величиною K D, що варіює від 0,02 нМ до 20 нМ, наприклад, від 0,2 нМ дo 2 нМ, наприклад, зі спорідненістю 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 або 1,0 нМ. Ґрунтуючись на цій властивості, досягають нейтралізації функціональної передачі сигналу ІФР. В одному з об'єктів даного винаходу за пунктом б) антитіло не зв'язується з інсуліном людини у концентраціях, які щонайменше у 100 разів вище, ніж мінімальна концентрація, необхідна для зв'язування з ІФР-1 або ІФР-2 людини. В іншому об'єкті даного винаходу властивість молекули анти-ІФР антитіла за пунктом в) відрізняється тим, що спорідненість молекули анти-ІФР антитіла до ІФР-1 та ІФР-2, відповідно, становить щонайменше 100-кратну й навіть більше ніж 1000-кратну величину у порівнянні з її спорідненістю з інсуліном. Однак проте у дуже високих дозах, наприклад, більше 100 мг/кг, не можна повністю виключати слабкого зв'язування, але молекула анти-ІФР антитіла не зв'язується з інсуліном у терапевтичних дозах. В одному з варіантів здійснення даного винаходу молекули антитіла за даним винаходом не впливають на мітогенні властивості інсуліну людини, які опосередковуються його зв'язуванням з рецептором інсуліну. (Загалом, мітогенну властивість визначають у вигляді властивій сполуці якості, що сприяє клітині ділитися, індукуючи мітоз, наприклад, у випадку інсуліну це його здатність індукувати ріст клітин). В іншому варіанті здійснення даного винаходу крім здатності придушувати опосередковану ІФР передачу сигналу через рецептор ІФР-1, антитіло за даним винаходом також має здатність придушувати передачу сигналу через ІФР-2 через рецептор інсуліну ІР-A. Антитіла за даним винаходом мають зненацька високу нейтралізуючу здатність у відношенні ІФР-1 та ІФР-2. Крім того, вони мають зненацька підвищену активність та єднальну спорідненість у відношенні ІФР-1, але не у відношенні ІФР-2. Вони мають високу розчинність і стабільність, у них відсутні небажані мотиви для глікозилування або гідролізу у варіабельному домені й вони мають тривалий період напіврозпаду при циркуляції в організмі. Докладний опис винаходу У наступному описі молекула антитіла, яка зв'язується з ІФР-1 та ІФР-2 людини, називається "молекулою анти-ІФР антитіла". Поняття "молекула анти-ІФР антитіла" охоплює анти-ІФР антитіла людини, фрагменти антиІФР антитіл, молекули типу анти-ІФР антитіл і кон'югати з якими-небудь зазначеними вище молекулами антитіл. До антитіл у рамках даного винаходу відносяться, але ними не обмежуються, моноклональні, химерні моноклональні й дво- або поліспецифічні антитіла. Поняття "антитіло" включає повні імуноглобуліни, вироблювані лімфоцитами, і, наприклад, присутні у сироватці, моноклональні антитіла, секретовані лініями гібридомних клітин, поліпептиди, вироблювані шляхом рекомбінантної експресії у клітинах-хазяїнах, які мають єднальну специфічність імуноглобулінів або моноклональних антитіл, і молекули, похідні від 5 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 таких імуноглобулінів, моноклональні антитіла або поліпептиди, що піддаються додатковому процесуванню, за умови, що вони зберігають єднальну специфічність. Зокрема, поняття "молекула антитіла" переважно включає імуноглобуліни, які є повністю імуноглобулінами людини, що включають два важких ланцюги й два легких ланцюга. В іншому варіанті здійснення даного винаходу молекула антитіла є фрагментом анти-ІФР антитіла, що містить область зв'язування антигену. Для одержання фрагментів антитіла, наприклад, фрагментів Fab, може проводитися розщеплення звичайними методами, наприклад, використовуючи папаїн або пепсин. Приклади розщеплення папаїном описані у WO 94/29348 і US 4342566. При розщепленні антитіл папаїном звичайно одержують два ідентичних фрагменти, що зв'язують антиген, так званих фрагмента Fab, кожний з єдиним сайтом зв'язування антигену, і залишковий фрагмент Fc. Після обробки пепсином одержують фрагмент F(ab')2, що має два сайти об'єднання з антигеном і зберігає здатність перехресного зв'язування антигену. Фрагменти антитіла також можуть бути отримані методами молекулярної біології, у ході яких одержують відповідні фрагменти ДНК, що кодують. Фрагменти Fab також містять константні домени легкого ланцюга й перший константний домен (CH1) важкого ланцюга. Фрагменти Fab' відрізняються від фрагментів Fab тим, що вони містять додаткові залишки з карбокси-кінця домену CH1 важкого ланцюга, включаючи один або декілька цистеїнів із шарнірної області антитіла. Позначення "Fab'-SH" у контексті даного винаходу відноситься до фрагмента Fab', у якому залишок (залишки) цистеїну у константних доменах несуть вільну тіолову групу. Фрагменти антитіла F(ab')2 споконвічно одержують у вигляді пари фрагментів Fab', що містять між ними шарнірні цистеїни. Фрагменти антигенсполучних антитіл або антитіло-подібні молекули, у тому числі одноланцюгові антитіла й лінійні антитіла, описані Zapata та ін., 1995, можуть містити в одному поліпептиді варіабельну область (області) окремо або у комбінації з цілими сполуками або їх частинами: з константним доменом легкого ланцюга, CH1, з шарнірною областю, з доменами CH2 і CH3, наприклад, з так званими низькомолекулярними імунофармацевтичними агентами ("SMIP – Small Modular Immunopharmaceutical), які є антитіло-подібними молекулами, що містять одноланцюговий поліпептидний ланцюг як єднальний домен Fv, що зв'язується з одноланцюговим шарніром і ефекторними доменами без константного домену CH1 (WO 02/056910). Низькомолекулярні імунофармацевтичні агенти можуть бути отримані як мономери або димери, але не димери димерних структур традиційних антитіл. До даного винаходу також відносяться фрагменти зв'язування антитіл, що включають яку-небудь комбінацію варіабельної області (областей) з областю константного домену легкого ланцюга, VH1, CH1, з шарнірною областю, CH2 і CH3 доменами. Фрагменти антитіла або антитіло подібні молекули можуть містити всі або тільки частину константної області такої довжини, що дозволяє їм проявляти специфічне зв'язування з релевантною частиною антигену ІФР-1/ІФР-2. Вибір типу або довжини константної області залежить, якщо немає потреби в ефекторних функціях типу фіксації комплементу або антитіло залежної клітинної токсичності, переважно від необхідних фармакологічних властивостей білка антитіла. Звичайно молекула антитіла представляє тетрамер, що складається з двох пар легкого ланцюга/важкого ланцюга, але також може бути димером, тобто представляти пару легкого ланцюга/важкого ланцюга, наприклад, фрагмент Fab або Fv, або вона може бути мономерним одноланцюговим антитілом (scFv). Анти-ІФР антитіло подібні молекули також можуть бути однодоменними антитілами (наприклад, так званими "нанотілами"), що несуть сайт зв'язування антигену в одному Ig-подібному домені (описаному, наприклад, у WO 03/050531 і у публікації Revets та ін., 2005). Іншими прикладами антитіло подібних молекул є антитіла суперсімейства імуноглобулінів (immunoglobulin super family antibodies – IgSF; Srinivasan і Roeske, 2005), або CDR-вмісні або CDR-пересаджені молекули, або "доменні антитіла (Domain Antibody – dAb)». Доменні антитіла є функціонально єднальними одиницями антитіл, що відповідають варіабельним областям або важких ланцюгів (VH), або легких ланцюгів (VL) антитіл людини. Молекулярна маса доменних антитіл приблизно становить 13 кДа або менше 1/10 розміру цілого антитіла. Створено серію великих і високо функціональних бібліотек VH і VL dAb, які повністю належать людині. Доменні антитіла також застосовні для "подвійного націлювання", тобто вони зв'язуються, крім ІФР1/ІФР-2, також з іншою мішенню в одній молекулі. Бібліотеки dAb, методи добору й скринінгу, формати dAb для подвійного націлювання й для забезпечення продовженого періоду напіврозпаду у сироватці описані, наприклад, в US 6696245, WO 04/058821, WO 04/003019 і WO 03/002609. У цілому фрагменти антитіл і антитіло подібні молекули успішно експресуються у бактеріях, дріжджах і клітинних системах ссавців. 6 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 У кращому варіанті здійснення даного винаходу молекула антитіла за даним винаходом, відповідно до зазначеного вище у пункті i), має варіабельний важкий ланцюг, що включає амінокислотну послідовність SEQ ID NO:8 і варіабельний легкий ланцюг, що включає амінокислотну послідовність SEQ ID NO:10 (ця послідовність може включати з С-кінця додатковий Gln. Таке положення амінокислоти може розглядатися або в якості С-кінця варіабельної області, за нумерацією Kabat, або, в іншому варіанті, і відповідно до послідовностей у переліку послідовностей, воно може представляти першу амінокислоту константної області легкого ланцюга, див. SEQ ID NO:34). Краще антитіло з варіабельним важким ланцюгом, що включає амінокислотну послідовність SEQ ID NO:8, і варіабельним легким ланцюгом, що включає амінокислотну послідовність SEQ ID NO:10, містить константну область важкого ланцюга IgG1. Переважно таке антитіло є антитілом, позначуваним 60814, яке містить константну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO:32, і константну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO:34. Повні амінокислотні послідовності антитіла, позначеного 60814, представлені у послідовності SEQ ID NO:35 (важкого ланцюга) і у послідовності SEQ ID NO:36 (легкого ланцюга). В іншому кращому варіанті здійснення даного винаходу молекула антитіла за даним винаходом, зазначена вище у пункті ii), містить варіабельний важкий ланцюг, що включає амінокислотну послідовність SEQ ID NO:18, і варіабельний легкий ланцюг, що включає амінокислотну послідовність SEQ ID NO:20 (ця послідовність може включати з С-кінця додатковий Gln. Таке положення амінокислоти може розглядатися або в якості С-кінця варіабельної області, за нумерацією Kabat, або, в іншому варіанті, і відповідно до послідовностей у переліку послідовностей, воно може представляти першу амінокислоту константної області легкого ланцюга, див. SEQ ID NO:34). Краще антитіло з варіабельним важким ланцюгом, що включає амінокислотну послідовність SEQ ID NO:18, і з варіабельним легким ланцюгом, що включає амінокислотну послідовність SEQ ID NO:20, містить константну область важкого ланцюга IgG1. Переважно таке антитіло містить константну область легкого ланцюга Igλ. Переважно таке антитіло є антитілом, позначеним 60819, яке містить константну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO:32, і константну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO:34. Повні амінокислотні послідовності антитіла, позначеного 60819, представлені у послідовності SEQ ID NO:37 (важкого ланцюга) і у послідовності SEQ ID NO:38 (легкого ланцюга). В іншому кращому варіанті здійснення даного винаходу молекула антитіла за даним винаходом, зазначений вище у пункті iii), містить варіабельний важкий ланцюг, що включає амінокислотну послідовність SEQ ID NO:28, і варіабельний легкий ланцюг, що включає амінокислотну послідовність SEQ ID NO:30 (ця послідовність може включати з С-кінця додатковий Gln. Таке положення амінокислоти може розглядатися або в якості С-кінця варіабельної області, за нумерацією Kabat, або, в іншому варіанті, і відповідно до послідовностей у переліку послідовностей, воно може представляти першу амінокислоту константної області легкого ланцюга, див. SEQ ID NO:34). Краще антитіло з варіабельним важким ланцюгом, що включає амінокислотну послідовність SEQ ID NO:28, і з варіабельним легким ланцюгом, що включає амінокислотну послідовність SEQ ID NO:30, містить константну область важкого ланцюга IgG1. Переважно таке антитіло містить константну область легкого ланцюга Igλ. Переважно таке антитіло є антитілом, позначеним 60833, яке містить константну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO:32, і константну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO:34. Повні амінокислотні послідовності антитіла, позначеного 60833, представлені у послідовності SEQ ID NO:39 (важкого ланцюга) і у послідовності SEQ ID NO:40 (легкого ланцюга). Перехресна реакційна здатність антитіл за даним винаходом з ІФР-1 миші й пацюка дозволяє перевірити їх ендокринні прояви, наприклад, вплив на метаболічний шлях гормону росту, у цих видів. Перехресна реакційна здатність з факторами ІФР пацюка особливо краща, оскільки пацюк є чудовою моделлю, яку переважно використовують при розробці лікарських засобів для вивчення токсикологічних проявів. Спостережуваний фармакодинамічний вплив антитіл на рівні сумарного ІФР-1, ймовірно через видалення вільного ІФР-1, що приводить до регуляції за типом зворотного зв'язку за метаболічним шляхом гормону росту, що приводить до підвищеної секреції ІФР-1 у печінці, є корисним фармакодинамічним маркером. Наявність такого маркера у тварин, що дозволяє 7 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 визначити взаємозв'язок дози/відповіді на ранньому етапі розробки лікарського засобу, полегшує проведення першої фази клінічних досліджень, в яких крім фармакокінетичного аналізу піддають моніторингу фармакодинамічну відповідь на сумарні рівні ІФР-1 у пацієнтів. Молекула анти-ІФР антитіла за даним винаходом також може бути варіантом антитіла, представленого амінокислотними послідовностями у переліку послідовностей. Таким чином, даний винахід також відноситься до антитіл, які є варіантами таких поліпептидів, яким властиві ознаки, зазначені вище у пунктах від а) до в). Використовуючи звичайні методи, фахівець у даній галузі може одержати, досліджувати й використовувати функціональні варіанти антитіл 60814, 60819 і 60833. Прикладами є варіанти антитіл, у яких змінене щонайменше одне положення у CDR і/або каркасній ділянці, варіанти антитіл з одиничними амінокислотними заміщеннями в області каркасної ділянки, де є відхилення від послідовності зародкової лінії, антитіла зі заміщеннями консервативних амінокислот, антитіла, які кодуються молекулами ДНК, які гібридизуються у жорстких умовах з молекулами ДНК, що перебувають у переліку послідовностей, які кодують варіабельні ланцюги антитіл 60814, 60819 або 60833, функціонально еквівалентних оптимізованим за кодонами варіантам антитіл 60814, 60819 і 60833. Варіант також може бути отриманий, використовуючи антитіло за даним винаходом як стартова точка для оптимізації й модифікування одного або декількох амінокислотних залишків, переважно амінокислотних залишків в одній або декількох областях CDR, і шляхом скринінгу одержуваної колекції варіантів антитіл із поліпшеними властивостями. Найбільше краща модифікація одного або декількох амінокислотних залишків в області CDR3 варіабельного легкого ланцюга, області CDR3 варіабельного важкого ланцюга, області CDR1 варіабельного легкого й/або CDR2 варіабельного важкого ланцюга. Модифікація може бути виконана методами, відомими у даній галузі, наприклад, так званим методом TRIM, описаним у WO 2007/042309. Маючи відомості за окремими амінокислотами, можна зробити раціональні заміщення для одержання варіантів антитіл, які зберігають загальну молекулярну структуру антитіл 60814, 60819 або 60833. Амінокислотні заміщення, тобто "консервативні заміщення", можуть бути зроблені, наприклад, на основі подібності у полярності, заряді, розчинності, гідрофобності, гідрофільності й/або амфіпатичної природі відповідної амінокислоти. Фахівцям відомі звичайно практиковані амінокислотні заміщення, наприклад, описані у WO 2007/042309, і методи одержання модифікованих у такий спосіб антитіл. За допомогою генетичного коду й методів синтезу й рекомбінації ДНК можуть бути отримані звичайним способом молекули ДНК, що кодують варіанти антитіл із одним або декількома консервативними амінокислотними заміщеннями, і легко отримані відповідні антитіла. Кращі варіанти антитіл мають ідентичність послідовності у варіабельних областях щонайменше на 60 %, більше переважно щонайменше на 70 % або 80 %, ще більше переважно щонайменше на 90 % і найбільше переважно щонайменше на 95 %. Кращі антитіла також мають подібність послідовностей у варіабельних областях щонайменше на 80 %, більше переважно на 90 % і найбільше переважно на 95 %. (Поняття "ідентичності послідовностей" стосовно до двох поліпептидних послідовностей означає відсоток ідентичних амінокислот у цих двох послідовностях. Поняття "подібності послідовностей" означає відсоток ідентичних амінокислот або консервативних амінокислотних заміщень.) В іншому варіанті здійснення даного винаходу молекула анти-ІФР антитіла за даним винаходом означає антитіло зі "спорідненістю, що сформувалася". Анти-ІФР антитілом зі "спорідненістю, що сформувалася" є анти-ІФР антитіло, похідне від вихідного анти-ІФР антитіла, наприклад, антитіла 60814, 60819 або 60833, що має один або декілька інших варіантів в одній або декількох областях CDR або в якому одна або декілька повних областей CDR заміщені, що приводить до поліпшення спорідненості з антигенами у порівнянні з відповідним вихідним антитілом. Один із методів одержання таких мутантних антитіл включає фаговий дисплей (Hawkins та ін., 1992; Lowman та ін., 1991). Коротенько, декілька сайтів у гіперваріабельній області (наприклад, 6-7 сайтів) мутовані для одержання всіх можливих амінокислотних заміщень у кожному сайті. Отримані таким способом антитіла відбиваються у моновалентній формі на частках нитчастих фагів як гібриди з продуктом гена III фага M13, упакованих у кожній частці.Мутантні фаги, отримані методом фагового дисплея, потім піддають скринінгу для виявлення біологічної активності (наприклад, сполучної спорідненості) відповідно до описаного у даному винаході. Антитіла зі спорідненістю, що сформувалася, також можуть бути отримані методами, описаними, наприклад, Marks та ін., 1992 (спорідненість, що сформувалася, шляхом 8 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 перетасування доменів варіабельного важкого ланцюга (VH) і варіабельного легкого ланцюга (VL)), або Barbas та ін., 1994; Shier та ін., 1995; Yelton та ін., 1995; Jackson та ін., 1995; і Hawkins та ін., 1992 (випадковий мутагенез залишків в області CDR і/або у каркасній ділянці). Кращі антитіла зі спорідненістю, що сформувалася, можуть мати дуже високу спорідненість, наприклад, виражену у пікомолях, для антигену-мішені. Даний винахід також відноситься до молекул ДНК, які кодують молекулу анти-ІФР антитіла за даним винаходом. Такі послідовності включають, але ними не обмежуються, ті молекули ДНК, що кодують антитіла 60814, 60819 і 60833, які зазначені у переліку послідовностей: SEQ ID NO:7 і SEQ ID NO:9, відповідно, кодуючі варіабельні важкий й легкий ланцюги, відповідно, антитіла 60814; SEQ ID NO:17 і SEQ ID NO:19, кодуючі варіабельні важкий й легкий ланцюги, відповідно, антитіла 60819; SEQ ID NO:27 і SEQ ID NO:29, кодуючі варіабельні важкий й легкий ланцюги, відповідно, антитіла 60833. Послідовності SEQ ID NO:9, SEQ ID NO:19 і 29, кодуючі варіабельні легкі ланцюги, можуть з 3’-кінця містити додатковий кодон, що відповідає Gln. Таким чином, даний винахід також відноситься до молекул нуклеїнової кислоти, які гібридизуються з молекулами ДНК, представленими нижче у переліку послідовностей, у дуже жорстких умовах зв'язування й промивання, наприклад, описаних у WO 2007/042309, де такі молекули нуклеїнових кислот кодують антитіло або його функціональний фрагмент, які мають властивості, рівні або переважаючі властивості антитіл 60814, 60819 або 60833. Кращими молекулами (відносно іРНК) є ті, які мають щонайменше на 70 % або 80 % (переважно щонайменше на 85 %, більше переважно щонайменше на 90 % і найбільше переважно щонайменше на 95 %) гомологію або ідентичність послідовностей з однієї з молекул ДНК, описаних у даному винаході. Варіанти ДНК ще одного класу, що перебувають у рамках охоплення даного винаходу, можуть бути визначені за поліпептидами, які вони кодують. Такі молекули ДНК мають відхилення у структурі послідовності від тих ДНК, які представлені у переліку послідовностей (послідовності SEQ ID NO:7, 17 і 27, або 9, 19, 29, відповідно), але вони кодують через виродженість генетичний код антитіла з ідентичними амінокислотними послідовностями антитіл 60814, 60819 або 60833, відповідно. За допомогою прикладу, беручи до уваги експресію антитіл 60814, 60819 або 60833 в еукаріотичних клітинах, останні дев'ять нуклеотидів, які, відповідно, кодують останні три амінокислоти варіабельних легких ланцюгів, можуть бути сконструйовані так, щоб відповідати застосуванню кодів в еукаріотичних клітинах. Якщо потрібно експресувати антитіла в E. coli, ці послідовності можуть бути змінені, щоб відповідати застосуванню кодонів в E. coli. Варіанти молекул ДНК за даним винаходом можуть бути сконструйовані декількома різними способами, відповідно до опису у WO 2007/042309. Для одержання молекул рекомбінантних анти-ІФР антитіл за даним винаходом молекули ДНК (кДНК і/або геномної ДНК), які кодують легкий ланцюг повної довжини (у випадку антитіла 60814 послідовність включає SEQ ID NO:9 і SEQ ID NO:33) і важкий ланцюг (у випадку антитіла 60814 послідовність включає SEQ ID NO:7 і SEQ ID NO:31) або їх фрагменти, інсертовані у вектори експресії таким чином, що послідовності оперативно пов'язані з послідовностями контролю транскрипції й/або трансляції. У випадку антитіла 60819 послідовностями є SEQ ID NO:19 і SEQ ID NO:33, і SEQ ID NO:17 і SEQ ID NO:31, відповідно, у випадку антитіла 60833 послідовностями є SEQ ID NO:29 і SEQ ID NO:33, і SEQ ID NO:27 і SEQ ID NO:31, відповідно. Для одержання антитіл за даним винаходом фахівець може вибрати систему з великої кількості різноманітних систем, відомих у даній галузі, наприклад, наведених в огляді Kipriyanow і Le Gall, 2004. Інший об'єкт даного винаходу відноситься до вектора експресії, що містить молекулу ДНК, що включає нуклеотидну послідовність, яка кодує варіабельний важкий ланцюг і/або варіабельний легкий ланцюг молекули антитіла відповідно до описаного вище. Переважно такий вектор експресії містить молекулу ДНК, що включає нуклеотидну послідовність SEQ ID NO:7 і/або SEQ ID NO:9, або що включає нуклеотидну послідовність SEQ ID NO:17 і/або SEQ ID NO:19, або що включає нуклеотидну послідовність SEQ ID NO:27 і/або SEQ ID NO:29. Переважно такий вектор експресії додатково містить молекулу ДНК, що кодує константний важкий ланцюг і/або константний легкий ланцюг, відповідно, пов'язану з молекулою ДНК, яка кодує варіабельний важкий ланцюг і/або варіабельний легкий ланцюг, відповідно. Вектори експресії включають плазміди, ретровіруси, косміди, похідні від EBV епісоми тощо. Вектор експресії й послідовності контролю експресії вибрані таким чином, щоб вони були сумісні з клітиною-хазяїном. Ген легкого ланцюга антитіла й ген важкого ланцюга антитіла можуть бути інсертовані у різні вектори. У деяких варіантах здійснення даного винаходу обидві послідовності 9 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 ДНК інсертовані у той самий вектор. Застосовні ті вектори, які кодують функціонально сумісну послідовність імуноглобуліну, що повністю є послідовністю людини, CH (константну послідовність важкого ланцюга) або CL (константну послідовність легкого ланцюга) послідовності імуноглобуліну, з відповідними сайтами рестрикції, сконструйованими таким чином, що яка-небудь послідовність VH (варіабельна послідовність важкого ланцюга) або VL (варіабельна послідовність легкого ланцюга) може бути легко інсертована й експресована, відповідно до описаного вище. У випадку антитіл із варіабельними областями антитіл 60814, 60819 і 60833, константним ланцюгом звичайно є ланцюг каппа або лямбда для легкого ланцюга антитіла, а для важкого ланцюга антитіла нею може бути, але ними перелік не обмежується, який-небудь ізотип IgG (IgG1, IgG2, IgG3, IgG4) або інші імуноглобуліни, включаючи алельні варіанти. Рекомбінантний вектор експресії також може кодувати сигнальний пептид, що полегшує секрецію ланцюга антитіла з клітини-хазяїна. ДНК, що кодує ланцюг антитіла, можна клонувати у векторі таким чином, що сигнальний пептид зв'язаний у рамці з амінокінцем ДНК ланцюга зрілого антитіла. Сигнальний пептид може бути сигнальним пептидом імуноглобуліну або гетерологічним пептидом від білка, що не є імуноглобуліном. В іншому варіанті послідовність ДНК, що кодує ланцюг антитіла, вже може містити послідовність сигнального пептиду. Крім послідовностей ДНК ланцюгів антитіл вектори рекомбінантної експресії несуть регуляторні послідовності, що включають промотори, енхансери, сигнали термінації й поліаденілювання та інші елементи контролю експресії, які контролюють експресію ланцюгів антитіл у клітині-хазяїні. Прикладами промоторних послідовностей (які ілюструють експресію у клітинах ссавців) є промотори й/або енхансери, похідні від CMV (наприклад, промотор/енхансер CMV, вірусу мавп 40 (SV40)), аденовірусів (наприклад, великий пізній промотор аденовірусу (adenovirus major late promoter-AdMLP)), поліом і сильних промоторів ссавців, наприклад, промоторів нативного імуноглобуліну й актину. Прикладами сигналів поліаденілювання є BGH поліА, SV40 пізня й рання послідовності поліА; в іншому варіанті можуть застосовуватися області 3´UTR генів імуноглобулінів тощо. Вектори рекомбінантної експресії також можуть нести послідовності, які регулюють реплікацію вектора у клітинах-хазяїнах (наприклад, початок реплікації), і селективні маркерні гени. Молекули нуклеїнової кислоти, які кодують важкий ланцюг або його антигенсполучну частину й/або легкий ланцюг або його антигенсполучну частину анти-ІФР антитіла, і вектори, що включають такі молекули ДНК, можуть бути інтродуковані у клітини-хазяїни, наприклад, бактеріальні клітини або у клітини вищих еукаріот, наприклад, клітини ссавців, методами трансфекції, відомими у даній галузі, включаючи опосередковану ліпосомами трансфекцію, опосередковану полікатіонами трансфекцію, злиття протопластів, мікроін'єкції, осадження фосфатом кальцію, електропорацію або перенос вірусними векторами. Переважно молекули ДНК, які кодують важкий ланцюг і легкий ланцюг, містяться у двох векторах, які спільно трансфекують у клітини-хазяїни, переважно, у клітини ссавця. Інший об'єкт даного винаходу відноситься до клітин-хазяїнів, що несуть один або декілька векторів експресії, відповідно до описаного раніше, переважно до клітин ссавців. Лінії клітин ссавців, доступні як хазяїни для експресії, відомі у даній галузі й включають поряд із іншими клітини яєчника китайського хом'ячка (клітини Chinese hamster ovary-CHO), клітини NSO, клітини SP2/0, клітини HeLa, клітини нирки новонародженого хом'яка (baby hamster kidney-BHK), клітини нирки мавпи (лінія COS), клітини карциноми людини (наприклад, клітини Hep G2 і A-549), клітини 3T3 або похідні/потомство якої-небудь з перерахованих ліній клітин. Можуть застосовуватися клітини інших ссавців, включаючи, але ними не обмежуючись, лінії клітин людини, миші, пацюка, мавпи й гризунів, або інші еукаріотичні клітини, включаючи, але ними не обмежуючись, клітини дріжджів, комах і рослин, або прокаріотичні клітини, наприклад, бактерії. Молекули анти-ІФР антитіл за даним винаходом одержують шляхом культивування клітин-хазяїнів протягом часу, достатнього для здійснення експресії молекули антитіла у клітинах-хазяїнах. Крім зазначеного вище, інший об'єкт даного винаходу відноситься до описаного способу одержання молекули антитіла, що включає трансфекцію клітин-хазяїнів ссавців одним або декількома описаними векторами, культивування клітин-хазяїнів, виділення й очищення антитіла. В іншому варіанті здійснення даний винахід відноситься до способу одержання антитіла, описаного вище, що включає одержання клітин-хазяїнів ссавця, що включають один або декілька описаних векторів, і культивування клітин-хазяїнів. В іншому варіанті здійснення даного винаходу спосіб додатково включає виділення й очищення антитіла. Молекули антитіл переважно виділяють з культурального середовища у вигляді секретованого поліпептиду або вони можуть бути виділені з лізатів клітин-хазяїнів, якщо, 10 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, експресуються без секреторного сигналу. Необхідно очистити молекули антитіла, використовуючи стандартні методи очищення білка, використовувані для рекомбінантних білків і білків клітин-хазяїнів таким чином, щоб одержати істотно гомогенні препарати антитіла. Приміром, використовувані у даній галузі методи очищення, застосовні для одержання молекул анти-ІФР антитіла за даним винаходом, включають як перша стадія видалення клітин і/або часток залишків клітин із культурального середовища або лізату. Потім антитіло очищають від контамінантних розчинних білків, поліпептидів і нуклеїнових кислот, наприклад, шляхом фракціонування за імунологічною спорідненістю або на іонообмінних колонках, осадженням спиртом, ВЕРХ зі зворотною фазою, фроматографією на сефадексі, хроматографією на кремніє або на катіонобмінній смолі. Як остання стадія одержання препарату молекули анти-ІФР антитіла можуть бути висушені, наприклад, ліофілізовані, відповідно до описаного нижче, для застосування у терапії. В одному з варіантів здійснення даного винаходу молекули анти-ІФР антитіла за даним винаходом можуть бути очищені у ході послідовних відомих у даній галузі стадій очищення, що включають афінну хроматографію (рекомбінантний білок А), інактивацію вірусу при низькій величині рН, фільтрацію через пористий фільтр, катіонообмінну хроматографію, аніонообмінну хроматографію, нанофільтрацію й 30 кДа ультра/діафільтрацію (Shukla та ін., 2007). Ще один об'єкт за даним винаходом відноситься до молекули антитіла, описаної вище, для застосування у медицині. Інший об'єкт за даним винаходом відноситься до фармацевтичної композиції, що містить як діючий інгредієнт молекули анти-ІФР антитіла, переважно, повного антитіла за даним винаходом. Для застосування у терапії молекули анти-ІФР антитіла включені у фармацевтичні композиції для полегшення їх введення тваринам і людям. Типові склади молекул анти-ІФР антитіла можуть бути отримані шляхом перемішування молекул анти-ІФР антитіла з фізіологічно прийнятними носіями, ексципієнтами або стабілізаторами, у формі ліофілізованих або іншим способом висушених складів або водних розчинів або водних або неводних суспензій. Носії, ексципієнти, модифікатори або стабілізатори є нетоксичними у застосовуваних дозах і концентраціях. До них відносяться буферні системи, наприклад, фосфат, цитрат, ацетати та інші неорганічні або органічні кислоти та їх солі; антиоксиданти, включаючи аскорбінову кислоту й метіонін; консерванти, наприклад, октадецилдиметилбензил амоній хлорид; гексаметоній хлорид; бензалконій хлорид, бензетоній хлорид; фенол, бутил або бензиловий спирт; алкілпарабени, наприклад, метил- або пропілпарабен; катехол; резорцин; циклогексан; 3-пентанол; і m-крезол; білки, наприклад, сироватковий альбумін, желатин або імуноглобуліни; гідрофільні полімери, наприклад, полівінілпіролідон або поліетиленгліколь (ПЕГ); амінокислоти, наприклад, гліцин, глутамін, аспарагін, гістидин, аргінін або лізин; моносахариди, дисахариди, олігосахариди або полісахариди та інші вуглеводи, включаючи глюкозу, маннозу, сахарозу, трегалозу, декстрини або декстрани; хелатуючі агенти, наприклад, EDTA; багатоатомні спирти, наприклад, маніт або сорбіт; формуючі солі протиіони, наприклад, натрій; комплекси з металами (наприклад, комплекси Zn-білок); і/або іонні або неіонні поверхнево-активні речовини, наприклад, продукт TWEEN™ (полісорбати), продукт PLURONICS™ або ефіри жирних кислот, ефіри жирних кислот або складні ефіри цукрів. У складі з антитілом також можуть бути органічні розчинники, наприклад, етанол або ізопропанол. Ексципієнти також можуть виконувати функцію модифікації вивільнення або модифікації адсорбції. Молекули анти-ІФР антитіл також можуть бути висушені (ліофільно, розбризкуванням, розбризкуванням із заморожуванням, висушуванням у близьких до критичного або у надкритичних газах, висушуванням у вакуумі, висушуванням на повітрі), осаджені або кристалізовані або захоплені у мікрокапсули, які осаджують, наприклад, методом коацервації або полімеризації на границі фаз, використовуючи, наприклад, гідроксиметилцелюлозу або желатин і полі(метилметакрилат), відповідно, у колоїдних системах вивільнення лікарських засобів (наприклад, у ліпосомах, альбумінових мікросферах, мікроемульсіях, наночастках, нанокапсулах), у макроемульсіях або осаджених або іммобілізованих на носіях або на поверхнях, наприклад, методом pcmc (protein coated microcrystals - мікрокристалів із нанесенням білка). Такі методи описані Remington, 2005. Безумовно, склади для введення in vivo обов'язково повинні бути стерильними; стерилізація може здійснюватися традиційними методами, наприклад, фільтрацією через стерильні фільтруючі мембрани. Може бути корисним для підвищення концентрації анти-ІФР антитіла одержувати так званий рідкий склад високої концентрації (high concentration liquid formulation-HCLF); описані різні 11 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 способи одержання таких складів. Молекули анти-ІФР антитіл також можуть міститися у препаратах стійкого вивільнення. До таких препаратів відносяться тверді, напіврідкі й рідкі матриці гідрофобних або гідрофільних полімерів і вони можуть бути у формі об'єктів певної форми, наприклад, плівок, паличок або мікрокапсул, і можуть застосовуватися за допомогою спеціального пристрою. До прикладів матриць стійкого вивільнення відносяться поліефіри, гідрогелі (наприклад, полі(2гідроксіетилметакрилат або ацетобутират сахарози), або полівініловий спирт), полімолочні кислоти (US 3773919), співполімери L-глутамінової кислоти й γ-етил-L-глутамату, ацетат етиленвінілу, що не піддається руйнуванню, співполімер молочної кислоти-гліколевої кислоти, що руйнується, наприклад, продукт LUPRON DEPOT™ (ін'єкційні мікросфери, що складаються з співполімера молочної кислоти-гліколевої кислоти й лейпроліду ацетату) і полі-D-(-)- 3гідроксимасляна кислота. Хоча полімери, наприклад, ацетат етиленвінілу й співполімер молочної кислоти-гліколевої кислоти, можуть вивільняти молекули протягом більше 100 діб, деякі гідрогелі вивільняють білки протягом більше коротких періодів. Якщо інкапсульовані антитіла зберігаються в організмі протягом довгого часу, вони можуть денатурувати або агрегувати у результаті впливу вологи при 37 °C, приводячи до втрати біологічної активності й можливих змін імуногенності. Раціональні стратегії можуть бути розроблені для стабілізації, залежно від задіяного механізму. Наприклад, якщо виявлений механізм агрегування полягає у формуванні внутрішньомолекулярних зв'язків S-S через тіо-дисульфідне чергування, стабілізація може бути досягнута шляхом модифікації сульфгідрильних залишків, ліофілізації (наприклад, описаної у WO 89/011297) з кислих розчинів, контролю вмісту вологи, використовуючи відповідні добавки, і розвитку специфічних полімерних матриксних композицій. Склади, які також можуть застосовуватися для молекули анти-ІФР антитіла за даним винаходом, описані в US 7060268 і US 6991790. Молекули анти-ІФР антитіла також можуть бути включені в інші використовувані форми, наприклад, дисперсії, суспензії або ліпосоми, таблетки, капсули, порошки, спреї, черезшкірні й внутрішньошкірні пластирі або мазі разом із пристосуваннями для підвищення проникності, пластини, назальні, буккальні або легеневі склади, або можуть бути отримані шляхом імплантації клітин або - після генної терапії - окремих власних клітин. Молекули анти-ІФР антитіла також можуть бути змінені за допомогою хімічної групи, наприклад, поліетиленгліколя (ПЕГ), метильної або етильної групи, або вуглеводневої групи. Такі групи можуть бути застосовні для поліпшення біологічних властивостей антитіла, наприклад, для підвищення періоду напіврозпаду у сироватці або для підвищення зв'язування тканиною. Кращим способом введення є парентеральний спосіб, інфузією або ін'єкцією (внутрішньовенною, внутрішньом'язовою, підшкірною, внутрішньочеревинною, внутрішньошкірною), але також можуть застосовуватися інші способи введення, наприклад, шляхом інгаляції, черезшкірне, внутрішньоназальне, буккальне, пероральне введення. У кращому варіанті здійснення даного винаходу фармацевтична композиція за даним винаходом містить анти-ІФР-антитіло, наприклад, антитіло 60814, 60819 або 60833, у концентрації 10 мг/мл, і додатково включає 25 мМ Na цитрату pH 6, 115 мМ NaCl, 0,02 % Tween® (полісорбат 20). В іншому варіанті здійснення даного винаходу фармацевтична композиція за даним винаходом є водним розчином, що містить анти-ІФР антитіло, наприклад, антитіло 60814, 60819 або 60833, у концентрації 10 мг/мл, і додатково включає 25 мМ гістидин HCl pH 6, 38,8 г/л маніту, 9,70 г/л сахарози й 0,02 % Tween® (полісорбат 20). Для внутрішньовенної інфузії фармацевтична композиція за даним винаходом може бути розведена у фізіологічному розчині, наприклад, в 0,9 % натріє хлориді або у 5 % глюкозі. Фармацевтична композиція може бути висушена ліофільно й відновлена водою для ін'єкцій перед застосуванням. Для попередження або лікування захворювання відповідне дозування антитіла може залежати від типу захворювання, що піддається лікуванню, тяжкості й ходу протікання захворювання, застосування антитіла для потреб лікування або попередження, від попереднього лікування, від історії хвороби пацієнта й від відповіді на антитіло, а також від вибору лікаря. Антитіло може бути введено пацієнтові однократно або у вигляді серійних введень. Залежно від типу й тяжкості захворювання приблизно від 1 мкг/кг дo 20 мг/кг (наприклад, 0,115 мг/кг) антитіла становить первісну дозу, яку підбирають, для введення пацієнтові, або, наприклад, у результаті одного, або декількох окремих введень, або шляхом безперервної інфузії, наприклад, інфузією протягом 1 год. Типова схема лікування звичайно включає 12 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 введення антитіла від одного разу на тиждень до одного разу кожні три тижні у дозах, що варіюють приблизно від 0,1 мкг/кг до приблизно 20 мг/кг або більше, залежно від зазначених вище факторів. Наприклад, тижнева доза може становити 5, 10 або 15 мг/кг. Хід лікування легко контролювати звичайними методами й аналізами. Поняття "терапевтично ефективна кількість" антитіла, що вводиться, означає мінімальну кількість, необхідну для попередження, полегшення або лікування захворювання або розладу. Молекули анти-ІФР антитіла за даним винаходом й фармацевтичні композиції, що містять їх, застосовні для лікування гіперпроліферативних розладів. У деяких варіантах здійснення даного винаходу гіперпроліферативним розладом є рак. Ракові захворювання класифікують за двома підходами: за типом тканини, з якої відбувається рак (гістологічний підхід), і за первинним осередком захворювання або за розташуванням в організмі, де рак уперше був сформований. До більшості основних місць розвитку раку відносяться шкіра, легені, груди, простата, товста кишка й пряма кишка, шийка матки й матка. Молекули анти-ІФР антитіла за даним винаходом використовують у лікуванні різних ракових захворювань, включаючи, але ними не обмежуючись, наступні захворювання: - рак, зв'язаний зі СНІД, наприклад, саркому Капоші, - рак костей, наприклад, сімейство пухлин і остеосарком Юінга; - рак мозку, наприклад, пухлина мозку дорослих, гліому стовбура мозку у дітей, астроцитому мозочка у дітей, церебральну астроцитому /злоякісну гліому у дітей, епендимому у дітей, медулобластому у дітей, розташовані над мозочковим наметом недиференційовані нейроектодермальні пухлини у дітей, гліому зорового шляху й гіпоталамуса у дітей та інші пухлини мозку у дітей; - рак грудей; - рак, пов'язаний з травною системою/шлунково-кишковим трактом, наприклад, рак анальної зони, рак позаланцюгових жовчних проток, шлунково-кишкову карциноїдну пухлину, шлунковокишкову стромальну пухлину, холангіокарциному, рак товстої кишки, рак стравоходу, рак жовчного міхура, первинний рак печінки дорослих (гепатоклітинну карциному, гепатобластому), рак печінки у дітей, рак підшлункової залози, рак прямої кишки, рак тонкого кишечника й рак шлунка; - рак, пов'язаний з ендокринною системою, наприклад, адренокортикальну карциному, шлунково-кишкову карциноїдну пухлину, карциному острівцевих клітин (ендокринної частини підшлункової залози), рак паращитовидної залози, феохромоцитому, пухлину гіпофіза й рак щитовидної залози; - ракові захворювання, пов'язані з очима, наприклад, внутрішньочну меланому й ретинобластому; - рак, пов'язаний з сечостатевою системою, наприклад, рак сечового міхура, рак нирок, рак пеніса, рак простати, перехідно-клітинний рак ниркової миски та сечоводу, рак насінників, рак уретри, пухлина Вільмса та інші пухлини нирок у дітей; - рак, пов'язаний зі зародковими клітинами, наприклад, злоякісну екстракраніальну герміноклітинну пухлину у дітей, внегонадну герміноклітинну пухлину, герміноклітинну пухлину яєчника й рак насінників; - рак жіночих статевих органів, наприклад, рак шийки матки, рак ендометрію, гестаційну трофобластичну пухлину, епітеліальний рак яєчника, пухлину зародкових клітин яєчника, передракову пухлину яєчника, саркому матки, рак піхви й рак зовнішніх жіночих статевих пухлин; - рак, пов'язаний з головою й шиєю, наприклад, підглотковий рак, рак гортані, рак губ і ротової порожнини, метастазуючий плоскоклітинний рак шиї зі схованим початком, носоглотковий рак, ротоглотковий рак, рак придаткових пазух носа й носової порожнини, рак паращитовидної залози й рак слинних залоз; - рак, пов'язаний з гематологією/кров'ю, наприклад, лейкози, наприклад, гострий лімфобластний лейкоз дорослих, гострий лімфобластний лейкоз у дітей, гострий мієлоїдний лейкоз дорослих, гострий мієлоїдний лейкоз у дітей, хронічний лімфоцитарний лейкоз, хронічний мієлогенний лейкоз і лейкоз ворсистих клітин; і лімфоми, наприклад, СНІД-зв'язану лімфому, шкірну Т-клітинну лімфому, лімфому Ходжкіна у дорослих, лімфому Ходжкіна у дітей, лімфому Ходжкіна у вагітних, грибоподібний мікоз, неходжкінську лімфому у дорослих, неходжкінську лімфому у дітей, неходжкінську лімфому у вагітних, первинну лімфому центральної нервової системи, синдром Сезарі, шкірну Т-клітинну лімфому і макроглобулінемію Вальденстрема та інші види раку, пов'язаного з гематологією/кров'ю, наприклад, хронічні мієлопроліферативні розлади, множинну мієлому/новоутворення плазмацитів, 13 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 мієлодиспластичні синдроми й мієлодиспластичні/ мієлопроліферативні захворювання; - рак, пов'язаний зі скелетно-м'язовою системою, наприклад, сімейство пухлин Юінга, остеосаркому, злоякісну фіброзну гістіоцитому костей, рабдоміосаркому у дітей, саркому м'яких тканин у дорослих, саркому м'яких тканин у дітей і саркому матки; злоякісні гемангіоми й ангіосаркому; - рак, пов'язаний з нервовою системою, наприклад, пухлина мозку у дорослих, пухлина мозку у дітей, гліому стовбура мозку, астроцитому мозочка, церебральну астроцитому /злоякісну гліому у дітей, епендимому, медулобластому, розташовані над мозочковим наметом недиференційовані нейроектодермальні пухлини, гліому зорового шляху й гіпоталамуса та інші пухлини мозку, наприклад, нейробластому, пухлину гіпофіза й первинну лімфому центральної нервової системи; - рак, пов'язаний з респіраторною/торакальною системою, наприклад, недрібноклітинний рак легенів, дрібноклітинний рак легенів, злоякісну мезотеліому, тимому й карциному вилочкової залози; - рак, пов'язаний зі шкірою, наприклад, шкірну Т-клітинну систему, саркому Капоші, меланому, рак шкіри з клітин Меркеля й рак шкіри; - пухлини з дрібних круглих синіх клітин. Зокрема, молекули анти-ІФР антитіл за даним винаходом й фармацевтичні композиції, що містять їх, корисні для лікування ракових захворювань системи кровотворення, включаючи лейкози, лімфоми й мієломи, ракових захворювань шлунково-кишкового тракту, включаючи рак стравоходу, шлунка, кишечника, підшлункової залози, печінки, жовчного міхура й жовчних проток; ракових захворювань жіночої статевої сфери, включаючи рак грудей, яєчника, матки й шийки матки; раку шкіри, голови й шиї, включаючи злоякісні меланоми; ракові захворювання у дітей типу пухлин Вільмса, нейробластоми й саркоми Юінга; ракові захворювання мозку, наприклад, глоібластоми; саркоми, типу остеосарком, саркоми м'якої тканини, рабдоміосаркоми, гемангіосаркоми; раку легенів, мезотеліоми й раку щитовидки. У кращому варіанті здійснення даного винаходу молекули анти-ІФР антитіл за даним винаходом й фармацевтичні композиції, що містять їх, корисні для лікування недрібноклітинного раку легенів (НДРЛ), зокрема локально сформованого або метастазуючого НДРЛ (стадія IIIB/IV). У цьому контексті молекули анти-ІФР антитіл за даним винаходом можуть сполучатися з хіміотерапією на основі платини, зокрема подвійною платиновою терапією паклітакселом/карбоплатином або гемцитабіном/цисплатином. В іншому кращому варіанті здійснення даного винаходу молекули анти-ІФР антитіл за даним винаходом й фармацевтичні композиції, що містять їх, корисні для лікування гепатоклітинної карциноми, зокрема локально сформованої або гепатоклітинної карциноми (на стадії III/IV). У цьому контексті молекули анти-ІФР антитіл за даним винаходом можуть сполучатися зі сорафенібом (Strumberg D., 2005). В іншому варіанті здійснення даного винаходу молекули анти-ІФР антитіл за даним винаходом й фармацевтичні композиції, що містять їх, застосовні для гіперпроліферативних розладів, що не відносяться до ракових захворювань, наприклад, псоріазу й рестенозу після ангіопластики, але ними перелік не обмежується. Крім того, ґрунтуючись на попередньому спостереженні (Reinberg, 2008), яке полягає у тому, що зниження дії ІФР-1 впливає на тривалість життя, антитіла за даним винаходом мають корисну властивість при лікуванні дорослих за вповільненням старінню й попередженням вікових захворювань. Таким чином, інший варіант здійснення даного винаходу відноситься до застосування молекул антитіл, подібних описаним вище, для одержання лікарського засобу для лікування зазначених вище ракових захворювань. В іншому варіанті здійснення даний винахід відноситься до фармацевтичної композиції, подібній описаній вище, для лікування зазначених вище ракових захворювань. У ще одному з варіантів здійснення даний винахід відноситься до способу лікування пацієнта з раковим захворюванням, зазначеним вище, що включає введення зазначеному пацієнтові ефективної кількості фармацевтичної композиції, описаної у даному винаході. Залежно від розладу, що піддається лікуванню, молекули анти-ІФР антитіла за даним винаходом можуть застосовуватися окремо або у комбінації з одним або декількома додатковими терапевтичними агентами, зокрема, вибраними з агентів, що руйнують ДНК, або терапевтично діючих сполук, які інгібують ангіогенез, метаболічні шляхи сигнальної трансдукції або мітотичні контрольні точки у ракових клітинах. Додатковий терапевтичний агент може водитися одночасно, при цьому необов'язково як компонент єдиного фармацевтичного препарату, або до або після введення молекули анти-ІФР антитіла. 14 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення даного винаходу додатковий терапевтичний агент може бути одним або декількома інгібіторами, вибраними з групи інгібіторів EGFR, VEGFR, HER2-neu, AuroraA, AuroraB, PLK і PI3 кінази, FGFR, PDGFR, Raf, KSP або PDK1, але ними перелік не обмежується. Іншими прикладами додаткових терапевтичних агентів є інгібітори CDK, Akt, src/ bcr- abl, cKit, cMet/HGF, c-Myc, Flt3, HSP90, антагоністи сигнального шляху hedgehog, інгібітори JAK/STAT, Mek, mTor, NFкаппа, протеасома, Rho, інгібітор передачі сигналу wnt або інгібітор метаболічного шляху убіквітинування. Прикладами інгібіторів Aurora є, але ними перелік не обмежується, PHA-739358, AZD-1152, AT-9283, CYC-116, R-763, VX-667, MLN-8045, PF-3814735, SNS-314, VX-689, GSK-1070916, TTP607, PHA-680626, MLN-8237 і ENMD-2076. Прикладом інгібітора PLK є GSK-461364. Прикладами інгібіторів raf є BAY-73-4506 (також інгібітор VEGFR), PLX- 4032, RAF-265 (також інгібітор VEGFR), сорафеніб (також інгібітор VEGFR), XL-281 і Nevavar (також інгібітор VEGFR). Прикладами інгібіторів KSP є іспінесиб, ARRY-520, AZD-4877, CK-1122697, GSK- 246053A, GSK-923295, MK-0731, SB-743921, LY-2523355 і EMD-534085. Прикладами інгібіторів src і/або bcr-abl є дасатиніб, AZD-0530, босутиніб, XL-228 (також інгібітор ІФР-1Р), нілотиніб (також PDGFR і cKit інгібітор), іматиніб (також інгібітор cKit), NS-187, KX2-391, AP-24534 (також інгібітор EGFR, FGFR, Tie2, Flt3), KM-80 і LS-104 (також інгібітор Flt3, Jak2). Прикладом інгібітора PDK1 є AR-12. Прикладом інгібітора Rho є BA-210. Прикладами інгібіторів PI3 кінази є PX-866, PX-867, BEZ-235 (також інгібітор mTor), XL-147, XL-765 (також інгібітор mTor), BGT-226, CDC-0941, GSK-1059615. Прикладами інгібіторів cMet або HGF є XL-184 (також інгібітор VEGFR, cKit, Flt3), PF2341066, MK-2461, XL-880 (також інгібітор VEGFR), MGCD-265 (також інгібітор VEGFR, Ron, Tie2), SU-11274, PHA-665752, AMG-102, AV-299, ARQ-197, MetMAb, CGEN-241, BMS-777607, JNJ- 38877605, PF-4217903, SGX-126, CEP-17940, AMG-458, INCB-028060 і E-7050. Прикладом інгібітора c-Myc є CX-3543. Прикладами інгібіторів Flt3 є AC-220 (також інгібітор cKit і PDGFR), KW-2449, LS-104 (також інгібітор bcr-abl і Jak2), MC-2002, SB-1317, лестауртиніб (також інгібітор VEGFR, PDGFR, PKC), TG-101348 (також інгібітор JAK2), XL-999 (також інгібітор cKit, FGFR, PDGFR і VEGFR), сунітибін (також інгібітор PDGFR, VEGFR і cKit) і тандутиніб (також інгібітор PDGFR і cKit). Прикладами інгібіторів HSP90 є танеспіміцин, алвеспіміцин, IPI-504, STA-9090, MEDI-561, AUY-922, CNF-2024 і SNX-5422. Прикладами інгібіторів JAK/STAT є CYT-997 (також взаємодіючий з тубуліном), TG-101348 (також інгібітор Flt3) і XL-019. Прикладами інгібіторів Mek є ARRY-142886, AS-703026, PD-325901, AZD-8330, ARRY-704, RDEA-119 і XL-518. Прикладами інгібіторів mTor є рапаміцин, темсиролімус, дефоролімус (який також діє як інгібітор VEGF), еверолімус (також інгібітор VEGF), XL-765 (також інгібітор PI3 кінази) і BEZ-235 (також інгібітор PI3). Прикладами інгібіторів Akt є перифозин, GSK-690693, RX-0201 і трицирибін. Прикладами інгібіторів cKit є маситиніб, OSI-930 (який також діє як інгібітор VEGFR), AC-220 (також інгібітор Flt3 і PDGFR), тандутиніб (також інгібітор Flt3 і PDGFR), акситиніб (також інгібітор VEGFR і PDGFR), сунітиніб (також інгібітор Flt3, PDGFR, VEGFR) і XL-820 (також діє як інгібітор VEGFR і PDGFR), іматиніб (також інгібітор bcr-abl), нілотиніб (також інгібітор bcr-abl і PDGFR). Прикладами антагоністів сигнального шляху hedgehog є IPI-609, CUR-61414, GDC-0449, IPI-926 і XL-139. Прикладами інгібіторів CDK є селіцикліб, AT-7519, P-276, ZK-CDK (також інгібуючий VEGFR2 і PDGFR), PD-332991, R-547, SNS-032, PHA-690509, PHA-848125 і SCH-727965. Прикладами інгібіторів протеасом/інгібіторів метаболічного шляху NFkappaB є бортезоміб, карфілзоміб, NPI-0052, CEP-18770, MLN-2238, PR-047, PR-957, AVE-8680 і SPC-839. Прикладом інгібітора метаболічного шляху убіквітинування є HBX-41108. До прикладів анти-ангіогенних агентів відносяться інгібітори FGFR, PDGFR і VEGF(R), і талідоміди, вибрані з наведених нижче агентів, якими однак перелік не обмежується, BIBF 1120 (продукт Vargatef®), бевацизумаб, мотезаніб, CDP-791, SU-14813, телатиніб, KRN-951, ZK-CDK (також інгібітор CDK), ABT-869, BMS-690514, RAF-265, IMC-KDR, IMC-18F1, IMiDs, талідомід, 15 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 CC-4047, леналідомід, ENMD-0995, IMC-D11, Ki-23057, бриваніб, седираніб, 1B3, CP-868596, IMC-3G3, R-1530 (також інгібітор Flt3), седираніб (також інгібітор cKit і Flt3), акситиніб (також інгібітор cKit), лестауртиніб (також інгібітор Flt3 і PKC), ваталаніб, тандутиніб (також інгібітор Flt3 і cKit), пазопаніб, PF-337210, афліберсепт, E-7080, CHIR-258, сорафеніб тозилат (також інгібітор Raf), вандетаніб, CP-547632, OSI-930, AEE-788 (також інгібітор EGFR і Her2), BAY-57-9352 (також інгібітор Raf), BAY-73-4506 (також інгібітор Raf), XL-880 (також інгібітор cMet), XL-647 (також інгібітор EGFR і EphB4), XL-820 (також інгібітор cKit), нілотиніб (також інгібітор cKit і brcabl), CYT-116, PTC-299, BMS-584622, CEP-11981, довітиніб, CY-2401401 і ENMD-2976. Додатковий терапевтичний агент також може бути вибраний з інгібіторів EGFR і може бути низькомолекулярним інгібітором EGFR або анти-EGFR антитілом. Прикладами анти-EGFR антитіл є, але ними перелік не обмежується, цетуксимаб, панітумумаб, німотузумаб, залутумумаб; прикладами низькомолекулярних інгібіторів EGFR є гефітиніб, ерлотиніб і вандетаніб (також інгібітор VEGFR). Іншим прикладом модулятора EGFR є гібридний токсин EGF. Іншими інгібіторами EGFR і/або Her2, застосовними для комбінації з молекулою анти-ІФР антитіла за даним винаходом, є BIBW 2992 (продукт Tovok®), лапатиніб, трастузумаб, пертузумаб, XL-647, нератиніб, BMS-599626 ARRY-334543, AV-412, mAB-806, BMS-690514, JNJ26483327, AEE-788 (також інгібітор VEGFR), AZD-8931, ARRY-380 ARRY-333786, IMC-11F8, земаб, TAK-285, AZD-4769. Іншими агентами, які переважно можуть комбінуватися при лікуванні молекулами анти-ІФР антитіла за даним винаходом, є тозитумумаб і ібритумомаб тіуксетан (два радіомічених антиCD20 антитіла); офатумумаб, ритуксимаб, LY-2469298, окрелізумаб, TRU-015, PRO-131921, FBT-A05, велтузумаб, R-7159 (інгібітори CD20), алемтузумаб (анти-CD52 антитіло), денозумаб, (інгібітор ліганду фактора диференціації остеокластів), галіксимаб (антагоніст CD80), занолімумаб (антагоніст CD4), SGN40 (модулятор рецептора ліганду CD40), XmAb-5485, Chi Lob 7/4, лукатумумаб, CP-870893 (інгібітори CD40), CAT-8015, епратузумаб, Y 90-епратузумаб, інотузумаба озогаміцин (інгібітори CD22), луміліксимаб (інгібітор CD23), TRU-016 (інгібітори CD37), MDX-1342, SAR-3419, MT-103 (інгібітори CD19), або мапатумумаб, тигатузумаб, лексатумумаб, апомаб, AMG-951 і AMG-655 (модулятори рецептора TRAIL). До іншим хіміотерапевтичних агентів, які можуть застосовуватися у комбінації з молекулами анти-ІФР антитіла за даним винаходом, відносяться, але ними не обмежуються, гормони, аналоги гормонів і антигормональних агентів (наприклад, тамоксифен, тореміфен, ралоксифен, фулвестрант, мегестрол ацетат, флутамід, нілутамід, бікалутамід, ципротерон ацетат, фінастерид, бусерелін ацетат, флудрокортизон, флуоксиместерон, медроксипрогестерон, окстреотид, арзоксифен, пасиреотид, вапреотид), інгібітори ароматази (наприклад, анастрозол, летрозол, ліарозол, екземестан, атаместан, форместан), агоністи й антагоністи LHRH (наприклад, госерелін ацетат, лейпролід, абарелікс, цетрорелікс, деслорелін, гістрелін, трипторелін), антиметаболіти (наприклад, антифолати, а саме метотрексат, пеметрексед, аналоги піримідину, наприклад, 5-фторурацил, капецитабін, децитабін, неларабін і гемцитабін, аналоги пурину й аденозину, наприклад, меркаптопурин тіогуанін, кладрибін і пентостатин, циторабін, флударабін); протипухлинні антибіотики (наприклад, антрацикліни, а саме доксорубіцин, даунорубіцин, епірубіцин і ідарубіцин, мітоміцин C, блеоміцин, дактиноміцин, плікаміцин, мітоксантрон, піксантрон, стрептозоцин); похідні платини (наприклад, цисплатин, оксиплатин, карбоплатин, лобаплатин, сатраплатин); алкілуючі агенти (наприклад, естрамустин, меклоретамін, мелфалан, хлорамбуцил, бусульфан, дакарбазин, циклофосфамід, іфосфамід, гідроксисечовина, темозоломід, нітрозосечовини, наприклад, кармустин і ломустин, тіотепа); антимітотичні агенти (наприклад, алкалоїди барвінку, наприклад, вінбластин, віндезин, вінорелбін, вінфлунін і вінкристин; і таксани, наприклад, паклітаксел, доцетаксел і склади з ними, ларотаксел; симотаксел і епотилони, наприклад, іксабепілон, патупілон, ZK-EPO); інгібітори топоізомерази (наприклад, епіподофілотоксини, наприклад, етопозид і етопофос, теніпозид, амсакрин, топотекан, іринотекан) і різні інші хіміотерапевтичні засоби, наприклад, аміфостин, анагрелід, інтерферон альфа, прокарбазин, мітотан і порфімер, бексаротен, целекоксиб. В одному з об'єктів даного винаходу молекули анти-ІФР антитіла за даним винаходом використовують у комбінації з хіміотерапією на основі платини, наприклад, у комбінації з паклітакселом/карбоплатином або гемцитабіном/цисплатином, при подвійній платиновій терапії. В одному з варіантів здійснення даного винаходу така комбінована терапія може бути повторена декілька разів, наприклад, 6 циклів (кожні три тижні). Це лікування може супроводжуватися додатковим повторюваним лікуванням (наприклад, 6 циклів кожні три тижні) тільки одним анти-ІФР антитілом. Такий режим може застосовуватися, наприклад, при лікуванні 16 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 недрібноклітинного раку легенів (НДРЛ). В іншому об'єкті даного винаходу молекули анти-ІФР антитіла за даним винаходом використовують у комбінації з сорафенібом. В одному з варіантів здійснення даного винаходу молекула анти-ІФР антитіла може вводитися періодично з інтервалами в 1-3 тижні, наприклад, протягом 12 циклів, у комбінації з безперервним введенням сорафенібу. Такий режим, наприклад, може застосовуватися для лікування гепатоклітинної карциноми. Молекули анти-ІФР антитіла за даним винаходом, наприклад, при застосуванні у низьких концентраціях, також можуть комбінуватися з агентами, які націлюються на ІФР-1Р. До таких агентів відносяться антитіла, які зв'язуються з ІФР-1Р (наприклад, CP-751871, AMG-479, IMC-A12, MK-0646, AVE-1642, R-1507, BIIB-022, SCH-717454, rhu Mab ІФР-Р) і нові хімічні агенти, які націлюються на домен кінази ІФР 1-Р (наприклад, OSI-906 або BMS-554417, XL-228, BMS-754807). Молекули анти-ІФР антитіла за даним винаходом також можуть застосовуватися у комбінації з іншими способами лікування, включаючи хірургію, радіотерапію, гормональну терапію, модифікатори біологічної відповіді, гіпертермію й кріотерапію, а також агенти для ослаблення якого-небудь побічного ефекту, наприклад, протиблювотні засоби й, у кращому варіанті здійснення даного винаходу, антидіабетичні засоби, наприклад, метформін. Молекули анти-ІФР антитіла за даним винаходом також можуть застосовуватися для діагностики раку, якщо підвищені рівні ІФР-1 і/або ІФР-2 у сироватці корелюють з розвитком і прогресуванням захворювання, наприклад, для визначення підвищених рівнів ІФР-2 через імпринтинг (ПІ), епігенетичної зміни, що впливає на ген II інсуліноподібного фактора росту (ІФР2). У деяких варіантах здійснення даного винаходу використовуване для діагностики антитіло, наприклад, для виявлення ІФР-1 у зрізах тканини людини за допомогою імуногістохімічного фарбування, є химерним антитілом, похідним від антитіла людини. У такому антитілі константні області або їх частини заміщені на відповідні послідовності від антитіл інших видів, наприклад, миші. З використанням такого химерного антитіла як основне антитіло вторинне антитіло, наприклад, козяче антитіло, що специфічно реагує з частиною Fc миші, може специфічно розпізнавати послідовності миші химерного основного антитіла й не зв'язується з частинами Fc інших молекул імуноглобуліну людини, які містяться у зразку тканини людини. Таким чином, уникають небажаного фонового фарбування. Антитіла за даним винаходом завдяки блокуванню передачі сигналу, опосередкованому ІФР-1 та ІФР-2, також можуть застосовуватися як контроль маси тіла й формування жирової тканини. З цією метою антитіла за даним винаходом вводять окремо або у комбінації з іншими засобами від ожиріння. Матеріали й методи Відбір антитіл, що повністю належать людині, які зв'язуються з високою спорідненістю з ІФР1 Відбір клонів специфічних фрагментів Fab з бібліотеки комбінаторних антитіл людини (HuCAL Gold) (Knappik та ін., 2000), які зв'язують ІФР-1 людини з низькою наномолярною спорідненістю, проводять способом, сутність якого описана Rauchenberger та ін., 2003, у трьох циклах пенінгу. Для ідентифікації фрагментів Fab з поліпшеною спорідненістю до ІФР-1 людини декілька таких "батьківських" клонів Fab піддають процедурі "дозріванню спорідненості in vitro" способом, сутність якого описана Nagy та ін., 2002. Послідовності L-CDR3 (області CDR3 легкого ланцюга) і H-CDR2 (області CDR2 важкого ланцюга) кожного клону модифікують окремо 8 шляхом заміщення вихідної послідовності приблизно 10 L-CDR3 і H-CDR2 касетами від HuCAL (Knappik та ін., 2000). Фаги одержують зі створених "бібліотек дозрівання" і кожну бібліотеку піддають методу пенінгу на ІФР-1 людини. Для відбору сполучних за найвищою спорідненістю з ІФР-1 людини, пенінги проводять в умовах нормального промивання й підвищеної твердості за методами, відомими у даній галузі, зі зменшенням антигену й з блокуванням і без блокування інсуліном людини. Отриманий після пенінгу матеріал після трьох циклів фагового пенінгу піддають субклонуванню у векторі експресії Fab і спорідненість кожного Fab у відношенні ІФР-1 людини визначають методом рівноважного титрування, заснованого на електрохемілюмінесценції, розробленим фірмою BioVeris (Witney, Оксфордшир, Великобританія), в основному за описом Haenel та ін., 2005. Клони Fab з найкращою спорідненістю до ІФР-1 секвенують, потім конвертують в IgG1 антитіло людини відповідно до опису Krebs та ін., 2001, з субнаномолярною спорідненістю до ІФР-1 людини без якої-небудь зміни специфічності у порівнянні з вихідними антитілами. Клонування й рекомбінантна експресія IgG1 антитіл Варіабельні області важкого ланцюга (VH) і варіабельні області легкого ланцюга (VL) виключають з векторів експресії Fab шляхом розщеплення ферментами рестрикції й лігуванням 17 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 у сумісні сайти рестрикції плазмід на основі pcДНК3.1, що містять важкий ланцюг IgG1 людини і константних областей легкого ланцюга Igλ людини, відповідно. Одержують плазмідні препарати EndoFree (фірма Qiagen) і плазміди важкого й легкого ланцюга спільно трансфекують у культуру клітин HEK293 freestyle (фірма Invitrogen) у концентрації кожної плазміди 1 мг/л за протоколом виробника. Через 72 год. супернатант збирають і концентрацію IgG визначають методом ELISA. Антитіла очищають у колонці з модифікованим білком А (фірма GE Healthcare), елюють цитратним буфером і потім діалізують до концентрації 2,5 мг/мл у ФСБ. В іншому варіанті лінію клітин CHO, зі стабільно інтегрованими плазмідами, які експресують антитіла, одержують і використовують для одержання антитіл. Аналіз методом поверхневого плазмонного резонансу для визначення констант спорідненості а) Спосіб захоплення антитіл Сенсорний чіп покривають приблизно 1000 КЕ контрольного антитіла у проточній кюветі 1 і приблизно 1000 КЕ специфічного антитіла кролика проти Fc-гамма людини у проточній кюветі 2, використовуючи з'єднуючі реагенти з набору сполук амінів. Мішень у кількості 1000 КЕ розташовують на поверхні препарату біосенсора Biacore 3000 при швидкості струму 5 мкл/хв. Використовують рухливий буфер HBS-EP. Вимірювання спорідненості проводять, використовуючи наступні параметри: потік 20 мкл/хв (рухливий буфер HCB); температура вимірювання 25 °C; Fc1, Fc2 напрямку потоку; Fc1, Fc2 детекція; захоплення анти-ІФР-huMAb: 3 хв розчину 1 мкг/мл; 5 хв ІФР-Ag-асоціація; 5 хв ІФР-Ag-дисоціація; регенерація: пульс 30 сек з 50 мМ HCl. Антигени ІФР розводять до 500, 250, 125, 62,5 і 31,3 нМ у рухливому буфері (HCB) і різні розведення антигену поодинці пропускають поверх Fc1 і Fc2 у випадковому порядку. Рухливий буфер пропускають вхолосту тільки у проміжках. Криву рухливого буфера віднімають з кривої зв'язування щораз перед аналізом спорідненості. Оцінку даних проводять, використовуючи програмне забезпечення BIAevaluation (версія 4.1, фірма Biacore, Фрайбург, Німеччина). Кінетичні фази асоціації й дисоціації встановлюють окремо. Для роздільної установки величин kdiss використовують строки ініціації 200-300 сек на фазі дисоціації (діапазон стійкого зниження сигналу). Для роздільної установки величин k ass використовують тимчасові рамки приблизно 100 сек (діапазон стійкого підвищення сигналу) і для підрахунку індивідуальних значень k diss використовують з асоціативною моделлю Ленгмюра1:1. Середні величини зі стандартним відхиленнями кінетичних даних підраховують разом із відповідними константами дисоціації (KD) і асоціації (KA). б) Спосіб покриття ІФР Визначення констант зв'язування антитіл ІФР з лігандами ІФР при нанесенні на сенсорний чіп лігандів ІФР в основному проводять за зазначеним вище описом, за винятком тієї обставини, 2 2 що на сенсорний чіп наносять 35,1 пг/мм і 38,5 пг/мм ІФР-1 та ІФР-2, відповідно. Потім антитіла пропускають над чіпом у наступних концентраціях: 50, 25, 12,5, 6,25, 3,12 нМ. Вимірювання за допомогою імуносорбентного аналізу зв'язування з факторами ІФР людини, миші й пацюка й з інсуліном людини Антитіла IgG1, що повністю є антитілами людини, які зв'язуються з високою спорідненістю з ІФР-1, також досліджують на здатність зв'язувати ІФР-1 людини у прямому імуносорбентному аналізі (ELISA). Аналіз проводять шляхом нанесення ІФР-1 людини (фірма R&D Systems, номер у каталозі 291-G1) в 96-ямкові планшети Maxisorb у концентрації 0,5 мкг/мл протягом ночі при 4 °C (100 мкл/ямку). Тільки один буфер для покриття використовують як контроль неспецифічного зв'язування. Потім ямки однократно промивають буфером для промивання (1 × TBS-T) і сайти зв'язування, що залишилися, блокують 200 мкл буфера, що блокує, протягом 1 год. при кімнатній температурі на круговій качалці з наступним циклом промивання. Серійні трикратні розведення кожного досліджуваного антитіла у буфері, що блокує, одержують безпосередньо у планшетах із покриттям. Типові застосовувані концентрації залишають 50, 16,6, 5,6, 1,8, 0,6, 0,2 і 0,07 нг/мл. Окремо рівень, що блокує, використовують як позитивний контроль. Потім планшети інкубують протягом 2 год. при кімнатній температурі при струшуванні. Після трьох циклів промивання по 100 мкл/ямку другого реагенту, а саме антитіла проти IgG людини, кон'югованого з пероксидазою хріну (HRPO-кон'югованого анти-IgG людини (фірма Jackson ImmunoResearch Inc.), розведеного у буфері, що блокує, додають в усі ямки. Через 2 год. інкубації при кімнатній температурі при струшуванні планшети тричі промивають і по 100 мкл/ямку субстратного розчину TMB (рівні кількості розчинів А і Б) вносять піпеткою в усі ямки. Планшети інкубують протягом 10-20 хв при кімнатній температурі при струшуванні й потім реакцію зупиняють додаванням 100 мкл/ямку 1 M фосфорної кислоти. Поглинання вимірюють при довжині хвилі 450 нм (контроль при 650 нм). Зв'язування IgG1 антитіл, що зв'язуються з фактором ІФР-1, що є повністю фактором 18 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 людини, з ІФР-1 миші (фірма R&D Systems, номер у каталозі 791-MG), ІФР-1 пацюка (фірма IBT, номер у каталозі RU100), ІФР-2 людини (фірма GroPep, номер у каталозі FM001), ІФР-2 миші (фірма R&D Systems, номер у каталозі 792-MG), ІФР-2 пацюка (фірма IBT, номер у каталозі AAU100) та інсулін людини (фірма Roche) також досліджують, відповідно до описаного вище для ІФР-1 людини (виключенням є застосовувана концентрація інсуліну для покриття, яка становить 3 мкг/мл). Дослідження проліферації клітин in vitro для визначення ефективності нейтралізації Клітини лінії MCF-7, отриманої від раку грудей (ATCC, HTB-22), і клітини лінії COLO 205, отриманої від раку товстої кишки (ATCC, CCL-222), висівають в 96-ямкові планшети при щільності клітин 1000 клітин/ямку у середовищі RPMI без сироватки. По 10 нг/мл або ІФР-1, або ІФР-2, додають при наявності або при відсутності гуманізованого антитіла контрольного ізотипу, що не зв'язується з ІФР-1 або ІФР-2, або антитіла 60814, 60819 і 60833 у концентрації 12, 37, 111, 333, 1000 і 3000 нг/мл. Клітини культивують протягом 5 діб, потім відносне число клітин визначають у кожній ямці, використовуючи метод люмінесцентного аналізу життєздатних клітин CellTiter-Glo (фірма Promega). Люмінесценцію (люмен (лм) = одиниця люмінесценції) записують, використовуючи програму XFluor GENios Pro 4. Дослідження росту ліній клітин, похідних від саркоми Юінга Клітини, похідні від саркоми Юінга, ліній TC-71 (ATCC, номер у колекції ACC516) і SK-ES-1 (ATCC, номер у колекції HTB86), висівають в 96-ямкові планшети з щільністю 1000 клітин/ямку у середовище DMEM, що містить 1×NEAA, 1×натрій піруват, 1×глутамакс і 10 % фетальної сироватки теляти (ФСТ) та інкубують протягом ночі при 37 °C і у вологій атмосфері з 5 % CO2. Наступного дня серійні розведення досліджуваного антитіла, гуманізованого ізотипового контрольного антитіла (гуманізованого антитіла IgG1, що націлюється на CD44-v6), яке не зв'язує ІФР-1 або ІФР-2, рапаміцину або комбінації рапаміцину й досліджуваного антитіла, додають до клітин. Типові використовувані концентрації дорівнюють 30, 10, 3,3, 1,1, 0,37 і 0,12 мкг/мл (або 100, 10, 1, 0,1, 0,01, 0,001 нМ рапаміцин і досліджуваного антитіла для дослідження комбінацій) і кожне розведення вносять в ямки у трьох повторах. Потім клітини з антитілом інкубують протягом 120 год., після чого визначають відносну кількість клітин у кожній ямці, використовуючи метод люмінесцентного аналізу життєздатних клітин CellTiter-Glo (фірма Promega). Люмінесценцію (люмен (лм) = одиниця люмінесценції) записують, використовуючи програму XFluor GENios Pro 4, і для аналізу даних одержують середнє значення за трьома ямками і відповідні розрахунки, використовуючи програму аналізу сигмоїдальної кривої (програму Graph Pad Prism) з варіабельним кутом нахилу кривої. Аналіз методом вестерн блоттингу рівнів фосфорилованих ферментів AKT і PTEN Клітини SK-ES-1 поміщають в 96-ямкові планшети у середовище, що містить 10 % фетальної сироватки теляти, і потім протягом ночі інкубування їх обробляють або 100 нМ ізотиповим контрольним антитілом (гуманізованим антитілом IgG1, що націлюється на CD44v6), яке не зв'язує ІФР-1 або ІФР-2, або 100 нМ 60819, 100 нМ рапаміцин, або комбінацією 100 нМ 60819 і 100 нМ рапаміцин. Через 24 год. клітини лізують і лізат клітин заморожують після визначення концентрації білка в аналізі Bradford. Аналіз методом вестерн-блоттингу здійснюють нанесенням 30 мкг білкових лізатів на гель SDS PAGE (фірма BioRad) і гель піддають блоттингу на сендвіч гель блоттингу Citerian. Вестерн-блотти інкубують протягом ночі з антитілом кролика анти-бета актину (контроль), антитілом кролика анти-PTEN (фірма Cell Signaling, номер у каталозі 9559) або антитілом кролика анти-pAKT (фірма Cell Signaling, номер у каталозі 4060) у розведенні 1:5000 (анти-бета актин), 1:1000 (анти-PTEN) або 1:2000 (анти-фосфоAKT) в 1 % порошковому молоці. Після промивання у TBS антитіло проти IgG кролика, кон'юговане з пероксидазою хріну (фірма Amersham), застосовують протягом 1 год. і потім додатково промивають у TBS і реакційну здатність антитіла фіксують за підвищеною хемолюмінесценцією (enhanced chemiluminescence-ECL) і захоплюють на плівці Hyperfilm (фірма Amersham). Комбінація in vitro анти-ІФР антитіла з інгібітором EGFR у клітинах лінії, похідної від недрібноклітинного раку легенів (НДРЛ) Клітини лінії A-549 (ATCC, номер у колекції CCL-185), похідні від НДРЛ, поміщають в 96ямкові планшети у кількості 1000 клітин/ямку у середовище RPMI 1640, що містить 2 мМ L-глутамін і 10 % фетальної сироватки теляти та інкубують протягом ночі при 37 °C у вологій атмосфері з 5 % CO2. Наступного дня до клітин додають серійні розведення досліджуваного ІФР антитіла, ерлотинібу/тарцеви або комбінації досліджуваного ІФР антитіла й ерлотинібу. Типові концентрації досліджуваного ІФР антитіла становлять 30000, 10000, 3333, 1111, 370,123, 41, 14 нг/мл, і типові використовувані концентрації ерлотинібу становлять 20000, 6667, 2222, 741, 247, 82, 27, 9 нМ, причому кожне розведення вносять в ямки у трьох повторах. Потім клітини інкубують протягом 120 год., після чого визначають відносне число клітин у кожній ямці, 19 UA 105198 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовуючи метод люмінесцентного аналізу життєздатних клітин CellTiter-Glo (фірма Promega). Люмінесценцію (люмен (лм) = одиниця люмінесценції) записують, використовуючи програму XFluor GENios Pro 4, і для аналізу даних одержують середнє значення за трьома ямками і відповідні розрахунки, використовуючи програму аналізу сигмоїдальної кривої (програму Graph Pad Prism) з варіабельним кутом нахилу кривої. Визначення впливу на сумарні рівні ІФР-1 у сироватці миші й пацюка Окремі внутрішньовенні (болюсні) введення 25, 12,5, 6,25 і 3,13 мг/кг досліджуваного ІФР антитіла вводять самкам безтимусних голих мишей лінії NMRI у віці 6-8 тижнів (n=5). Окремі 10хвилинні внутрішньовенні введення 30, 100, 200 мг/кг антитіла 60819 проводять самцям і самкам пацюків лінії Wistar Han у віці 6-8 тижнів (n=4 самця, 4 самки). Перед лікуванням антитілом і через 24 год. після введення беруть зразок крові, одержують сироватку й загальні рівні ІФР-1 миші або пацюка визначають, використовуючи імуноцитометричний аналіз сумарного ІФР-1 пацюка/миші OCTEIA. Аналіз проводять за інструкціями виробника, поглинання вимірюють при 450 нм і оцінюють, використовуючи програмне забезпечення SoftMax Pro. Використовують криву стандарту для визначення концентрації у сироватці сумарного ІФР-1 у нг/мл. Статистичний аналіз проводять, використовуючи програмне забезпечення GraphPad Prism. Дослідження методом ELISA на основі клітин фосфорилування ІФР-1Р Лінії клітин фібробластів миші, які рекомбінантно експресують ІФР-1Р людини або ІР-A людини, підтримують у середовищі DMEM, збагаченому 10 % інактивованою нагріванням ФСТ, 1 мМ натрієм піруватом, 0,075 % натрію бікарбонату, мінімальним середовищем Голка зі замінними амінокислотами (MEM NEAA) і 0,3 мкг/мл пуроміцину при 37 °C і в атмосфері з 5 % CO2 у вологому інкубаторі. Клітини роз'єднують трипсином/EDTA, ресуспендують у культуральному середовищі й розводять дo 100000 клітин/мл. По 100 мкл (10000 клітин) висівають в ямки стерильного 96-ямкового планшета та інкубують протягом ночі у вологому інкубаторі при 37 °C і в атмосфері 5 % CO2. Потім клітини виснажують середовищем для аналізу (середовище DMEM, збагачене 0,5 % інактивованою нагріванням ФСТ, 1 мМ натрієм піруватом, 0,075 % натрію бікарбонату й MEM NEAA) у кількості 100 мкл/ямку та інкубують протягом ночі відповідно до описаного вище. Антитіла у діапазоні концентрацій досліджуваного антитіла, приготовлених у середовищі для аналізу, додають до клітин, всі зразки готують у трьох повторах, щоб визначити стандартне відхилення для кожної умови проведення аналізу. У цих експериментах також досліджують антитіло ІФР-1Р, αIR-3 (фірма Calbiochem, номер у каталозі GR11L). Потім додають ІФР-1 (кінцева концентрація 20 нг/мл), ІФР-2 (кінцева концентрація 100 нг/мл) або сироватку людини (кінцева концентрація 20 %) і планшети інкубують протягом 30 хв у вологій атмосфері у термостаті. Клітини фіксують заміщенням середовища для росту на 4 % формальдегід у ФСБ протягом 20 хв при кімнатній температурі. Після двох циклів промивання за допомогою 300 мкл/ямку буфера для промивання (ФСБ з 0,1 % Triton X-100) протягом 5 хв (з перемішуванням) клітини блокують за допомогою 100 мкл/ямку 1,2 мас. % перекису водню у буфері для промивання протягом 30 хв при кімнатній температурі. Клітини знову промивають за допомогою 300 мкл/ямку буфера для промивання й блокують за допомогою 100 мкл/ямку буфера, що блокує (5 % БСА у буфері для промивання) протягом 60 хв при кімнатній температурі з перемішуванням. Буфер, що блокує, видаляють і додають 50 мкл/ямку первинного антитіла проти фосфо-ІФР-I рецептора β (tyr1135/1136) / інсулінового рецептора β (tyr1150/1151) (фірма Cell Signaling, номер у каталозі 3024), розведене 1:1000 у буфері, що блокує. Планшети інкубують протягом ночі при 4 °C при струшуванні, потім тричі промивають відповідно до зазначеного вище й вносять по 50 мкл/ямку козячих імуноглобулінів проти IgG кролика, кон'югованих із пероксидазою хріну (фірма Dako, номер у каталозі P0448), розведеною 1:500 у буфері, що блокує. Після 60 хв інкубації при кімнатній температурі при струшуванні ямки промивають двічі буфером для промивання відповідно до зазначеного вище й один раз 300 мкл ФСБ. 100 мкл/ямку субстратного розчину TMB (фірма Bender MedSystems, No. BMS406.1000) вносять в ямки та інкубують протягом 10 хв при перемішуванні, після чого реакцію зупиняють додаванням 100 мкл/ямку 1 M фосфорної кислоти, і зчитують поглинання, використовуючи фотометр (оптична щільність при 450 нм, оптична щільність при 650 нм використовується як контроль). Величини IC50 придушення ІФР-1Р або фосфорилування ІР-A визначають графічним аналізом. Спільна кристалізація Fab-ІФР-1 і визначення структури Моноклональні антитіла одержують у буфері 100 мМ Na фосфату (pH 7) перед розщепленням папаїном. Папаїн (фірма Sigma Aldrich, номер у каталозі 3125) активують у буфері для розщеплення (фосфатному буфері, що містить 10 мМ цистеїн гідрохлорид, 4 мМ EDTA, pH 7,0) за інструкціями виробника. Антитіло IgG змішують з активованим папаїном 20 UA 105198 C2 5 10 15 20 25 30 35 40 45 (співвідношення фермент:IgG=1:100) і реакційну суміш інкубують при 37 °C на круговій качалці протягом ночі. Розщеплення зупиняють додаванням йодацетаміду до кінцевої концентрації 30 мМ. Для відділення фрагмента Fab від фрагментів Fc, продуктів розщеплення Fc та інтактного моноклонального антитіла суміш після розщеплення вносять у колонку з сорбентом Protein A MabSelect, урівноважену фосфатним буфером. Колонку промивають п'ятьма об'ємами колонки ФСБ, і фрагмент Fab збирають в елюаті й з фракцій промивання. Фрагмент Fc та інтактне моноклональне антитіло елюють з колонки 100 мМ цитратним буфером (pH 3,0) і потім проводять ексклюзійну хроматографію фрагмента Fab, використовуючи колонку HiLoad Superdex 75. Через колонку пропускають зі швидкістю 0,5 мл/хв 20 мМ триетаноламін, 130 мМ NaCl, pH 8,0. Білкову концентрацію фрагментів Fab визначають за вимірюванням поглинання при довжині хвилі 280 нм. Якість фрагментів Fab досліджують методами вестерн-блоттингу й ELISA. Комплекс Fab-ІФР-1 одержують додаванням 2-кратного мольного надлишку рекомбінантного ІФР-1 (фірма Gropep; Receptor Grade) для очищення Fab, який потім інкубують протягом ночі на круговій качалці при 4 °C. Концентрування комплексу (до 15 мг/мл) і видалення незв'язаного ІФР-1 проводять, використовуючи пристрій Amicon-Ultra. Кристалізацію комплексу Fab:ІФР-1 проводять, використовуючи різні методи, наприклад, висячої краплі, сидячої краплі й затравки. В одному з варіантів здійснення даного винаходу кристал осаджують шляхом контакту розчину з резервуаром, що знижує розчинність білків через наявність осаджувачів, тобто реагентів, які індукують осадження. Скринінг різних умов приводить до виявлення відповідної буферної системи, керованої шляхом внесення осаджувача й добавок. Концентрація осадків переважно становить 5-50 мас. %. Величина pH буфера переважно становить приблизно від 3 до приблизно 6. Концентрація білка у розчині переважно така, що через надлишкове насичення випадає осад. Температура при кристалізації переважно становить від 4 °C до 25 °C. Тривимірна структура комплексу Fab:ІФР-1, визначена атомними координатами, отримана на підставі рентгеноструктурного дифракційного аналізу кристалу й карти щільності електронів, що випливає з нього. Дозвіл дифракції кристалів менше 2Å. Кристали переважно мають просторову групу P3221 (число 154) і розміри елементарних комірок становлять приблизно а = 70Å, b=70Å, c=195Å і γ = 120°. Спосіб визначення тривимірної структури представляє молекулярне заміщення, що включає застосування структури, близькій молекулі або комплексу рецепторного ліганду. Діючу систему зв'язування й очищення проводять протягом декількох повторюваних етапів до підсумкових R-факторів (R і Rfree), рівних 21 і 23 % відповідно. Визначення фармакокінетичних параметрів у пацюків Пацюкам лінії Wistar вводять п'ять болюсних внутрішньовенних уливань по 18, 52 і 248 мг/кг антитіла кожні 72 год. У різний час беруть зразки крові й визначають концентрацію антитіла людини у плазмі методом сендвіч-ELISA. У результаті розраховують фармакокінетичні параметри антитіла у першу добу дозування, а період напіврозпаду розраховують після останньої доби дозування (з t(n) = 1008 год.). Приклад 1. Відбір антитіл, що зв'язуються з ІФР-1 з високою спорідненістю Для ідентифікації фрагментів Fab з поліпшеною спорідненістю з фактором ІФР-1 людини декілька "батьківських" клонів Fab, для яких установлено, що вони зв'язують ІФР-1 зі спорідненістю, вимірюваною у наномолях, піддають процедурі "дозрівання спорідненості in vitro", при якій послідовності L-CDR3 і H-CDR2 кожного клону модифікують окремо шляхом заміщення вихідної послідовності бібліотекою нових послідовностей L-CDR3 і H-CDR2. Отримані у результаті "бібліотеки дозрівання" піддають методу пенінгу на ІФР-1 людини і клони з найкращою спорідненістю відбирають для конверсії в антитіла IgG1 і подальшого аналізу. Трьома антитілами, які мають найкращу спорідненість з фактором ІФР-1 людини, є антитіла 60814, 60819 і 60833, які мають спорідненість (KD) 180, 190 і 130 пМ, відповідно (див. табл. 1), визначену методом рівноважного титрування, заснованого на електрохемілюмінесценції. 50 Таблиця 1 Результати дослідження зв'язування ІФР-1 Антитіло 60814 60819 60833 Спорідненість (пМ) 180 190 130 21 UA 105198 C2 5 10 Також досліджують зв'язування антитіл з ІФР-1 та ІФР-2 людини, миші й пацюка й з інсуліном людини в імуносорбентних дослідженнях. Установлено, що 60814, 60819 і 60833 показують порівнянне перехресно-діюче зв'язування з ІФР-1 миші й пацюка й з ІФР-2 людини, миші й пацюка, але не взаємодіє з інсуліном людини (при найвищій певній концентрації 50 нг/мл) (фіг. 1A-1Ж). Константи спорідненості для зв'язування антитіл з факторами ІФР-1 та ІФР-2 людини, миші й пацюка, також визначають методом поверхневого плазмонного резонансу (Biacore). Цей спосіб включає захоплення антитіл поверхнею сенсора й струм антигенів ІФР над захопленими антитілами, у такий спосіб переборюючи який-небудь ефект авідитету, що може виникнути, якщо антигени ІФР наносять на сенсор і додають антитіла. Константи спорідненості, визначені цим методом для антитіла 60833, показані у табл. 2, в якій можна бачити, що вимірювані величини KD для ІФР-1 людини та ІФР-2 людини становлять 0,07 нМ і 0,9 нМ, відповідно. Таблиця 2 Константи спорідненості антитіла 60833 з ІФР-1 та ІФР-2 людини, миші й пацюка, визначені методом поверхневого плазмонного резонансу (метод захоплення антитіла) Антиген ІФР-1 людини ІФР-1 миші ІФР-1 пацюка ІФР-2 людини ІФР-2 миші ІФР-2 пацюка 15 20 25 30 35 -1 -1 -1 Kon [M s ] 6 4,74 10 6 1,00 10 6 3,81 10 6 3,97 10 5 8,68 10 6 2,56 10 Koff [s ] -4 3,01 10 -4 3,23 10 -4 2,53 10 -3 3,53 10 -2 1,1 10 -3 6,13 10 KD [нМ] 0,07 0,33 0,07 0,913 13,4 2,41 Приклад 2. Придушення передачі сигналу через ІФР Першою подією, що відбувається після зв'язування факторів ІФР з рецептором ІФР-1Р, є фосфорилування ІФР-1Р. Дослідження методом ELISA на основі клітин проводять для вимірювання придушення фосфорилування ІФР-1Р, індукованого ІФР, антитілом 60833. Визначають силу й ефективність (до 15 мкг/мл (100 нМ)) антитіла 60833 за нейтралізацією фосфорилування ІФР-1Р, індукованого рекомбінантними біологічно активними ІФР-1 та ІФР-2. У табл. 3 і на фіг. 2 показане, що антитіло 60833 сильно й ефективно придушує передачу сигналу, індуковану ІФР-1 (фіг. 2A) та ІФР-2 (фіг. 2Б). У тому же аналізі моноклональне антитіло αIR3, націлене на ІФР-1Р, діє набагато слабкіше й менш ефективно відносно передачі сигналу, індукованого ІФР-1, і проявляє дуже слабкий вплив на передачу сигналу, індуковану ІФР-2. Подібний метод ELISA застосовують для аналізу заснованого на клітинах фосфорилування ІР-A, щоб показати, що антитіло 60833 також може інгібувати сигнальний шлях ІФР-2 через ІР-A. У табл. 4 і у прикладі 3А показано, що антитіло 60833 сильно й ефективно придушує фосфорилування ІР-А, індуковане ІФР-2. Навпроти, моноклональне антитіло αIR3, яке не може зв'язувати ІР-A, не проявляє придушуючої дії. Рівень біологічної активності ІФР у зразках сироватки або плазми людини також може бути вимірюваний, використовуючи метод ELISA для аналізу заснованого на клітинах фосфорилування ІФР-1Р. Цей метод застосовують для визначення сили й ефективності (до 15 мкг/мл (100 нМ)) антитіла 60833 за нейтралізацією біологічної активності ІФР сироватки людини. У табл. 3 і на фіг. 3Б показано, що антитіло 60833 сильно й ефективно інгібує біологічну активність ІФР у сироватці людини. 22 UA 105198 C2 Таблиця 3 Вплив антитіла 60833 на фосфорилування ІФР-1Р Стимул фосфорилування ІФР-1Р Інгібітор IC50 (мкг/мл) 60833 αIR3 Контрольний IgG 60833 ІФР-2 (100 нг/мл) αIR3 Контрольний IgG 60833 Об'єднана сироватка людини від αIR3 здорових донорів (20 %) Контрольний IgG ІФР-1 (20 нг/мл) 0,09 1,16 >15 1,12 >15 >15 0,25 >15 >15 Збереження фосфорилування при концентрації інгібітора 15 мкг/мл (100 нМ) (%) 0 35 108 7 76 108 5 120 110 Таблиця 4 Вплив антитіла 60833 на фосфорилування ІР-A ІФР-2 (100 нг/мл) 5 10 Інгібітор IC50 (мкг/мл) 60833 αIR3 Контрольний IgG Стимул фосфорилування ІР-A 0,82 >15 Збереження фосфорилування при концентрації інгібітора 15 мкг/мл (100 нМ) (%) 6 115 >15 109 Приклад 3. Впливи на клітинну проліферацію, індуковану ІФР-1 та ІФР-2 Визначають вплив антитіл 60814, 60819 і 60833 на індуковану факторами ІФР-1 та ІФР-2 проліферацію клітин лінії MCF-7 (отриманої від раку грудей) і клітин лінії COLO 205 (отриманої від раку товстої кишки). Приклади впливу антитіл 60814 і 60819 показані на фіг. 4 A-Г. Всі три антитіла проявляють дозозалежне придушення проліферації клітин MCF-7 (фіг. 4A і 4Б) і COLO 205 (фіг. 4В і 4Г), індукованої ІФР-1 (фіг. 4A і 4В) та ІФР-2 (фіг. 4Б і 4Г). Концентрація кожного антитіла, необхідна для 50 % придушення проліферації кожної лінії клітин, індукованої ІФР-1 або ІФР-2, показана у табл. 5. Таблиця 5 Придушення проліферації ракових клітин ліній MCF-7 і COLO 205, індукованої ІФР-1 та ІФР-2 Лінія клітин MCF7 MCF7 COLO-205 COLO 205 15 20 Стимуляція ІФР-1 ІФР-2 ІФР-1 ІФР-2 60814 24,1 78,2 135,0 576,1 IC50 (нг/мл) 60819 54,0 40,8 216,9 100,8 60833 38,6 81,2 165,1 632,3 Приклад 4. Вплив на проліферацію ліній клітин, похідних від саркоми Юінга Вплив антитіл 60819 і 60833 на проліферацію клітин лінії TC-71, похідних від саркоми Юінга й вирощених на середовищі, що містить 10 % ФСТ, показаний на фіг. 5. При порівнянні з контрольним ізотиповим гуманізованим IgG1 антитілом, що не зв'язує ІФР-1 або ІФР-2, обидва антитіла, 60819 і 60833, показують дозозалежне придушення проліферації клітин TC-71. Приклад 5. Вплив на рівні сумарного ІФР-1 миші й пацюка Можна чекати, що нейтралізація діючого ІФР-1 за допомогою антитіла, націленого на ІФР, 23 UA 105198 C2 5 10 15 20 25 30 35 40 45 приведе до ендокринного зворотного зв'язку за метаболічним шляхом гормону росту (ГР), що у свою чергу приведе до підвищених рівнів у сироватці сумарного ІФР-1. Антитіла 60814, 60819 і 60833 проявляють перехресну реакційну здатність у відношенні ІФР-1 миші й пацюка, що допускає який-небудь фармакокінетичний вплив на рівні сумарного ІФР-1, вимірювані у зразках. З фіг. 6 і 7 слідує, що введення антитіла 60819 мишам (фіг. 6) і пацюкам (фіг. 7) приводить до дозозалежного підвищення рівнів сумарного ІФР-1 миші й пацюка через 24 год. після введення. Таким чином, ІФР-1 представляє корисний фармакокінетичний маркер дії таких антитіл, які можуть контролюватися протягом клінічного періоду у людей. Приклад 6. Вплив комбінації антитіл, що впливають на ліганд ІФР, і рапаміцину на проліферацію лінії клітин, похідних від саркоми Юінга, і на внутрішньоклітинне проведення сигналу Вплив антитіла 60819 та інгібітора mTOR рапаміцину, окремо або у комбінації, на проліферацію лінії клітин SK- ES-1, отриманих від саркоми Юінга, показаний на фіг. 8. Показане дозозалежне придушення проліферації окремо й антитілом 60819, і рапаміцином, причому обидва агента досягають приблизно 60 % придушення проліферації у концентрації 100 нМ. Комбінація рівних доз обох агентів, антитіла 60819 і рапаміцину, проявляє адитивний ефект на придушення проліферації клітин, приблизно рівний 95 % придушенню при комбінуванні доз по 100 нМ. Індукована фактором ІФР проліферація клітин опосередковується через ланцюг ланцюжка внутрішньоклітинних подій за фосфорилуванням білків. Одним із білків, фосфорилування якого підвищується стимуляцією ІФР, є AKT. Фіг. 9 показує вплив антитіла й рапаміцину, окремо або у комбінації, на фосфорилування AKT у клітинах SK-ES-1 через 24 год. після лікування з використанням доз 100 нМ. При порівнянні з проліферацією неопрацьованих клітин, що проявляють фосфорилування AKT, 100 нМ антитіла 60819 придушує фосфорилування AKT. Навпроти, обробка 100 нМ рапаміцину приводить до підвищених рівнів фосфорилованого AKT у порівнянні з контролем, що приблизно пов'язане з компенсаторним механізмом зворотного зв'язку після придушення mTOR. Однак якщо комбінують 100 нМ рапаміцину й 100 нМ антитіла 60819, фосфорилування AKT придушується. Це означає, що компенсаторний зворотній зв'язок, який приводить до фосфорилованого AKT при обробці рапаміцином, відбувається через підвищення лігандів ІФР, які придушуються антитілом 60819. Фіг. 9 також показує, що обидва агента, антитіло 60819 і рапаміцин, окремо або у комбінації, не впливають на сумарні рівні PTEN. Приклад 7. Вплив комбінації антитіла, що націлюється на ліганд ІФР, та інгібітора EGFR на проліферацію клітин лінії, похідної від НДРЛ Вплив антитіла 60819 та інгібітора EGFR ерлотинібу/тарцеви, окремо або у комбінації, на проліферацію лінії клітин A-549, отриманих від недрібноклітинного раку легенів (НДРЛ), показаний на фіг. 10. На цій моделі спостерігають тільки незначний вплив антитіла 60819, застосовуваного окремо, на проліферацію клітин, а тарцева проявляє дозозалежний вплив із придушенням проліферації клітин приблизно на 60 % при найвищій досліджуваній дозі (20 мкМ). Однак якщо антитіло 60819 і тарцеву комбінують, спостерігають більше сильне й ефективне придушення проліферації клітин, що вказує на синергетичний ефект. Приклад 8. Фармакокінетичні властивості у пацюків лінії Wistar Середні фармакокінетичні параметри антитіла 60833 у пацюків лінії Wistar у першу добу дозування 18, 52 і 248 мг/кг показані у табл. 6. Підсумковий період напіввиживання розраховують після останньої доби дозування (при t(n) = 1008 год.), середній підсумковий період напіввиживання для всіх трьох рівнів дозування становить 221 год. (9,2 діб). Таблиця 6 Середні фармакокінетичні параметри антитіла 60833 у пацюків лінії Wistar у першу добу дозування C(max) [мг/мл] AUC(0-72 год.) [мг×год./мл] CL [(мл/добу)/кг] V(ss) [мл/кг] t1/2φ [год.] Доза антитіла 60833 (мг/кг) 52 1,70 40,2 28,7 76,3 197 18 0,531 15,5 22,9 68,1 210 24 248 5,56 120 37,3 65,4 255 UA 105198 C2 5 10 φ = після останньої доби дозування при t(n) = 1008 год. Приклад 9. Спільна кристалізація й визначення структури Fab-ІФР-1 для ідентифікації сайтів зв'язування антитіла на ІФР-1 Для остаточного визначення залишків в ІФР-1 людини, які взаємодіють з антитілами до ІФР, спільно кристалізують Fab та ІФР-1 і визначають взаємодію з дозволом менше 2Å. Залишки у молекулі ІФР-1, які контактують з антитілом (Fab) 60833, показані у табл. 7. У цілому 19 залишків у молекулі ІФР-1 контактують з 15 залишками CDR в антитілі 60833. З цих 19 залишків в ІФР-1 17 залишків ідентичні залишкам в ІФР-2 людини, якщо вирівнювати амінокислотні послідовності ІФР-1 та ІФР-2 людини (перераховані у табл. 7). Фіг. 11 показує тривимірну структуру ІФР-1, в якій амінокислоти, що зв'язуються з антитілом 60833, виділені кольором, а також у представленій лінійній амінокислотній послідовності ІФР-1 людини ці взаємодіючі амінокислоти підкреслені. Таблиця 7 Амінокислотні залишки в ІФР-1 людини, що здійснюють контакти з амінокислотними залишками антитіла 60833 FAB Амінокислотні залишки в ІФР-1 Амінокислотні залишки контакту Гомологічний залишок в ІФР-2 при контакті з антитілом 60833 на антитілі 60833 (CDR) Leu (L) 5 Tyr (Y) 54; (HCDR 2) Leu (L) 8 Cys (C) 6 Ser (S) 56; (HCDR 2) Cys (C) 9 Thr (T) 52; (HCDR 2) Ser (S) 53; (HCDR 2) Glu (E) 9 Tyr (Y) 54; (HCDR 2) Glu (E) 12 Gly (G) 55; (HCDR 2) Ser (S) 56; (HCDR 2) Leu (L) 10 Phe (F) 57; (HCDR 2) Leu (L) 13 Asp (D) 12 Trp (W) 33; (HCDR 1) Asp (D) 15 Ala (A) 13 Trp (W) 33; (HCDR 1) Trp (W) 33; (HCDR 1) Arg (R) 92; (LCDR 3) Phe (F) 16 Tyr (Y) 98; (LCDR 3) Phe (F) 19 Trp (W) 99; (LCDR 3) Tyr (Y) 101; (HCDR 3) Arg (R) 92; (LCDR 3) Val (V)17 Val (V) 20 Tyr (Y) 98; (LCDR 3) Arg (R) 21 Tyr (Y) 95; (LCDR 3) Arg (R) 24 Ser (S) 56; (HCDR 2) Cys (C) 47 Cys (C) 46 Phe (F) 57; (HCDR 2) Cys (C) 48 Ser (S) 56; (HCDR 2) Cys (C) 47 Tyr (Y) 54; (HCDR 2) Phe (F) 49 Gly (G) 55; (HCDR 2) Phe (F) 48 Ser (S) 56; (HCDR 2) Gly (G) 55; (HCDR 2) Ser (S) 51 Ser (S) 56; (HCDR 2) Ser (S) 50 Thr (T) 58; (HCDR 2) Ser (S) 56; (HCDR 2) Cys (C) 52 Phe (F) 57; (HCDR 2) Cys (C) 51 Thr (T) 58; (HCDR 2) Phe (F) 57; (HCDR 2) Asp (D) 53 Asp (D) 52 Thr (T) 58; (HCDR 2) Trp (W) 33; (HCDR 1) Phe (F) 57; (HCDR 2) Leu (L) 54 Leu (L) 53 Thr (T) 58; (HCDR 2) Tyr (Y) 98; (LCDR 3) Lys (K) 65; (HCDR 2) Arg (R) 55 Gly (G) 96; (LCDR 3) Tyr (Y) 98; (LCDR 3) Leu (L) 57 Phe (F) 57; (HCDR 2) Leu (L) 56 25 UA 105198 C2 Таблиця 7 Амінокислотні залишки в ІФР-1 людини, що здійснюють контакти з амінокислотними залишками антитіла 60833 FAB Амінокислотні залишки в ІФР-1 Амінокислотні залишки контакту Гомологічний залишок в ІФР-2 при контакті з антитілом 60833 на антитілі 60833 (CDR) Tyr (Y) 95; (LCDR 3) Glu (E) 58 Gly (G) 96; (LCDR 3) Glu (E) 57 Tyr (Y) 98; (LCDR 3) 15 залишків в антитіла 60833 бере участь у контактах з фактором ІФР-1: 19 залишків у фактора ІФР-1 HCDR 1:1залишок беруть участь у контактах з HCDR 2:8 залишків антитілом 60833 HCDR 3:1 залишок LCDR 1: LCDR 2: LCDR 3:5 залишків 5 10 15 20 25 30 35 40 Джерела інформації: Barbas та ін., Proc. Nat. Acad. Sci, USA 91, 1994, сс. 3809-3813. Burtrum та ін., Cancer Res. 63, 2003, сс. 8912-8921. Chen та ін., J. Clin. Endocrinol. 90, 2005, сс. 366-371. Cui та ін., Science 299, 2003, сс. 1753-1755. Cruz-Correa та ін., Gastroenterology 126, 2004, сс. 1190-1193. Dufner і Thomas, Exp. Cell Res. 253, 1999, сс. 100-109. Frasca та ін., Mol. Cell. Biol. 19, 1999, сс. 3278-3288. Freier та ін., Gut, 44(5), 1999, сс. 704-708; Fukuzawa та ін., Int. J. Cancer 82, 1999, сс. 490-497. Goetsch та ін., Int. J. Cancer 113, 2005, сс. 316-328. Goya та ін., Cancer Res. 64, 2004, сс. 6252-6258. Haenel та ін., Anal. Biochem. 339, 2005, сс. 182-184. Hassan та ін., Cancer Res. 60, 2000, сс. 1070-1076. Hawkins та ін., J.MoI. Biol. 226(3), 1992, сс. 889-896. Jackson та ін., J. Immunol. 154(7), 1995, сс. 3310-3319. Jerome та ін., End. Rel. Cancer 10, 2003, сс. 561-578. Kabat E.A. та ін. у кн.: "Sequences of Proteins of Immunological Interest", 1991, 5-е вид., вид-во Public Health Service, Національний інститут здоров'я, Bethesda, Меріленд. Kipriyanow і Le Gall, Molecular Biotechnology 26, 2004, сс. 39-60. Knappik та ін., J. Mol. Biol. 296, 2000, сс. 57-86. Kolb та ін. Pediatr. Blood Cancer 50, 2008, сс. 1190-1197. Krebs B. та ін., J. Immunol. Meth. 245, 2001, сс. 67-84. Kulik та ін., Mol. Cell. Biol. 17, 1997, сс. 1595-606. LeRoith D, Experimental Diab. Res. 4, 2003, сс. 205-212. Li та ін., Tumour Biol. 25, 2004, сс. 62-68. Lowman та ін., Biochemistry 30(45), 1991, сс. 10832-10837. Lund та ін., Cancer Lett. 206, 2004, сс. 85-96. Manara та ін., Clin. Cancer Res. 13, 2007, сс. 1322-1330. Manes та ін., Endocrinology 138, 1997, сс. 905-915. Marks та ін., Biotechnology 10, 1992, сс. 779-783. Miyamoto та ін., Clin. Cancer Res. 11, 2005, сс. 3494-3502. Moorhead та ін., Oncogene 22, 2003, 853-857. Nagy та ін., Nature Med. 8(8), 2002, сс. 801-807. Ng та ін., J. Gastroenterol. Hepatol. 13, 1998, сс. 152-157. Pandini та ін., J. Biol. Chem. 277, 2002, сс. 39684-39695. Pollack та ін., Nature Rev. Can. 4, 2004, сс. 505-518. Pollack та ін., Американське суспільство клініцистів-онкологів (American Society for Clinical Oncology-ASCO), щорічна конференція, 2007, реферат 3587. Quinn та ін., J. Biol. Chem. 271, 1996, сс. 11477-11483. 26 UA 105198 C2 5 10 15 20 25 30 35 40 45 Rauchenberger R. та ін., J. Biol. Chem. 278, 2003, сс. 38194-38205. Reinberg, U.S. News World Report, March 5, 2008. е Remington, кн.: "The Science and Practice of Pharmacy", 2005, 21 вид., під ред. Hendrickson rd Randy, Advanced Concepts Institute, University of The Sciences in Philadelphia, 600 S. 43 Street, Philadelphia, PA 19104, USA; 215- 895- 1184. Renehan та ін., Br. J. Cancer 83, 2000a), сс. 1344-1350. Renehan та ін., J. Clin. Endocrinol. Metab. 85, 2000б), сс. 3402-3408. Revets та ін., Expert Opin Biol Ther. 5(1), 2005, сс. 111-124. Rubin та ін., Lab. Invest. 73, 1995, сс. 311-331. Russell та ін., Proc. Natl. Acad. Sci USA 81, 1984, сс. 2389-2392. Scotlandi та ін., Cancer Res. 56, 1996, сс. 4570-4574. Sell та ін., Natl. Acad. Sci. USA 90, 1993, сс. 11217-11221. Sell та ін., Mol. Cell. Biol. 14, 1994, сс. 3604-3612. Shier та ін., Gene 169, 1995, сс. 147-155. Shukla та ін., J. Chromatography B, 848(1), 2007, сс. 28-39. Srinivasan M. і Roeske RW., Curr Protein Pept Sci. 6(2), 2005, сс. 185-196. Strumberg D., Drugs Today (Barc), 41(12), 2005, сс. 773-784. Takanami та ін., J. Surg. Oncol. 61, 1996, сс. 205-208. Tsai та ін., Scand. J. Gastroenterol. 40, 2005, сс. 68-75. Wang та ін., World J. Gastroenterol. 9, 2003, сс. 267-270. Woodson та ін., J. Natl. Cancer Inst. 96, 2004, сс. 407-410. Yao та ін., Clin. Cancer Res. 9, 2003a), сс. 2719-2726. Yao та ін., J. Clin. Invest. 111, 2003б). сс. 265-273. Yelton та ін., Immunol. 155, 1995, сс. 1994-2004. Zapata та ін., Protein Eng. 8(10), 1995, сс. 1057-1062. Zhao та ін., Cancer Epidemiol. Biomarkers Prev. 14, 2005, сс. 1819-1822. WO 89/011297 WO 94/29348 WO 02/056910 WO 03/002609 WO 03/050531 WO 03/093317 WO 04/003019 WO 04/058821 WO 2005/018671 WO 2005/027970 WO 2005/028515 WO 2007/042309 WO 2007/070432 JP 2003-310275 US 4342566 US 3773919 US 6696245 US 6991790 US 7060268 27 UA 105198 C2 Перелік послідовностей 28
ДивитисяДодаткова інформація
Автори російськоюAdam, Paul, Borges, Eric
МПК / Мітки
МПК: A61K 39/395, A61P 35/00
Мітки: росту, інсуліноподібних, факторів, антитіло
Код посилання
<a href="https://ua.patents.su/79-105198-antitilo-proti-insulinopodibnikh-faktoriv-rostu.html" target="_blank" rel="follow" title="База патентів України">Антитіло проти інсуліноподібних факторів росту</a>
Попередній патент: Напій на основі ячменю і солоду з низьким рівнем dms
Наступний патент: Вузол нижнього ущільнювального клапана для завантажувальної системи шахтної печі, система завантаження матеріалу через колошник для шахтної печі та доменна піч
Випадковий патент: Барабанний млин