5,7-діацил-3-етил(циклогексил)-6-(4-хлоро-3-r-феніл)-5н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазини, що мають протипухлинну активність
Номер патенту: 116952
Опубліковано: 12.06.2017
Автори: Демченко Анатолій Михайлович, Янченко Віктор Олексійович, Бобкова Людмила Станіславівна, Демченко Діана Анатолійовна
Формула / Реферат
5,7-Діацил-3-етил(циклогексил)-6-(4-хлоро-3-R-феніл)-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазини
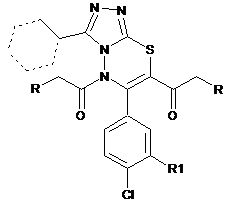 ,
,
де R=H, CH2CH3, R1 =H, Cl,
що мають протипухлинну активність.
Текст
Реферат: 5,7-Діацил-3-етил(циклогексил)-6-(4-хлоро-3-R-феніл)-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазини, де R=H, CH2CH3, R1 =H, Cl, що мають протипухлинну активність. UA 116952 U (12) UA 116952 U UA 116952 U Корисна модель належить до органічної, фармацевтичної хімії та медицини, а саме до одержання біологічно активних 5,7-діацил-3-етил(циклогексил)-6-(4-хлоро-3-R-феніл)-5H[1,2,4]триазоло[3,4-b][1,3,4]тіадіазинів формули: N N N S N R R O O R1 Cl 5 10 15 20 , де R = Н, СН2СН3, R1 = Н, СІ, що проявляють протипухлинну активність та можуть бути використані при лікуванні лейкемії. На сучасному етапі для лікування різних видів лейкемії часто застосовують хіміотерапію, яка складається, як правило, з комбінації лікарських препаратів, що перешкоджає виникненню резистентності ракових клітин до якогось певного препарату. Інші лікарські препарати, що застосовуються для лікування лейкемії, можуть запобігти виникненню інфекційних захворювань і допомагають організму продукувати нові клітини крові. Для лікування різних видів лейкозу застосовують преднізон, вінкристин, даунорубіцин, Lаспарагіназу, іматиніб метотрексат, циклофосфамід, ідарубіцин, цитозин арабінозу, мітоксантрон та інші препарати. Під час лікування лейкемії хіміотерапією виникають побічні ефекти, серед яких найпоширенішими і найбільш неприємними є нудота і блювота, а також порушення роботи систем організму. Відома також сполука, похідне біциклічних конденсованих гетероциклів (лікарський засіб метотрексат) формули: O H2N N 25 30 35 N OH N NH2 N O N O H N CH3 OH . Метотрексат - протилейкозний цитостатичний препарат з групи антиметаболітів, антагоністів фолієвої кислоти. Має виражену імуносупресивну дію навіть у відносно низьких дозах, і не володіє помітною гематологічною токсичністю. Завдяки цьому метотрексат ширше, ніж інші цитостатики з імуносупресивною активністю, застосовується як пригнічуючий імунітет препарат [1-6]. Метотрексат пригнічує дигідрофолатредуктазу (ДГФ), що перетворює дигідрофолієву кислоту в тетрагідрофолієву, яка є донором карбону в синтезі пуринових нуклеотидів. Крім цього в клітині метотрексат піддається поліглутамінуванню з утворенням метаболітів, що інгібують дію не тільки ДГФ, але і інших фолатзалежних ферментів. При застосуванні метотрексату часто можуть виникати виразковий стоматит, анорексія, некроз печінки, цироз, жирова атрофія, лейкопенія, анемія, тромбоцитопенія, головний біль, судоми, порушення оогенезу і сперматогенезу, імпотенція, цистит, виражені порушення функції нирок, кропив'янка, порушення пігментації, фурункульоз. Підвищення ефективності хіміотерапії пухлинної хвороби в першу чергу пов'язано із створенням нових, ефективних протипухлинних препаратів. 1 UA 116952 U 5 В основу корисної моделі поставлена задача пошуку нових речовин, що проявляють протипухлинну активність - здатність пригнічувати ріст ракових клітин лейкемії: CCRF-CEM, HL60(TB), K-562, MOLT-4, RPMI-8226 та SR. Поставлена задача вирішується тим, що як нові хімічні речовини синтезовано 5,7-діацил-3етил(циклогексил)-6-(4-хлоро-3-R-феніл)-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазини (3а-с). Заявлені сполуки (3а-с) одержують з високим виходом при використанні відомих синтетичних підходів у декілька стадій (схема 1). Схема 1. Синтез 5,7-діацил-3-етил(циклогексил)-6-(4-хлоро-3-R-феніл)-5H[1,2,4]триазоло[3,4-b][1,3,4]тіадіазинів 3а-с. 10 O N R2 N N N Br R1 R2 SH 1. Cl N N S N NH2 2. TEA 1 a-b (RCH2CO)2O N R2 O Cl N N R1 2 a-c S R N O R R1 Cl 3 a-c 15 20 25 30 , де 3а R = R2 = СН2СН3, R1 = H; 3b R=H, R1 = Cl, R2 = CH2CH3; 3c R = R1 = H, R2 = цикло-С6Н11. Дослідження мітотичної активності проведено методом флуоресцентного зафарбування (барвник - сульфородамін Б) (табл.). Приклади конкретного виконання. 4-Аміно-5-етил-4Н-[1,2,4]триазоліл-3-тіол 1а був одержаний за методом [7] взаємодії тіокарбогідразиду з пропановою кислотою. 4-Аміно-5-циклогексил-4Н-[1,2,4]триазол-3-тіол 1b було одержано за методом [8] з гідразиду циклогексилкарбонової кислоти, CS2 та гідразину. Заміщені 7H-[1,2,4]триазоло[3,4-b]тіадіазини 2а-с були синтезовані за методом [9] та використані без додаткового очищення та ідентифікації. Приклад 1. Синтез 5,7-дибутироніл-3-етил-6-(4-хлорофеніл)-5H-І1,2,4]триазоло[3,4b][1,3,4]тіадіазину 3а: 2,09 г (0,005 моля) 3-етил-6-(4-хлорофеніл)-7H-[1,2,4]триазоло[3,4b][1,3,4]тіадіазину 2а кип'ятили в 10 мл ангідриду бутанової кислоти протягом 3 годин з оберненим холодильником. Реакційну суміш охолоджували і виливали в воду. Продукт відфільтровували та перекристалізовували із ізопропанолу. Вихід 77 %. Тпл. = 86-7 °C. Спектр 1 ЯМР Н, , м.ч. (DMSO-d6): 0,86 (т, 3Н, СН3), 0,95 (т, 3Н, СН3), 1,41 (т, 3Н, СН3), 1,55 (м, 2Н, СН2), 1,67 (м, 2Н, СН2), 2,60 (т, 2H, СН2), 2,97 (т, 2Н, СН2), 3,09 (к, 2Н, СН2), 7,56 і 7,70 (д-д, 4Н, С6Н4). Знайдено, %: N 13,2; S 7,51. C20H23ClN4O2S. Вирахувано, %: N 13,4; S 7,65. Приклад 2. Синтез 5,7-діацетил-3-етил-6-(3,4-дихлорофеніл)-5H-[1,2,4]триазоло[3,4b]|1,3,4]тіадіазину 3b був одержаний аналогічно прикладу 1 з 3-етил-6-(3,4-дихлорофеніл)-7H[1,2,4,]триазоло[3,4-b][1,3,4] тіадиазину 2b та оцтового ангідриду. Вихід 87 %. Тпл. = 113-4 °C. 2 UA 116952 U Спектр ЯМР Н, , м.ч. (DMSO-d6): 1,42 (т, 3Н, СН3), 3,09 (к, 2Н, СН2), 2,35 (с, 3Н, NCOCH3), 2,57 (с, 3Н, ССОСН3), 7,76-7,91 (м, 3Н, С6Н3). Знайдено, %: N 14,3; S 8,26. C16H14Cl2N4O2S. Вирахувано, %: N 14,1; S 8,05. Приклад 3. Синтез 5,7-діацетил-3-циклогексил-6-(4-хлорофеніл)-5H-[1,2,4]триазоло[3,4b][1,3,4]тіадіазину 3с був одержаний аналогічно прикладу 1 з 3-циклогексил-6-(4-хлорофеніл)7H-[1,2,4,]триазоло[3,4-b][1,3,4]тіадіазину 2с та оцтового ангідриду. Вихід 81 %. Тпл. = 163-4 °C. 1 Спектр ЯМР Н, , м.ч. (DMSO-d6): 1,28-2,21 (м, 10Н, (СН2)5), 2,33 (с, 3Н, NCOCH3), 2,56 (с, 3Н, ССОСН3), 3,21 (м, 1Н, СH), 7,56 і 7,72 (д-д, 4Н, С6Н4). Знайдено, %: N 13,5; S 7,81. C20H21ClN4O2S. Вирахувано, %: N 13.4; S 7,67. Приклад 4. Для визначення протипухлинної активності 5,7-діацил-3-етил(циклогексил)-6-(4хлоро-3-R-феніл)-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазинів (3а-с). дослідження проведено in vitro на 60 лініях ракових клітин (лейкемії, легень, товстого кишечнику, ЦНС, меланоми, -5 яєчників, нирок, простати, молочної залози) при дії речовини в концентрації 10 моль/л за стандартною процедурою [10] оцінки мітотичної активності нових потенційних біологічно активних сполук методом флуоресцентного зафарбування (барвник - сульфородамін Б), виконаних у Національному інституті раку США (National Cancer Institute of Health, USA) в рамках Development Therapeutic Program. Результат проведених досліджень виражали у відсотках росту клітин раку у порівнянні з контролем - 5-флуорурацилом. Наведені у таблиці значення показують на скільки досліджувані сполуки є більш ефективними у пригніченні росту ракових клітин у порівнянні з контролем. Визначення проводили високочутливим флюорометричним методом, кількісно оцінюючи інтенсивність кольору флуоресцентного випромінювання (барвник - сульфородамін Б) через 48 год. опромінення клітини зі сполукою, що тестується. Результат проведених досліджень виражали у відсотках росту клітин раку до контролю. Використана система відбору та вивчення сполук з потенційною протипухлинною активністю in vitro основана на визначенні відсотку росту клітин пухлини (PG) під впливом сполуки, що тестується, який обчислюється за однією із наступних формул: Якщо (середня ODтест - середня ODtzero) > 0, тоді PG=100 × (середнє ODtest - середнє ODtzero) / (середнє ODctrl - середнє ODtzero); Якщо (середнє ODtest - середнє ODtzero) < 0, тоді PG=100 × (середнє ODtest - середнє ODtzero) / середнє ODtzero де: середнє ODtzero = середня величина оптичних вимірювань густини SRB-похідних кольорів безпосередньо перед дією на клітини тестованої сполуки; середнє ODtest = середня величина оптичних вимірювань густини SRB-похідних кольорів після 48 год. опромінення клітини тестованої сполуки; середнє ODctrl = середня величина оптичних вимірювань густини SRBпохідних кольорів після 48 год. без будь-якої дії на клітини тестованої сполуки. В умовах експерименту заявлені 5,7-діацил-3-етил(циклогексил)-6-(4-хлоро-3-R-феніл)-5H-5 [1,2,4]триазоло[3,4-b][1,3,4]тіадіазини (3а-с) у концентрації 10 моль/л виявили здатність пригнічувати ріст ракових клітин лейкемії: CCRF-CEM, HL-60(TB), K-562, MOLT-4, RPMI-8226 та SR. Крім того було відмічено, що похідні 5,7-діацил-3-етил(циклогексил)-6-(4-хлоро-3-R-феніл)5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазину також в певній мірі пригнічують ріст клітин практично всього спектру онкологічних захворювань людини (табл.). 1 5 10 15 20 25 30 35 40 Таблиця Протипухлинна активність сполук 3а-с in vitro -5 на лініях клітин раку при дії речовин в концентрації 10 моль/л Лінії ракових клітин CCRF-CEM HL-60(TB) К-562 MOLT-4 RPMI-8226 SR А549/АТСС EKVX 3а Лейкемія 13,56 32,77 25,33 6,20 16,03 Дрібноклітинний рак легень 32,51 3 3b 3с 24,59 42,80 28,14 0,85 27,89 13,10 17,39 15,07 21,76 7,80 23,29 5,21 63,61 48,18 26,62 UA 116952 U Таблиця Протипухлинна активність сполук 3а-с in vitro -5 на лініях клітин раку при дії речовин в концентрації 10 моль/л НОР-62 НОР-92 NCI-H226 NCI-H23 NCI-H322M NCI-H460 NCI-H522 COLO 205 HСС-2998 НСТ-116 НСТ-15 НТ29 КМ12 SW-620 SF-268 SF-295 SF-539 SNB-19 SNB-75 U251 LOX IMVI MALME-3M M14 MDA-MB-435 SK-MEL-2 SK-MEL-28 SK-MEL-5 UACC-257 UACC-62 IGROV1 OVCAR-3 OVCAR-4 OVCAR-5 OVCAR-8 NCI/ADR-RES SK-OV-3 786-0 A498 ACHN CAKI-1 RFX 393 SN12C TK-10 UO-31 PC-3 DU-145 97,70 38,80 54,53 42,72 75,52 54,33 68,55 Рак товстого кишечнику 74,38 85,83 26,61 16,99 53,72 26,46 36,59 Рак кори головного мозку 57,40 57,10 61,71 64,39 69,93 42,42 Меланома 32,19 83,33 63,69 46,85 80,18 70,80 49,75 76,96 43,77 Рак яєчників 61,17 64,88 61,46 52,71 20,13 49,96 105,19 Рак нирок 61,08 58,88 45,41 75,35 84,81 45,52 92,96 34,46 Рак простати 22,03 81,42 Рак молочної залози 4 94,14 82,77 59,65 58,75 71,62 87,16 93,23 64,67 45,36 38,29 71,73 62,90 52,00 104,82 95,41 32,49 31,33 89,30 36,28 81,99 55,97 67,55 11,51 27,39 27,44 24,23 46,28 70,77 98,55 81,88 80,14 48,73 77,02 47,67 72,28 54,62 60,14 35,65 64,84 55,92 91,62 85,54 65,02 125,13 74,58 18,21 57,05 55,52 29,37 50,45 30,41 76,37 44,87 83,16 81,32 75,33 86,65 84,19 88,88 38,36 40,32 47,80 55,11 36,78 75,36 82,49 81,13 70,96 76,20 85,77 92,61 72,44 107,95 63,95 71,81 74,14 75,40 49,95 30,85 39,25 40,91 30,07 116,83 38,27 86,94 UA 116952 U Таблиця Протипухлинна активність сполук 3а-с in vitro -5 на лініях клітин раку при дії речовин в концентрації 10 моль/л MCF7 MDA-MB-231/ATCC HS 578T ВТ-549 T-47D MDA-MB-468 5 10 15 20 25 30 35 40 45 45,06 12,02 84,69 44,95 38,90 68,83 51,50 54,13 111,88 45,91 32,85 67,51 32,13 24,98 39,40 69,06 Відповідно до наведеної таблиці, сполуки 3а-с, відносно клітин меланоми, лейкемії, дрібноклітинного раку легенів, раку товстого кишечнику, пухлин кори головного мозку, яєчників та нирок виявили більш високу протипухлинну активність, ніж препарат порівняння - 5флуороурацил. Так, сполука 3а щодо клітин лейкемії CCRF-CEM, К-562, MOLT-4 та RPMI-8226 затримка росту пухлин вище стандарту на 86,44 %, 74,67 %, 93,8 % та 83,97 % відповідно, клітин дрібноклітинного раку легенів А549/АТСС та НОР-92- на 67,49 %, та 61,20 %, клітин раку товстого кишечнику - на 14,17-83,01 %, клітин раку кори головного мозку - на 30,07-57,58 %, клітин раку нирок - на 15,19-65,54 %, %, клітин раку простати - на 18,58-77,97 %, а клітин меланоми на 16,67-67,81 %. Відносно клітин MDA-MB-231/ATCC заявлена сполука зупиняє ріст і поділ клітин на 87,98 %. Сполука 3b перевищує активність, порівняно з 5-флуороурацилом, майже до всіх досліджуваних клітин раку. Так, до клітин лейкемії CCRF-CEM, К-562, MOLT-4, RPMI-8226 та SR затримка росту пухлин вище стандарту на 75,41 %, 71,86 %, 99,15 %, 72,11 % та 86,90 % відповідно, клітин дрібноклітинного раку легенів NCI-H226 на 40,35 %, a NCI-H23 - на 41,25 %; клітин раку простати РС-3 - на 69,93 %, клітин меланоми LOX IMVI - на 64,35 % та клітин раку молочної залози T-47D на 67,15 %. Сполука 3с також перевищує активність, порівняно з 5-флуороурацилом, майже до всіх досліджуваних клітин раку. Так, до клітин лейкемії затримка росту пухлин вище стандарту на 78,24-94,79 %; клітин дрібноклітинного раку легенів EKVX на73,38 % та NCI-H23 на 61,71 %; клітин раку товстого кишечнику на 32,4588,49 %; пухлин кори головного мозку - на 22,88-51,27 %; клітин меланоми LOX IМVI - на 81,79 %; клітин раку яєчників - на 17,51-63,28 %; клітин раку нирок - на 34,62-71,07 %, клітин раку простати РС-3 на 61,73 % та клітин раку молочної залози - на 30,94-75,02 %. Таким чином, запропоновані нові біологічно активні сполуки, які можуть бути потенційними протипухлинними засобами. Джерела інформації: 1. Bedford Laboratories. Methotrexate for injection prescribing information. Bedford, OH: 2012 April. 2. Dava Pharmaceuticals, Inc. Rheumatrex (methotrexate tablets) prescribing information. Fort Lee, NJ: 2009 Jul. 3. Anon. Drugs of choice for cancer. Treatment Guidelines from the Medical Letter. 2003. - 1:4152. 4. Mycosis fungoides and the Sezary syndrome treatment. From PDQ: Physician data query (database). Bethesda, MD: National Cancer Institute; 2003, Dec 12. 5. Rajagopalan, P. T. Ravi; Zhang, Zhiquan; McCourt, Lynn; Dwyer, Mary; Benkovic, Stephen J.; Hammes, Gordon G. (2002). "Interaction of dihydrofolate reductase with methotrexate: Ensemble and single-molecule kinetics". Proceedings of the National Academy of Sciences. 99 (21): 13481-6. 6. Goodsell DS (August 1999). "The Molecular Perspective: Methotrexate". The Oncologist. 4 (4): 340-341. 7. Bhalerao, Uday Т.; Muralikrishna, Chivukula; Rani, Bonala Radha. Laccase Enzyme Catalysed Efficient Synthesis of 3-Substituted-1,2,4-Triazolo(4,3-b)(4,1,2)Benzothiadiazine-8-Ones Tetrahedron, 1994. - Vol.50, № 13. - Р. 4019-4024. 8. Marakos, Panagiotis; Papakonstantinou-Garoufalias, Spyroula; Tani, Ekaterini; Kourounakis, Panos N.; Athanasiou, George; Chytyroglou-Lada, Aikaterini. Synthesis and antifungal and antioxidant properties of some new 5-substituted-4-amino(or aryl)-3-mercapto-4(H)-1,2,4-triazoles Arzneimit-telForschung/Drug Research, 2002. - Vol. 52, № 7. - Р. 572-577. 9. Sasaki, Tadashi; Ito, Eikoh; Shimizu, Ikuo. Ring Transformation of 1,3,4-Oxadiazole to sTriazole-Fused Heterocycles. New Synthetic Route for Thiazolo[2,3-c]-s-triazole and 7H-sTriazolo[3,4-b][1,3,4]thiadiazine. Journal of Organic Chemistry, 1982. - Vol. 47, № 14. - Р. 2757-2760. 5 UA 116952 U 10. Beverly A. Teicher, Paul A. Andrews. Anticancer drug development guide: preclinical screening, clinical. - Medical. - 2004. - V. 1. - 450 p. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 5,7-Діацил-3-етил(циклогексил)-6-(4-хлоро-3-R-феніл)-5H-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазини N N N S N R R O O R1 Cl 10 , де R=H, CH2CH3, R1=H, Cl, що мають протипухлинну активність. Комп’ютерна верстка О. Рябко Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 417/00
Мітки: протипухлинну, мають, 5,7-діацил-3-етил(циклогексил)-6-(4-хлоро-3-r-феніл)-5н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазини, активність
Код посилання
<a href="https://ua.patents.su/8-116952-57-diacil-3-etilciklogeksil-6-4-khloro-3-r-fenil-5n-124triazolo34-b134tiadiazini-shho-mayut-protipukhlinnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">5,7-діацил-3-етил(циклогексил)-6-(4-хлоро-3-r-феніл)-5н-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазини, що мають протипухлинну активність</a>
Попередній патент: Підковдра
Наступний патент: Покрівельний лист
Випадковий патент: Спосіб виготовлення бринзи зі зниженим вмістом хлориду натрію












