Фармацевтична композиція
Формула / Реферат
(57) Фармацевтическая композиция, содержащая АСЕ-ингибитор и кислотный стабилизатор, отличающаяся тем, что в качестве стабилизатора она содержит донор НСІ, при весовом соотношении АСЕ-ингибитор : донор НСІ -2,5:1-1:7.
Текст
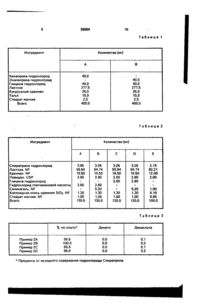
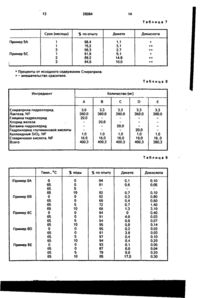
Фармацевтическая композиция, содержащая АСЕ-ингибитор и кислотный стабилизатор, о т л и ч а ю щ а я с я тем, что в качестве стабилизатора она содержит донор НСІ, при весовом соотношении АСЕ-ингибитор : донор НСІ - 2,5:1-1:7. С > Изобретение относится к новой фармацевтической композиции, содержащей АСЕингибитор и кислотный стабилизатор. Известно, что многие фармацевтические композиции нестабильны из-за того, что активный компонент разлагается, что снижает их пригодность Например, известно, что композиции, содержащие ингибитор АСЕ (Anglotensln Converting Enzyme), имеют этот недостаток, поскольку определенные ингибиторы АСЕ легко разлагаются в фармацевтических препаратах. Более конкретно, как и в случае других ингибиторов АСЕ, таких как квинакрил и эналаприл, спираприл может разлагаться в готовом препарате в дикетопиперазин (продукт внутренней циклизации) и дикислоту (продукт гидролиза эфира). В связи с этим предпринималось много попыток, направленных на преодоление проблемы нестабильности, связанной с композициями, содержащими ингибитор АСЕ: В патенте США № 4743450 стабилизируют фармацевтические композиции, содержащие ингибитор АСЕ, использованием в качестве стабилизатора сочетания соли ще лочного или щелочно-земельного металла (предпочтительно - карбоната магния) и сахарида (предпочтительно - маннитола или лактозы). Однако используемые стабилизаторы недостаточно эффективны. Задачей настоящего изобретения является создание фармацевтических композиций, обладающих повышенной стабильностью, особенно в присутствии влаги. Поставленная задача достигается новой фармацевтической композицией, содержащей АСЕ-ингибитор и кислотный стабилизатор, где в качестве стабилизатора используют донор HCI при весовом соотношении АСЕ-ингибитор:донор HCI (2,5:1)(1:7). Используемый в фармацевтической композиции в качестве стабилизатора донор НС! позволяет предохранить АСЕ-ингибитор от разложения. Такие композиции хранятся более длительное время, а также они могут быть менее чувствительны к влаге, и даже стабильность может повышаться при увеличении влажности, и/или они могут проявлять меньшее обесцвечивание через зна ю о* о о 26064 чительный период времени, и/или они могут проявлять меньшую нестабильность при их применении в присутствии окрашивающих веществ. В качестве стабилизатора можно ис- 5 пользовать любое вещество, продуцирующее соляную кислоту. Предпочтительными донорами кислоты являются гидрохлориды аминокислот, такие как гидрохлорид глицина, гидрохлорид глютаминовой кислоты, 10 гидрохлорид бетаина, гидрохлорид аланина, гидрохлорид валина, гидрохлорид лизина, гидрохлорид аргинина, гидрохлорид аспартовой кислоты, а также хлорид кислоты Льюиса, такой как феррохлорид, хлорид цинка и 15 хлорид алюминия. Более предпочтительными донорами кислоты являются гидрохлорид глицина, гидрохлорид глутаминовой кислоты и гидрохлорид бетаина. Наиболее предпочтитель- 20 ным донором кислоты является гидрохлорид глицина. Другие предпочтительные доноры соляной кислоты могут выбираться, например на основе измерений давления паров, опреде- 25 ляющего освобождение соляной кислоты, например такие, которые обладают свойствами, сходными со свойствами вышеупомянутых предпочтительных доноров кислоты. Хотя донор соляной кислоты может при- 30 меняться в любом количестве, которое предотвратит разложение активного компонента, например, по результатам стандартных тестов на стабильность, например, ингибитора АСЕ, используемое количе- 35 ство донора соляной кислоты таково, что весовое соотношение АСЕ-ингибитор:донор HCI составляет (2,5:1)-(1:7). Одним из классов ингибиторов АСЕ, входящих в состав настоящей композиции, 40 являются соединения формулы I: соон н н н \ | ' I •X-C-N-C-CH -СН II і | 2 г О СН COOR з з собой водород или метокси, a R3 - водород или метил. Наиболее предпочтительным соединением по вышеприведенной формуле является хинаприл с формулой .соон нн н \>C-N~C-C-CH 2 -СН n i t О СН 3 СООС Н ( О 50 где Ri и R2 независимо являются водородом или группой -ОСпНгп+1, где п является числом от 1 до 5 и R3- водород или группа -СпНгп+1, где п - такой, как определено выше. 55 В приведенной выше формуле предпочтительными соединениями являются те, которые имеют одинаковые Ri и R2. Более предпочтительными из них являются такие'' соединения, у которых Ri и R2 представляют 5 Все вышеуказанные соединения известны и описывались ранее, например в патенте США Ns 4344949, их используют при лечении повышенного давления (гипертензии). Другим классом ингибиторов АСЕ, входящих в состав композиции, являются соединения формулы II: R I С=0 R2 I I R-CH -CH-NH-CH-C-N А (II) С-СООН где R - Сі~Сб-алкил, бензил, бензилтио, бензилокси, фенилтио, или фенокси, . Ri - гидрокси или Ct-Сб-алкокси, R2 - водород, Сі~Сб-алкил или Сі-Сбаминоалкил. В вышеприведенной формуле предпочтительными соединениями являются те из них, у которых R является бензилом, Ri Сі-Сб-алкокси и R2 - водородом, метилом или аминобутилом. Более предпочтительными соединениями формулы II являются такие, у которых R - бензил, R2 - Сі~С4~алкокси и R2 - водород или метил. Еще более предпочтительными являются соединения, у которых R-бензил, Ri - этокси и R2 - метил. Наиболее предпочтительным соединением вышеприведенной формулы является эналеприл с формулой ОС Н 45 2 і 2 С=0 s СН СН СН -C-NH-C-C-N 2 2 і 1 II нО С оон н Все вышеуказанные соединения формулы II известны и описывались ранее, например в ЕР 12.401, их используют при лечении гипертензии. Особенно предпочтительным классом ингибиторов АСЕ, к которому применимо настоящее изобретение, являются соединения формулы III: 26064 6 групп, которые существенно воздействовали бы на активный компонент или стабилиС=0 R зирующий компонент. Например, вполне (ні) пригодны сахара, такие как лактоза, сахароR-CH -CH-NH-CH-C-N -COOH за, маннитол и сорбитол; крахмалы, такие 8 как кукурузный крахмал и крахмал из тапиоки, целлюлоза и ее производные, такие как где R, Ri и R2 имеют значения, указанные натрий карбоксиметилцеллюлоза, этилцелвыше для соединения формулы ІІ. люлоза и метилцеллюлоза: фосфаты кальНаиболее предпочтительным соедине- 10 ция, например дикальцийфосфат; сульфат нием формулы III является спираприл форнатрия и поливиниловый спирт. Соединения мулы такого типа обычно присутствуют в количествах от 5 до 90%, предпочтительно - от 10 до 80% от общего веса фармацевтической 15 композиции. Стабилизированные композиции по настоящему изобретению также могут содерСН СН -C-NH -C-C-N жать другие различные соединения, a которые обычно встречаются в фармацевти20 ческих составах, при этом единственным ограничением является то, что они должны быть совместимы с выбранной группой доВсе указанные соединения формулы III норов соляной кислоты, так, чтобы не меизвестны, описывались ранее, например в шать их стабилизирующему действию. патенте США № 4470972, и использовались 25 Типичными такими ингредиентами являютпри лечении гипертензии. ся смазывающие вещества, например тальк, Все соединения формул I, II и III образустеараты щелочно-земельных металлов, тают соли с различными неорганическими и кие как стеарат магния и стеарат кальция, органическими кислотами и основаниями, насыщенные (гидрогенированные) растиприготавливаемые обычными методами. По- 30 тельные масла, такие как масло из хлопковоэтому все такие соли, которые могут быть го семени; связующие, такие как использованы в качестве стабилизаторов из поливинилпирролидон (повидон) и желатин; выбранной группы доноров соляной кислодезинтегранты, такие как микрокристаллиты, согласуются с настоящим изобретением. ческая целлюлоза, поперечно связанный Количество активного компонента, на- 35 поливинилпирролидон и альгииовая кислота. Другие возможные ингредиенты - это пример ингибитора АСЕ, в фармацевтиченаполнители, вещества для связывания власких композициях по настоящему ги, буферы, консерванты, антиоксиданты, изобретению составляет 0,5-50%, предпочкрасители и вкусовые агенты. Общее количетительно - 0,75-25%, например от 1 до 25%, ство этих необязательных ингредиентов в более предпочтительно - от 0,75 до 20%, 40 стабилизированных композициях по настонапример 1-20% и наиболее предпочтиящему изобретению не имеет существеннотельно от 0,75 и 15%, например 1-15%, все го значения. Их общее количество зависит проценты от общего веса фармацевтической от количества активного компонента, стабикомпозиции. Как указало выше, все соединения фор- 45 лизатора и фармацевтически приемлемого носителя, то есть их общее количество будет мул I, II и III известны, и в литературных эквивалентно остатку фармацевтической источниках имеются данные об их полезнокомпозиции. сти в дневных дозировках. Фармацевтические композиции могут быть в любой форме, предпочтительными 50 Стабилизированные композиции по наявляются сухие формы, более предпочтистоящему изобретению могут быть получетельно - таблетки, капсулы и инкапсулироны посредством любых стандартных ванные таблетки. применяемых технологий, например методом влажного гранулирования. Эту технолоВ дополнение к активным компонентам, например ингибитору АСЕ, и стабилизирую- 55 гию предпочтительно выбирают для обеспечения гомогенного распределения щему компоненту, например гидрохлориду активного компонента и донора соляной глицина, фармацевтические композиции по ^кислоты поверх или среди частиц активного настоящему изобретению обычно содержат компонента. Донор соляной кислоты удобно фармацевтически приемлемый носитель, распределять в жидком виде, например с т.е. такие соединения, которые не содержат 2 26064 использованием водного раствора в качестве грануляционной жидкости. Примерами других рассматриваемых активных компонентов являются соединения с группой NH-CH-CO-N-C-COOH, как в вышеприведенных формулах 11 и III, например ,1 дикислотная форма "спираприла", спираприлат. Такие соединения включают рамиприл, преиндоприл, индолаприл, лизиноприл, алацеприл, трандолаприл, беназаприл, либензаприл, делаприл и цилизаприл. Нижеследующие примеры даны только с целью иллюстрации и никоим образом не предназначены для ограничения объема настоящего изобретения. П р и м е р 1. Ниже приведены стабилизированные композиции в соответствии с настоящим изобретением в виде белых таблеток (табл.1). П р и м е р 2. Следующие композиции A-D представляют стабилизированные композиции в соответствии с настоящим изобретением в виде белых таблеток, тогда как композиция Е не содержит стабилизатора по настоящему изобретению (табл.2). П р и м е р 3. Для того, чтобы продемонстрировать эффективность стабилизаторов по настоящему изобретению против дополнительной влажности, были получены следующие результаты с композициями по примеру 2A-2D, .которые хранили 3 месяца при 30°С и 75%-ной относительной влажности (табл.3). П р и м е р 4. Чтобы продемонстрировать эффективность стабилизаторов по настоящему изобретению против повышения температуры, были получены следующие результаты, когда композиции по примерам 2А и 2С хранили при 50°С различные сроки. Внизу дпя сравнения даны результаты, полученные с композицией по примеру 2Е, которую хранили при 50°С три месяца (табл.4). П р и м е р 5. Следующие композиции А, В и D представляют собой стабилизированные композиции в соответствии с настоящим изобретением в виде окрашенных таблеток, тогда как композиция С содержит малеиновую кислоту, раскрытый в более ранних публикациях подкислитель (табл.5). 5 10 15 20 25 30 35 40 45 Примерный способ получения. Партию в 1,6 млн. таблеток по примеру 5D изготавливают следующим образом: гидрохлорид спираприла (4,8 кг), 79,576 кг лактозы, 18 кг крахмала и 2,4 кг повидона раздельно про- сс сеивают (обычно на сите 1600/ІМ) и смешивают все вместе в высокоскоростной мешалке. Окись железа (0,024 кг) и лактозу (0.24 кг) смешивают вместе, просеивают и добавляют к смеси, полученной выше 8 2,4 кг гидрохлорида глицина в 13,40 деминерализованной воды заливают в смесь, полученную на предыдущей стадии, перемешивают и месят до готовности для процесса гранулирования. Гранулят сушат в сушилке с ожиженным слоем при 60°С, пока не достигается потеря при сушке около 2,1%, а затем просеивают (обычно 1000/гм). Получают партию гранул 107,44 кг. Аналогично изготавливают вторую партию 107,44 кг, и обе партии смешивают с получением 214,88 кг. В другой емкости смешивают 20,8 кг альгиновой кислоты, 2,4 кг коллоидного SIO2, а затем просеивают (обычно 1000 /гм), и просеивают почти со всем гранулятом, полученным выше. Смешивают вместе 1,92 кг стеарата магния и оставшуюся часть гранулята просеивают (обычно 1000 /гм) и соединяют с вышеполученной смесью. Таким образом, получают 240 кг таблеточной смеси, которую прессуют в таблетки. П р и м е р 6. Для того, чтобы продемонстрировать эффективность стабилизаторов по настоящему изобретению против повышения температуры в присутствии красителей, были получены следующие результаты, когда окрашенные кармином композиции по примерам 5А и 5В хранили при 50°С в течение трех месяцев (табл.6). П р и м е р 7. Для того, чтобы показать превосходство фармацевтических композиций по настоящему изобретению, были получены следующие результаты, когда композиции по примерам 5А и 5С хранили при 50°С различные сроки (табл.7). Пример 8 Следующие композиции A-D представляют собой стабилизированные композиции в соответствии с настоящим изобретением в виде белых таблеток, тогда как композиция Е не содержит стабилизатора по настоящему изобретению (табл 8). П р и м е р 9. Чтобы продемонстрировать эффективность фармацевтических композиций по настоящему изобретению против повышения температуры и дополнительной влаги, следующие результаты были получены, когда композиции по примерам 8A-8D хранили 72 часа. Для сравнения приведены результаты, полученные, когда композицию по примеру 8Е хранили 72 часа при тех же условиях (табл 9) П р и м е р 10 Чтобы продемонстрировэть более продолжительные сроки хранения стабилизированных композиций по настоящему изобретению, следующие результаты были получены, когда композицию по примеру 5А хранили длительный срок при различных условиях (табл 10) 26064 10 Таблица 1 Ингредиент Количество (мг) В А Хинаприла гидрохлорид Эналаприла гидрохлорид Глицина гидрохлорид Лактоза Кукурузный крахмал Тальк Стеарат магния Всего 40,0 40,0 40,0 277,5 25,0 15,0 2,5 400,0 40,0 277,5 25,0 15,0 2,5 400,0 Таблица 2 Ингредиент Количество (мг) А Спираприла гидрохлорид Лактоза, NF Крахмал, NF Повидон, USP Глицина гидрохлорид Гидрохлорид глютаминовой кислоты Силикагель, NF Коллоидная окись кремния SIO2, NF Стеарат магния, NF Всего в С D Е 3,06 99,94 19,50 2,60 3,06 94,74 19,50 2,60 2,60 5,20 1,30 1,00 130,0 3.06 94,74 19,50 2,60 2,60 3,19 80,21 12,00 2,00 2,60 3,06 99,94 19.50 2,60 2.60 1,30 1,00 130,0 5,20 1,30 1,00 130,0 1,90 0,10 0,60 100.0 1.30 1,00 130,0 Таблица 3 % по опыту* Пример 2А Пример 2В Пример 2С Пример 2D Д и кето Дикислота 99,6 100.0 99.6 99,9 0,0 0,0 0,0 0,0 0,1 0,2 0.1 0,2 * Проценты от исходного содержания гидрохлорида Спираприла. 26064 11 12 Таблица 4 Срок (месяцы) Д и кето Дикислота 1 Пример 2А % по опыту* 99,0 100,8 99,1 100.3 101.3 98.4 91,2 0.2 0,6 0,9 0.1 0,8 1БО 7,3 0,1 0,3 0,3 0.2 0,2 0.3 0,4 2 3 Пример 2С 1 2 3 3 Пример 2Е * Проценты исходного содержания Спираприла. + - наличие вмешательства красителя. Таблица 5 Ингредиент Количество (мг) А В с D Спираприла гидрохлорид Лактоза Крахмал Повидон Альгиновая кислота Глицина гидрохлорид Глютаминовой к-ты гидрохлорид Малеиновая кислота Кармин Окись железа, красная 3,06 96.94 19,50 2,60 3.06 96,94 19,50 2,60 3,06 96.94 19,50 2,60 6,0 99,77 22,50 3,0 13,0 3,0 КОЛЛОИДНЫЙ БЮг 1,30 1,00 130,00 Стеарат магния Всего 2,60 3,60 2,60 3,00 1,30 • 1,00 130,0 2,60 3,00 0,03 1,5 1,2 150,00 1.30 1,00 130,00 Таблица 6 % по опыту* Пример 5А Пример 5В Дикето Дикислота 96,3 96,0 2,7 1,8 ++ ++ * Проценты от исходного содержания Спираприла. + - наличие вмешательства красителя. 26064 13 14 Таблица 7 Срок (месяцы) % по опыту Дикето Дикислота 1 1 3 1 2 3 98,4 15,2 96,3 91,6 89,2 84,6 1,1 3,1 2,7 5,1 + Пример 5А Пример 5С ++ + 14,8 10,0 ++ ++ * Проценты от исходного содержания Спираприла. + - вмешательство красителя. Таблица 8 Ингредиент Количество (мг) А Спираприла гидрохлорид Лактоза, NF Глицина гидрохлорид Хлорид железа Бетаина гидрохлорид Гидрохлорид глутаминовой кислоты Коллоидный SiO2, NF Стеариновая кислота, NF Всего В D С Е 3,0 3,3 3,3 3,3 3,3 360,0 20,0 360,0 360,0 360,0 360,0 1,0 20,0 1,0 20,0 16,0 400,3 16,0 400,3 16.0 400,3 1,0 1,0 20,0 1,0 16,0 400,3 16,0 380,3 Таблица 9 Темп., °С Яіример 8А Пример 8В Пример 8С Пример 8D Пример 8Е % воды % по опыту Дикето Дикислота 0 65 65 65 0 0 0 5 10 0 0 94 91 92 62 66 72 66 94 91 94 95 95 91 97 94 93 87 79 65 0,1 0,6 0,7 0,3 0,4 0,7 1.3 0 4,0 0,9 0,8 0,2 3,6 0,4 0,4 0,1 6,0 9,0 0,10 0,05 65 65 65 0 65 65 65 0 65 65 65 0 65 65 65 5 10 0 0 5 10 0 0 5 10 0 0 5 10 17,0 _ 0,10 0,80 0,60 1,40 3,10 0,40 0,03 0,07 0,14 0,03 0.03 0,10 0,20 0,05 0,04 0,20 0,30 15 26064 T6 Т а б л и ц а 10 Срок (месяцы) 40°С 30°С 50°С 30°СП5 %РН ДК ДК ДА ДК ДА ДК ДА 0,4 0,4 0,5 0,9 1,1 1,5 0 3 6 9 1224 ДА 0.0 0,1 0,2 0,2 0,2 0,2 _ 1,3 1,7 2,6 _ 0,2 0,2 0,1 _ 2,5 3,0 _ 0.2 0,1 _ 0,4 0,5 _ 0,1 0,1 3 ДК - дикетопиперазин ДА - дикислота Упорядник Замовлення 4676 Техред М.Келемеш Коректор О.Кравцова Тираж Підписне Державне патентне відомство України, 254655, ГСП, КиТв-53, Львівська пл., 8 Відкрите акціонерне товариство "Патент", м. Ужгород, вул.Гагаріна. 101
ДивитисяДодаткова інформація
МПК / Мітки
Мітки: фармацевтична, композиція
Код посилання
<a href="https://ua.patents.su/8-26064-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція</a>
Попередній патент: Спосіб отримання бензинової фракції
Наступний патент: Спосіб безперервної полімеризації альфа-олефіну
Випадковий патент: Спосіб одержання 2,2-дифлуордіазоетану