Спосіб асиметричного одержання флорфеніколу, спосіб регіовибіркового розкриття хірального епоксиду та спосіб одержання r, s- ізомеру флорфеніколу
Формула / Реферат
1. Способ асимметричного получения флорфеникола формулы (I)
включающий получение оксазолина формулы (IV)
обработку его агентом фторирования с последующим гидролизом кислотой, отличающийся тем, что получение оксазолина вышеприведенной формулы (IV) включает стадию региоизбирательного открытия хирального эпоксида формулы (II)
путем последовательной обработки сильным основанием, кислотой Льюиса и дихлорацетонитрилом с получением оксазолина формулы (III)
и стадию избирательной инверсии-изомеризации полученного оксазолина формулы (III) путем последовательной обработки третичным амином и низшим алкилсульфонилхлоридом, водной кислотой и гидроксидом щелочного металла.
2. Способ региоизбирательного открытия хирального эпоксида формулы (II)
отличающийся тем, что он включает последовательную обработку сильным основанием, кислотой Льюиса и дихлорацетонитрилом с получением оксазолина формулы (III)
3. Способ получения R, S-изомера флорфеникола формулы (I)
отличающийся тем, что S, S- изомер флорфеникола формулы (V)
подвергают изомеризации путем последовательной обработки третичным амином и низшим алкилсульфонилхлоридом, водной кислотой и гидроксидом щелочного металла.
Текст
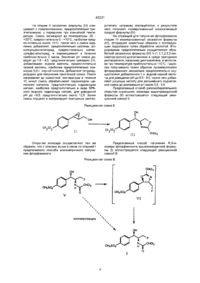
1 Способ асимметричного получения флорфеникола формулы (I) путем последовательной обработки сильным основанием, кислотой Льюиса и дихлорацетонитрилом с получением оксазолина формулы (III) ОН CH3SO2 СНСЇ2 (Ш) и стадию избирательной инверсии-изомеризации полученного оксазолина формулы (III) путем последовательной обработки третичным амином и низшим алкилсульфонилхлоридом, водной кислотой и гидроксидом щелочного металла 2 Способ региоизбирательного открытия хирального эпоксида формулы (II) ОН включающий получение оксазолина формулы (IV) сне: 2 го го го CH 3 SO 2 ' .00 обработку его агентом фторирования с последующим гидролизом кислотой, отличающийся тем, что получение оксазолина вышеприведенной формулы (IV) включает стадию региоизбирательного открытия хирального эпоксида формулы (II) отличающийся тем, что он включает последовательную обработку сильным основанием, кислотой Льюиса и дихлорацетонитрилом с получением оксазолина формулы (III) ОН CH3SO2 СНС1 2 (Ш). он (II) вш О 3 Способ получения R, S-изомера флорфеникола формулы (I) 43331 CH 3 SO; (V) CH3SO2 .(I) отличающийся тем, что S, S-изомер флорфеникола формулы (V) Настоящее изобретение относится к стереоспецифичному способу получения флорфеникола, в частности к способу получения флорфеникола, способу региоизбирательного открытия хирального эпоксида и к способу получения его R.S-изомера Известен способ получения флорфеникола [R-(R*, 3*)]-2,2-дихлор-г\1-1-(фтор-метил)-2-гидрокси-2-[4-(метилсульфонил)-фенил]-этилацетамида формулы (I) подвергают изомеризации путем последовательной обработки третичным амином и низшим алкилсульфонилхлоридом, водной кислотой и гидроксидом щелочного металла где Z имеет вышеуказанное значение, и полученное производное оксазолина формулы Б обрабатывают агентом фторирования с последующим гидролизом кислотой с получением флорфеникола (см WO 92/07824 А1, кл С07С 315/04, 14 05 92) Задачей изобретения является расширение технологической базы эффективного и экономичного получения флорфеникола Данная задача решается предлагаемым способом получения флорфеникола формулы (I) ОН 0) CH3SQ2 который заключается втом, что производное оксазолина формулы А включающим получение оксазолина формулы (IV) (IV) снагде Z означает метансульфонил, подвергают взаимодействию с реагентом, вызывающим равновесие с получением равновесной смеси, содержащей производное оксазолина вышеприведенной формулы А и производное оксазолина формулы Б CH 3 SO 2 обработку его агентом фторирования с последующим гидролизом кислотой, который заключается в том, что получение оксазолина вышеприведенной формулы (IV) включает стадию региоизбирательного открытия хирального эпоксида формулы (II) СНС1 (Ш CH3SO2 сн 2 он путем последовательной обработки сильным основанием, кислотой Льюиса и дихлорацетонитрилом с получением оксазолина формулы (III) 43331 он Дальнейшим объектом изобретения является способ получения R.S-изомера флорфеникола вышеприведенной формулы (I), заключающийся в том, что S.S-изомер флорфеникола формулы (V) (III) CH 3 SO 2 и стадию избирательной инверсии/изомеризации полученного оксазолина формулы (IV) путем последовательной обработки третичным амином и низшим алкилсульфонилхлоридом, водной кислотой и гидроксидом щелочного металла Дополнительным объектом изобретения является способ региоизбирательного открытия хирального эпоксида вышеприведенной формулы (II), заключающийся втом, что он включает последовательную обработку сильным основанием, кислотой Льюиса и дихлорацетонитрилом с получением оксазолина формулы (III) он он (V) подвергают изомеризации путем последовательной обработки третичным амином и низшим алкилсульфонилхлоридом, водной кислотой и гидроксидом щелочного металла Предлагаемый способ асимметричного получения флорфеникола иллюстрируется следующей реакционной схемой А (111) сна. Реакционная схема А Стадия он Стадия II он открытие эпоксида ш открытие эпоксида CH 3 SO 2 Стадия IV IV 1) фторирование 2) гидролиз CH3SO2 Хиральный эпоксид формулы (II) можно получать общеизвестными методами На стадии I эпоксид формулы (II) в виде раствора в пригодном растворителе, например тетрагидрофуране, медленно добавляют, предпочтительно каплями, к суспензии гидрида натрия в тетрагидрофуране при температуре от -10 до +20°С, предпочтительно от 0 до +10°С, наиболее предпочтительно примерно +5°С, и реакционную смесь оставляют стоять в течение около 30 минут К получаемой таким образом холодной смеси добавляют раствор безводного хлористого цинка в тетрагидрофуране Примерно через 30 минут при температуре от -10 до +20°С, предпочтительно от 0 до +10°С, наиболее предпочтительно примерно +5°С, к смеси добавляют раствор дихлорацетонитрила в тетрагидрофуране и молекулярное сито величиной пор 4А Смесь перемешивают в течение около 15 минут, нагревают до температуры 30 - 80°С, предпочтительно 50 - 60°С, наиболее предпочтительно 55°С, в течение 16 часов Получаемую смесь охлаждают до комнатной температуры, добавляют водный раствор бикарбоната натрия и экстрагируют пригодным растворителем, например этилацетатом, получаемый сырой продукт суспендируют в изопропаноле, фильтруют и сушат с выделением хирального оксазолина формулы (III) 43331 На стадии II оксазолин формулы (III) смешивают с триалкиламином, предпочтительно триэтиламином, и пиридином при комнатной температуре Смесь охлаждают до температуры -20 +20°С, предпочтительно 0 - +10°С, наиболее предпочтительно около +5°С, после чего к смеси медленно добавляют, предпочтительно каплями, алкилсульфонилхлорид, предпочтительно метансульфонилхлорид, и перемешивают в течение приблизительно 2 часов Значение рН смеси доводят до 1,9 - 4,0, предпочтительно примерно 2,0, добавлением водной кислоты, предпочтительно серной кислоты, наиболее предпочтительно примерно 3,0-н серной кислоты Добавляют тетрагидрофуран для получения гомогенной смеси После нагревания до комнатной температуры в течение 10 минут смесь обрабатывают гидроксидом щелочного металла, предпочтительно гидроксидом натрия, наиболее предпочтительно в виде 50%ного водного гидроксида натрия, для доведения рН до >9,5, предпочтительно около 12,5 Затем смесь сгущают и экстрагируют пригодным раство рителем, например етилацетатом, в результате чего получают изомеризованный оксазолиновый продукт формулы (IV) На служащей для получения флорфеникола стадии III изомеризованный оксазолин формулы (IV), фторируют известным образом с последующим гидролизом путем обработки кислотой Фторирование предпочтительно осуществляют обработкой оксазолина формулы (IV) 1\1-(1,1,1,2,3,3-гексафгорпропил)-диэтиламином в среде пригодного растворителя, например дихлорметана, в автоклаве при температуре приблизительно 110°С Гидролиз получаемого таким образом промежуточного фторированного оксазолина предпочтительно осуществляют добавлением 1 н водной серной кислоты для доведения рН до 6,5 - 6,0, после чего добавляют уксусную кислоту для дальнейшего подкисления смеси до достижения рН около 5,5 - 5,0 Предлагаемый способ региоизбирательного открытия хирального эпоксида вышеприведенной формулы (II) иллюстрируется следующей реакционной схемой Б Реакционная схема Б C H 3S0? снсь Открытие эпоксида осуществляют тем же образом, что и описано выше в связи со стадией I предлагаемого способа асимметричного получения флорфеникола Предлагаемый способ получения R.S-изомера флорфеникола вышеприведенной формулы (I) иллюстрируется следующей реакционной схемой В Реакционная схема В ОН VI изомеризация 43331 Изомеризацию осуществляют аналогично вышеописанной стадии II S.S-изомер флорфеникола смешивают с триалкиламином, предпочтительно триэтиламином, и пиридином при комнатной температуре Смесь охлаждают до температуры -20 до +20°С, предпочтительно 0 до +10°С, наиболее предпочтительно примерно +5°С, после чего к смеси медленно, предпочтительно каплями, добавляют алкилсульфонилхлорид, предпочтительно метансульфонилхлорид, и перемешивают в течение приблизительно 2 часов Затем реакционную смесь обрабатывают гидроксидом щелочного металла, предпочтительно гидроксидом натрия, наиболее предпочтительно в качестве 50%-ного водного гидроксида натрия, для доведения значения рН до примерно 12,5 Получаемый при этом промежуточный оксазолин формулы (VI) обрабатывают водным раствором кислоты, например уксусной кислоты, при комнатной температуре с получением R.S-изомера флорфеникола формулы (I) Следующие примеры поясняют настоящее изобретение Исходное соединение Пример 1 Смесь 312 г (2,99 моль) малоновой кислоты, 596 мл пиридина, 30 мл пиперидина и 300 г (1,49 моль) п-метилсульфонил-бензальдегида нагревают при 95 - 100° в течение 4 часов Смесь охлаждают до комнатной температуры и медленно подают в 3 л смеси соляной кислоты, воды и льда Выпавшийся осадок фильтруют, твердое вещество сушат и получают 340 г (83 %) производного Екоричной кислоты Температура плавления 294 296°С 1 Н-ЯМР (ДМСО-de, ч/милл) 7,96 (с, 4Н), 7,78 (д, J = 16 гц, 1Н), 6,71 (д, J = 16 гц, 1Н), 3,5 (шир с, 1Н), 3,25 (с, ЗН) Пример 2 Стадия А 2) борэн натрия Смесь 96 мл (1,35 моль) тионилхлорида и 50 г (0,225 моль) продукта примера 1 нагревают с обратным холодильником в течение часа Избыточный тионилхлорид отгоняют, после чего добавляют 100 мл дихлорметана Получаемый раствор прикапывают к предварительно охлажденной (до -5°С) смеси 42 г (1,1 моль) борана натрия и 500 мл этанола Реакционную смесь размешивают при 10°С в течение часа, после чего ее подают в смесь соляной кислоты, воды и льда, три раза экстрагируют дихлорметаном, взятым в количестве по 300 мл, экстракты объединяют, сгущают и фильтруют Получают 28 г (74 %) аллилового спирта Температура плавления 126-127°С 1 Н-ЯМР (CDCI3, ч/милл) 7,85 (д, J = 9 гц, 2Н), 6,52 (дт, J = 16 гц, 5 гц, 1Н), 4,38 (дд, J = 5 гц, 1 гц, 2Н), 3,05 (с, ЗН), 1,93 (шир с, 1Н) Стадия Б он •эп оксидирована в К 8 г молекулярного сита величиной пор 4А добавляют 1,74 г (7,4 ммоль) L-диизопропилвинной кислоты и 2,16 г (7,4 ммоль) изопропанолята титана (IV) при -20°С в безводных условиях и получаемую смесь перемешивают в течение 30 минут Прикапывают раствор 8,1 г (37 ммоль) аллилового спирта, получаемого на стадии А, в 500 мл дихлорметана и 13,4 мл 3,0-м раствора трет-бутил гид ропероксида в 2,2,4-триметилпентане Смесь перемешивают при -20°С в течение 4 часов, после чего добавляют 6,0 мл диметилсульфоксида, фильтруют, к фильтрату добавляют 250 мл насыщенного водного раствора фтористого натрия и перемешивают при 25°С в течение 16 часов Фильтруют на кизельгуре марки Целите и фильтрат три раза экстрагируют дихлорметаном, взятым в количестве по 100 мл Экстракты объединяют, дважды промывают водой, взятой в количестве по 100 мл, сгущают и фильтруют Получают 7,15 г (82%) 3,3-эпоксида, оптическая чистота которого составляет 97% Температура плавления 104- 106°С 1 Н-ЯМР (CDCI3) 7,92 (д, J = 8 гц, 2Н), 7,49 (д, J = 8 гц, 2Н), 4,10 (дд, J = 17 гц, 3 гц, 1Н), 4,04 (с, 1Н), 3,85 (дд, J = 17 гц, 3 гц, 1Н), 3,20 - 3,17 (м, 1Н), 3,05 (с, ЗН), 1,88 (шир с, 1Н) Оптическую чистоту эпоксида определяют хиральной хроматографией на колонке марки Chiracel OJ размером 25 см х 4,6 мм при температуре 25°С с применением в качестве элюента смеси гексана и изопропанола в соотношении 1 1, содержащей 1% ацетонитрила Стадия В CHjSQ, A^J N y° Смесь 6,1 г (153 ммоль) 60 %-ной дисперсии гидрида натрия в масле и 90 мл тетрагидрофурана охлаждают до 5°С К получаемой суспензии прикапывают раствор 30 г (128 ммоль) эпоксида стадии Б в 300 мл тетрагидрофурана, перемешивают при 5°С в течение 30 минут, после чего прикапывают 17,8 г (128 ммоль) безводного хлористого цинка в качестве раствора в 250 мл тетрагидрофурана и перемешивают при 5°С в течение 30 минут Прикапывают раствор 17,0 г (153 ммоль) дихлорацетонитрила в 10 мл тетрагидрофурана, после чего добавляют 1 г молекулярного сита ве 43331 личиной пор 4А и продолжают перемешивать при температуре 5°С в течение 15 минут Реакционную смесь нагревают до 55°С, перемешивают в течение 16 часов, охлаждают до комнатной температуры и добавляют водный раствор бикарбоната натрия Экстрагируют четыре раза этилацетатом, взятым в количестве по 400 мл, экстракты объединяют и сгущают Получаемый остаток суспендируют в изопропаноле, фильтруют и твердое вещество сушат Получают 16,0 г оксазолина, который перекристаллизовывают из метилизобутилкетона и получают очищенный оксазолин, чистота которого составляет 97% Температура плавления 156,5-157,5°С 1 Н-ЯМР (CDCI3) 7,93 (д, J = 8,4 гц, 2Н), 7,60 (д, J = 8,4 гц, 2Н), 6,26 (с, 1Н), 5,14 (д, J = 4 гц, 1Н), 4,57 (ддд, J = 8,7 гц, 7,9 гц, 4,0 гц, 1Н), 4,46 (дд, J = 9,7 гц, 7,9 гц, 1Н), 4,28 (дд, J = 9,7 гц, 8,7 гц, 1Н), 3,05 (с, ЗН), 2,60 (шир с, 1Н) Стадия Г зультате чего получают продукт оптической чистоты >99,9% Продукт очищают хроматографией на силикагеле Температура плавления 144-145°С 1 Н-ЯМР (ДМСО-de) 8,00 (д, J = 8,3 гц, 2Н), 7,26 (с, 1Н), 7,60 (д, J = 8,3 гц, 2Н), 5,75 (д, J = 6,4 гц, 1Н), 5,18 (т, J = 5,6 гц, 1Н), 4,10 - 4,05 (м, 1Н), 3,75 - 3,65 (м, 1Н), 3,60 - 3,55 (м, 1Н), 3,23 (с, ЗН) Оптическую чистоту оксазолина определяют хиральной хроматографией на колонке марки Chiracel OJ размером 25 см х 4,6 мм при температуре 25°С с применением в качестве элюента смеси гексана, изопропанола и ацетонитрила в соотношении 69 30 1 Стадия Д CHjSQj1 К 3,5 г (10 ммоль) оксазолина стадии В добавляют 5 мл пиридина и 2,8 мл триэтиламина при 25°С, получаемую смесь охлаждают до 5°С и прикапывают 0,95 мл (12 ммоль) метансульфонилхлорида Реакционную смесь перемешивают при 5°С в течение 2 часов, после чего добавлением 3,0-н водной серной кислоты рН доводят до 2 Затем к реакционной смеси добавляют 5 мл тетрагидрофурана, нагревают до комнатной температуры и перемешивают в течение 10 минут Добавлением 50%-ной водной гидроокиси натрия рН доводят до 12,5 Смесь сгущают и три раза экстрагируют этилацетатом, взятым в количестве по 30 мл Экстракты объединяют и сгущают, в ре В автоклав емкостью 30 мл подают 8,9 мл 23,3%-ного по весу раствора 1\1-(1,1,2,3,3,3-гексафторпропил)диэтиламина в метиленхлориде, после чего добавляют 2,0 г водной суспензии дихлорметилоксазолина стадии Г Автоклав закрывают и нагревают при температуре 100°С на масляной бане в течение 3 часов Затем охлаждают до 0°С, автоклав открывают и его содержимое перемешивают с 0,35 г ацетата калия и 2,0 мл метанола Органические растворители отгоняют и добавляют 20 мл смеси 2-пропанола и воды в соотношении 65 35 Остаток метиленхлорида отгоняют в вакууме и водную фазу нагревают с обратным холодильником в течение 3 часов Половину растворителя отгоняют в вакууме и оставшуюся водную фазу охлаждают до - 5°С при перемешивании Получаемые кристаллы фильтруют, промывают водой и сушат Выход 82% флорфеникола с чистотой 98,5% Пример 3 ОН OMs сна2 43331 Смесь 3,0 г (8,4 ммоль) S.S-изомера флорфеникола, 3 мл тетрагидрофурана, 3 мл пиридина и 2,3 мл триэтиламина при перемешивании охлаждают до 10 - 15°С Медленно прикалывают раствор 1,9 г (16,8 ммоль) метансульфонилхлорида в 2 мл тетрагидрофурана, поддерживая температуру при 10 - 15°С Получаемую смесь перемешивают при 10°С в течение 30 минут, потом нагревают до комнатной температуры и перемешивают в течение часа В этот момент образование промежуточного мезилата закончено К реакционной смеси добавляют 10 мл воды, охлаждают до 10°С, после чего медленно прикапывают раствор 2,7 г 50 %-ного водного гидроксида натрия, разбавленного в 5 мл воды Перемешивают в течение 10 минут при 10°С, добавляют еще 0,5 г 50 %-ного водного гидроксида натрия и продолжают перемешивать еще 10 минут до завершения образования промежуточного оксазолина Добавлением 1,0-н водной серной кислоты рН доводят до 6,5 - 6,0, после чего смесь дополнительно подкисляют добавлением уксусной кислоты до рН 5,5 - 5,0 Образуется осадок, который растворяют в ацетоне Получаемый раствор перемешивают при комнатной температуре в течение 16 часов, сгущают в вакууме для удаления тетрагидрофурана, пиридина и ацетона и получаемую смесь перемешивают в течение 30 минут при комнатной температуре Фильтруют, твердое вещество сушат и получают 2,5 г флорфеникола вышеприведенной формулы (I), имеющего чистоту 99% Тираж 50 екз Відкрите акціонерне товариство «Патент» Україна, 88000, м Ужгород, вул Гагаріна, 101 (03122) 3-72-89 (03122) 2-57-03 43331
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for assimetric obtaining of florfenicol, process for the regioselectively opening the chiral epoxide and the method of obtaining r, s-isomer of florfenikola
Автори англійськоюWU GUANG-ZHONG, TORMOS WANDA I.
Назва патенту російськоюСпособ ассиметрического получения флорфеникола, способ региоизбирательного раскрытия хирального эпоксида и способ получения r, s- изомера флорфеникола
Автори російськоюГуанг-Зонг Ву, Ванда Тормос И.
МПК / Мітки
МПК: C07C 317/32, C07B 53/00, C07C 231/00, C07D 263/14, C07C 233/18, C07C 315/00, C07D 303/00, C07C 233/25
Мітки: спосіб, ізомеру, епоксиду, хірального, флорфеніколу, розкриття, асиметричного, регіовибіркового, одержання
Код посилання
<a href="https://ua.patents.su/8-43331-sposib-asimetrichnogo-oderzhannya-florfenikolu-sposib-regiovibirkovogo-rozkrittya-khiralnogo-epoksidu-ta-sposib-oderzhannya-r-s-izomeru-florfenikolu.html" target="_blank" rel="follow" title="База патентів України">Спосіб асиметричного одержання флорфеніколу, спосіб регіовибіркового розкриття хірального епоксиду та спосіб одержання r, s- ізомеру флорфеніколу</a>
Попередній патент: Спосіб одержання гранул добривного фосфогіпсу
Наступний патент: Спосіб розриву пластів тиском стисненого газу і пристрій для його здійснення
Випадковий патент: Спосіб ліквідації порожнини ехінококової кістки іv сегмента печінки великих розмірів при відкритому хірургічному втручанні