Лікарський препарат для перорального застосування
Номер патенту: 49146
Опубліковано: 26.04.2010
Автори: Ковалєнко Алєксєй Лєонідовіч, Алєксєєва Людміла Євгеньєвна
Формула / Реферат
Лікарський препарат для перорального застосування, що містить як біологічно активну речовину N-метилглюкамінову сіль акридоноцтової кислоти, цільові добавки і кишковорозчинне покриття, який відрізняється тим, що додатково містить як добавку N-метилглюкамін, а кишковорозчинне покриття виконують у вигляді плівки на основі співполімеру метакрилової кислоти і етилакрилату, при наступному співвідношенні компонентів, мас. %:
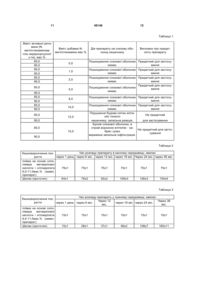
N - метилглюкамінова сіль акридоноцтової кислоти
83,0-90,0
N - метилглюкамін
2,0- 9,5
цільові добавки
1.1- 6,6
плівка на основі співполімеру метакрилової кислоти і етилакрилату
6,0-11,0.
Текст
Лікарський препарат для перорального застосування, що містить як біологічно активну речовину N-метилглюкамінову сіль акридоноцтової кислоти, цільові добавки і кишковорозчинне покриття, який відрізняється тим, що додатково містить як 3 49146 Даний препарат має лікувальну ефективність і може застосовуватися при проведенні тривалих курсів лікування вірусних захворювань і імунодефіцитних станів. Однак, відомий препарат має недоліки, пов'язані з використанням в якості кишковорозчинного покриття шелаку або ацетілфталілцелюлози. Нанесення покриття відомого лікарського препарату відбувається в органічному середовищі і, отже, технологія його виготовлення вимагає підвищених заходів пожежо і вибухобезпечності, а також негативно впливає на персонал і довкілля. Крім того, проведені дослідження показали, що при виготовленні таблеток з покриттям із шелаку або ацетілфталілцелюлози, в ядро таблетки потрапляє і сорбується велика кількість хлороформу, який є стандартним розчинником для вказаних покриттів. Наявність в лікарському препараті хлороформу, що має канцерогенну дію, може привести до розвитку побічних ефектів в організмі. Було встановлено, що покриття з ацетілфталілцелюлози з часом втрачає параметри кислотостійкості, що вимагає Фармакопея. Це відбувається внаслідок взаємодії ацетілфталілцелюлози з активною речовиною - N-метілглюкамінової сіллю акрідонуксусної кислоти з утворенням водорозчинних сполук, що сприяє передчасному розчиненню покриття в шлунку, а не в кишечнику, і призводить до зниження біодоступності активної речовини. Лікарський препарат, що містить в якості кишковорозчинного покриття - шелак, з часом втрачає параметри розчинності в лужному середовищі в результаті процесу полімеризації шелаку («старіння» покриття). Погіршення розчинності покриття з шелаку в лужному середовищі призводить до зниження біодоступності активної речовини внаслідок різкого збільшення часу розпаду таблетки, при якому вивільнення активної речовини сповільнюється і відбувається, в основному, в товстому кишечнику, де подальше розчинення покриття припиняється. Таким чином, у відомому лікарському препараті для перорального застосування, кишковорозчинне покриття з часом втрачає необхідні параметри кислотостійкості і розчинності і не забезпечує вивільнення активної речовини в кишечнику, що призводить до зменшення біодоступності активної речовини і зниження лікувальної ефективності препарату. Завданням корисної моделі є створення лікарського препарату для перорального застосування, що володіє високою лікувальною ефективністю і стабільністю лікарської форми при зберіганні. Поставлене завдання вирішується тим, що лікарський препарат для перорального застосування, що містить як біологічно активну речовину Nметілглкжамінову сіль акрідонуксусної кислоти, цільові добавки і кишковорозчинне покриття, згідно з винаходом, додатково містить як добавку Nметілглюкамін, а кишковорозчинне покриття виконують у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата, при наступному співвідношенні компонентів, мас.%: N – метілглюкамінова сіль акрі 83,0 -90,0 4 донуксусної кислоти N - метілглюкамін Цільові добавки Плівка на основі сополімера метакрілової кислоти і етілакрілата 2,0- 9,5 1,1- 6,6 6,0-11,0 Лікарський препарат, що заявляється, для перорального вживання містить як активну речовину N-метілглюкамінову сіль акрідонуксусної кислоти (1-дезоксі-1-N-[метіл(2-акрідон-9он-10-мулацетат)]-амоній-Д-глюцитол), яка відома як біологічно активна речовина, що має имуномодулюючу дію (ЕА патент №000382, С07Н5/06, приор. 22.01.1998р). В якості цільових добавок в препараті, що заявляється, використовують метілцелюлозу і стеарат кальцію. Лікарський препарат, що заявляється, додатково містить як добавку N - метілглюкамін (НД № 42-10844-00, НД № 42-6768-96). N - метілглюкамін є сильною органічною основою, і при введенні в шлунково-кишковий тракт, може спричинити ушкоджувальну дію на слизову оболонку кишечнику і призвести до її опіку. У зв'язку з цим, N-метілглюкамін у вільному стані не використовувався у відомих лікарських препаратах для перорального застосування. Авторами даної корисної моделі показано, що додавання N-метілглюкаміна в лікарський препарат для перорального застосування, що містить Nметілглюкамінову сіль акрідонуксусної кислоти, при експериментально підібраному оптимальному співвідношенні компонентів, не викликає пошкодження слизової оболонки кишечнику. Крім того, авторами вперше встановлений вплив N-метілглюкаміна на поліпшення розчинності покриття в кишечнику за рахунок стабілізації значення рН середовища кишечнику. При поліпшенні розчинності покриття в кишечнику, зменшується час розпаду лікарської форми, підвищується швидкість вивільнення активної речовини і відбувається більш швидше і повніше всмоктування його з місця введення в системний кровоток. Висока біодоступність активної речовини забезпечує швидке накопичення його в органах і тканинах організму в ефективній концентрації, що дозволяє скоротити час настання лікувального ефекту і підвищити лікувальну ефективність препарату. У лікарському препараті, що заявляється, для перорального застосування кишковорозчинне покриття виконують у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата. Для виготовлення плівки використовують сополімер метакрілової кислоти і етілакрілата у вигляді водної дисперсії з додаванням пластифікатора. Отримане покриття протягом довгого часу зберігає Фармакопейні параметри кислотостійкості і розчинності, що забезпечує стабільність лікарської форми при зберіганні. Таким чином, кишковорозчинне покриття препарату, що заявляється, у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата 5 дозволяє зберегти високу лікувальну ефективність препарату протягом всього часу його зберігання. Лікарський препарат, що заявляється, для перорального застосування при експериментально встановленому співвідношенні компонентів, є препаратом, що володіє високою лікувальною ефективністю і стабільністю лікарської форми при зберіганні. Корисну модель здійснюють наступним чином. Для приготування лікарського препарату, що заявляється, для перорального застосування здобувають ядро таблетки, яке покривають плівкою на основі сополімера метакрілової кислоти і етілакрілата. Для одержання ядер таблеток, 270г активної речовини - 1-дезоксі-1-N-[метіл(2-акрідон-9он-10мул-ацетат)]-амоній-Д-глюцитол і 30,4г Nметілгюкаміна гранулюють в сушарці-грануляторі, додаючи розчин крохмалю картопляного (цільова добавка). Гранулят просіюють, опудрюють стеаратом кальцію (цільова добавка) і таблетують отриману таблетну масу. Отримують 950 таблеток без покриття із середньою масою 0,3г (вихід 95%). Одна таблетка містить 0,27г 1-дезоксі-1-N[метіл(2-акрідон-9он-10-мул-ацетат)]-амоній-Дглюцитол, 0,03г N-метілглюкаміна, 0,004г крохмалю картопляного і стеарата кальцію (сумарно). Ядра таблеток в кількості 1000 штук поміщають в установку барабанного типу «Manesty», в яку подають 100 г водної дисперсії, що містить 18,0г сополімера метакрілової кислоти і етілакрілата і 2,0г пластифікатора (пропіленгліколь). В результаті, на поверхні ядра таблетки утворюється плівка масою 0,02г, що складає 6,25мас.% від загальної маси таблетки. Вихід готового препарату 92 %. Таким чином, кожна таблетка містить 83мас. % N-метілглюкамінової солі акрідонуксусної кислоти (активної речовини), 9,5мас.% Nметілглюкаміна (добавка), 1,25мас. % крохмалю картопляного і стеарата кальцію (цільові добавки) і 6,25мас.% кишковорозчинного покриття у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата. В таблицях 1-9 представлені результати експериментальних і клінічних досліджень лікарського препарату, що заявляється, для перорального застосування. В табл.1 представлені дані по вибору допустимого вмісту N-метілгюкаміна в препараті, що заявляється. В табл.2, 3, 4 представлені результати досліджень кислотостійкості і розчинності покриття препарату, що заявляється. В табл.5, 6, 7 представлені результати експериментальних досліджень розпаду і біологічній активності препарату, що заявляється. В табл.8, 9 представлені результати лікувальної ефективності препарату, що заявляється. Дослід 1. Перед вибором оптимального співвідношення компонентів, що входять до препарату, що заявляється, було визначено допустимий вміст цих компонентів. Вміст активної речовини - N-метілглюкамінової солі акрідонуксусної кислоти, встановили шляхом 49146 6 розрахунку ефективної разової дози, яка складає 0,27-0,90г на людину на добу, що відповідає 83,0 90,0 мас.%. Вміст допустимої кількості добавки Nметілгюкаміна в препараті визначили за результатами дослідження впливу N-метілглюкаміна на слизову оболонку кишечника експериментальних тварин. Дослід проводили на 32 кроликах породи Шиншила, отриманих з розплідника РАМН Рапполово. Тварин не годували протягом 24 годин до початку досліду і 48 годин після нього, даючи воду без обмежень. Протягом 2-х днів двічі на добу тваринам вводили внутришлунково через атравматичний зонд таблетки, вкриті плівкою на основі сополімера метакрілової кислоти і етілакрілата, що містять 83,0мас. % і 90,0мас. % активної речовини - N метілглкжамінової солі акрідонуксусної кислоти і різний вміст N-метілглюкаміна від 0,0 до 15,0 мас. % по відношенню до активної речовини. Для кожного складу використовували дві тварини. Через 48 годин після початку досліду, кроликів забивали електрострумом, вирізали тонкий кишечник і оцінювали дратівну дію Nметілглюкаміна на епітелій кишечнику при світловому мікроскопуванні на мікроскопі «БІОЛАМ». Результати дослідження представлені в таблиці. 1. Проведені дослідження показали, що препарат з вмістом N-метілглюкаміна 1,0 - 10,0 мас. % по відношенню до активної речовини, не викликає пошкодження слизової оболонки кишечнику. При вмісті добавки N-метілглюкаміна більше 10,0 мас. % спостерігалася запальна реакція слизової оболонки кишечнику. Так, при вмісті Nметілглюкаміна 12,0 мас. % відбувається порушення будови клітин епітелію тонкого кишечнику, а при вмісті N-метілглюкаміна 15,0 мас. % спостерігається ерозія слизової оболонки і частково - підслизового шару дванадцятипалої кишки. Крім того, в стромі ворсинок епітелію спостерігається набряк і різко виражена запальна інфільтрація. Отже, при вмісті добавки N-метілглюкаміна більше 10,0 мас.%, препарат справляє ушкоджувальну дію на слизову оболонку кишечнику. Таким чином, допустима кількість добавки Nметілгюкаміна в препараті складає 1,0 -10,0 мас. %. Оптимальне співвідношення компонентів, що входять до препарату, що заявляється, встановлювали в дослідах 2 і 3 на підставі визначення параметрів кислотостійкості і розчинності покриття препарату. Дослід 2. Параметри кислотостійкості і розчинності кишковорозчинного покриття у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата визначали за часом розпаду лікарської форми залежно від строку зберігання. Кислотостійкість покриття визначали за часом розпаду таблеток в кислому середовищі, що імітує середовище шлунку, при цьому, таблетки з кишковорозчинним покриттям повинні витримувати не менше 1 години в 0,1 н розчині соляної кислоти. 7 Розчинність покриття визначали за часом розпаду таблеток в лужному середовищі, що імітує середовище кишечнику, при цьому, таблетки, покриті кишковорозчинним покриттям, повинні повністю розпадатися в 1,5 % розчині натрію гідрокарбонату протягом 1 години. У досліді досліджували препарат, що заявлявся, з покриттям у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата з вмістом в інтервалі від 6,0 до 11,0 мас. %, і прототип з покриттям із шелаку. Для порівняльного дослідження покриттів використовували 5 серій по 100 таблеток, що упаковані в блістери і утримуються в умовах природного зберігання 1 день і 6, 12, 18, 24, 36 місяців. Результати дослідження, представлені в таблицях 2 і 3 показали, що через 1 день після виготовлення покриття препарату, що заявляється, і прототипу відповідали вимогам Державної Фармакопеї по параметрам кислотостійкості і розчинності. Препарат, що заявляється, з покриттям у вигляді плівки на основі з вмістом у 6,0 - 11,0 мас.%, зберігає параметри кислотостійкості і розпаду в лужному середовищі протягом 36 місяців. Кислотостійкість покриття з шелаку (прототип) зростає з часом і через 36 місяців складає 140,6% від початкового значення. Розчинність у лужному середовищі покриття прототипу з часом також погіршується: через 12 місяців час розпаду збільшився на 146,6 %, через 24 місяці - на 620 %, через 36 місяців - на 1000 %. Таким чином, при тривалому зберіганні відбувається «старіння» покриття з шелаку і через 18 місяців таблетки прототипу не придатні для медичного застосування. Дані, представлені в табл.4, показують, що при збільшенні вмісту покриття у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата більше 11,0 мас. %, має місце збільшення часу розпаду препарату в лужному середовищі, що призведе до зниження біодоступності активної речовини. При зменшенні вмісту покриття у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата менше 6,0 мас. %, має місце зменшення часу розпаду препарату в кислому середовищі, і, отже, вивільнення активної речовини відбуватиметься в шлунку, що призведе до різкого зниження біодоступності активної речовини. Таким чином, вміст кишковорозчинного покриття в препараті, що заявляється, в інтервалі 6,0 - 11,0 мас. % є оптимальним, оскільки при цьому вмісті покриття має параметри кислотостійкості і розчинності, що відповідають вимогам Фармакопеї, а також дозволяє берегти їх протягомтривалого часу, що забезпечує стабільність лікарської форми при зберіганні. Дослід 3. Оптимальний вміст добавки Nметілглюкаміна в лікарському препараті, що заявляється, для перорального застосування визначали на - підставі дослідження впливу Nметілглюкаміна на розпад лікарської форми в лужному середовищі, що імітує середовище кишечнику, і на швидкість вивільнення активної речовини. 49146 8 У досліді використовували препарат, що заявляється, і прототип, з вмістом активної речовини 83,0 мас. % і з вмістом N-метілглюкаміна від 0 до 10 мас. %. Дослідження розпаду лікарської форми проводили стандартним методом у 1,5 % розчині натрію гідрокарбонату на апараті фірми ERWEKA. Кількість активної речовини, що вивільнилася, визначали спектрофотометрично при 254 нм на приладі Shimadzu UV через 5, 10, 15, 30, 45 і 60 хвилин у день одержання дослідної серії таблеток. Для кожного дослідження використовували 5 серій по 100 таблеток. Результати дослідження, представлені в табл.5 показали, що при збільшенні вмісту Nметілглюкаміна в ядрі препарату, швидкість вивільнення активної речовини зростає незалежно від складу покриття препарату. Так, при вмісті N-метілглюкаміна 1,0 мас. % у ядрі таблеток з покриттям у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата, і з шелаку, повне вивільнення активної речовини (100%) відбувається через 30 хвилин. При вмісті N-метілглюкаміна від 5,0 до 10,0 мас. % у ядрі таблеток з покриттям як на основі сополімера метакрілової кислоти і етілакрілата, так і з шелаку, повне вивільнення активної речовини (100%) відбувається через 15 хвилин. За цей же час з ядра таблеток прототипу вивільнюється лише 42,5 % активної речовини, а з ядра таблеток з покриттям у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата, що не містять N-метілглюкамін, вивільнюється 48,3 % активної речовини. Приведені дані свідчать про вплив Nметілглюкаміна на розчинність покриття в лужному середовищі. Оскільки відомо, що розчинність покриття залежить від значення рН середовища кишечнику, яке може змінюватися залежно від стану організму людини, то важливо, щоб розчинність покриття якнайменше залежала від флуктуацій рН кишечнику. При вивільненні N-метілглюкаміна із складу ядра, відбувається підвищення, а потім - стабілізація лужності середовища кишечнику в результаті процесу дифузії і, отже, значення рН середовища кишечнику також стабілізується. Стабілізація значення рН середовища кишечнику приводить до поліпшення розчинності покриття і зменшення часу розпаду лікарської форми в кишечнику. При цьому, швидкість вивільнення активної речовини зростає. Таким чином, в лікарському препараті, що заявляється, для перорального застосування, оптимальним є вміст добавки N-метілглюкаміна від 5,0 до 10,0 мас.%, при якому відбувається повне вивільнення активної речовини за найбільш короткий час. Дослід 4. Дослідження біологічної активності лікарського препарату, що заявляється, проводили у порівнянні з прототипом на кроликах породи Шиншила вагою 2,7-3,1 кг, отриманих з розплідника РАМН Рапполово. Тварини були розбиті на шість груп по 48 особин в кожній. 9 У досліді досліджували препарат, що заявляється, і препарат, обраний як прототип, з однаковим вмістом активної речовини - 83,0 мас.%. Препарати були витримані в умовах природного зберігання 1 день і 6, 12, 18, 24, 36 місяців відповідно. Препарати вводили експериментальним тваринам у шлунково-кишковий тракт через атравматичний зонд одномиттєво по дві таблетки за 2 години до ранкового годування. Для дослідження біологічної активності препарату на момент його виготовлення, визначали титр / - інтерферону в сироватці крові, відібраної з вушної вени кролика через 4, 8, 16, 24 і 48 годин після введення таблеток стандартним методом (Ершов Ф.И., Система интерферона в норме и патологии, Москва, Медицина, 1996, с. 147-155). Результати досліджень представлені в таблицях 6 і 7. Дані, приведені в табл.7, показують, що пік біологічної активності прототипу (максимум індукції / - інтерферону у сироватці крові) спостерігався через 8 годин після введення препарату всередину. Пік біологічної активності препарату, що заявляється, спостерігався через 4 години після введення препарату всередину, при цьому максимальне значення титру / - інтерферону в сироватці крові зросло в 3,3 разу в порівнянні з прототипом. Таким чином, показники індукції інтерферону свідчать про високу біологічну активність препарату, що заявляється, максимум якою спостерігається раніше, ніж в прототипі, що дозволяє скоротити час настання лікувального ефекту. Результати дослідження біологічної активності препаратів залежно від терміну зберігання представлені в табл.8. Біологічну активність визначали за значенням титру / - інтерферону в сироватці крові через 4 години після введення відповідного препарату. Представлені дані показують, що біологічна активність препарату, обраного як прототип, через 12 місяців знижується на 25,0 %, через 24 місяці на 37,5 %, а через 36 місяців - повністю припиняється. Це пов'язано зі зменшенням біодоступності активної речовини за рахунок «старіння» покриття препарату. Значення титру / - інтерферону в сироватці крові через 4 години після введення препарату, що заявляється, з різним терміном зберігання, залишалося постійним, що свідчить про стабільність його біологічної активності протягом тривалого часу. Таким чином, препарат, що заявляється, для перорального застосування при встановленому оптимальному співвідношенні компонентів, має високу біологічну активність, яка досягається в короткі терміни і зберігається постійною при тривалому зберіганні препарату. Ефективність лікувальної дії препарату, що заявляється, оцінювали при проведенні курсу лікування ВІЛ-інфікованих хворих. Лікування здійснювали амбулаторно у 150 чоловік з вихідними показниками, що відображають 49146 10 різні стадії захворювання: вірусне навантаження (кількість вірусів в 1 мл крові) складала 3000060000 копій РНК вірусу в мл, ключовий показник імунітету склав 300-400 середнього значення СД4 маркерів Т-лімфоцитів. Хворі були поділені натри групи по 50 чоловік в кожній. В 1-ій групі хворі вживали препарат, що заявляється, який містить 83 мас. % Nметілглюкамінової солі акрідонуксусної кислоти (активної речовини), 9,5 мас. % N-метілглюкаміна (добавка), 1,25мас.% цільових добавок і має кишковорозчинне покриття у вигляді плівки на основі сополімера метакрілової кислоти і етілакрілата з вмістом 6,25мас. %. В 2-ой групі хворі вживали препарат, обраний за прототип, з таким же вмістом активної речовини - N-метілглюкамінової солі акрідонуксусної кислоти, як в препараті, що заявляється, і покриттям з шелаку. В 3-їй групі хворі отримували препарат - плацебо з кишковорозчинним покриттям з шелаку. В кожній групі хворі приймали по 4 таблетки 1 раз на добу через 5 днів протягом 12 місяців. Ефективність лікування оцінювалася по динаміці показників вірусного навантаження і імунітету у хворих, виміряних через б і 12 місяців після початку лікування. Результати лікування в трьох групах представлені в таблицях 8 і 9. Дані, приведені в табл.8, показують, що в 1-ій групі через 12 місяців після початку лікування, вірусне навантаження у хворих знизилось в 50,1 рази. В 2-ій групі через 12 місяців після початку лікування, вірусне навантаження у хворих знизилось в 15,8 рази, що в 3,2 рази менше, ніж в 1-ій групі. В 3-ій групі у хворих, що не отримували лікування, вірусне навантаження зросло в 1,5 рази, що свідчить про прогрес захворювання. В табл.9 представлена динаміка ключового показника імунітету - середнього значення СД4 маркерів Т- лімфоцитів в трьох групах хворих. В 1-ій і 2-ій групах значення показника імунітету у хворих зростали, в 3-ій групі показник імунітету зменшився на 14,7 %. При цьому, в 2-ій групі через 12 місяців після початку лікування середнє значення СД4-маркерів Т-лімфоцитів підвищилося на 30.5 %, а в 1-ій групі це значення підвищилося на 80,7 %. Таким чином, представлені результати лікування ВІЛ-інфікованих хворих підтверджують високу лікувальну ефективність препарату, що заявляється. Лікарський препарат для перорального застосування составу, що заявляється, володіє високою лікувальною ефективністю, а також стабільністю лікарської форми при зберіганні, дозволяє скоротити час настання лікувального ефекту і може бути використаний для проведення тривалих курсів лікування захворювань вірусної природи, а також імунодефіцитних станів, у тому числі ВІЛобумовлених. 11 49146 12 Таблиця 1 Вміст активної речовини (Nметілглюкамінова сіль акрідонуксусної к-ти), мас.% 83,0 90,0 83,0 90,0 83,0 90,0 83,0 90,0 83,0 90,0 83,0 90,0 83,0 Вміст добавки Nметілглюкаміна мас.% Висновок про придатність препарату 0,0 Пошкодження слизової оболонки Придатний для застосунемає. вання 1,0 Пошкодження слизової оболонки Придатний для застосунемає. вання 2,0 5,0 8,0 10,0 12,0 90,0 83,0 15,0 90,0 Дія препарату на слизову оболонку кишечнику Пошкодження слизової оболонки Придатний для застосунемає. вання Придатний для застосуПошкодження слизової оболонки вання немає. Пошкодження слизової оболонки Придатний для застосунемає. вання Пошкодження слизової оболонки Придатний для застосунемає. вання Порушення будови клітин епітеНе придатний лію тонкого кишечнику, запальна реакція. для застосування Ерозія слизової оболонки, в стромі ворсинок епітелію - наНе придатний для застобряк і різко сування виражена запальна інфільтрація. Таблиця 2 Час розпаду препарату в кислому середовищі, хвилин Кишковорозчинне покриття через 1 день через 6 міс. через 12 міс. через 18 міс. Через 24 міс. через 36 міс. плівка на основі сополімера метакрілової кислоти і етілакрілата 75±1 75±1 75±1 75±1 75±1 75±1 6,0-11,0мас.% (заявл. препарат) Шелак (прототип) 64±1 76±2 92±2 109±3 126±3 154±4 Таблиця 3 Час розпаду препарату у лужному середовищі, хвилин Кишковорозчинне покЧерез 12 Через 36 риття через 1 день через 6 міс. через 18 міс через 24 міс. міс. міс. плівка на основі сополімера метакрілової кислоти і етілакрілата 15±1 15±1 15±1 15±1 15±1 15±1 6,0-11,0мас.% (заявл. препарат) Шелак (прототип) 15±1 28±1 37±1 56±2 108±7 165±11 13 49146 14 Таблиця 4 Плівка на основі сополімера метакрілової кислоти і етілакрілата, мас. % 5,0 6,0-11,0 12,0 Час розпаду препарату в лужному середовищі, хвилин Час розпаду препарату в кислому середовищі, хвилин 5±1 15±1 58±1 20±1 75±1 92±1 Таблиця 5 Плівка на основі сополімера метакрілової кислоти і етілакрілата (6,0-1-1,0 мас. %) Вміст Nметілглюкаміна в ядрі (мас.%) 0,0 1,0 5,0 через 5 хв. Сліди Сліди 2,8±0,7 Вивільнення активної речовини, % через 10 через 15 через 30 через 45 через 60 хв. хв. хв. хв. хв. 6,1±0,9 48,3±3,7 100 100 100 12,1±2,5 78,6±5,3 100 100 100 42,4±5,7 100 100 100 100 10,0 6,4±1,5 69,2±8,1 100 100 100 100 0,0 1,0 5,0 10,0 Кишковорозчинне покриття Сліди Сліди 2,1 ±0,5 6,2±1,2 5,1±0,7 10,1+2,5 38,3±4,1 65,6±8,4 42,5±4,7 62,2±5,0 100 100 100 100 100 100 100 100 100 100 100 100 100 100 Шелак Таблиця 6 Препарат Препарат, що заявляється Прототип через 4 години Титр ( / - інтерферону в сироватці крові (МЕ/мл) через 8 години через 16 години через 24 години через 48 години 360000 240000 180000 52000 0 64000 96000 48000 0 0 Таблиця 7 Препарат Препарат, що заявляється Прототип Титр / - інтерферону в сироватці крові (МЕ/мл) через 4 години після введення препарату, при терміні зберігання препарату 1 день 6 міс. 12 міс. 18 міс. 24 міс. 36 міс. 360000 360000 360000 360000 360000 360000 64000 64000 48000 48000 40000 0 Таблиця 8 Група хворих 1 (препарат, що заявляється) 2 (прототип) 3 (плацебо) Вірусне навантаження в сироватці крові, Log10 копій РНК/мл Початкове через 6 місяців через 12 місяців 4,8±0,6 3,8±0,3 3,1±0,3 4,7±0,5 4,5±0,6 4,2±0,5 4,6±0,5 3,9±0,3 4,6±0,6 Таблиця 9 Група хворих 1 (препарат, що заявляється) 2 (прототип) 3 (плацебо) Середні значення СД4-маркерів Т-лімфоцитів Початкове через 6 місяців через 12 місяців 328,9±39,3 512,8±23,7 594,4±34,5 368,1±48,4 380,8±29,5 412,7±36,2 355,2±29,4 480,5±48,8 324,7±50,7 15 Комп’ютерна верстка І.Скворцова 49146 Підписне 16 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPreparation for oral use
Автори англійськоюAlekseeva Liudmila Yevhenievna, Kovalenko Aleksei Leonidovich
Назва патенту російськоюЛекарственный препарат для перорального применения
Автори російськоюАлексеева Людмила Евгеньевна, Коваленко Алексей Леонидович
МПК / Мітки
МПК: A61K 31/19, A61K 9/20
Мітки: лікарський, препарат, перорального, застосування
Код посилання
<a href="https://ua.patents.su/8-49146-likarskijj-preparat-dlya-peroralnogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Лікарський препарат для перорального застосування</a>
Попередній патент: Станок для утримання підсисних свиноматок
Наступний патент: Тренажер для водного моціону свиней
Випадковий патент: Сполуки бензоїламіногетероциклілу як активатори глюкокінази