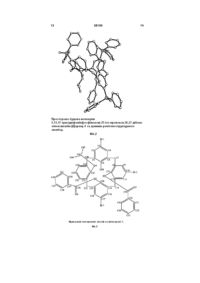
Спосіб одержання 5,11,17-трис(дифенілфосфіно)-25-ізо-пропокси-26,27,28-тригідроксикалікс[4]арену
Номер патенту: 58150
Опубліковано: 11.04.2011
Автори: Шишкін Олег Валерійович, Кальченко Віталій Іванович, Матвєєв Юрій Іванович, Шишкіна Світлана Валентинівна
Формула / Реферат
Спосіб одержання 5,11,17-трис(дифенілфосфіно)-25-ізо-пропокси-26,27,28-тригідроксикалікс[4]арену загальної формули:
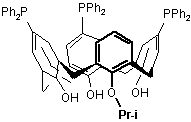 ,
,
який відрізняється тим, що моноізо-пропоксикаліксарен бромують N-бромосукцинімідом в ацетоні до 5,11,17-трибромо-25-ізо-пропоксикалікс[4]арену, який взаємодією з безоїлхлоридом в присутності основи дає 5,11,17-трибромо-25-ізо-пропокси-26,27- дибензоїлоксикалікс[4]арен, який при нагріванні в присутності NiBr2 вступає в реакцію Арбузова-Тавса з дифенілізопропілфосфінітом з утворенням 5,11,17-трис(дифенілфосфінокси)-25-ізо-пропокси-26,27-дибензоїлокси-калікс[4]арену, лужний гідроліз якого приводить до утворення 5,11,17-трис(дифенілфосфінокси)-25-ізо-пропокси-26,27,28-тригідрокси-калікс[4]арену, відновленням останнього фенілсиланом в толуолі отримують цільовий 5,11,17-трис(дифенілфосфіно)-25-ізо-пропокси-26,27,28-тригідроксикалікс[4]арен, який виділяють як і проміжні продукти звичайними методами.
Текст
Спосіб одержання 5,11,17трис(дифенілфосфіно)-25-ізо-пропокси-26,27,28тригідроксикалікс[4]арену загальної формули: OH Pr-i Ph2P PPh2 OH OH O PPh2 OH Pr-i Ця сполука може знайти застосування для створення гібридних органо-неорганічних гетерогенних каталізаторів органічних реакцій та як сорбент перехідних, важких та благородних металів. Названа сполука, її властивості та застосування в патентних виданнях і науковій літературі не описані. Найближчими структурними аналогами сполуки, яка заявляється є 25-ізопропокси-26,27,28тригідроксикалікс[4]арен А та 5,11,17трис(дифенілфосфіно)-25,26,27,28тетрапропоксикалікс[4]арен Б: (11) Корисна модель відноситься до органічної хімії, а саме до способу одержання 5,11,17трис(дифенілфосфіно)-25-ізопропоксикалікс[4]арену загальної формули: 58150 , UA OH OH O PPh2 (19) PPh2 який відрізняється тим, що моноізопропоксикаліксарен бромують Nбромосукцинімідом в ацетоні до 5,11,17-трибромо25-ізо-пропоксикалікс[4]арену, який взаємодією з безоїлхлоридом в присутності основи дає 5,11,17трибромо-25-ізо-пропокси-26,27- дибензоїлоксикалікс[4]арен, який при нагріванні в присутності NiBr2 вступає в реакцію Арбузова-Тавса з дифенілізопропілфосфінітом з утворенням 5,11,17трис(дифенілфосфінокси)-25-ізо-пропокси-26,27дибензоїлокси-калікс[4]арену, лужний гідроліз якого приводить до утворення 5,11,17трис(дифенілфосфінокси)-25-ізо-пропокси26,27,28-тригідрокси-калікс[4]арену, відновленням останнього фенілсиланом в толуолі отримують цільовий 5,11,17-трис(дифенілфосфіно)-25-ізопропокси-26,27,28-тригідроксикалікс[4]арен, який виділяють як і проміжні продукти звичайними методами. U 2 (13) 1 Ph2P видається під відповідальність власника патенту ОПИС 3 OH OH O 58150 OH ,А PPh2 Ph2P PPh2 O O O O ,Б Сполука А завдяки наявності трьох гідроксильних груп на нижньому вінці макроциклу здатна до хімічного зв'язування з поверхнею силікагелю [2] по типу: O O OH OH OH O SiO2 Разом з тим сполука А не містить металкоординуючих груп на верхньому вінці макроциклу. Сполука Б, подібно іншим фосфінокаліксаренам, здатна утворювати комплекси з перехідними, важкими та благородними металами [3]. Наприклад, в роботі [6] описано застосування нікелевого комплексу дибромобіс(дифенілфосфіно)тетрапропоксикалікс[4]арену в суміші з комплексом цирконію як гомогенного каталізатора для отримання поліетилену низького тиску: Br Ni Br PPh2 Br Cl Zr Pr O O Pr Cl O Pr Pr OH Pr-i , O PPh2 OH Si Ph2P PPh2 OOR Si Br Методи синтезу широкого спектру фосфоровмісних каліксаренів та їх застосування для каталізу органічних реакцій різного типу та сорбції катіонів перехідних, важких та благородних металів узагальнені в огляді [7]. Разом з цим сполука Б не містить на нижньому вінці макроциклу реакційних груп, здатних до хімічного зв'язування з поверхнею полімерних носіїв. В літературі описано метод отримання тетрапропокси трпе(дифенілфосфіно)каліксарену Б літіюванням трибромотетрапропокси-каліксарену бутиллілієм та наступною взаємодією Li-похідного з хлородифенілфосфіном [3]. Аналогічно отримані інші діфенілфосфінопохідні кліксаренів різного ступеня заміщення [4,5]. Проте, цей метод не придатний для отримання С-літієвих похідних гідроксикаліксаренів. Дифенілфосфінові похідні алкоксикаліксаренів отримано також Ni-каталітичним фосфорилюванням бромоалкоксикаліксаренів алкіловими естерами дифенілфосфінистої кислоти та наступним відновленням утворених фосфін оксидів фенілсиланом. Разом з тим описаний метод виявився непридатним для фосфорилювання трибромоізопропокситригідроксикалікс [4] арену. Задачею корисної моделі є спосіб отримання 5,11,17-трис(дифенілфосфіно)-25-ізопропоксикалікс[4]арену загальної формули: Ph2P Ti O 4 , Спосіб одержання сполуки, яка заявляється складається з п'яти стадій, згідно наведеної нижче схеми. Бромування моноізопропоксикалікс[4]арену 1N-бромосукцинімідом дає 5,11,17-трибромо-25-ізо-пропоксикалікс[4]арен 2. При взаємодії 2 з безоїлхлоридом в присутності основи утворюється 5,11,17-трибромо-25-ізопропокси-26,27-дибензоїлоксикалікс[4]арен 3. Каліксарен 3 вступає в реакцію Арбузова-Тавса з алкіловими естерами дифенілфосфінистої кислоти з утворенням 5,11,17-трис(дифенілфосфінокси)25-ізо-пропокси-26,27-дібензоїлоксикалікс-[4]арену 4. Гідроліз 4 призводить до відщеплення бензоїльних груп та утворення 5,11,17трис(дифенілфосфінокси)-25-ізопропоксикалікс[4]арену 5. Відновлення 5 дає цільовий 5,11,17-трис(дифенілфосфіно)-25-ізопропоксикалікс[4]арен 6. 5 58150 Br 6 Br Br Br C(O)Ph Br O B OH OH OH O O 1 Ph2P(O) OH O O OH O OH PhC(O) 2 P(O)Ph2 C(O)Ph O PhC(O) Br 3 P(O)Ph2 Ph2P(O) P(O)Ph2 Ph2P PPh2 PPh2 PhSiH3 KOH/MeOH/H2O O OH O Ph2P-OPr-i/NiBr2 PhC(O)Cl NBS O OH O OH OH OH O OH P(O)Ph2 4 Варто зазначити, що спроби провести фосфорилювання речовини 2 дифеніл ізопропілфосфітом в умовах реакції Арбузова-Тавса виявились безрезультатними. На відміну від тригідроксикаліксарену 2 похідне 3 з захищеними гідроксильними группами легко вступає в реакцію Арбузова-Тавса з утворенням 5,11,17трис(дифенілфосфінокси)-25-ізо-пропокси-26,27дібензоїлоксікалікс[4]арену 4. Індивідуальність та структура всіх отриманих 1 31 13 каліксаренів 2-6 доведені ІЧ-, ЯМР Н-, Р- та С спектрами, елементним аналізом, методом LCMS. Структура сполук 3 та 4, які знаходяться в конформації частковий конус, підтверджені рентгеноструктурним дослідженням (див. фіг. 1, 2). Корисна модель ілюструється методами отримання і фізико-хімічними характеристиками всіх синтезованих сполук. Приклад 1. Спосіб одержання 5,11,17трибромо-25-ізо-пропоксикалікс[4]арену 2. До розчину 0.93 г (2.0 ммоля) моноізопропоксикаліксарену 1 в 60 мл сухого ацетону додають 1.07 г (6.0 ммоля) N-бромосукциніміду і перемішують при 20 °С впродовж 24 годин. Реакційну суміш розбавляють вдвічі водою, твердий світло-жовтий продукт відфільтровують, промивають на фільтрі 250 мл теплої води, сушать на відкритому повітрі. Вихід 1.28 г (91 %), т.топл.> 330°С (з розкл.). 1 Спектр ЯМР Н (DMSO-d6) δ, м.ч.: 1.45 д (6Н, СН3, J 5.9 Гц), 3.46 д (2Н, АrСН2-екв., J 13.4 Гц), 3.53 д (2Н, АrСН2-екв., J 13.4 Гц), 4.20 д (4Н, АrСН2-акс, J 13.4 Гц), 4.37 м (1Н, СН, J 5.9 Гц), 6.88 т (1Н, рАrН, J 7.5 Гц), 7.20 д (2Н, м-ArH, J 7.5 Гц), 7.30 с (2Н, АrН), 7.44 с (4Н, АrН). Знайдено, %: С 54.27; Н 4.16; Вr 32.58. С31Н27Вr3О4. Вирахувано, %: С 52.94; Н 3.87; Вr 34.09. Приклад 2. Спосіб одержання 5,11,17-трибромо-25-ізопропокси-26,27-дибензоїл-оксикалікс[4]арену 3. До 0.7 г (1.0 ммоля) трибромокаліксарену 2 додають 10 мл піридину, 2.11 г (15 ммолей) бензоїлхлориду і перемішують при 20 °С впродовж 72 годин. Реакційну суміш підкисляють розбавленою 5 6 соляною кислотою до рН 3-4 та екстрагують хлороформом (2 х 10 мл). Органічний шар відокремлюють, промивають водою (2 х 50 мл), насиченим розчином NaCl, висушують над сульфатом натрію. Розчин упарюють до 5 мл, додають метанол до початку кристалізації і залишають на 24 години. Осад, що утворився відокремлюють і кристалізують з суміші бензол-гексан. Отримують безбарвні кристали. Вихід 0.57 г (63 %), т.топл.> 300 °С (з -1 розкл.). ІЧ спектр (КВг), см : 1730 (С=О), 2930, 1 2980, 3060 (СН), 3260 (ОН). Спектр ЯМР Н (CDCl3) δ, мл.: 1.33 та 1.47 2д (3Н кожний, СН3, J 5.9 Гц), 3.20 д (1Н, АrСН2-екв., J 12.8 Гц), 3.44 д (1Н, АrСН2-екв., J 14.0 Гц), 3.66 д (1Н, АrСН2-екв., J 15.9 Гц), 3.79 д (2Н, АrСН2-екв.+ АrСН3-акс, J 15.9 Гц), 3.98, 4.01 та 4.05 3д перекр. (3Н, АrСН2акс, J 15.9, 12.8, 14.0 Гц), 4.52 м (1Н, СН, J 5.9 Гц), 6.24 т (1Н, ArH, J 7.2 Гц), 6.52 д (1Н, ArH, J 7.2 Гц), 6.64 м (3Н, АrН), 6.84 м (3Н, АrН), 6.98 та 7.30 2с (2Н кожний, АrН), 7.36 т (1Н, ArH, J 7.2 Гц), 7.47 м перекрив. (3Н, АrН), 7.67 т (1Н, ArH, J 7.2 Гц), 7.80 с (1Н, ОН), 8.03 д (2Н, АrН). Знайдено, %: С 59.87; Н 4.14; Вr 26.95. С45Н35Вr3О6. Вирахувано, %: С 59.30; Н 3.87; Вr 26.30. Приклад 3. Спосіб одержання 5,11,17трис(дифенілфосфінокси)-25-ізо-пропокси-26,27дібензоїлоксикалікс[4]арену 4. 0.91 г (1.0 ммоль) каліксарену 3 та 5.0 мл сухого бензонітрилу нагрівають при перемішуванні до 160 °С, додають 0.079 г (0.36 ммоля) безводного NiBr2 і доводять температуру реакційної суміші до 170-175 °С. Потім, невеликими полттічми, з інтервалом 3-5 хвилин, додають 3.87 г (15.0 ммолей) дифенілізо-пролилфосфінита. Після додавання всієї кількості фосфорилюючого агента реакційну суміш перемішують при 175 °С ще 1 годину, доводять до 40-50 °С та упарюють досуха в вакуумі масляного насосу. Темний маслянистий залишок розчиняють в 20 мл хлороформу та промивають 10 % водним розчином амоніаку до негативної 2+ проби на Ni (спиртовий розчин дигліму). Органічний шар відокремлюють, сушать над сульфатом 7 натрію, потім упарюють. Маслоподібний залишок перемішують з 20 мл гексану при 20 °С впродовж 48 годин. Білий осад, що утворився, відфільтровують і кристалізують з суміші бензол-гексан або метанол-вода. Вихід 0.88 г (69 %), т.толл. 352-356 1 °С. Спектр ЯМР Н (CDCl3) δ, м.ч.: 1.23 та 1.29 2д (3Н кожний, СН3, J 6.2 Гц), 3.33, 3.56, 3.74 та 3.82 4д (1Н кожний, АrСН2-екв., J 12.8, 14.0, 16.2 та 17.1 Гц відповідно), 3.97 д (1Н, АrСН2-акс, J 16.2 Гц), 4.06 та 4.08 2д перекрив. (2Н, АrСН2-акс, J 14.0 та 17.1 Гц), 4.17 д (1Н, АrСН2-акс, J 12.8 Гц), 4.40 м (1Н, СН, J 6.2 Гц), 5.91 т (1Н, ArH, J 7.5 Гц), 6.39 м (5Н, АrН, J 7.5 Гц), 6.66 та 6.82 2м (2Н кожний, АrН), 6.90 т (1Н, ArH, J 7.2 Гц), 7.07 д (1Н, ArH, J 11.2 Гц), 7.14-7.93 м (35Н, АrН), 8.09 д (2Н, 31 ArH, J 7.5 Гц), 8.77 с (1Н, ОН). Спектр ЯМР Р (CDC13) δ, м.ч.: 27.47, 28.30 та 28.86 3м (J 6.1 та 9.2 Гц). Мас-спектр (LCMS): m/z 1275.3. Знайдено, %: С 76.48; Н 5.23; Р 6.79. С81Н65О9Р3. Вирахувано, %: С 76.29; Н 5.14; Р 7.29. Приклад 4. Спосіб одержання 5,11,17трис(дифенілфосфінілокси)-25-ізопропоксикалікс[4]арену 5. До суспензії 0.26 г (0.2 ммоля) каліксарену 4 в 10 мл метанолу додають 0.55 мл 40 % водного розчину КОН (25-кратний мольний надлишок). Реакційну суміш кип'ятять протягом 16 годин, потім охолоджують до 20 °С, підкисляють розбавленою соляною кислотою до рН 3-4. Білий осад, що утворився, відфільтровують, промивають на фільтрі водою, висушують. Кристалізують з суміші хлороформ-гексан, потім ще раз в ацетонітрилу. Вихід 0.18 г (85 %), т.топл. 215-218 °С. ІЧ спектр (КВr), -1 см : 1160 (Р=О), ш. 3300 (ОН∙∙∙ОН∙∙∙ОРr). Спектр l ЯМР H (CDCl3) δ, м.ч.: 1.56 д (6Н, СН3, J 5.9 Гц), 3.41 д (2Н, АrСН2-екв., J 14.0 Гц), 3.48 д (2Н, АrСН2-екв., J 13.4 Гц), 4.21 д (2Н, АrСН2-екв., J 14.0 Гц), 4.36 д (2Н, АrСН2-екв., J 13.4 Гц), 4.51 м (1Н, СН, J 5.9 Гц), 6.85 м (Ш, АrН), 6.97 д (2Н, ArH, J 7.5 Гц), 7.18 м (3Н, АrН), 7.29-7.69 м (32Н, АrН), 31 8.04 д (1Н, АrН), 9.65 с (3Н, ОН). Спектр ЯМР Р (CDCl3) δ, м.ч.: 28.60 та 29.13 два м. Спектр ЯМР 13 С (CDCl3) δ, м.ч.: 22.28, 32.06, 32.27, 80.06, 122.92, 124.00, 124.84, 125.91, 126.24, 127.53, 127.67, 128.21, 128.41, 128.48, 128.50, 128.53, 128.60, 128.62, 128.67, 128.78, 128.91, 129.93, 129.98, 131.85, 131.93, 131.94, 131.96, 132.03, 132.05, 132.13, 132.15, 132.25, 132.31, 132.58, 132.89, 132.98, 133.11, 133.22, 133.24, 133.35, 133.40, 133.51, 133.68, 149.40, 152.35, 152.38, 154.89, 154.92, 168.59. Мас-спектр (LCMS): m/z 1067.4. Приклад 5. Спосіб одержання 5Д1,17трис(дифенілфосфіно)-25-ізо-прошжсикалікс[4]арену 6. До суспензії 0.21 г (0.2 ммоля) каліксарену 5 в 3 мл толуола додають 1.05 г (9.7 ммоля) фенілсилану та при перемішуванні нагрівають при 90-95 °С впродовж 60 годин. Реакційну суміш доводять до кімнатної температури і упарюють в вакуумі 0.05 мм рт. ст. досуха. Залишок обробляють 5 мл хлороформа, перемішують 30 хв. при 20 °С та ві 58150 8 дфільтровують. З фільтрату висаджують метанолом білий осад, який відфільтровують та кристалізують з суміші хлороформ-метанол. Вихід 0.2 г 1 (69%), т.топл. 143-145 °С. Спектр ЯМР Н (CDCl3) δ, м.ч.: 0.75 д (6Н, СН3, J 6.2 Гц), 3.25 та 3.27 два д перекрив. (4Н, АrСН2-екв., J 13.7 та 13.1 Гц відповідно), 3.66 м (1Н, СН, J 6.2 Гц), 4.48 дд (4Н, АrСН2-акс, J 13.7 та 13.1 Гц відповідно), 6.69 м (2Н, АrН), 6.88 д (2Н, АrН, J 7.5 Гц), 6.97 дд (2Н, АrН, J 7.5 Гц), 7.08 - 7.21 м (9Н, АrН), 7.23-7.39 м (19Н, АrН + 3Н, ОН), 7.48 та 7.55 два м перекрив. (3Н, АrН), 7.92 д (2Н, АrН, J 7.5 Гц). Спектр ЯМР 31 Р (CDCl3) δ, м.ч.: -6.80 м (2Р), -5.71 м (IP). Спектр 13 ЯМР С (CDCl3) δ, м.ч.: 21.66, 33.07, 34.39, 78.16, 123.49, 127.49, 128.10, 128.42, 128.49, 128.55, 128.62, 128.65, 128.76, 129.55, 129.64, 130.36, 130.42, 130.49, 130.75, 130.83, 131.26, 131.48, 131.58, 132.12, 132.22, 133.05, 133.36, 133.48, 133.55, 133.56, 133.58, 133.67, 133.75, 133.78, 134.15, 134.22, 134.76, 135.03, 135.22, 135.77, 135.99, 137.39, 137.49, 137.63, 137.74, 137.76, 137.87, 148.62, 152.03, 153.89. Приклад 6. Приклад 6. Рентгеноструктурне дослідження просторової будови 5,11,17-трибромо-25-ізо-пропокси-26,27дибензоїл-оксикалікс[4]арену 3. Кристали сполуки 3 моноклінні, С45Н35Вr3О6, при -173 °С а = 10.2403(4), b = 14.0732(6), с = 3 26.772(1) Å, β = 95.267(4)°, V = 3841.9(3) Å , Мr = 911.46, Z = 4, просторова група P21/n, dвир = 1.576 3 -1 г/см , μ(МоКα) = 3.200 мм , F(000) = 1832. Параметри елементарної комірки та інтенсивності 16035 відображень (6687 незалежних, Rint = 0.036) виміряні на дифрактометрі «Xcalibur-3» (МоКα випромінювання, CCD-детектор, графітовий монохроматор, ω-сканування, 20макс = 50°). Структура розшифрована прямим методом за допомогою комплексу програм SHELXTL [8]. Поглинання враховане за результатами мультисканування, Tmin = 0.447, Tmax = 0.567. Положення атомів водню виявлені з різнецевого синтезу електронної густини та уточнені по моделі «вершника» з Uізо = nUекв (n=1.5 для гідроксильної та метильних груп та n=1.2 для інших атомів водню) неводневого атома, пов'язаного з даним водневим. Структуру 2 уточнено по F повноматричним МНК в анізотропному наближенні для неводневих атомів до wR2 = 0.067 по 6602 відображенням (R1 = 0.035 по 4454 відображенням с F>4σ(F), S = 0.883). Згідно з даними рентгеноструктурного аналізу молекула 3 в кристалічному стані має конформацію частковий конус (фіг. 1, 3) з інвертованим ароматичним циклом С(15)...С(20). По нижньому ободу макроциклічний скелет стабілізовано внутрішньомолекулярним водневим зв'язком О(1)Н(1О)...О(4) Н...O 1.91 Å O-Н...O 167° між гідроксильною та ізопропокси групами. Бензоїльна група замісника в інвертованому ароматичному циклі розташована майже перпендикулярно його площині (торсійний кут С(36)-О(3)-С(20)-С(19) 92.4(3)°) і розвернута таким чином, що фенільний цикл має антиперипланарну конформацію по відношенню до зв'язку С(20)-О(3) (торсійний кут С(20)-О(3)С(36)-С(37) 178.4(3)°). Слід відзначити, що карбоксильна група та фенільна група замісника в інвер 9 тованому циклі дещо некопланарні (торсійний кут О(3)-С(36)-С(37)-С(42) 13.1(4)°), що може бути наслідком стекінг-взаємодій між ароматичним циклом С(37)...С(42) та бром-замісником при сусідньому ароматичному циклі макроциклічного скелету С(8)...С(13), про що свідчить досить невелика (близько 3.6 Å) відстань між ними. Бензоїльна група замісника в неінвертованому ароматичному циклі С(8)...С(13) знаходиться в + sс-конформації відносно зв'язку С(8)-С(13) (торсійний кут С(29)-О(2)-С(13)-С(8) 75.1(4)°). Бензольний цикл знаходиться в антиперипланарній конформації щодо зв'язку С(13)-О(2) (торсійний кут С(13)О(2)-С(29)-С(30) 176.5(3)°) та дещо некопланарний площині карбоксильного фрагменту (торсійний кут О(2)-С(29)-С(30)-С(35) -8.8(4)°). Така конформація замісника може бути додатково стабілізована утворенням слабкого внутрішньомолекулярного водневого зв'язку С(35)-Н(35)...π (С(16)) Н...С 2.85 Å С-Н...С 128°. Ізопропільна група має -scконформацію відносно зв'язку С(27)-С(26) і розвернута відносно зв'язку С(27)-О(4) (торсійні кути С(43)-О(4)-С(27)-С(26) -77.5(3)°, Н(43)-С(43)-О(4)С(27) 45°). В кристалі між молекулами каліксарену 3 знайдено слабкі міжмолекулярні водневі зв'язки C(40)-H(40)...Br(3)' (0.5+x, 0.5-y, 0.5+z) Н...Вr 2.86 А С-H...Br 146°; С(18)-Н(18)...О(5)' (х-1, у, z) H...O 2.43 Å С-Н...O 154°; С(43)-Н(43)...С(18)' (π) (0.5-х, 0.5+у, 0.5-z) Н...π 2.77 А C-Н...π 134°; С(16)Н(16)...С(5)' (1.5-х, -0.5+у, 0.5-z) Н...π 2.67 А CН...π 150° та міжмолекулярні взаємодії Вr(2)... Вr(2)' (2-х, -у, 1-z) 3.42 Å (сума вандерваальсових радіусів [9] 3.94 Å) та Вr(3)...С(4)' (1.5-х, -0.5+у, 0.5z) 3.54 Å (сума радіусів 3.68 Å). Приклад 7. Рентгеноструктурне дослідження просторової будови 5,11,17-трис-(дифенілфосфінокси)-25-ізопропокси-26,27-дібензоїлоксикалікс[4]арену 4 Кристали сполуки 4 моноклінні, С81Н65Р3О9 ∙ 5 СН4О ∙ 1.25 ∙ Н2О, при -173 °С a = 18.0861(6), b = 26.9857(7), с = 18.1482(6) Å, β = 116.704(4)°, V = 3 7910.8(4) Å , Мr = 1457.47, Z = 1, просторова група 3 -1 Р21/с, dвир = 1.224 г/см , μ(МоКα) = 0.140 мм , F(000) = 3080. Параметри елементарної комірки та інтенсивності 36000 відображень (13817 незалежних, Rint = 0.031) виміряні на дифрактометрі «Xcalibur-3» (МоКα випромінювання, CCD- детектор, графітовий монохроматор, со-сканування, 2θмакс = 50°). Структура розшифрована прямим методом за допомогою комплексу програм SHELXTL [8]. Під час уточнення структури використовували обмеження на довжину зв'язку С-O в молекулах метанолу (1.41 Å). Положення атомів водню виявлені з різностного синтезу електронної густини та уточнені по моделі «вершника» з Uізо = nUекв (n=1.5 для гідроксильної та метильних груп та n =1.2 для інших атомів водню) неводневого атома, пов'язано2 го з даним водневим. Структуру уточнено по F повноматричним МНК в анізотропному наближенні для неводневих атомів до wR2 = 0.105 по 13394 відображенням (R1 = 0.045 по 8338 відображенням с F>4σ(F), S = 0.881). 58150 10 За даними рентгеноструктурного аналізу каліксарен 4 існує в кристалічному стані у вигляді сольвату з метанолом та водою у співвідношенні 4:метанол:вода 1:5:1.25. Макроцикл має конформацію частковий конус з інвертованим ароматичним циклом С(15)...С(20) (фіг. 2, 4). По нижньому ободу конформація макроциклічного скелету стабілізована внутрішньомолекулярним водневим зв'язком О(1)-(Н1О)...О(4) Н...O 1.95 Å O-Н...O 166°. Бензоїльна група замісника в інвертованому ароматичному циклі має +sс-конформацію відносно зв'язку С(20)-С(19) (торсійний кут С(72)-О(3)С(20)-С(19) 74.7(2)°) і розвернута таким чином, що фенільна група має антиперипланарну конформацію по відношенню до зв'язку С(20)-O(3) (торсійний кут С(20)-О(3)-С(72)-С(73) -173.1(1)°). Карбоксильна група та бензольний цикл замісника в інвертованому циклі компланарні (торсійний кут О(3)С(72)-С(73)-С(78) -2.3(2)°). Можна припустити, що положення бензоїлокси-замісника в порожнині макроциклу стабілізоване утворенням С-Н...7І внутрішньо-молекулярних водневих зв'язків С(77)Н(77)...С(34) Н...С 2.81 Å С-Н...С 154°; С(42)Н(42)...С(75) Н...С 2.85 Å С-Н...С 125°; С(42)Н(42)...С(76)Н...С2.82 Å С-Н...С 152°. Бензольна група замісника в неінвертованому ароматичному циклі С(8)...С(13) розташована майже перпендикулярно площині циклу (торсійний кут С(53)-О(2)-С(13)-С(8) 79.2(2)°). Бензольний цикл знаходиться в антиперипланарній конформації відносно зв'язку С(13)-О(2) та дещо некопланарний площині карбоксильного фрагменту (торсійні кути С(13)-О(2)-С(53)-С(54) -174.1(1)°, О(2)-С(53)С(54)-С(59) 6.7(2)°). Конформація замісника додатково стабілізована внутрішньо молекулярним CН...π водневим зв'язком С(7)-Н(7b)...С(53) Н...С 2.72 Å С-Н...С 122°. Ізопропільна група розташована майже перпендикулярно площині ароматичного циклу С(22)...С(27) (торсійний кут С(79)-О(4)С(27)-С(22) 105.8(1)°) і розвернута таким чином, що торсійний кут С(27)-О(4)-С(79)-Н(79) складає 59.0°. Дифенілфосфіноксидні замісники мають конформацію, при якій зв'язок Р=О дещо некопланарний площині відповідного ароматичного циклу (торсійні кути О(5)-Р(1)-С(3)-С(2) -21.4(1)°, О(6)-Р(2)С(10)-С(9) 35.0(1)°, О(8)-Р(3)-С(17)-С(16) -4.7(1)°). Фенільні групи по різному розвернуті відносно відповідних зв'язків Саr-Р (торсійні кути С(3)-Р(1)С(29)-С(34) 42.1(2)°, С(3)-Р(1)-С(35)-С(40) 64.4(2)°, С(10)-Р(2)-С(41)-С(46) 93.5(1)°, С(10> Р(2)-С(47)С(52) -41.8(1)°, С(17)-Р(3)-С(66)-С(71) 95.2(1)°) і тільки в одному випадку площина ароматичного циклу і зв'язок Саr-Р майже компланарні (торсійний кут С(17)-Р(3)-С(60)-С(65) 9.1(2)°). В кристалі молекули каліксарену 4 пов'язані між собою через місткові молекули метанолу та води за допомогою системи міжмолекулярних водневих зв'язків O(1w)-H(1wa)...O(1s)' Н..O 1.87 Å OН...O 157°; O(1w)-H(1wb)...O(2s)' Н...О 1.84 Å OН...O 172°; O(1s)-H(1s)...O(6)' (х-1, у, z) H...О 1.88 Å O-Н...O 174°; O(2s)-H(2s)...O(8)' H...O 1.85 А OН...O 169°; O(3s)-H(3s)...O(1w)' (х, 1.5-у, -0.5+z) Н...O 1.63 А О-Н...О 164°; O(4s)-H(4s)...O(1w)' (x, 1.5-у, -0.5+z) H...O 1.99 Å О-Н...О 169°; O(5s) 11 H(5s)...O(5)' (1-х, 0.5+у, 0.5-z) H...O 1.86 А O-Н...O 174°. Джерела інформації: 1. Notestein J.M., AndriniL. R., Kalchenko V.I., Requejo F.G, Katz A., and Iglesia E. Structural assessment and catalytic consequences of the oxygen coordination environment in grafted Ticalixarenes //J. Am. Chem. Soc-2007. - Vol. 129. - P. 1122-1131. 2. Notestein, J.M., Iglesia, E., Katz. A. Grafted Metallocalixarenes as single-site surface organometallic catalysts. //J. Am. Chem. Soc - 2004. Vol. l26. - P. 16478-16486. 3. Cherenok S., Kalchenko V. Phosphoruscontaining calixarenes. //Top. Heterocycl. Chem. 2009. - Vol. 20. - P. 229-273. 4. Gagnon J., Vezina M., Harvey P. Regioselective upper-rim functionalizations of 58150 12 calix[4]arene by diphenylphosphino groups. //Can. J. Chem. - 2001. - P. 1439-1446. 5. Такепака К, Obora Y, Jiang L, Tsuji Y. Platinum(II) and palladium(II) complexes of bis(diphenylphosphino)calix[4]arene tetrabenxyl ether: fluxional behavior caused by two motions. //Organometallics. - 2002. - Vol. 21. - P. 1158. 6. Semeril D., Lejeune M., Matt D. Calix[4]arenederived nickel diphosphine complexes for LLDPE synthesis via orthogonal tandem and one-pot catalysis. //New J. Chem. - 2007. - Vol. 31. - P. 502505. 7. Homden DM. and Redshaw С The use of calixarenes in metal-based catalysis. //Chem. Rev. 2008. - Vol. 108. - P. 5086-5130. 8. Sheldrick G.M. //Acta Crystallogr., Sect. A, 2008. - A64, - P. 112-122. 9. Зефіров Ю.В. //Кристаллографія - 1997. - T. 42. - № 5. - C. 936-958. С. 13 58150 14 15 Комп’ютерна верстка Г. Паяльніков 58150 Підписне 16 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 5,11,17-tris(diphenylphosphino)-25-iso-propoxy-26,27,28-trihydroxycalix[4]arene
Автори англійськоюMatvieev Yurii Ivanovych, Kalchenko Vitalii Ivanovych, Shyshkina Svitlana Valentynivna, Shyshkin Oleh Valeriiovych
Назва патенту російськоюСпособ получения 5,11,17-трис(дифенилфосфино)-25-изо-пропокси-26,27,28-тригидроксикаликс[4]арена
Автори російськоюМатвеев Юрий Иванович, Кальченко Виталий Иванович, Шишкина Светлана Валентиновна, Шишкин Олег Валерьевич
МПК / Мітки
МПК: C07C 39/12, C07C 39/00, C07C 39/367, C07C 37/00
Мітки: одержання, 5,11,17-трис(дифенілфосфіно)-25-ізо-пропокси-26,27,28-тригідроксикалікс[4]арену, спосіб
Код посилання
<a href="https://ua.patents.su/8-58150-sposib-oderzhannya-51117-trisdifenilfosfino-25-izo-propoksi-262728-trigidroksikaliks4arenu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5,11,17-трис(дифенілфосфіно)-25-ізо-пропокси-26,27,28-тригідроксикалікс[4]арену</a>
Попередній патент: Процес видалення технологічних забруднень з поверхонь клапанних гнізд головок блоків циліндрів та контролю щільності прилягання клапанів до клапанних гнізд
Наступний патент: Паркінг гаражний двоповерховий
Випадковий патент: Ультразвуковий датчик рівня рідини