Похідні фенілпіперазину
Номер патенту: 74160
Опубліковано: 15.11.2005
Автори: ван Фліт Бернард Ж., Крузе Корнеліс Г., Віссер Гербен М., ван Гес Рулоф, Тіпкер Якобус, Тульп Мартінус Т.М., Ван дер Хейден Йоганес А.М.
Формула / Реферат
1. Похідні фенілпіперазину формули (І)
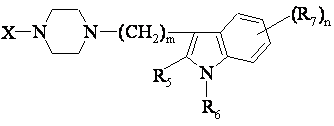 , (І)
, (І)
де:
Х - це 1) група формули
 , (1)
, (1)
у якій
S1 – водень або галоген,
S2 та S3 - незалежно один від одного водень, алкіл (1-6С), феніл або бензил,
S4 - два атоми водню або оксогрупа,
S5 - Н або алкіл(1-4С), і
Y - C, O aбo S,
або 2) група формули
 , (2)
, (2)
де S1 має вищенаведене значення, a R - Н, алкіл (1-4С), алкоксіалкіл (2-6С), алкеніл (2-4С) або алкініл (2-4С),
або 3) група формули
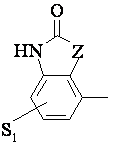 , (3)
, (3)
де S1 має вищенаведене значення, а Z - С, О або N,
або 4) група формули
 , (4)
, (4)
де S1 має вищенаведене значення,
або 5) група формули
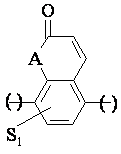 , (5)
, (5)
де S1 має вищенаведене значення, а А - О або N,
зв'язаний з піперазиновим кільцем у позиції 5 або 8,
або 6) група формули
 , (6)
, (6)
де S1 має вищенаведене значення, а S6 та S7 - атоми водню або оксогрупу,
або 7) група формули
 , (7)
, (7)
де одна з пунктирних ліній являє собою подвійний зв'язок, S1 має вищенаведене значення, а
Р=Т= Q= азот
або Р=Т=азот, a Q=C
або Р=Q=азот, а Т=С або С-СН3
або Р=азот, а Т і Q - вуглець
або Р=азот, Т - вуглець і Q – сірка,
m має величину 2-6;
n має величину 0-2;
R5 та R6 - незалежно один від одного Н або алкіл (1-3С); або R5+R6 являють собою групу -(СН2)-р, де р має значення 3-5,
R7 - алкіл (1-3С), алкокси (1-3С), галоген або ціан; або R6+R7 (R7 у позиції 7 індольної групи) являє собою групу -(CH2)q, де q має величину 2-4, та їхні солі.
2. Сполука за п. 1, у якій Х являє собою групу формули (1), (2) або (3), а символи мають значення, наведені у п. 1.
3.Сполука за п. 1, у якій Х - група формули (І), де S1=H, S2=СН3, S3=Н, S4=окco, S5=H , a Y - кисень, m - 3, R5=R6=водень, n - 0 або 1, a R7 - 5-фтор, та її солі.
4. Спосіб одержання сполук за п. 1, який відрізняється тим, що сполуку формули
(II)
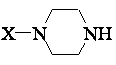 (II)
(II)
піддають реакції в лужних умовах зі сполукою формули (III)
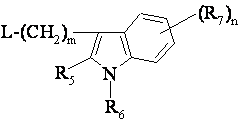 , (III)
, (III)
причому в цих формулах символи мають значення, як у п. 1, а L - так звана вихідна група.
5. Фармацевтична композиція, яка містить сполуку за п.1 як діючу речовину, додану в ефективній кількості.
6. Спосіб лікування розладів ЦНС, який відрізняється тим, що застосовують сполуку за п. 1.
Текст
Винахід стосується групи нових похідних фенілпіперазину формули (І) (I) де: - X - це 1) гр упа формули (1) у якій - S1 - водень або галоген - S2 та S3 - незалежно один від одного водень, алкіл (1-6С), феніл або бензіл, - S4 - два атоми водню або оксогрупа, - S5 - H або алкіл(1-4С), - Υ - С, О або S - або 2) група формули (2) де S1 має вищенаведене значення, a R - Н, алкіл (1-4С), алкоксіалкіл (2-6С), алкеніл (2-4С) або алкініл (24С), або 3) група формули (3) де S1 має вищенаведене значення, a Z - С, О або Ν, або 4) група формули (4) де S1 має вищенаведене значення, або 5) група формули (5) де S1 має вищенаведене значення, а А - О або N, прив'язаний до піперазинового кільця у позиції 5 або 8, або 6) група формули (6) де S1 має вищенаведене значення, a S6 та S7 представляють атоми водню або оксогрупу, або 7) група формули (7) де одна з пунктирних ліній представляє подвійний зв'язок , S1 має вищенаведене значення, а Р=Т=Q= азот або Р=Т= азот, a Q=C або P=Q= aзот, а Т=С або С-СН 3 або Р= азот, а Т і Q – вуглець або Р= азот, Τ - вуглець і Q - сірка - m має величину 2-6; - n має величину 0-2; - R5 та R6 - незалежно один від одного Η або алкіл (1-3С); або R5+R6 представляють групу -(СН2)-p, де p має значення 3-5, - R7 - алкіл (1-3С), алкоксі (1-3С), галоген або ціан; або R6+R7 (R7 у позиції 7 індольної групи) представляє груп у -(СН2)q , де q має величину 2-4, та їхні соли, що виявляють велику спорідненість до рецептора допаміну D2 й є добрими інгібіторами повторного засвоєння серотоніну (І3С). Перевага у винаході віддається сполукам формули (І), де X представляє груп у формули (1), (2) або (3), у якій символи мають наведені вище значення, та їхнім солям. Особливу перевагу мають сполуки формули (І), де X - група формули (1), у якій S1=H, S2=CH3, S3=H, S4= оксо, S5=H, a Υ - кисень, m-3, R 5=R6= водень, n-0 або 1, а R7-5-фтор, та їхнім солям. Встановлено, що сполуки згідно з винаходом мають високу спорідненість як до рецептора допаміну D2, так і до площадки засвоєння серотоніну. Таке сполучення є корисне для лікування шизофренії та інших психічних розладів, бо дозволяє більш повне вилікування усіх симптомів хвороби (наприклад, позитивних та негативних симптомів). Однак деякі сполуки формули (1) є (частковими) агоністами рецепторів допаміну D2, що робить їх особливо придатними для лікування хвороби Паркінсона. Ці сполуки виявляють активність як антагоністи рецепторів допаміну D2, оскільки потенційно антагонізують викликаній апоморфіном бентежливій поведінці у мишей. Ці сполуки виступають також як інгібітори засвоєння серотоніну, бо потенціюють викликану 5-НТР поведінку у мишей. Ці сполуки активно діють у терапевтичних моделях, чутливи х до клінічно значущи х антипсихотиків [тобто обумовленої реакції уникання: Van der Heyden & Bradford, Behav.Brain Res., 1988, 31: 61-67], а також антидепресантів або анксіолітиків [наприклад, придушення викликаної стресом вокалізації: van der Poel et al., Psychopharmacology, 1989, 97: 147-148] У протилежність клінічно релевантним антагоністам рецептора допаміну D 2 зазначені сполуки не мають особливої схильності викликати каталепсію в гризунів і як такі, видимо, спричинюють менше екстрапірамідальних бічних явищ, ніж відомі антипсихотичні препарати. Здатність інгібувати повторне засвоєння серотоніну, притаманна цим сполукам, може пояснювати терапевтичний ефект, що спостерігається у моделях поведінки, чутливи х до антидепресантів або анксіолітиків. Ці сполуки можуть застосовуватися для лікування уражень або захворювань центральної нервової системи, спричинених порушеннями або у допамінергічній, або у серотонергічній системах: агресії, занепокоєної поведінки, аутизму, запаморочень, депресій, розладів мислення або пам'яті, хвороби Паркінсона, а особливо шизофренії та інших психічних розладів. Фармакологічно прийнятними кислотами, з якими сполуки згідно з винаходом можуть утворювати зручні приєднані солі, є, наприклад, соляна кислота, сірчана кислота, фосфорна кислота, азотна кислота та органічні кислоти, такі, як лимонна, фумарова, малеїнова, винна, оцтова, бензойна, р-толуолсульфонова, матансульфонова та нафталінсульфонова. Якщо ці сполуки утворюють центр хіральності, то як рацемічна суміш, так і окремі енантіомери охоплюються обсягом винаходу. Сполуки та їхні солі з приєднаними кислотами можна одержати у формах, зручних до вживання, за допомогою відповідних процесів з участю допоміжних речовин, наприклад, рідких та твердих носіїв. Сполуки формули (І) можна приготувати реакцією сполуки формули (II) у лужних умовах зі сполукою формули (III) В обох формулах символи мають значення, що наведені вище, a L - так звана вихідна група, наприклад, атом водню або мезилатна група. Піперазинові сполуки формули (II) можна одержати [згідно з заявками ЕР 0138280, ЕР 0189612 та/або ЕР 0900792] або аналогічним чином. Піперазини формули (II) можна готувати , як вказано на схемах (i-iv) нижче. Деякі шляхи призводять до одержання оптично чистих похідних піперазину. Вихідні сполуки формули (III) можна приготувати способами, відомими для аналогічних сполук, [див., наприклад, Organic Process Res.and Dev. 1997(1), 300-310]. Винахід далі пояснюється наступними прикладами: Приклад 1: приготування сполуки а.і (див, схему і) Етап 1 (схема і): До розчину хлорнітрокатехолу (6,45г, 34ммоля) у сухому діметилсульфоксиді (ДМСО) (50мл) додають порошок NaOH (2,72г, 68ммолів). Після перемішування 30 хвилин додають розчин Rгліцеролкеталмезилату (8,0г, 38ммолів) у ДМСО (20мл) і суміш нагрівають при 80°С 24 години. Після охолодження до кімнатної температури реакційну суміш виливають у воду (200мл), підкислюють 1N HCl та екстрагують метил-трет-бутилетером. Органічну фракцію промивають водою та сушать на MgSO4. Після видалення сушильного агенту та розчинника у вакуумі одержану олію піддають швидкій хроматографії (SiO2, елюент поліетилен/ацетон 3:1). Вихід S-кеталю 9,29г (90%). Етап 2 (схема і): до розчину S-кеталю (31г, 102ммоля) в оцтовій кислоті (120мл) додають 35%-ний розчин НВr в оцтовій кислоті (80мл) і суміш обертають 2 години в обертовому випарнику на водяній бані при 50°С. Реакційну суміш розбавляють етанолом (96%, 250мл), охолоджують соляно-крижаною сумішшю, після чого поволі додають 250мл 50%-ного водяного розчину NaOH, підтримуючи температуру нижче 15°С. Після додання 250мл етанолу та 250мл води реакційну суміш перемішують при кімнатній температурі 16 годин. Після цього додають біля 300 мл концентрованої НСl та воду й екстрагують суміш етилацетатом. Після промивання органічної фракції 5%-ним NaHCO3(4´500мл) розчинник видаляють у вакуумі, а одержану олію піддають швидкій хроматографії (SiO2, елюент поліетилен/ацетон 3:1). Вихід 20,5г (81%) R-бензодіоксану у вигляді жовтої олії. Етап 3 (схема і): До розчину R-бензодіоксану (20г, 81ммоль) у діметилформаміді (ДМФ) (200мл) додають КОН (4,56г, 81ммоль). Після охолодження червоного розчину крижано-ацетоновою сумішшю додають 23мл діметилсульфату й перемішують реакційну суміш 1,5 години при кімнатній температурі. Потім додають ще 4,56г КОН при охолодженні й перемішують суміш при кімнатній температурі 16 годин. Додають 700мл води та екстрагують продукт етилацетатом. Останній видаляють у вакуумі, а одержану олію піддають швидкій хроматографії (SiO2, елюент поліетилен/ацетон 4:1). Виходить 12,3г (58%) R-метоксіметилбензодіоксану у вигляді жовтої олії. [&]D25= -97° (метанол). Етап 4 (схема і). До розчину R-метоксіметилбензодіоксану (5г, 19ммолів) у етанолі (100мл) та етилацетаті (50мл) додають каталітичну кількість 10% Pd/C та трусять розчин під атмосферним тиском Нг при кімнатній температурі. Після того, як розрахована кількість Н 2 буде засвоєна реакційною сумішшю, каталізатор відфільтровують, а фільтрат концентрують у вакуумі. Вихід 3,7г (100%) відповідної анілінової сполуки. Етап 5 (схема і): Анілінову сполуку (4г, 2ммоля) та ВСЕА, тобто HN(CH 2CH2Cl)2. HCl (3,7г, 2ммоля) розчинюють у хлорбензолі (100мл). Суміш нагрівають до 150°С 16 годин, концентрують у вакуумі та очищують швидкою хроматографією (SiO2, діхлорметан/метанол/гідроксид амонію 92:7,5:0,5). Вихід піперазину 3,67г (68%). Приклад 2: Приготування сполуки №126 Шлях, тобто реакцію сполуки (II) зі сполукою (III), описаний вище. Мезилати формули (III) одержують з відповідних спиртів відомими способами, наприклад, з MsCl/Et3N. Суміш піперазину а.i (3,6г, 13,6ммоля), 5-фторіндолмезилату (4,1г, 15,1ммоля), триетиламіну (2мл) та каталітичної кількості КІ у CH3CN (100мл) нагрівають зі зворотним холодильником 18 годин, після чого концентрують реакційну суміш у вакуумі та очищують хроматографією (SiO2, ді хлорметан/метанол/гідроксид амонію 92:7,5:0,5). Вихід становить 3,77г вільного лугу (олії). Вільний луг розчиняють в етанолі й додають 1 еквівалент розчину фумарової кислоти в етанолі. Після видалення розчинника одержують сполуку №126 (4,3г, вихід 57%). [&]D 25= -2° (метанол). Приклад 3: приготування сполуки b.іі (див, схему іі) Етап 1 (схема іі): Розчин амінофенолу (37,3г, 198ммолів), метилефіру S-молочної кислоти (20мл) та трифенілфосфіну (58г, 220ммолів) у тетрагідрофурані (ТГФ) (2000мл) охолоджують крижано-соляною сумішшю (температура 245 (дес.) >165 скло 176-7 Амор ф. Амор ф. Амор ф. >240 (дес.) Амор ф. Амор ф. Скло 188-190 25 [a] D (У метанолі) S1=H Ν СН S S1-S5 =H S2=CH 3, S1=S 3-S5 =H S4=oxo, S2=CH 3, S1=S3=S5=H S1=H S4=oxo, S2=CH 3, S1=S3=S5=H S4=oxo, S2=CH 3, S1=S3=S5=H S4=oxo, S2=CH 3, S1=S3=S5=H S4=oxo, S2=CH 3, S1=S3=S5=H S4=oxo, S2=CH 3, S1=S3=S5=H S4=oxo, S2=CH 3, S1=S3=S5=H S4=oxo, S2=p heny l, S1=S3=S 5=H S4=oxo, S2=p heny l, S1=S3=S 5=H S4=oxo, S2=p heny l, S1=S3=S 5=H S1=H S1=H S1=H S1=H S1=H S1=H S4=oxo, S2=C 3H 7, S1 =S3 =S5 =H S4=oxo, S2=C 3H 7, S1 =S3 =S5 =H S4=oxo, S2=C 3H 7, S1 =S3 =S5 =H S4=oxo, S2=S5=CH 3, S1=S3=H S4=oxo, S2=S5=CH 3, S1=S3=H S4=oxo, S2=S5=CH 3, S1=S3=H S4=oxo, S2=b en zy l, S1=S3 =S5 =H S4=oxo, S2=b en zy l, S1=S3 =S5 =H S4=oxo, S2=b en zy l, S1=S3 =S5 =Н S1=H S1=H S1=H S4=oxo, S2=S3=CH 3, S1=S5=H S4=oxo, S2=S3=CH 3, S1=S5=H S1=H S1=H S1=H S1=H S4=oxo, S2=S5=CH 3, S1=S3=H S4=oxo, S2=S5=CH 3, S1=S3=H S4=oxo, S2=S5=CH 3, S1=S3=H S4=oxo, S2=S5=CH 3, S1=S3=H S4=oxo, S1=7 -Cl, S2=S3 =S5 =CH 3 S4=oxo, S1=H, S2=S 3=S 5=CH 3 S1=H 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 ½.Фу марат Фу марат Фу марат ½.Фу марат ½.Фу марат Фу марат HCl HCL HCl HCL ½.Фу марат ½.Фу марат ½.Фу марат HCL Фу марат 2/3.Фу марат Вільний лу г Вільний лу г Вільний лу г ½.Фу марат Вільний лу г Вільний лу г Вільний лу г Вільний лу г ½.Фу марат Фу марат 2.Фу марат Вільний лу г ½.Фу марат Фу марат ½.Фу марат 3/2.Фу марат Фу марат Вільний лу г Вільний лу г Вільний лу г HCl Фу марат Фу марат Фу марат Фу марат Фу марат Вільний лу г Фу марат Фу марат Фу марат Фу марат Фу марат Фу марат Фу марат Фу марат Вільний лу г Вільний лу г Вільний лу г ½.Фу марат Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Фу марат Фу марат Фу марат Фу марат Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Фу марат Фу марат Фу марат Вільний лу г Вільний лу г Вільний лу г >230 (дес.) Амор ф. 160-2 247-8 (дес.) >240 (дес.) Амор ф. Амор ф. Амор ф. 220-4 >250 (дес.) 214-7 (дес.) 240-3 220-2 (дес.) Амор ф. 223-5 200-2 Скло 196-7 181-2 138.5-41 190-5 (дес.) Скло Скло Скло 185-6 210-1 (дес.) Амор ф. Амор ф. >250 Скло 245-7 175-8 Скло 220-4(дес.) 234-6 (дес.) >280 Скло Скло Скло Скло Скло Скло 212.5-14.5 Скло Скло Скло Скло Скло Скло Скло Скло Амор ф. Амор ф. Амор ф. 218-20 Скло Скло Скло Скло 184-5 181-3 Скло Скло Скло 70-3 73-5 Скло Скло Скло Скло 158-60 181-2 174-6 Скло Скло Скло Скло 207-10 (дес.) 197-9 (дес.) Скло Скло Скло 191-4 190-2 Амор ф. +28 +28 +25 +39 +36 +37 (в ільний лу г) R-конф. (в ільний лу г) R-конф. (в ільний лу г) R-конф. -26 R-кон ф. +27 S-кон ф. -24 R-кон ф. +24 S-кон ф. -25 R-кон ф. +25 S-кон ф. (в ільний лу г) R-конф. (в ільний лу г) R-конф. (в ільний лу г) R-конф. +31 (в ільний лу г) R-конф. +31 (в ільний лу г) R-конф. 0 S-кон ф. 117 118 119 120 121 122 123 124 125 126 Фу марат Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Вільний лу г Фу марат Амор ф. Амор ф. Амор ф. Амор ф. Амор ф. Амор ф. Амор ф. Амор ф. Амор ф. Амор ф. S-кон ф. R-кон ф. 0 R-кон ф. -31 R-кон ф. -28 R-кон ф. +28 S-кон ф. +32 S-кон ф. -2 R-кон ф.
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenylpiperazine derivatives
Автори англійськоюKruse Cornelis G., Kruse, Cornelis G., Van Vliet Bernard J.
Назва патенту російськоюПроизводные фенилпиперазина
Автори російськоюКрузе Корнелис Г., ван Флит Бернард Ж.
МПК / Мітки
МПК: A61P 1/08, A61P 25/22, A61P 25/00, A61P 25/16, C07D 403/12, A61P 25/18, A61P 25/24, A61K 31/404, A61K 31/4709, A61K 31/428, C07D 209/40, C07D 401/12, A61K 31/4184, A61K 31/496, A61K 31/538, A61K 31/55, A61K 31/5415, C07D 417/12, C07D 413/12, C07D 209/34, C07D 405/12
Мітки: фенілпіперазину, похідні
Код посилання
<a href="https://ua.patents.su/8-74160-pokhidni-fenilpiperazinu.html" target="_blank" rel="follow" title="База патентів України">Похідні фенілпіперазину</a>
Попередній патент: Спосіб забарвлення безкольорових натуральних алмазів
Випадковий патент: Спосіб виробництва фруктового концентрату












