Розділювана галенова форма, яка робить можливим модифіковане вивільнення активного інгредієнта
Номер патенту: 86731
Опубліковано: 12.05.2009
Автори: Фонкнехтен Жиль, Пен Жан-Манюель, Вютріш Патрік, Женті Патрік
Формула / Реферат
1. Розділювана таблетка модифікованого вивільнення, яка містить гліклазид, похідне целюлози і зв'язувальну речовину, де нерозділена таблетка і частина вказаної таблетки, яку одержують шляхом розділення, мають однакові параметри розчинення.
2. Таблетка за п. 1, яка відрізняється тим, що похідне целюлози являє собою гідроксиметилцелюлозу, гідроксіетилцелюлозу, гідроксипропілцелюлозу і/або гідроксипропілметилцелюлозу.
3. Таблетка за одним з пп. 1 або 2, яка відрізняється тим, що похідне целюлози являє собою гідроксипропілметилцелюлозу низької в'язкості.
4. Таблетка за одним з пп. 1-3, яка відрізняється тим, що зв'язувальна речовина являє собою мальтодекстрин, полівідон або гідроксипропілметилцелюлозу дуже низької в'язкості.
5. Таблетка за одним з пп. 1-4, яка відрізняється тим, що таблетка містить гідрофілізуючий засіб, і гідрофілізуючий засіб переважно являє собою колоїдний кремнезем.
6. Таблетка за одним з пп. 1-5, яка відрізняється тим, що вона містить гліклазид, похідне целюлози, мальтодекстрин і безводний колоїдний кремнезем.
7. Таблетка за одним з пп. 1-6, яка відрізняється тим, що відсоток активної речовини складає від 12 % до 40 % загальної ваги таблетки.
8. Таблетка за одним з пп. 1-7, яка відрізняється тим, що відсоток похідного целюлози складає від 10 % до 60 % загальної ваги таблетки.
9. Таблетка за одним з пп. 1-8, яка відрізняється тим, що відсоток зв'язувальної речовини складає від 2 % до 15 % загальної ваги таблетки.
10. Таблетка за одним з пп. 2-9, яка відрізняється тим, що вона містить загальну кількість гліклазиду, що складає 60 мг.
11. Розділювана таблетка модифікованого вивільнення, яка відрізняється тим., що вона містить 18,7 % гліклазиду, 22,3 % моногідрату лактози, 6,9 % мальтодекстрину, 50 % низькозаміщеної гідроксипропілметилцелюлози, 0,5 % стеарату магнію і 1,6 % безводного колоїдного кремнезему.
12. Таблетка за одним з пп. 1-11, яка відрізняється тим, що вона має одну або більше канавок розлому, перпендикулярних висоті і довжині таблетки.
13. Таблетка за одним з пп. 1-12, яка відрізняється тим, що вона робить можливим пролонговане вивільнення.
14. Таблетка за одним з пп. 1-13, яка відрізняється тим, що від 13 до 27 % загальної кількості активної речовини вивільняється протягом 2 годин, від 32 до 52 % загальної кількості активної речовини вивільняється протягом 4 годин і більше ніж 85 % загальної кількості активної речовини вивільняється протягом 12 годин.
15. Таблетка за одним з пп. 1-14, яку застосовують як лікарський засіб для лікування діабету.
16. Спосіб одержання таблетки за одним з пп. 1-15, який відрізняється тим, що це є спосіб одержання шляхом вологої грануляції, який включає наступні стадії:
а) змішування гліклазиду, мальтодекстрину, моногідрату лактози, частини похідного целюлози і частини колоїдного кремнезему;
b) після змішування проводять змочування; вологу масу, одержану таким чином, потім гранулюють, висушують і класифікують;
c) гранулят, який одержують на стадії b), складає внутрішню фазу і його перемішують із залишковою частиною похідного целюлози низької вязкості;
d) змащування гранулята, який одержують на стадії с), за допомогою колоїдного кремнезему і стеарату магнію;
e) компресія змащеної суміші, використовуючи пуансони, які дозволяють зробити канавки розлому в таблетці.
17. Спосіб одержання таблетки за одним з пп. 1-15, який відрізняється тим, що це є спосіб одержання шляхом прямої компресії, який включає наступні стадії:
а) змішування гліклазиду, мальтодекстрину, моногідрату лактози, похідних целюлози і частини колоїдного кремнезему;
b) змащування гранулята, який одержують на стадії а), за допомогою колоїдного кремнезему і стеарату магнію;
с) компресія змащеної суміші, використовуючи пуансони, які дозволяють зробити канавки розлому в таблетці.
18. Спосіб одержання таблетки за одним з пп. 1-15, який відрізняється тим, що це є спосіб одержання шляхом сухої грануляції, який включає наступні стадії:
а) змішування гліклазиду, мальтодекстрину, моногідрату лактози, частини похідного целюлози і частини колоїдного кремнезему;
b) після змішування проводять ущільнювання і потім класифікування;
c) гранулят, який одержують на стадії b), складає внутрішню фазу і його перемішують із залишковою частиною похідного целюлози низької вязкості;
d) змащування гранулята, який одержують на стадії с), за допомогою колоїдного кремнезему і стеарату магнію;
e) компресія змащеної суміші, використовуючи пуансони, які дозволяють зробити канавки розлому в таблетці.
Текст
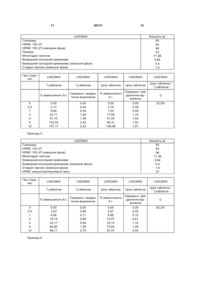
1. Розділювана таблетка модифікованого вивільнення, яка містить гліклазид, похідне целюлози і зв'язувальну речовину, де нерозділена таблетка і частина вказаної таблетки, яку одержують шляхом розділення, мають однакові параметри розчинення.2. Таблетка за п. 1, яка відрізняється тим, що похідне целюлози являє собою гідроксиметилцелюлозу, гідроксіетилцелюлозу, гідроксипропілцелюлозу і/або гідроксипропілметилцелюлозу.3. Таблетка за одним з пп. 1 або 2, яка відрізняється тим, що похідне целюлози являє собою гідроксипропілметилцелюлозу низької в'язкості.4. Таблетка за одним з пп. 1-3, яка відрізняється тим, що зв'язувальна речовина являє собою мальтодекстрин, полівідон або гідроксипропілметилцелюлозу дуже низької в'язкості.5. Таблетка за одним з пп. 1-4, яка відрізняється тим, що таблетка містить гідрофілізуючий засіб, і гідрофілізуючий засіб переважно являє собою колоїдний кремнезем.6. Таблетка за одним з пп. 1-5, яка відрізняється тим, що вона містить гліклазид, похідне целюлози, мальтодекстрин і безводний колоїдний кремнезем.7. Таблетка за одним з пп. 1-6, яка відрізняється тим, що відсоток активної речовини складає від 12 % до 40 % загальної ваги таблетки.8. Таблетка за одним з пп. 1-7, яка відрізняється тим, що відсоток похідного целюлози складає від 10 % до 60 % загальної ваги таблетки.9. Таблетка за одним з пп. 1-8, яка відрізняється тим, що відсоток зв'язувальної речовини складає від 2 % до 15 % загальної ваги таблетки.10. Таблетка за одним з пп. 2-9, яка відрізняється тим, що вона містить загальну кількість гліклазиду, що складає 60 мг.11. Розділювана таблетка модифікованого вивільнення, яка відрізняється тим, що вона містить 18,7 % гліклазиду, 22,3 % моногідрату лактози, 6,9 % мальтодекстрину, 50 % низькозаміщеної гідроксипропілметилцелюлози, 0,5 % стеарату магнію і 1,6 3 86731 4 целюлози і частини колоїдного кремнезему;b) після змішування проводять ущільнювання і потім класифікування;c) гранулят, який одержують на стадії b), складає внутрішню фазу і його перемішують із залишковою частиною похідного целюло зи низької в′язкості;d) змащування гранулята, який одержують на стадії с), за допомогою колоїдного кремнезему і стеарату магнію;e) компресія змащеної суміші, використовуючи пуансони, які дозволяють зробити канавки розлому в таблетці. Даний винахід стосується галузі дослідження і розробки нових галенових форм фармацевтичних препаратів.Даний винахід стосується розділюваної галенової форми, яка дозволяє модифіковане вивільнення активного інгредієнта.Фармацевтичні композиції з модифікованим вивільненням - наприклад, пролонгованим вивільненням, відстроченим вивільненням або безперервним вивільненням - активної речовини були відомі протягом тривалого часу. Зокрема, вони дають можливість уникнути викидів активного інгредієнта в кров і одержати стійку концентрацію крові у людини. Це включає зменшення небажаних ефектів, які можуть виникнути в результаті "ефекту викиду", який може супроводжуватись гідроелектролітичними проблемами і проблемами метаболічного типу, асоційованими зі змінами в рівнях плазми активного інгредієнта. Форма з модифікованими вивільненням є особливо переважною у порівнянні з формою негайного вивільнення, тому що у конкретних пацієнтів вона дозволяє уникнути концентрацій активного інгредієнта в крові, які є підвищеними і короткотривалими, і ефект від яких може виявитись шкідливим при лікуванні конкретних патологій.Розділювана галенова форма, така як розділювана таблетка, має такі ознаки, як лінії розлому, які дозволяють вказаній галеновій формі бути розколотій і які дають в результаті дози практично рівної маси, які містять практично рівні кількості активної речовини. Поділ таблетки складає традиційну, але все ж таки знову виникаючу проблему в галузі галенових препаратів. Загально використовуваними є таблетки, які мають канавки для розлому, що дозволяють легке розділення і роблять можливим одержання розколених доз, які містять точну і рівну кількість активного інгредієнта.Задачею даного винаходу є забезпечити одну й ту ж саму галенову форму зі звичайними і ще взаємно антагоністичними властивостями, а саме бути розділюваною і мати модіфіковане вивільнення.Директивна CPMP/QWP/604/96 ЕМЕА, Європейське Агентство Лікарських Засобів, явно відмовляє від поєднання властивостей розділювання і пролонгованого вивільнення в одній і тій же галеновій формі: "Помилковою практикою є розділяти дозовані форми з пролонгованим вивільненням, але це може бути виправдане у виняткових випадках."Хоч має місце те, що таблетки, які мають відносно глибокі канавки для розлому, дозволяють одержати більш легкий розлом вказаних таблеток і точну кількість активної речовини в кожній розколеній дозі, ці розділювані таблетки, які мають глибокі канавки для розлому і які використовуються у формі розколених доз, мають суттєве збільшення площі їх поверхні, що відповідає поверхні розлому, яка може досягати 20% загальної площі поверхні. Це значне зростання у площі поверхні у випадку розколених доз має надзвичайно руйнуючий ефект на характеристики вивільнення активної речовини. Отже, у випадку, коли загальна площа поверхні значно збільшена в результаті розділення, модифіковане вивільнення активної речовини з розколених доз змінюється до такої міри, що вказані розколені дози більше не мають, або мають тільки частково, бажані властивості, зокрема нормальне модифіковане вивільнення. Отже, використання розділюваних таблеток, які мають відносно глибокі канавки для розлому призводить до відсутності впевненості щодо властивостей і ефективності, що не прийнятне для пацієнта.Для того, щоб подолати проблеми, пов'язані з розділенням галенових форм з модифікованим вивільненням, досліджувались галенові розчини. Зокрема, була розроблена нова форма розділюваних таблеток з модифікованим вивільненням для того, щоб збільшення загальної площі поверхні завдяки поверхням розлому було якомога меншим при розділенні (FR 2 462 908). Ця продовгувата таблетка має точні умовні співвідношення довжини/ширини/висоти від 2,5 до 5 / від 0,9 до 2/1. Крім того, ширина складає не більше ніж 2/3 довжини, і загальну глибину канавок доводять до між 1/3 і 1/2 висоти так, щоб продукт ділянки поверхні розлому і кількість можливих фрагментів складали не більше ніж 15% зовнішньої площі поверхні нерозділеної таблетки. Однак, через збільшену легкість, з якою ці розділювані таблетки ламаються, завдяки малій ділянці поверхні розлому, вказані таблетки мають тенденцію до розлому на роздільній панелі, що є небажаним ефектом в ході виробничого процесу.Задачею даного винаходу є, відповідно, запропонувати альтернативну стратегію, яка дає можливість, уникнути проблем, властивих при розробці вже доступних розділюваних таблеток з модифікованим вивільненням, з метою подолати, щонайменше частково, недоліки, пов'язані із розділенням таблеток на розколені дози. Ця альтернативна стратегія базується на новизні фармацевтичної композиції галенової форми.Даний винахід має стосується розділюваної галенової форми, наприклад, розділюваної таблетки, з модифікованим вивільненням і яка містить один або більше активних інгредієнтів і наступні наповнювачі: полімер похідного целюлози і зв'язувальну речовину. Ця нова галенова форма характеризується тим, що вона має однаковий профіль розчинення, розділена вона або ні. Наприклад, розділювана таблетка з пролонгованим вивільненням у нерозділеній формі і частина вказаної форми, яку одержують розділенням, мають однакові параметри розчинення.В контексті даного винаходу, під "однаковими параметрами розчинення" мається на увазі кінетика розчинення, яка має коефіцієнти варіації статистично значущих відмінностей. Однакова in vitro кінетика розчинення відповідно до даного винаходу призводить до однакової кінетики плазми.Вираз "активний інгредієнт" відповідно до даного винаходу включає активний інгредієнт як 5 86731 такий або один з його гідратів, кристалічних форм і адитивних солей з фармацевтично прийнятною кислотою.Відповідно до даного винаходу, вираз "активна речовина" або "активний інгредієнт" стосується, без жодного обмеження, наступних терапевтичних сімейств: антибіотики, серцево-судинні засоби, знеболювальні засоби, антикоагулянти, антитромботичні засоби, вазоконстриктори, судинорозширювальні засоби, протипухлинні засоби, гіперглікемічні і гіпоглікемічні засоби, протизапальні засоби, протиаритмічні засоби, протихолестеринемічні засоби, вітаміни, мінерали, кожний з цих активних інгредієнтів може бути в поєднанні один з одним.Переважно, активний інгредієнт відповідно до даного винаходу являє собою гіпоглікемічній засіб, особливо протидіабетичний засіб. Більш переважно, активний інгредієнт являє собою сполуку сульфонілсечовини.Перевага віддається активному інгредієнту, використаному в даному винаході, який являє собою гліклазид формули (І): H3C S O2 O NH NH N Гліклазид являє собою сполуку сульфонілсечовини, визнану завдяки своїм протидіабетичним властивостям.Одинична доза гліклазиду може змінюватись відповідно до віку і ваги пацієнта, і природи і тяжкості діабету. Вона зазвичай знаходиться в діапазоні від 30 до 120 мг, у формі єдиного введення, для денного лікування. Процентне відношення гліклазиду в галеновій формі складає від 12 до 40% загальної ваги таблетки.Досі існуючі формулювання складались з:- таблетки негайного вивільнення, яка містить 80 мг; і- матриксної таблетки, яка містить 30 мг гліклазиду. Ця таблетка дає можливість дотримуватись режиму одиничної дози, що знаходиться в діапазоні від 30 до 120 мг у формі єдиного щоденного введення, що відповідає прийому від 1 до 4 таблеток 30 мг. Ця таблетка гліклазиду, введена у формі гідрофільного матриксу, яка розкрита в описі патенту ЕР 1 148 871, забезпечує пролонговане і контрольоване вивільнення активного інгредієнта без in vitro кінетики розчинення згаданого матриксу, що знаходиться під впливом рН. Ця форма пролонгованого вивільнення гліклазиду забезпечує стійкі рівні плазми і низькі зміни Смакс-Смін.Схема дозування, яка рекомендується для гліклазиду, включає введення гліклазиду в дозі 30 мг протягом першого періоду і потім, протягом другого періоду, гліклазиду в дозі 60 мг, яка являє собою дозу лікування, що вводиться більшості пацієнтів. До того ж, пацієнтів, які більш серйозно уражені хворобою, необхідно лікувати дозами 90 мг, або навіть 120 мг, гліклазиду.Надзвичайно переважним чином, у порівнянні до існуючих формулювань, даний винахід, який складається з розділюваної матриксної таблетки з тривалим вивільненням, яка містить 60 мг гліклазиду, гарантує кращу схему лікування через обме 6 ження кількості таблеток, які приймає пацієнт, а також дозволяє оптимізувати виробництво лікарських засобів на єдиній виробничій лінії.У формулі полімер похідного целюлози має функцію утворення матриксу, який гарантує, між іншим, модифіковане вивільнення активного інгредієнта. Вивільнення активного інгредієнта має місце як за допомогою дифузії, так і за допомогою ерозії матриці і, зокрема, дає пролонговане вивільнення активного інгредієнта.Як зрозуміло відповідно до даного винаходу, похідні целюлози, або полімери целюлози, являють собою, наприклад, етилцелюлозу, метилцелюлозу, ацетат целюлози, ацетатфталат целюлози, гідроксиметилцелюлозу, гідроксіетилцелюлозу, гідроксипропілцелюлозу і гідроксипропілметилцелюлозу.Похідні целюлози, яким віддають перевагу відповідно до даного винаходу, являють собою: гідроксиметилцелюлозу, гідроксіетилцелюлозу, гідроксипропілцелюлозу і гідроксипропілметилцелюлозу.Перевага віддається таблетці відповідно до даного винаходу, яка містить похідне целюлози низької в'язкості. Надалі перевага віддається таблетці відповідно до даного винаходу, яка містить гідроксипропілметилцелюлозу, або НРМС.НРМС являють собою комерційно доступні полімери, відомі кваліфікованому в даній галузі фахівцю і які звичайно використовують в галузі технології виготовлення лікарських засобів. Необхідно також відмітити, що ці полімери доступні на ринку, особливо під торговельною маркою Methocel™ і Metolose™.НРМС високої в'язкості можуть бути вибрані з Methocel K15M™ і Methocel К100М™, 2% за вагою водні розчини яких мають в'язкість 15000 і 100000 сП, відповідно.НРМС середньої в'язкості можуть бути вибрані з Methocel E4M™, Methocel К4М™ і Methocel K4MCR™, 2 % за вагою водні розчини яких мають в'язкість 4000 сП.НРМС низької в'язкості можуть бути вибрані з Methocel E5™, Methocel E5 LV™, Methocel E15 LV™, Methocel E50 LV™, Methocel K100 LV™ і Metolose 90SH100™, 2% за вагою водні розчини яких мають в'язкість 5, 5, 15, 50, 100 і 100 сП, відповідно.У фармацевтичній композиції відповідно до даного винаходу зв'язувальна речовина служить для того, щоб зв'язувати разом частинки, які не можуть бути зв'язані разом виключно під дією тиску.Винахід переважно стосується зв'язувальних речовин, включених у наступний перелік: розчин сахарози, розчин глюкози, розчин сорбіту, сироп глюкози, переважно мальтодекстрин, гуміарабік, трагакант, метилцелюлоза, карбоксиметилцелюлоза, желатин, крохмаль, PEG 4000 і 6000, полівідон (PVP) і НРМС дуже низької в'язкості.Таблетка відповідно до даного винаходу переважно містить мальтодекстрин, полівідон або НРМС дуже низької молекулярної ваги як зв'язувальну речовину для даної галенової форми.Даний винахід відповідно стосується переважно розділюваної таблетки пролонгованого вивільнення: а) гліклазид, похідне целюлози і мальтодекстрин або b) гліклазид, похідне целюлози і полівідон або с) гліклазид, похідне целюлози і НРМС від низької до дуже низької молекулярної ваги.У переважному втіленні, таблетка відповідно до даного винаходу також містить гідрофілізуючий засіб. Відповідно до звичайного за 7 стосування, мається на увазі, що гідрофілізуючий засіб означає будь-яку речовину, здатну покращити просочення матриксу водою так, щоб швидко утворити гель. У контексті даного винаходу, гідрофілізуючі засоби являють собою ті, які включені у наступний список: колоїдний кремнезем, полісорбат, складний ефір сорбіту. Переважно, таблетка відповідно до даного винаходу містить колоїдний кремнезем як гідрофілізуючий засіб даної галенової форми. Процентний вміст колоїдного кремнезему як гідрофілізуючого засобу в таблетці відповідно до даного винаходу складає від 0,1% до 5% загальної ваги таблетки.Даний винахід стосується особливо розділюваної таблетки пролонгованого вивільнення, яка містить гліклазид, похідне целюлози, мальтодекстрин і колоїдний кремнезем.Даний винахід стосується також таблетки, яка містить, в доповнення до активних інгредієнтів і наповнювачів, які вже розкрито,- щонайменше, один розріджувач або заповнювач, такий як моногідрат лактози, маніт, поліол, незаміщену целюлозу або альтернативно крохмаль і мінеральну сіль; фосфат дикальцію; і /або- щонайменше, одну змащувальну речовину, особливо компресійну змащувальну речовину, таку як стеарат магнію або альтернативно стеарат кальцію, стеарат цинку, стеарат алюмінію, натрій стеарил фумарат; і/або- щонайменше, один засіб, що забезпечує текучість, такий як безводний колоїдний кремнезем.Переважно, винахід стосується розділюваної таблетки модифікованого вивільнення, яка містить від 12 % до 40 % активного інгредієнта відносно загальної ваги таблетки. Переважно, розділювана таблетка відповідно до даного винаходу також містить від 10 % до 60 % похідного целюлози відносно загальної ваги таблетки. Дуже особливо, розділювана таблетка відповідно до даного винаходу містить від 2 % до 15 % зв'язувальної речовини відносно загальної ваги таблетки.До того ж, розділювана таблетка відповідно до даного винаходу має одну або більше канавок розлому, розташованих на одній стороні або обох сторонах, перпендикулярно напрямам висоти і довжини таблетки. Канавки розлому, забезпечені на обох сторонах, розташовані переважно одна навпроти одної або ж чергуються, і більш того однакової глибини або різних глибин. Розділювана таблетка може відповідно бути розколеною на дві або декілька заздалегідь визначених частин. Це дає можливість пристосувати дозу лікарського засобу до конкретного режиму дозування, пов'язаного з патологією або пацієнтом.Винахід переважно стосується розділюваної таблетки, в якій від 13 до 27% загальної кількості активної речовини вивільняється протягом 2 годин, від 32 до 52% загальної кількості активної речовини вивільняється протягом 4 годин і більше ніж 85% загальної кількості активної речовини вивільняється протягом 12 годин.Переважно, таблетка відповідно до даного винаходу має наступний єдиний склад (в мг/таблетка) і наступний процентний склад:L0014022: - гліклазид 60,00 18,7% - моногідрат лактози 71,36 22,3% -НРМС 100 сП 160,00 50% 86731 8 - мальтодекстрин 22,00 6,9% - безводний колоїдний 1,6% кремнезем 5,04 - стеарат магнію 1,60 0,5% Загальна вага: 320,00 Наступний склад таблетки відповідно до даного винаходу наданий, як функція, з одного боку, кількості в одиницях мг/загальна вага кожної сполуки і, з іншого боку, розташування вказаної сполуки у внутрішній фазі або зовнішній фазі:L0014022: Внутрішня фаза: Гліклазид 60 Лактоза 71,36 НРМС 100 сП 64 Мальто декстрин 22 Безводний колоїдний кремнезем 4,4 Зовнішня фаза: НРМС 100 сП 96 Стеарат магнію 1,6 Безводний колоїдний кремнезем 0,64 Загальна вага 320 Винахід стосується способу одержання, за допомогою вологої грануляції, розділюваної таблетки, як описано тут вище, який включає щонайменше наступні стадії:a) змішування гліклазиду, мальтодекстрину, моногідрату лактози, частини похідного целюлози і частини колоїдного кремнезему;b) після змішування проводять змочування; вологу масу, одержану таким чином, потім гранулюють, висушують і класифікують;c) гранулят, який одержують на стадії b), складає внутрішню фазу і його перемішують із залишковою частиною похідного целюлози низької в'язкості;d) змащування грануляту, який одержують на стадії с), за допомогою колоїдного кремнезему і стеарату магнію;e) компресія змащеної суміші, використовуючи пуансони, які дозволяють зробити канавки розлому в таблетці.Винахід стосується способу одержання, за допомогою прямої компресії, розділюваної таблетки, як описано тут вище, який включає щонайменше наступністадії:a) змішування гліклазиду, мальтодекстрину, моногідрату лактози, похідних целюлози і частини колоїдного кремнезему;b) змащування суміші, яку одержують на стадії с), за допомогою колоїдного кремнезему і стеарату магнію;c) компресія змащеної суміші, використовуючи пуансони, які дозволяють зробити канавки розлому в таблетці.Нарешті, винахід стосується способу одержання, за допомогою грануляції ущільнювання або сухої грануляції, розділюваної таблетки, як описано тут вище, який включає щонайменше наступні стадії:a) змішування гліклазиду, мальтодекстрину, моногідрату лактози, частини похідного целюлози і частини колоїдного кремнезему;b) після змішування проводять ущільнювання і потім класифікування;c) гранулят, який одержують на стадії Ь), складає внутрішню фазу і його перемішують із залишковою частиною похідного целюлози низької в'язкості;d) змащування грануляту, який одержують на стадії с), за допомогою колоїдного кремнезему і стеарату магнію;є) компресія змащеної суміші, використовуючи пуансони, які дозволяють зробити канавки розлому в таблетці.Переважно, в кінці процесу одержують 9 86731 таблетки, твердість яких, що вимірюється переломлюванням по діаметру, складає від 60 до 120 N і розламування яких за допомогою канавок розлому удосконалює схему лікування.Переважно, розділювані галенові форми модифікованого вивільнення гліклазиду відповідно до даного винаходу використовують при виробництві лікарських засобів для лікування діабету.Даний винахід ілюстрований наступними Фігурами і Прикладами, які жодним чином не обмежують його:Фігура 1: Порівняльна кінетика розчинення для цілої таблетки і половини таблетки композиції L0014022;Фігура 2: Порівняльна кінетика розчинення для цілої таблетки і половини таблетки композиції L0023844;Фігура 3: Порівняльна кінетика розчинення для цілої таблетки і половини таблетки композиції L0023845;Фігура 4: Порівняльна кінетика розчинення для цілої таблетки і половини таблетки композиції L0023849.Приклади 1 - 4: Порівняння кінетики розчиненняПриклади 1 - 4 порівнюють кінетику вивільнення in vitro нерозділених таблеток з кінетикою вивільнення in vitro розколених доз. Параметри розчинення порівнюють, використовуючи коефіцієнт подібності (f2). Вважається, що два параметри розчинення є однаковими, коли значення (f2) більше ніж або дорівнює 50. Директиви ЕМЕА і FDA рекомендують обчислення коефіці 10 єнта подібності (f2) для того, щоб порівняти два параметри розчинення і для того, щоб вирішити, чи є вказані параметри розчинення однаковими.Коефіцієнт подібності (f2) має формулу: é ê ê 100 ê f= 50 · log ê 2 t = n 2 ê å R(t ) - T(t ) ê =1 t ê 1+ n ë [ ] ù ú ú в якому f2 являє ú ú, ú ú ú û собою коефіцієнт подібності, п являє собою кількість стандартизованих точок, R(t) означає середній процент активного інгредієнта, який розчиняється з нерозділеної таблетки і T(t) означає середній процент активного інгредієнта, який розчиняється з розколеної дози згаданої таблетки. У Прикладах 1-4, стандартизовані точки знаходиться у t = 2 години, t = 4 години і t = 12 годин.Таблетки, які оцінюють, мають різні склади; ці склади відрізняються особливо за природою похідних целюлози і за природою зв'язувальних речовин, які використовують. Таблетки виробляють відповідно до способу за даним винаходом, який розкрито тут вище.Приклад 1: L0014022 Гліклазид НРМС 100 сП НРМС 100 сП (зовнішня фаза) Повідон Моногідрат лактози Безводний колоїдний кремнезем Безводний колоїдний кремнезем (зовнішня фаза) Стеарат магнію (зовнішня фаза) Час(години) L0014022 1 0 0,5 1 2 4 8 12 /2 таблетки L0014022 1 L0014022 L0014022 /2 таблетки Ціла таблетка Ціла таблетка Середньо% вивільненого А.І. квадратичне відхилення 0 0 4,34 0,33 9,93 0.57 22,38 1,07 47,8 1,78 90,17 2,87 98,58 2,93 Приклад 2: Кількість мг 60 64 96 22 71,36 0,64 4,4 1,6 % вивільненого А.І. 0 3,61 8,68 20,25 43,77 84,64 99,1 Середньо- квадратичне відхилення 0 0,95 1,05 2,09 3,54 3,26 0,8 L0014022 Ціла таблетка/1/2 таблетки f2 75% 11 86731 12 L0023844 Гліклазид НРМС 100 сП НРМС 100 сП (зовнішня фаза) Повідон Моногідрат лактози Безводний колоїдний кремнезем Безводний колоїдний кремнезем (зовнішня фаза) Стеарат магнію (зовнішня фаза) Час (години) L0023844 Кількість мг 60 64 96 22 71,36 0,64 4,4 1,6 L0023844 L0023844 L0023844 L0023844 /2таблетки Ціла таблетка Ціла таблетка Ціла таблетка / 1 /2таблетки % вивільненого А.І. Середньо- квадратичне відхилення % вивільненого А.І. 0,00 3,17 8,94 22,11 51,10 102,52 107,17 0,00 0,24 0,44 1,04 1,36 2,42 2,32 0,00 2,79 7,04 17,65 41,04 84,31 106,48 1 0 0,5 1 2 4 8 12 /2таблетки 1 Середньо- квадратичне відхилення 0,00 0,48 0,59 1,19 1,63 1,52 1,91 f2 52,8% Приклад 3: L0023845 Гліклазид НРМС 100 сП НРМС 100 сП (зовнішня фаза) Моногідрат лактози Безводний колоїдний кремнезем Безводний колоїдний кремнезем (зовнішня фаза) Стеарат магнію (зовнішня фаза) НРМС низької молекулярної ваги Час (години) L0023845 Кількість мг 60 64 96 71,36 0,64 4,4 1,6 22 L0023845 L0023845 L0023845 L0023845 /2таблетки Ціла таблетка Ціла таблетка Ціла таблетка / 1 /2таблетки % вивільненого А.І. Середньо- квадратичне відхилення % вивільненого А.І. 0,00 3,53 8,06 19,15 43,17 84,60 98,11 0,00 0,68 0,71 0,88 0,94 1,58 2,75 0,00 2,97 6,86 15,87 35,74 73,65 97,37 1 0 0,5 1 2 4 8 12 Приклад 4: /2таблетки 1 Середньо- квадратичне відхилення 0,00 0,05 0,12 0,61 1,14 1,49 2,03 f2 62,2% 13 86731 14 L0023849 Мальтодекстрин Гідроксіетилцелюлоза Гідроксіетилцелюлоза (зовнішня фаза) Гліклазид Моногідрат лактози Безводний колоїдний кремнезем Безводний колоїдний кремнезем (зовнішня фаза) Стеарат магнію (зовнішня фаза) Час (години) L0023849 Кількість мг 22 64 96 60 71,36 0,64 4,4 1,6 L0023849 L0023849 /2таблетки Ціла таблетка % вивільненого A.I. Середньо-квадратичне відхилення % вивільненого А.І. 0,00 4,63 8,91 19,32 41,34 86,61 95,71 0,00 0,29 0,31 0,62 1,04 2,62 2,76 0,00 3,80 7,27 15,78 37,47 67,37 95,00 1 0 0,5 1 2 4 8 12 /2таблетки 1 Фармацевтичні композиції, які оцінюють у Прикладах 1 - 5, мають подібні параметри розчи . L0023849 L0023849 Ціла таблеЦіла таблетка тка / 1/2 таблетки Середньоквадратичне відхилення 0,00 53,4% 0,10 0,25 0,58 2,02 3,10 1,92 нення для нерозділеної форми і для частин форми, яку одержують розділенням 15 Комп’ютерна верстка Д. Шеверун 86731 Підписне 16 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюDivisible galenic form of the modified drug release
Автори англійськоюFonknechten Gilles, Genty Patrick, Pean Jean-Manuel, Wutrich Patrick
Назва патенту російськоюДелимая галеновая форма модифицированного высвобождения активного ингредиента
Автори російськоюФонкнехтен Жиль, Женти Патрик, Пен Жан-Манюель, Вютриш Патрик
МПК / Мітки
МПК: A61K 9/22, A61K 31/64, A61K 9/20
Мітки: активного, галенова, яка, можливим, робіт, розділювана, форма, інгредієнта, модифіковане, вивільнення
Код посилання
<a href="https://ua.patents.su/8-86731-rozdilyuvana-galenova-forma-yaka-robit-mozhlivim-modifikovane-vivilnennya-aktivnogo-ingrediehnta.html" target="_blank" rel="follow" title="База патентів України">Розділювана галенова форма, яка робить можливим модифіковане вивільнення активного інгредієнта</a>
Попередній патент: Мастило для гарячої обробки металів тиском
Наступний патент: Спосіб виготовлення покриття, що перешкоджає ковзанню
Випадковий патент: Передавальна антенна система з фазованою решіткою