Спосіб ідентифікації стовбурових ракових клітин
Номер патенту: 87508
Опубліковано: 10.02.2014
Автори: Останков Максим Вадимович, Бондарович Микола Олександрович, Гаєвська Юлія Олександрівна, Челомбітько Ольга Василівна, Гольцев Анатолій Миколайович, Бабенко Наталія Миколаївна, Дубрава Тетяна Георгіївна
Формула / Реферат
Спосіб ідентифікації стовбурових ракових клітин, що передбачає використання реагента із флуоресцентною активністю, який відрізняється тим, що як такий реагент використовують сферичні наночастинки ортованадату.
Текст
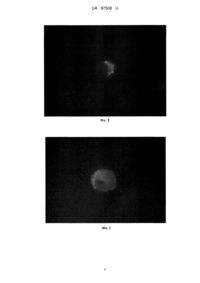
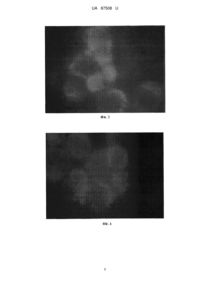
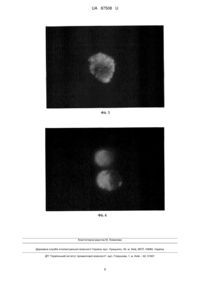
Реферат: Спосіб ідентифікації стовбурових ракових клітин передбачає використання реагента із флуоресцентною активністю. Як такий реагент використовують сферичні наночастинки ортованадату. UA 87508 U (12) UA 87508 U UA 87508 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до галузі медицини, а саме до онкології, і може бути використана для кількісної оцінки пула стовбурових ракових клітин (СРК) в асцитній і інших біологічних рідинах (ексудатах), малігнізованих тканинах людини й лабораторних тварин при онкопатології, зокрема при аденокарциномі Ерліха (АКЕ). Необхідність створення подібних способів продиктована потребами медицини в розробці нових методів диференціальної діагностики онкологічних хвороб, а також нових методів оцінки ефективності їхнього лікування. Відомо, що при багатьох видах раку, включаючи й АКЕ, як ініціюючий чинник пухлинного росту може виступати популяція клітин, що має властивості стовбурових клітин [1], яка + + + характеризується певним спектром маркерів диференціації - CD44 CD24 , CD133 , Sca-1 та ін. Ця популяція має здатність до самовідновлення, що є необхідною умовою канцерогенезу й диференціації, спричиняє гетерогенність ракових клітин. Є дані, що СРК є посередниками метастазування пухлини і, завдяки їхній відносній стійкості до хіміотерапії й радіотерапії, можуть підтримувати резистентність пухлини до проведеного лікування й спричиняти виникнення рецидивів. Використання технологій для виявлення клітин-попередників різного рівня диференціювання в пухлинному вогнищі може дати можливість не тільки ідентифікувати стадії, динаміку розвитку й інвазивність процесу, але і його чутливість до проведеного в тій або іншій формі терапії. Відомий спосіб ідентифікації СРК шляхом фарбування клітин флуоресцентним барвником Хехст. Суть його полягає в диференціальній здатності клітин пухлини різного ступеня диференціювання вибірково зв'язуватися з барвником Хехст [2]. Однак цей спосіб не знайшов широкого застосування через токсичну дію барвника на клітини й високу погрішність результатів (стовбурні клітини зв'язують від 10 до 80 % Хехста33342 щодо диференційованих клітин) [3]. Відомий спосіб ідентифікації СРК, заснований на оцінці експресії альдегід дегідрогенази, підвищено експресованій СРК [4]. Використання цього способу обмежено у зв'язку зі значними фінансовими витратами й необхідністю використання спеціального устаткування. Найбільш близьким до способу, що заявляється, є спосіб ідентифікації СРК методом проточної цитометрії з використанням кон'югованих із флуорохромом моноклональних антитіл (МАТ) до антигенів (АГ) СРК [5]. Відповідно до способу суспензію клітин вносять у центрифужні 7 пробірки в обсязі 100 мкл із концентрацією 1-2×10 клітин/мл. До клітин додають 2 мкл відповідних МАТ і інкубують при +4 °C. Потім клітини піддають дворазовому відмиванню розчином Хенкса, після чого досліджують на проточному цитофлюориметрі (FACS Calibur фірми Becton Dickinson (США)). Аналіз отриманих даних здійснюють за допомогою програми WinMDi 2.8. Істотними недоліками способу є його трудомісткість і відсутність універсальності. Трудомісткість пов'язана з необхідністю використання при деяких видах онкопатології, у тому числі й АКЕ, одночасно кілька маркерів, і у зв'язку із цим, більш детальним молекулярнобіологічним аналізом первинного зразка. Спосіб не є універсальним, тому що для кожного типу пухлини СРК доводиться використовувати специфічні для даного виду онкопатології МАТ. У зв'язку з тим, що в зразку може бути присутнім відразу декілька субпопуляцій СРК, що характеризуються різними CD-молекулами, використання для виявлення цих клітин МАТ дозволяє визначити тільки конкретну субпопуляцію, а не весь пул СРК [6]. Крім цього, висока вартість реактивів, використовуваних у даному способі, обмежує його широке використання в експериментальних і клінічних дослідженнях в онкології. В основу корисної моделі поставлено задачу шляхом використання реагенту, що має здатність селективно проникати в СРК, створити нетрудомісткий і універсальний спосіб ідентифікації СРК для широкого використання в онкології. Ця задача вирішується тим, що в способі ідентифікації СРК, що передбачає використання реагенту із флуоресцентною активністю, відповідно до корисної моделі, як такий реагент використовують сферичні наночастинки ортованадату. Пропонований спосіб не вимагає великих витрат праці, оскільки передбачає одноразове додавання тест-частинок до зразка з наступним інкубуванням суспензії клітин. Він є універсальним, оскільки проникнення використовуваних наночастинок у клітини засновано на специфічних їхніх властивостях селективної тропності до мембран СРК [7], що дозволяє використовувати наночастинки для діагностики ракових клітин різного генезу й локалізації, при цьому дозволяє виявляти весь пул СРК, не залежно від експресованих на їхній поверхні маркерів. 60 1 UA 87508 U 5 10 15 20 25 30 35 40 45 50 Спосіб здійснюють таким чином. До досліджуваного зразка додають суспензію сферичних наночастинок ортованадату у вихідній концентрації, після чого проводять інкубацію суспензії клітин з наночастинками ортованадату при кімнатній температурі. Потім досліджують СРК на люмінесцентному мікроскопі. Для збудження люмінесценції в мікроскопі використовують фільтр, що пропускає випромінювання з довжиною хвилі 460-490 нм. Спостереження проводять при збільшенні X1000 в умовах масляної імерсії. Приклад 1. Дослідження проводили на клітинах АКЕ, пасированих на 8-місячних самках мишей лінії Balb/C масою 16-18 г, які утримувалися в стандартних умовах віварію Інституту проблем кріобіології і кріомедицини НАН України (м. Харків). Як первинну культуру використовували кріоконсервовані клітини АКЕ, які зберігалися в низькотемпературному банку Інституту проблем кріобіології і кріомедицини НАН України при -196 °C. Відігріті клітини АКЕ "стабілізували" багаторазовим перевиванням in vivo протягом 7 діб, поки вони не здобували структурно-функціональні ознаки нативих АКЕ. Як тест-частинки для виявлення СРК використовували сферичні наночастинки ортованадату 3+ (Y0,1-0,3VO4:Еu ) у концентрації 0,875 г/л і 4,38 г/л. У дозах нижче 0,8 г/л нанокристалічних люмінофорів не достатньо для виявлення люмінісценції в клітинах, а в концентрації вище 4,4 г/л молекули ортованадату призводять до значного зниження кількості життєздатних клітин [8]. Виходячи з вищевикладеного, була апробована здатність наночастинок до акумуляції на клітинах АКЕ в зазначених концентраціях. Для проведення кількісної оцінки СРК суспензію клітин АКЕ переносили в пробірку, у яку додавали суспензію наночастинок ортованадату у 7 вихідній концентрації. Інкубацію клітин АКЕ (10 кл/мл) з наночастинками ортованадату проводили в ізотонічному 5 % розчині глюкози при кімнатній температурі протягом 1 і 3 годин. Ідентифікацію клітин, які були інкубовані, проводили на люмінесцентному мікроскопі Olympus IX 71 із джерелом збудження - ксеноновою лампою 75 W. Для збудження люмінесценції в мікроскопі був використаний фільтр, що пропускає випромінювання з довжиною хвилі 460-490 нм. Спостереження проводили при збільшенні X1000 в умовах масляної імерсії. При інкубації клітин АКЕ зі сферичними наночастинками протягом 1 години не спостерігали їхнього специфічного зв'язування із клітинами. При 3-годинній інкубації відзначалася чітка локалізація наночастинок в 6,00±0,81 % трансформованих клітин (Табл. 1). Наночастинки були представлені у вигляді зерен червоного кольору. Морфологічно це були більші за розмірами клітини зі співвідношенням ядра до цитоплазми 1:1. При цьому була встановлена адсорбція наночастинок як на мембрані, так і в цитоплазмі клітин (дифузійне на поверхні клітини, концентроване у вигляді "вкраплень", у вигляді обручки). Клітини, які не візуалізувались наночастинками, були значно меншими за розмірами й з ядром, що займало всю клітину (фіг. 1). Отримані дані про кількість клітин, що світилися після інкубації з наночастинками, узгоджувалися з результатами ідентифікації СРК методом проточної цитометрії, в якому вміст + + CD117 клітин становив 1,29±0,12 %, CD44 /24 - 4,80±0,33 % (Табл.1). Більше того, при інкубації + збагаченої СРК фракції CD44 клітин, виділеної методом магнітного сортування, був виявлений високий відсоток клітин, що світилися (49,57±3,56 %). Збільшення концентрації сферичних наночастинок з 0,875 г/л до 4,38 г/л не викликало посилення їхньої адсорбції на поверхні клітин АКЕ, кількість клітин, що світилися склав 6,25±0,96 %. Установлена характерна адсорбція наночастинок у цитоплазмі клітин (фіг. 2). Приклад 2. Проводили порівняльну оцінку можливості ідентифікації СРК при використанні наночастинок ортованадату інших форм: веретеноподібній і стрижнеподібній. Клітини АКЕ інкубували з наночастинками ортованадату в концентраціях 0,875 г/л і 4,38 г/л протягом 3 годин. Установлено, що інкубація клітин АКЕ з веретеноподібними наночастинками не приводила до візуально значимої адсорбції наночастинок на клітинах АКЕ (фіг. 3, 4). При інкубації АКЕ протягом 3 годин зі стрижнеподібними наночастинками в концентраціях 0,875 г/л, і 4,38 г/л, спостерігали тільки аутофлуоресценцію клітин(зелене фарбування) без адсорбції наночастинок (фіг. 5,6). На підставі вищенаведених даних можна зробити висновок про тропність сферичних наночастинок ортованадату до СРК і можливості їхнього використання для ідентифікації цих клітин з метою діагностики й типізації пухлинного процесу. 55 2 UA 87508 U Таблиця 1 Кількість клітин АКЕ після інкубації з наночастинками ортованадату, що світилися Час інкубації 1 година 3 години АКЕ+сферичні АКЕ+сферичні наночастинки (0,875 г/л) наночастинки (4,38 г/л) 6,00±0,81 % 6,25±0,96 % Вміст + CD44 /24 % 4,8±0,33 % Вміст + CD117 , % 1,29±0,12 % Таблиця 2 Кількість клітин АКЕ після інкубації з наночастинками ортованадату, що світилися Час інкубації 1 година 3 години 5 10 15 20 Веретеноподібні 0,875 г/л 4,38 г/л Стрижеподібні 0,875 г/л 4,38 г/л + Вміст CD44 /24", % 4,8±0,33 % Джерела інформації:. 1.А1-Hajj M., Wicha M.S., Benito-Hemandez A. [et al.] Prospective identification of tumorigenic breast cancer cells // Proc. Natl. Acad. Sci. USA.-2003. - Vol. 100, №7. -P. 3983-3989. 2. Pan Z., Zhou Q. Side population cells and lung cancer stem cells // ZhongguoFei Ai ZaZhi.2012. - Vol.15, №3. - P. 187-190. 3. Zhou S., Schuetz J.D., Bunting K.D., Colapietro A.-M. et al. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype // NatureMed. - 2001. -Vol. 7. - P.1028-1034. 4. Kim R.J., Park J.R., Roh K.J., Choi A.R. et al. High aldehyde dehydrogenase activity enhances stem cell features in breast cancer cells by activating hypoxia-inducible factor-2? //Cancer Lett. 2013. - Vol.333, №1. - P.18-31. 5. Ahmed M.A., Aleskandarany M.A., Rakha E.A., Moi'stafa R.Z., et al. A CD44+/CD24-phenotype is a poor prognostic marker in early invasive breast cancer // Breast Cancer Res Treat.-2012. Vol.133, №3. - P. 979-995. 6. Wright M.H., Calcagno A.M., Salcido C.D., Carlson MD, et al. Brcal breast tumors contain + + distinct CD44 /CD24 and CD133 cells with cancer stem cell characteristics // Breast Cancer Res.2008. - Vol.10, №1. - P.R10. 7. Ho D. Nanodiamonds. Applications in biology and nanoscale medicine/ New York: Springer, 2010. - P. 286. 8. Iordachescu D., Dinu D., Bonoiu A. et al. Time and dose-respnse study of the effects of vanadate of human skin fibroblasts // Romanian J. Biophys. - 2002. - Vol. 12, №3-4. - P. 69-76. 25 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 30 Спосіб ідентифікації стовбурових ракових клітин, що передбачає використання реагента із флуоресцентною активністю, який відрізняється тим, що як такий реагент використовують сферичні наночастинки ортованадату. 3 UA 87508 U 4 UA 87508 U 5 UA 87508 U Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Автори англійськоюHoltsev Anatolii Mykolaiovych, Dubrava Tetiana Heorhiivna, Ostankov Maksym Vadymovych, Bondarovych Mykola Oleksandrovych, Chelombitko Olha Vasylivna
Автори російськоюГольцев Анатолий Николаевич, Дубрава Татьяна Георгиевна, Останков Максим Вадимович, Бондарович Николай Александрович, Челомбитько Ольга Васильевна
МПК / Мітки
МПК: G01N 33/483
Мітки: ракових, клітин, ідентифікації, стовбурових, спосіб
Код посилання
<a href="https://ua.patents.su/8-87508-sposib-identifikaci-stovburovikh-rakovikh-klitin.html" target="_blank" rel="follow" title="База патентів України">Спосіб ідентифікації стовбурових ракових клітин</a>
Попередній патент: Пристрій для експресної оцінки фальсифікації соків
Наступний патент: Спосіб електрохімічного полірування нержавіючих і низьколегованих сталей
Випадковий патент: Пневмотранспортний дозатор сипучих формувальних матеріалів