Спосіб одержання фармацевтичного продукту, що містить налбуфін
Формула / Реферат
1. Спосіб одержання фармацевтичного продукту, який містить поміщений у ампули розчин для ін'єкцій на основі налбуфіну гідрохлориду, що має виражену аналгетичну дію, який включає одержання розчину для ін'єкцій шляхом внесення у підготовлений згідно з діючими санітарними нормами апарат води та розрахованої кількості налбуфіну гідрохлориду та допоміжних речовин, доведення рН та об'єму одержаного розчину до необхідного значення та стерилізуюче фільтрування розчину, наповнення одержаним розчином для ін'єкцій ампул, їх подальшу запайку та стерилізацію, який відрізняється тим, що:
а) налбуфіну гідрохлорид розчиняють у воді для ін'єкцій з подальшим барботуванням азоту;
б) до розчину, отриманого на стадії а), додають в зазначеному порядку натрію цитрат, кислоту лимонну, натрію хлорид та/або натрію метабісульфіт або натрію метабісульфат з необов'язковим доведенням значення рН до величини в інтервалі від 3,4 до 3,7 додаванням 0,1М розчину хлористоводневої кислоти і наступним барботуванням азоту;
в) розчин, отриманий на стадії б), піддають стерилізуючій фільтрації;
г) розчином, отриманим на стадії в), заповнюють ампули/скляні флакони, які потім запаюють та стерилізують, одержуючи ін'єкційні одиниці;
д) одержані на стадії г) ін'єкційні одиниці поміщають в упаковку.
2. Спосіб за п. 1, який відрізняється тим, що одержані на стадії г) ін'єкційні одиниці містять 1 мл або 2 мл розчину для ін'єкцій з розрахунку 10 мг або 20 мг активної речовини у 1 одиниці.
3. Спосіб за п. 1 або п. 2, який відрізняється тим, що налбуфіну гідрохлорид на стадії а) розчиняють при перемішуванні у воді для ін'єкцій з температурою 15-25 °C.
4. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що на стадії б) контролюють повноту розчинення кожного з зазначених компонентів перед додаванням наступного.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що значення рН на стадії б) необов'язково доводять до величини в інтервалі від 3,4 до 3,7.
6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що на стадії в) стерилізуючу фільтрацію здійснюють передавлюванням розчину тиском азоту через систему з двох послідовних фільтрів з відсікаючою здатністю 1,0 мкм і 0,2 мкм.
7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що на стадії г) стерильний розчин у потоці азоту поміщають в ампули шприцевого наповнення по 1 мл або по 2 мл на ампулу.
8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що запаяні на стадії г) ампули стерилізують при 120±1 °C протягом 15 хвилин.
9. Спосіб за будь-яким з пп. 1-8, який відрізняється тим, що ін'єкційні одиниці на стадії д) поміщають у контурні упаковки коміркового типу.
10. Спосіб за будь-яким з пп. 1-9, який відрізняється тим, що ін'єкційні одиниці на стадії д) вносять у пачку або у коробки.
11. Спосіб за будь-яким з пп. 1-10, який відрізняється тим, що в упаковку, в яку на стадії г) поміщені ін'єкційні одиниці, додають інструкцію по застосуванню.
12. Спосіб за будь-яким з пп. 1-11, який відрізняється тим, що розчин для ін'єкцій, який містить продукт, має рН 3,0-5,0.
13. Спосіб за будь-яким з пп. 1-12, який відрізняється тим, що розчин для ін'єкцій, який містить продукт, має рН 3,0-4,2.
14 Спосіб за будь-яким з пп. 1-13, який відрізняється тим, що розчин для ін'єкцій, що входить до складу продукту, містить, мас. %:
налбуфіну гідрохлорид
1,0-2,0
лимонну кислоту
1,26
натрію цитрат
0,94
натрію хлорид
0,1
натрію метабісульфіт
0,1
воду для ін'єкцій
решта.
15. Спосіб за будь-яким з пп. 1-14, який відрізняється тим, що одержують продукт, призначений для внутрішньовенного, внутрішньом'язового та/або підшкірного введення.
Текст
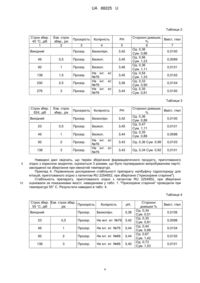
Реферат: Спосіб одержання фармацевтичного продукту полягає у тому, що налбуфіну гідрохлорид розчиняють у воді для ін'єкцій з подальшим барботуванням азоту, додають натрію цитрат, кислоту лимонну, натрію хлорид та/або натрію метабісульфіт або натрію метабісульфат з необов'язковим доведенням значення рН до величини в інтервалі від 3,4 до 3,7 додаванням 0,1М розчину хлористоводневої кислоти і наступним барботуванням азоту. Отриманий розчин піддають стерилізуючій фільтрації, заповнюють ним ампули/скляні флакони, які потім запаюють та стерилізують, одержуючи ін'єкційні одиниці, які поміщають в упаковку. UA 88225 U (54) СПОСІБ ОДЕРЖАННЯ ФАРМАЦЕВТИЧНОГО ПРОДУКТУ, ЩО МІСТИТЬ НАЛБУФІН UA 88225 U UA 88225 U 5 10 15 20 25 30 35 40 45 50 Корисна модель належить до медицини і фармакології, а саме до забезпечення способу одержання фармацевтичного продукту, який містить поміщений у ампули розчин для ін'єкцій на основі налбуфіну гідрохлориду, що має виражену аналгетичну дію, а також фармацевтичного продукту, що має яскраво виражену аналгетичну дію, який включає ряд окремих та таких, що можна індивідуально вилучати з упаковки ін'єкційних одиниць, які являють собою поміщений у ампулу/скляний флакон розчин для ін'єкцій на основі налбуфіну гідрохлориду. Корисна модель може знайти застосування в медицині для усунення больових синдромів середньої і вираженої інтенсивності при інфаркті міокарда, під час підготовки до операції, в післяопераційному періоді, а також як додатковий засіб знеболення при загальній анестезії. Налбуфін має властивості агоніста-антагоніста опіоїдних рецепторів (агоніст каппа- та антагоніст мю-опіоїдних рецепторів), який активує ендогенну антиноцицептивну систему через каппа-опіатні рецептори і порушує міжнейронну передачу больових імпульсів на різних рівнях центральної нервової системи. Впливаючи на вищі відділи головного мозку, налбуфін змінює емоційне забарвлення болю, а також гальмує умовні рефлекси, чинить седативний вплив. До побічних ефектів слід віднести дисфорію, міоз і збудження блювального центру. Однак, на відміну від морфіну, налбуфін у меншому ступені пригнічує дихальний центр і впливає на моторику шлунково-кишкового тракту, не впливає на гемодинамічні показники. Крім того, ризик розвитку звикання та опіоїдної залежності при контрольованому застосуванні незначний. Фармакологічний болезаспокійливий вплив проявляється через 2-3 хвилини після внутрішньовенного введення або через 10-15 хвилин після внутрішньом'язового введення. Максимальна концентрація в плазмі крові після внутрішньом'язового введення спостерігається через 30-60 хвилин. Тривалість дії становить 3-6 годин, період напіввиведення дорівнює 2,5-3 години. Час досягнення Сmах при внутрішньом'язовому введенні становить близько 1 години, при внутрішньовенному введенні - 30 хвилин. Виводиться, головним чином, у вигляді метаболітів печінки, переважно - з жовчю, а також у невеликих кількостях з сечею. Проникає через плацентарний бар'єр і виявляється в материнському молоці (менше 1 % введеної дози). У патенті RU 2362560 (опубл. 10.05.2006) описаний фармацевтичний препарат на основі метилналтрексону або його солі, який необов'язково містить налбуфін, який є розчином, що включає метилналтрексон або його сіль і хелатоутворюючий агент, при цьому розчин має рН від 2 до 6, а хелатоутворюючим агентом є етилендіамінтетраоцтова кислота (ЕДТА) або дикалію едетат, динатрію едетат, динатрію кальцію едетат. Найближчим аналогом є патент RU 2254852 (опубл. 27.06.2005), який розкриває препарат, що має виражену аналгетичну дію, та спосіб його одержання. Згідно з вказаним документом препарат являє собою ампули, заповнені розчином для ін'єкцій, який містить налбуфіну гідрохлорид, буферну суміш, стабілізатор і воду для ін'єкцій, при цьому розчин додатково містить комплексоутворюючий компонент при наступному співвідношенні компонентів, мас. %: налбуфіну гідрохлорид 0,8-2,2 буферна суміш 0,5-3,5 стабілізатор 0,15-0,25 комплексоутворюючий компонент 0,001-0,2 вода решта. Недоліком описаного способу одержання препарату та самого препарату є ймовірність виникнення побічних ефектів, пов'язаних з внутрішньовенним введенням ЕДТА, який він містить протягом більш ніж 5 днів, наприклад гіпокальцемії, гіпокалемії, загострення захворювань нирок та печінки. Крім того, препарат може викликати небажані побічні реакції у хворих на діабет, хворих з низьким рівнем калію, порушенням серцевого ритму, серцево-судинними захворюваннями. Відомостей про безпеку запропонованого препарату в описі винаходу до патенту RU 2254852 не міститься. В основу корисної моделі поставлена задача розширення арсеналу сильних анальгетичних засобів. Поставлена задача вирішена шляхом забезпечення способу одержання фармацевтичного продукту, який містить поміщений у ампули розчин для ін'єкцій на основі налбуфіну гідрохлориду, що має виражену аналгетичну дію, який включає одержання розчину для ін'єкцій шляхом внесення у підготовлений згідно з діючими санітарними нормами апарат води та розрахованої кількості налбуфіну гідро хлориду, та допоміжних речовин, доведення рН та об'єму одержаного розчину до необхідного значення та стерилізуюче фільтрування розчину, наповнення одержаним розчином для ін'єкцій ампул, їх подальшу запайку та стерилізацію, у якому: а) налбуфіну гідрохлорид розчиняють у воді для ін'єкцій з подальшим барботуванням азоту; 1 UA 88225 U 5 10 15 20 25 30 35 40 45 50 б) до розчину, отриманого на стадії а), додають в зазначеному порядку натрію цитрат, кислоту лимонну, натрію хлорид та/або натрію метабісульфіт або натрію метабісульфат з необов'язковим доведенням значення рН до величини в інтервалі від 3,4 до 3,7 додаванням 0,1М розчину хлористоводневої кислоти і наступним барботуванням азоту; в) розчин, отриманий на стадії б), піддають стерилізуючій фільтрації; г) розчином, отриманим на стадії в), заповнюють ампули/скляні флакони, які потім запаюють та стерилізують, одержуючи ін'єкційні одиниці; д) одержані на стадії г) ін'єкційні одиниці поміщають в упаковку. Також одержані згідно зі способом на стадії г) ін'єкційні одиниці можуть містити 1 мл або 2 мл розчину для ін'єкцій з розрахунку 10 мг або 20 мг активної речовини у 1 одиниці. Також згідно зі способом налбуфіну гідрохлорид на стадії а) можуть розчиняти при перемішуванні у воді для ін'єкцій з температурою 15-25 °C. Також згідно зі способом на стадії б) контролюють повноту розчинення кожного з зазначених компонентів перед додаванням наступного. Також значення рН на стадії б) необовязково доводять до величини в інтервалі від 3,4 до 3,7, а на стадії в) стерилізуючу фільтрацію можуть здійснювати передавлюванням розчину тиском азоту через систему з двох послідовних фільтрів з відсікаючою здатністю 1,0 мкм і 0,2 мкм. Крім цього, також на стадії г) стерильний розчин у потоці азоту поміщають в ампули шприцевого наповнення по 1 мл або по 2 мл на ампулу. Також стерилізацію на стадії г) можуть здійснювати при 120±1 °C протягом 15 хвилин. Крім цього, ін'єкційні одиниці на стадії д) можуть поміщати у контурні упаковки коміркового типу та або вносити у пачку або у коробки, а також додавати інструкцію по застосуванню. Крім цього, розчин для ін'єкцій, який містить продукт, має рН 3,0-5,0 або рН 3,0-4,2. Поставлена задача вирішена також шляхом створення фармацевтичного продукту, який включає ряд окремих та таких, що можна індивідуально вилучати з упаковки ін'єкційних одиниць, які являють собою поміщений у ампулу/скляний флакон розчин для ін'єкцій, який містить, мас. %: налбуфіну гідрохлорид 1,0-2,0 лимонну кислоту 1,26 натрію цитрат 0,94 натрію хлорид 0,1 натрію метабісульфіт 0,1 воду для ін'єкцій решта. Також поміщений у ампулу/скляний флакон розчин для ін'єкцій може містити 1,0 мас. % налбуфіну. Також ін'єкційна одиниця може містити 1 мл або 2 мл зазначеного розчину для ін'єкцій. Фармацевтичний продукт згідно з корисною моделлю може бути призначений для внутрішньовенного, внутрішньом'язового або підшкірного введення і може включати маркування для застосування, що включає інструкції щодо використання вказаного продукту. Іншою задачею корисної моделі є подолання основного недоліку найближчого аналога, який обумовлено присутністю у відомому препараті ЕДТА, а саме - можливих ускладнень у кардіологічних хворих діабетом, хворих з серцево-судинними захворюваннями. Таким чином, технічним результатом корисної моделі є отримання фармацевтичного продукту налбуфіну для ін'єкцій, який має знижену токсичність. Також автори корисної моделі несподівано встановили, що виключення комплексоутворюючої сполуки зі складу препарату дозволяє збільшити термін зберігання препарату до 3 років. Поставлена задача вирішується способом отримання фармацевтичного продукту, в якому: а) налбуфіну гідрохлорид розчиняють у воді для ін'єкцій з подальшим барботуванням азоту; б) до розчину, отриманого на стадії а), додають в зазначеному порядку натрію цитрат, кислоту лимонну, натрію хлорид і натрію метабісульфіт або натрію метабісульфат з необов'язковим доведенням значення рН до величини в інтервалі від 3,4 до 3,7 і наступним барботуванням азоту; в) розчин, отриманий на стадії б), піддають стерилізуючій фільтрації; г) розчином, отриманим на стадії в), заповнюють ампули/скляні флакони, які потім запаюють та стерилізують, при цьому одержані ін'єкційні одиниці містять 1 мл або 2 мл розчину для ін'єкцій з розрахунку 10 мг або 20 мг активної речовини у 1 одиниці; д) одержані на стадії г) ін'єкційні одиниці поміщають в упаковку; є) в упаковку додають інструкцію по застосуванню. 2 UA 88225 U 5 10 15 20 Досягнення технічних результатів при здійсненні корисної моделі підтверджується наступними прикладами. Приклад 1. Приготування фармацевтичного продукту, який включає поміщений у ампули розчин налбуфіну гідрохлориду для ін'єкцій. У підготовлений згідно з діючими санітарними нормами скляний апарат місткістю 1,5 л, який оснащено мішалкою, термометром і барботером, завантажують 920-930 мл води для ін'єкцій з температурою 15-25 °C і при перемішуванні розчиняють 10,0 г налбуфіну гідрохлориду. Через барботер в апарат подають азот. Після цього, постійно перемішуючи, до розчину додають 9,4 г натрію цитрату 5,5-гідрату, 12,6 г кислоти лимонної, 1,0 г натрію хлориду та 1,0 г натрію метабісульфіту, контролюючи повноту розчинення компонента перед додаванням наступного. Значення рН доводять до величини в інтервалі від 3,4 до 3,7 додаванням 1М розчину хлористоводневої кислоти, після чого об'єм розчину доводять до 1,0 л і барботують його азотом. Отриманий розчин тиском азоту передавлюють через систему з двох послідовних фільтрів з відсікаючою здатністю 1,0 мкм і 0,2 мкм в підготовлений збірник. Стерильний розчин у потоці азоту поміщають в ампули шприцевого наповнення по 1 мл на ампулу. Запаяні ампули стерилізують при 120±1 °C протягом 15 хвилин. Стерильні ампули з розчином (ін'єкційні одиниці) запаковують у контурні упаковки коміркового типу та вносять у пачку або у коробки (для стаціонару), а також оснащують інструкціями по застосуванню. Здійснюють вибірковий контроль якості за показниками, наведеними в табл. 1. Таблиця 1 Показник Опис або значення Прозора рідина Рідина безбарвна або забарвлена не інтенсивніше, ніж еталон Колірність № 7б РН 3,0-4,2 Сторонні домішки (з аналізу Одинична домішка: не більше 1,5 %; Вміст домішок - не більше ВЕРХ) 3,0 % Вміст налбуфіну гідрохлориду 0,0090-0,0110 г/мг (визначено спектрофотометрично) Прозорість 25 30 35 40 45 Всі ампули з вибірки (N=10) відповідають критеріям якості. Приклад 2. Оцінка токсичності пропонованого продукту для ін'єкцій. Гостру токсичність досліджували на статевозрілих білих мишах обох статей при внутрішньошлунковому (в/ш) та внутрішньом'язовому (в/м) введенні в дозах 500-1500 мг/кг і 150-600 мг/кг відповідно. Відмічався незначний відсоток загибелі тварин у стані сну через 14-20 хвилин після введення препарату. У тварин, що вижили, не спостерігалося відхилень інтегральних та функціональних показників, а також масових коефіцієнтів і макроскопічних характеристик внутрішніх органів після розтину. Рандомізоване дослідження гострої токсичності дало оцінки LD50 772 мг/кг при в/ш та 600 мг/кг при в/м введенні. Таким чином, досліджений препарат належить до малонебезпечних речовин (4 клас небезпеки). Субхронічну токсичність досліджували на щурах Вістар обох статей з масою тіла 210-240 г при 14-денному внутрішньом'язовому (в/м) введенні в дозах 3 та 30 мг/(кг•добу) і внутрішньошлунковому (в/ш) введенні в дозах 10 і 100 мг/(кг•добу), що перевищує максимальну терапевтичну добову дозу для людини в 1,25 та 12,5 разів відповідно. Відношення максимальної сумарної дози (1400 мг/кг в/ш і 420 мг/кг в/м) до середньосмертельної дози склало 1,81 (в/ш) і 0,7 (в/м). Загибелі тварин не відмічено. Фізіологічні, гематологічні та біохімічні показники тварин під час дослідження не виходили за межі природної норми. Визначення морфологічних характеристик внутрішніх органів після розтину не показало патологічних змін. Подразнюючої дії на ШКТ і в місці ін'єкції не відмічено. При задовільному стані всіх тварин після 14-денного дослідження з урахуванням відношень максимальної сумарної дози до середньосмертельної дози можна стверджувати, що досліджений препарат не має вираженої кумулятивності. Приклад 3. Дослідження стабільності ("прискорене старіння"). Стабільність при зберіганні оцінювали за показниками якості, наведеним у табл. 1. "Прискорене старіння" проводили при температурі 45 °C або 55 °C. Результати наведені в табл. 2 і 3 відповідно. 3 UA 88225 U Таблиця 2 Строк збер. 45 °C, діб 1 Екв. строк збер., рік 2 Вихідний Прозорість Колірність 3 4 Сторонні домішки, Вміст, г/мл % 6 7 Од. 0,36 0,0100 Сум. 0,86 Од. 0,56 0,0099 Сум. 1,23 Од. 0,36 0,0101 Сум. 1,11 Од. 0,54 0,0102 Сум. 1,33 Од. 0,33 0,0104 Сум. 0,90 Од. 0,35 0,0100 Сум. 0,81 РН 5 Прозор. Безколірн. 3,42 46 0,5 Прозор. Безкол. 3,45 92 1 Прозор. Безкол. 3,46 138 1,5 Прозор. 230 2,5 Прозор. 276 3 Прозор. Не інт. ет. №76 Не інт. ет. №76 Не інт. ет. №76 3,45 3,36 3,44 Таблиця 3 Строк збер. 55Х, діб Екв. строк збер., рік Вихідний Прозорість Колірність Прозор. Безколірн. 3,42 23 Прозор. Безкол. 3,45 1 Прозор. Безкол. 3,44 92 2 Прозор. 138 10 0,5 46 5 Сторонні домішки, Вміст, г/мл % Од. 0,36 0,0100 Сум. 0,86 Од. 0,47 0,0101 Сум. 1,11 Од. 0,35 0,0098 Сум. 0,86 РН 3 Прозор. Не інт. ет. №76 Не інт. ет. №76 3,43 Од. 0,36 Сум. 0,98 0,0103 3,43 Од. 0,34 Сум. 0,92 0,0101 Наведені дані свідчать, що термін зберігання фармацевтичного продукту, приготованого згідно з корисною моделлю, оцінюється 3 роками, що було підтверджено випробуванням партії, закладеної на зберігання при кімнатній температурі. Приклад 4. Порівняльне дослідження стабільності препарату налбуфіну гідрохлориду для ін'єкцій, приготованого згідно з патентом RU 2254852, при зберіганні ("прискорене старіння"). Стабільність препарату, приготованого згідно з патентом RU 2254852, при зберіганні оцінювали за показниками якості, наведеними у табл. 1. "Прискорене старіння" проводили при температурі 55° С. Результати наведені в табл. 4. Таблиця 4 Строк збер. Екв. строк збер., Прозорість 55 °C, діб рік Вихідний Колірність рН, Прозор. Безколірн. 3,38 23 0,5 Прозор. Не инт. ет. №76 3,42 46 1 Прозор. Не інт. ет. №76 3,44 92 2 Прозор. Не інт. ет. №66 3,44 138 3 Прозор. Не інт. ет. №66 3,40 4 Сторонні домішки % Од. 0,34 Сум. 0,51 Од. 0,35 Сум. 0,81 Од. 0,44 Сум. 0,88 Од. 0,67 Сум. 1,42 Од. 0,73 Сум. 1,53 Вміст, г/мл 0,0106 0,0098 0,0104 0,0102 0,0101 UA 88225 U 5 10 15 20 25 30 35 40 45 50 Наведені дані свідчать, що при еквівалентному терміні зберігання, що перевищує 2 роки, у продукті, що містить розчин налбуфіну гідрохлориду для ін'єкцій, приготованому згідно із патентом RU 2254852, відбувається наростання інтенсивності забарвлення, а також помітне збільшення вмісту сторонніх домішок. Таким чином, фармацевтичний продукт, запропонований згідно з даною корисною моделлю, є малотоксичним, має кумулятивність і проявляє низьку субхронічну токсичність на моделях у природних умовах. Крім того, термін зберігання такого продукту перевищує термін зберігання найближчого аналога. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 1. Спосіб одержання фармацевтичного продукту, який містить поміщений у ампули розчин для ін'єкцій на основі налбуфіну гідрохлориду, що має виражену аналгетичну дію, який включає одержання розчину для ін'єкцій шляхом внесення у підготовлений згідно з діючими санітарними нормами апарат води та розрахованої кількості налбуфіну гідрохлориду та допоміжних речовин, доведення рН та об'єму одержаного розчину до необхідного значення та стерилізуюче фільтрування розчину, наповнення одержаним розчином для ін'єкцій ампул, їх подальшу запайку та стерилізацію, який відрізняється тим, що: а) налбуфіну гідрохлорид розчиняють у воді для ін'єкцій з подальшим барботуванням азоту; б) до розчину, отриманого на стадії а), додають в зазначеному порядку натрію цитрат, кислоту лимонну, натрію хлорид та/або натрію метабісульфіт або натрію метабісульфат з необов'язковим доведенням значення рН до величини в інтервалі від 3,4 до 3,7 додаванням 0,1М розчину хлористоводневої кислоти і наступним барботуванням азоту; в) розчин, отриманий на стадії б), піддають стерилізуючій фільтрації; г) розчином, отриманим на стадії в), заповнюють ампули/скляні флакони, які потім запаюють та стерилізують, одержуючи ін'єкційні одиниці; д) одержані на стадії г) ін'єкційні одиниці поміщають в упаковку. 2. Спосіб за п. 1, який відрізняється тим, що одержані на стадії г) ін'єкційні одиниці містять 1 мл або 2 мл розчину для ін'єкцій з розрахунку 10 мг або 20 мг активної речовини у 1 одиниці. 3. Спосіб за п. 1 або п. 2, який відрізняється тим, що налбуфіну гідрохлорид на стадії а) розчиняють при перемішуванні у воді для ін'єкцій з температурою 15-25 °C. 4. Спосіб за будь-яким з пп. 1-3, який відрізняється тим, що на стадії б) контролюють повноту розчинення кожного з зазначених компонентів перед додаванням наступного. 5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що значення рН на стадії б) необов'язково доводять до величини в інтервалі від 3,4 до 3,7. 6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що на стадії в) стерилізуючу фільтрацію здійснюють передавлюванням розчину тиском азоту через систему з двох послідовних фільтрів з відсікаючою здатністю 1,0 мкм і 0,2 мкм. 7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що на стадії г) стерильний розчин у потоці азоту поміщають в ампули шприцевого наповнення по 1 мл або по 2 мл на ампулу. 8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що запаяні на стадії г) ампули стерилізують при 120±1 °C протягом 15 хвилин. 9. Спосіб за будь-яким з пп. 1-8, який відрізняється тим, що ін'єкційні одиниці на стадії д) поміщають у контурні упаковки коміркового типу. 10. Спосіб за будь-яким з пп. 1-9, який відрізняється тим, що ін'єкційні одиниці на стадії д) вносять у пачку або у коробки. 11. Спосіб за будь-яким з пп. 1-10, який відрізняється тим, що в упаковку, в яку на стадії г) поміщені ін'єкційні одиниці, додають інструкцію по застосуванню. 12. Спосіб за будь-яким з пп. 1-11, який відрізняється тим, що розчин для ін'єкцій, який містить продукт, має рН 3,0-5,0. 13. Спосіб за будь-яким з пп. 1-12, який відрізняється тим, що розчин для ін'єкцій, який містить продукт, має рН 3,0-4,2. 14 Спосіб за будь-яким з пп. 1-13, який відрізняється тим, що розчин для ін'єкцій, що входить до складу продукту, містить, мас. %: налбуфіну гідрохлорид 1,0-2,0 лимонну кислоту 1,26 натрію цитрат 0,94 натрію хлорид 0,1 натрію метабісульфіт 0,1 воду для ін'єкцій решта. 5 UA 88225 U 15. Спосіб за будь-яким з пп. 1-14, який відрізняється тим, що одержують продукт, призначений для внутрішньовенного, внутрішньом'язового та/або підшкірного введення. Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Автори російськоюСорокин Николай Борисович
МПК / Мітки
МПК: A61P 23/00, A61K 9/08, A61K 31/485
Мітки: налбуфін, спосіб, одержання, фармацевтичного, продукту, містить
Код посилання
<a href="https://ua.patents.su/8-88225-sposib-oderzhannya-farmacevtichnogo-produktu-shho-mistit-nalbufin.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання фармацевтичного продукту, що містить налбуфін</a>
Попередній патент: Електрична машина з постійними магнітами
Наступний патент: Спосіб захисту гвинтової пари натискного пристрою
Випадковий патент: Фільтр із зворотним промиванням