Композиція для лікування диспластичних процесів шийки матки
Формула / Реферат
1. Лікувальний засіб для лікування диспластичних процесів шийки матки та слизової прямої кишки в формі супозиторія, який характеризується тим, що містить 3,3'-дііндолілметан, епігалокатехін-3-галат, а також каталізатор інгібуючої активності епігалокатехін-3-галату відносно ДНК-метилтрансфераз, який являє собою катіони Mg2+ у вигляді фармацевтично прийнятної солі магнію, ліофільну основу, яка містить твердий жир, полівінілпіролідон та бутилгідроксіанізол та/або бутилгідроксітолуол при наступному вмісту, мас. %:
3,3'-дііндолілметан
1,0-10,0
епігалокатехін-3-галат
1,0-8,0
полівінілпіролідон
0,5-1,2
бутилгідроксіанізол
0,3-0,5
сіль магнію
0,1-2,0
ліпофільна основа
решта.
2. Лікувальний засіб за п. 1, який характеризується тим, що вказаний супозиторій являє собою вагінальний супозиторій.
3. Лікувальний засіб за п. 1, який характеризується тим, що вказаний супозиторій являє собою ректальний супозиторій.
4. Лікувальний засіб за будь-яким з пп. 1-3, який характеризується тим, що каталізатор інгібуючої активності епігалокатехін-3-галату відносно ДНК-метилтрансфераз являє собою магній хлористий.
Текст
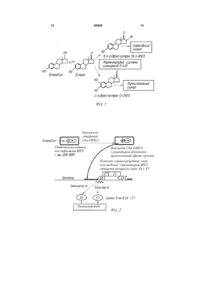
1. Лікувальний засіб для лікування диспластичних процесів шийки матки та слизової прямої кишки в формі супозиторія, який характеризується тим, що містить 3,3'-дііндолілметан, епігалокатехін-3-галат, а також каталізатор інгібуючої активності епігалокатехін-3-галату відносно ДНК2+ метилтрансфераз, який являє собою катіони Mg C2 2 95583 1 3 4) травматизація під час абортів, пологів, діагностичних вискоблювань; 5) пристрасть до паління. До патогенетичних факторів ДШМ відносять наявність запалювальних процесів, порушення балансу статевих гормонів та перенесені травми шийки матки. Однак головним фактором патогенезу ДШМ вважається інфікування вірусом папіломи людини (ВПЛ). ДНК ВПЛ високого ступеню онкогенного ризику (переважно 16 та 18 типів) виявляють у більш ніж 80 % зразків помірної та важкої дисплазії плоского епітелію шийки матки. Папіломовірусна інфекція (ПВЇ) є найбільш розповсюдженим інфекційним захворюванням, яке передається статевим шляхом. Відповідно до статистики більш 50 % сексуально активного населення протягом життя інфікується ВПЛ. Підвищений біологічний та медичний інтерес до ПВІ пояснюється тим, що вона відноситься до опухолеродних інфекцій, які здатні викликати доброякісну гіперплазію, а деякі типи ПВИ - ініціювати розвиток злоякісних пухлин аногенітальної області: рак шийки матки, вульви, піхви та інш. ДНК ВПЛ високої частоти онкогенного ризику (переважно 16 та 18 типів) виявляють у 90 % випадків інвазійного раку. Рак шийки матки (РШМ) займає друге місце по розповсюдженості серед злоякісних новоутворень у жінок. Щорічно у світі реєструється біля півмільйону нових випадків цього захворювання і 270 000 з них закінчується смертельним результатом. Стандартизований показник захворюваності та смертності від РШМ складає 16,2 та 9 на 100 000 населення, відповідно. В Росії від РШМ (що складає 4,8 % від усіх злоякісних захворювань у жінок) щорічно вмирає більш 6 тис. хворих (у літній категорії від 20 до 40 років РШМ є основною причиною смерті), показник захворюваності - приблизно вдвічі вище. Не меншою за значенням медичною проблемою є доброякісні проявлення ПВІ, до яких відносяться екзофітні та ендофітні ураження різних дільниць епітелію вульви, піхви та шийки матки, а також навколишніх шкіряних покровів та слизових оболонок, включаючи анальний отвір. Екзофітні форми (геніальні кондиломи) включають у себе різноманітні за зовнішнім виглядом та розміром гострокінцеві, папілярні та папуловиглядові утворення, які нерідко ускладнюються приєднанням вторинної бактеріальної інфекції та супроводжуються не тільки психологічними, але й фізичними стражданнями пацієнта. Частота геніальних кондилом (геніальних бородавок), які є наслідком інфікування доброякісними ВПЛ - типами, за даними Мінздраву РФ (2001 p.) складає 26 на 100 000 населення. Ендофітні форми (субклінічна ПВІ) являють собою також різні морфологічні зміни плоского епітелію без наріжних розростань. Геніальні кондиломи є також причиною зворотного респіраторного папіломатозу у дітей, що обумовлено вертикальною трансмісією вірусу від інфікованої матері до дитини. Слід відмітити, що за останні роки значно збільшилася кількість діагнозів раку прямої кишки, 95583 4 також обумовленого вірусами папіломи людини. Особливе розповсюдження цей вид патології отримав серед чоловіків з нетрадиційною сексуальною орієнтацією. У більшості випадків онкологічній патології передує утворення кондилом слизової прямої кишки, яке супроводжується кровотечами при акті дефекації, запальними процесами та тріщинами анального отвору. Основними методами лікування геніальних кондилом і передракових неопластичних захворювань, які обумовлені ВПЛ, в цей час є хімічна деструкція, хірургічне висічення або аблація. Ці методи нерідко супроводжуються ускладненнями, потребують застосування дорогого медичного обладнання і далеко не завжди виявляються ефективними. При цьому велика кількість молодих жінок з невираженою картиною вагінального кондиломатозу, які не підлягають деструктивному лікуванню, є носіями інфекції та являють собою небезпеку для статевих партнерів та майбутньої дитини. При інфікуванні епітеліальних тканин вірус папіломи використовує цілий набір механізмів, підкоряючих своїм інтересам життєдіяльність інфікованої клітини. Відомо, що ДНК ВПЛ кодує синтез двох білків Е6 та Е7, які індукують перехід диференційованих клітин в S - фазу клітинного циклу. На стадії активної репродукції вірусу експресія генів Е6 та Е7 регулюється білковим продуктом гена Е2 – репресором транскрипції цих генів. Ключовою подією в малігнізації клітин є інтеграція вірусу в геном клітини - хазяїна, яка супроводжується делецією гена Е2. Контроль клітинного циклу та диференціювання здійснюється за допомогою онкогенним білкам Е6 та Е7, інактивують "ключеві" білки - регулятори проліферативної активності клітин - проапоптотичний білок р53 та білок ретинобластоми (pRB). Встановлено, що білок Е7 здатний утворювати стабільний комплекс з білком pRB, викликаючи його деградацію, що призводить до вивільнення транскрипційного фактора E2F, який стимулює транскрипцію генів, які необхідні для реплікації ДНК в S - фазі клітинного циклу. Крім того, Е7 впливає на активність цілого ряду інших білківрегуляторів клітинного циклу, таких як А - та Ε цикліни, cdk2 -кіназа та інгібітори циклін-залежної кінази р21 тар27 (Киселев В.И., Вирусы папилломы человека в развитии рака шейки матки, Монография, Из-во «Димитрейд График Групп », Москва, 2004). Відомо, що у патогенезі вірусної інфекції, яка призводить до підвищення проліферативної активності інфікованих клітин доброякісного характеру (а інколи і з їх злоякісним переродженням) значну роль грає рівень та активість жіночих статевих гормонів - естрогенів (Киселев В.И., Дмитриев Г.А., Кубанова А.А., Взаимосвязь вирусных инфекций, передаваемых половым путем, и онкологических заболеваний урогенитального тракта, Вестник дерматологии и венерологии, 2000, № 6, стр. 2023). При цьому відносна сталість проліферативної клітинної активності в естроген - чутливих тканинах контролюється за допомогою спеціальних ме 5 таболічних механізмів, які конвертують естрадіол (найбільш активний естроген) в біологічно активні його похідні. Основний пул ендогенного естрогену утилізується за допомогою локалізованої у печінці монооксігеназної системи цитохромів Ρ - 450, яка каталізує утворення його гідроксіпохідних, що полегшує їх розчинність та наступне виведення із організму через нірки та жовчновивідні шляхи. Ферментативна система цитохромів Ρ-450 забезпечує конверсію естрадіолу в два основних метаболіта: 16а - гідроксіестрон (16α-ОНЕ1) та 2гідроксіестрон (2-ОНЕ1) (фіг. 1). 16α-ОНЕ1 відноситься до категорії "агресивних" гормонів, які викликають тривалий канцерогенний ефект (Schneider J., Kinne D., Fracchia A. et al, Abnormal oxidative metabolism of esradiol in women with breast cancer, Proc. Natl. Acad. Sci. USA, 1982, v.79, p. 3047 - 3051). Показано, що цей ефект обумовлений утворенням міцних ковалентних зв'язків 16α-ОНЕ1, який є агоністом естрогену, з ядерними естрогеновими рецепторами (Swaneck GE, FishmanJ, Covalent binding of the endogenous estrogen 16 alphahydroxyestrone to estradiol receptor in human breast cancer cells: characterization and intranuclear localization, Proc. Natl. Acad. Sci. USA, 1988, v.85 (21), p. 7831-7835). 2-OHE1 володіє помірними функціями та, на відміну від 16α-ОНЕ1, напроти, нормалізує клітинний ріст. При підвищенні рівня 2-ОНЕ1 спостерігається тенденція до загибелі пухлинних клітин та до профілактики їх подальшого утворення. Вивчення функцій цих двох метаболітів дозволило виявити однозначний зв'язок між рівнем 16αОНЕ1 та ризиком розвитку пухлин в естрогензалежних тканинах та прийти до висновку, що співвідношення 2-ОНЕ1 до 16α-ОНЕ1 є водночас універсальним біомаркером і надійним діагностичним критерієм при визначенні ризику та прогнозу розвитку естроген-залежних пухлин. Давно було замічено, що тканинні зміни в цервікальному каналі, які викликані ВПЛ, локалізовані головним чином в естроген-чутливих зонах. Більш того, було встановлено, що там, де спостерігається активна експресія білків ВПЛ, відзначений високий рівень синтезу 16α-ОНЕ1 порівняний з таким в ракових клітинах молочної залози. Слід підкреслити, що в нормі епітеліальні клітини шийки матки не здатні забезпечувати перетворення естрадіолу в 16α-гідроксіестрон. Таким чином, активна репродукція ВПЛ індукує утворення "агресивного" метаболіту в інфікованих клітинах (Киселев В.И., Вирусы папилломы человека в развитии рака шейки матки, Монография, Из-во «Димитрейд График Групп®», Москва, 2004). В той же час було показано, що ВПЛінфіковані кератиноцити людини проявляють проліферативну активність in vitro, але при цьому не мають пухлинного фенотипу при мікроскопічному дослідженні. Додавання в культуральне середовище екзогенного 16α-ОНЕ1 перетворює клітини в типово ракові (Auborn К, Woodworth G, DiPaolo J, Bradlow L, The interaction between HPV infection and estrogen metabolism in cervical carcinogenesis, Int. J. Cancer, 1991, v. 49, p. 867-869). 95583 6 Таким чином, формується «порочне коло», при якому вірус через утворення "агресивної" форми естрадіолу створює сприятливі умови для розвитку пухлини, стимулюючі синтез онкобілку Е7. В свою чергу, онкобілок Е7, з однієї сторони активує механізми патологічноїпроліфірації клітин, а з другої - блокує противірусний імунологічний захист (фіг. 2). Ще одною важливою властивістю білку Е7 є його здібність індукувати експресію циклооксігенази 2-го типу (ЦОГ-2) (Subbaramaiah K. and Dannenberg A.J., Cyclooxygenase-2 transcription is regulated by human papillomavirus 16 E6 and E7 oncoprotein: Evidence of corepressor/coactivator exchange, Cancer Res, 2007, 67(8), 3976-3985). В останні роки доказана виключно важлива роль цього ферменту в малігнізації епітеліальних клітин шийки матки (Kulkarni S., Rader J.S. et al, Cyclooxigenase-2 is overexpressed in human cervical cancer, Clinical Cancer Research, 2001, vol.7, pp.429-434), (Ferrandina G., Lauriola L. et al, Increased Cyclooxigenase-2 expression is associated with chemotherapy resistence and poor survival in cervical cancer patients, J of Clinical Oncology, 2002, v.20,4, pp.973-981). Однак багаторічні клінічні спостереження показують, що вірусна інфекція - необхідний, але недостатній елемент у розвитку пухлинних процесів шийки матки. За різними даними, лише від 1% до 4% випадків ВПЛ інфекції епітелію шийки матки розвиваються шляхом малігнізації та приводять до раку. Це означає, що для індукції канцерогенезу є необхідними ще якісь метаболічні порушення епітелію, інфікованого ВПЛ. В останні роки накопичуються дані про те, що гіперметилування генів - супресорів пухлинного росту може слугувати сприятливим фоном для ініціації канцерогенезу (Momparler R.L., Cancer epigenetics, Oncogene, 2003, v.22, pp. 6479-6483). Річ у тому, що онкогенного потенціалу ВПЛ недостатньо для ініціації незворотних процесів канцерогенезу епітелію шийки матки, якщо вірус інфікує здоровий епітелій, який не має ознак генетичних порушень. Цим і пояснюється той факт, що у більшості випадків інфікування спостерігаються помірні процеси дисплазії (CIN І) та (CIN II), які з великою ймовірністю вирішуються спонтанно, без лікарського втручання. У випадку, коли вірусна інфекція уражає епітелій з певними генетичними порушеннями, наприклад, дефектами в експресії генів - супресорів пухлинного росту, то процеси малігнізації набувають злоякісного характеру, що призводить до розвитку раку in situ (Кекеева Т.В., Жевлова А.И. и др., Аномальное метилирование генов супрессоров опухолевого роста и микросателлитная нестабильность в предраковых состояниях шейки матки, Молекулярная биология, 2006, том.40, № 2, с. 224-230). Для формування незворотної неоплазії є необхідними: 1) індукція метаболічних механізмів конверсії естрадіолу в 16α-ОНЕ1, який грає ключову роль в раковому переродженні ВПЛ - інфікованих клітин; 2) активна експресія онкогенів Е6 та Е7 вірусу, яка стимулюється взаємодією комплексу гормонрецепторів з промотором ДНК ВПЛ; 7 3) індукція множинних ушкоджень хромосомної ДНК в інфікованій клітині, яка завершує процес пухлинної трансформації; 4) гіперметилувааня генів-супресорів пухлинного росту, в результаті якого порушується їх експресія та втрачається механізм контролю над процесами малігнізації епітеліальних клітин В зв'язку з появленням вірусної концепції церві кального канцерогенезу принципово змінилися й підходи до лікування диспластичних процесів шийки матки та прилеглих областей. Зокрема був розроблений засіб на основі композиції для профілактики та лікування дисплазій та раку шийки матки та папіломатозу гортані, який включає індол-3-карбінол (ІЗС) в ефективній кількості та відповідний фармацевтичний носій у вигляді вагінапьних свічок (патент РФ 2196568, опубл. 2003.01.20). Сполучення ІЗС володіє широким спектром протипухлинної активності. Однак індол-3-карбінол є нестабільним сполученням. Тому більш перспективним уявляється дііндолілметан (DIM), який являє собою димер, що утворюється із індол-3карбінолу (ІЗС) у кислому середовищі. Експериментально доказано, що практично усі механізми, які є індукуємими ІЗС in vitro та in vivo, характерні й для DIM. В одному із останніх експериментальних досліджень була показана здібність DIM викликати апоптоз цервікальних ВПЛ - інфікованих кератиноцитів людини в умовах in vitro. При цьому на одній з трьох досліджених клітинних лініях цервікального раку DIM демонстрував у кілька разів більшу ефективність, ніж ІЗС. Величина LD50 складала 50-60 мкМ для DIM и 200 мкМ для ІЗС. Але так само, як і його метаболічний попередник - ІЗС, DIM не викликав апоптотичних змін в нормальних (нетрансформованих) кератиноцітах (Chen D.Z., Qi M., AubornK., Carter Т.Н. Indole-3-Carbinol and Diindollylmethane induce apoptosis of human cervical cancer cells and in murine HPV16-transgenic preneoplastic cervical epithelium, J. Nutrit, 2001, 131, 3294-3302). Нещодавно також була описана важлива властивість - його імуномодулююча активність. Було показано, що в умовах in vitro в пухлинних клітинах DIM стимулює IFN-залежні сигнальні каскади за допомогою активацієї експресії рецепторів IFN, а також інших IFN-респонсивних регуляторних білків (Riby J.E., Xue L., Chatterji U. Et al., Activation and potentiation of interferon-γ signaling by 3,3'diindolylmethane in MCF-7 breast cancer cells, Моl. Pharmacol., 2006, 69, 430-439). Маючи на увазі високу противірусну та протипухлинну активність IFN, ця властивість може мати велике клінічне значення при використанні DIM для лікування цервікальнях дисплазій, обумовлених ВПЛ. Як найближчим аналогом може бути вказано рішення, яке стосується лікувальної форми у вигляді вагінальних суппозиторіїв, які містять як активну субстанцію метиндол (3,3'-дііндолілметан), ліпофільну основу, яка включає твердий кондитерський жир, полівінілпірролідон та бутилгідроксіанізол, які взяті у певному співвідношенні (Па 95583 8 тент РФ № 2318510, опубл. 2008.03.10). Засіб призначений для лікування геніальних кондилом та неопластичних захворювань репродуктивних органів. Клінічні дослідження показали його ефективність при CIN І та CIN II. Морфологічні та клінічні ознаки цервікальних дисплазій зникали при двохтижневому курсі препарату (по 1 свічці 1 раз на день). Позитивна динаміка супроводжувалась іррадікацією ДНК ВПЛ в пробах цервікального епітелію аналізуємо полімеразною ланцюговою реакцією (ПЛР). Однак в процесі клінічних випробувань було встановлено, що вагінальні суппозиторії, які містять DIM, володіли недостатньою ефективністю у пацієнток з важкою дисплазією (CIN III). За нашою думкою, це обумовлено більш глибоким ступенем малігнізації клітин, яка вже у меншому ступеню залежить від експресії генів вірусу папіломи людини та набуває незворотного характеру за рахунок порушень клітинного геному, в основному завдяки епігенетичним механізмам інактивації генів - супресорів пухлинного росту, яка настає в результаті гіперметилування промоторних областей цих генів. Таким чином, задачею цього винаходу був пошук більш ефективного засобу на основі дііндолілметану. Ключовим механізмом епігенетичної регуляції є метилування ДНК. Воно полягає в ковалентному приєднанні метильної групи по С5 - положенню цитозину у складі динуклеотида CpG (цитозинфосфор-гуанозін). Динуклеотидні сполучення CpG можуть бути локалізовані як в регуляторних (промоторних) ділянках генів, так й на усьому іншому протязі молекул ДНК. Приблизно 50% генів ссавців у складі своїх промоторів містять динуклеотид CpG. Якщо CpG знаходиться в неметилованому стані, спостерігається активна експресія відповідного гена. Приєднання метильної групи до цитозину CpG, навпаки, пригнічує експресію генів и переводить їх в статус "безмовних". Метилування цитозинів у складі пари CpG здійснюється за допомогою спеціального ферменту - ДНК - метилтрансферази (DNMT), а точніше, сімейства з трьох ізоферментів - DNMT1, DNMT3a, DNMT3b. Показано, що в умовах in vitro та in vivo рівень експресії та активність DNMT1 специфічно підвищені при багатьох злоякісних пухлинах (Fang J.Y., Cheng Z.H., Chen Y.X. et al, Expression of Dnmtl, demethylase, MeCP2 and methylation of tumor-related genes in human gastric cancer, World J. Gastroenterol, 2004, 10, 3394-3398), (Mizuno S., ChijiwaT., OkamuraT. et al, Expression of DNA methyltransferases DNMT1, 3А, and 3B in nirmal hematopoiesis and in acute and chronic myelogenous leukemia, Blood, 2001, 97, 1172-1179), (Patra S.K., Patra Α., Zhao H., Dahiya R., DNA metyltransferase and demethylase in human prostate cancer, Мої. Carcinog, 2002, 33, 163-171). Підвищений рівень DNMT - опосередкованого ДНК-метилуванняя зв'язується з підвищеною пухлиноутворюючою (малігнізуючою) активністю клітин ссавців. Напроти, інгібування DNMT (особливо ізоформи DNMT I) блокує гіперметилування знов синте 9 зованих ДНК-ланцюгів, внаслідок чого відбувається зниження загального рівня метилування геному та реекспресія генів, "безмовних" (Clark SJ, Melki J, DNA methylation and gene silencing in cancer: which is the guilty party, Oncogene, 2002, 21, 5380-5387). В 2003 p. було показано, що епігаллокатехін-3 галлат (EGCG) - самий активний із катехінів зеленого чаю - є ефективним інгібітором ферменту ДНК-метилтрансферази, основного клітинного ферменту, який здійснює метилування залишків цитозину в молекулі ДНК (Fang M.Z., Wang Y., Ai N. et al, Tea polyphenol (-)-epigallocatechin-3-gallate inhibits DNA methyltransferase and reactivates methylation-silenced genes in cancer cell lines, Cancer Res, 2003, 63, 7563-7570). EGCG (5-50 мкМ) дозо-залежним чином ефективно пригнічує активність ДНК-метилтрансферази, внаслідок чого відбувається деметилування CpG-динуклеотидів та реактивація метилованих "безмовних" (транскрипційно неактивних) генів, які утягнені в процеси канцерогенеза, а саме, гена супресора пухлинного росту p16, гена ретиноїдних рецепторів (RAR), гена метилгаунін-метилтрансферази (MGMT) та гена hMLH1, який є відповідальним за репарацію ДНК (фіг. 3). EGCG не тільки є деметилуючим агентом, але також інгібує ЦОГ-2, про важливу роль якої у розвитку дисплазій шийки матки згадувалося раніше (Guang Peng, Dan A Dixon et. Al, Green tea polyphenol-Epigallocatechin-3-gallate inhibits cyclooxygenase-2 expression in colon carcinogenesis, Molecular carcinogenesis, 2006, 45, 309-319). Нами несподівано було виявлено, що інгібуючу активність EGCG відносно ДНКметилтрансфераз можна на порядок посилити 2+ додаванням катіону Mg . Таким чином, вищевказана задача була вирішена новим лікувальним засобом для лікування диспластичних процесів шийки матки та слизової прямої кишки. Новий засіб виконаний у вигляді супозиторію вагінального або ректального, який містить як активні субстанції 3,3'-дііндолілметан та епігаллокатехін-3-галлат, а також каталізатор інгібуючої активності епігаллокатехін-3-галлата відносно ДНК-метилтрансфераз, який являє собою ка2+ тіони Mg у вигляді фармацевтично прийнятної солі магнію, ліпофільну основу, яка містить твердий жир, полівінілпірролідон та бутилгідроксіанізол та/або бутилгідроксітолуол при наступному вмісті, мас.%: 3,3'-Дііндолілметан 1,0-10,0 Епігаллокатехін-3 -галлат 1,0-8,0 Полівінілпірролідон 0,5-1,2 Бутилгідроксіанізол та/або бутилгідроксітолуол 0,3-0,5 Сіль магнію 0,1-2,0 Ліпофільна основа решта. Як ліпофільна основа, що містить твердий жир, можуть бути використані будь-які відомі в галузі фармації основи даного типу: бутирол, сплав масло какао з гідрогенізованим маслом та парафіном, кулінарний жир у суміші з парафіном, вітепсол і т.п. 95583 10 Як каталізатор інгібуючої активності епігаллокатехін-3-галлата відносно ДНК- метилтрансфераз можуть бути використані фармацевтично прийнятні солі магнію, такі як магнію аспарагінат, магнію фумарат, магнію сукцинат та ін. Бажано використання магнію хлориду, особливо бажано використання магнію хлористого 6-водного. Бутилгідроксіанізол та бутилгідрооксітолуол проявляють ефективну антиоксидантну дію і є відомими консервантами. Введення їх в суппзиторну масу дає додатковий ефект впливу на уражену слизову. Включення ПВП в ліпофільну основу забезпечує також сприятливу дію на слизову оболонку. Спосіб приготування супозиторіїв полягає в тому, що розплавляють компоненти ліпофільної основи, частину її окремо розтирають з діючою речовиною до одержання гомогенної зависі, до охолодженої частини основи, що залишилася, додають полівінілпірролідон (ПВП) та бутилгідроксіанізол та/або бутилгідроксітолуол, а потім одержану завись перемішують до однорідного стану та формують свічки методом виливання у форми. Переважно дііндолілметан міститься в кількості 0,01 - 0,6 г. на свічку, епігаллокатехін-3-галлат 0,01 - 0,4 г., магнію сіль-0,01 - 0,02 г. Винахід пояснюється наступними малюнками: Фігура 1 - Метаболізм естрадіолу, Фігура 2 - Роль естрагенів у канцерогенезі епітеліальних клітин шийки матки, інфікованих ВПЛ, Фігура 3 - Епігенетична регуляція активності генів. Винахід може бути проілюстровано наступними прикладами: Приклад 1 Склад фармацевтичної композиції у вигляді вагінальних супозиторіїв в мас. %: Дііндолілметан 2,0 Епігаллокатехін-3-галлат 10,0 Полівінілпірролідон 1,2 Бутилгідроксіанізол 0,3 Магній хлористий 2,0 Твердий жир типу А решта. Приклад 2 Склад фармацевтичної композиції у вигляді вагінальних супозиторіїв в мас. %: Дііндолілметан 10,0 Епігаллокатехін-3-галлат 2,0, Полівінілпірролідон 1,0 Бутилгідроксіанізол 0,5 Магній хлористий 0,1 вітепсол решта Приклад 3 Склад фармацевтичної композиції у вигляді вагінальних супозиторіїв в мас. %: Дііндолілметан 3,0 Епігаллокатехін-3-галлат 3,0 Полівінілпірролідон 0,5 бутилгідроксітолуол 0,3 Магній аспарагінат од Основа з кулінарного жиру та парафіну 1:1 решта. 11 95583 Приклад 4 Дослідження клінічної ефективності розробленої фармацевтичної композиції у пацієнток з дисплазією шийки матки. Для клінічних досліджень були відібрані дві групи пацієнток з діагнозом дисплазії шийки матки. 12 В першу групу відбирали пацієнток з легкою (CIN I) та помірною формами дисплазій (CIN ІІ) (таблиця 1), у другу групу - пацієнток з важкою формою дисплазій (CIN III) (таблиця 2). Таблиця 1 Кількість паціПризначення: єнтів з діагноВапнальні суппозизом CIN I-CIN торії, які містять II 10 DIM 10 DIM+EGCG 10 DIM+EGCG+Mg Результати лікування (кількість пацієнтів) Клініка Морфологія ПЦР ДНК ВПЛ Hopма Патологія Норма Патологія Норма Патологія 8 9 10 2 1 0 8 9 10 2 1 0 7 8 10 3 2 0 Таблиця 2 Кількість паціПризначення: єнтів з діагно- Вапнальні суппозизом CIN ІІІ торії, які містять 10 DIM 10 DIM+EGCG 10 DIM+EGCG+Mg Результати лікування (кількість пацієнтів) Клініка Морфологія ПЦР ДНК ВПЛ Норма Патологія Норма Патологія Норма Патологія 2 8 2 8 3 7 9 1 9 1 9 1 10 0 10 0 10 0 Всі діагнози були підтверджені морфологічними дослідженнями. У всіх пацієнток в цервікальньїх зіскобах були виявлені методом ПЦР віруси папіломи людини високого онкогенного ризику типи 16 або 18. Кожна з груп ділилася на три підгрупи, одній з яких призначалося лікування вагінальними супозиторіями, які містять DIM, друга група застосовувала для лікування супозиторії, які містять DIM у комбінації з EGCG, і третя свічки по прикладу 2. Курс лікування продовжувався протягом 14 днів по одній свічці через день. Через місяць після лікування пацієнток обстежили за допомогою кольпоскопії, провели морфологічні дослідження клітин шийки матки та лабораторний аналіз ПЦР на наявність ДНК ВПЛ 16 та 18 типів. Приклад 5. Дослідження клінічної ефективності застосування запропонованої фармацевтичної композиції для лікування пацієнток з діагнозом кондиломи прямої кишки. Для клінічного дослідження були відібрані 20 пацієнтів проктологічного відділення з діагнозом "рецидивуючі кондиломи прямої кишки". Пацієнти пред'являли скарги на болі при акті дефекації, сліди крові у випорожненнях. При візуальному огляді слизової прямої кишки виявлені кондиломи розміром 0.2-0.2 см., слизова запалена. У деяких хворих виявлені тріщини анального отвору. Пацієнтам призначена монотерапія ректальними супозиторіями по прикладу 1, по 1 свічці ранком та вечором протягом 14 днів. Після проведеного курсу лікування у 16 пацієнтів настало повне клінічне одужання, яке супроводжувалося зникненням кондилом та усіх ознак запального процесу. У 4 пацієнтів після проведеного лікування спостерігалося зменшення кількості кондилом і відсутність ознак запалення. 13 95583 14 15 Комп’ютерна верстка Т. Чепелева 95583 Підписне 16 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition for treatment of displastic processes of uterine cervix
Автори англійськоюKiselev, Vsevolod Ivanovich, Kisieliov Vsevolod Ivanovych
Назва патенту російськоюКомпозиция для лечения диспластических процессов шейки матки
Автори російськоюКиселев Всеволод Иванович
МПК / Мітки
МПК: A61K 31/405, A61K 31/353, A61P 31/12, A61P 35/00, A61K 33/06, A61K 9/02, A61P 15/00
Мітки: композиція, лікування, процесів, шийки, матки, диспластичних
Код посилання
<a href="https://ua.patents.su/8-95583-kompoziciya-dlya-likuvannya-displastichnikh-procesiv-shijjki-matki.html" target="_blank" rel="follow" title="База патентів України">Композиція для лікування диспластичних процесів шийки матки</a>
Попередній патент: Розширення utran для підтримання заглушення міжстільникових перешкод
Наступний патент: Спосіб виявлення джерел інфрачервоного випромінювання
Випадковий патент: Спосіб виробництва столового напівсухого червоного вина "таїровський корал"