Ліганд, корисний для лікування захворювань, пов’язаних з msrv
Номер патенту: 105495
Опубліковано: 26.05.2014
Автори: Бертранд Жан-Баптіст, Бернард Корінне, Перрон Ерве, Ланг Алоіс Бернхарт
Формула / Реферат
1. Ліганд, який містить кожну з ділянок, які визначають комплементарність (CDR),
викладених у SEQ ID NО. 1, SEQ ID NО. 2, SEQ ID NО. 3, SEQ ID NО. 4, SEQ ID NО. 5 й SEQ ID NО. 6, або ліганд визначає антиліганд, представлений послідовностями SEQ ID NО. 32 або SEQ ID NО. 20.
2. Ліганд, який містить;
- варіабельну ділянку легкого ланцюга (VL), що має амінокислотну послідовність, викладену в SEQ ID NО. 7, і
- варіабельну ділянку важкого ланцюга (VH), що має амінокислотну послідовність, викладену в SEQ ID NО. 8,
де ліганд визначає антиліганд, представлений послідовностями SEQ ID NО. 32 або SEQ ID NО. 20.
3. ScFV-фрагмент, який містить ліганд згідно з будь-яким із пп. 1, 2.
4. Fab-фрагмент, який містить ліганд згідно з будь-яким із пп. 1, 2.
5. Антитіло, яке містить ліганд згідно з будь-яким із пп. 1, 2.
6. Антитіло згідно з п. 5, яке відрізняється тим, що є химерним, сконструйованим або гуманізованим антитілом.
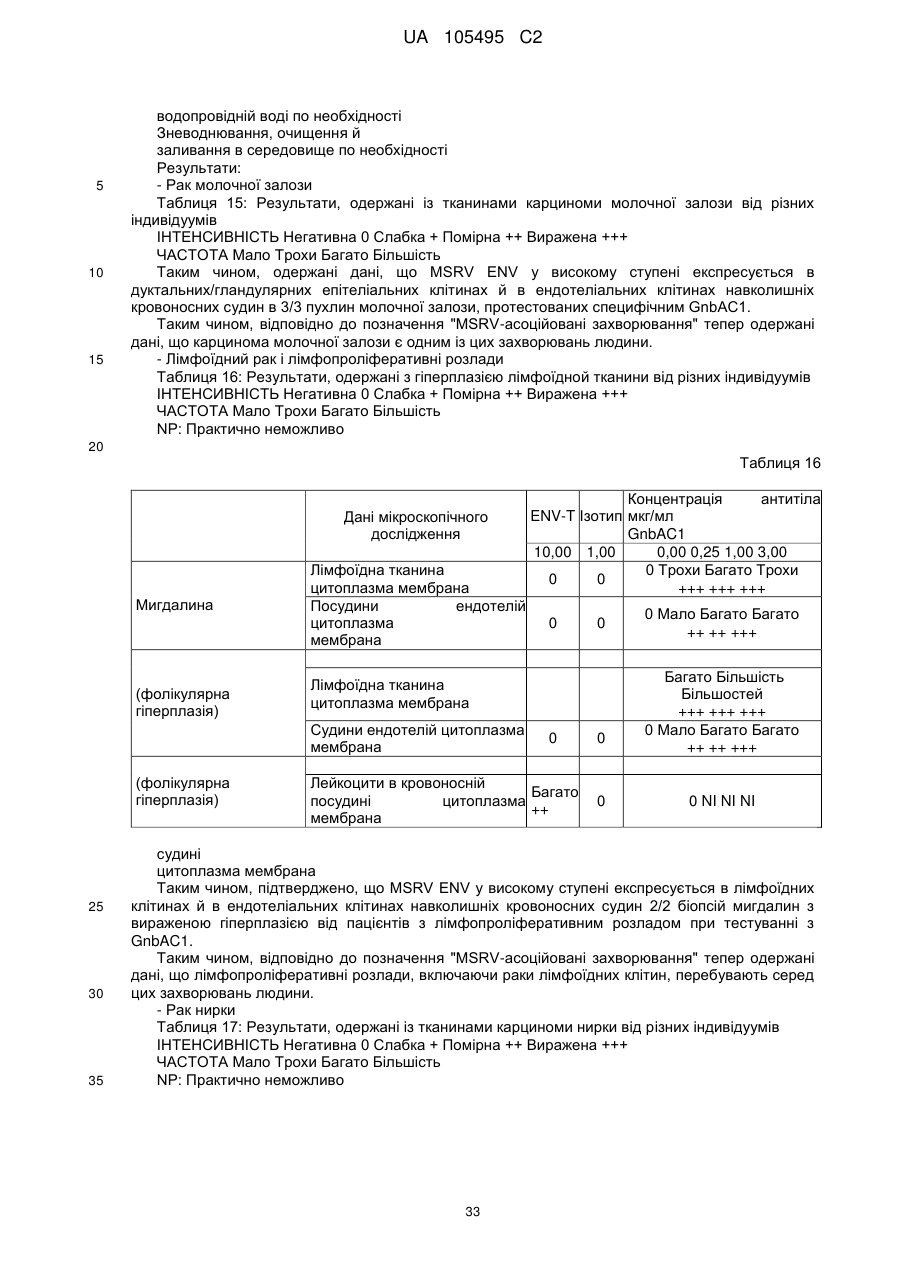
7. Антитіло згідно з п. 5 або 6, яке є IgG.
8. Антитіло згідно з п. 7, яке є IgGI або lgG4 людини.
9. Фармацевтична композиція, яка містить як активний інгредієнт ліганд згідно з будь-яким із пп. 1-2, scFV-фрагмент згідно з п. 3, Fab-фрагмент згідно з п. 4 або антитіло згідно з будь-яким із пп. 5-8.
10. Ліганд, який містить кожну з ділянок, які визначають комплементарність (CDR), що кодується
- SEQ ID NО. 13b, SEQ ID NО. 14, SEQ ID NО. 15, SEQ ID NО. 16, SEQ ID NО. 17, SEQ ID No. 18, або
- SEQ ID NО. 13, SEQ ID NО. 14, SEQ ID NО. 15, SEQ ID NО. 16. SEQ ID NО. 17, SEQ ID NО. 18,
де ліганд визначає антиліганд, представлений послідовностями SEQ ID NО. 32 або SEQ ID NО. 20.
11. Ліганд, який містить:
- варіабельну ділянку легкого ланцюга (VL), що кодується SEQ ID NО. 10 або 12 і
- варіабельну ділянку важкого ланцюга (VH), що кодується SEQ ID NО. 9 або 11,
де ліганд визначає антиліганд, представлений послідовностями SEQ ID NО. 32 або SEQ ID NО. 20.
12. Спосіб лікування, який включає введення ліганду згідно з будь-яким із пп. 1, 2, scFV-фрагмента згідно з п. 3, Fab-фрагмента згідно з п. 4 або антитіла згідно з будь-яким із пп. 5-8, або фармацевтично прийнятної форми ліганду згідно з будь-яким із пп. 1, 2, scFV-фрагмента згідно з п. 3, Fab-фрагмента згідно з п. 4 або антитіла згідно з будь-яким із пп. 5-8, або фармацевтичної композиції згідно з п. 9.
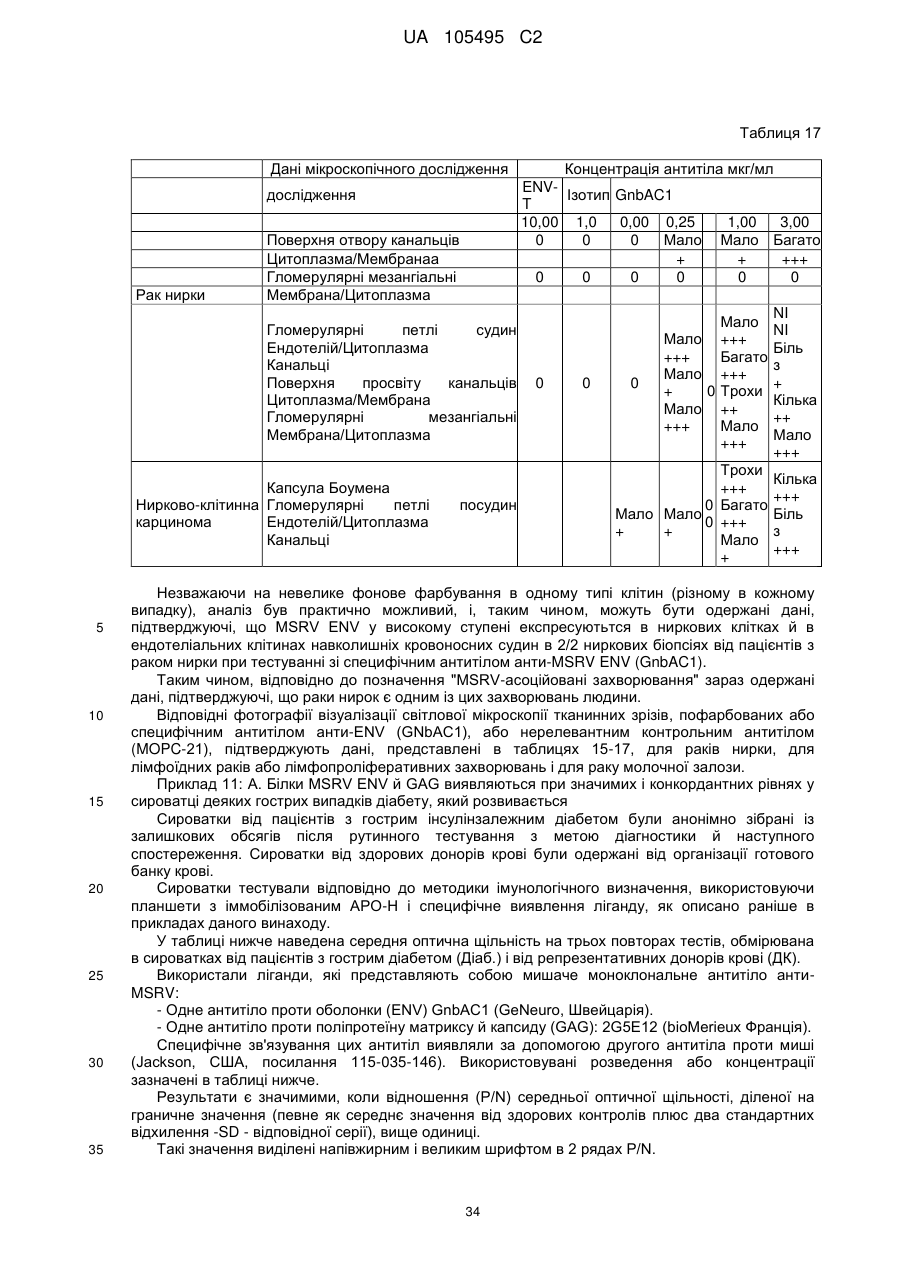
13. Спосіб лікування згідно з п. 12, для лікування захворювання, пов'язаного з MSRV (ретровірус, пов'язаний з розсіяним склерозом), вибраного з групи, яка включає розсіяний склероз, шизофренію, клінічно ізольований синдром, хронічну запальну демієлінізуючу поліневропатію, епілепсію, псоріаз, рак, запальний панкреатит і діабет, зокрема діабет типу І.
14. Спосіб лікування захворювань, пов'язаних з MSRV, згідно з будь-яким з пп. 12 або 13, який включає введення антитіла IgG4 або IgGI згідно з п. 8 як хронічного лікування регулярно повторюваними ін'єкціями.
15. Спосіб визначення антиліганду в біологічному зразку із застосуванням ліганду згідно з будь-яким з пп. 1, 2, ScFV-фрагмента згідно з п. 3, Fab-фрагмента згідно з п. 4 або антитіла згідно з будь-яким з пп. 5-8, який включає стадії:
(а) приведення в контакт зразка з лігандом згідно з будь-яким з пп. 1, 2, ScFV-фрагментом згідно з п. 3, Fab-фрагментом згідно з п. 4 або антитілом згідно з будь-яким з пп. 5-8,
(б) визначення присутності антиліганду в зразку.
16. Спосіб визначення антиліганду згідно з п. 14, який додатково включає стадію:
(в) приведення в контакт зразка з лігандом, який специфічно зв'язується з GAG-антигеном.
17. Набір для імунологічного аналізу для визначення антиліганду в біологічному зразку, який містить ліганд згідно з будь-яким з пп. 1, 2, ScFv фрагмент згідно з п. 3, Fab-фрагмент згідно з п. 4 або антитіло згідно з будь-яким з пп. 5-8 і реагенти для визначення специфічного зв'язування антиліганду з вищевказаним лігандом, scFv, Fab-фрагментом або антитілом.
18. Набір для імунологічного аналізу для визначення антиліганду, згідно з п. 15, у біологічному зразку, який додатково включає ліганд, який специфічно зв'язується з GAG-антигеном.
19. Застосування набору для імунологічного аналізу, згідно з п. 15 або 16, при визначенні захворювання, пов'язаного з MSRV, вибраного із групи, яка включає розсіяний склероз, шизофренію, клінічно ізольований синдром, хронічну запальну демієлінізуючу поліневропатію, епілепсію, псоріаз, рак, запальний панкреатит та діабет, зокрема діабет типу І.
Текст
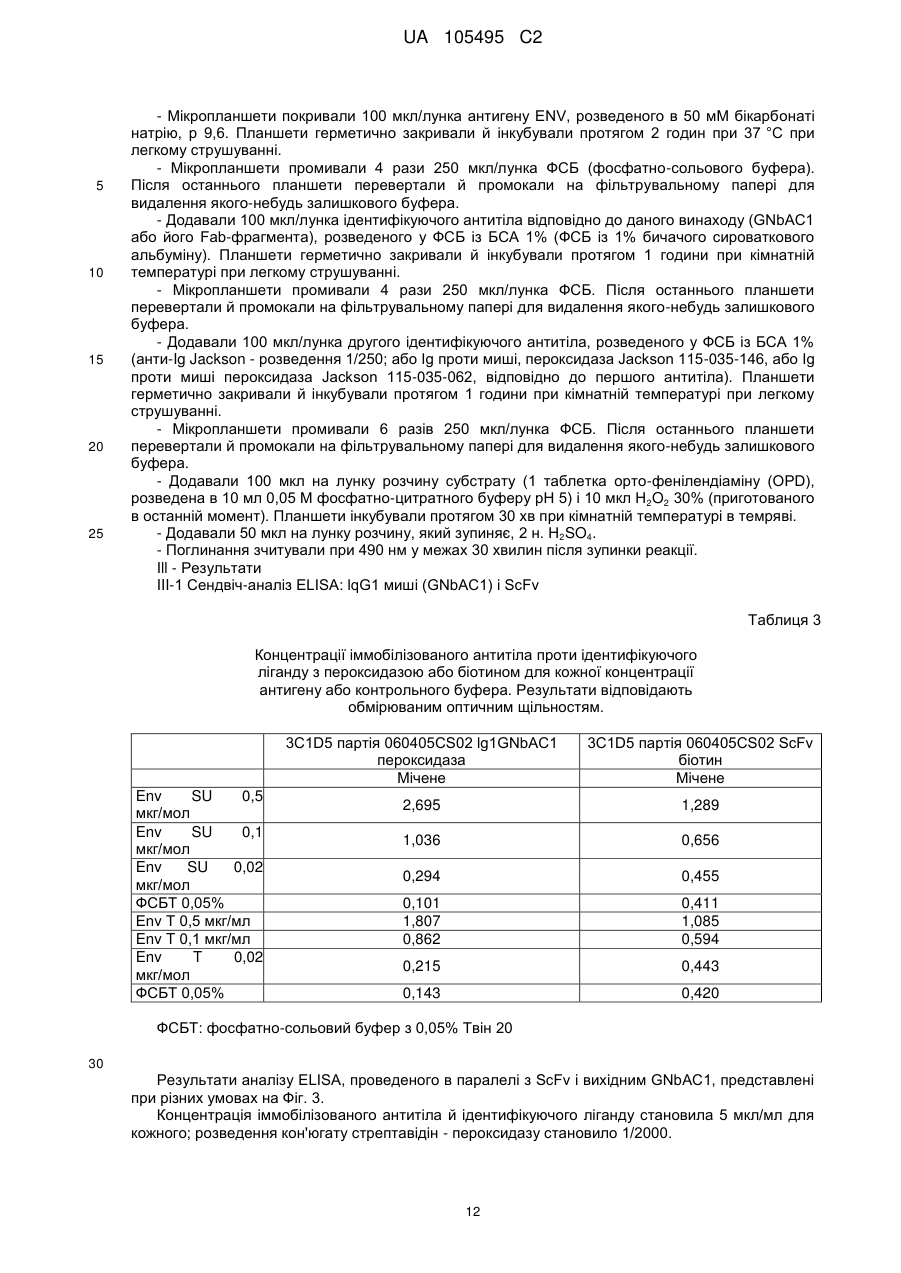
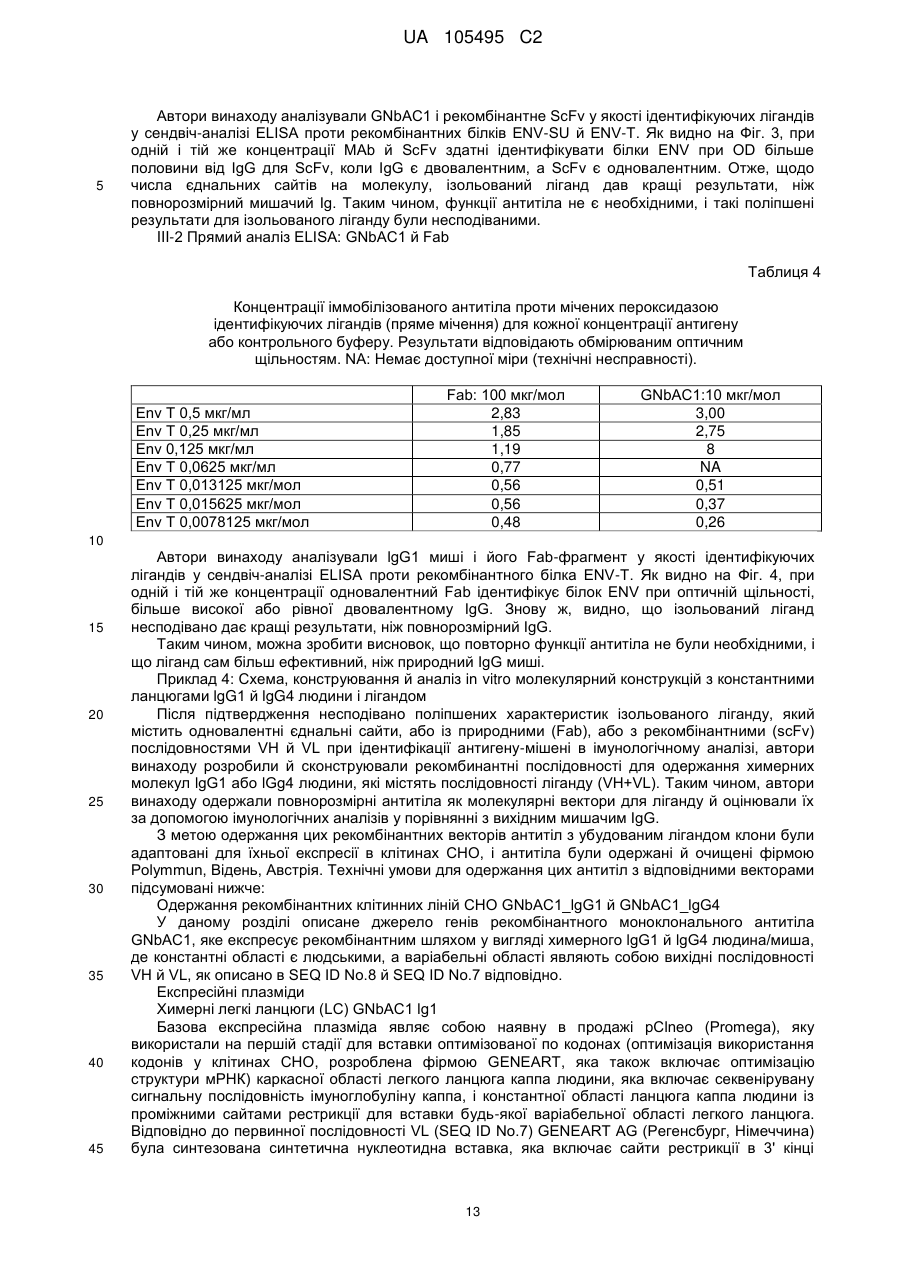
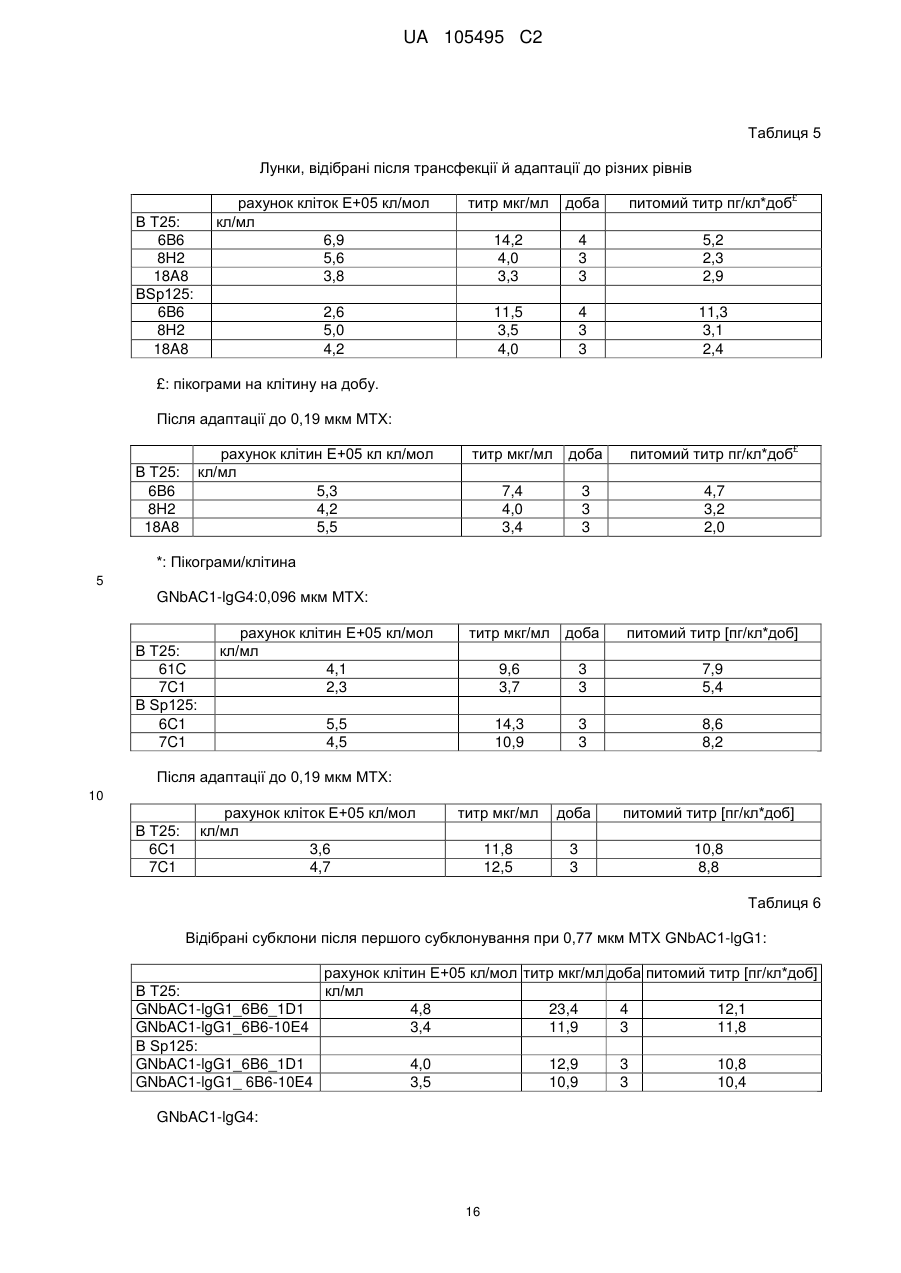
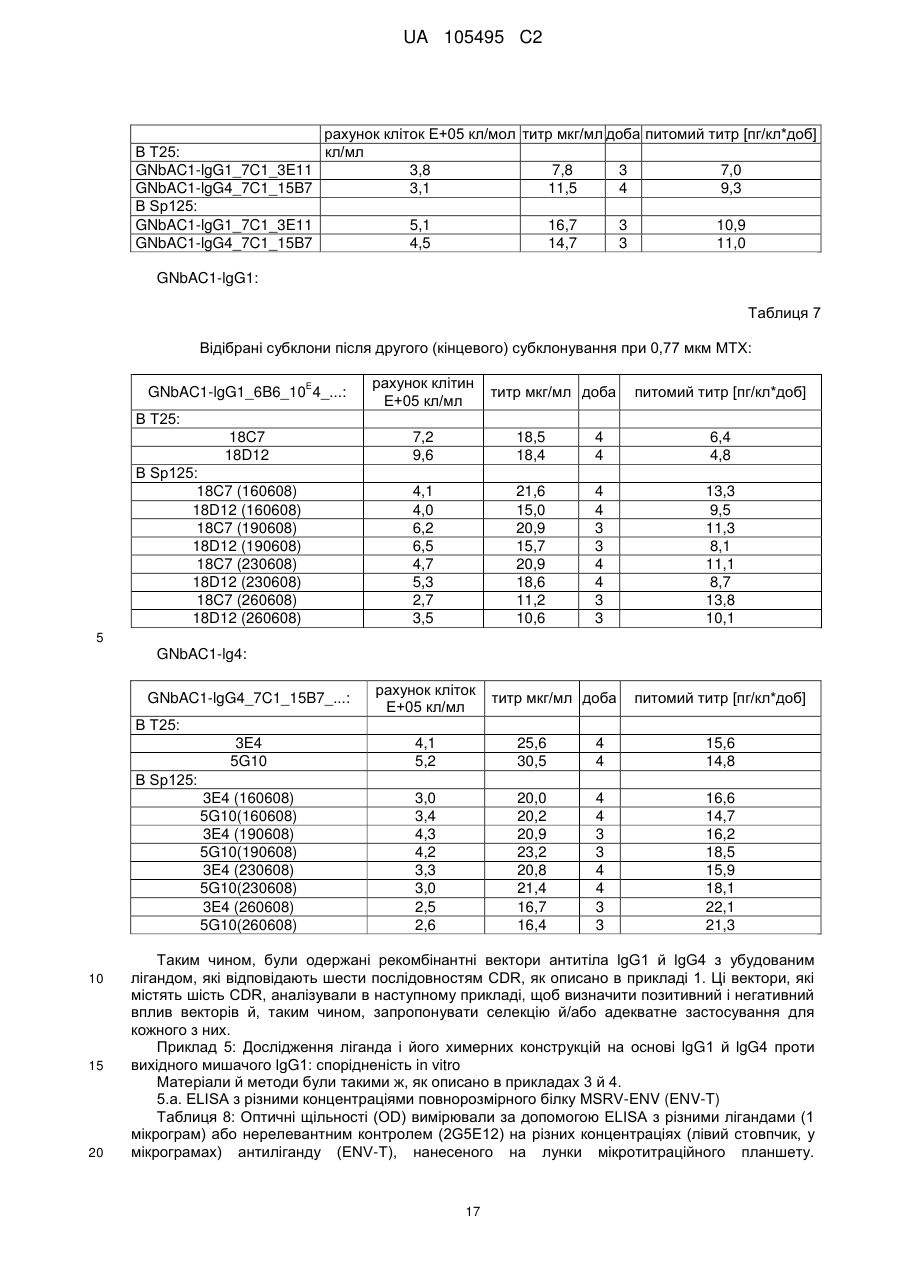
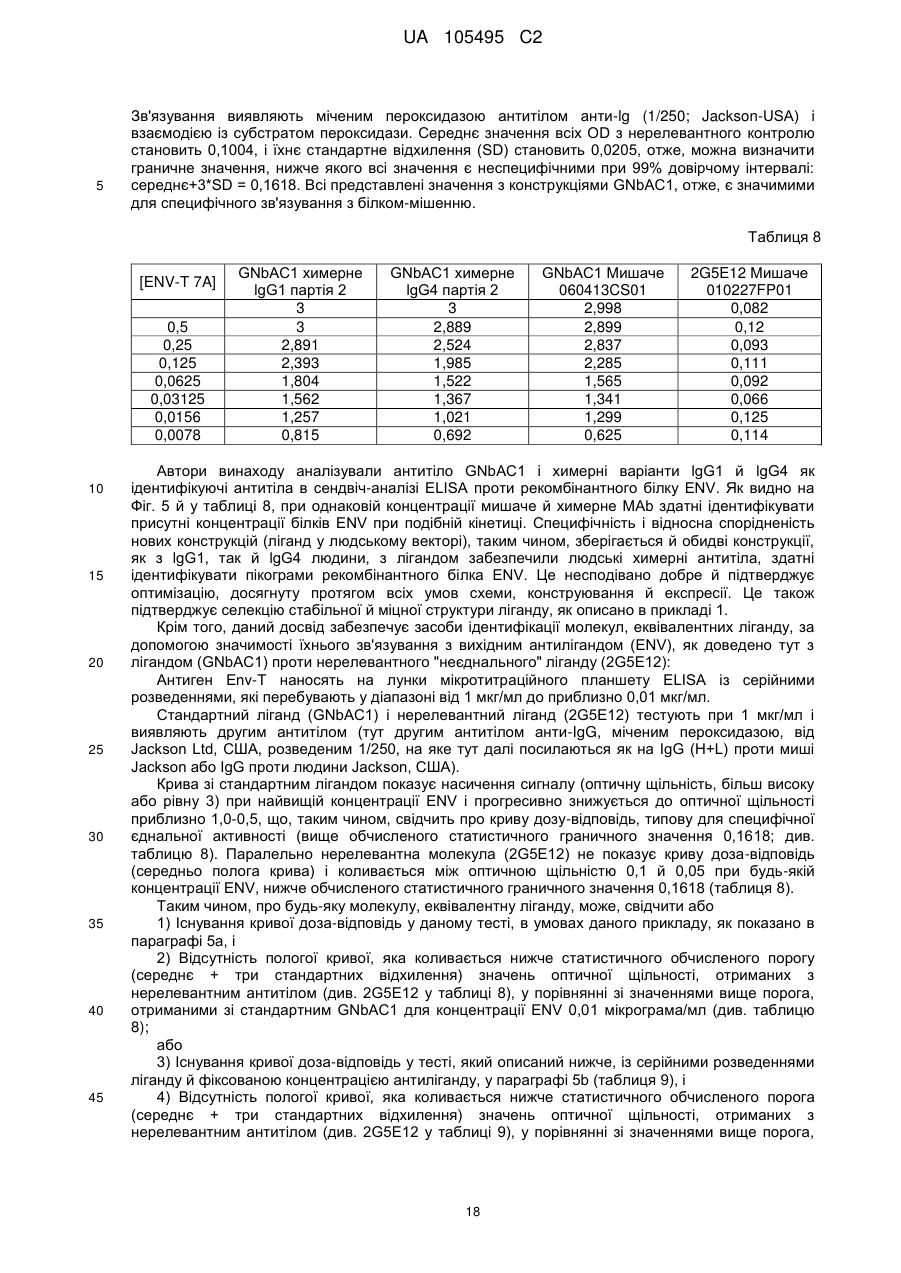
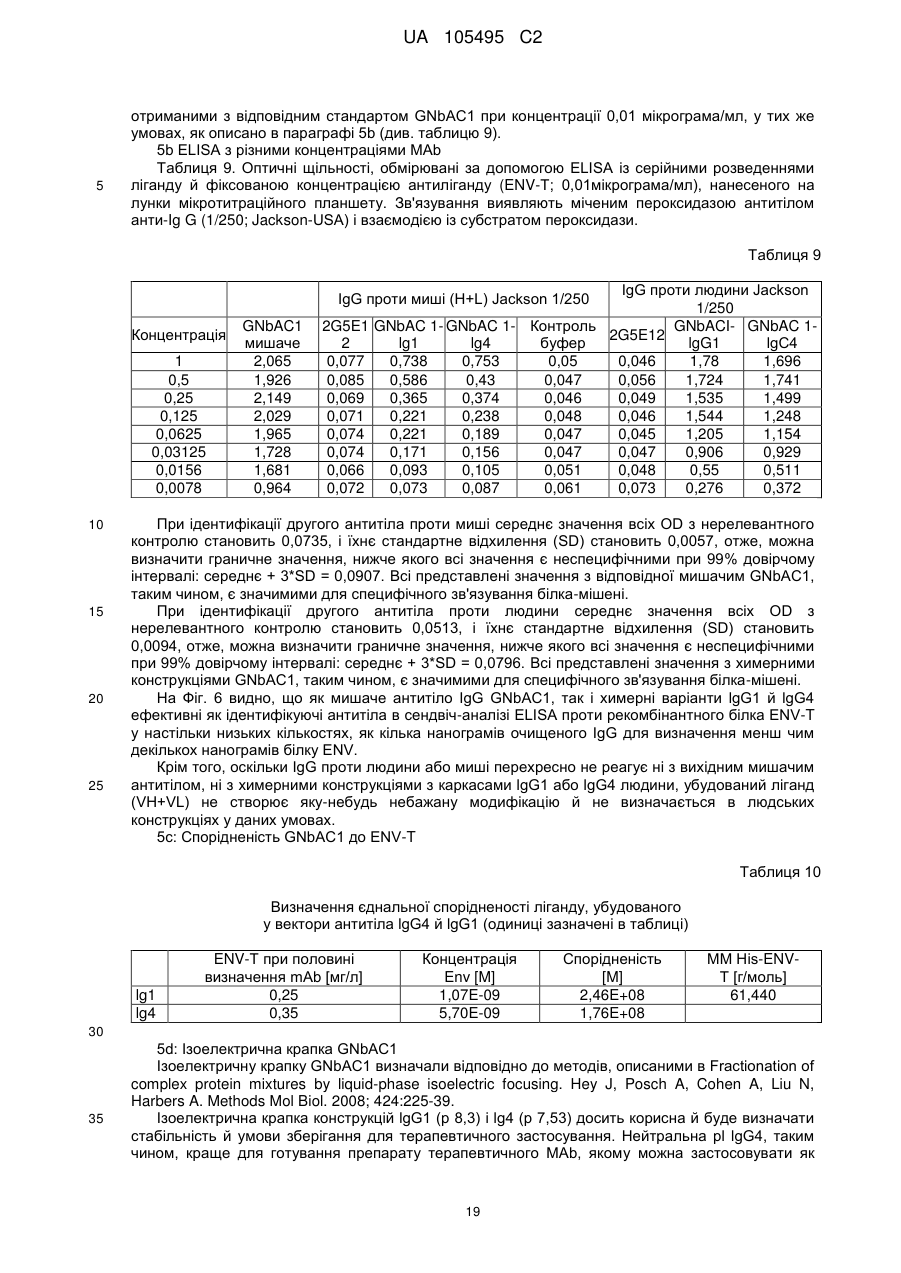
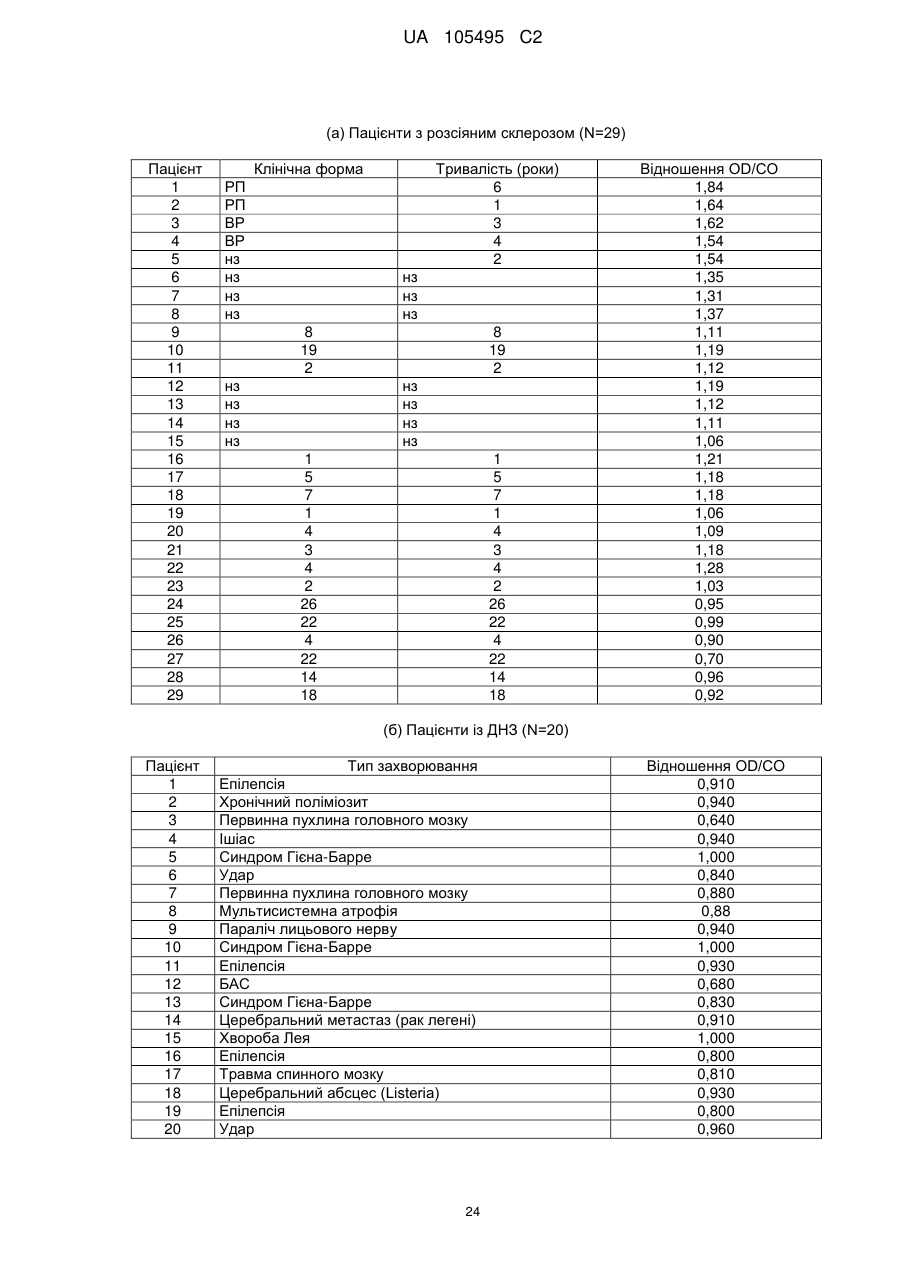
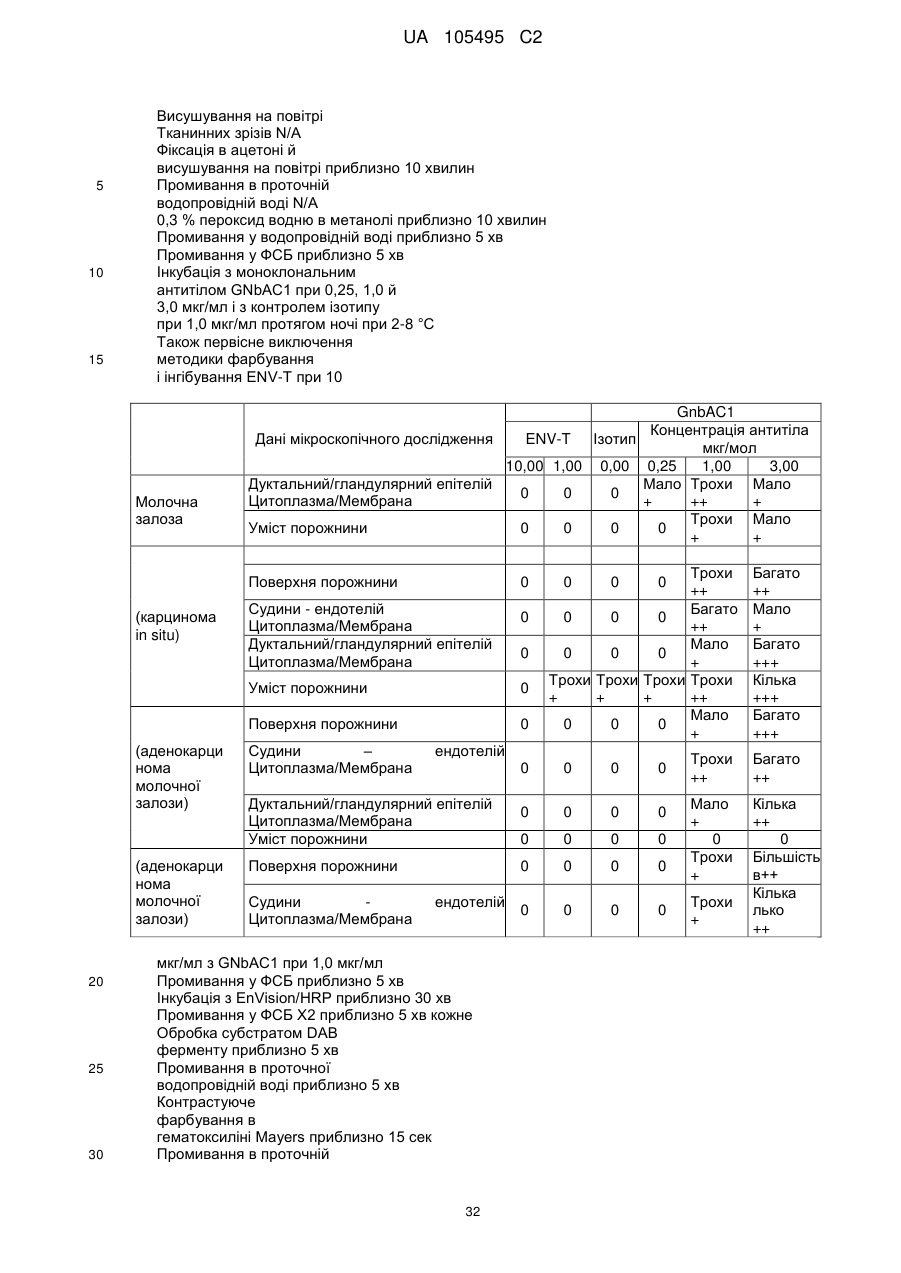
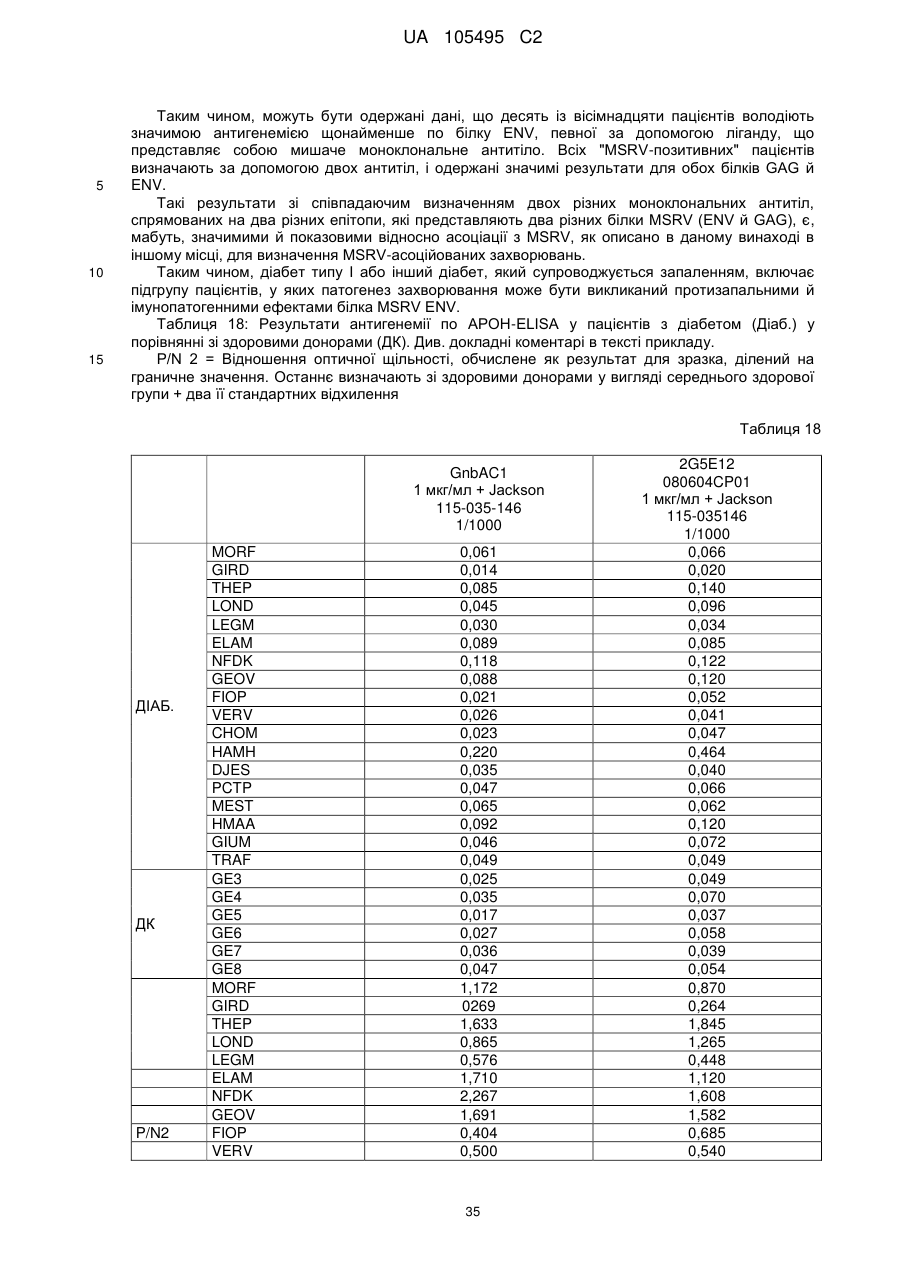
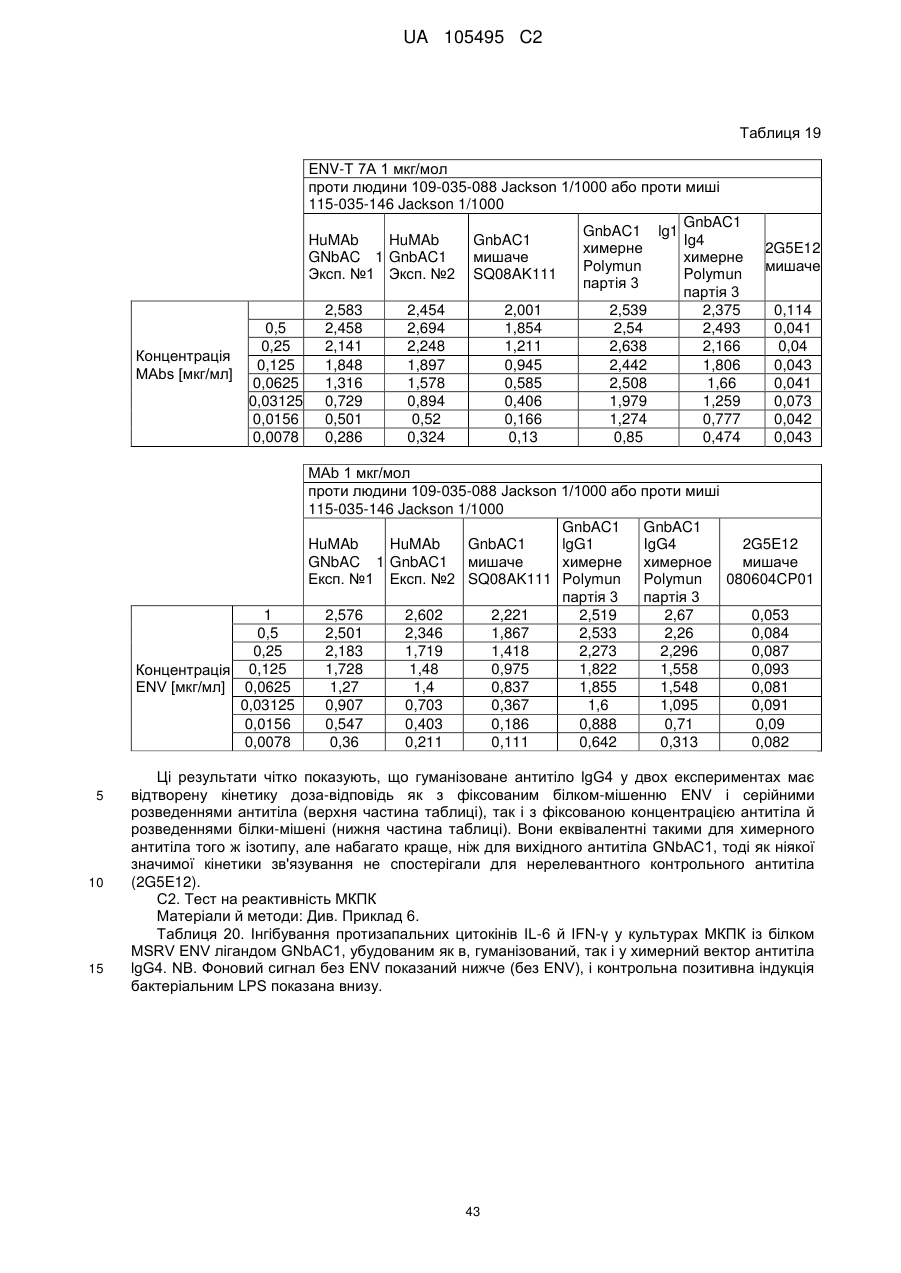
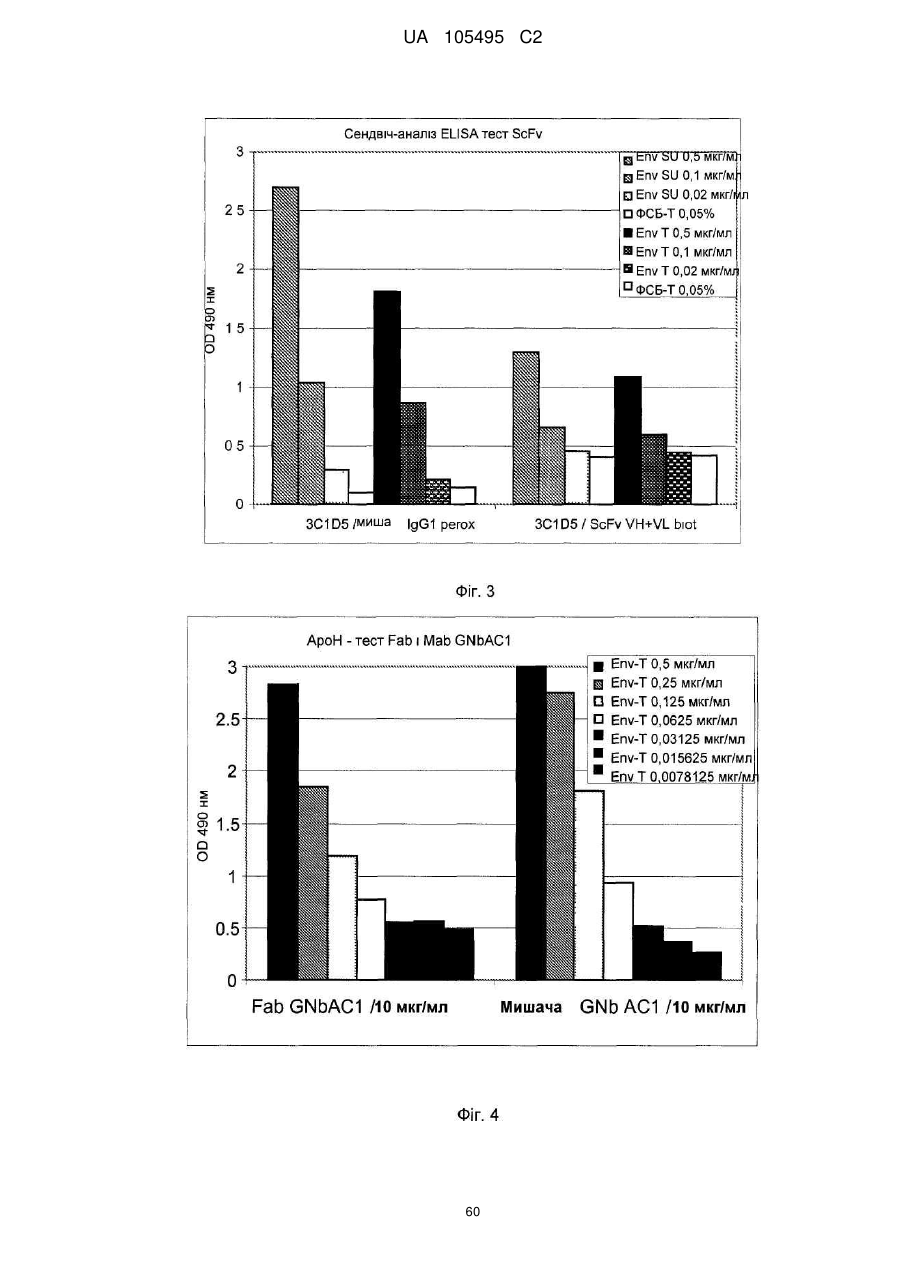
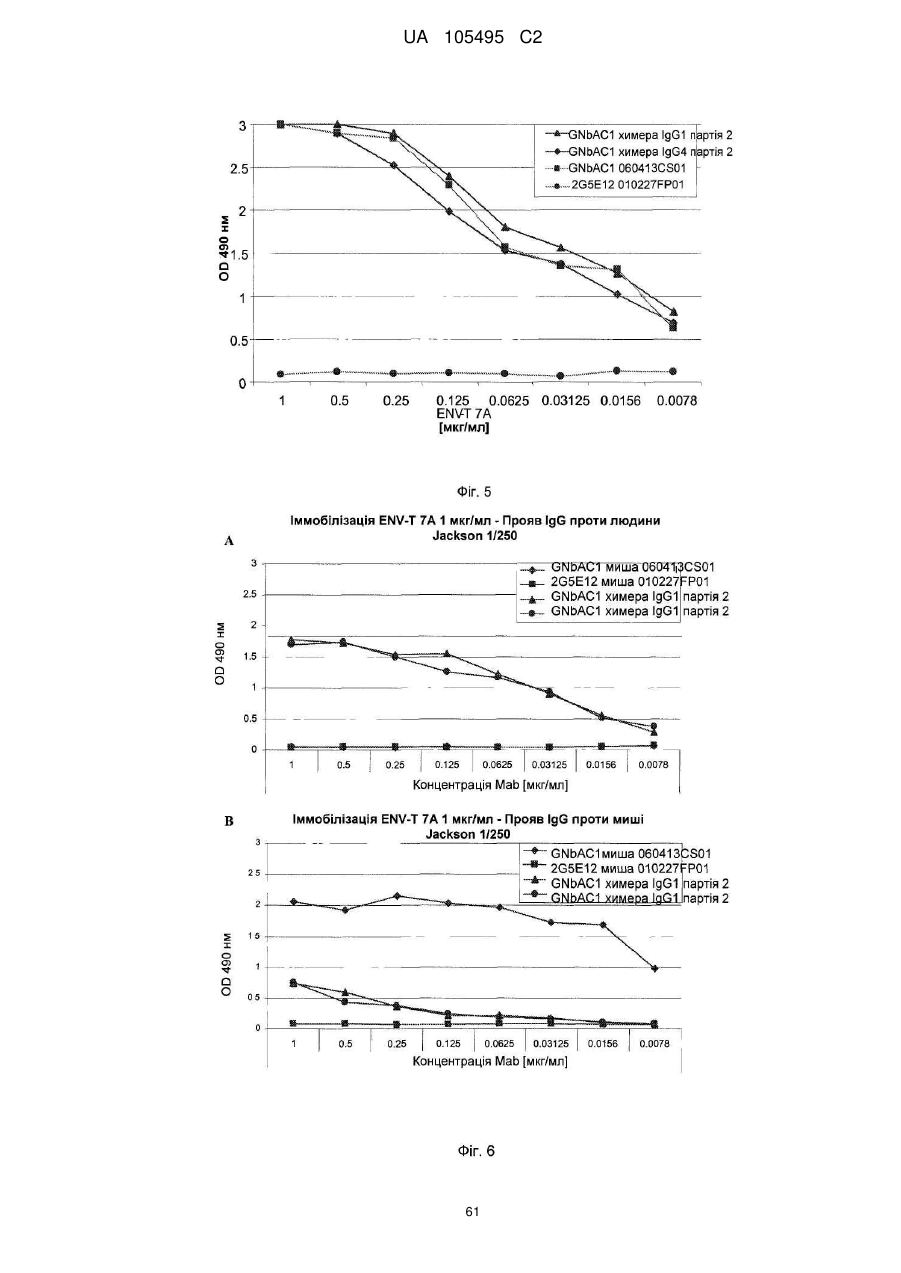
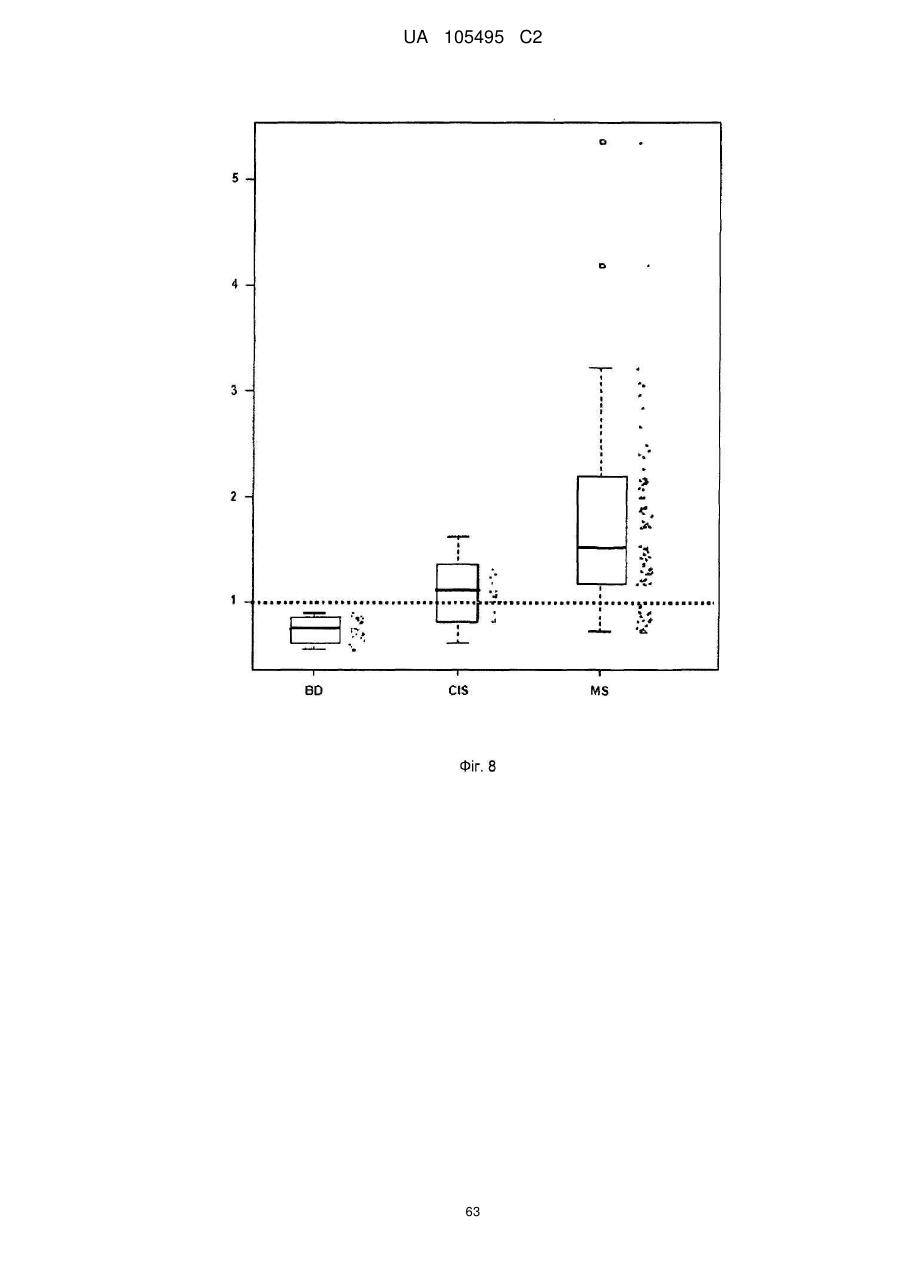
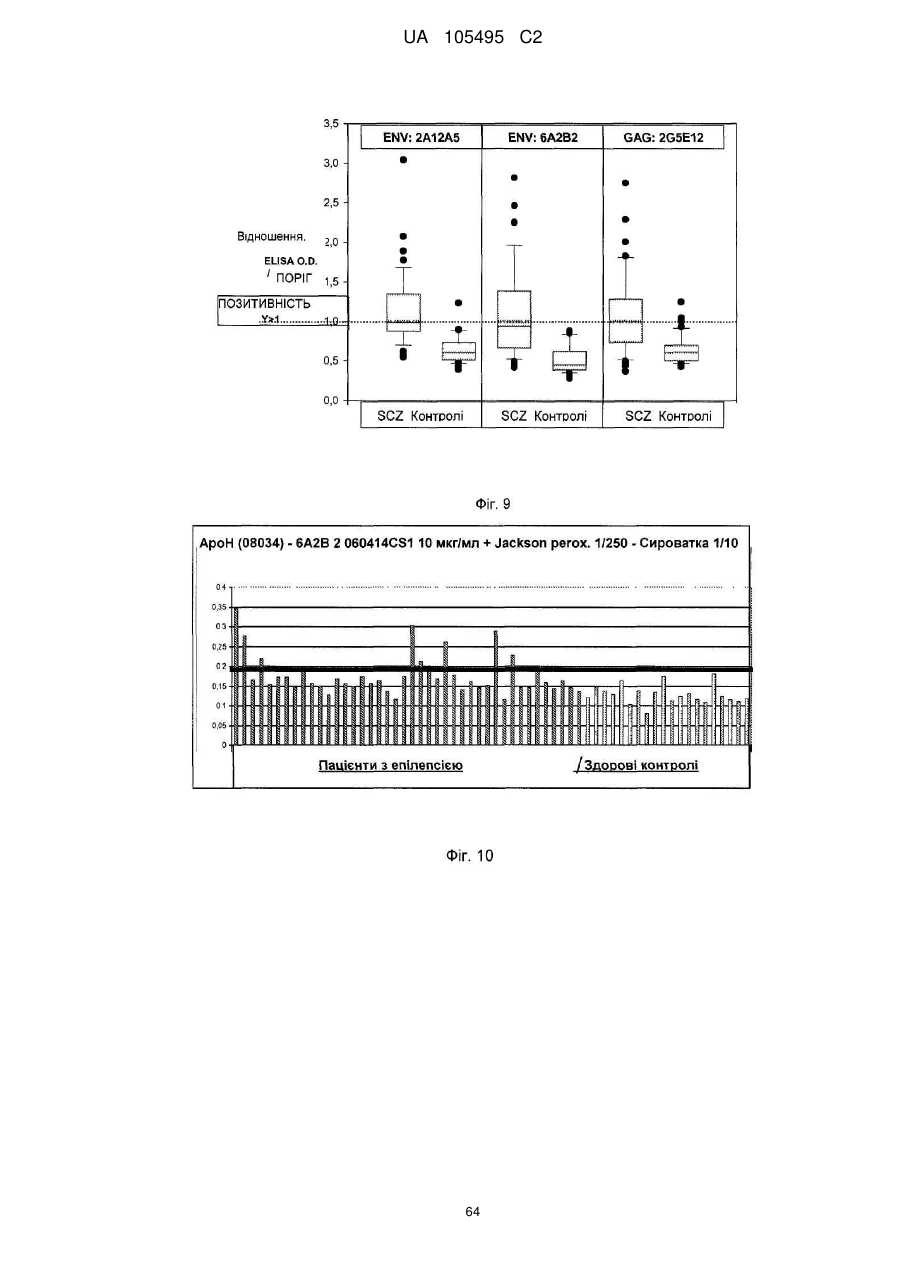
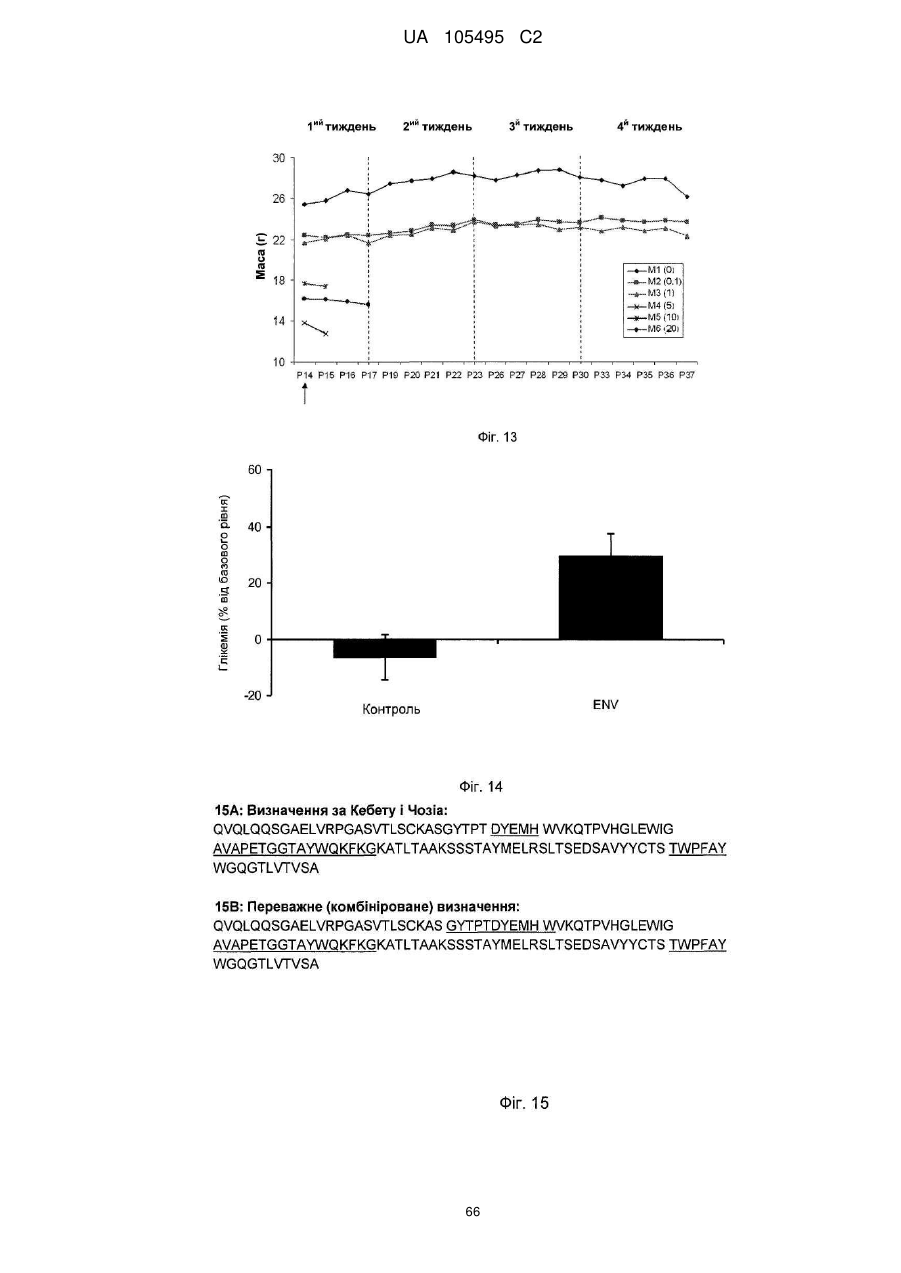
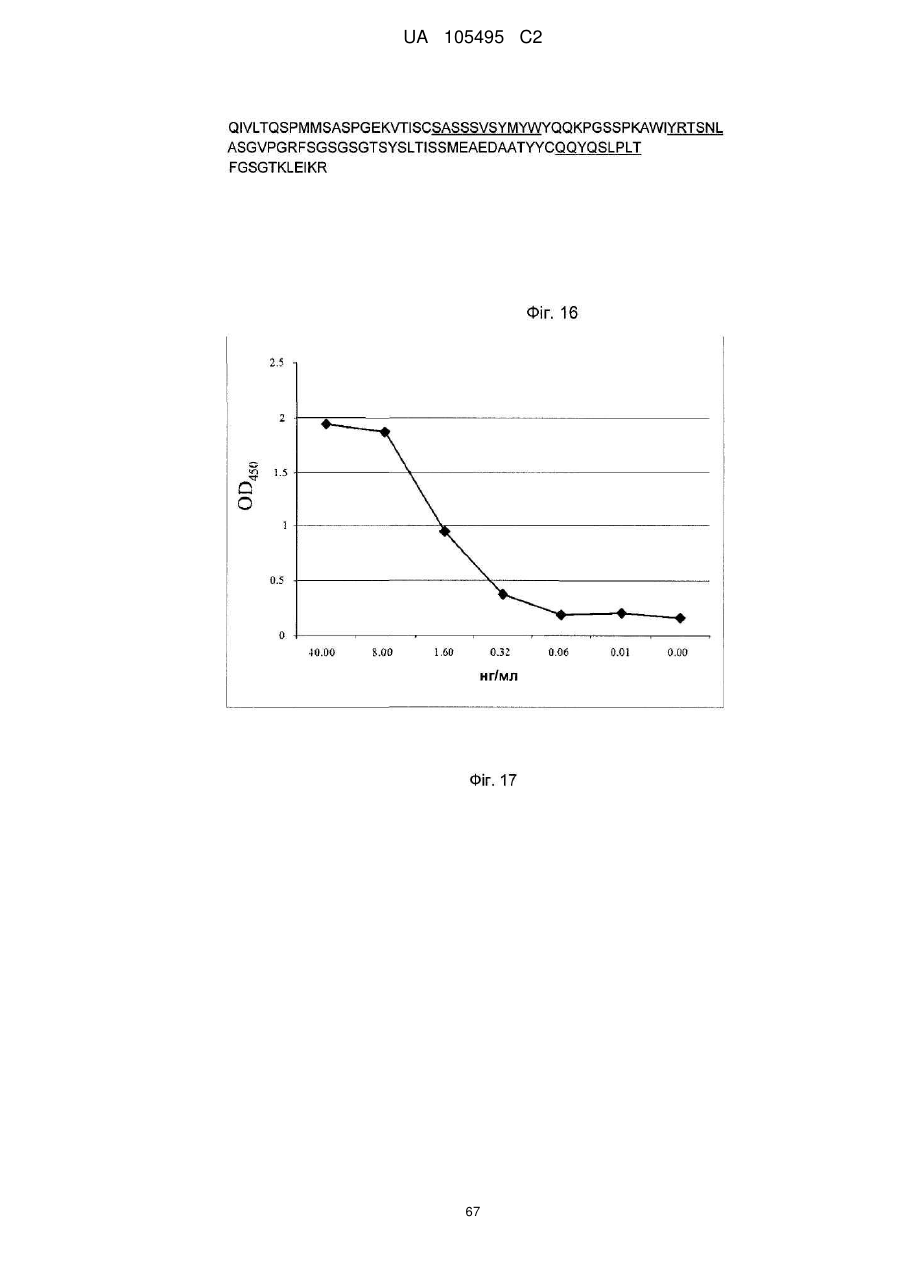
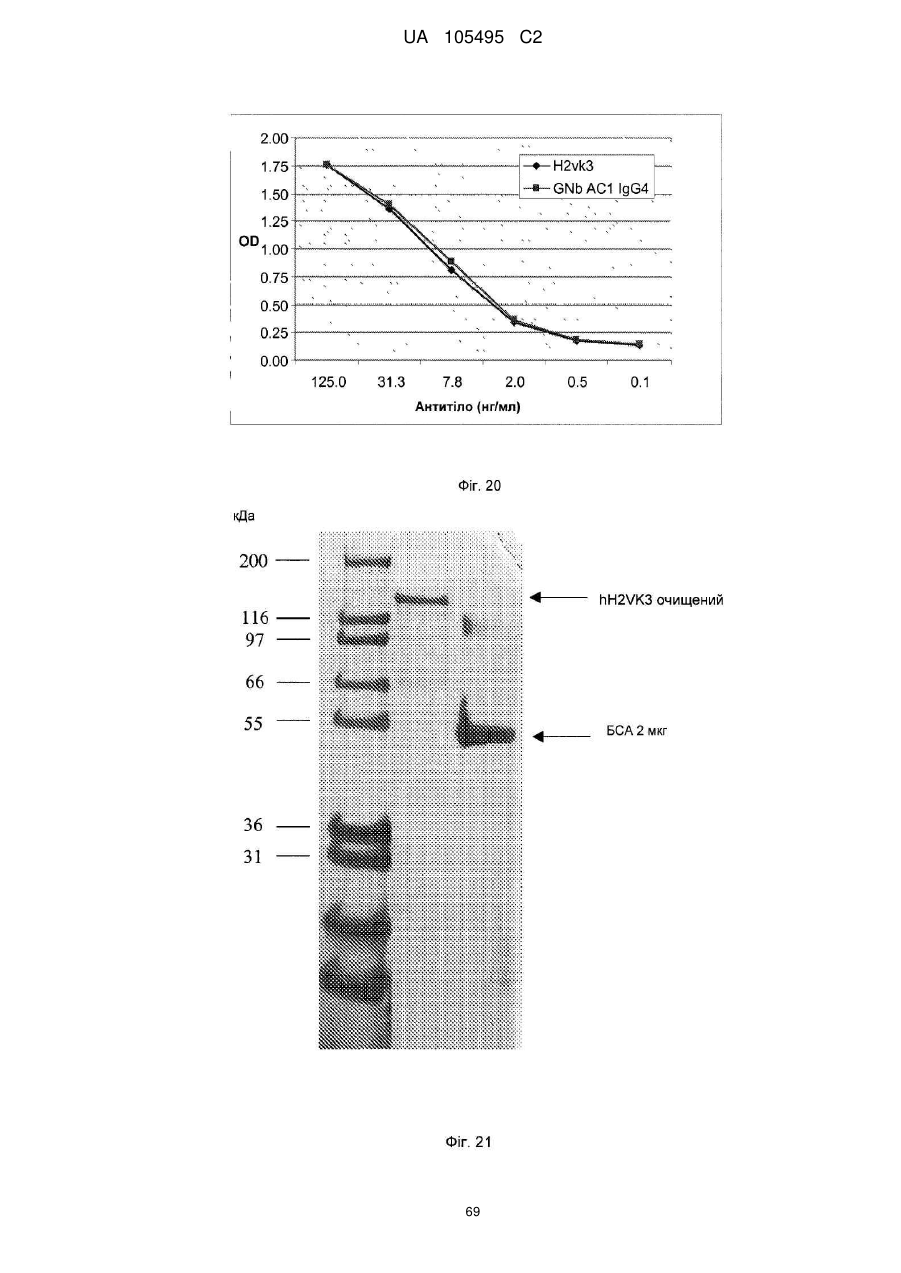
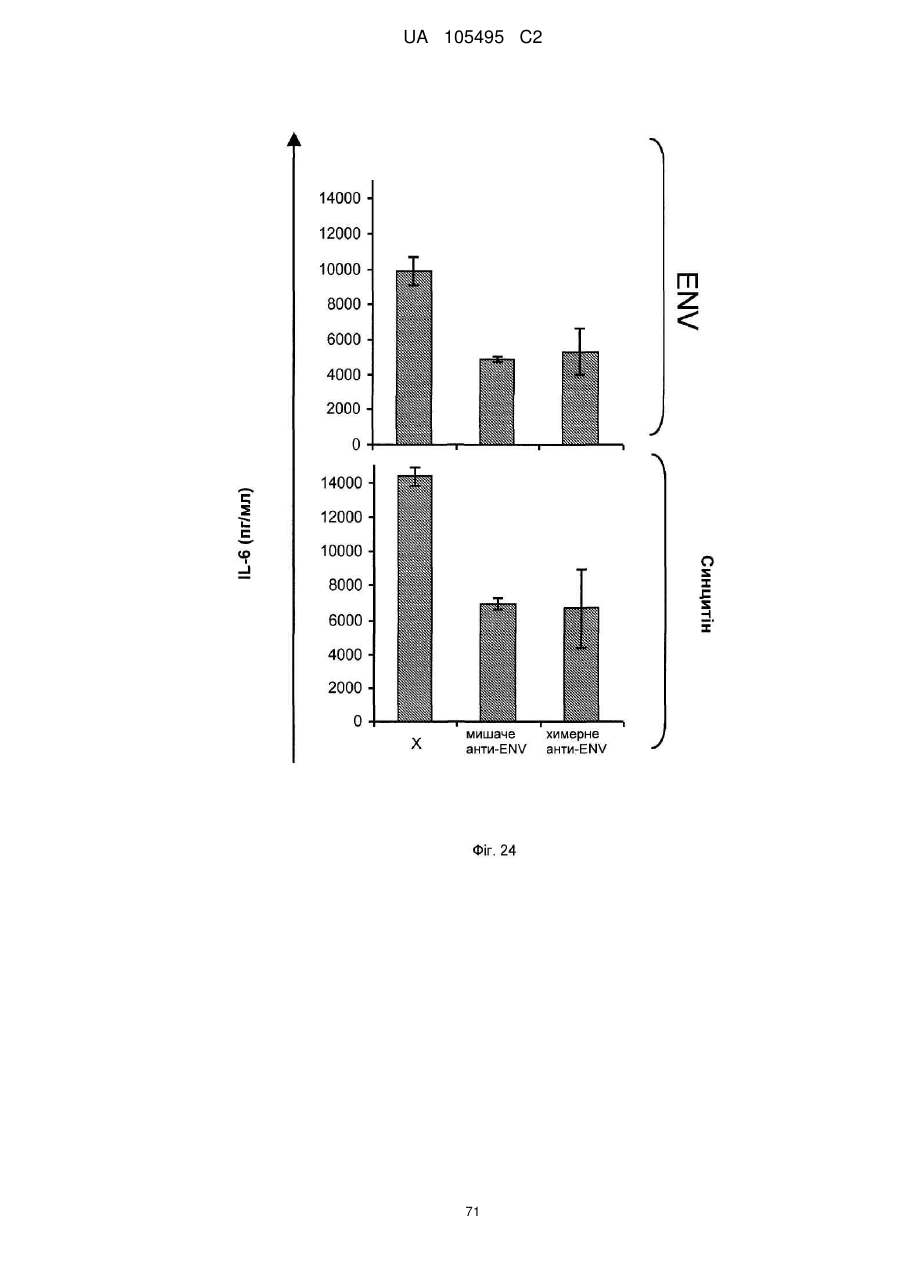
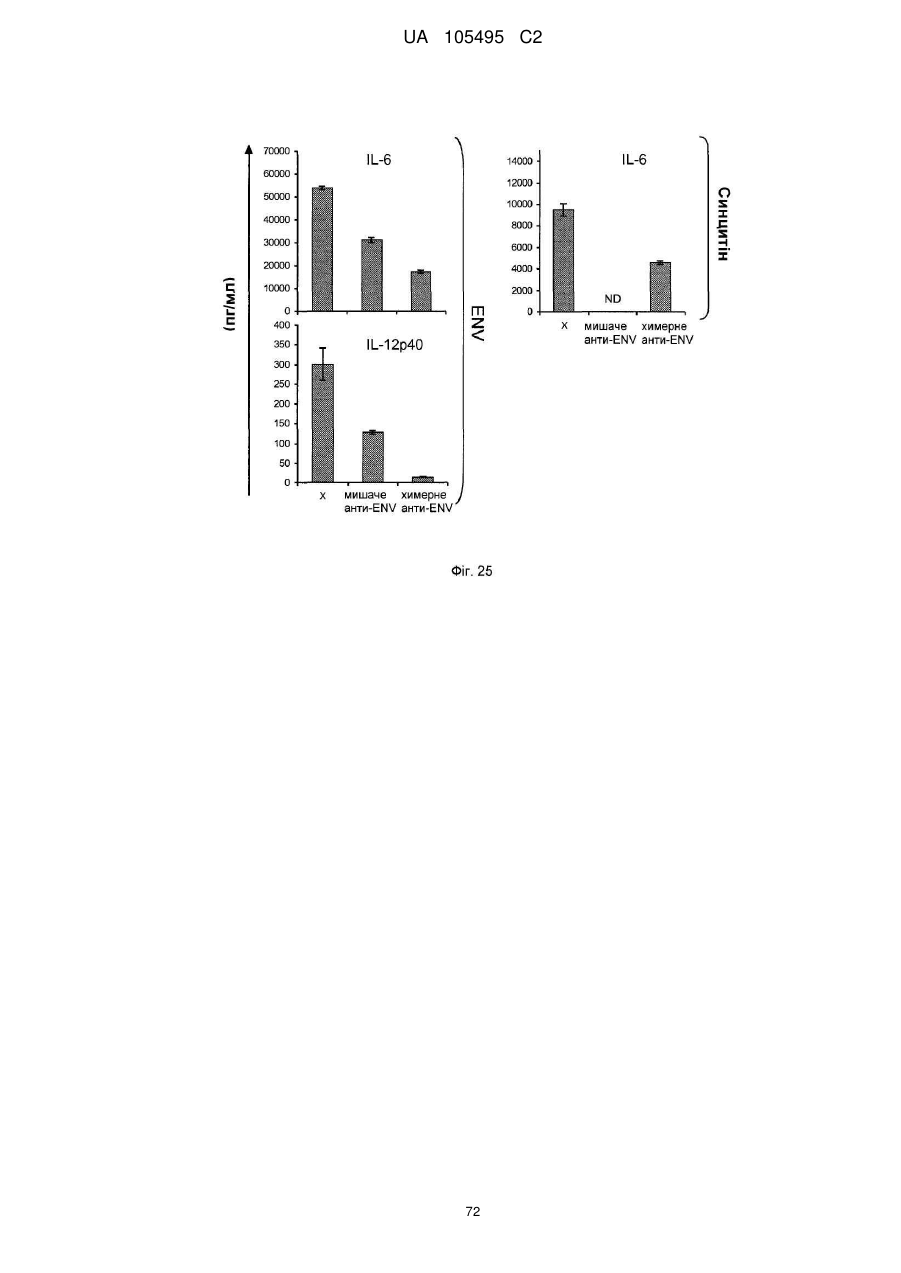
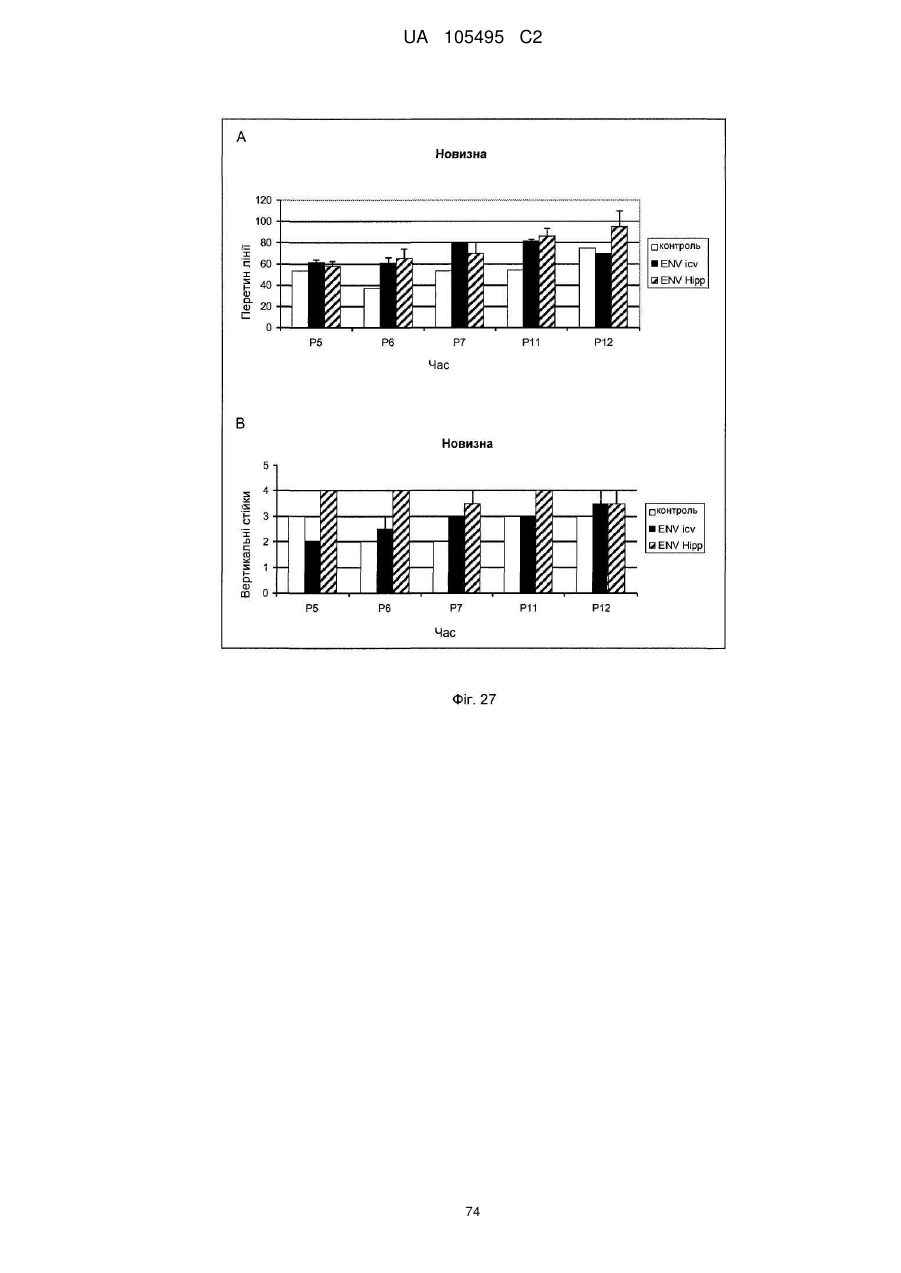
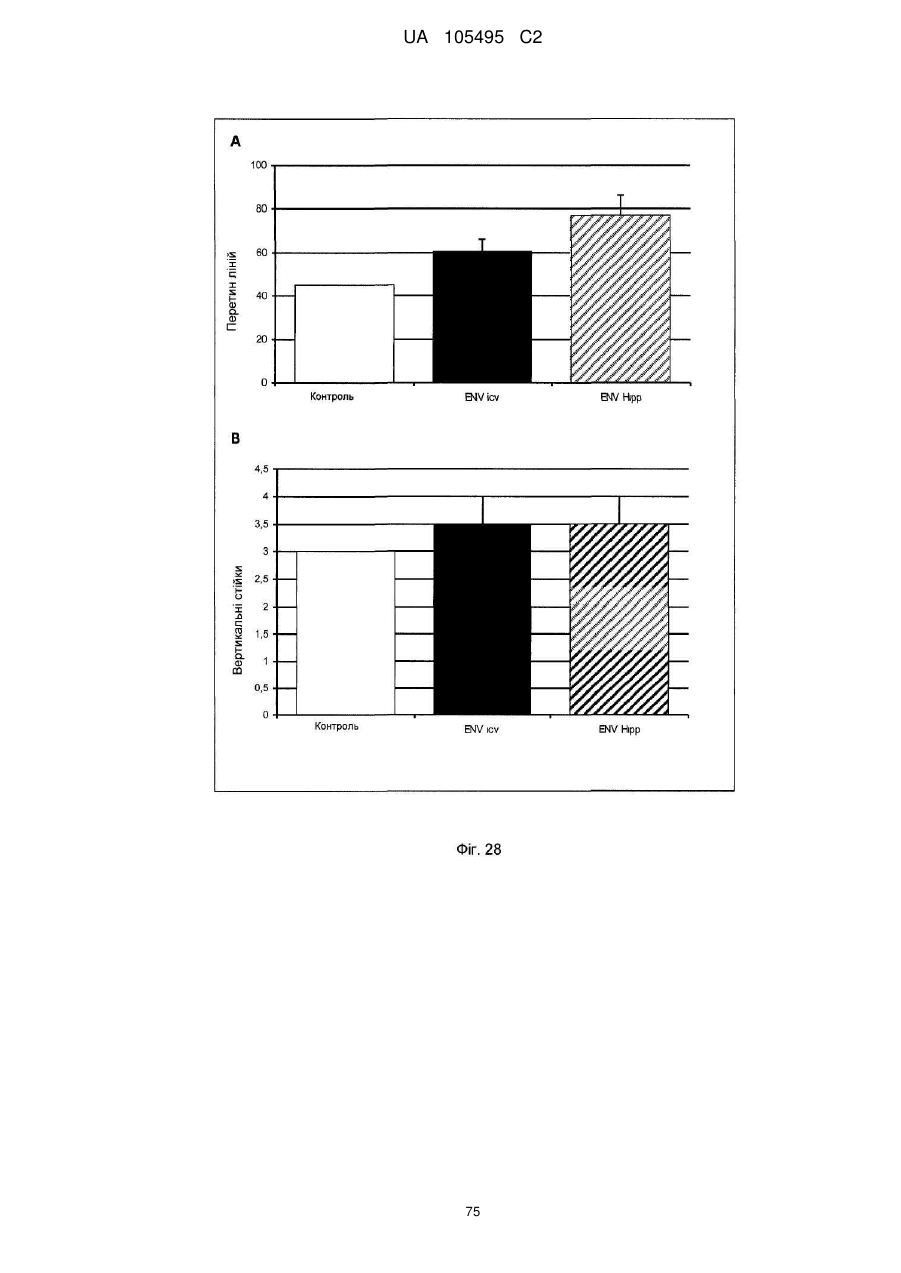
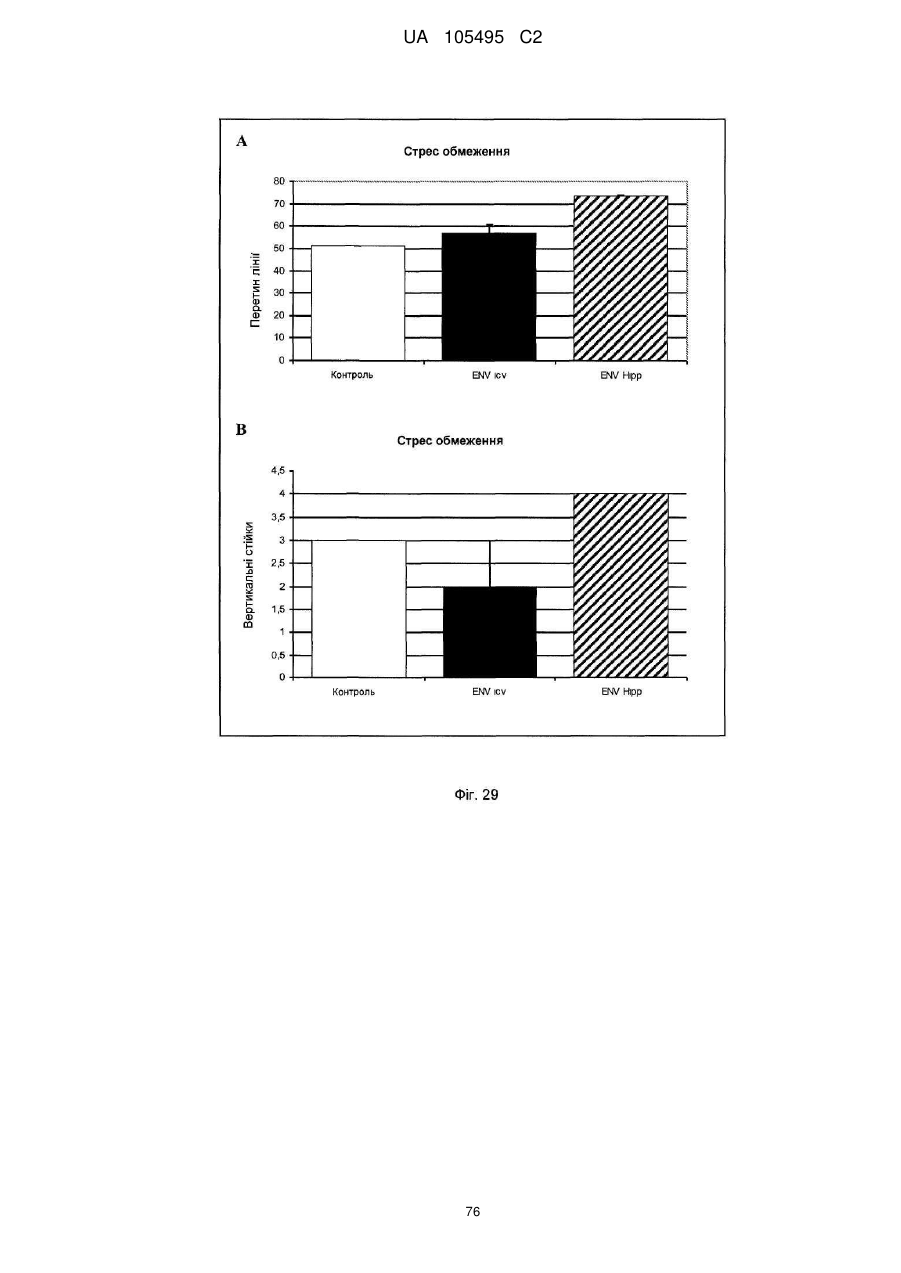
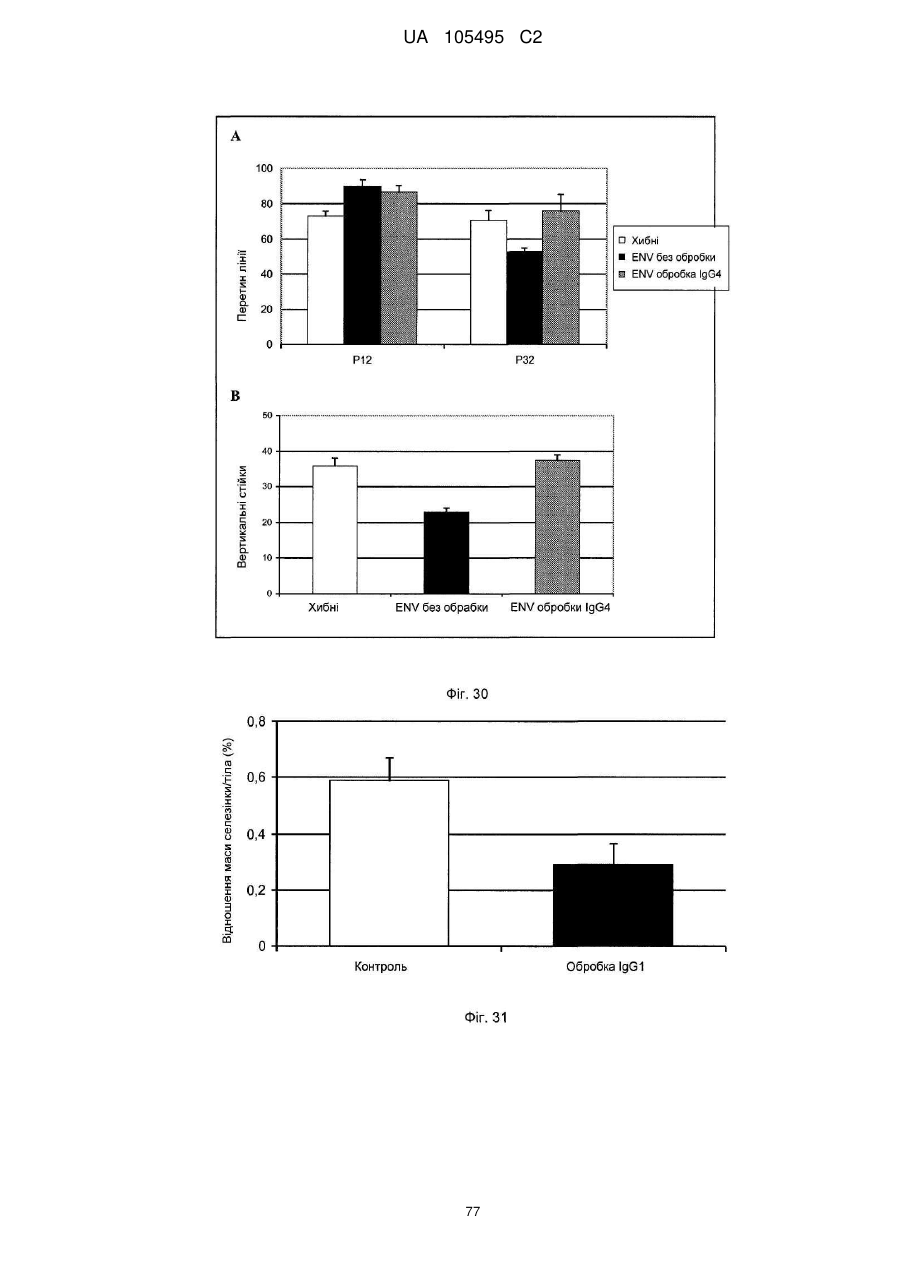
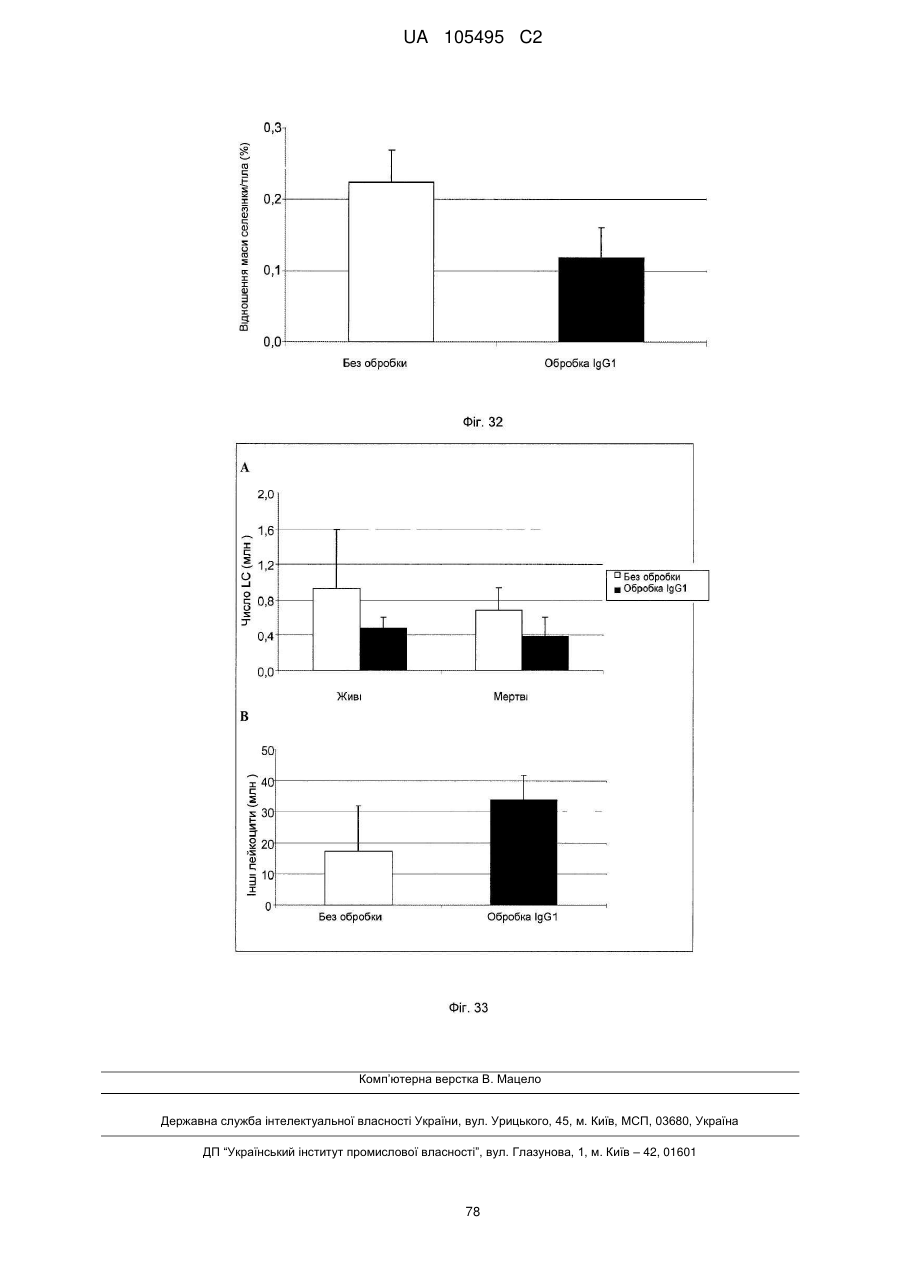
Реферат: UA 105495 C2 (12) UA 105495 C2 Даний винахід належить до ліганду, що містить кожну з ділянок, які визначають комплементарність (CDR), представлених SEQ ID NО: 1, SEQ ID NО: 2, SEQ ID NО: 3, SEQ ID NО: 4, SEQ ID NО: 5 і SEQ ID NО: 6, для лікування захворювань, пов′язаних з MSRV. UA 105495 C2 5 10 15 20 25 30 35 40 45 50 55 Об'єктом даного винаходу є ліганд, який у значній мірі зв’язується з молекулою-мішенню, антилігандом. Згідно з даним винаходом "антилігандом" є білок MSRV-ENV (оболонковий), MSRV означає "ретровірус пов'язаний з розсіяним склерозом (РС)" (Perron, et al. (1997). "Molecular identification of а novel retrovirus repeatedly isolated from patients with multiple sclerosis. The Collaborative Research Group on Multiple Sclerosis". Proc Natl Acad Sci USA 94(14): 7583-8). Термін "білок MSRV-ENV" слід розуміти як повнорозмірний або частковий білковий продукт, який кодується генами MSRV env, як визначено в Komurian-Pradel, F, et al. (1999). Virology 260(1): 1-9, і Rolland A, et al. (2006) J Immunol 176(12): 7636-44, або будь-яку молекулу, яка імітує антигенні або зв'язуючі властивості MRSV-ENV (мімотоп). “ENV-T” відповідає повнорозмірному білку, який докладно описаний в прикладі 2 (залишки 1-542), а “ENV-SU”, також відомий під назвою ENV-1, відповідає послідовності S30-K316, як показано в прикладі 2. ENV-SU також згадується в статті Rolland A, et al. (2006) J Immunol 176(12): 7636-44. Зазвичай для ретровірусів, MSRV проявляє варіабельність в оболонковому білку -ENV- (Perron, H. et al. (2000) J Neurovirol 6: S67-75; Voisset, C. O. Bouton et al. (2000) AIDS Res Hum Retroviruses 16(8): 731-40). Показано, що мімотопи, які імітують часткові білкові фрагменти MSRV ENV, існують і вибірково зв'язуються антитілами пацієнтів з розсіяним склерозом (Jolivet-Reynaud, C, H. Perron, et al. (1999). "Specificities of multiple sclerosis cerebrospinal fluid and serum antibodies against mimotopes". Clin Immunol 93(3): 283-93). Конкретніше, ліганд згідно з даним винаходом містить кожну з ділянок, які визначають компліментарність (CDR), мають амінокислотні послідовності SEQ ID No. 1, SEQ ID No. 2, SEQ ID No. 3, SEQ ID No. 4, SEQ ID No. 5 і SEQ ID No. 6 або будь-яку послідовність, яка має: - зазначену далі кількість заміщених амінокислот в межах вказаних послідовностей, і відомих як доцільні для одержання функціонально еквівалентних амінокислотних послідовностей (Huang 1986; Zabin, Horvath et al. 1991; Edgar and Schwartz 1992; Sardana, Emini etal. 1992; Xu, Kapferetal. 1992; Lamande and Bateman 1993; Verdoliva, Ruvo et al. 1995; Yu, Schurr et al. 1995; Wehrmann, Van Vliet et al. 1996; Ullmann, Hauswald et al. 1997; Minuth, Kramer et al. 1998; Ullmann, Hauswald et al. 2000; Janke, Martin et al. 2003): від 0 до 3 в CDR1 (SEQ ID No. 1), від 0 до 2 в CDR2 (SEQ ID No. 2), від 0 до 2 в CDR3 (SEQ ID No. 3), від 0 до 1 в CDR4 (SEQ ID No. 4), від 0 до 4 в CDR5 (SEQ ID No. 5), від 0 до 2 в CDR6 (SEQ ID No. 6), або - амінокислоти, заміщені іншими амінокислотами, які мають еквівалентні хімічні функції і властивості, добре відомі фахівцям в даній області (так званою "амінокислотною подібністю"), як вказано, наприклад, в приведеному нижче переліку подібних амінокислот (однолітерний код): G або A, F або Y, D або E, N або Q, K або R або H, S або T, C або M, V або L або I, W або P, і/або заміщені відомим з попереднього рівня техніки чином (Huang 1986; Zabin, Horvath et al. 1991; Edgar and Schwartz 1992; Sardana, Emini et al. 1992; Xu, Kapfer et al. 1992; Lamande and Bateman 1993; Verdoliva, Ruvo et al. 1995; Yu, Schurr et al. 1995; Wehrmann, Van Vliet et al. 1996; Ullmann, Hauswald et al. 1997; Minuth, Kramer et al. 1998; Ullmann, Hauswald et al. 2000; Janke, Martin et al. 2003) в межах вказаних послідовностей SEQ ID No.1 - SEQ ID No. 6. Ці варіанти є результатом делецій, додавань або замін амінокислот в пептидах SEQ ID No. 1 - 6 і, також охоплені даним винаходом, і можуть бути одержані способами, відомими в даній галузі техніки, такими як, наприклад, шляхом сайт-спрямованого мутагенезу або шляхом хімічного синтезу. Ліганди згідно з даним винаходом мають здатність зв'язуватися з антилігандом згідно з даним винаходом. Відповідно до даного винаходу під виразом "зв'язує" або "зв'язуючий" слід розуміти, що ліганд у значній мірі розпізнає антиліганд відповідно до критеріїв, приведених в прикладі 5. У іншому аспекті винаходу вказаний ліганд включає варіабельну ділянку легкого ланцюга (VL), який містить ділянки, які визначають компліментарність (CDR), мають амінокислотні послідовності SEQ ID No. 1, SEQ ID No. 2 і SEQ ID No. 3 або будь-яку послідовність, яка щонайменше на 80% ідентична і, переважніше на 90% ідентична вказаним послідовностям, і варіабельну ділянку домена важкого ланцюга (VH), CDR, які мають амінокислотні послідовності SEQ ID No. 4, SEQ ID No. 5 і SEQ ID No. 6 або будь-яку послідовність, яка щонайменше на 80% ідентична і, переважно на 90% ідентична вказаним послідовностям. У наступному аспекті ліганд згідно з даним винаходом включає варіабельну ділянку легкого ланцюга (VL), яка має амінокислотні послідовності, викладену в SEQ ID No. 7, або будь-яку послідовність, яка щонайменше на 75% ідентична і, переважніше на 80% і ще переважніше на 90% ідентична вказаній послідовності, і варіабельну ділянку важкого ланцюга (VH), який має амінокислотну послідовність, представлену в SEQ ID No. 8, або будь-яку послідовність, яка 1 UA 105495 C2 5 10 15 2025 30 35 40 45 50 55 щонайменше на 75% ідентична і, переважніше на 80% і, ще переважніше на 90% ідентична вказаній послідовності. Варіанти цих послідовностей VH і VL відповідно до даного винаходу у значній мірі зв'язуються з антилігандом. "Ідентичність послідовності" означає, наприклад, що в послідовності, яка на 80% ідентична послідовності, 80% ідентичних амінокислот знаходяться в тому ж положенні при порівнянні послідовностей, що можна здійснювати відомими в даній галузі техніки способами, такими як описані в Sequence - Evolution - Function Computational Approaches in Comparative genomics. Koonon E. et al., 2003: Kluwer Academic Publishers, або відповідно до параметрів за умовчанням програмного забезпечення "Mac Vector" (UK). Ліганд за даним винаходом може бути також визначений як включений в рекомбінантний білок scFV. Відповідно до наступних аспектів винаходу ліганд може бути включений в Fab-фрагмент, в антитіло, яке може бути поліклональним, моноклональним, олігоклональним, химеризованим, сконструйованим або гуманізованим антитілом. У конкретному аспекті винаходу антитілом, яке включає ліганд, є IgG людини, і конкретніше lgG1 або lgG4. Поліклональні, олігоклональні, моноклональні антитіла можуть бути одержані класичними способами, такими як описані Kohler and Milstein (1975), або використовуючи способи описані в Sambrook et al, A Guide to Molecular Cloning, A Laboratory Manual, 2nd edition (1989), використовуючи вищеописані антиліганди. Конкретніше антиліганд за даним винаходом, який використовують для одержання антитіл, є антиліганд, який складається з SEQ ID No. 20 або з SEQ ID No. 32 або будь-якої послідовності, яка має щонайменше 75% ідентичності послідовностям, представленим в SEQ ID No. 20 або SEQ ID No. 32, або будь-якій послідовності, на 100% комплементарну їм. Зокрема, у формі пептиду, пов'язаного з білком-носієм, таким як сироватковий альбумін або KLH, який зазвичай використовують для імунізації. Винахід також відноситься до фармацевтичної композиції, яка містить ліганд за винаходом як активний інгредієнт. Цей ліганд може бути також присутнім у фармацевтичній композиції у формі ScFv, Fab-фрагмента або антитіла. Фармацевтичну композицію за винаходом застосовують для лікування MSRV-асоційованих захворювань. В межах значення за даним винаходом "лікування" охоплює або профілактичне, або терапевтичне лікування. Фармацевтичну композицію за даним винаходом вводять в кількостях, які будуть терапевтично ефективними і імуногенними і, як відомо в даній галузі техніки, дозування, яке вводять, залежить від індивідуума, який підлягає лікуванню. У наступному аспекті винахід відноситься до способу лікування, який включає введення ліганду, ScFv, Fab-фрагменту або антитіла або ліганду в будь-якому молекулярному або відповідному терапевтичному векторі, який зберігає його єднальні властивості, як обговорено вище, або фармацевтичній композиції, як описано вище. Спосіб лікування за винаходом направлений на лікування MSRV-асоційованих захворювань. MSRV є ретровірусом людини, вперше виділеним у пацієнтів з розсіяним склерозом (Perron, H., B. Lalande, et al. (1991), Lancet 337(8745): 862-3; Perron, H., J. A. Garson, et al. (1997), Proc Natl Acad Sci USA 94(14): 7583-8). Асоційовані захворювання або синдроми визначають присутністю у відповідних пацієнтів або (i) специфічної РНК MSRV або антигенів, переважно виявлених в рідинах організму (крові, спинномозковій рідині, сечі), або (i) підвищеного числа копій ДНК або РНК в клітинах або тканинах органів з пошкодженнями або дисфункціями, або (i) специфічних білків або антигенів MSRV в клітинах або тканинах, залучених в процес захворювання або клінічного синдрому, або (i) білків або антигенів MSRV в рідинах організму індивідуумів із захворюванням або тих, в яких виражений клінічний синдром (як описано в прикладі 8, див. нижче, і в інших нижче). Оскільки MSRV має генетичну гомологію з сімейством ендогенних ретровірусів людини типу W (HERV-W) (Blond et al., 1999; Dolei, 2005; Dolei and Perron, 2008), альтернативне або додаткове визначення MSRV-асоційованих захворювань може бути також одержане з нуклеїновими кислотами, антигенами або білками HERV-W, використовуваними для таких же тестів на виявлення (Antony et al., 2004; Arru et al., 2007; Karlsson et al., 2004; Mameli et al., 2007). Крім того, експресія MSRV може бути зумовлена регуляцією деяких копій HERV-W, які спільно виявляються в патогенних пошкодженнях (Mameli et al., 2009). Таким чином, непряме визначення MSRV-асоційованих захворювань включає зв'язок з HERV-W елементами. 2 UA 105495 C2 5 10 15 20 25 30 35 40 45 50 55 60 MSRV- асоційоване захворювання вибране з групи, яка включає розсіяний склероз, шизофренію, клінічно ізольований синдром (КІС, з неврологічним симптомом), хронічну запальну демієлінізуючу поліневропатію, епілепсію, псоріаз, рак, запальний панкреатит і діабет, такий як діабет типу 1 або типу 2, коли він пов'язаний із запаленням або порушенням імунної регуляції і з присутністю продуктів експресії MSRV, як визначено вище. У конкретній формі здійснення спосіб лікування MSRV-асоційованих захворювань включає введення антитіла lgG4 або lgG1 як хронічне лікування ін'єкціями, які регулярно повторюються. У іншому аспекті винахід відноситься до молекули нуклеїнової кислоти, яка містить щонайменше одну повнорозмірну нуклеїново-кислотну послідовність, представлену в SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17, SEQ ID No. 18, або будьяку послідовність, яка щонайменше на 70% і, переважніше на 80% і, ще переважніше на 90% ідентичні вказаним послідовностям, або будь-яку послідовність, на 100% комплементарну їм. "Ідентичність послідовності" означає, наприклад, що в послідовності, яка має 80% ідентичності послідовності, 80% ідентичних нуклеотидів присутніх в тому ж положенні при вирівнюванні послідовностей, які можна здійснити відомими в даній галузі техніки способами (див. вище). У переважному втіленні вищеописаного аспекту винаходу молекула нуклеїнової кислоти включає кожну з послідовностей, представлених SEQ ID No. 13, SEQ ID No. 14, SEQ ID No. 15, SEQ ID No. 16, SEQ ID No. 17 і SEQ ID No. 18, або будь-яку послідовність, яка щонайменше на 70% і, переважніше на 80% і, ще переважніше на 90% ідентичні вказаним послідовностям, або будь-яку послідовність, на 100% комплементарну їм. У наступному аспекті нуклеїнова кислота кодує VH ланцюг, і конкретніше вона представлена SEQ ID No. 10 або 12, або будь-яку послідовність, яка щонайменше на 70% і, переважніше на 80% і, ще переважніше на 90% ідентичні вказаним послідовностям, або будь-яку послідовність, на 100% комплементарну їм, без обмеження вищеописаними відсотками замін, інсерцій і делецій, які зберігають антигенні і зв'язуючі властивості початкових молекул ліганду або антиліганду (Huang 1986; Zabin, Horvath et al. 1991; Edgar and Schwartz 1992; Sardana, Emini et al. 1992; Xu, Kapfer et al. 1992; Lamande and Bateman 1993; Verdoliva, Ruvo et al. 1995; Yu, Schurr et al. 1995; Wehrmann, Van Vliet et al. 1996; Ullmann, Hauswald et al. 1997; Minuth, Kramer et al. 1998; Ullmann, Hauswald et al. 2000; Janke, Martin et al. 2003). Нуклеїновокислотна послідовність може також кодувати VL ланцюг, який представлений послідовностями SEQ ID No. 9 або 11, або будь-яку послідовність, яка щонайменше на 70% і, переважніше на 80% і, ще переважніше на 90% ідентичні вказаним послідовностям, або будьяку послідовність, на 100% комплементарну їм, без обмеження вищеописаними відсотками замін, інсерцій і делецій, які зберігають антигенні і зв'язуючі властивості початкових молекул ліганду або антиліганду (Huang 1986; Zabin, Horvath et al. 1991; Edgar and Schwartz 1992; Sardana, Emini et al. 1992; Xu, Kapfer et al. 1992; Lamande and Bateman 1993; Verdoliva, Ruvo et al. 1995; Yu, Schurr et al. 1995; Wehrmann, Van Vliet et al. 1996; Ullmann, Hauswald et al. 1997; Minuth, Kramer et al. 1998; Ullmann, Hauswald et al. 2000; Janke, Martin et al. 2003). Будь-які нуклеїнові кислоти, які гібридизуються в жорстких умовах з нуклеїновими кислотами, які кодують щонайменше один з пептидів відповідно до винаходу, також охоплені винаходом. Як використовується в даній заявці, термін "жорсткі умови" відноситься до умов, які дають можливість гібридизації між послідовностями зонду і нуклеотидною послідовністю, яку потрібно визначити. Відповідні жорсткі умови можуть бути визначені, наприклад, концентраціями солі або формаміду в розчинах прегібридизації і гібридизації, або температурою гібридизації, і добре відомі в даній галузі техніки. Зокрема, жорсткість можна підвищити шляхом зниженням концентрації солі, підвищенням концентрації формаміду або підвищенням температури гібридизації. Температурний інтервал, відповідний конкретному рівню жорсткості, може бути додатково звужений шляхом обчислення відношення пурину до піримідину, нуклеїнової кислоти, яка цікавить, і відповідного регулювання температури. Варіації вищеописаних інтервалів і умов добре відомі в даній галузі техніки. Даний винахід також відноситься до химерного гену, який містить у функціональному зчепленні один з одним щонайменше один промотор, який є функціональним в організмігосподарі, нуклеїнову кислоту відповідно до винаходу і термінаторний елемент, який є функціональним в тому ж організмі-господарі. Різні елементи, які може містити химерний ген, є, по-перше, елементами, регулюючими транскрипцію, трансляцію і мацерація білків, таких як промотор, послідовність, що кодує сигнальний пептид або транзитний пептид, або термінальний елемент, представлений сигналом поліаденілування, і, по-друге, полінуклеотид, який кодує білок. Вираз "функціонально звязаний один з одним" означає, що вказані елементи химерного гену зчеплені один з одним таким чином, що на функцію одного з цих елементів впливає 3 UA 105495 C2 5 10 15 20 25 30 35 40 45 50 55 60 функція іншого. Наприклад, промотор функціонально зчеплений з кодуючою послідовністю, коли він здатний впливати на експресію вказаної кодуючої послідовності. Конструювання химерного гену відповідно до винаходу і складання різних його елементів можна здійснити, використовуючи методики, добре відомі фахівцям в даній галузі техніки, зокрема, описані в Sambrook et al. (1989, Molecular Cloning: A Laboratory Manual, Nolan C. ed., New York: Cold Spring Harbor Laboratory Press). Вибір регуляторних елементів, складових химерного гену, істотно залежить від організму-господаря, в якому вони повинні функціонувати, і фахівці в даній галузі техніки здатні вибрати регуляторні елементи, які є функціональними в даному організмігосподарі. Термін "функціональний" мають на увазі як маючий здатність функціонувати в даному організмі-господарі. Промотори, які можуть містити химерний ген відповідно до винаходу, є або конститутивними, або індуцибельними. Наприклад, універсально ефективним промотором, використовуваним для експресії в клітинах ссавців, є pCMV (цитомегаловірусний промотор). Відповідно до винаходу химерний ген може також містити інші регуляторні послідовності, які розташовані між промотором і кодуючою послідовністю, такі як активатори транскрипції (енхансери). Даний винахід також відноситься до клонуючого і/або експресійного вектору, який містить химерний ген відповідно до винаходу. Вектор відповідно до винаходу призначений для використання трансформації організму-господаря і експресії ліганду в цьому організмі. Цей вектор може бути плазмідою, космідою, бактеріофагом або вірусом. Переважно вектор трансформації відповідно до винаходу є плазмідою. Як правило, основними якостями цього вектора має бути здатність до самовідтворення та самореплікації в клітинах організмугосподаря, зокрема, за рахунок наявності точки початку реплікації, і експресії в них ліганду. Для забезпечення стабільної трансформації організму-господаря вектор може також інтегруватися в геном. Тоді композиція вектора може бути обмежена елементами, потрібними для синтезу ліганду в господарях. Вибір такого вектора, а також методики вставки химерного гену відповідно до винаходу в цей вектор детально описані в Sambrook et al. (1989, Molecular Cloning: A Laboratory Manual, Nolan C. ed., New York: Cold Spring Harbor Laboratory Press) і загально відомими для фахівців в даній галузі техніки. Переважно вектор, використовуваний в даному винаході, також містить, додатково до химерного гена відповідно до винаходу, химерний ген, який кодує селективний маркер. Цей селективний маркер дає можливість відібрати організмигосподарі, які ефективно трансформувалися, тобто ті, які включили вектор. Можна згадати гени, які легко кодують ідентифіковані ферменти, такі як фермент GUS, або гени, які кодують пігменти або ферменти, регулюючі продукування пігментів в трансформованих клітинах. Такі селективні маркерні гени, зокрема, описані в заявках на патенти WO 91/02071, WO 95/06128, WO 96/38567 і WO 97/04103. Даний винахід також відноситься до трансформованих організмів-господарів, які містять щонайменше один химерний ген відповідно до винаходу, або інтегрований в їх геном, або переносний на екстрахромосомному генетичному елементі, наприклад, на плазміді. Під терміном "організм-господар" мається на увазі будь-який нижчий або вищий одноклітинний або субклітинний організм, в який можна вводити химерний ген відповідно до винаходу з метою продукування ліганду відповідно до винаходу. Переважно організм-господар є клітинами CHO (яєчника китайського хом'яка) або HEK (ниркового епітелію людини). Виразом "трансформований організм-господар" мається на увазі організм-господар, який означає, включений, в його геном або в екстрахромосомний генетичний елемент, наприклад, плазміду, щонайменше одного химерного гену відповідно до винаходу, і який, отже, продукує ліганд в своїх тканинах або в культуральному середовищі. Для одержання організмів-господарів відповідно до винаходу фахівці в даній галузі техніки можуть використовувати один з багатьох відомих способів трансформації. Один з цих способів полягає в приведенні в контакт клітин або тканин організмів-господарів, які потрібно трансформувати, з поліетиленгліколем (ПЕГ) і з векторами відповідно до винаходу (Chang and Cohen, 1979, Mol. Gen. Genet. 168(1), 111-115; Mercenier and Chassy, 1988, Biochimie 70(4), 503-517). Електропорація є іншим способом, який полягає в дії на клітини або тканини, які потрібно трансформувати, і вектори за винаходом електричного поля (Andreason and Evans, 1988, Biotechniques 6(7), 650-660; Shigekawa and Dower, 1989, Aust. J. Biotechnol. 3(1), 56-62). Інший спосіб полягаєв прямій ін'єкції векторів в клітини або тканини шляхом мікроін'єкції (Gordon and Ruddle, 1985, Gene 33(2), 121-136). Переважно можна використовувати "біолістичний" спосіб. Він полягає в бомбардуванні клітин або тканин частками, на яких адсорбовані вектори за винаходом (Bruce et al., 1989, Proc. Natl. Acad. Sci. USA 86(24), 96929696; Klein et al., 1992, Biotechnology 10(3), 286-291; U.S. Pat. No. 4,945,050). 4 UA 105495 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід також охоплює спосіб одержання ліганду, наприклад, ScFv, Fab фрагменту або антитіл, описаних вище, який включає стадію культивування клітини-господаря, описаної вище, в умовах, які дають можливість синтезу ліганду, Fab фрагменту або антитіла. Ліганд за винаходом характеризується його зв'язуючими властивостями з антилігандом. У конкретній формі антиліганд за винаходом характеризується тим, що він складається з амінокислотної послідовності, визначеною SEQ ID No. 20, де переважний вибір представлений SEQ ID N°32. Спосіб визначення антиліганду в біологічному зразку з використанням ліганду у формі ScFv, Fab фрагменту або антитіла відповідно до даного винаходу також складає частину даного винаходу. Цей спосіб включає стадії: (a) приведення в контакт зразка з лігандом відповідно до винаходу, ScFv, Fab фрагментом або антитілом, як описано вище (б) визначення присутності антиліганду в зразку. Вказаний спосіб визначення може бути виконаний за допомогою додаткової стадії приведення в контакт зразку з лігандом, який специфічно зв'язується з антигеном MSRV GAG, кодований геном gag MSRV, як описано в Komurian-Pradel et al. Virology, 1999 ; 260(1), pages 19. Відповідно до іншого аспекту даний винахід також відноситься до набору для імунологічного аналізу на визначення антиліганду в біологічному зразку, який включає ліганд відповідно до винаходу, SсFV, Fab фрагмент або антитіло, як описано вище, і реагенти для виявлення специфічного скріплення антиліганду з вищеописаним лігандом, Fab фрагментом або антитілом, а також який включає всі реагенти, необхідні для імунологічної реакції. Вказаний набір може додатково включати ліганд, який специфічно зв'язується з антигеном GAG, як визначено вище. Відповідно до іншого аспекту даний винахід також відноситься до застосування вказаного набору для імунологічного аналізу, як описано вище, при визначенні MSRV-асоційованого захворювання, вибраного з групи, яка включає розсіяний склероз, шизофренію, клінічно ізольований синдром, хронічну запальну деміелінізуючу поліневропатію, епілепсію, псоріаз, рак, запальний панкреатит і діабет, і конкретніше діабет типу 1 або діабет типу 2. Біологічний зразок може бути сироваткою, сечою, слиною, матеріалом біопсії і тому подібним. Схема імунологічних аналізів є загальноприйнятою в даній галузі техніки, і протоколи, такі як використання твердих носіїв або імунопреципітації, є добре відомими методами. Антитіло може бути міченим в цілях його виявлення з використанням ферментативних, флуоресцентних, хемілюмінесцентних, радіоактивних або фарбувальних міток. Аналізи, які ампліфікують сигнали від імунного комплексу, такі як аналізи з використанням біотину і авідину або стрептавідину, і імуноферментні аналізи, такі як ELISA або сендвіч-аналізи, складають частину даного винаходу. Короткий опис графічних матеріалів Фіг. 1: (A) амінокислотна послідовність VL, (B) амінокислотна послідовність VH, послідовності CDR підкреслені Фіг. 2: структура повнорозмірного білка ENV (ENV-T) і фрагмент розщеплювання зовнішнього покриття (ENV 1 або ENV-SU) Фіг. 3: Вимір оптичної щільності за допомогою колориметрії з субстратом пероксидази, які зрівнюють ліганд, який є мишачим антитілом GNbAC1 (мишачий lgG1 perox), і рекомбінантним фрагментом ScFv з одним лігандом (ScFv VH+VL biot). Концентрація покриваючого антитіла і ліганду кожного визначення складала 5 мкг/мкл кожного; розведення кон'югату стрептавідин-пероксидазу складало 1/2000. Фіг. 4: Вимір оптичної щільності за допомогою колориметрії з субстратом пероксидази, яка порівнює ліганд, який є мишачим антитілом GNb AC1, і Fab зв'язуючим фрагментом з одним лігандом. Концентрація ліганду і lgG1 кожного визначення складала 10 мкг/мл + Jackson антиFab з пероксидазою або анти-IgG, розведеного при 1/250. Тестували різні концентрації ENV-T. Фіг. 5: Тест GNbAC1 і химерних антитіл lgG1 і lgG4 відповідно до винаходу на серійному розведенні антигену ENV (ENV-T). Концентрація антитіл складала 1 міліграм/мл, а розведення другого міченого пероксидазою антитіла анти-IgG складала 1/250. Антитіло 2G5E12 є нерелевантним антитілом, яке не зв'язується з антигеном ENV, використовуване як негативний контроль. Фіг. 6: Тест GNbAC1 і химерних конструкцій lgG1 і lgG4 на постійній концентрації антигену (ENV-T) на двох партіях лігандів (A) партія 1, (B) партія 2. Концентрація антигену складала від 1 до 0,0078 початкового мишачого моноклонального антитіла (GNbAC1), вказаного як mulgG, 5 UA 105495 C2 5 10 15 20 25 30 35 40 45 50 55 60 конструкцій lgG1 або lgG4 людини з лігандом (вказаних як hulgG1 і hulgG4), мкг/мл. Розведення другого антитіла Jackson IGG проти миші або проти людини складало 1/250. Фіг. 7: GNbAC1, ScFv, химерні конструкції антитіла людини lgG1 і lgG4 з лігандом: ингібірування протизапальної активації МКПК антигеном ENV (ENV SU), яке представлене зниженням IL-6. Співвідношення між антитілом або ScFv і антигеном ENV складало 25/1. Фіг. 8: Результати ApoH-ELISA. Сироватки з європейського багатоцентрового дослідження по розсіяному склерозу тестували всліпу в незалежній лабораторії. Фіг. 9: Антігенемія MSRV-ENV і GAG у пацієнтів з шизофренією і в контролях. Використані антитіла 2A12A5 і 6A2B2 для ENV і 2G5E12 для GAG. Фіг. 10: Оптична щільність (OD) ApoH-ELISA на визначення антигену MSRV-ENV специфічним моноклональним антитілом 6A2B2. Фіг. 11: Клінічне спостереження гуманізованих мишей SCID, у яких розвивається гостре нервове запалення і деміелінізація (експериментальний алергічний енцефаломієліт, модель розсіяного склерозу на тваринах): порівняння клінічного результату груп, оброблених різними антитілами, в порівнянні з необробленими групами. Початкове мишаче моноклональне антитіло (GNb AC1) вказане як mulgG, конструкції lgG1 або lgG4 людини з лігандом вказані як hulgG1 і hulgG4. Фіг. 12: Криві гуманізованих мишей, які виживають SCID, і в яких розвивається гостре нервове запалення і деміелінізація (експериментальний алергічний енцефаломієліт, модель розсіяного склерозу на тваринах): порівняння клінічного результату груп, оброблених різними антитілами, в порівнянні з необробленими групами. Початкове мишаче моноклональне антитіло (GNb AC1) вказане як mulgG, конструкції lgG1 або lgG4 людини з лігандом вказані як hulgG1 і hulgG4. Фіг. 13: Криві маси тіла кожної миші NOD-SCID, яка тестується в попередньому експерименті. Доза білку ENV, ін'єктованого кожній миші, вказана в дужках. Остання ін'єкція білка ENV, емульгованного в IFA і PTX (P14), вказана стрілкою. Мишей позначили як M1 - M6, відповідно до дози ENV, яку вони отримали, що вказане після коду між дужками (від 0 до 20 мікрограмів) в графічній легенді. Переривання кривих відповідає добі загибелі тварини у відповідній категорії. Фіг. 14: Концентрації глюкози в крові (глікемія) в контрольних (контроль) і ENV-ін'єктованих мишей NOD-SCID (ENV): порівняння між добами першої ін'єкції (P0) і одним тижнем після останньої ін'єкції (P30). Глікемія, зміряна на P30, виражена у вигляді відсотка від виміру на P0 (вісь Y), в ін'єктованих контролем і ENV- ін'єктованих групах (вісь X: - контролі і "ENV"). Фіг. 15: Визначення CDR важкого ланцюга антитіла GNb AC1. 15A: Амінокислоти, ідентифіковані відповідно до визначення по Чозіа, представлені буквами меншого розміру. Амінокислоти, ідентифіковані відповідно до визначення Kabat, представлені підкресленими буквами. 15B: Відповідно до переважного визначення, об'єднуючого обидва визначення, підкреслені початкові ділянки CDR миші, яких потрібно розглядати для щеплення функціонального ліганду на варіабельну ділянку важкого ланцюга антитіла lgG4 людини. Фіг. 16: Визначення CDR легкого ланцюга антитіла GNb AC1. CDR, ідентифіковані відповідно до визначення по Кебету, підкреслені, CDR, ідентифіковані відповідно до визначення по Контакту (нестандартним), мають букви меншого розміру. Фіг. 17: Зв'язуюча активність химерного антитіла GNb AC1 з імобілізованим білком ENV. Умови описані в тексті відповідного прикладу. На осі Y представлений вимір оптичної щільності (OD) для кожної крапки шляхом колориметрії і відповідність кількості антитіла, зв'язаного з білком-мішенню ENV. На осі X представлена концентрація рекомбінантного білку ENV, використаного для покриття відповідних лунок мікропланшету, і після відмивання отримують широкий кількісний спектр відповідного білка, іммобілізованого на планшеті. Фіг. 20: Порівняння єднальної активності гуманізованого антитіла H2A/K3 (H2vk3) і химерного антитіла (GNbAC1 lg4) з імобілізованим ENV. Умови описані в тексті відповідного прикладу. На осі Y представлений вимір оптичної щільності (OD) для кожної крапки шляхом колориметрії й відповідність кількості антитіла, пов'язаного з білком-мішенню ENV. На осі X представлена концентрація рекомбінантного білку ENV, використаного для покриття відповідних лунок мікропланшету, і після відмивання одержують широкий кількісний спектр відповідного білка, іммобілізованого на планшеті. Фіг. 21: Очищене антитіло H2VK3 у гелі, який не відновлює. Умови описані в тексті відповідного прикладу. Ліворуч числа (кДа) вказують рівні (смуги), на які стандартні білки з певною молекулярною масою (кДа) мігрували в гелі, як показано на лівій доріжці зображення. Очищене антитіло H2A/K3 показано (стрілка) у вигляді однієї смуги на середній доріжці 6 UA 105495 C2 5 10 15 20 25 30 35 40 45 50 55 зображення, де бичачий сироватковий альбумін (стандарт у буферах антитіла, як контроль, зазначеного стрілкою при різній молекулярній масі), показаний на правій доріжці зображення. Фіг. 22: Порівняння єднальних активностей очищеного H2A/K3 (очищеного hН2+hVK3) і очищеного химерного антитіла (GNbAC1 lg4) з іммобілізованим ENV (0,5 мкг/мл). На осі X представлена концентрація химерного lgG4 або відібраного гуманізованого антитіла в нанограммах/мл. На осі Y представлена оптична щільність, обмірювана шляхом колориметрії, яка відповідає кількості антитіла, пов'язаного з іммобілізованим білком ENV постійної концентрації в аналізі. Фіг. 23: Амінокислотні послідовності важкого ланцюга H2 і легкого ланцюга VK3 гуманізованого антитіла. Амінокислоти в літерах напівжирним шрифтом підрядкового індексу являють собою мишачі амінокислоти, які містяться в каркасній області, на підставі їхнього консенсусу-положення з послідовностями людського антитіла, проаналізованими в базах даних. Фіг. 24: Протизапальні цитокіни перетерплюють сильну підвищувальну регуляцію стимуляцією клітин-астроцитів білками, родинними HERV-W ENV. Результати представлені у вигляді середніх значень трьох повторів. ENV: MSRV-ENV; Сінцітин: HERV-W ENV з копії хромосоми 7q; X: Нерелевантне антитіло (контроль ізотипу); Мишаче анти-ENV: мишаче антитіло GNb AC1; Химерне анти-ENV: Химерний IgG4 людини й GNb AC1; пг/мл: пікограми на мілілітр. Фіг. 25: Культури мононуклеарних клітин периферичної крові. Результати представлені у вигляді середніх значень трьох повторів. ENV: MSRV-ENV; Сінцітин: HERV-W ENV з копії хромосоми 7q; X: Нерелевантне антитіло (контроль ізотипу); Мишаче анти-ENV: мишаче антитіло GNb AC1; Химерне анти-ENV: Химерний IgG4 людини й GNb AC1; пг/мл: пікограми на мілілітр. Фіг. 26: Визначення глікозіліруваних білків, споріднених HERV-W ENV, людини із трьома формами ліганду GNb AC1 (мишаче, химерне й гуманізоване антитіло). A) Визначення глікозіліруваних білків, споріднених HERV-W ENV, людини з мишачим антитілом GNb AC1. Б): Визначення глікозіліруваних білків, споріднених HERV-W ENV, людини з химерним антитілом GNb AC1; В): Визначення глікозіліруваних білків, споріднених HERV-W ENV, людини з глікозіліруваним антитілом. Вісь Y: Оптична щільність; Вісь X: Бактеріальний білок MSRV-ENV (партія ENV-T 7A); Бактеріальний поверхневий фрагмент MSRV-ENV (партія ENV-SU 4A); глікозіліруваний сінцітин людини; глікозіліруваний білок MSRV-ENV людини (партія ENV-T P1). Фіг. 27: Нейроповедінкове оцінювання пацюків, ін'єктованих інтрацеребрально MSRV ENV або контрольним розчином (контроль): Горизонтальна - представлена числом пересічених ліній на осі Y- (A) і вертикальна представлена підйомами на задні лабети на осі Y- (B) локомоторна активність після впливу винаходу в декількох моментах часу після інтрацеребральної ін'єкції пацюкам (P5, P6, P7, P11 й P12) у контролі (розчин ФСБ - фосфатно-сольовий буфер), ENV-icv (ENV ін'єктовані інтрацеребральні шлуночки) і ENV-hipp (гіпокамп). Фіг. 28: Нейроповедінкове оцінювання пацюків ін'єктованих інтрацеребрально MSRV ENV або контрольним розчином (контроль): Горизонтальна - представлена числом пересічених ліній на осі Y- (A) і вертикальна представлена підйомами на задні лапки на осі Y- (B) локомоторна активність після ін'єкції пацюкам фізіологічного розчину в контролі, ENV-icv й ENV-hipp при P11. Фіг. 29: Нейроповедінкове оцінювання пацюків, ін'єктованих інтрацеребрально MSRV ENV або контрольним розчином (контроль): Горизонтальна - представлена числом пересічених ліній на осі Y- (A) і вертикальна представлена підйомами на задні лапки на осі Y- (B) локомоторна активність після стресу обмеження контрольних, ENV-icv й ENV-hipp пацюків при P13. Фіг. 30: Нейроповедінкове оцінювання пацюків, ін'єктованих інтрацеребрально MSRV ENV, яке показує терапевтичний ефект ліганду lgG4 GNbAC1: (A) Горизонтальна локомоторна активність, обмірювана у відкритому полі, після впливу винаходу при P12 і при P32 - як показано на осі X- у контрольних пацюків, не оброблених пацюків, ін'єктованих ENV (ENV+), і lgG4-оброблених ENV+ пацюків, як зазначено в легенді (B) Підтвердження терапевтичного ефекту ліганду lgG4, спостережуваного при P32 з горизонтальною локомоторною активністю після стресу обмеження; її вимірювали як число пересічених ліній на осі Y у відкритому полі після стресу обмеження після повторної системної ін'єкції білка ENV у контрольних пацюків, неопрацьованих пацюків ENV+ й lgG4-оброблених пацюків ENV+, як зазначено на осі X. 7 UA 105495 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 31: Дослідження "ENV-позитивних" безтимусних мишей із щепленою лімфомою, яка показує терапевтичний ефект ліганду lgG1 GNbAC1. Селезінковий індекс (вісь Y), обчислений на контрольні й lgG1-оброблених мишах (вісь X) через 19 діб після ін'єкції клітин лімфоми. Селезінковий індекс обчислювали в такий спосіб: [(маса селезінки/маса тіла) x 100]. Межі помилок, які не перекриваються, вказують на статистичну значимість. Фіг. 32: Дослідження "ENV-позитивних" мишей SCID із щепленою лімфомою, яка показує терапевтичний ефект ліганду lgG1 GNbAC1 Співвідношення маси селезінки/тіла (вісь Y) обчислено на неопрацьованих й lgG1оброблених мишах SCID через 7 діб після ін'єкції клітин B-лімфоми. Співвідношення маси селезінки/тіла обчислювали в такий спосіб: [(маса селезінки/маса тіла) x 100]. Фіг. 33: Дослідження "ENV-позитивних" мишей SCID із щепленою лімфомою, яка показує терапевтичний ефект ліганду lgG1 GNbAC1. Число життєздатних і мертвих лімфобластоїдних клітин - вісь Y- (A), і інших лейкоцитів (B) у перитонеальній рідині, зібраної в контрольних й lgG1-оброблених мишей - вісь X -, через 7 діб після ін'єкції клітин лімфоми й через 6 діб після ін'єкції антитіла. Наведені нижче приклади служать для ілюстрації винаходу без обмеження яким-небудь чином даного винаходу. Приклади Приклад 1: Аналіз мишачого специфічного антитіла (GNbAC1): ідентифікація послідовності й структури молекулярного ліганду, специфічного до білка MSRV ENV і його еквівалентам Гібридому миші одержували після злиття міеломи миші й клітин селезінки від мишей Balb-C, імунізованих рекомбінантним білком MSRV, продукованим в E. coli й очищеним із клону MSRV "ENV", як описано в 'Komurian-Pradel, F., G. Paranhos-Baccala, et al. (1999), Virology 260(1): 1-9). ПЦР ампліфікацію областей VH й VL з даної гібридоми, продукуюючої lgG1/каппа (GNbAC1), проводили відповідно до наведеного нижче протоколу. 7 Полі(A+) РНК екстрагували й очищали з 5x10 клітини гібрідоми, продукуючої lgG1/каппа, використовуючи набір для очищення мРНК (Amersham Bioscience) відповідно до інструкцій виробника. Зворотну транскрипцію проводили з 800 нг мрнк, використовуючи набір дл я ОТПЦР (Amersham Bioscience) відповідно до інструкцій виробника. кДНК, яка кодує послідовності генів варіабельних областей легкого (VL) і важкого (VH) ланцюгів, одержували, використовуючи спосіб швидкої ампліфікації кінців кДНК (RACE), як описано раніше (Ruberti et al., 1994, J. Immunol. Methods 173, 33-39). Прямий праймер являв собою наведену нижче послідовність SEQ ID No. 21 (RACEforward), зворотні праймери являли собою наведені нижче послідовності: SEQ ID No. 22 (CL_Ala130_Fwd) для VL ампліфікації й SEQ ID No. 23 (CH1_Pro119_Fwd) для VH ампліфікації, з буквеним кодом R = A/G, K = G/T, H = A/T/C. Зворотні праймери CL_Ala130_Backward й CH1_Pro119_Backward, виведені з консенсусів-послідовностей, опублікованих Kabat et al. (1991) Sequences of proteins of immunological interest. National Institute of Health Bethesda, MD), специфічні до N-кінців домену каппа/CL миші й домену lgG/CH1, відповідно. Продукти ПЦР одержували, використовуючи Taq ДНК полімеразу, і безпосередньо лігірували у векторі pCR®2.1-TOPO®, використовуючи набір для TA клонування (Invitrogen) відповідно до інструкцій виробника. Послідовності клонованих ДНК визначали шляхом секвенірування на автоматичному секвенаторі ABI310, використовуючи набір Dye Terminator Cycle Sequencing Ready Reaction Kit (Applied Biosystems). У результаті цих ПЦР ампліфікацій з наступними стадіями клонування й секвенірування одержали послідовності VL й VH ланцюгів, які представлені SEQ ID No. 7 й 8, відповідно, по їхніх амінокислотних послідовностях, виведеним з вихідних нуклеотидних послідовностей. Крім того, аналіз цих амінокислотних послідовностей дав можливість ідентифікації ділянок, які визначають комплементарність (CDR), залучених у специфічність ліганду (відповідно до Kabat (Wu and Kabat 1970, An analysis of the sequences of the variable regions of Bence Jones proteins and myeloma light chains and their implications for antibody complementarity. J. Exp. Med. 132:211th 250; Kabat et al. 1987, 1991, Sequences of proteins of immunological interest; 4 edn. US Govt. Printing Off. No.165-492), або на підставі структури відповідно до Chothia (Chothia and Lesk 1987, Canonical structures for the hypervariable regions of immunoglobulins. J. Mol. Biol. 196:901-917; Chothia et al. 1989, Conformations of immunoglobulin hypervariable regions. Nature 342: 877-883). Три послідовності CDR, ідентифіковані на амінокислотній послідовності VH (Фіг. 1 B), відповідають SEQ ID No. 4, SEQ ID No. 5 й SEQ ID Nо. 6, і три послідовності CDR, ідентифіковані на амінокислотній послідовності VL (Фіг. 1 A), відповідають SEQ ID No. 1, SEQ ID No. 2 й SEQ ID Nо. 3. Ці шість послідовностей CDR являють собою корові "мінімальні" 8 UA 105495 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності, які вимагаються для єднальної специфічності ліганду, і, отже, розглянуті в будьякій композиції або молекулярній конструкції, яка зберігає активність даним ідентифікованого специфічного ліганду. Проте, фахівцям у даній галузі техніки відомо, що кілька амінокислот можуть бути замінені амінокислотами з еквівалентними властивостями, зберігаючи, таким чином, специфічність вихідних послідовностей ліганду й роблячи його еквівалентним лігандом. Такі варіації відомі як можливі в межах максимального діапазону 10-12%. Приклад 2: Приклад одержання й очищення антигену MSRV ENV для імунізації мишей з метою одержання анті-ENV реактивних спленоцитів для утворення специфічних гібридом. Джерело: плазміда p14 з виріону MSRV (Perron, Jouvin-Marche et al. 2001), яка містить білкову послідовність, яка відповідає номеру доступу бази даних (NCBI-Entrez/Genbank): AF331500.1. На Фіг. 2 представлена структура повнорозмірного білку ENV (ENV-T, SEQ ID No. 19) і фрагмент поверхневого відщіплення (ENV 1 або ENV-SU, SEQ ID No. 24). На Фіг. 2 сигнальний пептид починається із залишку №1 (метіонин) і кінчається залишком №29 (треонин). Спосіб одержання: Після лігірування послідовності, яка кодує, ENV-T, наданої Geneart (США) , в експресійній плазміді, експресійному векторі pET-15b, який поставляє Novagen (EMD Chemicals, Inc., Gibbstown, NJ, США), відповідно до інструкцій виробника й трансформації бактерій штаму BL21 E. coli шляхом класичної пермеабілізації CaCI2, як описано в "DNA Isolation and Sequencing" (Essential Techniques Series) by Bruce A. Roe, Judy S. Crabtree and Akbar S. Khan Published by John Wiley & Sons, ISBN 0-471-97324-0 QP625.N89R64 1996 John Wiley & Sons, і в "Molecular Biology Techniques: An Intensive Laboratory Course (Paperback) by Katharine G. Field (Author), Walt Ream (Author), трансформовані бактерії вирощують у середовищі LB у присутності 30 мкг/мл канаміцину 37 °C до оптичної щільності. Потім експресію білка індукували 1 мМ ІПТГ (ізопропіл-β-D-1-тіогалактопіранозид), і культивування продовжували при 37 °C протягом 4 годин. Спосіб екстракції: Після центрифугування при 5000 g протягом 20 хвилин при 4 °C бактеріальний осад ресуспендують в 20 мл/л культури лізіруючого буферу (Тріс 20 мМ p 7,5; NaCI 0,15 M; лейпептин 1 мкг/мл, пепстатин 1 мкг/мл, PMSF 1 мМ, MgCI2 2 мМ, лізоцим 50 мкг/мл). Розчин інкубують протягом 30 хв при 4 °C при струшуванні, а потім обробляють ультразвуком на льоді/етанолі (4 стадії по 7 хв при 80% 0,5). Додають ДНКазу 1 мМ, і розчин інкубують одну годину при 4 °C при струшуванні. Суспензію центрифугують при 40000 g протягом 30 хв при 4 °C. Осад ресуспендують в 7,5 мл/л культури солюбілізуючого буферу (Тріс 20 мМ p 7,5, NaCI 150 мМ, сечовина 2 M, ДСН 1,5%, β-меркаптоетанол 50 мМ). Розчин інкубують 2 години при 8 °C при струшуванні. Потім суспензію центрифугують при 40000 g протягом 30 хв при 10 °C. Спосіб очищення: Надосадову рідину сечовини розводять в 5 разів у буфері Тріс 20 мм p 7,5, NaCI 150 мм, ДСН 1,5%. Очищення проводять на 1 мл/л культури за допомогою афінної хроматографії на колонку Ni Sepharose Fast Flow (Amersham BioScience). Надосадову рідину наносять при 2 мл/хв на смолу після зрівноважування буфером Тріс 20 мм, p 7,5, NaCI 150 мм, сечовина 500 мм, ДСН 1,5%, ßмеркаптоетанол 10 мм. Елюірування Env здійснюють східчасто 30 й 50 мм імідазолу. Очищення проводять знесолюючим стовпчиком (Amersham BioScience, 25 мл смоли). Пул після афінної хроматографії наносять при 2 мл/хв на смолу після зрівноважування буфером Тріс 20 мм, p 7,5, NaCI 150 мм, ДСН (додецилсульфат натрію) 1,5%, ДТТ 10 мм. Білки елюірують тим же буфером. Після цього білки наносять при 1 мл/хв на стовпчик для гель-фільтрації Superdex 200 (Amersham Bioscience), урівноважену буфером Тріс 20 мм p 7,5, NaCI 150 мм, ДСН 1,5%, ДТТ (дітиотреітол) 10 мм. Білки елюірують тим же буфером. Видалення ендотоксинів: Очищення проводять за допомогою стовпчика Acticlean (Amersham Bioscience, 8 мл смоли). Пул наносять на смолу при 1 мл/хв після зрівноважування буфером Трс 20 мм p 7,5, NaCI 150 мм, ДСН 1,5%, ДТТ 10 мм. Білки елюірують тим же буфером. Контроль якості партії: - Мас-спектрометрія MALDI-TOFF (відрізок часового спектру із іонізацією лазерною десорбцією з матриці): не можна використати у зв'язку із ДСН. - N-Кінцеве секвенірування: ALPYXTFLFT 9 UA 105495 C2 5 10 15 20 25 30 35 40 45 50 - Аналіз на ендотоксини: 90% Концентрація: 0,05 мг/мл Зберігання: -80 °C Кількість: 1,5 мг Буфер: Тріс 20мм p 7,5, NaCI 150 мм, ДСН 1,5%, ДТТ 10 мм Приклад 3: Дані in vitro активності зв'язування ліганду, специфічного до антигену MSRV ENV I - Завдання Автори винаходу оцінили спорідненість ліганду до рекомбінантного антиліганду у формі рекомбінантного білку ScFv із клонованих послідовностей VH+VL або у формі Fab-фрагменту, вищепленого з вихідного мишиного GNbAC1 (який має розщеплені ланцюги VH+VL без функції й структури мишиного антитіла), за допомогою імунологічного аналізу (ELISA). Цей ліганд порівнювали з вихідним мишачим GNbAC1 і з молекулярними конструкціями, які містять ліганд, вбудований у константні області ланцюгів lgG1 або lgG4 людини, і придатні послідовності для їхнього застосування як фармакологічні вектори. II - Матеріал і способи a) Клонування VH й VL: Клонування й нуклеотидне секвенірування варіабельної області GNb AC1 легкого (VL) і важкого (VH) ланцюгів 7 Полі(A+)РНК екстрагували й очищали з 5x10 клітин гібридоми, продукуючої антитіло GNb AC1, використовуючи набір для очищення мРНК (Amersham Bioscience) відповідно до інструкцій виробника. Зворотну транскрипцію проводили з 800 нг мрнк, використовуючи набір для ОТ-ПЦР (Amersham Bioscience) відповідно до інструкцій виробника. кДНК, яка кодує послідовності генів варіабельної області легкого (VL) і важкого (VH) ланцюгів, була отримана з використанням способу швидкої ампліфікації кінців кДНК (RACE), як описано раніше (Ruberti et al, 1994, The use of the RACE method to clone hybridoma cDNA when V region primers fail. J. Immunol. Methods 173, 33-39). Прямий праймер був наступним: RACE прямий (SEQ ID No. 21). Зворотні праймери були наступними: CL_Ala130_зворотний (SEQ ID No. 25) для ампліфікації VL й CH1_Pro119_зворотний (SEQ ID No. 26) для ампліфікації VH, з буквеним кодом R = A/G, K = G/T, H = A/T/C. Зворотні праймери CL_Ala130_зворотний й CH1_Pro119_зворотний, виведені з консенсусівпослідовностей, опублікованих Kabat et al. (1991, Sequences of proteins of immunological interest. National Institute of Health Bethesda, MD), специфічні до N-кінців мишачого домену каппа/CL і домену lgG/CH1, відповідно. Продукти ПЦР одержували, використовуючи Taq ДНК полімеразу, і безпосередньо лігірували у вектор pCR®2.1-TOPO®, використовуючи набір для клонування TA (Invitrogen) відповідно до інструкцій виробника. Послідовності клонованих кДНК визначали шляхом секвенірування на автоматичному секвенаторі ABI310, використовуючи набір Dye Terminator Cycle Sequencing Ready Reaction Kit (Applied Biosystems). b) Конструювання й експресія ScFv: ScFV отримували відповідно до методів, описаними в Mallano A, et al. 2008, Generation and characterization of a human single-chain fragment variable (scFv) antibody against cytosine deaminase from Yeast. M. BMC Biotechnol. Sep 10; 8:68. c) Fab з антитіла GNb AC1 Fab отримували відповідно до методів, описаними в Lefranc G, Lefranc MP. Antibody engineering and perspectives in therapy. Biochimie. 1990 Sep; 72(9): 639-51. II-1 Матеріал II-1а Моноклональні антитіла Ліганд, молекулярні конструкції на основі IgG людини або GNbAC1, були одержані й очищені в наведених нижче концентраціях: 10 UA 105495 C2 Таблиця 1 Концентрації різних лігандів, ScFV, Fab й антитіл Назва Концентрація 5,91 мг/мл 1 мг/мл 2 мг/мл 1 мг/мл 1 мг/мл GNbAC1 Ліганд в lgG1 людини Ліганд в lgG4 людини Мишачий Fab Рекомбінантний ScFv II-1b Рекомбинантні білки 5 Обидва рекомбінантних білка, повнорозмірний MSRV ENV (ENV-T) і фрагмент,який представляє собою поверхневий домен (ENV-SU), були одержані фірмою Protein Expert в E.coli і далі очищені, як описано в прикладі 2. Таблиця 2 Концентрація рекомбінантих білків Назва білка ENV-T ENV-SU Концентрація 0,15 мг/мл 0,20 мг/мл Ендотоксин
ДивитисяДодаткова інформація
Назва патенту англійськоюTherapeutic use of specific ligand in msrv associated diseases
Автори російськоюBernard, Corinne, Lang, Alois, Bernhardt, Perron, Herve, Bertrand, Jean-Baptiste
МПК / Мітки
МПК: A61K 39/42, A61P 25/00, A61P 1/18, A61P 35/00, C07K 16/10, A61P 3/10
Мітки: пов'язаних, корисний, лікування, ліганд, захворювань
Код посилання
<a href="https://ua.patents.su/80-105495-ligand-korisnijj-dlya-likuvannya-zakhvoryuvan-povyazanikh-z-msrv.html" target="_blank" rel="follow" title="База патентів України">Ліганд, корисний для лікування захворювань, пов’язаних з msrv</a>
Попередній патент: Гетероциклічна сполука і її застосування
Наступний патент: Доставка октреотиду сухими фармакологічними формами
Випадковий патент: Спосіб забезпечення зв'язку між двома радіорелейними станціями