Оксадіазолідиндіонова сполука
Номер патенту: 94455
Опубліковано: 10.05.2011
Автори: Куросакі Тосіо, Негоро Кендзі, Йосіда Сігеру, Івасакі Фумійосі, Йонетоку Ясухіро, Асаі Норіо, Сога Такатосі, Охнукі Кей
Формула / Реферат
1. Оксадіазолідиндіонова сполука, представлена наступною формулою (І), або її фармацевтично прийнятна сіль,
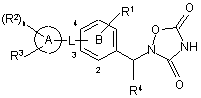 (I)
(I)
(символи в представленій формулі представляють наступні значення:
R1: -Н, галоген, -R0, галогенонижчий алкіл, -ORz, -S-R0 або -О-галогенонижчий алкіл,
R0: нижчий алкіл,
Rz: однакові або відмінні один від одного і кожний являє собою -Н або нижчий алкіл,
L: *-нижчий алкілен-О-, *-нижчий алкілен-N(Rz)- або *-CON(Rz)-, де знак * у L означає зв'язування з кільцем А,
кільце А: бензол, піридин, тіофен, піперидин, дигідропіридин, піримідин або тетрагідрохінолін,
кільце В: бензол або піридин,
R2: відповідно однакові або відмінні один від одного і кожний являє собою -галоген, -R0, галогенонижчий алкіл, -O-Rz, -S-R0, -О-галогенонижчий алкіл, -О-нижчий алкіленарил або оксо,
n: 0, 1 або 2,
R3: -галоген, -R0, -галогенонижчий алкіл, -OR0, -S-R0, -О-галогенонижчий алкіл, -Х-(феніл, що може бути заміщений) або -Х- (гетероарил, що може бути заміщений),
X: простий зв'язок, О, S або N(Rz),
R4: -Н або нижчий алкіл,
або R1 і R4 разом можуть утворювати нижчий алкілен,
за умови, що
2-{4-[2-(4-метил-6-оксо-2-пропілпіримідин-1(6Н)-іл)етокси]бензил}-1,2,4-оксадіазолідин-3,5-діон і
2-{4-[2-(2-етил-4-метил-6-оксопіримідин-1(6Н)-іл)етокси]бензил}-1,2,4-оксадіазолідин-3,5-діон виключаються).
2. Сполука за п. 1, де положення заміщення L у кільці В являє собою 4-положення.
3. Сполука за п. 2, де кільце А являє собою бензольне кільце.
4. Сполука за п. 3, де R3 являє собою феніл або піридил, що може бути відповідно заміщений.
5. Сполука за п. 4, де L являє собою *-СН2-О- або *-CH2-NH- (де * означає зв'язування з кільцем А).
6. Сполука за п. 5, де R4 являє собою -Н.
7. Сполука за п. 6, де R1 являє собою -Н, галоген або R0.
8. Сполука за п. 7, де n має значення 0, або R2 являє собою галоген або R0.
9. Сполука за п. 8, де R3 являє собою феніл, що заміщений групою, вибраною з класу, що включає -О-нижчий алкілен-ORz, -О-нижчий алкілен -CON(Rz)2 і -O-нижчий алкілен-(циклоалкіл, що може бути заміщений групою -ORz), і може бути додатково заміщений 1 або 2 групами нижчий алкіл, галоген або -OR0.
10. Сполука за п. 1, що вибрана з групи, що включає
2-{[3'-({4-[(3,5-діоксо-1,2,4-оксадіазолідин-2-іл)метил]фенокси}метил)-2,6-диметилбіфеніл-4-іл]окси}-N-метилацетамід,
2-(4-{[4'-(2-гідроксіетокси)-2'-метилбіфеніл-3-іл]метокси}бензил)-1,2,4-оксадіазолідин-3,5-діон,
2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2',6'-диметилбіфеніл-3-іл]метокси}бензил)-1,2,4-оксадіазолідин-3,5-діон,
2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2,2'-диметилбіфеніл-3-іл]метокси}бензил)-1,2,4-оксадіазолідин-3,5-діон,
2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2,2',6'-триметилбіфеніл-3-іл]метокси}бензил)-1,2,4-оксадіазолідин-3,5-діон,
2-{4-[(4'-{[(3R)-3-гiдpoкcибyтил]oкcи}-2,2'-димeтилбiфeніл-3-іл)метокси]бензил}-1,2,4-оксадіазолідин-3,5-діон,
2-{4-[(4'-{[(3S)-3-гідроксибутил]окси}-2,2'-диметилбіфеніл-3-іл)метокси]бензил}-1,2,4-оксадіазолідин-3,5-діон,
2-[4-({[4'-(3-гідрокси-3-метилбутокси)-2,2'-диметилбіфеніл-3-іл]метил}аміно)бензил]-1,2,4-оксадіазолідин-3,5-діон,
2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2'-метокси-2-метилбіфеніл-3-іл]метокси}бензил)-1,2,4-оксадіазолідин-3,5-діон,
2-{4-[(4'-{[(3R)-3-гідроксибутил]окси}-2,2'6'-триметилбіфеніл-3-іл)метокси]бензил}-1,2,4-оксадіазолідин-3,5-діон,
2-{4-[(4'-{[(3S)-3-гідроксибутил]окси}-2,2'6'-триметилбіфеніл-3-іл)метокси]бензил}-1,2,4-оксадіазолідин-3,5-діон,
2-[(6-{[4'-(3-гідрокси-3-метилбутокси)-2,2',6'-триметилбіфеніл-3-іл]метокси}піридин-3-іл)метокси]-1,2,4-оксадіазолідин-3,5-діон і
2-[4-({4'-[2-(1-гідроксициклопропіл)етокси]-2,2',6'-триметилбіфеніл-3-іл}метокси)бензил]-1,2,4-оксадіазолідин-3,5-діон,
або її фармацевтично прийнятна сіль.
11. Фармацевтична композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій.
12. Фармацевтична композиція за п. 11, що являє собою агоніст GPR40.
13. Фармацевтична композиція за п. 11, що являє собою засіб, що стимулює секрецію інсуліну.
14. Фармацевтична композиція за п. 11, що являє собою засіб для профілактики і/або лікування діабету.
15. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для одержання агоніста GPR40, засобу, що стимулює секрецію інсуліну, або засобу для профілактики і/або лікування діабету.
16. Спосіб профілактики і/або лікування діабету, що включає введення пацієнту ефективної кількості сполуки за п. 1 або її солі.
Текст
УКРАЇНА (19) UA (11) 94455 (13) C2 (51) МПК (2011.01) C07D 271/06 (2006.01) A61K 31/4245 (2011.01) A61K 31/4439 (2011.01) A61P 3/08 (2006.01) A61P 3/10 (2006.01) A61P 43/00 C07D 413/12 (2006.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) ОКСАДІАЗОЛІДИНДІОНОВА СПОЛУКА 2 O R4 (I) (символи в представленій формулі представляють наступні значення: 1 0 z R : -Н, галоген, -R , галогенонижчий алкіл, -OR , 0 S-R або -О-галогенонижчий алкіл, 0 R : нижчий алкіл, z R : однакові або відмінні один від одного і кожний являє собою -Н або нижчий алкіл, (11) 94455 (13) C2 z L: *-нижчий алкілен-О-, *-нижчий алкілен-N(R )z або *-CON(R )-, де знак * у L означає зв'язування з кільцем А, кільце А: бензол, піридин, тіофен, піперидин, дигідропіридин, піримідин або тетрагідрохінолін, кільце В: бензол або піридин, 2 R : відповідно однакові або відмінні один від одно0 го і кожний являє собою -галоген, -R , галогенониz 0 жчий алкіл, -O-R , -S-R , -О-галогенонижчий алкіл, -О-нижчий алкіленарил або оксо, n: 0, 1 або 2, 3 0 0 R : -галоген, -R , -галогенонижчий алкіл, -OR , -S0 R , -О-галогенонижчий алкіл, -Х-(феніл, що може бути заміщений) або -Х- (гетероарил, що може бути заміщений), z X: простий зв'язок, О, S або N(R ), 4 R : -Н або нижчий алкіл, 1 4 або R і R разом можуть утворювати нижчий алкілен, за умови, що 2-{4-[2-(4-метил-6-оксо-2-пропілпіримідин-1(6Н)іл)етокси]бензил}-1,2,4-оксадіазолідин-3,5-діон і 2-{4-[2-(2-етил-4-метил-6-оксопіримідин-1(6Н)іл)етокси]бензил}-1,2,4-оксадіазолідин-3,5-діон виключаються). 2. Сполука за п. 1, де положення заміщення L у кільці В являє собою 4-положення. 3. Сполука за п. 2, де кільце А являє собою бензольне кільце. 3 4. Сполука за п. 3, де R являє собою феніл або піридил, що може бути відповідно заміщений. 5. Сполука за п. 4, де L являє собою *-СН2-О- або *-CH2-NH- (де * означає зв'язування з кільцем А). 4 6. Сполука за п. 5, де R являє собою -Н. 1 7. Сполука за п. 6, де R являє собою -Н, галоген 0 або R . 2 8. Сполука за п. 7, де n має значення 0, або R 0 являє собою галоген або R . 3 9. Сполука за п. 8, де R являє собою феніл, що заміщений групою, вибраною з класу, що включає UA (21) a200813478 (22) 23.04.2007 (24) 10.05.2011 (86) PCT/JP2007/058694, 23.04.2007 (31) 2006-118630 (32) 24.04.2006 (33) JP (46) 10.05.2011, Бюл.№ 9, 2011 р. (72) НЕГОРО КЕНДЗІ, JP, ІВАСАКІ ФУМІЙОСІ, JP, ОХНУКІ КЕЙ, JP, КУРОСАКІ ТОСІО, JP, ЙОНЕТОКУ ЯСУХІРО, JP, АСАІ НОРІО, JP, ЙОСІДА СІГЕРУ, JP, СОГА ТАКАТОСІ, JP (73) АСТЕЛЛАС ФАРМА ІНК., JP (56) JP 2005-015461 A JP 2002-503255 А JP 2002-515874 А JP 7-2848 А JP 8-59638 А JP 10-502907 А WO 2005/030203 A1 WO 94/25448 A1 (57) 1. Оксадіазолідиндіонова сполука, представлена наступною формулою (І), або її фармацевтично прийнятна сіль, O R1 (R2)n 4 O A L B NH N 3 R3 2 (19) 1 3 94455 z 4 -О-нижчий алкілен-OR , -О-нижчий алкілен z CON(R )2 і -O-нижчий алкілен-(циклоалкіл, що моz же бути заміщений групою -OR ), і може бути додатково заміщений 1 або 2 групами нижчий алкіл, 0 галоген або -OR . 10. Сполука за п. 1, що вибрана з групи, що включає 2-{[3'-({4-[(3,5-діоксо-1,2,4-оксадіазолідин-2іл)метил]фенокси}метил)-2,6-диметилбіфеніл-4іл]окси}-N-метилацетамід, 2-(4-{[4'-(2-гідроксіетокси)-2'-метилбіфеніл-3іл]метокси}бензил)-1,2,4-оксадіазолідин-3,5-діон, 2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2',6'диметилбіфеніл-3-іл]метокси}бензил)-1,2,4оксадіазолідин-3,5-діон, 2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2,2'диметилбіфеніл-3-іл]метокси}бензил)-1,2,4оксадіазолідин-3,5-діон, 2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2,2',6'триметилбіфеніл-3-іл]метокси}бензил)-1,2,4оксадіазолідин-3,5-діон, 2-{4-[(4'-{[(3R)-3-гiдpoкcибyтил]oкcи}-2,2'димeтилбiфeніл-3-іл)метокси]бензил}-1,2,4оксадіазолідин-3,5-діон, 2-{4-[(4'-{[(3S)-3-гідроксибутил]окси}-2,2'диметилбіфеніл-3-іл)метокси]бензил}-1,2,4оксадіазолідин-3,5-діон, 2-[4-({[4'-(3-гідрокси-3-метилбутокси)-2,2'диметилбіфеніл-3-іл]метил}аміно)бензил]-1,2,4оксадіазолідин-3,5-діон, 2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2'-метокси-2метилбіфеніл-3-іл]метокси}бензил)-1,2,4оксадіазолідин-3,5-діон, 2-{4-[(4'-{[(3R)-3-гідроксибутил]окси}-2,2'6'триметилбіфеніл-3-іл)метокси]бензил}-1,2,4оксадіазолідин-3,5-діон, 2-{4-[(4'-{[(3S)-3-гідроксибутил]окси}-2,2'6'триметилбіфеніл-3-іл)метокси]бензил}-1,2,4оксадіазолідин-3,5-діон, 2-[(6-{[4'-(3-гідрокси-3-метилбутокси)-2,2',6'триметилбіфеніл-3-іл]метокси}піридин-3іл)метокси]-1,2,4-оксадіазолідин-3,5-діон і 2-[4-({4'-[2-(1-гідроксициклопропіл)етокси]-2,2',6'триметилбіфеніл-3-іл}метокси)бензил]-1,2,4оксадіазолідин-3,5-діон, або її фармацевтично прийнятна сіль. 11. Фармацевтична композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. 12. Фармацевтична композиція за п. 11, що являє собою агоніст GPR40. 13. Фармацевтична композиція за п. 11, що являє собою засіб, що стимулює секрецію інсуліну. 14. Фармацевтична композиція за п. 11, що являє собою засіб для профілактики і/або лікування діабету. 15. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для одержання агоніста GPR40, засобу, що стимулює секрецію інсуліну, або засобу для профілактики і/або лікування діабету. 16. Спосіб профілактики і/або лікування діабету, що включає введення пацієнту ефективної кількості сполуки за п. 1 або її солі. Даний винахід належить до фармацевтичного засобу, зокрема, нової оксадіазолідиндіонової сполуки або її фармацевтично прийнятної солі, що є корисними як засіб, який стимулює секрецію інсуліну або засобу для профілактики/лікування діабету. Передумови винаходу Діабет являє собою захворювання, основним симптомом якого є хронічно високий рівень глюкози в крові, що утворюється в результаті абсолютної або відносної недостатності дії інсуліну. Клінічно, він грубо підрозділяється на інсулін-залежний цукровий діабет (IDDM) і інсулін-незалежний цукровий діабет (NIDDM). При інсулін-незалежному цукровому діабеті (NIDDM) зниження секреції інсуліну з панкреатичних β-клітин є однією з основних причин прояву захворювання, і зокрема, було визнано, що високий рівень глюкози в крові після прийому їжі виникає в результаті початкової стадії порушення секреції інсуліну. У недавній час великомасштабні клінічні дослідження підтвердили, що корекція високого рівня глюкози в крові після прийому їжі є важливою для прояву і супресії діабетичних ускладнень. Крім того, були повідомлення про те, що артеріосклероз розвивається на стадії тільки високого рівня глюкози в крові після прийому їжі, і що трохи підвищений рівень, який зберігається, глюкози в крові після прийому їжі підвищує показник смертності в результаті судинних захворювань і т.п. Це показує, що підвищений рівень глюкози в крові після прийому їжі с незалежним фактором ризику смерті від серцево-судинних захворювань, навіть коли він трохи підвищений. На підставі викладеної вище інформації, була визнана необхідність лікарської терапії від підвищеного рівня глюкози в крові після прийому їжі. В даний час основним напрямком з галузі засобів, що стимулюють секрецію інсуліну, є препарати сульфонілсечовини (SU), але відомо, що вони здатні викликати гіпоглікемію і призводять до вторинної інвалідності через виснаження підшлункової залози у випадку їхнього довгострокового введення. Крім того, SU препарати є ефективними для контролю рівня глюкози в крові в процесі прийому їжі, але дуже важко пригнічувати рівень глюкози в крові після прийому їжі. GPR40 являє собою зв'язаний з G білком рецептор, що був ідентифікований як рецептор жирних кислот і має високий рівень експресії в βклітинах підшлункової залози, і були повідомлення про те, що він пов'язаний з інсулін-секреторною дією жирної кислоти (непатентний посилальний документ 1). Отже, оскільки корекція високого рівня глюкози в крові після прийому їжі, як очікується, заснована на дії по стимуляції секреції інсуліну, агоніст GPR40 рецептора є корисною як засіб для профі 5 лактики/лікування інсулін-залежного цукрового діабету (IDDM), інсулін-незалежного цукрового діабету (NIDDM) і легких форм діабету пограничного типу (аномальні толерантність до глюкози і рівні глюкози в крові натщесерце). У посилальному патентному документі 1 повідомляється, що сполука, представлена формулою (А), яка включає широкий ряд сполук, має контролюючу GPR40 рецептор дію і є корисною як засіб, що стимулює секрецію інсуліну або засіб для профілактики/лікування діабету. Однак відсутнє будьяке ілюстративне розкриття сполуки, що має структуру оксадіазолідиндіону. (У представленій формулі, кільце Ρ являє собою ароматичне кільце, що може містити замісник, і кільце Q являє собою ароматичне кільце, що може додатково містити замісник, відмінний від X і Υ спейсери, і група, здатна до вивільнення катіону.) У посилальному патентному документі 2 повідомляється, що сполука, представлена формулою (В), має контролюючу GPR40 рецептор дію і є корисною як засіб, що стимулює секрецію інсуліну або засіб для профілактики/лікування діабету. Однак відсутнє будь-яке ілюстративне розкриття сполуки, що має структуру оксадіазолідиндіону. (Символи в представленій формулі див. у зазначеній публікації.) У посилальному патентному документі 3 повідомляється, що сполука, представлена формулою (С), має контролюючу GPR40 рецептор дію і є корисною як засіб, що стимулює секрецію інсуліну або засіб для профілактики/лікування діабету. Однак відсутнє будь-яке ілюстративне розкриття сполуки, що має структуру оксадіазолідиндіону. (Символи в представленій формулі див. у зазначеній публікації.) У посилальному патентному документі 4 повідомляється, що оксадіазолідиндіонова сполука, представлена формулою (D), має інгібувальну дію у відношенні інгібітору активації плазміногену (РАІ)-1 і є корисною дня лікування 94455 6 тромбів, фібриляції передсердя, ішемії міокарда, діабету і т.п. Однак відсутній будь-який опис її дії у відношенні GPR40 рецептора. (У представленій формулі, X являє собою Інші символи див. у зазначеній публікації) У посилальному патентному документі 5 повідомляється, що сполука, яка має дві оксадіазолідиндіонові структури, представлена формулою (Е), має дію посилення чутливості до інсуліну і є корисною для лікування діабету. Однак відсутній будь-який опис її дії на GPR40 рецептор. (Символи в представленій формулі див. у зазначеній публікації.) У посилальному патентному документі 6 повідомляється, що оксазолідиндіонова сполука, представлена формулою (F), має дію по зниженню рівня глюкози в крові і дію по зниженню рівня ліпідів у крові і є корисною для лікування діабету. Однак кільце, що відповідає оксадіазолідиндіону за даним винаходом, являє собою оксазолідиндіон. Крім тою, відсутній будь-який опис її дії у відношенні GPR40 рецептора. (Символи в представленій формулі див у зазначеній публікації.) У посилальному патентному документі 7 повідомляється, що оксадіазолідиндіонова сполука, представлена формулою (G), має дію по зниженню рівня глюкози в крові і є корисною для лікування діабету. Однак кільце, що відповідає кільцю А за даним винаходом, являє собою оксадіазольне кільце. Крім того, відсутній будь-який опис її дії на GPR40 рецептор. (Символи в представленій формулі див. у зазначеній публікації.) 7 У посилальному патентному документі 8 повідомляється, що сполука, представлена формулою (Н), має дію по зниженню рівня глюкози в крові і є корисною для лікування діабету. Однак відсутній будь-який опис її дії на GPR40 рецептор. (Символи в представленій формулі див. у зазначеній публікації.) У посилальному патентному документі 9 повідомляється, що оксадіазолідиндіонова сполука, представлена формулою (J), має дію по зниженню рівня глюкози в крові і є корисною для лікування діабету. Однак кільце, що відповідає кільцю А сполуки за даним винаходом, являє собою оксазол або тіазол. Крім того, відсутній будь-який опис її дії на GPR40 рецептор. (X у представленій формулі являє собою атом кисню або атом сірки. Інші символи див. у зазначеній публікації.) У посилальному патентному документі 10 повідомляється, що сполука, представлена формулою (К), є корисною від гіперліпемії, гіперглікемії, ожиріння і т.п. Однак кільце, що відповідає кільцю А сполуки за даним винаходом, являє собою морфолін або тіоморфолін. Крім того, відсутній будьякий опис її дії на GPR40 рецептор. (У представленій формулі являє собою атом кисню або атом сірки. Інші символи див. у зазначеній публікації.) У непатентному посилальному документі 2 повідомляється, що оксадіазолідиндіонова сполука, представлена формулою (L), має дію по зниженню рівня глюкози в крові і є корисною для лікування діабету. Однак кільце, що відповідає кільцю А сполуки за даним винаходом, являє собою (ді)азольне кільце. Крім того, відсутній будь-який опис її дії на GPR40 рецептор. 94455 8 (У представленій формулі, X являє собою О, S або Ν, Υ являє собою С або N, і n має значення 1 або 2. Інші символи див. у зазначеному посилальному документі.) Непатентний посилальний документ 1: Nature, (England), 2003, νol.422, рр.173-176 Непагентний посилальний документ 2: European Journal of Medicinal Chemistry, (France), 2001, vol.36, pp.31-42 Патентний посилальний документ 1: Міжнародна Публікація № 2004/041266 Патентний посилальний документ 2: Міжнародна Публікація № 2005/063729 Патентний посилальний документ 3: Міжнародна Публікація № 2005/063725 Патентний посилальний документ 4: Міжнародна Публікація № 2005/030203 Патентний посилальний документ 5: Міжнародна Публікація № 94/25448 Патентний посилальний документ 6: JP-A2000-212174 Патентний посилальний документ 7: Міжнародна Публікація № 95/30664 Патентний посилальний документ 8: Міжнародна Публікація № 97/41097 Патентний посилальний документ 9: Патент США № 5480896 Патентний посилальний документ 10: JP-A-72848 Розкриття винаходу Завдання, розв'язувані даним винаходом Даний винахід має на меті забезпечення нової сполуки, що має агоністичну дію у відношенні GPR40 рецептора і є корисною як засіб, що стимулює секрецію інсуліну або засіб для профілактики/лікування діабету. Засоби для вирішення завдань Автори даного винаходу провели всебічні дослідження сполук, що мають агоністичну дію у відношенні GPR40 рецептора, і виявили, що нові оксадіазолідиндіонові сполуки або їх солі мають відмінну агоністичну дію у відношенні GPR40 рецептора. Як результат, був створений даний винахід шляхом відкриття того, що оксадіазолідиндіонові сполуки мають відмінну дію по стимуляції секреції інсуліну і сильно інгібують підвищення рівня глюкози в крові після глюкозного навантаження. Таким чином, даний винахід належить до оксадіазолідиндіонової сполуки, представленої наступною формулою (І), або її фармацевтично прийнятної солі. (Символи в представленій формулі представляють наступні значення, 1 0 R : -Н, галоген, -R , галогено-нижчий алкіл. Z 0 OR , -S-R або -О-галогено-нижчий алкіл, 0 R : нижчий алкіл, z R : однакові або відмінні один від одного, і кожний являє собою -Н або нижчий алкіл, 9 94455 z L: *-нижчий алкілен-О-, *-нижчий алкілен-N(R )z або *-CON(R )-, де знак * у L означає зв'язування з кільцем А, кільце А: бензол, піридин, тіофен. піперидин, дигідропіридин, піримідин або тетрагідрохінолін, кільце В: бензол або піридин, 2 R : відповідно однакові або відмінні один від одного, і кожний являє собою -галоген, 0 Z 0 -R , галогено-нижчий алкіл, -OR , -S-R , -Огалогено-нижчий алкіл, -О-нижчий алкілен-арил або оксо, n: 0, 1 або 2, 3 0 0 R : -галоген, -R , -галогено-нижчий алкіл, -OR , 0 -S-R , -О-галогено-нижчий алкіл, -Х-(феніл, що може бути заміщений) або -Х-(гетероарил, що може бути заміщений), Z X: простий зв'язок, О, S або N(R ), 4 R : -Η або нижчий алкіл, 1 4 або R і R разом можуть утворювати нижчий алкілен, за умови, що 2-{4-[2-(4-метил-6-оксо-2-пропілпіримідин1(6Н)-іл)етокси]бензил}-1,2,4-оксадіазолідин-3,5діон і 2-{4-[2-(2-етил-4-метил-6-оксопилпіримідин1(6Н)-іл)етокси]бензил}-1,2,4-оксадіазолідин-3,5діон виключаються. Те ж застосовано до опису, що іде далі.) Крім того, дана заявка також належить до фармацевтичною засобу, зокрема, агоністу GPR40, в якому використовують оксадіазолідиндіонову сполуку, представлену загальною формулою (І), або її сіль як активний інгредієнт. Крім того, дана заявка також належить до застосування сполуки, представленої формулою (І), або її фармацевтично прийнятної солі для одержання агоністу GPR40, засобу, що стимулює секрецію інсуліну або засобу для профілактики і/або лікування діабету, і до способу профілактики і/або лікування діабету, що включає введення пацієнту ефективної кількості сполуки, представленої формулою (І), або її фармацевтично прийнятої солі. А саме, представлені (1) фармацевтична композиція, що містить сполуку, представлену формулою (І), або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій, (2) фармацевтична композиція, описана в п. (1), що являє собою агоніст GPR40, (3) фармацевтична композиція, описана в п. (1), що являє собою засіб, що стимулює секрецію інсуліну, (4) фармацевтична композиція, описана в п. (1), що являє собою засіб для профілактики і/або лікування діабету, (5) застосування сполуки, описаної в представленій формулі (І), або її фармацевтично прийнятної солі для одержання агоністу GPR40, засобу, що стимулює секрецію інсуліну, або засобу для профілактики і/або лікування діабету, (6) спосіб профілактики і/або лікування діабету, що включає введення пацієнту ефективної кількості сполуки, описаної в представленій формулі (І), або її фармацевтично прийнятної солі. Ефект даного винаходу 10 Фармакологічна активність сполуки за даним винаходом була підтверджена методами випробувань, описаними нижче. Метод випробування 1: визначення агоністичної дії у відношенні GPR40 і) Клонування GPR40 людини Повнорозмірну послідовність GPR40 одержували шляхом здійснення методу ПЛР відповідно до процедури, представленої нижче, з використанням геномної ДНК людини (Clontech) як матрицю. Олігонуклеотид, що складається з нуклеотидної послідовності, представленої як SEQ ID NО:1, використовували як прямий праймер, а олігонуклеотид складається з нуклеотидної послідовності, представленої як SEQ ID NО:2 - як зворотний праимер. У цьому зв'язку, нуклеотидну послідовність, що включає область розпізнавання ХbаI, додавали до відповідного 5'-кінця зазначених вище прямого праймера і зворотного праймера. ПЛР здійснювали в присутності 5% диметилсульфоксиду (DMSO) з використанням Taq ДНК полімерази (Eх Taq DNA polymerase; Takara Bio), шляхом повторення 30 разів циклу, що включає 94°С (15 секунд)/55°С (30 секунд)/72°С (1 хвилина). Як результат, був ампліфікований ДНК фрагмент близько 0,9 т.п.н. Цей ДНК фрагмент розщеплювали за допомогою Xbal і потім вставляли в ХbаI сайт плазміди pEF-BOSdhfr (Nucleic acids Research, 18, 5322, 1990), з одержанням, таким чином, плазміди pEF-BOS-dhfrGPR40. Нуклеотидну послідовність GPR40 гена в pEFBOS-dhfr-GPR40 визначали методом дидезокситермінатору з використанням ДНК секвенатору (АВІ 377 DNA Sequencer, Applied Biosystems). Нуклеотидна послідовність гена GPR40 являла собою таку ж, як нуклеотидна послідовність, представлена як SEQ ID NO:3. Нуклеотидна послідовність, представлена як SEQ ID NO:3, має відкриту рамку зчитування (ORF) з 903 основ, і амінокислотна послідовність, виведена з цієї ORF (300 амінокислот), являла собою таку ж, як амінокислотна послідовність, представлена як SEQ ID NO:4. іі) Одержання клітин зі стабільною експресією GPR40 Як клітини, що експресують білок GPR, використовували клітини СНО dhfr (дигідрофолатредуктаза(dhfr)-дефіцитні СНО клітини). Також, як плазміду, що експресує білок GPR40, використовували плазміду pEF-BOS-dhfr-GPR40, отриману на зазначеній вище стадії і). Клітини СНО dhfr вносили в середовище (MEM, що містить 10% фетальну телячу сироватку (FCS), з використанням 6-ямкового планшета (Asahi Techno Glass) і культивували протягом ночі до 80-90% конфлюентності, а потім використовували 2 мкг на ямку плазміди pEF-BOS-dhfr-GPR40 для перенесення генів з використанням реагенту для трансфекції (Lipofectamine 2000; Invitrogen). Після 24 годин культивування з моменту перенесення генів клітини розбавляли і знову вносили в середовище. У цьому випадку, середовище МЕМ, що містить 10% FCS, заміняли на середовище МЕМ, що містила 10% FCS, але не містила нуклеїнову кислоту. Після 20 днів культивування утворені, таким чи 11 94455 ном, колонії клітин окремо витягали і культивували з одержанням СНО клітин, що стабільно експресують GPR40. З них відбирали клітини, що мають високу реакційну здатність у відношенні внутрішніх лігандів - олеїнової кислоти і ліноленової кислоти. ііі) Визначення агоністичної дії у відношенні GPR40 У цьому випробуванні здійснювали вимірювання за допомогою FLIPR (зареєстрована торгова марка, Molecular Device) з використанням як показника зміни внутрішньоклітинної концентрації кальцію. Цей метод випробування описаний нижче. Штам СНО клітин, в якому відбувалася експресія GPR40 людини, вносили в 384-ямковий чорний планшет (Becton Dickinson) при щільності 6x10 клітин на ямку і культивували протягом ночі в СО2 інкубаторі. З використанням набору для аналізу Calcium-3 (Molecular Device), одну колбу з фосфоресцентним пігментом розчиняли в 10 мл буферу HBSSHEPES (рН 7.4, 1 х HBSS, 20 мМ HEPES, Invitrogen). 35,68 мг пробенециду (Sigma) розчиняли в 250 мкл 1М NaOH і регулювали шляхом додавання 250 мкл буфера HBSS-HEPES. Розчин фосфоресцентного пігменту одержували шляхом змішування 16 мл буфера HBSS-HEPES, 640 мкл фосфоресцентного пігменту і 32 мкл пробенециду на один планшет. Середовище зливали з планшета і розчин фосфоресцентного пігменту розподіляли по 40 мкл на ямку і потім інкубували при кімнатній температурі протягом 2 годин. Кожну випробовувану сполуку розчиняли в DMSO і потім розводили буфером HBSS-HEPES і розподіляли по 10-мкл порціях у планшет, починаючи, таким чином, реакцію, і зміни внутрішньоклітинної концентрації кальцію вимірювали за допомогою FLIPR. Значення ЕС50 для кожної випробовуваної сполуки розраховували за допомогою кривої дозавідповідь за змінами інтенсивності флуоресценції через 1 хвилину вимірювань. Результати випробування представлені в таблиці 1. Приклад являє собою номер приклада сполуки, описаної нижче. 12 166 173 189 193 406 Метод випробування 2: дія по стимуляції секреції інсуліну з використанням клітин ΜΙΝ6 У цьому випробуванні досліджували дію випробовуваних сполук по прискоренню секреції інсуліну з використанням штаму β-клітин підшлункової залози миші, клітин ΜΙΝ6. Цей метод випробування описаний нижче. 4 ΜΙΝ6 клітини розподіляли при щільності 5х10 клітин/ямку (200 мл) у 96-ямковий планшет. Як середовище використовували DMEM (25 мМ глюкози), що містить 10% FBS, 55 мкМ 2меркаптоетанолу, 100 Од/мл пеніциліну і 100 мкг/мл стрептоміцину. Середовище зливали через 2 дні з використанням аспіратора, з наступним однократним промиванням 200 мкл KRB-HEPES (116 мМ NaCl, 4,7 мМ КС1, 1,2 мМ КН2РО4, 1,2 мМ MgSO4, 0,25 мМ СаСl2, 25 мМ NaHCO3, 0,005% BSA без FFA, 24 мМ HEPES (рН 7,4)), що містить 2,8 мМ глюкози, що був нагрітий до 37С, а потім знову інкубували при 37°С протягом 1 години шляхом додавання 200 мкл цього ж буфера. Після того, як зазначений вище буфер зливали, використовуючи аспіратор, і знову промивали буфером (200 мкл), попередньо визначену концентрацію випробовуваної сполуки додавали до KRB-HEPES, що містить 2,8 мм або 22,4 мм глюкози, і додавали у відповідні ямки порціями по 100 мкл і інкубували при 37°С протягом 2 годин. Зазначені вище зразки розділяли на фракції і розбавляли 100-кратні. і концентрацію інсуліну визначали з використанням набору інсулін R1A (Amersham RI). Активність показана у вигляді значення відносної активності (%) на момент 1 мкм кожної сполуки, виходячи з 100% контролю (DMSO). Результати випробування представлені в таблиці 2. У результаті було підтверджено, що сполука за даним винаходом має відмінну дію, що стимулює секрецію інсуліну. Таблиця 1 Приклад 4 8 9 14 16 33 38 39 44 47 56 60 82 99 117 119 ЕС50 (мкМ) 0,35 0,031 0,80 0,39 0,45 0,64 0,65 0,26 0,67 0,420,76 0,46 0,93 0,45 0,29 0,22 0,22 0,66 0,059 0,52 0,12 Таблиця 2 Приклад 4 34 38 39 44 Дія по стимуляції секреції інсуліну (%) 177 169 228 192 287 Метод випробування 3: випробування толерантності до глюкози при однократному пероральному введенні здоровим мишам У цьому випробуванні досліджували дію випробовуваних сполук по пригніченню глюкози в крові після глюкозного навантаження з використанням здорових мишей. Цей метод випробування описаний нижче. Самців мишей ICR (вік 6 тижнів) після 1 тижня попереднього виведення піддавали голодуванню 13 94455 протягом ночі і використовували як випробовуваних тварин. Кожну випробовувану сполуку суспендували в 0,5% метилцелюлозі і перорально вводили при дозі 10 мг/кг за 30 хвилин до глюкозного навантаження (2 г/кг). Введення 0,5% метилцелюлози використовували для контрольної групи. Зниження рівня глюкози в крові (%) через 30 хвилин після глюкозного навантаження розраховували на підставі контрольної групи. Результати випробування представлені в таблиці 3, У результаті було підтверджено, що сполука за даним винаходом має відмінну дію по зниженню рівня глюкози в крові. Таблиця 3 Приклад 14 39 44 47 56 60 117 119 166 173 189 193 406 Показник зниження рівня глюкози в крові (%) 34 26 21 36 31 13 21 22 35 21 30 46 42 Як результат описаних вище відповідних випробувань, очевидно, що сполука за даним винаходом має відмінну агоністичну дію у відношенні GPR40 і тому є корисною як засіб, що стимулює секрецію інсуліну або засіб для профілактики/лікування захворювання, де задіяний GPR40, такого як діабет (інсулін-залежний цукровий діабет (IDDM). інсулін-незалежний цукровий діабет (NIDDM) і легкі форми діабету пограничного типу (аномальні толерантність до глюкози і рівні глюкози в крові натщесерце)) і т.п. Переважний спосіб здійснення винаходу Нижче представлений докладний опис даного винаходу. У представленому описі, "алкіл" і "алкілен" означають лінійні або розгалужені вуглеводневі ланцюги. "Нижчий алкіл", переважно, являє собою алкільну групу, що містить від 1 до 6 атомів вуглецю (далі зазначена як С1-6), більш переважно С1-4 алкіл, і ще більш переважно метил і етил. "Нижчий алкініл", переважно, являє собою лінійну або розгалужену С2-6 алкінільну групу, і ілюстративно можна вказати етиніл, пропініл, бутиніл, пентиніл, 1-метил-2-пропініл, 1,3-бутадиніл, 1,3 14 пентадиніл або т.п. Більш переважним є С2-4 алкініл, і особливо переважним є етиніл або пропініл. "Нижчий алкілен" означає двовалентну групу (С1-6 алкілен), в якій один необов'язковий водень вилучений із зазначеного вище "нижчого алкілу", і, переважно, являє собою С1-4 алкілен, більш переважно метилен, етилен, триметилен, пропіл або диметилметилен, і ще більш переважно метилен або етилен. "Галоген" означає F, СІ, Вr і І. "Галогено-нижчий алкіл", переважно, являє собою С1-6 алкіл, заміщений щонайменше одним галогеном, більш переважно галогено С1-3 алкіл, ще більш переважно фторметил, дифторметил, трифторметил, 1,1-дифторетил, 2,2,2трифторетил або 3,3,3-трифторпропіл, більш переважно трифторметил, 1,1-дифторетил або 2,2,2трифторетил. "Циклоалкіл" являє собою С3-10 насичену вуглеводневу кільцеву групу, що може містити місток. Ілюстративно, можна вказати циклопропіл, циклобутил, циклопентип, циклогексил, циклогептил, циклооктил, адамантил або т.п. Переважним є С3-6 циклоалкіл, циклопропіл, і ще більш переважним є циклопропіл, циклобутил, циклопентил або циклогексил. "Циклоалкеніл" являє собою С3-15 циклоалкеніл, що може містити місток, і включає кільцеву групу, конденсовану з бензольним кільцем на ділянці подвійного зв'язку. Ілюстративно можна вказати циклопентеніл, циклоненгадієніл, циклогексеніл, циклогексадієніл, 1-тетрагідронафтил, 1інденіл, 9-флуореніл або т.п. Переважним є С5-10 циклоалкеніл, і більш переважним є циклопентеніл, циклогексеніл, 1-інденіл або 1тетрагідронафтил. "Арил" являє собою С6-14 ароматичний вуглеводневий радикал, переважно, феніл, нафтил або тетрагідронафтил, і більш переважним є феніл. "Гетероарил" означає групу, що містить кільце, вибране з і) моноциклічного 5- або 6-членного ароматичного гетерокільця, що містить від 1 до 4 гетероатомів, вибраних з О, S і N, іі) біциклічного гетерокільця, в якому гетерокільця, зазначені в представленому вище і), є конденсованими по кільцю, де конденсовані кільця можуть бути однакові або відмінні один від одного, і ііі) біциклічного гетерокільця, в якому гетерокільце, зазначене в представленому вище і), є конденсованим з бензольним кільцем або 5-7-членним циклоалканом. Як приклад кільця, що складає зазначену групу, можна вказати, наприклад, і) піридин, піразин, піримідин, піридазин, імідазол, пірол, тіофен, фуран, триазин, триазол, тіазол, тіадіазол, оксадіазол, піразол, ізотіазол, оксазол, ізоксазол, іі) нафтиридин, імідазопіридин, піролопіримідин, тієнопіридин, тієнопіролін, ііі) хінолін, бензімідазол, бензофуран, бензотіофен, бензотіадіазол, бензотіазол, бензоізотіазол, бензоксазол, бензоізоксазол, хінолін, ізохінолін, 5,6,7,8-тетрагідрохінолін, 5,6,7,8тетрагідроізохінолін, хіназолін, хіноксалін, фталазин, індол, ізоіндол, тетрагідробензімідазол, хроман і індазол. Крім того, оксидо може бути утворений через окислення атомів S або N кільця. 15 Переважним є зазначене вище і) моноціклічне ароматичне гетерокільце. "Гетерокільце" або "гетерокільцева група" означає групу, що містить кільце, вибране з і) моноциклічного 4-8-членного, переважно з 5-7членного, насиченого, ненасиченого або частково ненасиченого гетерокільця, що містить від 1 до 4 гетероатомів, вибраних з О, S і N, іі) біциклічного гетерокільця, в якому гетерокільця, зазначені в представленому вище і), є конденсованими по кільцю, де конденсовані кільця можуть бути однакові або відмінні один від одного, і ііі) біциклічного гетерокільця, в якому гетерокільце, зазначене в представленому вище і), є конденсованим з бензольним кільцем або 5-7-членним циклоалканом. Як приклад кільця, що складає зазначену групу, можна вказати, наприклад, і) азетидин, піперидин, піролідин, піперазин, азепан, діазепан, морфолін, тіоморфолін, діоксан, діоксолан, піразолін, піперидин, піперазин, оксетан, тетрагідрофуран, дигідропіридин, піридин, піразин, піримідин, піридазин, імідазол, пірол, тіофен, фуран, триазин, триазол, тіазол, тіадіазол, оксадіазол, піразол, ізотіазол, оксазол, ізоксазол, іі) хинуклідин, нафтиридин, імідазопіридин, піролопіримідин, тієнопіридин, тієнопіролін, ііі) дигідробензофуран, 1,2,3,4тетрагідрохінолін, 1,2,3,4-тетрагідроізохінолін, дигідробензофуран, бензодіоксолан, індолін, індазолін, хінолін, бензімідазол, бензофуран, бензотіофен, бензотіадіазол, бензотіазол, бензоізотіазол, бензоксазол, бензоізоксазол, ізохінолін, 5,6,7,8тетрагідрохінолін, 5,6,7,8-тетрагідроізохінолін, хіназолін, хіноксалін, фталазин, індол, ізоіндол, тетрагідробензімідазол, хроман і індазол. Крім того, оксидо або діоксидо можуть бути утворені через окислення атома S або N кільця. Переважним є зазначене вище і) моноціклічне гетеро кільце. Термін "може бути заміщений" означає "незаміщений" або "заміщений однаковими або відмінними один від одного 1-5 замісниками". "Заміщений" означає "що має однакові або відмінні один від одного 1-5 замісників". Переважною як прийнятний замісник "фенілу, що може бути заміщений" і "гетероарилу, що може 3 бути заміщений" у R є група, вибрана з групи G, представленої нижче. 0 Група G: галоген, -CN, -R , галогено-нижчий Z Z алкіл, -OR , -О-галогено-нижчий алкіл, -N(R )COZ Z Z R , -CO2R , -CON(R )2, -CO-гетерокільцева група, z z CON(R )-нижній алкініл, -СОN(R )-циклоалкіл, z СОN(R )-циклоалкеніл, z СОN(циклоалкіл)(гетерокільцева група), - СОN(R )0 0 0 гетерокільцева група, -S-R , -SO2-R , -O-S(O)2-R , О-S(О)2-галогено-нижчий алкіл, нижчий алкіленz z OR , нижчий aлкiлeн-O-COR , нижчий алкіленz z z N(R )2,· нижчий aлкiлeн-N(R )CO-R , нижчий алкі2 z лен-COR ; нижчий алкілен-CO2R , нижчий алкіленz z CON(R )2, -О-нижчий алкілен-OR , -О-нижчий алкіz z лен-О-СОR , -О-нижчий алкілен-N(R )2, -О-нижчий z z z aлкiлeн-N(R )CO-R , -О-нижчий алкілен-N(R )СО20 z R , -О-нижчий алкілен-CO-R , -О-нижчий алкіленz z СО2-R , -О-нижчий aлкiлeн-CON(R )2, -О-нижчий z алкілен- СОN(R )-(нижчий алкіл, що може бути z 0 заміщений групою –OR ), -О-нижчий алкілен-SR , О-нижчий алкілен-цилоалкіл, -О-нижчий aлкiлeн 94455 16 z CON(R )-циклоалкіл, -О-гетерокільцева група, -Онижчий алкілен-гетерокільцева група, -О-нижчий алкілен-СО-гетерокільцева група, -О-нижчий алкіz z лен-CON(R )-гетерокільцева група, -N(R )COz z нижчий алкеніл-OR , -CON(R )-гaлoгeнo-нижчий z алкіл, -CON(R )-(нижчий алкіл, заміщений групою Z z z OR ), -CON(R )-нижчий алкілен-CN, -CON(R )z нижчий алкілен-О-нижчий aлкiлeн-OR , z z CON(нижчий aлкiлeн-OR )2, - СОN(R )-нижчий z z Z aлкiлeн-O-COR , -CON(R )-нижчий алкілен-N(R )2, z z z z - СОN(R )-нижчий aлкiлeн-N(R )CO-R , -CON(R )z z нижчий алкілен-COR , -CON(R )-нижчий алкіленz z z СО2R , -CON(R )-нижчий aлкiлeн-CON(R )2, Z z z CON(R )-нижчий алкілен-SO2R , -CON(R )-нижчий z алкілен-циклоалкіл, -CON(R )-нижчий алкілен-Оz циклоалкіл, - СОN(R )-нижчий алкілен-арил, z CON(R )-(нижчий алкілен, заміщений групою z z N(R )2)-apил, - СОN(R )-нижчий алкілен-О-арил, Z z z CON(R )-нижчий алкілен-N(R )-арил, СОN(R )нижчий алкілен-СО-арил, -СОN(нижчий алкіленz z ОR )-нижчий алкілен-арил, СОN(R )-нижчий алкіz лен-гетерокільцева група, СОN(R )-нижчий алкіz лен-О-гетерокільцева група, - СОN(R )-нижчий z z алкілен-N(R )-гетерокшьцева група, СОN(R )нижчий алкілен-СО-гетерокільцева група, z СОN(нижчий алкілен-ОR )-нижчий алкіленгетерокільцева група, -СON(нижчий алкілен-СN)нижчий алкілен-гетерокільцева група і СОN(нижчий алкілен-гетерокільцева група)2. У цьому відношенні, у групі G нижчий алкілен Z може бути заміщений галогеном або -OR , і циклоалкільна, циклоалкенільна, арильна і гетерокільцева група можуть бути заміщені групою, виб1 раною з представленої нижче групи G . 1 0 Група G : галоген, ціано, -R , галогено-нижчий Z Z алкіл, -OR , -О-галогено-нижчий алкіл, -N(R )2, -S0 0 Z z z R , -SO2-R , -SO2N(R )2, -CO-R , -CON(R )2, Z z Z Z CON(R )- нижчий алкілен-OR , -N(R )CO-R , оксо, z нижчий алкілен-CN, нижчий алкілен-OR , -арил, (нижчий алкілен, що може бути заміщений групою z -OR )-арил, нижчий алкілен-О-арил, гетерокільцева група і нижчий алкілен-гетерокільцева група. У цьому відношенні, арил і гетерокільцева гру1 па в ірупі G можуть бути заміщені групою, вибра2 ною з представленої нижче групи G . 2 Група G : галоген, ціано, галогено-нижчий алZ кіл, -OR , -О-галогено-нижчий алкіл і оксо. Переважною як прийнятний замісник для "фенілу, що може бути заміщений" і "гетероарилу, що 3 може бути заміщений" у R , більш переважно, є 3 група з представленої нижче групи G . 3 0 Група G : галоген, -R , галогено-нижчий алкіл, Z Z Z -OR , -CON(R )2, -CON(R )-гетерокільцева група, 0 z O-S(O)2-R , -О-нижчий алкілен-OR , -О-нижчий Z z алкілен-О-COR , -О-нижчий алкілен-N(R )2, -Оz z нижчий aлкiлeн-N(R )CO-R , -О-нижчий алкілен0 z СО2R , -О-нижчий алкілен-СОN(R )-2, -О-нижчий z aлкiлeн-CON(R )-(нижчий алкіл заміщений групою Z 0 OR ), -О-нижчий алкілен-SR , -О-нижчий алкіленz циклоалкіл, -О-нижчий aлкiлeн-CON(R )циклoaлкiл, -О-нижчий алкілен-гетерокільцева груz па і -О-нижчий алкілен- СОN(R )-гетерокільцева група. У цьому відношенні, нижчий алкілен у групі G3 Z може бути заміщений галогеном або -OR , і цик 17 лоалкіл і гетерокільцева група можуть бути заміщені групою, вибраною з зазначеної вище групи 1 G. Переважною як прийнятний замісник "фенілу, що може бути заміщений" і "гетероарилу, що може 3 бути заміщений" у R , ще більш переважно, є гру0 Z па, вибрана з галогену, -R -OR , -О-галогеноz нижчого алкілу, групи -О-нижчий алкілен-OR , груz пи -О-нижчий алкілен- СОN(R )2 і групи -О-нижчий алкілен-(циклоалкіл, що може бути заміщений груZ пою -OR ). Переважний як прийнятний замісник для "фенілу, що може бути заміщений" і "гетероарилу, що 3 може бути заміщений" у R , більш переважно, є 2 О-нижчий алкілен-OR , О-нижчий алкіленz CON(R )2 або -О-нижчий алкілен-(циклоалкіл, що Z може бути заміщений групою -OR ). Переважний варіант втілення даного винаходу представлений нижче. 1 0 (a) Переважним як R є -Н, -галоген або -R , більш переважно -Н. 2 0 (b) Переважним як R є -галоген, -O-R , або 0 0 R , більш переважно -галоген або -R . (c) Переважним як n є 0 або 1. 3 (d) Переважним як R є -Х-(феніл, що може бути заміщений) або -X-(гетероарил, що може бути заміщений), більш переважно - або феніл піридил, що, відповідно, може бути заміщений, ще більш переважно - феніл, що може бути заміщений, ще більш переважно - феніл, що може бути заміще3 ний групою, вибраною з зазначеної вище групи О , особливо переважно - феніл, що заміщений групою, вибраною з класу, що включає -О-нижчий z z aлкiлeн-OR , -О-нижчий anKmeH-CON(R )2 і -Онижчий алкілен-(циклоалкіл, що може бути заміZ щений групою -OR ), і може бути додатково замі0 0 щений R , або галогеном -OR . 4 (e) Переважним як R є -Н. (f) Переважним як кільце А є бензольне кільце, піридинове кільце або тіофенове кільце, більш переважно бензольне кільце. (g) Переважним як кільце В є бензольне кільце. (п) Переважним як L є *- нижчий алкілен-Оабо *- нижчий алкілен-NH-, більш переважно *СН2-О- або *-CH2-NH- (де * означає зв'язування з кільцем А). Крім того, як положення заміщення L у 4 кільці В, 4-положення відносно -CH(R )-(3,5-діоксо1,2,4-оксадіазолін-2-іл) є переважним. Як інший переважний варіант втілення, сполуку, що містить комбінацію переважних груп, описаних у представлених вище пп. (a)-(h), є переважним. Також, ще один переважний варіант втілення сполуки за даним винаходом, представленої загальною формулою (І), представлений нижче. (1) Сполука, описана загальною формулою (І), де положення заміщення L у кільці В являє собою 4-положення. (2) Сполука, описана в п. (1), де кільце А являє собою бензольне кільце. 3 (3) Сполука за п. (2), де R являє собою або феніл піридил, що може бути відповідно заміщений. 94455 18 (4) Сполука, описана в п. (3), де L являє собою *-СН2-О- або *-CH2-NH- (де * означає зв'язування з кільцем А). 4 (5) Сполука за п. (4), де R являє собою -Н. 1 (6) Сполука, описана в п. (5), де R являє со0 бою -Н, галоген або R . (7) Сполука, описана в п. (6), де n має значен2 0 ня 0, або R являє собою або галоген R . 3 (8) Сполука за п. (7), де R являє собою феніл, що заміщений групою, вибраною з класу, що z включає -О-нижчий алкілен-OR , -О-нижчий алкіZ лен-CON(R )2 і -О-нижчий алкілен-(циклоалкіл, що Z може бути заміщений групою -OR ), і може бути додатково заміщений 1 або 2 групами нижчий ал0 кіл, галоген або -OR . (9) Сполука, описана формулою (І), що вибрана з групи, яка включає 2-{[3'-({4-[(3,5-діоксо-1,2,4-оксадіазолідин-2іл)метил]фенокси}метил)-2,6-диметилбіфеніл-4іл]окси}-N-метилацетамід, 2-(4-{[4'-(2-гідроксіетокси)-2'-метилбіфеніл-3іл]метокси} бензил)-1,2,4-оксадіазолідин-3,5-діон, 2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2',6'диметилбіфеніл-3-іл]метокси} бензил)-1,2,4оксадіазолі дин-3,5 -діон, 2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2,2'диметилбіфеніл-3-іл]метокси}бензил)-1,2,4оксадіазолідин-3,5-діон, 2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2,2',6'триметилбіфеніл-3-іл]метокси}бензил)-1,2,4оксадіазолідин-3,5-діон, 2-{4-[(4’-{[(3R)-3-гiдpoкcибyтил]oкcи}-2,2’димeтилбiфeнiл-3-іл)метокси]бензил}-1,2,4оксадіазолідин-3,5-діон, 2-{4-[(4'-{[(3S)-3-гідроксибутил]окси}-2,2'диметилбіфеніл-3-іл)метокси]бензил}-1,2,4оксадіазолідин-3,5-діон, 2-[4-({[4'-(3-гідрокси-3-метилбутокси)-2,2'диметилбіфеніл-3-іл]метил}аміно)бензил]-1,2,4оксадіазолідин-3,5-діон, 2-(4-{[4'-(3-гідрокси-3-метилбутокси)-2'метокси-2-метилбіфеніл-3-іл]метокси}бензил)1,2,4-оксадіазолідин-3,5-діон, 2-{4-[(4'-{[(3R)-3-гідроксибутил]окси}-2,2'6'триметилбіфеніл-3-іл)метокси]бензил}-1,2,4оксадіазолідин-3,5-діон, 2-{4-[(4'-{[(3S)-3-гідроксибутил]окси}-2,2'6'триметилбіфеніл-3-іл)метокси]бензил}-1,2,4оксадіазолідин-3,5-діон, 2-[(6-{[4'-(3-гідрокси-3-метилбутокси)-2,2',6'триметилбіфеніл-3-іл]метокси}піридин-3іл)метокси]-1,2,4-оксадіазолідин-3,5-діон і 2-[4-({4'-[2-(1-гідроксициклопропіл)етокси]2,2',6’-триметилбіфеніл-3-іл}метокси)бензил]-1,2,4оксадіазолідин-3,5-діон, або її фармацевтично прийнятна сіль. Існують випадки, коли сполука за даним винаходом, представлена формулою (І), утворює сіль, і така сіль включена в сполуку за даним винаходом, за умови, що вона являє собою фармацевтично прийнятну сіль. Ілюстративно, можна вказати як приклад кислотно-адитивні солі з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, азотна кислота, фосфорна 19 кислота і т.п., або органічними кислотами, такими як мурашина кислота, оцтова кислота, пропіонова кислота, щавлева кислота, малонова кислота, бурштинова кислота, фумарова кислота, малеїнова кислота, молочна кислота, яблучна кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, птолуолсульфонова кислота, аспарагінова кислота, глутамінова кислота і т.п., солі з неорганічними основами, що містять метали (наприклад, натрій, калій, кальцій, магній і т.п.), або з органічними основами, такими як метиламін, етиламін, етаноламін, лізин, орнітин і т.п., солі амонію і т.п. Крім того, сполука за даним винаходом в деяких випадках може містити асиметричний атом вуглецю, залежно від типу замісників, і на підставі цього можуть бути присутніми оптичні ізомери. Даний винахід включає всі суміші і виділені форми цих оптичних ізомерів. Також, у деяких випадках можуть бути присутнім таутомери в сполуці за даним винаходом, і даний винахід включає розділені форми цих ізомерів або їх суміші. Крім того, даний винахід також включає мічену речовину, а саме, сполуку, в якій щонайменше один атом сполуки за даним винаходом заміщений радіоізотопом або нерадіоактивним ізотопом. Крім того, різні типи гідратів і сольватів і поліморфізм сполуки за даним винаходом також включені в даний винахід. У цьому зв'язку, повинно бути зрозуміло, що сполука за даним винаходом не обмежується сполуками, описаними в прикладах, які представлені нижче, і всі сполуки, представлені формулою (І), і їх фармацевтично прийнятні солі включені в даний винахід. У цьому зв'язку, усі сполуки, що перетворяться в сполуки за даним винаходом в живому організмі, так називані проліками, також включені в сполуку за даним винаходом. Як групи, що утворюють проліки сполук за даним винаходом, можна вказати як приклад групи, описані в "Progress in Medicine", Lifescience Medica, 1985, vol.5, pp.2157-2161, і групи, описані в "Iyakuhin no Kaihatsu (Development of Medicines)", vol.7 Bunshi Sekkei (Molecular Design), pp. 163-198, опублікований Hirokawa Shoteny 1990. (Способи одержання) Сполуку за даним винаходом і її фармацевтично прийнятну сіль можна одержати з використанням різних традиційно відомих способів синтезу, використовуючи характеристики, засновані на її основному скелеті або типі замісників. Типові способі одержання наведені як приклад нижче. У цьому зв'язку, залежно від типу функціональної групи, існує ефективний спосіб, з погляду технології виробництва, заміщення зазначеної функціональної групи відповідною захисною групою, а саме, групою, що може бути легко перетворена в зазначену функціональну групу, на стадії вихідної речовини до проміжної сполуки. Потім, бажана сполука може бути отримана шляхом видалення захисної групи, як це буде необхідно в кожному конкретному випадку. Як таку функціональну групу можна вказати гідроксильну групу, карбоксильну групу, аміногрупу і т.п., а як їх захисні групи - захисні групи, описані, наприклад, у "Protective Groups in Organic Synthesis" (USA) third edition, edited by Greene and 94455 20 Wuts, John Wiley & Sons, 1999, що, необов'язково, можна використовувати відповідно до реакційних умов. Спосіб одержання 1: реакція циклізації (У представленій формулі, Lv являє собою групу, що видаляється. Те ж застосовано до опису, що іде далі.) Цей спосіб одержання являє собою спосіб, в якому сполуку (І) за даним винаходом одержують шляхом реакції циклізації сполуки (1) і сполуки (2). Як удаляемой групу Lv, переважною групою є галоген (наприклад, хлор, або бром т.п.) або алкоксигрупа (наприклад, метокси, етокси або т.п.). Реакцію можна здійснити з використанням сполуки (1) і сполуки (2) в еквівалентних кількостях, або з використанням однієї з них у надлишковій кількості, при охолодженні, при кімнатній температурі або при нагріванні, у розчиннику, такому як прості ефіри (наприклад, діетиловий ефір, тетрагідрофуран (ТГФ), діоксан, диметоксіетан (DME) або т.п.), галогеновані вуглеводні (наприклад, дихлорметан, 1,2-дихлоретан, або хлороформ т.п.), ароматичні вуглеводні (наприклад, бензол, толуол, або ксилол т.п.), або т.п. Коли сполука (1) містить гідроксильну групу, відмінну від гідроксіаміногрупи, цю гідроксильну групу в деяких випадках піддають карбамоїлуванню. Видалення карбамоїльної групи можна здійснити способом, зазвичай використовуваним фахівцями в даній галузі для де-карбамоїлування. Наприклад, це можна здійснити в розчиннику, такому як спирти (наприклад, метанол, етанол або т.п.), вода або т.п., при охолодженні, при кімнатній температурі або при нагріванні, з використанням основи, такої як метоксид натрію, натрію етоксид, гідроксид натрію або т.п. Спосіб одержання 2: реакція сполучення (У представленій формулі, будь-який один з 1 2 Lv і Lv являє собою або галоген трифторметилсульфонілоксигрупу, а іншим являє собою -В(ОН)2, 00 0 -B(OR )2 або – Sn 3, Аr являє собою або феніл гетероарил, що може бути відповідно заміщений, і 00 00 R являє собою нижчий алкіл, або два R разом утворюють нижчий алкілен. Те ж застосовано до опису, що іде далі). Цей спосіб одержання являє собою спосіб, в якому сполуку (I-а) за даним винаходом одержують шляхом реакції сполучення сполуки (3) і сполуки (4). Реакцію можна здійснити з використанням паладієвого комплексу, такого як тетракистрифенілфосфінпаладій, ацетату паладію або т.п. як каталізатор і з використанням сполуки (3) і сполуки (4) в еквівалентних кількостях, або з використанням 21 одного з них у надлишковій кількості, при охолодженні, при кімнатній температурі або при нагріванні, у розчиннику, такому як прості ефіри, спирти, галогеновані вуглеводні, ароматичні вуглеводні, вода або т.п. Крім того, у деяких випадках для забезпечення рівного протікання реакції вигідне здійснення реакції в присутності основи, такої як карбонат натрію, карбонат цезію, третбутоксид або натрію т.п., або літієвої солі, такої як хлорид літію, бромід або літію т.п. Спосіб одержання 3: відновне амінування (У представленій формулі, Alk являє собою 10 нижчий алкілен, і R являє собою або зв'язок С1-5 11 алкілен, і R являє собою Η або С1-5 алкіл. Однак 10 11 кількість атомів вуглецю в R і R у цілому складає від 0 до 5. Те ж застосовано до опису, що іде далі.) Цей спосіб одержання являє собою спосіб, в якому сполуку (І-b) за даним винаходом одержують, піддаючи сполуку (5) і сполуку (6) відновному амінуванню. Реакцію здійснюють з використанням сполуки (5) і сполуки (6) в еквівалентних кількостях, або з використанням однієї з них у надлишковій кількості, і при перемішуванні, у присутності відновника й у реакційно-інертному розчиннику, при температурі від -45°С до температури кипіння зі зворотним холодильником, переважно при температурі від 0°С до кімнатної температури, зазвичай протягом часу від 0,1 години до 5 днів. Як розчинник у цьому випадку, наприклад, можна вказати спирти, прості ефіри або їх суміші. Як відновлювач можна вказати ціаноборгідрид натрію, триацетоксиборгідрид натрію, боргідрид натрію і т.п. У деяких випадках переважне здійснення реакції в присутності дегідруючого агента, такого як молекулярні сита або т.п., або кислоти, такої як оцтова кислота, хлористоводнева кислота, комплекс ізопропоксиду титану(ІV) або т.п. Залежно від реакції, коли імінову сполуку, що утворюється в реакційній системі як проміжна сполука, можна виділяти стабільним чином, реакцію відновлення можна здійснювати окремо після одержання зазначеної імінової сполуки. Спосіб одержання 4: амідування 94455 22 Цей спосіб одержання являє собою спосіб, в якому сполуку (1-c) за даним винаходом одержують, піддаючи сполуку (7) і сполуку (6) амідуванню. Замість карбоновокислотної сполуки (7), також можна використовувати її реакційноздатне похідне. Реакцію можна здійснити з використанням карбоновокислотної сполуки (7) або її реакційноздатного похідного й аміносполуки (6) в еквівалентних кількостях, або з використанням одного з них у надлишковій кількості, при охолодженні, при кімнатній температурі або при нагріванні, у розчиннику, такому як ароматичні вуглеводні, галогеновані вуглеводні, прості ефіри, Ν,Ν-диметилформамід (ДМФА), Ν,Ν-диметилацетамід (DMA), 1метилпіролідин-2-он (NMP), диметилсульфоксид (DMSO), етилацетат, піридин, ацетонітрил або т.п. Коли використовують карбоновокислотну сполуку (7), переважно використовувати Ν,Ν'дициклогексилкарбодіімід (DCC), PS-карбодіімід (Argonaut, USA), 1-[3-(диметиламіно)пропіл]-3етилкарбодіімід (WSC), 1,1’-карбонілбісімідазол (CDI), Ν,Ν'-дисукцинімідилкарбонат, Вор реагент (Aldrich, USA), 2-(1Н-бензотриазол-1-іл)-1,1,3,3тетрафторборат тетраметилуронію (TBTU), гексафторфосфат 2-(1Н-бензотриазол-1-іл)-1,1,3,3тетраметилуронію (HBTU), азид дифеніл фосфорної кислоти (DPPA), 4-(4,6-диметокси-1,3,5триазин-2-іл)-4-метилморфолінійхлорид (DMT-MM) або т.п. як агент конденсації і, у деяких випадках, додатково використовувати 1гідроксибензотриазол ((HOBt), Nгідроксисукцинімід (HONSu), 1-гідрокси-7азабензотриазол ((HOAt) або т.п. як додатковий агент. Як реакційноздатне похідне карбоновокислотної сполуки (7) можна вказати як приклад галогенангідрид кислоти (хлорангідрид кислоти, бромангідрид кислоти або т.п.), ангідрид кислоти (змішаний ангідрид кислоти, отриманий шляхом взаємодії з етилхлоркарбонатом, бензилхлоркарбонатом, фенілхлоркарбонатом, птолуолсульфоновою кислотою, ізовалеріановою кислотою і т.п., або симетричний ангідрид кислоти), активний складний ефір (складний ефір, отриманий з використанням фенолу, HOBt, HONSu або т.п., що може бути заміщений електронакцепторною групою, такою як нітрогрупа, атом фтору або т.п.). нижчий алкіловий ефір, азид кислоти і т.п. Ці реакційноздатні похідні можна одержати загальними способами. Залежно від типу реакції, для забезпечення рівного протікання реакції іноді вигідне здійснення реакції в присутності основи, такої як триетиламін, 23 діізопропілетиламін, N-метилморфолін, піридин, 4(N,N-диметиламіно)піридин (DMAP) або т.п. Спосіб одержання 5: інші способі одержання Крім того, деякі сполуки, представлені формулою (І), також можуть бути отримані зі сполук за даним винаходом, отриманих як зазначено вище, при необов'язковому поєднанні традиційно відомих способів амідування, окиснення, гідролізу і т.п., що зазвичай можуть використовувати фахівці в даній галузі. Наприклад, можна використовувати наступні реакції. 5-1: амідування Амідування можна здійснити таким же способом, як у способі одержання 4. 5-2: окиснення Сульфоксидну сполуку або сульфонову сполуку можна одержати шляхом окислення S атома сульфідної сполуки різними агентами окиснення. Реакцію можна здійснити, наприклад, при охолодженні, при кімнатній температурі або при нагріванні, з використанням еквівалентної кількості або надлишкової кількості м-хлорпербензойної кислоти, пероцтової кислоти, водного розчину пероксиду водню, реагенту Dess-Martin (1,1,1 триацетокси-1,1 -дигідро-1,2-бензойодоксол-3(1Н)он) або т.п. як окисника, у розчиннику, такому як галогеновані вуглеводні, оцтова кислота, вода або т.п. 5-3: гідроліз Сполуку, що містить карбоксильну групу, можна одержати шляхом гідролізу сполуки, що містить складноефірну групу. Наприклад, це можна здійснити при температурі від охолодження до нагрівання в реакційно-інертному розчиннику, такому як ароматичні вуглеводні, прості ефіри, галогеновані вуглеводні, спирти, ДМФА, DMA, NMP, DMSO, піридин, вода або т.п., у присутності мінеральної кислоти, такої як сірчана кислота, хлористоводнева кислота, бромистоводнева кислота або т.п., або органічної кислоти, такої як мурашина кислота, оцтова кислота або т.п., або т.п. ; або в присутності основи, такої як гідроксид літію, гідроксид натрію, гідроксид калію, карбонат калію, карбонат натрію, карбонат цезію, аміак або т.п. (Способи одержання вихідних сполук) Вихідні речовини для використання при одержанні сполук за даним винаходом можна одержати, наприклад, з використанням нижченаведених способів, способів, описаних у прикладах одержання, що описані далі, традиційно відомих способів або способів, очевидних для фахівців у даній галузі, або способів, що представляють собою модифікацію таких способів. Синтез вихідних речовин Синтез вихідних речовин 1: О-алкілування 94455 24 3 (У представленій формулі, Lv являє собою ОН або групу, що видаляється, таку як галоген, метансульфонілокси, н-толуолсульфонілокси або т.п. Те ж застосовано до опису, що іде далі.) Цей спосіб одержання являє собою спосіб, в якому сполуку (10) одержують шляхом Оалкілування сполуки (8) за допомогою сполуки (9). 3 Коли використовують сполуку (8), в якій Lv являє собою -ОН, синтез можна здійснити з використанням загального способу реакції Міцунобу, що зазвичай використовують фахівці в даній галузі. Наприклад, його можна здійснити з використанням активуючого агента, отриманого зі сполуки фосфору (наприклад, трибутилфосфіну, трифенілфосфіну або т.п.) і азодикарбонільної сполуки (наприклад, діетилазодикарбоксилату, 1,1’(азодикарбоніл)дипіперидину або т.п.) або з використанням ціанометилентрибутилфосфоранового або т.п. реагенту, у розчиннику, такому як галогеновані вуглеводні, прості ефіри, ароматичні вуглеводні або т.п., при охолодженні, при кімнатній температурі або при нагріванні. 3 Коли використовують сполуку (8), в якій Lv являє собою групу, що видаляється, таку як галоген, метансульфонілокси, п-толуолсульфонілокси або т.п., синтез, наприклад, можна здійснити з використанням сполуки (8) і сполуки (9) в еквівалентних кількостях, або з використанням одного з них у надлишковій кількості в присутності основи, такої як карбонат калію, карбонат цезію, метоксид натрію, гідрид або натрію т.п., у розчиннику, такому як галогеновані вуглеводні, прості ефіри, ароматичні або вуглеводні т.п., ДМФА або т.п., при охолодженні, при кімнатній температурі або при нагріванні. Синтез вихідних речовин 2 Перша стадія: утворення оксиму Це стадія, на якій сполуку (12) одержують, піддаючи сполуку (11) реакції утворення оксиму. Що стосується утворення оксиму, можна використовувати спосіб утворення оксиму, зазвичай використовуваний фахівцями в даній галузі. Наприклад, це можна здійснити з використанням сполуки (11) і гідроксиламіну або її солі в еквіва 25 лентних кількостях, або з використанням одного з них у надлишковій кількості, у розчиннику, такому як спирти, оцтова кислота, піридин, вода або т.п., при охолодженні, при кімнатній температурі або при нагріванні. Залежно від типу сполуки, у деяких випадках для забезпечення розвитку реакції вигідне додавання ацетату натрію, птолуолсульфонової кислоти або т.п. Друга стадія: відновлення Це стадія, на якій сполуку (1) одержують шляхом відновлення сполуки (12). Що стосується реакції відновлення оксиму, можна використовувати спосіб відновлення оксиму, зазвичай використовуваний фахівцями в даній галузі. Наприклад, це можна здійснити з використанням сполуки (12) і відновника, такого як комплекс боран-піридин, ціаноборгідрид натрію або т.п., в еквівалентних кількостях, або з використанням одного з них у надлишковій кількості, у розчиннику, такому як прості ефіри, спирти, ароматичні вуглеводні, оцтова кислота або т.п., при охолодженні, при кімнатній температурі або при нагріванні. Сполуку за даним винаходом, отриману таким способом, виділяють і очищають безпосередньо як таку або у вигляді солі такої сполуки, використовуючи для цього звичайну обробку для утворення солі. Виділення й очищення здійснюють з використанням загальних хімічних процедур, таких як екстракція, концентрування, випарювання, кристалізація, фільтрування, перекристалізація, різні типи хроматографії і т.п. Різні типи ізомерів можна виділяти звичайним способом з використанням розходжень у фізикохімічних властивостях між ізомерами. Наприклад, рацемічну суміш можна перетворити в оптично чистий ізомер за допомогою загального способу розділення рацемічних сумішей, такого як, наприклад, спосіб, в якому такі сполуки перетворюють у діастереомерні солі з використанням оптично активних кислот, таких як винна кислота або т.п., і потім піддають оптичному розділенню. Також, діастереомерну суміш можна розділити, наприклад, за допомогою фракціонованої кристалізації або різних типів хроматографії. Крім того, оптично активна сполука також може бути отримана з використанням відповідної оптично активної сполуки як вихідної речовини. Фармацевтичну композицію, що містить одну або декілька сполук за даним винаходом або їх фармацевтично прийнятних солей як активний інгредієнт, одержують у вигляді таблеток, порошків, тонкоподрібнених речовин, гранул, капсул, пігулок, розчинів, препаратів для ін'єкцій, супозиторіїв, мазей, пластирів і т.п. з використанням носіїв, наповнювачів і інших додаткових речовин, зазвичай використовуваних для одержання фармацевтичних препаратів, і вводять перорально або парентерально. Клінічну дозу сполуки за даним винаходом для людини, необов'язково, визначають з урахуванням симптомів, віку, статі і т.п. кожного пацієнта, але у випадку перорального введення, добова доза зазвичай складає від близько 0,0001 до 50 мг/кг, переважно від близько 0,001 до 10 мг/кг, ще більш переважно від 0,01 до 1 мг/кг, і її вводять у вигляді 94455 26 однієї дози або розділеної на 2-4 частині. У випадку внутрішньовенного введення, добова доза в розрахунку на масу тіла складає від близько 0,0001 до 1 мг/кг, переважно від близько 0,0001 до 0,1 мг/кг, і її вводять у вигляді однієї дози або розділеної на два або декілька введень на день. Оскільки доза варіює в залежності від різних умов, у деяких випадках задовільний ефект одержують при використанні більш низьких кількостей, ніж зазначені вище межі доз. Як тверду композицію для перорального введення, згідно із даним винаходом, використовують таблетки, порошки, гранули і т.п. У таких твердих композиціях, одну або декілька активних речовин змішують з щонайменше одним інертним розріджувачем, таким як лактоза, маніт, глюкоза, гідроксипропілцелюлоза, мікрокристалічна целюлоза, крохмаль, полівінілпіролідон, алюміній-магнієвий силікат або т.п. Зазвичай, композиція може містити інші домішки, крім інертного розріджувача, такі як мастильні речовини (наприклад, стеарат магнію або т.п.), розпушувач (наприклад, гліколят кальційцелюлози або т.п.,) стабілізатор, солюбілізувальна речовина і т.п. Якщо необхідно, на таблетки або пігулки може бути нанесене покриття, таке як цукрове покриття або плівкове покриття з гастроабо ентеросолюбільної речовини, такої як сахароза, желатин, гідроксипропілцелюлоза, фталат гідроксипропілметилцелюлози або т.п. Рідка композиція для перорального введення включає фармацевтично прийнятні емульсії, розчини, суспензії, сиропи, еліксири і т.п. і містить зазвичай використовуваний інертний розріджував, такий як дистильована вода або етанол (ЕtOН). Крім інертного розріджувача, така композиція може містити змочувальну речовину, суспендувальну речовину і подібні допоміжні речовини, а також підсолоджувачі, віддушки, ароматизатори й антисептики. Як препарати для ін'єкцій для парентерального введення, включені у винахід асептичні водні або неводні розчини, суспензії й емульсії. Як водні розчини і суспензії, наприклад, включена дистильована вода для ін'єкцій і фізіологічний розчин. Як неводні розчини і суспензії, наприклад, використовують пропіленгліколь, поліетиленгліколь, рослинна олія (наприклад, маслинова або олія т.п.), спирти (наприклад, ЕtOН або т.п.), полісорбат 80 і т.п. Така композиція може додатково містити допоміжні речовини, такі як антисептик, змочувальна речовина, емульгатор, диспергувальна речовина, стабілізатор, солюбілізувальна речовина або т.п. їх стерилізують, наприклад, шляхом фільтрування через фільтр, що містить бактерії, змішування з бактерицидною речовиною або опромінення. їх також можна використовувати шляхом одержання твердих композицій і розчинення їх у стерильній воді або стерильному розчиннику для ін'єкцій перед застосуванням. Як зовнішні препарати, включені мазі, тверді креми, креми, желе, припарки, спреї, лосьйони, очні краплі, очні мазі і т.п. Такі препарати включають зазвичай використовувані основи для мазі, основи для лосьйону, водні або неводні розчини, суспензії, емульсії і т.п. Наприклад, як основу для 27 мазі або лосьйону можна вказати як приклад поліетиленгліколь, пропіленгліколь, вазелін, білий бджолиний віск, поліоксіетилен-гідрогенована рицинова олія, гліцеринмоностеарат, стеариловий спирт, цетиловий спирт, лауромакроголь, сорбітансесквіолеат і т.п. Препарати для інгаляцій, препарати для введення через слизову оболонку, такі як препарати для введення через ніс і т.п., використовують у твердій, рідкій або напівтвердій формі, і їх можна одержати відповідно до традиційно відомих способів. Наприклад, можна додати, але необов'язково, традиційно відомий наповнювач і, крім того, агент, що регулює рН, антисептик, поверхневоактивну речовину, лубрикант, стабілізатор, загущувач і т.п. Для введення можна використовувати відповідний пристрій для інгаляції або вдування. Наприклад, з використанням мірного пристрою для введення шляхом інгаляції або подібного традиційно відомого пристрою або спреєвого пристрою, сполуку можна вводити окремо або у вигляді порошкоподібної сформульованої суміші, або у вигляді розчину або суспензії шляхом комбінування з прийнятним з медичної точки зору носієм. Інгалятор сухого порошку або т.п. може бути призначений для разового або багаторазового застосування, і можна використовувати порошок або капсулу, що містить порошок. Альтернативно, це може бути аерозольний спрій, що знаходиться під тиском, або подібна форма, в якій використовують хлорфторалкан, гідрофторалкан або діоксид вуглецю або подібний придатний газ. Приклади Нижче іде ілюстративний опис даного винаходу на основі прикладів, але даний винахід не обмежується цими прикладами. У цьому зв'язку, оскільки нові речовини включені у вихідні сполуки для використання в цих прикладах, способи одержання таких вихідних сполук описані як приклади одержання. У зв'язку з цим, використовують наступні абревіатури в прикладах і таблицях. Прикл.одерж.: номер приклада одержання, Прикл.: номер приклада, №: номер сполуки, Стр.: структурна формула (Коли в структурній формулі присутня НС1, це означає, що сполука являє собою гідрохлорид.), Синт.: спосіб одержання (У випадку, коли зазначені тільки цифри, вони показують номер приклада, в якому сполуку одержують у такий же спосіб, і коли перед цифрою присутня R, це вказує номер приклада одержання, в якому сполуку одержують у такий же спосіб, відповідно.), Дані: фізико-хімічні 1 дані (ЯМР1: δ (м.ч.) - дані H ЯМР у DMSO-d6, 1 ЯМР2: δ (м.ч.) - дані H ЯМР у CDCl3, FAB: FABMS (катіон), FAB-N; FAB-MS (аніон), ESI: ESI-MS (катіон), ESI-N: ESI-MS (аніон), ΕΙ: ΕΙ-MS (катіон), СІ: СІ-MS (катіон)), Me: метил, Et: етил, Ас: ацетил, TBS: трет-бутилдиметилсиліл, Вос: третбутоксикарбоніл, Ts: п-толуолсульфоніл. Приклад одержання 1 Шляхом додавання тіонілхлориду і ДМФА до 1-(2,6-диметилфеніл)-6-оксо-1,6-дигідропіролідин3-карбонової кислоти і при перемішуванні реакційної суміші при 60°С протягом 2 годин одержували 1-(2,6-диметилфеніл)-6-оксо-1,6-дигідропіролідин 94455 28 3-карбонілхлорид. Отриманий 1-(2,6диметилфеніл)-6-оксо-1,6-дигідропіролідин-3карбонілхлорид розчиняли в ДМФА і додавали боргідрид натрію при охолодженні льодом з наступним перемішуванням протягом 0,5 годин з одержанням 1 -(2,6-диметилфеніл)-5(гідроксиметил)піридин-2(1Н)ону. Приклад одержання 2 В атмосфері азоту, розчин 1,0 Μ діізобутилалюмінійгідриду в ТГФ додавали по краплях при 78°С до розчину в ТГФ метил 1-(2,6диметилфеніл)-6-оксо-1,6-дигідропіридин-3карбоксилату. Після перемішування при -78°С протягом 2 годин температуру підвищували до 0°С з наступним перемішуванням при 0°С протягом 1,5 годин. Реакційну суміш нагрівали до кімнатної температури з наступним перемішуванням при кімнатній температурі протягом 2 годин. Розчин 1,0 Μ діізобутилалюмінійгідриду в ТГФ додавали по краплях до реакційної суміші при 0°С з наступним нагріванням до кімнатної температури і перемішуванням протягом 1 години з одержанням метил 1(2,6-диметилфеніл)-6-оксо-1,4,5,6тетрагідропіридин-3-карбоксилату. В атмосфері азоту, літійалюмінійгідрид додавали до отриманого метил 1-(2,6-диметилфеніл)-6-оксо-1,4,5,6тетрагідропіридин-3-карбоксилату при одночасному охолодженні на бані лід-метанол. Потім при перемішуванні реакційної суміші протягом 2 годин при одночасному нагріванні до температури кипіння зі зворотним холодильником одержували [1(2,6-диметилфеніл)піперидин-3-іл]метанол. Приклад одержання 3 Шляхом додавання третбутил(диметил)силілхлориду до розчину в ДМФА 4'-гідрокси-2',6'-диметилбіфеніл-3-карбальдегіду і імідазолу і при перемішуванні при кімнатній температурі протягом 10 годин одержували 4'-{[третбутил(диметил)силіл] окси} -2' ,6' - диметилбіфеніл-3 -карбальдегід. Приклад одержання 4 В атмосфері азоту, н-бутиллітій (розчин у гексані) додавали при -75°С до розчину в ТГФ (4бром-3-метоксифенокси)(третбутил)диметилсилану з наступним перемішуванням при -75°С протягом 1 години. До реакційної суміші додавали триізопропілборат з наступним перемішуванням при кімнатній температурі протягом 30 хвилин. Реакційну суміш обробляли хлористоводневою кислотою з одержанням (4-{[третбутил(диметил)силіл]окси}-2метоксифеніл)боронової кислоти. Приклад одержання 5 В атмосфері азоту, суміш метил 3-бром-2метилбензоату, біс(пінаколат)дибору, дихлориду біс(трифенілфосфін)паладію(ІІ), трифенілфосфіну, трикалійфосфату і діоксану перемішували при 100°С протягом 3 днів, з одержанням, таким чином, метил 2-метил-3-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)бензоату. Приклад одержання 6 В атмосфері азоту, суміш (2,6диметилфеніл)боронової кислоти, етил 3бромбензоату, тетракис(трифенілфосфін)наладію, водного розчину 1 Μ карбонату натрію, толуолу і 29 етанолу перемішували при нагріванні при 80°С з одержанням, таким чином, етил 2',6'диметилбіфеніл-3-карбоксилату. Суміш етил 2',6'диметилбіфеніл-3-карбоксилату, водного розчину 1 Μ гідроксиду натрію і етанолу перемішували при нагріванні при 60°С з одержанням, таким чином, 2',6'-диметилбіфеніл-3-карбонової кислоти. Приклад одержання 7 В атмосфері азоту, тетракис(трифенілфосфін)паладій додавали до суміші 2-бром-1,3-диметилбензолу, (5-форміл-2метоксифеніл)боронової кислоти, водного розчину 1М карбонату натрію, етанолу і диметоксіетану з наступним перемішуванням при 80°С протягом 25 годин з одержанням 6-метокси-2',6'диметилбіфеніл-3-карбальдегіду. Приклад одержання 8 Трифторметансульфоновий ангідрид додавали по краплях, при охолодженні льодом, до суміші 4-гідрокси-3,5-диметилбензонітрилу, піридину і дихлорметану з наступним перемішуванням при кімнатній температурі протягом 2 годин з одержанням 4-ціано-2,6диметилфенілтрифторметансульфонату. В атмосфері азоту, суміш 4-ціано-2,6диметилфенілтрифторметансульфонату, (3формілфеніл)боронової кислоти, ацетату паладію, дициклогексил(2',6'-диметоксибіфеніл-2іл)фосфіну, трикалійфосфату, толуолу і води перемішували при кімнатній температурі протягом 6 годин з одержанням 3'-форміл-2,6диметилбіфеніл-4-карбонітрилу. Приклад одержання 9 В атмосфері азоту, суміш метил 2-метил-3(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)бензоату, 4-бром-3,5-диметилфенолу, ацетату паладію, дициклогексил(2',6'-диметоксибіфеніл-2іл)фосфіну, трикалійфосфату, толуолу і води перемішували протягом 14,5 годин при нагріванні при 60°С з одержанням метил 4'-гідрокси-2,2',6'триметилбіфеніл-3-карбоксилату. Приклад одержання 10 В атмосфері азоту, суміш (4-{[третбутил(диметил)силіл]окси}-2,6диметилфеніл)боронової кислоти, 6-бромпіридин2-карбальдегіду, ацетату паладію, 2'(дициклогексилфосфіно)-N,N-диметилбіфеніл-2аміну, трикалійфосфату, толуолу і води перемішували протягом 20 годин при нагріванні при 60°С з одержанням, таким чином, 6-(4-{[третбутил(диметил)силіл]окси}-2,6диметилфеніл)піридин-2-карбальдегіду. Приклад одержання 11 В атмосфері азоту, при охолодженні льодом, боргідрид натрію додавали до етанольного розчину 4'-хлор-2'-метилбіфеніл-3-карбальдегіду з наступним перемішуванням протягом 1 години з одержанням (4'-хлор-2'-метилбіфеніл-3іл)метанолу. Приклад одержання 12 В атмосфері азоту, при охолодженні льодом, метил 4'-(метилсульфоніл)біфеніл-3-карбоксилат додавали до суспензії в ТГФ літійалюмінійгідриду з наступним перемішуванням протягом 20 хвилин з 94455 30 одержанням [4'-(метилсульфоніл)біфеніл-3іл]метанолу. Приклад одержання 13 В атмосфері азоту, суміш метил 3-бром-4хлорбензоату, (2,6-диметилфеніл)боронової кислоти, хлориду літію, карбонату натрію, води, етанолу, диметоксіетану і тетракис(трифенілфосфін)паладію перемішували при 90°С протягом 15 годин з одержанням, таким чином, метил 6-хлор-2',6'-диметилбіфеніл-3карбоксилату. Літійалюмінійгідрид додавали при охолодженні льодом до розчину в ТГФ отриманого метил 6-хлор-2',6'-диметилбіфеніл-3-карбоксилату з наступним нагріванням до кімнатної температури і при перемішуванні протягом 2 годин з одержанням (6-хлор-2',6'-диметилбіфеніл-3-іл)метанолу. Приклад одержання 14 В атмосфері азоту, тетракистрифенілфосфінпаладій додавали до суміші 2-бром-1,3диметилбензолу, 2-фтор-5-формілфенілборонової кислоти, водного розчину 1М карбонату натрію, етанолу і толуолу з наступним перемішуванням при 80°С протягом 8 годин з одержанням 6-фтор2',6'-диметилбіфеніл-3-карбальдегіду. При охолодженні на бані лід-метанол, боргідрид натрію додавали невеликими порціями до етанольного розчину отриманого 6-фтор-2',6'-диметилбіфеніл-3карбальдегіду і реакційну суміш перемішували при цій же температурі протягом 1 години з одержанням (6-фтор-2',6'-диметилбіфеніл-3-іл)метанолу. Приклад одержання 15 Тіонілхлорид додавали до (4'-хлор-2'метилбіфеніл-3-іл)метанолу при охолодженні з використанням бані лід-метанол з наступним перемішуванням при кімнатній температурі протягом 1 години з одержанням 4-хлор-3'-(хлорметил)-2метилбіфенілу. Приклад одержання 16 Карбонат калію додавали до розчину в ДМФА 4-хлор-3'-(хлорметил)-2-метилбіфенілу і 4гідроксибензальдегіду з наступним перемішуванням при кімнатній температурі протягом 20 годин з одержанням 4-[(4'-хлор-2'-метилбіфеніл-3іл)метокси]бензальдегіду. Приклад одержання 17 Трибутилфосфін і 1,1’(азодикарбоніл)дипіперидин додавали до розчину в ТГФ (4-{[трет-бутил(диметил)силіл]окси}-2',6'диметилбіфеніл-3-іл)метанолу і 4гідроксибензальдегіду з наступним перемішуванням при кімнатній температурі протягом 14 годин з одержанням 4-[(4-{[третбутил(диметил)силіл]окси}-2',6'-диметилбіфені л-3 -іл)метоксибензальдегіду. Приклад одержання 18 В атмосфері азоту, гідрид натрію додавали при охолодженні льодом до розчину в ТГФ (2',6'диметилбіфеніл-3-іл)метанолу з наступним перемішуванням при зазначеній температурі протягом 15 хвилин. Потім до реакційної суміші додавали 6хлорнікотинонітрил при охолодженні льодом з наступним нагріванням до кімнатної температури і при перемішуванні протягом 3 годин з одержанням 6-[(2',6'-диметилбіфеніл-3іл)метокси]нікотинонітрилу. 31 Приклад одержання 19 В атмосфері азоту, розчин 1,0 Μ діізопроиілалюмінійгідриду в толуолі додавали по краплях при -78°С до толуольному розчину 6-[(2',6'диметилбіфеніл-3-іл)метокси]нікотинонітрилу з наступним перемішуванням при -78°С протягом 1,5 годин з одержанням 6-[(2',6'-диметилбіфеніл-3іл)метокси]нікотинальдегіду. Приклад одержання 20 В атмосфері азоту, розчин у ТГФ метил 4-[(4'хлор-2'-метилбіфеніл-3-іл)метокси]-2фторбензоату додавали по краплях до суспензії в ТГФ літійалюмінійгідриду при охолодженні на бані лід-метанол з наступним перемішуванням при кімнатній температурі протягом 1 години з одержанням 4-[(4'-хлор-2'-метилбіфеніл-3-іл)метокси]-2фторбензилового спирту. При додаванні діоксиду марганцю до розчину в ТГФ отриманого 4-[(4'хлор-2'-метилбіфеніл-3-іл)метокси]-2фторбензилового спирту і при перемішуванні при 40°С протягом 17 годин одержували 4-[(4'-хлор-2'метилбіфеніл-3-іл)метокси]-2-фторбензальдегід. Приклад одержання 21 В атмосфері азоту, боргідрид натрію додавали до метанольного розчину 4-{[2',6'-диметил-4'-(2оксопропокси)біфеніл-3-іл]метокси}бензальдегіду при охолодженні льодом з наступним перемішуванням при кімнатній температурі протягом 2 годин з одержанням 1-[(-3'-{[4(гідроксиметил)фенокси]метил}-2,6диметилбіфеніл-4-іл)окси]пропан-2-олу. При додаванні хлороформу і діоксиду марганцю до отриманої сполуки і при перемішуванні при 60°С протягом 5 годин одержували 4-{[4'-(2-гідроксипропокси)2',6'-диметилбіфеніл-3-іл]метокси} бензальдегід. Приклад одержання 22 Метансульфонілхлорид додавали по краплях при охолодженні льодом до суміші 4- [(4' -гідрокси2' ,6' - диметилбіфеніл-3 - іл)метокси] бензальдегіду, триетиламіну і етилацетату з наступним перемішуванням при 0°С протягом 2 годин з одержанням 3'-[(4-формілфенокси)метил]-2,6диметилбіфеніл-4-ілметансульфонату. Приклад одержання 23 Суміш 4-[(4'-гідрокси-2',6'-диметилбіфеніл-3іл)метокси]бензальдегіду, 2-брометилацетату, карбонату цезію і ДМФА перемішували при 60°С протягом 21 годин з одержанням 2-({3'-[(4формілфенокси)метил]-2,6-диметилбіфеніл-4-іл} оксі)етилацетату. Приклад одержання 24 В атмосфері азоту, суміш 2гідроксіетилацетату, гідриду натрію і ДМФА перемішували при кімнатній температурі протягом 15 хвилин і потім додавали 1-бром-4-фтор-2(трифторметил)бензол з наступним перемішуванням при кімнатній температурі протягом 1,5 годин з одержанням 2-[4-бром-3(трифтормстил)феноксі]етанолу. Приклад одержання 25 Метансульфонілхлорид додавали по краплях до суміші 1-(3-гідроксипропіл)піролідин-2-ону, триетиламіну і етилацетату при охолодженні льодом з наступним перемішуванням при 0°С протягом 2 годин з одержанням безбарвного масла. 4-[(4' 94455 32 гідрокси-2',6'-диметилбіфеніл-3іл)метокси]бензальдегід, карбонат цезію і ДМФА додавали до отриманого масла з наступним перемішуванням при нагріванні при 60°С протягом 19 годин з одержанням 4-({2',6'-диметил-4'-[3-(2оксопіролідин-1-іл)пропокси]біфеніл-3іл}метокси)бензальдегіду. Приклад одержання 26 В атмосфері азоту, розчин у ТГФ метилмагниййодиду додавали по краплях при охолодженні льодом до розчину в ТГФ 1-[(3'-{[4(гідроксиметил)фенокси]метил}-2,6диметилбіфеніл-4-іл)оксі]ацетону з наступним перемішуванням при кімнатній температурі протягом 30 хвилин з одержанням 1-[(3'-{[4(гідроксиметил)фенокси]метил}-2,6диметилбіфеніл-4-іл)окси]-2-метилпропан-2-олу. Приклад одержання 27 Суміш 1 [(3' {[4(гідроксиметил)фенокси]метил} -2,6диметилбіфеніл-4-іл)окси]-2-метилпропан-2-олу, діоксиду марганцю і хлороформу перемішували при нагріванні при 50°С протягом 20 годин з одержанням 4-{[4'-(2-гідрокси-2-метилпропокси)-2',6'диметилбіфеніл-3-іл]метокси}бензальдегіду. Приклад одержання 28 Суміш 4- {[4' -(3 -гідроксипропокси)-2' ,6' - диметилбіфені л-3 -іл]метокси} бензальдегіду, ацетилхлориду, триетиламіну і дихлорметану перемішували при кімнатній температурі протягом 3,5 годин з одержанням 3-({3'-[(4формілфенокси)метил]-2,6-диметилбіфеніл-4іл}окси)пропілацетату. Приклад одержання 29 Суміш 4-{[4'-(3-гідрокси-3-метилбутокси)-2',6'диметилбіфеніл-3-іл]метокси} бензальдегіду, оцтового ангідриду, піридину, DM АР і хлороформу перемішували при кімнатній температурі протягом 2 днів з одержанням 3-({3'-[(4формілфенокси)метил]-2,6-диметилбіфеніл-4іл}окси)-1,1-диметилпропілацетату. Приклад одержання 30 Розчин 4 Μ хлористого водню в етилацетаті додавали по краплях при охолодженні льодом до розчину в етилацетаті трет-бутил [2-({3'-[(4формілфенокси)метил]-2,6-диметилбіфеніл-4іл}оксі)етил]карбамату з наступним перемішуванням при 0°С протягом 2 годин. Дихлорметан, ацетилхлорид і триетиламін додавали до отриманої сполуки з наступним перемішуванням при кімнатній температурі протягом 12 годин з одержанням Ν-[2-({3'-[(4-формілфенокси)метил]-2,6диметилбіфеніл-4-іл}оксі)етил]ацетаміду. Приклад одержання 31 Трифторметансульфоновий ангідрид додавали по краплях при охолодженні льодом до суміші 4-[(4'-гідрокси-2,2'-диметилбіфеніл-3іл)метокси]бензальдегіду, піридину і дихлорметану з наступним перемішуванням при 0°С протягом 1 години з одержанням 3'-[(4формілфенокси)метил]-2,2'-диметилбіфеніл-4ілтрифторметансульфонату. Приклад одержання 32 Гідрохлорид гідроксиламіну і водний розчин ацетату натрію додавали до етанольного розчину 33 4-[(4'-хлор-2'-метилбіфеніл-3іл)метокси]бензальдегіду з наступним перемішуванням при кімнатній температурі протягом 18 годин з одержанням 4-[(4-{[третбутил(диметил)силіл]окси}-2',6'-диметилбіфеніл-3іл)метокси]бензальдегідоксиму. Ціаноборгідрид натрію додавали до змішаного розчину в метаноліТГФ отриманого 4-[(4-{[третбутил(диметил)силіл]окси}-2',6'-диметилбіфеніл-3іл)метокси]бензальдегідоксиму і потім до суміші додавали по краплях розчин 4 Μ хлористого водню в діоксані з наступним перемішуванням при кімнатній температурі протягом 1 години з одержанням Ν-{4-[(4-{[трет-бутил(диметил)силіл]окси}2',6'-диметилбіфеніл-3іл)метокси]бензил)гідроксиламіну. Приклад одержання 33 В атмосфері азоту, комплекс трифториду сірки і діетиламіну додавали по краплях при -75°С до розчину в дихлорметані 4-(4-бром-3метилфенокси)-2-метилбутан-2-олу і температуру підвищували до кімнатної температури з одержанням 1-бром-4-(3-фтор-3-метилбутокси)-2метилбензолу. Приклад одержання 34 В атмосфері азоту, суміш 1-бром-4-(3-фтор-3метилбутокси)-2-метилбензолу, метил 2-метил-3(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)бензоату, ацетату паладію, дициклогексил(2',6'диметоксибіфеніл-2-іл)фосфіну, трикалійфосфату, толуолу і води перемішували при 80°С протягом 12 годин з одержанням метил 4'-(3-фтор-3мегилбутокси)-2,2'-диметилбіфеніл-3карбоксилату. Літійалюмінійгідрид додавали до розчину в ТГФ отриманого метил 4'-(3-фтор-3метилбутокси)-2,2'-диметилбіфеніл-3карбоксилату при охолодженні льодом з наступним нагріванням до кімнатної температури і при перемішуванні протягом 1 години з одержанням [4'-(3-фтор-3-метилбутокси)-2,2'-диметилбіфеніл3-іл]метанолу. Приклад одержання 35 В атмосфері азоту, гідрид натрію додавали при охолодженні льодом до суміші 5-бром-4метилпіридин-2-олу і ДМФА з наступним перемішуванням при кімнатній температурі протягом 1 години. Потім до суміші додавали 3-гідрокси-3метилбутил 4-метилбензолсульфонат з наступним перемішуванням при 40°С протягом 14 годин з одержанням 4-[(5-бром-4-метилпіридин-2іл)окси]2-метилбутан-2-олу і 5-бром-1-(3-гідрокси3-метилбутил)-4-метилпіридин-2(1Н)-ону. Приклад одержання 36 В атмосфері азоту, суміш (4-{[третбутил(диметил)силіл]окси}-2метилфеніл)боронової кислоти, 6-[(3-бром-2метилбензил)окси]нікотинальдегіду, ацетату паладію, дициклогексил(2',6'-диметоксибіфеніл-2іл)фосфіну, трикалійфосфату, толуолу і води перемішували при нагріванні при 60°С протягом 2 днів з одержанням 6-[(4'-{[третбутил(диметил)силіл]окси}-2,2'-диметилбіфеніл-3іл)метокси]нікотинальдегіду. Приклад одержання 37 94455 34 В атмосфері азоту, суміш трет-бутил[3,5диметил-4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)фенокси]диметилсилану, 6-[(3бром-2- метилбензил)окси]нікотинальдегіду, ацетату паладію, дициклогексил(2',6'диметоксибіфеніл-2-іл)фосфіну, трикалійфосфату, толуолу і води перемішували при нагріванні при 60°С протягом 3 днів з одержанням 6-[(4'-{[третбутил(диметил)силіл]окси} -2,2' ,6' -триметил біфеніл-3 -іл)метокси]нікотинальдегіду. Приклад одержання 38 В атмосфері азоту, трет-бутоксид калію додавали при охолодженні льодом до суміші циклобутанону, етилхлорацетату і ТГФ протягом 40 хвилин з наступним перемішуванням при 0°С протягом 2 годин, підвищуючи температуру до кімнатної температури, і при перемішуванні при кімнатній температурі протягом 1 дня з одержанням, таким чином, етил 1-оксаспиро[2,3]гексан-2-карбоксилату. Розчин отриманого етил 1-оксаспиро[2,3]гексан-2карбоксилату в діетиловому ефірі додавали до суспензії літійалюмінійгідриду в ТГФ при охолодженні льодом в атмосфері азоту з наступним перемішуванням при кімнатній температурі протягом 7 годин з одержанням 1-(2гідроксіетил)циклобутанолу. Суміш отриманого 1(2-гідроксіетил)циклобутанолу, 4метилбензолсульфонілхлориду, триетиламіну і ТГФ перемішували при кімнатній температурі протягом 16 годин з одержанням 2-(1гідроксициклобутил)етил 4метилбензолсульфонату. Таким же способом, як в описаних вище способах прикладів одержання 1-38, одержували сполуки прикладів одержання 39-299 з використанням відповідних вихідних речовин, відповідно. Структури сполук прикладів одержання представлені в таблицях 4-44, а способі одержання і фізикохімічні дані в таблицях 45-52. Приклад 1 Хлоркарбонілізоціанат (0,10 мл) додавали по краплях, при охолодженні на бані лід-метанол, до розчину в ТГФ (10 мл) N-{4-[(4'-хлор-2'метилбіфеніл-3-іл)метокси] бензил}гідроксиламіну (430 мг) і температуру підвищували до кімнатної температури з наступним перемішуванням протягом 1 години. До реакційної суміші додавали розчин 1 Μ хлористоводневої кислоти (30 мл), з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Шляхом очищення отриманого залишку за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол) одержували безбарвну піноподібну речовину. Отриману піноподібну речовину розчиняли в етанолі (5 мл) і до суміші додавали водний розчин 1 Μ гідроксиду натрію (1,06 мл) з наступним концентруванням при зниженому тиску. Шляхом перекристалізації отриманого залишку з води-ізопропанолу одержували натрій 2{4-[(4'-хлор-2'-метилбіфеніл-3-іл)метокси]бензил}3,5-діоксо-1,2,4-оксадіазолідин-4-ід (347 мг) у вигляді безбарвних кристалів. Приклад 2 35 Хлоркарбонілізоціанат (0,14 мл) додавали по краплях, при охолодженні на бані лід-метанол, до розчину в ТГФ (15мл) 4-({[3'-({4[(гідроксіаміно)метил]фенокси}метил)-2,6диметилбіфеніл-4-іл]окси}метил)тетрагідро-2Нтіопіран-4-олу (792 мг) з наступним підвищенням температури до кімнатної температури і потім перемішуванням протягом 1 години. До реакційної суміші додавали розчин 1 Μ хлористоводневої кислоти (40 мл) з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Шляхом очищення отриманого залишку за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол) одержували безбарвну піноподібну речовину (777 мг). Метоксид натрію (50 мг) додавали до метанольного розчину (10 мл) отриманої піноподібної речовини (116 мг) з наступним перемішуванням при кімнатній температурі протягом 30 хвилин. Потім до суміші додавали метоксид натрію (200 мг) з наступним перемішуванням при кімнатній температурі протягом 1 години. Реакційну суміш нагрівали до 60°С, перемішували протягом 2 годин і потім спонтанно прохолоджували до кімнатної температури. До реакційної суміші додавали розчин 1 Μ хлористоводневої кислоти (10 мл) і воду (20 мл), з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Отриманий залишок розчиняли в метанолі (5 мл)ТГФ (10 мл) і додавали водний розчин 1 Μ гідроксиду натрію (0,20 мл) з наступним концентруванням при зниженому тиску. Шляхом промивання отриманого залишку сумішшю ізопропанолдіетиловий ефір одержували натрій 2-[4-({4'-[(4гідрокситеграгідро-2Н-тіопіран-4-іл)метокси]-2’,6'диметилбіфеніл-3-іл}метокси)бензил]-3,5-діоксо1,2,4-оксадіазолідин-4-ід (80 мг) у вигляді блідожовтої твердої речовини. Приклад 3 Хлоркарбонілізоціанат (0,14 мл) додавали по краплях, при охолодженні на бані лід-метанол, до розчину в ΊΤΦ (15мл) 4-({[3'-({4[(гідроксіаміно)метил]фенокси}метил)-2,6диметилбіфеніл-4-їл]окси}метил)тетрагідро-2Нтіопіран-4-олу (792 мг) з наступним підвищенням температури до кімнатної температури і наступним перемішуванням протягом 1 години. До реакційної суміші додавали розчин 1М хлористоводневої кислоти (40 мл) з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Шляхом очищення отриманого залишку за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол), одержували безбарвну піноподібну речовину (777 мг). При охолодженні на бані лід-метанол, мхлорпербензойну кислоту (630 мг) додавали до розчину в хлороформі (20 мл) отриманої піноподібної речовини (600 мг) з наступним перемішуванням протягом 30 хвилин. До реакційної суміші додавали воду (20 мл), з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарю 94455 36 вали при зниженому тиску. Шляхом очищення отриманого залишку за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол), одержували безбарвну піноподібну речовину (510 мг). Отриману піноподібну речовину (510 мг) промивали діізопропіловим ефіром-етилацетатомгексаном і сушили при зниженому тиску з одержанням трохи жовтуватої твердої речовини (432 мг). Метоксид натрію (800 мг) додавали до метанольному розчину (30 мл) отриманого трохи жовтуватої твердої речовини (387 мг) з наступним перемішуванням при 60°С протягом 2 годин і потім спонтанним охолодженням до кімнатної температури. До реакційної суміші додавали розчин 1 Μ хлористоводневої кислоти (30 мл) і воду (50 мл), з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Отриманий залишок розчиняли в метанолі (5 мл)ТГФ (15 мл), додавали водний розчин 1 Μ гідроксиду натрію (0,63 мл) з наступним концентруванням при зниженому тиску. Шляхом промивання отриманого залишку сумішшю ізопропанолдіетиловий ефір одержували натрій 2-[4-({4'-[(4гідрокси-1,1-діоксотетрагідро-2Н-тіопіран-4іл)метокси]-2',6'-диметилбіфеніл-3іл}метокси)бензил]-3,5-діоксо-1,2,4-оксадіазолідин4-ід (252 мг) у вигляді безбарвної твердої речовини. Приклад 4 Суміш 2-{4-[(3-бромбензил)окси]бензил}-1,2,4оксадіазолідин-3,5-діону (500мг), 2,6-дифтор-4метоксифенілборонової кислоти (325 мг), тетракистрифенілфосфінпаладію (80 мг), хлориду літію (6 мг), водного розчину карбонату натрію (562 мг/5 мл), етанолу (5 мл) і 1,2-диметоксіетану (25 мл) перемішували при 90°С протягом 5 годин в атмосфері азоту. До реакційної суміші знову додавали 2,6-дифтор-4-метоксифенілборонову кислоту (325 мг) з наступним перемішуванням при 90°С протягом 13 годин. До реакційної суміші додавали наступну додаткову кількість 2,6-дифтор-4метоксифенілборонової кислоти (325 мг) з наступним перемішуванням при 90°С протягом 2 годин. До реакційної суміші додавали наступну додаткову кількість 2,6-дифтор-4-метоксифенілборонової кислоти (325 мг) з наступним перемішуванням при 90°С протягом 5 годин і спонтанним охолодженням до кімнатної температури. До реакційної суміші додавали розчин 1 Μ хлористоводневої кислоти (50 мл) з наступною екстракцією етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію і фільтрували. До фільтрату додавали силікагель (3 г) з наступним концентруванням при зниженому тиску. Продукт, отриманий таким чином, очищували за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол) з одержанням жовтуватої піноподібної речовини (614 мг). Отриману піноподібну речовину (614 мг) розчиняли в ТГФ (5 мл)етанолі (5 мл), додавали водний розчин 1 Μ гідроксиду натрію (1,32 мл) з наступним концентруванням при зниженому тиску. Шляхом перекристалізації отриманого залишку з ізопропанолу-води 37 одержували натрій 2-{4-[(2',6'-дифтор-4'метоксибіфеніл-3-іл)метокси]бензил}-3,5-діоксо1,2,4-оксадіазолідин-4-ід (366 мг) у вигляді безбарвної твердої речовини. Приклад 5 Водний розчин 1 Μ гідроксиду натрію (5 мл) додавали до суміші метил 3'-({4-[(3,5-діоксо-1,2,4оксадіазолідин-2-іл)метил]фенокси}метил)-4біфенілкарбоксилату (196 мг), метанолу (5 мл) і ТГФ (5 мл) з наступним перемішуванням протягом 1 години при нагріванні при 60°С. До реакційної суміші додавали розчин 1 Μ хлористоводневої кислоти (7 мл) з наступним перемішуванням при кімнатній температурі. Осаджену тверду речовину збирали фільтруванням і сушили шляхом нагрівання при зниженому тиску з одержанням 3'-({4[(3,5-діоксо-1,2,4-оксадіазолідин-2іл)метил]фенокси}метил)-4-біфенілкарбонової кислоти (176 мг) у вигляді білої твердої речовини. Приклад 6 WSC гідрохлорид (163мг) додавали до суміші 3'-({4-[(3,5-діоксо-1,2,4-оксадіазолідин-2іл)метил]фенокси}метил)-4-біфенілкарбонової кислоти (293 мг), (2-етоксіетил)аміну (0,11 мл), HOBt (142 мг) і ДМФА (10 мл) з наступним перемішуванням при кімнатній температурі протягом 27 годин. Розчинник випарювали при зниженому тиску і до залишку додавали хлороформ/метанол (4/1) з наступним промиванням водою і насиченим водним розчином хлориду амонію. Розчинник випарювали при зниженому тиску і залишок очищували за допомогою колонкової хроматографії на силікагелі (хлороформ/метанол), отриману піноподібну речовину потім кристалізували шляхом додавання діетилового ефіру й отримані кристали перекристалізовували з метанолу з одержанням 3'-({4-[(3,5-діоксо-1,2,4-оксадіазолідин-2іл)метил]фенокси}метил)-N-(2-етоксіетил)-4біфенілкарбоксаміду (135 мг) у вигляді білих кристалів. Приклад 7 DMT-MM (653 мг) додавали до охолодженої льодом суміші 3'-({4-[(3,5-діоксо-1,2,4оксадіазолідин-2-іл)метил]фенокси}метил)-4біфенілкарбонової кислоти (329 мг), 2аміноетанолу (0,14 мл), ТГФ (20 мл) і метанолу (4 мл) з наступним перемішуванням при кімнатній температурі протягом 25 годин. Розчинник випарювали при зниженому тиску і до залишку додавали насичений водний розчин хлориду амонію з наступною екстракцією хлороформом/метанолом (4/1). Розчинник випарювали при зниженому тиску і залишок очищували за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол). Отриману блідо-жовта тверду речовину (276 мг) розчиняли в ТГФ (5 мл)-метанолі (5 мл) і додавали водний розчин 1 Μ гідроксиду натрію (0,79 мл) з наступним перемішуванням при кімнатній температурі протягом 10 хвилин. Осаджену тверду речовину збирали фільтруванням і сушили шляхом нагрівання при зниженому тиску з одержанням натрій 2-{4-[(4'-{[(2гідроксіетил)аміно]карбоніл}біфеніл-3іл)метокси]бензил}-3,5-діоксо-1,2,4-оксадіазолідин4-іду (188 мг) у вигляді білої твердої речовини. 94455 38 Приклад 8 Розчин 1,0 Μ тетрабутиламонійфториду (TBAF) у ТГФ (1,94 мл) додавали по краплях до охолодженої льодом суміші 2-(4-{[4'-(2-{[третбутил(диметил)силіл]оксі}етокси)біфеніл-3іл]метокси} бензил-1,2,4-оксадіазолідин-3,5-діону (532 мг) і ТГФ (10 мл) з наступним поступовим підвищенням температури до кімнатної температури і наступним перемішуванням протягом 13 годин. Реакційну суміш розбавляли хлороформом/метанолом (4/1) і промивали насиченим водним розчином хлориду амонію і насиченим водним розчином хлориду натрію. Потім розчинник випарювали при зниженому тиску. Залишок очищували за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол) і отриману тверду речовину перекристалізовували з етилацетатугексану-діетилового ефіру з одержанням 2-(4-{[4'(2-гідроксіетокси)-3-біфеніл]метокси}бензил-1,2,4оксадіазолідин-3,5-діону (171 мг) у вигляді білих кристалів. Приклад 9 Гідрохлорид гідроксиламіну (12,85 г) і водний розчин ацетату натрію (19,22 г/110 мл) додавали до етанольної (800 мл) суспензії 4-[(3бромбензил)окси]бензальдегіду (17,94 г) з наступним перемішуванням при кімнатній температурі протягом 18 годин. Реакційну суміш концентрували при зниженому тиску і до залишку додавали воду (100 мл) з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і розчинник випарювали при зниженому тиску з одержанням безбарвної твердої речовини (19,94 г). До розчину в метанолі (350 мл)-ТГФ (350 мл) отриманої безбарвної твердої речовини (19,94 г) додавали ціаноборгідрид натрію (19,36 г). Потім розчин 4 Μ хлористого водню в діоксані (160 мл) повільно додавали по краплях при охолодженні льодом. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин. До реакційної суміші додавали водний розчин 1 Μ гідроксиду натрію (700 мл) при охолодженні льодом, з наступною екстракцією хлороформом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску з одержанням жовтуватої твердої речовини (25,53 г). Хлоркарбонілізоціанат (5,00 мл) додавали по краплях до розчину в ТГФ (380 мл) отриманої жовтуватої твердої речовини (25,53 г) при охолодженні на бані лід-метанол з наступним перемішуванням при кімнатній температурі протягом 2 годин. До реакційної суміші додавали розчин 1 Μ хлористоводневої кислоти (400 мл) з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і розчинник випарювали при зниженому тиску. Отриманий залишок промивали етилацетатом і потім сушили при 50°С при зниженому тиску з одержанням 2-{4-[(3бромбензил)окси]бензил}-1,2,4-оксадіазолідин-3,5діону (6,08 г) у вигляді безбарвної твердої речовини. Приклад 10 39 Суміш 2-(4-амінобензил)-1,2,4-оксадіазолідин3,5-діону (500мг), 4'-хлор-2'-метилбіфеніл-3карбальдегіду (668 мг), оцтової кислоти (0,33 мл) і ТГФ (40 мл) перемішували при кімнатній температурі протягом 24 годин. До реакційної суміші додавали триацетоксиборгідрид натрію (767 мг) з наступним перемішуванням при кімнатній температурі протягом 15 хвилин. Розчинник випарювали при зниженому тиску і до залишку додавали воду з наступною екстракцією хлороформом. Органічний шар промивали насиченим водним розчином хлориду натрію, розчинник випарювали при зниженому тиску, до залишку додавали толуол і розчинник знову випарювали при зниженому тиску. Залишок очищували за допомогою колонкової хроматографії на силікагелі (гексан-етилацетат) і додавали ТГФ (5 мл), метанол (5 мл) і водний розчин 1 Μ гідроксиду натрію (1,47 мл) до отриманої блідо-жовтої піноподібної речовини (620 мг) з наступним перемішуванням при кімнатній температурі протягом 5 хвилин. Розчинник випарювали при зниженому тиску, залишок очищували за допомогою ODS колонкової хроматографії (водаацетонітрил) і стверджували шляхом додавання діетилового ефіру. Цю тверду речовину збирали фільтруванням і потім сушили шляхом нагрівання при зниженому тиску з одержанням натрій 2-(4{[(4'-хлор-2'-метилбіфеніл-3іл)метил]аміно}бензил)3,5-діоксо-1,2,4оксадіазолідин-4-іду (160мг) у вигляді білої твердої речовини. Приклад 11 Суміш 2-(4-амінобензил)-1,2,4-оксадіазолідин3,5-діону (365мг), 2-[(3'-форміл-2,6диметилбіфеніл-4-іл)оксі]етилацетату (660 мг), оцтової кислоти (0,3 мл), ТГФ (20 мл) і молекулярних сит 4А (1 г) перемішували при кімнатній температурі протягом 22 годин. До реакційної суміші додавали триацетоксиборгідрид натрію (560 мг) з наступним перемішуванням при кімнатній температурі протягом 22 годин. До реакційної суміші додавали воду з наступною екстракцією етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску, до залишку додавали толуол, розчинник знову випарювали при зниженому тиску і потім залишок очищували за допомогою колонкової хроматографії на силікагелі (гексан-етилацетат). Метанол (10 мл) і метоксид натрію (52 мг) додавали до отриманої блідо-жовтої піноподібної речовини (406 мг) з наступним перемішуванням протягом 2 годин при одночасному нагріванні при 60°С. Розчинник випарювали при зниженому тиску і до залишку додавали хлороформ із наступним промиванням водою і насиченим водним розчином хлориду натрію і сушінням над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску і ТГФ (5 мл), метанол (5 мл) і водний розчин 1 Μ гідроксиду натрію (0,81 мл) додавали до отриманої блідо-жовтої піноподібної речовини (373 мг) з наступним перемішуванням при кімнатній температурі протягом 5 хвилин. Розчинник випарювали при зниженому тиску, залишок очищували за допомогою ODS ко 94455 40 лонкової хроматографії (вода-ацетонітрил), отриману блідо-жовту піноподібну речовину перетворювали у тверду речовину шляхом додавання діетилового ефіру. Цю тверду речовину збирали фільтруванням і потім сушили шляхом нагрівання при зниженому тиску з одержанням натрій 2- [4({[4'-(2-гідроксіетокси)-2',6'-диметилбіфеніл-3 іл]метил}аміно)бензил]-3,5-діоксо-1,2,4оксадіазолідин-4-іду (226 мг) у вигляді блідожовтої твердої речовини. Приклад 12 Суміш 3-[(3'-форміл-2,2'-диметилбіфеніл-4іл)окси]-1,1-диметилпропілацетату (479мг), 2-(4амінобензил)-1,2,4-оксадіазолідин-3,5-діону (340 мг) і оцтова кислоти (6 мл) перемішували при кімнатній температурі протягом 20 годин. До реакційного розчину додавали триацетоксиборгідрид натрію (573 мг) з наступним перемішуванням при кімнатній температурі протягом 2 годин. Після випарювання розчинника при зниженому тиску до залишку додавали воду з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Отриманий залишок очищували за допомогою колонкової хроматографії на силікагелі (гексан-етилацетат) і суміш отриманої блідо-жовтої піноподібної речовини (719 мг), ТГФ (5 мл), метанолу (5 мл) і водного розчину J Μ гідроксиду натрію (4 мл) перемішували при 50°С протягом 4 годин. рН доводили до 4-5 шляхом додавання розчину 1 Μ хлористоводневої кислоти з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Отриманий залишок очищували за допомогою колонкової хроматографії на силікагелі (гексанетилацетат) і водний розчин 1 Μ гідроксиду натрію (0,89 мл) додавали до суміші отриманого блідожовтого масла (448 мг), ТГФ (3 мл) і метанолу (3 мл) з наступним перемішуванням протягом 10 хвилин. Після випарювання розчинника при зниженому тиску отриманий залишок промивали діетиловим ефіром з одержанням натрій 2-[4-({[4'-(3гідрокси-3-метилбутокси)-2,2'-диметилбіфеніл-3іл]метил}аміно)бензил]-3,5-діоксо-1,2,4оксадіазолідин-4-іду (398 мг) у вигляді білої твердої речовини. Приклад 13 Суміш 3-({3'-[(4-формілфенокси)метил]-2,6диметилбіфеніл-4-іл}окси)пропілацетату (675 мг), гідрохлориду гідроксиламіну (217 мг), ацетату натрію (307 мг), етанолу (15 мл) і води (4 мл) перемішували при кімнатній температурі протягом 18 годин. Розчинник випарювали при зниженому тиску і до залишку додавали воду з наступною екстракцією хлороформом. Органічний шар промивали насиченим водним розчином хлориду натрію і сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску і до залишку додавали оцтову кислоту (5 мл) і ціаноборгідрид натрію (196 мг) з наступним перемішуванням при кімнатній температурі протягом 7 годин. Реакційну систему підлужнювали шляхом додавання насиченого водного розчину карбонату натрію з наступною екстракцією хлороформом. Органічний шар 41 промивали насиченим водним розчином хлориду натрію і потім розчинник випарювали при зниженому тиску. Залишок очищували за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол) і ТГФ (10 мл) додавали до отриманого безбарвного масла (256 мг) з наступним охолодженням льодом. До суміші додавали по краплях хлоркарбонілізоціанат (0,05 мл) з наступним перемішуванням протягом 15,5 годин при кімнатній температурі. Розчинник випарювали при зниженому тиску і до залишку додавали хлороформ із наступним промиванням розчином 1 Μ хлористоводневої кислоти і насиченим водним розчином хлориду натрію. Розчинник випарювали при зниженому тиску, залишок очищували за допомогою колонкової хроматографії на силікагелі (гексан-етилацетат) і до отриманого безбарвного масла (242 мг) додавали метанол (10 мл) і метоксид натрію (92 мг) з наступним перемішуванням при нагріванні при 60°С протягом 2 годин. Розчинник випарювали при зниженому тиску і до залишку додавали воду з наступною екстракцією хлороформом і промиванням насиченим водним розчином хлориду натрію. Розчинник випарювали при зниженому тиску, залишок очищували за допомогою колонкової хроматографії на силікагелі (гексанетилацетат) і до отриманого безбарвного масла (152 мг) додавали ТГФ (5 мл), метанол (5 мл) і водний розчин 1 Μ гідроксиду натрію (0,33 мл) з наступним перемішуванням при кімнатній температурі протягом 5 хвилин. Розчинник випарювали при зниженому тиску, залишок очищували за допомогою ODS колонкової хроматографії (водаацетонітрил), отримане безбарвне масло перетворювали на тверду речовину шляхом додавання діетилового ефіру і цю тверду речовину збирали фільтруванням і потім сушили шляхом нагрівання при зниженому тиску з одержанням натрій 2-(4-{[4'(3-гідроксипропокси)-2',6'-диметилбіфеніл-3іл]метокси}бензил)-3,5-діоксо-1,2,4-оксадіазолідин4-іду (126 мг) у вигляді білої твердої речовини. Приклад 14 Суміш 2-({3'-[(4-формілфенокси)метил]-2метилбіфеніл-4-іл}оксі)етилацетату (935 мг), гідрохлориду гідроксиламіну (480 мг), водного розчину ацетату натрію (760 мг/3 мл) і етанолу (15 мл) перемішували при кімнатній температурі протягом 1,5 годин. Після випарювання розчинника при зниженому тиску до залишку додавали воду (20 мл) з наступною екстракцією етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію, сушили над безводним сульфатом магнію і розчинник випарювали при зниженому тиску з одержанням безбарвного масла (1,07 г). Ціаноборгідрид натрію (430 мг) і оцтову кислоту (1 мл) додавали в зазначеному порядку при охолодженні льодом до суміші отриманого масла, метанолу (10 мл) і ТГФ (10 мл) з наступним перемішуванням протягом 5 хвилин. При поступовому нагріванні реакційної рідини до кімнатної температури, до суміші придатним чином додавали розчин 4 Μ хлористого водню в діоксані (всього 1 мл) з наступним перемішуванням протягом 5 годин. До реакційної рідини додавали насичений водний розчин бікарбонату натрію (20 мл) з насту 94455 42 пною екстракцією хлороформом. Потім органічний шар сушили над безводним сульфатом магнію і розчинник випарювали при зниженому тиску. Отриманий залишок очищували за допомогою колонкової хроматографії на силікагелі (гексанетилацетат) з одержанням безбарвного масла (0,50 г). Хлоркарбонілізоціанат (190 мг) додавали до суміші отриманого масла і ТГФ (5 мл) з наступним перемішуванням при кімнатній температурі протягом 15 хвилин і потім даючи суміші вистоятися протягом ночі. До реакційної рідини додавали воду (10 мл) з наступною екстракцією етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію і сушили над безводним сульфатом магнію. Шляхом випарювання розчинника при зниженому тиску одержували безбарвне масло (413 мг). Суміш цього масла з водним розчином 1 Μ гідроксиду натрію (3 мл), метанолом (3 мл) і ТГФ (6 мл) перемішували при 60°С протягом 3 годин. До реакційної рідини додавали розчин 1 Μ хлористоводневої кислоти (3,5 мл) з наступною екстракцією етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію і розчинник випарювали при зниженому тиску. Отриманий залишок очищували за допомогою колонкової хроматографії на силікагелі (гексан-етилацетат) з одержанням безбарвного масла (331 мг). ТГФ (10 мл), метанол (1 мл) і водний розчин 1 Μ гідроксиду натрію (0,7 мл) додавали до отриманого масла і розчинник випарювали при зниженому тиску. До отриманого залишку додавали діетиловий ефір і тверду речовину збирали фільтруванням і сушили при 60°С при зниженому тиску з одержанням натрій 2-(4-{[4'-(2гідроксіетокси)-2'-метилбіфеніл-3іл]метокси}бензил)-3,5-діоксо-1,2,4-оксадіазолідин4-іду (243 мг) у вигляді безбарвної твердої речовини. Приклад 15 Суміш {[3'-({4-[(3,5-діоксо-1,2,4-оксадіазолідин2-іл)метил]фенокси}метил)-2,6-диметилбіфеніл-4іл]оксі}оцтової кислоти (482 мг), гідрохлориду диметиламіну (165 мг), WSC гідрохлориду (388 мг), триетиламіну (0,56 мл) і ДМФА (10 мл) перемішували при кімнатній температурі протягом 22,5 годин. Розчинник випарювали при зниженому тиску і до залишку додавали розчин 1 Μ хлористоводневої кислоти, з наступною екстракцією хлороформом/метанолом (4/1). Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску і залишок очищували за допомогою колонкової хроматографії на силікагелі (гексан-етилацетат і хлороформ-метанол). Метанол (5 мл), ТГФ (5 мл) і водний розчин 1 Μ гідроксиду натрію (0,36 мл) додавали до отриманого блідо-жовтого масла (178 мг) з наступним перемішуванням при кімнатній температурі протягом 5 хвилин. Розчинник випарювали при зниженому тиску і залишок очищували за допомогою ODS колонкової хроматографії (вода-ацетонітрил). Отриману безбарвну піноподібну речовину отверджували шляхом додавання діетилового ефіру і цю тверду речовину збирали фільт 43 руванням і потім сушили шляхом нагрівання при зниженому тиску з одержанням натрій 2-[4-({4'-[2(диметиламіно)-2-оксоетокси]-2',6'диметилбіфеніл-3-іл}метокси)бензил]-3,5-діоксо1,2,4-оксадіазолідин-4-іду (52 мг) у вигляді білої твердої речовини. Приклад 16 Оксалілдихлорид (0,15 мл) додавали до розчину в ТГФ (10 мл) 2',6'-диметилбіфеніл-3карбонової кислоти (277 мг) з наступним перемішуванням при кімнатній температурі протягом 5 хвилин. Потім додавали ДМФА (1 крапля) з наступним перемішуванням при цій же температурі протягом 1 години. Розчинник випарювали при зниженому тиску і розчин отриманого залишку в ТГФ (10 мл) додавали по краплях до суміші 2-(4амінобензил-1,2,4-оксадіазолідин-3,5-діону (380 мг) і насиченого водного розчину бікарбонату натрію (10 мл) з наступним перемішуванням при кімнатній температурі протягом 2 годин. До реакційної рідини додавали розчин 1 Μ хлористоводневої кислоти (20 мл) з наступною екстракцією етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію і розчинник випарювали при зниженому тиску. Метанол (5 мл), ТГФ (5 мл) і водний розчин 1 Μ гідроксиду натрію (1,2 мл) додавали до отриманого залишку і розчинник випарювали при зниженому тиску. До отриманого залишку додавали ТГФ-гексан і розчинник випарювали при зниженому тиску з наступним сушінням при 50°С при зниженому тиску з одержанням, таким чином, натрій 2-(4-{[(2',6'-диметилбіфеніл-3іл)карбоніл]аміно}бензил)-3,5 діоксо-1,2,4оксадіазолідин-4-іду (530 мг) у вигляді жовтої твердої речовини. Приклад 17 Суміш {[3'-({4-[(3,5-діоксо-1,2,4-оксадіазолідин2-іл)метил]фенокси}метил)-2,6-диметилбіфеніл-4іл]оксі}оцтової кислоти (500 мг), водного розчину 12 Μ етиламіну (0,175 мл), WSC гідрохлориду (302 мг), HOAt (214 мг) і ДМФА (10 мл) перемішували при кімнатній температурі протягом 21,5 годин. До реакційної суміші додавали розчин 1 Μ хлористоводневої кислоти і воду, з наступною екстракцією етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску і залишок очищували за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол і гексанетилацетат). Метанол (3 мл), ТГФ (3 мл) і водний розчин 1 Μ гідроксиду калію (0,611 мл) додавали до отриманої безбарвної піноподібної речовини (308 мг) з наступним перемішуванням при кімнатній температурі протягом 10 хвилин. Розчинник випарювали при зниженому тиску, до залишку додавали етилацетат, розчинник знову випарювали при зниженому тиску. Осаджену тверду речовину збирали фільтруванням і потім сушили шляхом нагрівання при зниженому тиску з одержанням калій 2-[4-({4'-[2-(етиламіно)-2-оксоетокси]-2',6'диметилбіфеніл-3-іл}метокси)бензил]-3,5-діоксо1,2,4-оксадіазолідин-4-іду (300 мг) у вигляді білої твердої речовини. 94455 44 Приклад 18 Суміш 2,2,2-трифтор-1-[({3'-[(4формілфенокси)метил]-2,6-диметилбіфеніл-4іл}окси)метил]етилацетату (590 мг), гідрохлориду гідроксиламіну (253 мг), ацетату натрію (378 мг), етанолу (15 мл) і води (4 мл) перемішували при кімнатній температурі протягом 21 годин. Розчинник випарювали при зниженому тиску і до залишку додавали воду, з наступною екстракцією хлороформом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску, залишок очищували за допомогою колонкової хроматографії на силікагелі (гексан-етилацетат) і до отриманого безбарвного масла (310 мг) додавали оцтову кислоту (8 мл) і ціаноборгідрид натрію (127 мг) з наступним перемішуванням при кімнатній температурі протягом 4 годин. Розчинник випарювали при зниженому тиску і залишок підлужнювали шляхом додавання водного розчину 1 Μ гідроксиду натрію, з наступною екстракцією хлороформом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску, залишок очищували за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол). До отриманої безбарвної піноподібної речовини (266 мг) додавали ТГФ (10 мл) з наступним охолодженням льодом. Потім до суміші додавали по краплях етоксикарбонілізоціанат (0,065 мл) з наступним перемішуванням при 0°С протягом деякого часу, а потім перемішуванням при кімнатній температурі протягом 4 днів. До реакційної суміші додавали воду з наступною екстракцією етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім розчинник випарювали при зниженому тиску. Залишок очищували за допомогою колонкової хроматографії на силікагелі (гексан-етилацетат) і ТГФ (5 мл) і до отриманої безбарвної піноподібної речовини додавали водний розчин 1 Μ гідроксиду натрію (0,36 мл) з наступним перемішуванням при кімнатній температурі протягом 6 годин. Розчинник випарювали при зниженому тиску і до залишку додавали розчин 1 Μ хлористоводневої кислоти з наступною екстракцією хлороформом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску і залишок очищували за допомогою колонкової хроматографії на силікагелі (гексанетилацетат). Метанол (4 мл), ТГФ (4 мл) і водний розчин 1 Μ гідроксиду калію (0,31 мл) додавали до отриманої безбарвної піноподібної речовини (164 мг) з наступним перемішуванням при кімнатній температурі протягом 10 хвилин. Розчинник випарювали при зниженому тиску, до залишку додавали етилацетат і розчинник знову випарювали при зниженому тиску. До залишку додавали діетиловий ефір з наступним перемішуванням при кімнатній температурі. Осаджену тверду речовину збирали фільтруванням і потім сушили шляхом нагрівання при зниженому тиску з одержанням калій 2-(4-{[2',6'-диметил-4' -(3,3,3 -трифтор-2 45 гідроксипропокси)біфеніл-3 -іл]метокси} бензил)3,5 -діоксо-1,2,4-оксадіазолідин-4-іду (163 мг) у вигляді білої твердої речовини. Приклад 19 Суміш 2-(4-{[4'-(2-гідроксипропокси)-2',6'диметилбіфеніл-3-іл]метокси}бензил)-1,2,4оксадіазолідин-3,5-діону (240 мг), 1,1,1триацетокси-1,1-дигідро-1,2-бензойодоксол-3(1Н)ону (320 мг) і дихлорметану (10 мл) перемішували при кімнатній температурі протягом 1,5 годин. До реакційної суміші додавали воду з наступною екстракцією хлороформом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію і розчинник випарювали при зниженому тиску. Залишок очищували за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол і гексан-етилацетат) і до отриманої безбарвної піноподібної речовини (196 мг) додавали метанол (3 мл), ТГФ (3 мл) і водний розчин 1 Μ гідроксиду натрію (0,41 мл) з наступним перемішуванням при кімнатній температурі протягом 10 хвилин. Розчинник випарювали при зниженому тиску і залишок очищували за допомогою ODS колонкової хроматографії (вода-ацетонітрил). Отриману безбарвну піноподібну речовину стверджували шляхом додавання діетилового ефіру і цю тверду речовину збирали фільтруванням і сушили шляхом нагрівання при зниженому тиску з одержанням натрій 2-(4-{[2',6'-диметил-4'-(2оксопропокси)біфеніл-3-іл]метокси}бензил)-3,5діоксо-1,2,4-оксадіазолідин-4-іду (70 мг) у вигляді білої твердої речовини. Приклад 20 Суміш трет-бутил[2-({3'-[(4формілфенокси)метил]-2,6-диметилбіфеніл-4іл}оксі)етил]карбамату (505 мг), гідрохлориду гідроксиламіну (221 мг), ацетату натрію (331 мг), етанолу (15 мл) і води (4 мл) перемішували при кімнатній температурі протягом 24 годин. Розчинник випарювали при зниженому тиску і до залишку додавали воду, з наступною екстракцією хлороформом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску і до залишку додавали оцтову кислоту (10 мл) і ціаноборгідрид натрію (167 мг) з наступним перемішуванням при кімнатній температурі протягом 4 годин. Реакційну суміш підлужнювали шляхом додавання водного розчину 1 Μ гідроксиду натрію з наступною екстракцією хлороформом. Органічний шар промивали насиченим водним розчином хлориду натрію і потім сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску і до отриманої безбарвної піноподібної речовини (528 мг) додавали ТГФ (8 мл) з наступним охолодженням льодом. До реакційної суміші додавали по краплях хлоркарбонілізоціанат (0,094 мл) з наступним перемішуванням при кімнатній температурі протягом 14,5 годин. Розчинник випарювали при зниженому тиску і до залишку додавали насичений водний розчин хлориду амонію з наступною екстракцією хлороформом. Органічний шар промивали насиченим водним розчином хлориду натрію і по 94455 46 тім сушили над безводним сульфатом магнію. Розчинник випарювали при зниженому тиску і залишок очищували за допомогою колонкової хроматографії на силікагелі (гексан-етилацетат). До отриманої безбарвної піноподібної речовини додавали етилацетат (3 мл) з наступним охолодженням льодом. До реакційної суміші додавали по краплях розчин 4 Μ хлористого водню в етилацетаті (12 мл) з наступним перемішуванням при 0°С протягом 2 годин. Розчинник випарювали при зниженому тиску і до отриманої блідо-жовтої піноподібної речовини додавали діетиловий ефір-гексан з наступним перемішуванням при кімнатній температурі. Цю тверду речовину збирали фільтруванням і потім сушили шляхом нагрівання при зниженому тиску з одержанням гідрохлориду 2-(4-{[4'-(2аміноетокси)-2',6'-диметилбіфеніл-3іл]метокси}бензил)- 1,2,4-оксадіазолідин-3,5-діону (200 мг) у вигляді блідо-жовтої твердої речовини. Приклад 21 Суміш етил 2-({3'-[(4-формілфенокси)метил]2,2'-диметилбіфеніл-4-іл}окси)-2-метилпропаноату (1,87 г), гідрохлориду гідроксиламіну (378 мг), ацетату натрію (515 мг), етанолу (36 мл) і води (9 мл) перемішували при кімнатній температурі протягом 3 годин. Після випарювання розчинника при зниженому тиску до залишку додавали воду з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Ціаноборгідрид натрію (790 мг) додавали до розчину в оцтовій кислоті (20 мл) отриманої блідо-жовтої піноподібної речовини (1,95 г) з наступним перемішуванням при кімнатній температурі протягом 3 годин. Реакційний розчин підлужнювали шляхом додавання насиченого водного розчину бікарбонату натрію і карбонату натрію з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Отриманий залишок очищували за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол) і до розчину отриманої безбарвної піноподібної речовини (1,17 г) у ТГФ (15 мл) додавали хлоркарбонілізоціанат (0,234 мл) при охолодженні льодом з наступним перемішуванням при кімнатній температурі протягом 24 годин. До реакційної суміші додавали розчин 1 Μ хлористоводневої кислоти з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Суміш отриманої безбарвної піноподібної речовини (1,43 г), ТГФ (15 мл), метанолу (15 мл) і водного розчину 1 Μ гідроксиду натрію (15 мл) перемішували при 60°С протягом 1 години. Розчинник випарювали при зниженому тиску і до отриманого залишку додавали розчин 1 Μ хлористоводневої кислоти з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску з одержанням 2-{[3'-({4-[(3,5-діоксо1,2,4-оксадіазолідин-2-іл)метил]фенокси}метил)2,2'-диметилбіфеніл-4-іл]окси}-2-метилпропанової кислоти (1,29 г) у вигляді безбарвного піноподібної речовини. До суміші отриманої 2-{[3'-({4-[(3,5 47 діоксо-1,2,4-оксадіазолідин-2іл)метил]фенокси}метил)-2,2'-диметилбіфеніл-4іл]окси}-2-метилпропанової кислоти (291 мг), ТГФ (3 мл) і метанолу (3 мл) додавали водний розчин 1 Μ гідроксиду натрію (1,15 мл) з наступним перемішуванням протягом 10 хвилин. Потім розчинник випарювали при зниженому тиску. Шляхом перекристалізації отриманого залишку з етанолу-води одержували динатрій 2-{[3'-({4-[(3,5-діоксо-1,2,4оксадіазолідин-2-іл)метил]фенокси}метил)-2,2'диметилбіфеніл-4-іл]окси}-2-метилпропаноат (149 мг) у вигляді білих кристалів. Приклад 22 При охолодженні льодом, розчин 4 Μ хлористого водню в діоксані (15 мл) додавали по краплях до суміші трет-бутил (3-{[3'-({4-[(3,5-діоксо-1,2,4оксадіазолідин-2-іл)метил]фенокси}метил)-2,2'диметилбіфеніл-4-іл]окси}пропіл)карбамату (1,95 г) і етилацетату (5 мл) з наступним перемішуванням при 0°С протягом деякого часу і потім перемішуванням при кімнатній температурі протягом 1,5 годин. Розчинник випарювали при зниженому тиску й осаджену тверду речовину збирали фільтруванням і сушили шляхом нагрівання при зниженому тиску з одержанням гідрохлориду 2-(4-{[4'-(3амінопропокси)-2,2'-диметилбіфеніл-3іл]метокси}бензил)-1,2,4-оксадіазолідин-3,5-діону (1,53 г) у вигляді білої твердої речовини. Приклад 23 Суміш натрій 2-{4-[(4'-{[(4R)-2,2-диметил-1,3діоксолан-4-іл]метокси}-2,2'-диметилбіфеніл-3іл)метокси]бензил}-3,5-діоксо-1,2,4-оксадіазолідин4-іду (467 мг), 1 Μ хлористоводневої кислоти (5 мл) і ТГФ (5 мл) перемішували при 50°С протягом 2 годин. Після охолодження до кімнатної температури до реакційної суміші додавали воду (10 мл) з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Водний розчин 1 Μ гідроксиду натрію (0,977 мл) додавали до розчину отриманого залишку в ТГФ (5 мл) з наступним концентруванням при зниженому тиску. Шляхом промивання отриманого залишку діетиловим ефіром одержували натрій 2-{[(4'{[(2S)-2,2-дигідроксипропіл]окси}-2,2'диметилбіфеніл-3-іл)метокси]бензил}-3,5-діоксо1,2,4-оксадіазолідин-4-ід (392 мг) у вигляді білої твердої речовини. Приклад 24 Суміш 2,2-дифтор-2-({3'-[(4формілфенокси)метил]-2,2'-диметилбіфеніл-4іл}окси)-N-метилацетаміду, гідрохлориду гідроксиламіну (122 мг), ацетату натрію (167 мг), етанолу (12 мл) і води (3 мл) перемішували при кімнатній температурі протягом 16 годин. До реакційної суміші додавали воду з наступною екстракцією хлороформом. Після сушіння органічного шару над безводним сульфатом магнію розчинник випарювали при зниженому тиску. Ціаноборгідрид натрію (257 мг) додавали до розчину в метанолі (5 мл) ТГФ (5 мл) отриманої безбарвної піноподібної речовини (594 мг) і потім при охолодженні льодом до реакційної суміші повільно додавали по краплях розчин 4 Μ хлористого водню в діоксані (2мл). Реакційну суміш перемішували при кімнатній темпе 94455 48 ратурі протягом 2 годин. До реакційної суміші додавали водний розчин 1 Μ гідроксиду натрію (7 мл), при охолодженні льодом, з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Отриманий залишок очищували за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол), до отриманого безбарвного масла додавали ТГФ (6 мл) (559 мг) з наступним охолодженням льодом. До реакційної суміші додавали по краплях етоксикарбонілізоціанат (0,152 мл) з наступним перемішуванням при 0°С протягом 30 хвилин і потім перемішуванням при кімнатній температурі протягом 1 години. До реакційної суміші додавали водний розчин 1 Μ гідроксиду натрію (3 мл) з наступним перемішуванням при кімнатній температурі протягом 12 годин. До реакційної суміші додавали розчин 1 Μ хлористоводневої кислоти (4 мл) з наступною екстракцією хлороформом. Органічний шар сушили над безводним сульфатом магнію і потім розчинник випарювали при зниженому тиску. Шляхом очищення отриманого залишку за допомогою колонкової хроматографії на силікагелі (хлороформ-метанол) одержували 2-{[3'-({4-[(3,5-діоксоі,2,3-оксадіазолідин-2-іл)метил]фенокси}метил)2,2'-диметилбіфеніл-4-іл]окси}-2,2-дифтор-Nметилацетамід (76 мг) у вигляді безбарвного піноподібної речовини і {[3'-({4-[(3,5-діоксо-1,2,4оксадіазолідин-2-іл)метил]фенокси}метил)-2,2'диметилбіфеніл-4-іл]окси}(дифтор)оцтову кислоту (217 мг) у вигляді безбарвного піноподібної речовини. До розчину в ТГФ (5 мл) отриманої {[3'-({4[(3,5-діоксо-1,2,4-оксадіазолідин-2іл)метил]фенокси}метил)-2,2'-диметилбіфеніл-4іл]окси}(дифтор)оцтової кислоти додавали водний розчин 1 Μ гідроксиду натрію (0,847 мл) з наступним концентруванням при зниженому тиску. Шляхом промивання отриманого залишку діетиловим ефіром одержували динатрій {[3'-({4-[(3,5-діоксо1,2,4-оксадіазолідин-4-ід-2іл)метил]фенокси}метил)-2,2'-диметилбіфеніл-4іл]окси}(дифтор)ацетат (203 мг) у вигляді білої твердої речовини. Приклад 25 3'-({4-[(3,5-діоксо-1,2,4-оксадіазолідин-2іл)метил]фенокси}метил)-2-метилбіфеніл-4карбонову кислоту (10,8 мг) розчиняли в змішаному розчині ТГΦ-метанолу [1 мл, 4:1 (об/об)] і розчин додавали до піролідину (3,2 мг). Додавали DMT-MM (12 мг) з наступним перемішуванням протягом ночі при кімнатній температурі. Потім до реакційної рідини додавали хлороформ і органічний шар промивали розчином 1 Μ хлористоводневої кислоти. Органічний шар концентрували і залишок очищували за допомогою фракціонованої ВЕРХ (Waters, найменування продукту: Waters SunFire™ Prep C18OBD™ (19x100 мм, 5 мкм)) з одержанням 2-(4-{[2'-метил-4'-(піролідин-1ілкарбоніл)біфеніл-3-іл]метокси}бензил)-1,2,4оксадіазолідин-3,5-діону (8,2 мг). Приклад 26 3'-({4-[(3,5-діоксо-1,2,4-оксадіазолідин-2іл)метил]фенокси}метил)-2-метилбіфеніл-4карбонову кислоту (10,8 мг) розчиняли в змішано 49 му розчині ΊΤΦ-метанолу [1 мл, 4:1 (об/об)] і розчин додавали до гідрохлориду 4(метоксиметил)піперидину (7,5 мг). Додавали DMT-MM (12 мг) і триетиламін (20 мкл) з наступним перемішуванням протягом ночі при кімнатній температурі. Потім до реакційної рідини додавали хлороформ і органічний шар промивали розчином 1 Μ хлористоводневої кислоти. Органічний шар концентрували і залишок очищували за допомогою фракціонованої ВЕРХ (Waters, найменування продукту: Waters SunFire™ Prep C18OBD™ (19x100мм, 5мкм)) з одержанням 2-{4-[(4'-{[4(метоксиметил)піперидин-1-іл]карбоніл}-2'метилбіфеніл-3-іл)метокси]бензил}-1,2,4оксадіазолідин-3,5-діону (9,0 мг). Приклад 27 3' -({4- [(3,5 - діоксо-1,2,4-оксадіазолі дин-2іл)метил] фенокси} метил)-2-метилбіфеніл-4карбонову кислоту (10,8 мг) розчиняли в змішаному розчині ТГФ-метанолу [1 мл, 4:1 (об/об)] і розчин додавали до 1-етилпіперидин-3-аміну (5,8 мг). Додавали DMT-MM (12 мг) з наступним перемішуванням протягом ночі при кімнатній температурі. 94455 50 Потім до реакційної рідини додавали хлороформ і органічний шар промивали водою. Органічний шар концентрували і залишок очищували за допомогою фракціонованої ВЕРХ (Waters, найменування продукту: Waters SunFire™ Prep C18OBD™ (19x100 мм, 5 мкм)) з одержанням 3'-({4-[(3,5-діоксо-1,2,4оксадіазолідин-2-іл)метил]фенокси}метил)-N-(1етилпіперидин-3-іл)-2-метилбіфеніл-4карбоксаміда (3,4 мг). Таким же способом, як у способах прикладів 127, одержували сполуки прикладів 28-407, представлені в таблицях нижче, з використанням відповідних вихідних речовин, відповідно. Структури сполук прикладів представлені в таблицях 53-113, а способи одержання і фізико-хімічні дані в таблицях 114-135. Крім того, структури інших сполук за даним винаходом представлені в таблицях 136-138. їх можна легко синтезувати з використанням зазначених вище способів одержання, способів, описаних у прикладах, і способів, очевидних для фахівців у даній галузі, або способів, що представляють собою модифікацію таких способів. 51 94455 52 53 94455 54 55 94455 56 57 94455 58 59 94455 60
ДивитисяДодаткова інформація
Назва патенту англійськоюOxadiazolidinedione compound
Автори англійськоюNegoro Kenji, Iwasaki Fumiyoshi, Ohnuki Kei, Kurosaki Toshio, Yonetoku Yasuhiro, Asai Norio, Yoshida Shigeru, Soga Takatoshi
Назва патенту російськоюОксадиазолидиндионовое соединение
Автори російськоюНегора Кендзи, Ивасаки Фумийоси, Охнуки Кей, Куросаки Тосио, Йонетоку Ясухиро, Асаи Норио, Йосида Сигера, Сога Такатоса
МПК / Мітки
МПК: C07D 271/06, A61K 31/4245, A61P 3/10, A61P 3/08, C07D 413/12, A61P 43/00, A61K 31/4439
Мітки: сполука, оксадіазолідиндіонова
Код посилання
<a href="https://ua.patents.su/80-94455-oksadiazolidindionova-spoluka.html" target="_blank" rel="follow" title="База патентів України">Оксадіазолідиндіонова сполука</a>
Попередній патент: Глюкопіранозилзаміщені похідні бензонітрилу
Наступний патент: Спосіб визначення ph рідини і пристрій для його здійснення
Випадковий патент: Спосіб лікування хворих на травматичну енцефалопатію з лікворно-дисциркуляторним та/або вегетативно-судинним синдромом












