Глюкопіранозилзаміщені похідні бензонітрилу
Номер патенту: 94454
Опубліковано: 10.05.2011
Автори: Томас Лео, Хіммельсбах Франк, Зауер Ахім, Екхардт Маттіас, Айкельманн Петер
Формула / Реферат
1. Глюкопіранозилзаміщена похідна бензонітрилу формули І
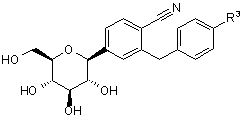 , (I)
, (I)
у якій
R3 означає водень, фтор, хлор, бром, йод, метил, етил, пропіл, ізопропіл, бутил, втор-бутил, ізобутил, трет-бутил, 3-метилбут-1-ил, циклопропіл, циклобутил, циклопентил, циклогексил, 1-гідроксициклопропіл, 1-гідроксициклобутил, 1-гідроксициклопентил, 1-гідроксициклогексил, дифторметил, трифторметил, пентафторетил, 2-гідроксіетил, гідроксиметил, 3-гідроксипропіл, 2-гідрокси-2-метилпроп-1-іл, 3-гідрокси-3-метилбут-1-ил, 1-гідрокси-1-метилетил, 2,2,2-трифтор-1-гідрокси-1-метилетил, 2,2,2-трифтор-1-гідрокси-1-трифторметилетил, 2-метоксіетил, 2-етоксіетил, гідроксигрупу, дифторметилоксигрупу, трифторметилоксигрупу, 2-метилоксіетилоксигрупу, метилсульфаніл, метилсульфініл, метилсульфоніл, етилсульфініл, етилсульфоніл, триметилсиліл або ціаногрупу,
або її похідна, у якій одна або більша кількість гідроксигруп b-D-глюкопіранозильної групи ацильовані групами, вибраними із групи, яка включає (С1-С18-алкіл)карбоніл, (С1-С18-алкіл)оксикарбоніл, фенілкарбоніл і феніл-(С1-С3-алкіл)карбоніл;
або її таутомери, стереоізомери, їх суміш; або її фізіологічно прийнятна сіль.
2. Глюкопіранозилзаміщена похідна бензонітрилу за п. 1, яка характеризується тим, що атом водню гідроксигрупи атома 0-6 b-D-глюкопіранозильної групи заміщений групою, вибраною із групи, яка включає (С1-С8-алкіл)карбоніл, (С1-С8-алкіл)оксикарбоніл і фенілкарбоніл, або її фізіологічно прийнятна сіль.
3. Глюкопіранозилзаміщена похідна бензонітрилу за п. 1, яка характеризується тим, що вибрана з групи, що включає
(1) 2-(4-етилбензил)-4-(b-D-глюкопіраноз-1-ил)-бензонітрил,
(2) 4-(b-D-глюкопіраноз-1-ил)-2-(4-гідроксибензил)-бензонітрил,
(3) 4-(b-D-глюкопіраноз-1-ил)-2-(4-метилбензил)-бензонітрил,
(4) 2-(4-ціанобензил)-4-(b-D-глюкопіраноз-1-ил)-бензонітрил,
(5) 4-(b-D-глюкопіраноз-1-ил)-2-(4-метоксіетоксибензил)-бензонітрил,
(6) 4-(b-D-глюкопіраноз-1-ил)-2-(4-трифторметоксибензил)-бензонітрил,
(7) 4-(b-D-глюкопіраноз-1-ил)-2-(4-трифторметилбензил)-бензонітрил,
(8) 4-(b-D-глюкопіраноз-1-ил)-2-(4-ізопропілбензил)-бензонітрил,
(9) 4-(b-D-глюкопіраноз-1-ил)-2-(4-трет-бутилбензил)-бензонітрил,
(10) 4-(b-D-глюкопіраноз-1-ил)-2-(4-триметилсилілбензил)-бензонітрил,
(11) 4-(b-D-глюкопіраноз-1-ил)-2-(4-метилсульфанілбензил)-бензонітрил,
(12) 4-(b-D-глюкопіраноз-1-ил)-2-[4-(3-метилбут-1-ил)-бензил]-бензонітрил,
(13) 2-(4-фторбензил)-4-(b-D-глюкопіраноз-1-ил)-бензонітрил,
(14) 2-(4-хлорбензил)-4-(b-D-глюкопіраноз-1-ил)-бензонітрил,
(15) 2-(4-дифторметоксибензил)-4-(b-D-глюкопіраноз-1-ил)-бензонітрил,
(16) 2-(4-дифторметилбензил)-4-(b-D-глюкопіраноз-1-ил)-бензонітрил,
(17) 2-(4-циклопропілбензил)-4-(b-D-глюкопіраноз-1-ил)-бензонітрил,
(18) 2-(4-циклобутилбензил)-4-(b-D-глюкопіраноз-1-ил)-бензонітрил,
(19) 4-(b-D-глюкопіраноз-1-ил)-2-(4-проп-1-ілбензил)-бензонітрил,
(20) 4-(b-D-глюкопіраноз-1-ил)-2-[4-(1-гідроксициклопропіл)-бензил]-бензонітрил,
(21) 4-(b-D-глюкопіраноз-1-ил)-2-(4-йодбензил)-бензонітрил,
(22) 2-(4-бромбензил)-4-(b-D-глюкопіраноз-1-ил)-бензонітрил,
(23) 4-(b-D-глюкопіраноз-1-ил)-2-(4-пентафторетилбензил)-бензонітрил,
(24) 4-(b-D-глюкопіраноз-1-ил)-2-(4-метилсульфінілбензил)-бензонітрил,
(25) 4-(b-D-глюкопіраноз-1-ил)-2-(4-метилсульфонілбензил)-бензонітрил.
4. Глюкопіранозилзаміщена похідна бензонітрилу за будь-яким з пп. 1-3 у формі її фізіологічно прийнятної солі з неорганічною або органічною кислотою.
Текст
1. Глюкопіранозилзаміщена похідна бензонітрилу формули І N R3 2 (19) 1 3 94454 4 (14) 2-(4-хлорбензил)-4-(-D-глюкопіраноз-1-ил)бензонітрил, (15) 2-(4-дифторметоксибензил)-4-(-Dглюкопіраноз-1-ил)-бензонітрил, (16) 2-(4-дифторметилбензил)-4-(-Dглюкопіраноз-1-ил)-бензонітрил, (17) 2-(4-циклопропілбензил)-4-(-D-глюкопіраноз1-ил)-бензонітрил, (18) 2-(4-циклобутилбензил)-4-(-D-глюкопіраноз1-ил)-бензонітрил, (19) 4-(-D-глюкопіраноз-1-ил)-2-(4-проп-1ілбензил)-бензонітрил, (20) 4-(-D-глюкопіраноз-1-ил)-2-[4-(1гідроксициклопропіл)-бензил]-бензонітрил, (21) 4-(-D-глюкопіраноз-1-ил)-2-(4-йодбензил)бензонітрил, (22) 2-(4-бромбензил)-4-(-D-глюкопіраноз-1-ил)бензонітрил, (23) 4-(-D-глюкопіраноз-1-ил)-2-(4пентафторетилбензил)-бензонітрил, (24) 4-(-D-глюкопіраноз-1-ил)-2-(4метилсульфінілбензил)-бензонітрил, (25) 4-(-D-глюкопіраноз-1-ил)-2-(4метилсульфонілбензил)-бензонітрил. 4. Глюкопіранозилзаміщена похідна бензонітрилу за будь-яким з пп. 1-3 у формі її фізіологічно прийнятної солі з неорганічною або органічною кислотою. Даний винахід стосується глюкопіранозилзаміщених похідних бензонітрилy загальної формули I Інші задачі даного винаходу стануть зрозумілі спеціалісту з наведених вище та нижче даних. Першим об'єктом даного винаходу є глюкопіранозилзаміщені похідні бензонітрилу формули І I I 3 у якій група R визначена нижче в даному винаході, включаючи їх таутомери, стереоізомери, їх суміші і їх солі. Даний винахід також стосується фармацевтичних композицій, які містять сполуку формули І, пропоновану в даному винаході, а також застосування сполуки, пропонованої в даному винаході, для приготування фармацевтичної композиції, призначеної для лікування або попередження метаболічних порушень. Крім того, даний винахід стосується способів приготування фармацевтичної композиції, а також сполуки, пропонованої в даному винаході. У літературі сполуки, які здійснюють інгібуючий вплив на натрієзалежний співпереносник глюкози SGLT2 запропоновані для лікування захворювань, краще - діабету. Глюкопіранозилзаміщені ароматичні групи і їх одержання і їх можлива активність як інгібітори SGLT2 описані в заявці WO 2005/092877 і в цитованих в ній публікаціях. Задачею даного винаходу є одержання нових глюкопіранозилзаміщених похідних бензонітрилу, краще таких, які активні відносно натрієзалежного співпереноснику глюкози SGLT, краще - SGLT2. Іншою задачею даного винаходу є одержання глюкопіранозилзаміщених похідних бензолу, які здійснюють більш значний інгібуючий вплив на натрієзалежний співпереносник глюкози SGLT2 in vitro і/або in vivo, ніж відомі структурно подібні сполуки, і/або мають кращі фармакологічні або фармакокінетичні характеристики. Іншою задачею даного винаходу є одержання нових фармацевтичних композицій, які застосовні для попередження і/або лікування метаболічних порушень, краще - діабету. у якій 3 R означає водень, фтор, хлор, бром, йод, метил, етил, пропіл, ізопропіл, бутил, втор-бутил, ізобутил, трет-бутил, 3-метилбут-1-ил, циклопропіл, циклобутил, циклопентил, циклогексил, 1гідроксициклопропіл, 1-гідроксициклобутил, 1гідроксициклопентил, 1-гідроксициклогексил, дифторметил, трифторметил, пентафторетил, 2гідроксіетил, гідроксиметил, 3-гідроксипропіл, 2гідрокси-2-метилпроп-1-іл, 3-гідрокси-3-метилбут1-ил, 1-гідрокси-1-метилетил, 2,2,2-трифтор-1гідрокси-1-метилетил, 2,2,2-трифтор-1-гідрокси-1трифторметилетил, 2-метоксіетил, 2-етоксіетил, гідроксигрупу, дифторметилоксигрупу, трифторметоксигрупу, 2-метилоксіетилоксигрупу, метилсульфаніл, метилсульфініл, метилсульфоніл, етилсульфІніл, етилсульфоніл, триметилсиліл або ціаногрупу, або його похідна, у якій одна або більша кількість гідроксигруп β-D-глюкопіранозильної групи ациловані групами, вибраними із групи, яка включає (С1-С18-алкіл)карбоніл, (С1-С18алкіл)оксикарбоніл, фенілкарбоніл і феніл-(С1-С3алкіл)-карбоніл; включаючи їх таутомери, стереоізомери і їх суміші; і їх фізіологічно прийнятні солі. Сполуки, пропоновані в даному винаході, і їх фізіологічно прийнятні солі мають цінні фармакологічні характеристики, зокрема, здійснюють інгібуючий вплив на натрієзалежний співпереносник глюкози SGLT, краще - SGLT2. Крім того, сполуки, пропоновані в даному винаході, можуть здійснювати інгібуючий вплив на натрієзалежний співпереносник глюкози SGLT1. У порівнянні з можливим інгібуючим впливом на SGLT1 сполуки, пропоно 5 вані в даному винаході, переважно селективно інгібують SGLT2. Даний винахід також стосується фізіологічно прийнятних солей сполук, пропонованих у даному винаході, з неорганічними або органічними кислотами. Даний винахід також стосується фармацевтичних композицій, які містять принаймні одну сполуку, пропоновану в даному винаході, або фізіологічно прийнятну сіль, пропоновану в даному винаході, необов'язково разом з одним або більшою кількістю інертних носіїв і/або розріджувачів. Даний винахід також стосується застосування принаймні однієї сполуки, пропонованої в даному винаході, або її фізіологічно прийнятної солі для приготування фармацевтичної композиції, яка застосовна для лікування або попередження захворювань або патологічних станів, на які можна впливати шляхом інгібування натрієзалежного співпереносника глюкози SGLT, краще - SGLT2. Даний винахід також стосується застосування принаймні однієї сполуки, пропонованої в даному винаході, або її фізіологічно прийнятної солі для приготування фармацевтичної композиції, яка застосовна для лікування однієї або більшої кількості метаболічних порушень. Іншим об'єктом даного винаходу є застосування принаймні однієї сполуки, пропонованої в даному винаході, або однієї з її фізіологічно прийнятних солей для приготування фармацевтичної композиції, призначеної для попередження дегенерації бета-клітин панкреатичних острівців і/або для поліпшення і/або відновлення функціональної активності бета-клітин панкреатичних острівців. Іншим об'єктом даного винаходу є застосування принаймні однієї сполуки, пропонованої в даному винаході, або однієї з її фізіологічно прийнятних солей для приготування фармацевтичної композиції, призначеної для попередження, уповільнення, затримування або лікування захворювань або патологічних станів, обумовлених аномальним накопиченням жиру в печінці, у пацієнта, який потребує цього. Даний винахід також стосується застосування принаймні однієї сполуки, пропонованої в даному винаході, або її фізіологічно прийнятної солі для приготування фармацевтичної композиції, призначеної для інгібування натрієзалежного співпереносника глюкози SGLT, краще - SGLT2. Даний винахід також стосується способу приготування фармацевтичної композиції, пропонованої в даному винаході, який характеризується тим, що сполуку, пропоновану в даному винаході, або одну з її фізіологічно прийнятних солей включають в один або більшу кількість інертних носіїв і/або розріджувачів за допомогою нехімічної методики. Даний винахід також стосується способу одержання сполук загальної формули І, пропонованих у даному винаході, який характеризується тим, що а) для одержання сполук загальної формули І, які визначені вище та нижче в даному винаході, сполуку загальної формули II 94454 6 II у якій R' означає Н, С1-С4-алкіл, (С1-C18алкіл)карбоніл, (С1-С18-алкіл)оксикарбоніл, арилкарбоніл і арил-(С1-C3-алкіл)-карбоніл, де алкільні або арильні групи можуть бути моно- або полізаміщені галогеном; 8a 8b 8c 8d R , R , R , R незалежно один від одного означають водень або алільну групу, бензильну групу, (С1-С4.алкіл)карбоніл, (С1С4.алкіл)оксикарбоніл, арилкарбоніл, арил-(С1-С3алкіл)-карбоніл і арил-(С1-С3-алкіл)-оксикарбоніл a b c або групу R R R Si, або кетальну або ацетальну групу, краще - алкіліденову або арилалкіліденову кетальну або ацетальну групу, де в кожному випа8a 8b 8c 8d дку дві сусідні групи R , R , R , R можуть утворити циклічну кетальну або ацетальну групу або 1,2-ді(С1-С3-алкокси)-1,2-ді(С1-С3-алкіл)етиленовий місток, де зазначений вище етиленовий місток разом із двома атомами кисню та двома зв'язаними з ними атомами вуглецю піранозного кільця утворюють заміщене діоксанове кільце, краще - 2,3-диметил-2,3-ді(С1-С3-алкокси)-1,4діоксанове кільце, і де алкільні, алільні, арильні і/або бензильні групи можуть бути моно- або полізаміщені галогеном або С1-С3-алкоксигрупою, і де бензильні групи також можуть бути заміщені ди(С1-С3-алкіл)аміногрупою; і a b c R , R , R незалежно один від одного означають С1-С4-алкіл, арил або арил-С1-С3-алкіл, де арильні або алкільні групи можуть бути моно- або полізаміщені галогеном; де арильні групи, зазначені у визначенні відзначених вище груп, означають фенільні або нафтильні групи, краще - фенільні групи; 3 і в якій група R визначена вище та нижче в даному винаході; вводять у реакцію з відновленим реагентом у присутності кислоти Льюїса або Бренстеда та будь-які захисні групи, які містяться, відщеплюють одночасно або послідовно; або b) для одержання сполук загальної формули І, сполуку загальної формули III III 8a 8b 8c 8d 3 у якій R , R , R , R та R визначені вище та нижче в даному винаході, за умови, що принаймні 8a один замісник, вибраний із групи, яка включає R , 8b 8c 8d R , R , R , не означає водень; 8a 8b 8c 8d захисні групи R , R , R , R , які не означають водень, відщеплюють; і при необхідності одержану в такий спосіб сполуку загальної формули І шляхом ацилування пе 7 ретворюють на відповідний ацил загальної формули І, і/або при необхідності відщеплюють будь-яку захисну групу, яка використовується в описаних вище реакціях, і/або при необхідності одержану в такий спосіб сполуку загальної формули І розділяють на її стереоізомери і/або при необхідності одержану в такий спосіб сполуку загальної формули І перетворюють на її солі, для застосування у фармацевтиці краще - у її фізіологічно прийнятні солі. Іншим об'єктом даного винаходу є нові проміжні продукти, описані на схемах реакцій і в експериментальній частині нижче в даному винаході. Об'єкти даного винаходу, зокрема, сполуки, фармацевтичні композиції та їх застосування стосуються глюкопіранозилзаміщених похідних бензонітрилу загальної формули І, визначених вище та нижче в даному винаході, або їх похідних, включаючи їх таутомери, стереоізомери та їх суміші, і їх фізіологічно прийнятні солі. Нижче описані альтернативні кращі варіанти здійснення даного винаходу: У першому варіанті здійснення даного винахо3 ду R означає водень, фтор, хлор, бром, йод, метил, етил, пропіл, ізопропіл, бутил, втор-бутил, ізобутил, трет-бутил, 3-метилбут-1-ил, циклопропіл, циклобутил, циклопентил, циклогексил, дифторметил, трифторметил, пентафторетил, 2гідроксіетил, гідроксиметил, 3-гідроксипропіл, 2гідрокси-2-метилпроп-і-іл, 3-гідрокси-3-метилбут-1ил, 1-гідрокси-1-метилетил, 2,2,2- трифтор-1гідрокси-1-метилетил, 2,2,2-трифтор-1-гідрокси-1трифторметилетил, 2-метоксіетил, 2-етоксіетил, гідроксигрупу, дифторметилоксигрупу, трифторметилоксигрупу, 2-метилоксіетилоксигрупу, метилсульфаніл, метилсульфініл, метилсульфоніл, етилсульфініл, етилсульфоніл, триметилсиліл або ціаногрупу. У другому варіанті здійснення дан ого винахо3 ду R означає водень, фтор, хлор, бром, йод, гідроксигрупу, дифторметилоксигрупу, трифторметилоксигрупу, 2-метилоксіетилоксигрупу, метилсульфаніл, метилсульфініл, метилсульфоніл, етилсульфініл, етилсульфоніл, триметилсиліл або ціаногрупу. У третьому варіанті здійснення даного вина3 ходу R означає метил, етил, пропіл, ізопропіл, бутил, втор-бутил, ізобутил, трет-бутил, 3метилбут-1-ил, циклопропіл, циклобутил, циклопентил, циклогексил, дифторметил, трифторметил, пентафторетил, 2-гідроксіетил, гідроксиметил, 3гідроксипропіл, 2-гідрокси-2-метилпроп-1-іл, 3гідрокси-3-метилбут-1-ил, 1-гідрокси-1-метилетил, 2,2,2-трифтор-1-гідрокси-1-метилетил, 2,2,2трифтор-1-гідрокси-1-трифторметилетил, 2метоксіетил або 2-етоксіетил. 94454 8 У четвертому варіанті здійснення даного вина3 ходу R означає метил, етил, пропіл, ізопропіл, бутил, втор-бутил, ізобутил, трет-бутил, Зметилбут-1-ил, дифторметил, трифторметил або пентафторетил. У п'ятому варіанті здійснення даного винаходу 3 R означає циклопропіл, циклобутил, циклопентил або циклогексил. У шостому варіанті здійснення даного винахо3 ду R означає 1-гідроксициклопропіл, 1гідроксициклобутил, 1-гідроксициклопентил або 1гідроксициклогексил. У сьомому варіанті здійснення даного винахо3 ду R означає 2-гідроксіетил, гідроксиметил, 3гідроксипропіл, 2-гідрокси-2-метилпроп-1-іл, 3гідрокси-3-метилбут-1-ил, 1-гідрокси-1-метилетил, 2,2,2-трифтор-1-гідрокси-1-метилетил, 2,2,2трифтор-1-гідрокси-1-трифторметилетил, 2метоксіетил або 2-етоксіетил. У восьмому варіанті здійснення даного вина3 ходу R означає 2-гідроксіетил, гідроксиметил, 3гідроксипропіл або 1-гідрокси-1-метилетил. У дев'ятому варіанті здійснення даного вина3 ходу R означає гідроксигрупу, дифторметилоксигрупу, трифторметилоксигрупу або ціаногрупу. У десятому варіанті здійснення даного вина3 ходу R означає метил, етил, пропіл, ізопропіл, дифторметил, трифторметил або пентафторетил. Краще, якщо всі гідроксигрупи β-Dглюкопіранозильної групи є незаміщеними або тільки гідроксигрупа атома O-6 β-Dглюкопіранозильної групи заміщена, як це визначено. Кращі замісники вибрані із групи, яка включає (С1-С8-алкіл)карбоніл, (С1-С8алкіл)оксикарбоніл і фенілкарбоніл. Ще більш кращі замісники вибрані із групи, яка включає ацетил, метоксикарбоніл і етоксикарбоніл, більш краще - ацетил і етоксикарбоніл. Позначення в структурних формулах, які використовуються вище та нижче в даному винаході, у яких зв'язок замісника циклічної групи, такий як, наприклад, фенільне кільце, спрямований до центра циклічної групи, якщо не зазначено інше, означає, що замісник може бути приєднаний у будь-якому вільному положенні циклічної групи, яка містить атом Н. Сполуки, пропоновані в даному винаході, можна одержати за методиками синтезу, які в цілому відомі. Сполуки бажано одержують за наведеними нижче методиками, пропонованими в даному винаході, які більш докладно описані нижче в даному винаході. Похідні глюкози формули II, пропоновані в даному винаході, можна синтезувати з Dглюконолактону або його похідної шляхом приєднання необхідного бензилбензолу у формі металоорганічної сполуки (схема 1). 9 94454 10 Схема 1: Приєднання металоорганічної сполуки до глюконолактону Реакцію, представлену на схемі 1, краще проводять із використанням як вихідна речовина галогенованого бензилбензолу загальної формули IV, 1 у якій Hal означає хлор, бром або йод. R на схемі 1 означає ціаногрупу або групу, яку потім можна перетворити на ціаногрупу, таку як хлор, бром, карбоксигрупу, етерифіковану карбоксигрупу, карбоксамідну групу або її похідну, боронову або силільну групу, захищену або замасковану альдегідну групу, таку як, наприклад, ацетальну або тіазольну, або захищену або замасковану аміногрупу, таку як, наприклад, нітрогрупу. Реагент Гриньяра або літійвмісний реагент на основі бензилбензолу (V) можна одержати з відповідного хлорованого, бромованого або йодованого бензилбензолу IV за допомогою так називаної реакції обміну галоген-метал або шляхом ввндення металу по зв'язку вуглець-галоген. Обмін галогенметал для синтезу відповідної літієвої сполуки V можна провести, наприклад, з літійорганічною сполукою, такою як, наприклад, н-, втор- або третбутиллітій. Аналогічно магнієву сполуку також можна одержати за допомогою обміну галоген-метал з придатним реагентом Гриньяра, таким як, наприклад, ізопропіл- або втор-бутилмагнійбромід або хлорид, або діізопропіл- або ди-втор-бутилмагній без присутності або в присутності додаткової солі, такої як, наприклад, хлорид літію, який може прискорювати металування; конкретну переметалувальну магнієорганічну сполуку також можна одержати in situ з придатних попередників (див., наприклад, Angew. Chem. 2004, 116, 3396-3399 і Angew. Chem. 2006, 118, 165-169 і цитовані в них посилання). Крім того, також можна використовувати комплекси магнієорганічних сполук, одержані, наприклад, об'єднанням бутилмагнійхлориду або броміду або ізопропілмагнійхлориду або -броміду та бутиллітію (див., наприклад, Angew. Chem. 2000, 112, 2594-2596 і Tetrahedron Lett. 2001, 42, 4841-4844 і цитовані в них посилання). Реакції обміну галоген-метал переважно проводять при температурі від 40 до -100 °С, особливо краще від 10 до -80 °С, в інертному розчиннику або в їх сумішах, таких як, наприклад, діетиловий ефір, діоксан, тетрагідрофуран, толуол, гексан, диметилсульфоксид, дихлорметан або їх суміші. Одержані в такий спосіб магнієві або літієві похідні сполук необов'язково можна переметалувати солями металів, такими як, наприклад, трихлорид церію, хлорид або бромід цинку, хлорид або бромід індію, з утворенням альтернативних металоорганічних сполук (V), придатних для приєднання. Альтернативно, металоорганічну сполуку V також можна одержати шляхом введення металу по зв'язку вуглець-галоген гетероароматичної сполуки IV. Елементарними металами, які придатні для цього перетворення, є літій і магній. Введення можна провести в розчинниках, таких як, наприклад, діетиловий ефір, діоксан, тетрагідрофуран, толуол, гексан, диметилсульфоксид і їх суміші, при температурі в діапазоні від -80 до 100 °С, краще - від -70 до 40 °С. У випадку, коли до активації металу мимовільна реакція не протікає, може знадобитися активація, така як, наприклад, обробка 1,2диброметаном, йодом, триметилсилілхлоридом, оцтовою кислотою, хлористоводневою кислотою і/або обробка ультразвуком. Приєднання металоорганічної сполуки V до глюконолактону або його похідних (VI) краще проводять при температурі від 40 до -100 °С, особливо краще - від 0 до -80 °С, в інертному розчиннику або в їх сумішах і одержують сполуку формули II. Всі зазначені вище реакції можна провести на повітрі, хоча краще проведення в атмосфері інертного газу, такого як аргон і азот. Маталування і/або реакцію сполучення також можна провести в мікрореакторах і/або мікрозмішувачах, у яких забезпечуються високі швидкості обміну; наприклад, аналогічно способам, описаним в WO 2004/076470. Розчинниками, які придатні для приєднання металованої фенільної групи V до відповідним чином захищеного глюконолактону VI, є, наприклад, діетиловий ефір, диметоксіетан, бензол, толуол, метиленхлорид, гексан, тетрагідрофуран, діоксан, iV-метилпіролідон і їх суміші. Реакції приєднання можна провести без додавання будь-яких допоміжних речовин або у випадку повільно взаємодіючих компонентів реакції сполучення - у присутності промотору, такого як, наприклад, BF3*OEt2 або Me3SiCl (див. М. Schlosser,Organometallics in Synthesis, John Wiley & Sons, Chichester/New York/Brisbane/Toronto/Singapore, 8 1994). Кращими значеннями замісників R на схемі 1 є бензил, заміщений бензил, аліл, триалкілсиліл, особливо краще - триметилсиліл, триізопропілсиліл, аліл, 4-метоксибензил і бензил. Якщо два су8 сідніх замісники R зв'язані один з одним, то краще, якщо ці два замісники є частиною бензиліденацеталю, 4 11 метоксибензиліденацеталю, ізопропілкеталю або утворюють діоксан з 2,3-диметоксибутиленом, який у положеннях 2 і 3 бутану зв'язаний із сусід1 німи атомами кисню піранози. Група R краще означає водень, С1-C4-алкіл, С1-C4-алкілкарбоніл або С1-C4-алкоксикарбоніл, особливо краще - водень, метил або етил. Групу R' вводять після приєднання металоорганічної сполуки V або її похідної до глюконолактону VI. Якщо R' означає водень або С1-C4-алкіл, то розчин реакційної суміші обробляють спиртом, таким як, наприклад, метанол або етанол, або водою в присутності кислоти, такої як, наприклад, оцтова кислота, метансульфонова кислота, толуолсульфонова кислота, сірчана кислота, трифтороцтова кислота або хлористоводнева кислота. R' також можна приєднати після одержання воденьвмісної сполуки II за реакцією аномірної гідроксигрупи з придатним електрофільним реагентом, таким як, наприклад, метилйодид, диметилсульфат, етилйодид, діетилсульфат, ацетилхлорид або оцтовий ангідрид, у присутності основи, такої як, наприклад, триетиламін, етилдіізопропіламін, карбонат натрію або калію або цезію, гідроксид натрію або калію або цезію. Гідроксигрупу також можна депротонувати до додавання електрофільного реагенту, наприклад, за допомогою гідриду натрію. Під час введення R' захисні 8 групи R можуть відщепитися, якщо вони нестабі 94454 12 льні при використовуваних умовах проведення реакції, що приводить до відповідної протонованої 8 сполуки, тобто до сполуки II, у якому R означає Н. Синтез галогенароматичної сполуки формули IV можна провести за стандартними методиками перетворень в органічній хімії або принаймні за методиками, наведеними у спеціальній літературі з органічного синтезу (див., наприклад, J. March, Advanced Organic Reactions, Reactions, Mechanisms, and Structure, 4th Edition, John Wiley & Sons, Chichester/New York/Brisbane/Toronto/Singapore, 1992 і цитовану в ній літературу). Крім того, застосування перехідних металів і металоорганічних сполук для синтезу ароматичних сполук докладно описано в різних монографіях (див., наприклад, L. Brandsma, S.F. Vasilevsky, H.D. Verkruijsse, Application of Transition Metal Catalysts in Organic Synthesis, SpringerVerlag, Berlin/Heidelberg, 1998; M. Schlosser, Organometallics in Synthesis, John Wiley & Sons, Chichester/New York/Brisbane/Toronto/Singapore, 1994; P.J. Stang, F. Diederich, Metal-Catalyzed Cross-Coupling Reactions, Wiley-VCH, Weinheim, 1997 і цитовані в них посилання). Стратегії синтезу, описані нижче, показують це як приклад. Крім того, за допомогою таких же синтетичних підходів агліконний фрагмент також можна об'єднати з уже наявним піранозним фрагментом. Схема 2: Синтез діарилкетонового фрагмента На схемі 2 представлено одержання попередника, який можна використовувати для синтезу галогенароматичної сполуки формули IV з використанням як вихідна речовина бензоїлхлориду та другої ароматичної групи за допомогою ацилуван1 ня за Фріделем-Крафтсом і його варіантів. R на схемі 2 означає ціаногрупу або групу, яку потім можна перетворити на ціаногрупу, таку як хлор, бром, карбоксигрупу, етерифіковану карбоксигрупу, етерифіковану карбоксигрупу, карбоксамідну групу або її похідну, захищену або замасковану альдегідну групу, таку як, наприклад, тіоацетальну або тіазольну, або захищену або замасковану аміногрупу, таку як, наприклад, нітрогрупу. Цю класи чну реакцію проводять із більшою кількістю субстратів і звичайно проводять у присутності затора, який використовують у каталітичних або стехіометричних кількостях, такого як, наприклад, АlСl3, FeCl3, йод, залізо, ZnCl2, сірчана кислота або трифторметансульфонова кислота. Замість їлхлориду також можна використовувати відповідну карбонову кислоту, ангідрид, складний ефір або бензонітрил. Реакції переважно проводять у хлорованих вуглеводнях, таких як, наприклад, дихлорметан і 1,2-дихлоретан, при температурі від -30 до 120°С, краще - від 30 до 100°С. Однак також можливі реакції у відсутності розчинника та реакції в мікрохвильовій печі. 13 94454 14 Схема 3: Відновлення діарилкетонів і діарилметанолів у діарилметани На схемі 3 замісник R означає С1-C3-алкіл або 1 арил і R означає ціаногрупу або групу, яку потім можна перетворити на ціаногрупу, таку як хлор, бром, карбоксигрупу, етерифіковану карбоксигрупу, карбоксамідну групу або її похідну, боронову або силільну групу, захищену або замасковану альдегідну групу, таку як, наприклад, ацетальну або тіазольну, або захищену або замасковану аміногрупу, таку як, наприклад, нітрогрупу. З використанням як вихідна речовина діарилкетону або діарилметанолу за одну або дві стадії реакції можна одержати діарилметан. Діарилкетон можна відновити в діарилметан у дві стадії через відповідний діарилметанол або в одну стадію. У двостадійному варіанті кетон відновлюють відновленим реагентом, таким як, наприклад, гідрид металу, такий як, наприклад, NaBH4, LiAlH4 або іВи2АlН, і одержують спирт. Одержаний спирт відновленим реагентом, таким як, наприклад, EtsSiH, NaBH4 або Ph2SiClH, можна перетворити на цільовий дифенілметан у присутності кислоти Льюїса, такої як, наприклад, BF3*OEt2, ІnСl3 або АlСl3 або кислоти Бренстеда, такої як, наприклад, хлористоводнева кислота, сірчана кислота, трифтороцтова кислота або оцтова кислота. Одностадійну реакцію з використанням як вихідна речовина кетону для одержання дифенілметану можна провести, наприклад, з використанням силану, такого як, наприклад, Et3SiH, борогідриду, такого як, наприклад, NaBH4 або гідриду алюмінію, такого як, LiAlH4, у присутності кислоти Льюїса або Бренстеда, такої як, наприклад, BF3*OEt2, трис(пентафторфеніл)боран, трифтороцтова кислота, хлористоводнева кислота, хлорид алюмінію або ІnСl3. Реакції бажано проводять у розчинниках, таких як, наприклад, галогеновані вуглеводні, такі як, дихлорметан, толуол, ацетонітрил або їх суміші при температурі від -30 до 150°С, краще - від 20 до 100°С. Відновлення воднем у присутності каталізатора на основі перехідного металу, такого як, наприклад, Pd на деревному вугіллі є іншою можливою методикою синтезу. Також можливе відновлення за ВольфомКішнером і його варіанти. Спочатку кетон піддають перетворенню за допомогою гідразину або його похідної, такої як, наприклад, 1,2-біс(третбутилдиметилсиліл)гідразин, у гідразон, який у сильнолужному середовищі та при нагріванні розкладається з утворенням дифенілметану та азоту. Реакцію можна провести в одну стадію або, після виділення гідразону або його похідної, у дві окремі стадії. Придатні основи включають, наприклад, KОН, NaOH і KOtBu у розчинниках, таких як, наприклад, етиленгліколь, толуол, ДМСО (диметилсульфоксид), 2-(2-бутоксіетоксі)етанол або третбутанол; також можливі реакції у відсутності розчинника. Реакції можна провести при температурі від 20 до 250°С, краще - від 80 до 200°С. Альтернативою відновленню в лужному середовищі за Вольфом-Кішнером є відновлення за Клеменсеном, яке протікає в кислому середовищі і яке також можна використовувати в даному винаході. Гідроксигрупу діарилметанолу також можна спочатку перетворити в групу, яка легше відщеплюєтьсяся, таку як, наприклад, хлорид, бромід, йодид, ацетат, карбонат, фосфат, або сульфат; наступна стадія відновлення з утворенням діарилметану докладно описана в літературі органічної хімії. 15 94454 16 Схема 4: Синтез діарилметанового фрагмента та можливих його попередників 1 На схемі 4 R означає ціаногрупу або групу, яку потім можна перетворити на ціаногрупу, таку як хлор, бром, карбоксигрупу, етерифіковану карбоксигрупу, карбоксамідну групу або її похідну, боронову або силільну групу, захищену або замасковану альдегідну групу, таку як, наприклад, ацетальну або тіазольну, або захищену або замасковану аміногрупу, таку як, наприклад, нітрогрупу. Термін "Alk" означає С1-С4-алкіл і кожний замісник R незалежно один від одного вибраний із групи, яка включає Н, С1-С3-алкіл і С1-С3-алкоксигрупу. На схемі 4 представлений синтез діарилметанів і можливих його попередників з використанням як вихідна речовина металованої фенільної групи. Літіє- і магнієзаміщені ароматичні сполуки можна синтезувати із хлорованих, бромованих або йодованих ароматичних сполук за допомогою реакції обміну галоген-метал, наприклад, з бутиллітієм, ізопропілмагнійгалогенідом або діізопропілмагнієм, або шляхом введення елементарного металу по зв'язку галоген-вуглець. Відповідну борзаміщену сполуку, таку як, наприклад, боронову кислоту, ефір боронової кислоти або діалкіларилборан можна одержати із цих метилованих фенільних груп за реакцією з електрофільним реагентом, який містить бор, таким як, наприклад, ефір боронової кислоти або його похідну. Крім того, бориловану ароматичну сполуку також можна одержати з відповідного галогенованого або псевдогалогенованого попередника та сполуки, яка містить два атоми бору або борану за реакцією, яка каталізується перехідним металом, наприклад, паладієм (див., наприклад, Tetrahedron Lett. 2003, p. 4895-4898 і цитовані в них посилання). Літіє- і магнієзаміщені феніли сполуки приєднують до бензальдегідів (стадія 3) і бензойних кислот або їх похідних (ста 17 дія 4), таких як ефіри бензойної кислоти, бензаміди, такі як, наприклад, типу Вайнреба, бензонітрили або бензоїлхлориди. Цю реакцію можна проводити без додаткового каталізу перехідним металом і переметалування іншим металом, таким як, наприклад, церій, індій або цинк; іноді краще використання одного з останніх варіантів. Арилборонові кислоти можна приєднати до бензальдегідів за допомогою родієвого каталізатора й одержати відповідний діарилметанол (див., наприклад, Adv. Synth. Catal. 2001, p. 343-350 і цитовані в них посилання). Крім того, арилборонові кислоти, їх ефіри, діалкілборани або арилтрифторборати можна ввести в реакцію сполучення з бензоїлхлоридами при каталізі перехідним металом, таким як, наприклад, паладій, його комплекс або сіль, і одержати діарилкетони. Металовані фенільні групи можна ввести в реакцію з бензильними електрофільними реагентами, такими як, бензилхлориди, -броміди 94454 18 або -йодиди, і одержати діарилметани. Літієві або магнієві похідні фенільних сполук ефективно вступають у реакцію, але не завжди обов'язково в присутності перехідного металу, такого як, наприклад, мідь, залізо або паладій (див., наприклад, Org. Lett. 2001, З, 2871-2874 і цитовані в ній посилання). Переметалування із заміною літію або магнію, наприклад, на бор, олово, кремній або цинк, дає, наприклад, відповідні ароматичні боронові кислоти, станани, силани або сполуки цинку відповідно, які можна ввести в реакцію з бензильними електрофільними реагентами, наприклад, бензилгалогенідами, -карбонатами, -фосфатами, сульфонатами або ефірами карбонових кислот. Реакцію проводять у присутності перехідного металу, наприклад, паладію, нікелю, родію, міді або заліза (див., наприклад, Tetrahedron Lett. 2004, p. 8225-8228 і Org. Lett. 2005, p. 4875-4878 і цитовані в них посилання). Схема 5: Введення ціаногрупи На схемі 5 представлені можливі шляхи приєднання ціаногрупи до центральної фенільної групи на різних стадіях синтезу цільової молекули. Ціаногрупу можна ввести за допомогою реакції сполучення, яка каталізується перехідним металом відповідного джерела ціаногрупи, такого як, наприклад, ціанід натрію, калію, цинку або міді, з галогенованою або псевдогалогенованою фенільною групою. Придатний каталізатор можна приготувати з перехідних металів, таких як, наприклад, паладій, родій, нікель, залізо або мідь, які можна використовувати в елементній формі, такій як, наприклад, паладію на вугіллі, у вигляді солей, таких як, наприклад, хлорид, бромід або ацетат паладію, або комплексів, наприклад, з фосфінами, такими як, наприклад, трифенілфосфін, три-третбутилфосфін або dppf, або з алкенами, такими як, наприклад, дибензиліденацетон. Активний каталі затор можна утворити in situ або до додавання до реакційної суміші. Може бути корисним використання добавок, таких як, наприклад, цинк в елементному вигляді або у вигляді солі (див. Tetrahedron Lett. 2005, 46, 1849-1853 і Tetrahedron Lett. 2005, 46, 1815-1818 і цитовані в них посилання). Реакції відповідних сполук цинку, магнію або літію, які можна одержати із хлорованих, бромованих або йодованих сполук за реакцією обміну галоген-метал або шляхом введення відповідного металу по зв'язку з галогеном, з електрофільним реагентом, який містить ціаногрупу, таким як, наприклад, птолілсульфонілціанід, бромціан або 2піридилціанат, є іншим ефективним шляхом введення ціаногрупи (див., наприклад, Synth. Commun. 1996, 3709-3714 і цитовані в ній посилання). 19 94454 20 Схема 6: Введення ціаногрупи за допомогою похідної альдегіду або карбонової кислоти Альтернативною методикою введення ціаногрупи є синтез із використанням як вихідна речовина альдегіду або карбоксаміду (схема 6). Альдегідну групу можна ввести саму по собі, у захищеному або замаскованому вигляді. Розповсюдженими захисними групами альдегідної групи є ацетальні, але також можна використовувати інші захисні групи (див. Т. W. Greene, P.G.M. Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, Inc., New York, 1999). Придатними засобами маскування альдегідної групи є, наприклад, олефіни та тіазоли. Альдегідну групу можна перетворити на ціаногрупу, наприклад, з використанням гідроксиламіну в комбінації, наприклад, з мурашиною кислотою, концентрованою хлористоводневою кислотою, поліфосфорною кислотою або сумішшю піридин-толуол. Проміжний оксим, який утворюється за таких умов проведення реакції, можна виділити до дегідратації з одержанням кінцевого продукту. Також можна використовувати альтернативні гідроксиламіни, такі як, наприклад, бістрифторацетилгідроксиламін і NH2OSO3 і без використання додаткових реагентів одержати нітрил. Іншими реагентами,які використовуються, є, наприклад, ΝΗ4ΡΟ4Η2 і нітропропан в оцтовій кислоті, триметилсилілазид і S,S-диметилсіркадіімід. Придатними попередниками нітрилів можуть бути й карбоксаміди. Перетворення можна провести дегідратуючими реагентами, такими як, наприклад, ангідрид трифтороцтової кислоти, пентаоксид фосфору, РОСl3, комбінація ССl4-фосфін, комбінація Сl3СОСІ-амін, реагент Бурджеса, реагент Вілсмайєра, SOCl2 або хлорангідрид ціанурової кислоти. З використанням як вихідна речовина відповідного моноалкілованого карбоксаміду, карбонової кислоти, її ефіру або хлорангідриду карбонової кислоти, одержання нітрилу також можливе в однореакторному режимі без виділення будьякого проміжного продукту. Схема7: Введення ціаногрупи за допомогою анілінового попередника Загальноприйнятою методикою введення ціаногрупи є так називана реакція Зандмайєра із ціанідом міді та відповідною діазонієвою сполукою, яку можна одержати діазотуванням відповідної похідної аніліну. Синтез діазонієвих сполук і наступне видалення діазогрупи докладно описані в літературі з органічної хімії. 21 94454 22 Схема 8: Альтернативний синтез діарилметанового фрагмента Альтернативний шлях формування діарилметанового фрагмента представлений на схемі 8. У ньому використовується орто-фторзаміщений бензонітрил, який або є у продажу або його можна одержати за зазначеними вище методиками. Орто-фторзаміщений бензонітрил у лужному середовищі вводять у реакцію з алкілфенілацетатом, 3 який містить замісник R (див., наприклад, J. Org. Chem. 55, 1990, 4817-4821; J. Heterocycl. Chem, 32, 1995, 1461-1466), а потім розщеплюють складний ефір і проводять декарбоксилування (див., наприклад, J. Heterocycl. Chem, 32, 1995, 14611466; Org. Prep. Proced. Int. 37, 2005, 550-555) або пряме деалкоксикарбонілювання (див., наприклад, J. Med. Chem. 46, 2003, 5249-5257; Angew. Chem. Int. Ed. 47, 2004, 6493-6496). Для одержання сполук загальної формули І у способі а), пропонованому в даному винаході, сполуку загальної формули II II 3 у якій R' і R є такими, як визначено вище в даному винаході, і 8a 8b 8c 8d R , R , R , R є такими, як визначено вище в даному винаході, і незалежно один від одного означають, наприклад, ацетил, півалоїл, бензоїл, трет-бутоксикарбоніл, бензилоксикарбоніл, аліл, триалкілсиліл, бензил або заміщений бензил, або 8a 8b 8c в кожному випадку дві сусідні групи R , R , R , 8d R утворюють бензиліденацетальну, ізопропіліденкетальну або 2,3-диметоксибутиленову групу, яка у положеннях 2 і 3 бутиленової групи зв'язана з атомами кисню піранозного кільця й утворює із ним заміщений діоксан, яку можна одержати, як описано вище в даному винаході, вводять у реакцію з відновленим реагентом у присутності кислоти Льюїса або Бренстеда. Відновні реагенти, які придатні для цієї реакції, включають, наприклад, силани, такі як триетил-, трипропіл-, триізопропіл- або дифенілсилан, борогідрид натрію, ціаноборогідрид натрію, борогідрид цинку, борани, алюмогідрид літію, діізопропілалюмінійгідрид і йодид самарію. Відновлення прово дять при відсутності або в присутності придатної кислоти Бренстеда, такої як, наприклад, хлористоводнева кислота, толуолсульфонова кислота, трифтороцтова кислота або оцтова кислота, або кислоти Льюїса, такої як, наприклад, ефірат трифториду бору, триметилсилілтрифлат, тетрахлорид титану, тетрахлорид олова, трифлат скандію або йодид цинку. Залежно від відновного реагенту та кислоти реакцію можна провести в розчиннику, такому як, наприклад, метиленхлорид, хлороформ, ацетонітрил, толуол, гексан, діетиловий ефір, тетрагідрофуран, діоксан, етанол, вода або їх суміші при температурі від -60 до 120°С. Особливо придатна комбінація реагентів включає, наприклад, триетилсилан і ефірат трифториду бору, яку звичайно використовують в ацетонітрилі або дихлорметані при температурі від -60 до 60°С. Крім того, для описаних перетворень можна використовувати водень у присутності каталізатора на основі перехідного металу, такого як, наприклад, паладій на деревному вугіллі або нікель Ренея, у розчинниках, таких як, тетрагідрофуран, етилацетат, метанол, етанол, вода або оцтова кислота. Альтернативно, для одержання сполук загальної формули І способом b), пропонованим у даному винаході, відщеплюють захисні групи від сполуки загальної формули III III 3 у якій R є таким, як визначено вище в даному винаході, і 8a 8d R - R означають одну із захисних груп, визначених вище в даному винаході, таку як, наприклад, ацильна, арилметильна, алільна, ацетальна, кетальна або силільна група, і яку можна одержати наприклад, відновленням із сполуки формули II, як описано вище в даному винаході. Слід розуміти, що при проведенні зазначених вище синтезів можна заміняти одну або декілька із 8a 8d груп R - R . Будь-яку ацильну захисну групу, яка використовується, відщеплюють, наприклад, гідролітично у водному розчиннику, наприклад, у воді, суміші 23 ізопропанол/вода, оцтова кислота/вода, тетрагідрофуран/вода або діоксан/вода, у присутності кислоти, такої як трифтороцтова кислота, хлористоводнева кислота або сірчана кислота, або в присутності основи лужного металу, такої як гідроксид літію, гідроксид натрію або калію, або апротонно, наприклад, у присутності йодтриметилсилану при температурі від 0 до 120°С, краще - при температурі від 10 до 100°С. Трифторацетильну групу краще відщеплюють шляхом обробки кислотою, такою як хлористоводнева кислота, необов'язково в присутності розчинника, такого як оцтова кислота, при температурі від 50 до 120°С або шляхом обробки розчином гідроксиду натрію необов'язково в присутності розчинника, такого як тетрагідрофуран або метанол, при температурі від 0 до 50°С. Будь-яку ацетальну або кетальну захисну групу, яка використовується, відщеплюють, наприклад, гідролітично у водному розчиннику, наприклад, у воді, суміші ізопропанол/вода, оцтова кислота/вода, тетрагідрофуран/вода або діоксан/вода, у присутності кислоти, такої як трифтороцтова кислота, хлористоводнева кислота або сірчана кислота, або апротонно, наприклад, у присутності йодтриметилсилану, при температурі від 0 до 120°С, краще - при температурі від 10 до 100°С. Триметилсилільну групу відщеплюють, наприклад, у воді, у водній суміші розчинників або в нижчому спирті, такому як метанол або етанол, у присутності основи, такої як гідроксид літію, гідроксид натрію, карбонат калію або метоксид натрію. У водні або спиртові розчинники корисно включати кислоти, такі як, наприклад, хлористоводнева кислота, трифтороцтова кислота або оцтова кислота. Для відщеплення в органічних розчинниках, таких як наприклад, діетиловий ефір, тетрагідрофуран або дихлорметан, також корисно використовувати фториди, таких як, наприклад, тетрабутиламонійфторид. Бензильну, метоксибензильну та бензилоксикарбонільну групу краще відщеплювати гідрогенолітично, наприклад, воднем у присутності каталізатора, такого як паладій/деревне вугілля, у придатному розчиннику, такому як метанол, етанол, етилацетат або льодяна оцтова кислота, необов'язково з додаванням кислоти, такої як хлористоводнева кислота, при температурі від 0 до 100°С, але краще - при температурі навколишнього середовища, що дорівнює від 20 до 60°С, і при тиску водню, що дорівнює від 1 до 7 бар, але краще - від 3 до 5 бар. Однак 2,4-диметоксибензильну групу краще відщеплювати у трифтороцтовій кислоті в присутності анізолу. Трет-бутильну або трет-бутилоксикарбонільну групу краще відщеплювати шляхом обробки кислотою, такою як трифтороцтова кислота або хлористоводнева кислота або шляхом обробки йодтриметилсиланом, необов'язково з використанням розчинника, такого як метиленхлорид, діоксан, метанол або діетиловий ефір. При проведенні реакцій, описаних вище в даному винаході, будь-які активні групи, які містяться, такі як етинільна група, гідроксигрупа, аміног 94454 24 рупа, алкіламіногрупа або іміногрупа, на час проведення реакції можна захистити звичайними захисними групами, які повторно відщеплюють після проведення реакції. Наприклад, захисною групою етинільної групи може бути триметилсилільна або триізопропільна група. Як захисну групу також можна використовувати 2-гідроксіізопроп-2-ільну групу. Наприклад, захисною групою гідроксигрупи може бути триметилсилільна, ацетильна, тритильна, бензильна або тетрагідропіранільна група. Захисними групами для аміногрупи, алкіламіногрупи або іміногрупи можуть бути, наприклад, формільна, ацетильна, трифторацетильна, етоксикарбонільна, трет-бутоксикарбонільна, бензилоксикарбонільна, бензильна, метоксибензильна або 2,4-диметоксибензильна група. Крім того, одержані сполуки загальної формули І можна розділити на їх енантіомери і/або діастереоізомери, як відзначено вище в даному винаході. Так, наприклад, цис-транс-суміші можна розділити на цис- і транс-ізомери, і сполуки, що містять принаймні один оптично активний атом вуглецю, можна розділити на їх енантіомери. Так, наприклад, цис/транс-суміші можна розділити за допомогою хроматографії на цис- та транс-ізомери, одержані сполуки загальної формули І, які є рацематами, можна розділити за відомими методиками (див. Allinger N. L. and Eliel Ε. L. in "Topics in Stereochemistry", Vol. 6, Wiley Interscience, 1971) на їх оптичні антиподи та сполуки загальної формули І, які містять принаймні 2 оптично активних атоми вуглецю, можна розділити на їх діастереоізомери з використанням розходжень їх фізико-хімічних характеристик за відомими методиками, наприклад, за допомогою хроматографії і/або фракційної кристалізації, і, якщо ці сполуки одержують у рацемічній формі, то потім їх можна розділити на енантіомери, як зазначено вище. Енантіомери переважно розділяють на колонках з хіральними фазами або шляхом перекристалізації з оптично активного розчинника або за реакцією з оптично активною речовиною, яка утворює солі або похідні, такі як, наприклад, складні ефіри або аміди з рацемічною сполукою, краще - її складні ефіри та активовані похідні або спирти, і розділення одержаної в такий спосіб суміші діастереоізомерів солей або похідних, наприклад, на основі розходження їх розчинностей, хоча вільні антиподи можна виділити із чистих діастереоізомерів солей або похідних шляхом обробки придатними реагентами. Оптично активними кислотами, які звичайно використовуються, є, наприклад, D- і Lформи винної кислоти або дибензоїлвинної кислоти, ді-о-толуолвинної кислоти, яблучної кислоти, мигдальної кислоти, камфорсульфонової кислоти, глутамінової кислоти, аспарагінової кислоти або хінінової кислоти. Оптично активним спиртом може бути, наприклад, (+) або (-)-ментол і оптично активною ацильною групою в амідах може бути, наприклад, (+)- або (-)-ментилоксикарбонільна група. Крім того, сполуки формули І можна перетворити на їх солі, для застосування у фармацевтиці бажано - у фізіологічно прийнятні солі з неорганіч 25 94454 26 ними або органічними кислотами. Кислоти, які можна використовувати для цієї мети, включають, наприклад, хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, метансульфонову кислоту, фосфорну кислоту, фумарову кислоту, бурштинову кислоту, молочну кислоту, лимонну кислоту, винну кислоту та малеїнову кислоту. Крім того, одержані сполуки можна перетворити на суміші, наприклад, суміші складу 1:1 або 1:2 з амінокислотами, переважно - з альфаамінокислотами, такими як пролін або фенілаланін, які можуть мати особливо сприятливі характеристики, такі як високий ступінь кристалічності. Сполуки, пропоновані в даному винаході, також краще одержувати за методиками, описаними у наведених нижче прикладах, які для цієї мети можна комбінувати з методиками, відомими спеціалісту в даній галузі техніки з літератури, наприклад, з методиками, описаними в WO 98/31697, WO 01/27128, WO 02/083066, WO 03/099836 і WO 2004/063209. Даний винахід також стосується нових проміжних сполук, описаних на схемах реакцій вище в даному винаході та описаних в експериментальному розділі нижче в даному винаході. Зокрема, додатковим об'єктом даного винаходу є наступні проміжні сполуки: де 8a 8d R - R визначені вище в даному винаході й бажано означають Η або ацетил; R' визначений вище в даному винаході й бажано означає Н, метил або етил; Аlk означає С1-С4-алкіл, краще - метил або етил; 1 R визначений вище в даному винаході й бажано означає Вr або CN, найбільш краще - CN; 3 R визначений вище в даному винаході й означає, наприклад, циклопропіл або циклобутил, і бажано вибраний із групи, яка включає хлор, бром, метил, етил, н-пропіл, ізопропіл, циклопропіл, циклобутил, циклопентил, гідроксигрупу, ціаногрупу; LG означає групу, яка відщеплюється, таку як Br, I, -O-(SO2)-CF3, краще - -O-(SO2)-CF3; U означає СІ, Вr, І, -О-СО-С1-С4-алкіл, -ОС(=О)-О-С1-С4-алкіл або -ОРО(О-С1-С4-алкіл)2; краще - Вr. Як уже відзначено, сполуки загальної формули І, пропоновані в даному винаході, і їх фізіологічно прийнятні солі мають цінні фармакологічні характеристики, зокрема, інгібуючий вплив на натрієзалежний співпереносник глюкози SGLT, краще SGLT2. 27 Біологічні характеристики цих нових сполук можна досліджувати так, як описано нижче: Здатність сполук, пропонованих у даному винаході, інгібувати активність SGLT2 можна продемонструвати експериментально з використанням клітин лінії СНО-K1 (АТСС № CCL 61) або в іншому варіанті клітин лінії НЕK293 (АТСС № CRL1573), стабільно трансфікованих експресуючим вектором pZeoSV (Invitrogen, реєстраційний номер L36849 у базі даних EMBL), який містить кДНК для кодуючої послідовності натрієзалежного співпереносника глюкози типу 2 людини (реєстраційний номер у банку генів NM_003041) (CHO-hSGLT2 або HEK-hSGLT2). Клітини цих ліній забезпечують натрієзалежний перенос всередину клітин мічено14 14 го С альфа-метилглюкопіранозиду ( С-АМГ, Amersham). Дослідження SGLT-2 проводять у такий спосіб: Клітини CHO-hSGLT2 культивують у середовищі Хема F12 (Bio Whittaker), доповненому 10% фетальної телячої сироватки та зеоцином у концентрації 250 мкг/мл (Invitrogen), а клітини HEK293-hSGLT2 культивують у середовищі МДСІ (модифікована за способом Дульбекко середовище Ігла), доповненому 10% фетальної телячої сироватки та зеоцином у концентрації 250 мкг/мл (Invitrogen). Клітини відокремлюють від колб для культивування шляхом дворазового промивання забуференним фосфатом фізіологічним розчином (ЗФР) і наступної обробки сумішшю трипсин/Е ДТК (етилендіамінтетраоцтова кислота). Після додавання культурального середовища клітини відокремлюють центрифугуванням, потім повторно суспендують у культуральному середовищі й підраховують у цитометрі з технологією CASY. Потім клітини висівають у білий, покритий полі-D-лізином 96-лунковий планшет по 40000 клітин на лунку та інкубують протягом ночі при 37°С і 5% СО2. Потім клітини двічі промивають 300 мкл буфера для аналізу (збалансований сольовий розчин Хенкса, 137 мМ NaCl, 5,4 мМ KСl, 2,8 мМ СаСl2, 1,2 мМ MgSO4 та 10 мМ HEPES (N-2гідроксіетилпіперазин-N'-2-етансульфонова кислота) (рН 7,4), 50 мкг/мл гентаміцину). Потім у кожну лунку додають по 250 мкл буфера для аналізу й по 5 мкл досліджуваної сполуки й планшети інкубують протягом наступних 15 хв у термостаті. Як негативний контроль використовують 5 мкл 10% ДМСО. Реакцію ініціюють додаванням у кожну лу14 нку по 5 мкл С-АМГ (0,05 мкКи). Після 2 год інкубації при 37°С і 5% СО2 клітини повторно промивають за допомогою 300 мкл ЗФР (20°С), після чого лізують шляхом додавання 25 мкл 0,1 н. NaOH (протягом 5 хв при 37°С). Потім у кожну лунку додають по 200 мкл сцинтилятора MicroScint20 (фірма Packard) і інкубують протягом ще 20 хв при 37°С. Після завершення цієї інкубації в детекторі Topcount (Packard) за допомогою програми вимі14 рювання сцинтиляції, обумовленої С, вимірюють 14 радіоактивність поглиненого С-АМГ. Для визначення селективності відносно SGLT1 людини проводять аналогічне дослідження, у якому в клітинах СНО-K1 або НЕК293 експресується кДНК для hSGLT1 (реєстраційний номер у банку генів NM_000343) замість кДНК для hSGLT2. 94454 28 Сполуки, пропоновані в даному винаході, можуть, наприклад, мати значення ЕС50, що дорівнює менш ніж 1000 нМ, краще - менш ніж 200 нМ, найбільш краще - менш ніж 50 нМ. З урахуванням їх здатності інгібувати активність SGLT сполуки, пропоновані в даному винаході, і їх відповідні фармацевтично прийнятні солі придатні для лікування і/або попереджувального лікування всіх тих патологічних станів або захворювань, на які можна впливати шляхом інгібування активності SGLT, краще -активності SGLT-2. Тому сполуки, пропоновані в даному винаході, є особливо придатними для попередження або лікування захворювань, краще - метаболічних порушень, або патологічних станів, таких як цукровий діабет типу 1 і типу 2, ускладнення при діабеті (такі як, наприклад, ретинопатія, нефропатія або невропатія, діабетична стопа, виразки, макроангіопатії), метаболічний ацидоз або кетоз, реактивна гіпоглікемія, гіперинсулінемія, порушення обміну глюкози, резистентність до інсуліну, метаболічний синдром, дисліпідимії різного генезу, атеросклероз і подібні захворювання, ожиріння, підвищений артеріальний тиск, хронічна серцева недостатність, набряк і гіперурикемія. Ці сполуки також придатні для попередження дегенерації бета-клітин, такої як, наприклад, апоптоз або некроз бета-клітин панкреатичних острівців. Ці сполуки також придатні для поліпшення або відновлення функціональної активності клітин підшлункової залози, і для збільшення кількості та розміру бета-клітин панкреатичних острівців. Сполуки, пропоновані в даному винаході, також можна використовувати як діуретики або гіпотензивні засоби і вони придатні для попередження та лікування гострої ниркової недостатності. Шляхом введення сполуки, пропонованої в даному винаході, можна зменшити або пригнітити аномальне накопичення жиру в печінці. Тому іншим об'єктом даного винаходу є спосіб попередження, уповільнення, затримування або лікування захворювань або патологічних станів, обумовлених аномальним накопиченням жиру в печінці, у пацієнта, який потребує цього, який характеризується тим, що вводять сполуку або фармацевтичну композицію, пропоновану в даному винаході. Захворювання або патологічні стани, обумовлені аномальним накопиченням жиру в печінці, краще вибрані із групи, яка включає загальну жирову інфільтрацію печінки, неалкогольну жирову інфільтрацію печінки (НАЖП), неалкогольний стеатогепатит (HАСГ), викликану гіпераліментацією жирову інфільтрацію печінки, діабетичну жирову інфільтрацію печінки, викликану алкоголем жирову інфільтрацію печінки або токсичну жирову інфільтрацію печінки. Зокрема, сполуки, пропоновані в даному винаході, включаючи їх фізіологічно прийнятні солі, застосовні для попередження або лікування діабету, бажано - цукрового діабету типу 1 та типу 2 і/або ускладнень при діабеті. Крім того, сполуки, пропоновані в даному винаході, є особливо придатними для попередження або лікування надлишкової ваги, ожиріння (включаючи ожиріння І класу, II класу і/або III класу), 29 вісцерального ожиріння і/або абдомінального ожиріння. Дози, необхідні для забезпечення відповідної активності з метою лікування або попередження, звичайно залежать від сполуки, яку необхідно вводити, від пацієнта, характеру та тяжкості захворювання або патологічного стану та методики й частоти введення й визначаються лікарем. Доцільна доза може становити від 1 до 100 мг, краще від 1 до 30 мг при внутрішньовенному введенні та від 1 до 1000 мг, краще - від 1 до 100 мг при пероральному введенні й у кожному випадку засіб вводять від 1 до 4 разів на добу. Для цієї сполуки, пропоновані в даному винаході, необов'язково можна приготувати разом з іншими активними речовинами, разом з однією або більшою кількістю звичайних інертних наповнювачів і/або розріджувачів, наприклад, з кукурудзяним крохмалем, лактозою, глюкозою, мікрокристалічною целюлозою, стеаратом магнію, полівінілпіролідоном, лимонною кислотою, винною кислотою, водою, сумішшю вода/етанол, вода/гліцерин, вода/сорбіт, вода/поліетиленгліколь, пропіленгліколем, цетилстеариловим спиртом, карбоксиметилцелюлозою або жировмісними речовинами, такими як отверджений жир, або їх прийнятними сумішами, з одержанням звичайних галенових препаратів, таких як таблетки без покриття або з покриттям, капсули, порошки, суспензії або супозиторії. Сполуки, пропоновані в даному винаході, також можна використовувати разом з іншими активними речовинами, бажано - для лікування і/або попередження зазначених вище захворювань і патологічних станів. Інші активні речовини, які придатні для таких комбінацій, включають, наприклад, такі, які підсилюють терапевтичну дію антагоніста SGLT, пропонованого в даному винаході, при його введенні у випадку одного із зазначених вище показань і/або які дозволяють знизити дозування антагоніста SGLT пропонованого в даному винаході. Терапевтичні засоби, які придатні для таких комбінацій, включають, наприклад, антидіабетичні засоби, такі як метформін, сульфонілсечовини (наприклад, глібенкламід, толбутамід, глімепірид), натеглінід, репаглінід, тіазолідиндіони (наприклад, росиглітазон, піоглітазон), агоністи та антагоністи рецептора PPAR-гама (наприклад, GI 262570), модулятори рецептора PPAR-гама/альфа (наприклад, KRP 297), інгібітори альфаглюкозидази (наприклад, акарбоза, воглібоза), інгібітори DPP-IV (наприклад, LAF237, МК-431), альфа2-антагоністи, інсулін та аналоги інсуліну, GLP-1 та аналоги GLP-1 (наприклад, ексендин-4) або амілін. Перелік також включає інгібітори протенітирозинфосфатази 1, речовини, які впливають на дерегуляцію продукування глюкози в печінці, такі як, наприклад, інгібітори глюкозо-6фосфатази, фруктозо-1,6-бісфосфатази, глікогенфосфорилази, антагоністи глюкагонового рецептора та інгібітори фосфоенолпіруваткарбоксикінази, глікогенсинтазикінази або піруватдегідрогенази, засоби, що знижують вміст ліпідів у крові, такі як, наприклад, інгібітори ГМГ КоА-редуктази (наприклад, сімвастатин, аторвастатин), фібрати (наприклад, безафібрат, фенофіб 94454 30 рат), нікотинову кислоту та її похідні, агоністи PPAR-альфа, агоністи PPAR-дельта, інгібітори АСАТ (наприклад, авасиміб) або інгібітори всмоктування холестерину, такі як, наприклад, езетиміб, речовини, що зв'язують жовчні кислоти, такі як, наприклад, холестирамін, інгібітори подвздошного транспорту жовчних кислот, сполуки, що підвищують рівень ліпопротеїнів високої густини в крові, такі як інгібітори СЕТР або регулятори АВС1, або активні речовини для лікування ожиріння, такі як сибутрамін, тетрагідроліпстатин, дексфенфлурамін, аксокін, антагоністи канбіноїдного рецептора 1, антагоністи рецептора МСН-1, агоністи рецептора МС4, антагоністи NPY5 або NPY2 або β3агоністи, такі як SB-418790 або AD-9677, а також агоністи рецептора 5НТ2с. Крім того, є придатні комбінації з лікарськими засобами, які впливають на підвищений артеріальний тиск, хронічну серцеву недостатність або атеросклероз, такими як, наприклад, антагоністи ангіотензину II (А-ІІ) або інгібітори АСЕ, інгібітори ЕСЕ, діуретики, β-блокатори, Са-антагоністи, гіпотензивні засоби, які мають центральну дію, антагоністи альфа-2-адренорецептора, інгібітори нейтральної ендопептидази, інгібітори агрегації тромбоцитів та інші або їх комбінації. Прикладами антагоністів рецептора ангіотензину II є кандесартан, цилексетил, калій-лосартан, епросартанмезилат, валсартан, телмісартан, ірбесартан, ЕХР3174, L-158809, ЕХР-3312, олмесартан, медоксоміл, тазосартан, КТ-3-671, GA-0113, RU-64276, EMD-90423, BR-9701 та ін. Антагоністи рецептора ангіотензину II бажано використовуються для лікування або попередження підвищеного артеріального тиску та ускладнень при діабеті, часто в сполученні з діуретиком, таким як гідрохлортіазид. Для лікування або попередження подагри застосовні комбінації з інгібіторами синтезу сечової кислоти або засобами, які сприяють виведенню з організму сечової кислоти. Для лікування або попередження ускладнень при діабеті можна використовувати комбінації з антагоністами ГАМК-рецептора, блокаторами Naканалів, топіраматом, інгібіторами протеїнкінази С, інгібіторами кінцевих продуктів глікозилування або інгібіторами альдозоредуктази. Дозування компонентів комбінацій, зазначених вище, краще становить від 1/5 від звичайно рекомендованої мінімальної дози до 1/1 від звичайно рекомендованої дози. Тому, іншим об'єктом даного винаходу є застосування сполуки, пропонованої в даному винаході, або фізіологічно прийнятної солі такої сполуки в комбінації принаймні з однією з активних речовин, описаних вище як компоненти комбінації, для приготування фармацевтичної композиції, яка застосовна для лікування або попередження захворювань або патологічних станів, на які можна впливати шляхом інгібування натрієзалежного співпереносника глюкози SGLT. Ними переважно є метаболічні захворювання, переважно - одне з перерахованих вище захворювань або патологічних станів, найбільш краще - діабет або ускладнення при діабеті. 31 Застосування сполуки, пропонованої в даному винаході, або її фізіологічно прийнятної солі, у комбінації з іншою активною речовиною можна проводити одночасно або по черзі через певні проміжки часу, але краще - через невеликі проміжки часу. Якщо їх вводять одночасно, то ці дві активні речовини вводять пацієнту спільно; якщо їх вводять по черзі через певні проміжки часу, то ці дві активні речовини вводять пацієнту через проміжки часу, які менші або дорівнюють 12 год, але краще - які менші або дорівнюють 6 год. Тому іншим об'єктом даного винаходу є фармацевтична композиція, яка включає сполуку, пропоновану в даному винаході, або фізіологічно прийнятну сіль такої сполуки й принаймні одну з активних речовин, описаних вище як компоненти комбінації, необов'язково разом з однією або більшою кількістю інертних носіїв і/або розріджувачів. Так, наприклад, фармацевтична композиція, пропонована в даному винаході, включає комбінацію сполуки, пропонованої в даному винаході, або фізіологічно прийнятної солі такої сполуки та принаймні одного антагоніста рецептора ангіотензину II необов'язково разом з однією або більшою кількістю інертних носіїв і/або розріджувачів. Сполука, пропонована в даному винаході, або її фізіологічно прийнятна сіль, і додаткова активна речовина, яка комбінована з нею можуть обидві міститися в одному препараті, наприклад, таблетці або капсулі, або окремо входити у два однакових або різних препарати, наприклад, у вигляді так називаного набору компонентів. У тексті вище та нижче атоми Η гідроксигруп зазначені в структурних формулах не у всіх випадках. Наведені нижче приклади призначені для ілюстрації даного винаходу без накладення обмежень. Терміни "кімнатна температура" і "температура навколишнього середовища" використовуються, як взаємозамінні, і означають температуру, що дорівнює приблизно 20°С. ДМФ диметилформамід ΝΜΡ N-метил-2-піролідон ТГФ тетрагідрофуран Одержання вихідних сполук: Приклад І 4-Бром-3-гідроксиметил-1-йодбензол Оксалілхлорид (13,0 мл) додають до охолодженого льодом розчину 2-бром-5-йодбензойної кислоти в СН2Сl2 (200 мл). Додають ДМФ (0,2 мл) і розчин перемішують при кімнатній температурі протягом 6 год. Потім розчин концентрують при зниженому тиску і залишок розчиняють у ТГФ (100 мл). Одержаний розчин охолоджують у бані з льодом і порціями додають LiВН4 (3,4 г). Охолодну баню забирають і суміш перемішують при кімнатній температурі протягом 1 год. Реакційну суміш розбавляють за допомогою ТГФ і обробляють 0,1 94454 32 Μ хлористоводневою кислотою. Потім органічний шар відокремлюють і водний шар екстрагують етилацетатом. Об'єднані органічні шари сушать (Na2SO4) і розчинник випарюють при зниженому тиску і одержують неочищений продукт. Вихід: 47,0 г (99% від теоретичного) Приклад II 4-Бром-3-хлорметил-1-йодбензол Тіонілхлорид (13 мл) додають до суспензії 4бром-3-гідроксиметил-1-йодбензолу (47,0 г) у дихлорметані (100 мл), яка містить ДМФ (0,1 мл). Суміш перемішують при температурі навколишнього середовища протягом 3 год. Потім розчинник і надлишок реагенту видаляють при зниженому тиску. Залишок розтирають із метанолом і сушать. Вихід: 41,0 г (82% від теоретичного) Приклад III 4-Бром-1-йод-3-феноксиметилбензол Фенол (13 г), розчинений в 4 Μ розчині КОН (60 мл), додають до 4-бром-3-хлорметил-1йодбензолу (41,0 г), розчиненого в ацетоні (50 мл). Додають Nal (0,5 г) і одержану суміш перемішують при 50 °С протягом ночі. Потім додають воду й одержану суміш екстрагують етилацетатом. Об'єднані екстракти сушать і розчинник випарюють при зниженому тиску. Залишок очищають за допомогою хроматографії на силікагелі (циклогексан/етилацетат 19:1). Вихід: 38,0 г (79% від теоретичного) Приклад IV (5-Бром-2-хлорфеніл)-(4-метоксифеніл)метанон 38,3 мл Оксалілхлориду та 0,8 мл диметилформаміду додають до суміші 100 г 5-бром-2хлорбензойної кислоти з 500 мл дихлорметану. Реакційну суміш перемішують протягом 14 год, потім фільтрують і відокремлюють від всіх летких компонентів у роторному випарнику. Залишок розчиняють в 150 мл дихлорметану, одержаний розчин охолоджують до -5 °С і додають 46,5 г анізолу. Потім порціями додають 51,5 г трихлориду алюмінію, так щоб температура не перевищувала 5 °С. Розчин перемішують протягом 1 год при температурі від 1 до 5 °С і потім виливають у подрібнений лід. Органічну фазу відокремлюють і водну фазу 33 екстрагують дихлорметаном. Об'єднані органічні фази двічі промивають 1 Μ хлористоводневою кислотою, двічі 1 Μ розчином гідроксиду натрію та розсолом. Потім органічну фазу сушать над сульфатом натрію, розчинник видаляють і залишок перекристалізовують з етанолу. Вихід: 86,3 г (64% від теоретичного) + Мас-спектр (ІЕР - іонізація електророзпилен+ ням): m/z = 325/327/329 (Вr+Сl) [М+Н] Приклад V 1-Бром-4-хлор-3-(4-метоксибензил)-бензол Розчин 86,2 г (5-бром-2-хлорфеніл)-(4метоксифеніл)-метанону та 101,5 мл триетилсилану в 75 мл дихлорметану та 150 мл ацетонітрилу охолоджують до 10 °С. Потім при перемішуванні додають 50,8 мл ефірату трифториду бору таким чином, щоб температура не перевищувала 20 °С. Розчин перемішують протягом 14 год при температурі навколишнього середовища й потім додають ще 9 мл триетилсилану та 4,4 мл ефірату трифториду бору. Розчин перемішують протягом ще 3 год при 45-50 °С і потім охолоджують до температури навколишнього середовища. Додають розчин 28 г гідроксиду калію в 70 мл води та одержану суміш перемішують протягом 2 год. Органічну фазу відокремлюють і водну фазу ще три рази екстрагують діізопропіловим ефіром. Об'єднані органічні фази двічі промивають 2 Μ розчином гідроксиду калію й один раз розсолом і потім сушать над сульфатом натрію. Після випарювання розчинника залишок промивають етанолом і сушать при 60 °С. Вихід: 50,0 г (61% від теоретичного) + Мас-спектр (ІЕР ): m/z = 310/312/314 (Br+Cl) + [M+H] Приклад VI 4-(5-Бром-2-хлорбензил)-фенол Розчин 14,8 г 1-бром-4-хлор-3-(4метоксибензил)-бензолу в 150 мл дихлорметану охолоджують у бані з льодом. Додають 50 мл 1 Μ розчину триброміду бору в дихлорметані й одержаний розчин перемішують протягом 2 год при температурі навколишнього середовища. Потім розчин охолоджують у бані з льодом і по краплях додають насичений розчин карбонату калію. При температурі навколишнього середовища значення рН суміші доводять до 1 за допомогою 1 Μ водного розчину хлористоводневої кислоти, органічну фазу відокремлюють і водну фазу три рази екстрагують етилацетатом. Об'єднані органічні фази сушать над сульфатом натрію й розчинник повністю 94454 34 видаляють. Вихід: 13,9 г (98% від теоретичного) Мас-спектр (ІЕР-): m/z = 295/297/299 (Br+Cl) [M-H] Приклад VII [4-(5-Бром-2-хлорбензил)-фенокси]-третбутилдиметилсилан Розчин 13,9 г 4-(5-бром-2хлорбензил)-фенолу в 140 мл дихлорметану охолоджують у бані з льодом. Потім додають 7,54 г трет-бутилдиметилсилілхлориду в 20 мл дихлорметану й після цього 9,8 мл триетиламіну та 0,5 г 4-диметиламінопіридину. Одержаний розчин перемішують протягом 16 год при температурі навколишнього середовища й потім розбавляють за допомогою 100 мл дихлорметану. Органічну фазу двічі промивають 1 Μ водним розчином хлористоводневої кислоти й один раз водним розчином гідрокарбонату натрію й потім сушать над сульфатом натрію. Після видалення розчинника залишок фільтрують через силікагель (циклогексан/етилацетат 100:1). Вихід: 16,8 г (87% від теоретичного) Мас-спектр (ІЕУ - іонізація електронним уда+ ром): m/z = 410/412/414 (Br+Cl) [M] Приклад VIII 1-Бром-4-(1-метокси-D-глюкопіраноз-1-ил)-2(феноксиметил)-бензол 2 Μ Розчин iPrMgCl у ТГФ (11 мл) додають до сухого LiCl (0,47 г), суспендованого в ТГФ (11 мл). Суміш перемішують при кімнатній температурі до повного розчинення LiCl. Цей розчин в атмосфері аргону по краплях додають до розчину 4-бром-1йод-3-феноксиметилбензолу (8,0 г) у тетрагідрофурані (40 мл), охолодженого до -60 °С. Розчин нагрівають до -40 °С і потім додають 2,3,4,6тетракіс-О-(триметилсиліл)-D-глюкопіранон (10,7 г, чистота 90%) у тетрагідрофурані (5 мл). Одержаний розчин нагрівають до -5 °С в охолодній бані й перемішують протягом ще 30 хв при цій температурі. Додають водний розчин NH4C1 і одержану суміш екстрагують етилацетатом. Об'єднані органічні екстракти сушать над сульфатом натрію й розчинник видаляють при зниженому тиску. Залишок розчиняють у метанолі (80 мл) і обробляють метансульфоновою кислотою (0,6 мл). Після перемішування розчину при 35-40 °С протягом ночі, розчин нейтралізують твердим NaHCO3 і метанол видаляють при зниженому тиску. Залишок розбавляють водним розчином NaHCO3 і одержану суміш екстрагують етилацетатом. Об'єднані екстракти сушать над сульфатом натрію й розчинник випарюють і одержують неочищений продукт, який 35 вводять у реакцію відновлення без додаткового очищення. Вихід: 7,8 г (93% від теоретичного) Приклад IX 1-Бром-4-(2,3,4,6-тетра-О-ацетил-Dглюкотраноз-1-ил)-2-(феноксиметил)-бензол Ефірат трифториду бору (4,9 мл) додають до розчину 1-бром-4-(1-метокси-D-глюкопіраноз-1ил)-2-(феноксиметил)-бензолу (8,7 г) і триетилсилану (9,1 мл) у дихлорметані (35 мл) та ацетонітрилі (50 мл), охолодженого до -20 °С з такою швидкістю, щоб температура підтримувалася нижче 10 °С. Одержаний розчин нагрівають при 0 °С протягом 1,5 год і потім обробляють водним розчином гідрокарбонату натрію. Одержану суміш перемішують протягом 0,5 год, органічний розчинник видаляють і залишок екстрагують етилацетатом. Об'єднані органічні шари сушать над сульфатом натрію й розчинник видаляють. Залишок розбавляють дихлорметаном (50 мл) і піридином (9,4 мл), до розчину послідовно додають оцтовий ангідрид (9,3 мл) і 4-диметиламінопіридин (0,5 г). Розчин перемішують протягом 1,5 год при температурі навколишнього середовища й потім розбавляють дихлорметаном. Цей розчин двічі промивають 1 Μ хлористоводневою кислотою й сушать над сульфатом натрію. Після видалення розчинника залишок перекристалізовують з етанолу й одержують продукт у вигляді безбарвної твердої речовини. Вихід: 6,78 г (60% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 610/612 (Br) [M+NH4] Приклад X 2-(Феноксиметил)-4-(2,3,4,6-тетра-О-ацетил-Dглюкопіраноз-1-ил)-бензонітрил Колбу, у яку поміщені 1-бром-4-(2,3,4,6-тетраO-ацетил-D-глюкопіраноз-1-ил)-2-(феноксиметил)бензол (5,4 г), ціанід цинку (1,0 г), цинк (30 мг), Рd2(дибензиліденацетон)3*СНСl3 (141 мг) і тритрет-бутилфосфонійтетрафторборат (111 мг), продувають аргоном. Потім додають NMP (Nметилпіролідон) (12 мл) і одержану суміш перемішують при кімнатній температурі протягом 18 год. Після розведення етилацетатом суміш фільтрують 94454 36 і фільтрат промивають водним розчином гідрокарбонату натрію. Органічну фазу сушать (сульфат натрію) і розчинник видаляють. Залишок перекристалізовують з етанолу. Вихід: 4,10 г (84% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 557 [M+NH4] Описані нижче сполуки можна одержати за наступною методикою: Колбу, у яку поміщені стрижень для перемішування, 1-бром-4-(2,3,4,6тетра-O-ацетил-D-глюкопіраноз-1-ил)-2(феноксиметил)-бензол (14,7 г), ціанід міді (4,1 г) і NMP (100 мл) кип'ятять зі зворотним холодильником протягом 8 год. Після розведення водою (600 мл) осад відокремлюють, декілька разів промивають водою й потім розчиняють в етилацетаті (200 мл). Одержаний розчин фільтрують через шар силікагелю з використанням етилацетату (300 мл) як елюент. Фільтрат концентрують при зниженому тиску й залишок розчиняють у дихлорметані (100 мл) для переацетилування кисневмісних груп, від яких під час ціанування відщеплені захисні групи. Для цього послідовно додають піридин (4 мл), 4диметиламінопіридин (0,3 г) і оцтовий ангідрид (4,4 мл). Одержаний розчин перемішують при кімнатній температурі протягом 1 год. Потім реакційну суміш розбавляють дихлорметаном (50 мл) і тричі промивають 1 Μ водним розчином хлористоводневої кислоти, один раз водним розчином гідрокарбонату натрію та один раз водою. Органічну фазу сушать (сульфат натрію) і розчинник видаляють. Залишок перекристалізовують з етанолу. Вихід: 10,0 г (75% від теоретичного) Приклад XI 2-Бромметил-4-(2,3,4,6-тетра-О-ацетил-Dглюкопіраноз-1-ил)-бензонітрил 33% Розчин бромистоводневої кислоти в оцтовій кислоті (15 мл) додають до розчину 2-фенілоксиметил-4-(2,3,4,6тетра-О-ацетил-D-глюкопіраноз-1-ил)бензонітрилу (0,71 г) і оцтового ангідриду (0,12 мл) в оцтовій кислоті (10 мл). Одержаний розчин перемішують при 55 °С протягом 6 год і потім охолоджують на бані з льодом. Реакційну суміш нейтралізують охолодженим водним розчином карбонату калію й одержану суміш екстрагують етилацетатом. Об'єднані органічні екстракти сушать над сульфатом натрію й розчинник видаляють при зниженому тиску. Залишок переносять у суміш етилацетат/циклогексан (1:5) і осад відокремлюють фільтруванням і сушать при 50 °С і одержують чистий продукт. Вихід: 0,52 г (75% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 543/545 (Br) [M+NH4] 37 Приклад XII 1-Хлор-4-(β-D-глюкопіраноз-1-ил)-2-(4гідроксибензил)-бензол Розчин 4,0 г [4-(5-бром-2-хлорбензил)фенокси]-трет-бутилдиметилсилану в 42 мл сухого діетилового ефіру охолоджують до -80 °С в атмосфері аргону. До охолодженого розчину повільно додають 11,6 мл охолодженого (приблизно -50 °С) 1,7 Μ розчину трет-бутиллітію в пентані й потім розчин перемішують протягом 30 хв при -80 °С. Потім цей розчин шприцом, голка якого охолоджена твердим діоксидом вуглецю, по краплях додають до розчину 4,78 г 2,3,4,6-тетракіс-О(триметилсиліл)-D-глюкопіранону в 38 мл діетилового ефіру, охолодженого до -80 °С. Одержаний розчин перемішують протягом 3 год при -78 °С. Потім додають розчин 1,1 мл метансульфонової кислоти в 35 мл метанолу й одержаний розчин перемішують протягом ще 16 год при температурі навколишнього середовища. Потім розчин нейтралізують твердим гідрокарбонатом натрію, додають етилацетат і одержаний розчин концентрують при зниженому тиску. До розчину, який залишився, додають водний розчин гідрокарбонату натрію й чотири рази екстрагують етилацетатом. Об'єднані органічні фази сушать над сульфатом натрію й розчинник випарюють. Залишок розчиняють в 30 мл ацетонітрилу та 30 мл дихлорметану й одержаний розчин охолоджують до -10 °С. Після додавання 4,4 мл триетилсилану по краплях додають 2,6 мл ефірату трифториду бору, так щоб температура не перевищувала -5 °С. Після завершення додавання розчин перемішують протягом ще 5 год при температурі від -5 до -10 °С і потім реакцію зупиняють шляхом додавання водного розчину гідрокарбонату натрію. Органічну фазу відокремлюють і водну фазу чотири рази екстрагують етилацетатом. Об'єднані органічні фази сушать над сульфатом натрію, розчинник видаляють і залишок очищають за допомогою хроматографії на силікагелі (дихлорметан/метанол). Одержаний продукт являє собою суміш β/α складу приблизно 6:1, яку можна розділити шляхом повного ацетилування гідроксигруп оцтовим ангідридом, піридином і 4-диметиламінопіридином у дихлорметані та перекристалізації одержаного ацетилованого продукту з етанолу. Одержаний у такий спосіб чистий ацетилований β-продукт перетворюють на цільову сполуку шляхом видалення ацетильних груп у метанолі 4 Μ розчином гідроксиду калію. Вихід: 1,6 г (46% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 398/400 (СІ) [M+NH4] 94454 38 Приклад ХІll 1-Хлор-2-(4-циклопентилоксибензил)-4-(β-Dглюкопіраноз-1-ил)-бензол 0,16 мл Йодциклопентану додають до суміші 0,25 г 1-хлор-4-(β-Dглюкопіраноз-1-ил)-2-(4-гідроксибензил)-бензолу та 0,4 г карбонату цезію в 2,5 мл диметилформаміду. Суміш перемішують протягом 4 год при 45°С, а потім додають ще 0,1 г карбонату цезію та 0,05 мл йодциклопентану. Після перемішування протягом ще 14 год при 45 °С додають водний розчин хлориду натрію й одержану суміш екстрагують етилацетатом. Органічну фазу сушать над сульфатом натрію, розчинник видаляють і залишок очищають, використовуючи силікагель (дихлорметан/метанол 1:0->5:1). Вихід: 0,23 г (78% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 466/468 (СІ) [M+NH4] Наступні сполуки одержують за аналогією із прикладом XIII: (1) 1 -Хлор-4-(β-D-глюкопіраноз-1-ил)-2-[4-((R)тетрагідрофуран-3-ілокси)-бензил]-бензол Реакцію проводять із використанням тетрагідрофуран-3-іл-(S)-толуол-4-сульфонату як компонента реакції сполучення. + Мас-спектр (ІЕР ): m/z = 451/453 (СІ) [М+Н] Приклад XIV + 1-Хлор-4-(β-D-глюкопіраноз-1-ил)-2-[4(трифторметилсульфонілокси)-бензил]-бензол 10 мг 4-Диметиламінопіридину додають до розчину 0,38 г 1-хлор-4-(β-D-глюкопіраноз-1-ил)-2-(4гідроксибензил)-бензолу, 0,21 мл триетиламіну та 0,39 г N,N-біс-(трифторметилсульфоніл)-аніліну в 10 мл сухого дихлорметану. Розчин перемішують протягом 4 год при температурі навколишнього середовища й потім поєднують із розсолом. Одержану суміш екстрагують етилацетатом, органічні екстракти сушать над сульфатом натрію й розчинник видаляють. Залишок очищають за допомогою хроматографії на силікагелі (дихлорметан/метанол 1:0->4:1). Вихід: 0,33 г (64% від теоретичного) + + Мас-спектр (IEР ): m/z = 530/532 (Cl) [M+NH4] 39 94454 Наступні сполуки одержують за аналогією із прикладом XIV: (1) 1-Ціано-4-(β-D-глюкопіраноз-1-ил)-2-[4(трифторметилсульфонілокси)-бензил]-бензол + Мас-спектр (ІЕР ): m/z = 504 [М+Н] Приклад XV + 1-Хлор-4-(2,ЗА6-тетра-О-ацетил-β-Dглюкопіраноз-1-ил)-2-[4(трифторметилсульфонілокси)-бензил]-бензол До розчину 5,6 г 1-хлор-4-(β-D-глюкопіраноз-1ил)-2-[4-(трифторметилсульфонілокси)-бензил]бензолу в 75 мл дихлорметану послідовно додають 7 мл піридину, 7,8 мл оцтового ангідриду та 0,12 г 4-диметиламінопіридину. Розчин перемішують при температурі навколишнього середовища протягом 1 год. Після додавання 50 мл води одержану суміш перемішують протягом ще 5 хв. Органічну фазу відокремлюють і промивають 1 Μ водним розчином хлористоводневої кислоти та водним розчином гідрокарбонату натрію. Після сушіння над сульфатом магнію та видалення органічного розчинника одержують продукт у вигляді білої твердої речовини. Вихід: 7,0 г (94% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 698/700 (СІ) [M+NH4] Наступні сполуки одержують за аналогією із прикладом XV: (1) 1-Ціано-4-(2,3,4,6-тетра-О-ацетил-β-Dглюкопіраноз-1-ил)-2-[4(трифторметилсульфонілокси)-бензил]-бензол + Мас-спектр (ІЕР ): m/z - 689 [M+NH4] + 40 Приклад XVI 1-Хлор-2-(4-етинілбензилУ4-(β-Dглюкопіраноз-1-ил)-бензол 25 мг Йодиду міді, 44 мг біс-(трифенілфосфін)дихлориду паладію, 0,30 мл триетиламіну і на закінчення 0,14 мл триметилсилілац етил єну в атмосфері аргону додають до розчину 0,32 г 1-хлор4-(β-D-глюкопіраноз-1-ил)-2-[4(трифторметилсульфонілокси)-бензил]-бензолу в 3 мл диметилформаміду. Колбу щільно закривають і суміш перемішують протягом 8 год при 90 °С. Потім додають ще 25 мг біс-(трифенілфосфін)дихлориду паладію та 0,1 мл триметилсилілацетилену й розчин перемішують протягом ще 10 год при 90°С. Додають водний розчин гідрокарбонату натрію й одержану суміш три рази екстрагують етилацетатом і об'єднані органічні фази сушать над сульфатом натрію. Після випарювання розчинника залишок розчиняють в 5 мл метанолу й поєднують із 0,12 г карбонату калію. Суміш перемішують протягом 1 год при температурі навколишнього середовища й потім нейтралізують 1 Μ хлористоводневою кислотою. Потім метанол випарюють, залишок поєднують із розсолом і екстрагують етилацетатом. Зібрані органічні екстракти сушать над сульфатом натрію й розчинник видаляють. Залишок очищають за допомогою хроматографії на силікагелі (дихлорметан/метанол 1:0>5:1). Вихід: 0,095 г (40% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 406/408 (СІ) [M+NH4] Приклад XVII 1-Хлор-2-(4-етилбензил)-4-(β-D-глюкопіраноз1-ил)-бензол 2,87 г 1 -Хлор-2-(4-етинілбензил)-4-(β-Dглюкопіраноз-1-ил)-бензолу розчиняють в 10 мл етилацетату та 5 мл етанолу. Додають 0,3 г 10% паладію на вугіллі й одержану суміші перемішують в атмосфері водню (1 атм.) протягом ночі. Реакційну суміш фільтрують через целіт і фільтрат концентрують. Залишок очищають за допомогою хроматографії на силікагелі (дихлорметан/метанол 1:0->5:1). Вихід: 1,0 г (34% від теоретичного) + + Мас-спектр (ІЕР ): m/z - 410/412 (СІ) [M+NH4] 41 94454 42 Приклад XVIII 1-Хлор-2-[4-((S)-тетрагідрофуран-3-ілокси)бензил]-4-(2,3,4,6-тетра-O-ацетил-β-Dглюкопіраноз-1-ил)-бензол До розчину 2,02 г 1-хлор-4-(β-D-глюкопіраноз1-ил)-2-[4-((S)-тетрагідрофуран-3-ілокси)-бензил]бензолу в 20 мл дихлорметану послідовно додають 2,5 мл піридину, 2,8 мл оцтового ангідриду та 50 мг 4-диметиламінопіридину. Розчин перемішують при температурі навколишнього середовища протягом 4 год. Розчин розбавляють за допомогою 50 мл дихлорметану, двічі промивають за допомогою 50 мл 1 Μ хлористоводневої кислоти й один раз розчином гідрокарбонату натрію. Після сушіння над сульфатом натрію розчинник випарюють і одержують продукт. Вихід: 2,53 г (91% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 642/644 (СІ) [M+Na] Наступні сполуки можна одержати за аналогією із прикладом XVIII: (1) 1 -Хлор-2-(4-етилбензил)-4-(2,3,4,6-тетраО-ацетил-β-D-глюкопіраноз-1-ил)-бензол (2) 2-(4-Ацетокси-бензил)-1-хлор-4-(2,3,4,6тетра-О-ацетил-β-D-глюкопіраноз-1-ил)-бензол + + Мас-спектр (ІЕР ): m/z = 608/610 (СІ) [M+NH4] (3) 1-Ціано-2-(4-метоксибензил)-4-(2,3,4,6тетра-О-ацетил-[бета]-D-глюкопіраноз-1-ил)бензол + Мас-спектр (ІЕР ): m/z = 576 [M+Na] Приклад XIX + 1-Хлор-2-(4-метилбензил)-4-(2,3,4,6-тетра-Оацетил-β-D-глюкопіраноз-1-ил)-бензол Діізобутилалюмінійгідрид (54 мкл, 1 моль/л у толуолі) в атмосфері Аr додають до суміші 1,1'біс(дифенілфосфіно)фероцен-дихлорпаладію(ІІ) (22 мг) із ТГФ (3 мл) і охолоджують у бані з льодом. Суміш перемішують у бані з льодом протягом 0,5 год і потім послідовно додають 1-хлор-4(2,3,4,6-тетра-О-ацетил-В-D-глюкопіраноз-1-ил)-2[4-(трифторметилсульфонілокси)-бензил]-бензол (0,60 г) і Me2Zn (0,88 мл, 1 моль/л у толуолі). Баню з льодом видаляють і суміш кип'ятять зі зворотним холодильником протягом 2,5 год. Після охолодження до кімнатної температури додають 1 Μ хлористоводневу кислоту й одержану суміш екстрагують етилацетатом. Зібрані екстракти сушать над сульфатом натрію й розчинник видаляють. Залишок очищають за допомогою хроматографії на силікагелі (циклогексан/етилацетат 1:0->2:1). Вихід: 0,25 г (52% від теоретичного) Приклад XX 1-Хлор-2-(4-ціанобензил)-4-(2,3,4,6-тетра-Оацетил-β-D-глюкопіраноз-1-ил)-бензол Тетракіс(трифенілфосфін)паладій(0) (0,13 г) в атмосфері Аr додають у колбу, яка містить 1-хлор4-(2,3,4,6-тетра-О-ацетил-β-D-глюкопіраноз-1-ил)2-[4-(трифторметилсульфонілокси)-бензил]-бензол (0,80 г) і ціанід цинку (0,14 г). Суміш перемішують при 100 °С протягом 3 год. Після охолодження до кімнатної температури додають етилацетат і одержану суміш фільтрують, промивають водним розчином NaHCO3, сушать (сульфат натрію) і розчинник видаляють. Залишок перекристалізовують з етанолу. 43 94454 Вихід: 0,45 г (69% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 580/582 (СІ) [M+Na] Приклад XXI 4-Циклопропілфенілборонова кислота 2,5 Μ н-Бутиллітій у гексані (14,5 мл) по краплях додають до 1-бром-4-циклопропілбензолу (5,92 г) у ТГФ (14 мл) і толуолу (50 мл), охолодженого до -70 °С. Одержаний розчин перемішують при -70 °С протягом 30 хв потім додають триізопропілборат (8,5 мл). Розчин нагрівають до -20 °С і потім обробляють 4 Μ водним розчином хлористоводневої кислоти (15,5 мл). Реакційну суміш нагрівають до кімнатної температури й потім органічну фазу відокремлюють. Водну фазу екстрагують етилацетатом і об'єднані органічні фази сушать (сульфат натрію). Розчинник випарюють і залишок промивають сумішшю ефіру із циклогексаном і одержують продукт у вигляді безбарвної твердої речовини. Вихід: 2,92 г (60% від теоретичного) Мас-спектр (IЕР ): m/z = 207 (СІ) [М+НСОО] Наступні сполуки можна одержати за аналогією із прикладом XXI: (1) 4-Дифторметоксифенілборонова кислота 1-Бром-4-ціано-3-(4-метоксибензил)-бензол Суміш 25 г етил-(4-метоксифеніл)-ацетату, 27,4 г 1-бром-4-ціано-3-фторбензолу та 20 мл Nметилпіролідин-2-ону повільно додають до 31,4 г трет-бутоксиду калію в 130 мл N-метилпіролідин2-ону, підтримуючи температуру нижче 10°С. Після перемішування протягом 1 год при кімнатній температурі додають 100 мл метанолу й 137 мл 1 М водного розчину гідроксиду натрію й суміш перемішують протягом ночі при кімнатній температурі. Метанольну фракцію випарюють, залишок підлуговують 1 Μ водним розчином гідроксиду натрію й екстрагують трет-бутилметиловим ефіром. Водну фазу підкисляють 4 Μ хлористоводневою кислотою й декілька разів екстрагують етилацетатом. Об'єднані етилацетатні екстракти випарюють і залишок разом з 120 мл Ν,Ν-диметилформаміду та 24,9 г карбонату калію нагрівають при 100°С протягом 1 год. Реакційну суміш розбавляють водним розчином бікарбонату натрію й декілька разів екстрагують етилацетатом. Об'єднані екстракти випарюють і залишок кристалізують із метанолу. Вихід: 13 г (33% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 319/321 (Br) [M+NH4] Наступну сполуку одержують за аналогією із прикладом XXII: (1) 1-Бром-4-ціано-3-(4-циклопропілбензил)бензол Мас-спектр (ΙΕΡ ): m/z = 233 (СІ) [М+НСОО] На відміну від методики, описаної вище, сполуки одержують із 4-дифторметокси-1-йодбензолу з використанням iPrMgCl для утворення арилпохідної металу взаємодії цього проміжного продукту із триметилборатом. (2) 4-Дифторметилфенілборонова кислота + 44 + Мас-спектр (ІЕР ): m/z = 329/331 (Br) [M+NH4] Похідну фенілоцтової кислоти, необхідну для одержання цієї сполуки, синтезують за методикою, представленою в наведеному нижче прикладі XXIII. Приклад XXIII Етил-4-циклопропілфенілацетат + Мас-спектр (ІЕР ): m/z = 172 (СІ) [М+Н] На відміну від методики, описаної вище, сполуки одержують із 4-дифторметил-1-йодбензолу (одержаного з 4-йодобензальдегіду з використанням діетиламінотрифториду сірки (ДАТС) у дихлорметані) з використанням iPrMgCl для утворення арилвмісного металу та взаємодії цього проміжного продукту із триметилборатом. Приклад XXII Одержують із етил-4-бромфенілацетату за допомогою реакції сполучення, яка каталізується перехідним металом із циклопропілбороновою кислотою з використанням трициклогексилфосфонійтетрафторборату, ацетату паладію, фосфату калію в толуолі та воді за методикою, описаною в публікації Tetrahedron Lett. 2002, 43, 6987-6990 + + Мас-спектр (ІЕР ): m/z = 205 [М+Н] 45 94454 46 Приклад XXIV + 1-Ціано-4-(3-D-глюкопіраноз-1-ил)-2-(4метоксибензил)-бензол Колбу, у яку поміщені стрижень для перемішування та 1-бром-4-ціано-3-(4-метоксибензил)бензол (9,90 г), розчинений у сухому ТГФ (120 мл), які знаходяться в атмосфері аргону, охолоджують до -87 °С. До цього розчину повільно додають попередньо охолоджений (приблизно до -70°С) розчин трет-бутиллітію в пентані (1,7 М, 39 мл) і одержаний розчин перемішують протягом 30 хв при 87 °С. Потім додають розчин 2,3,4,6-тетракіс-O(триметилсиліл)-D-глюкопіранону (16,5 г) у ТГФ (80 мл) і об'єднаний розчин перемішують при -75 °С протягом 1 год. Реакцію зупиняють водним розчином NH4CI і одержану суміш екстрагують етилацетатом. Після сушіння (Na2SO4) органічних екстрактів і видалення розчинника залишок розчиняють у метанолі (150 мл) і додають метансульфонову кислоту (5 мл). Одержаний розчин перемішують при 55 °С протягом 8 год для утворення необхідної аномерної конфігурації. Після охолодження до температури навколишнього середовища розчин нейтралізують твердим гідрокарбонатом натрію й метанол випарюють при зниженому тиску. До залишку додають розсіл і одержану суміш екстрагують етилацетатом. Об'єднані екстракти сушать (сульфат натрію) і розчинник випарюють. Залишок розчиняють в ацетонітрилі (50 мл) і дихлорметані (50 мл) для відновлення аномерного вуглецевого центра. Після охолодження цього розчину до -20 °С і додавання триетилсилану (16 мл) по краплях додають діетилефірат трифториду бору (9,2 мл). Розчин реакційної суміші повільно нагрівають в охолодній бані до 0 °С і потім реакцію зупиняють шляхом додавання водного розчину гідрокарбонату натрію. Органічну фазу відокремлюють і водну фазу екстрагують етилацетатом. Об'єднані органічні фази сушать (сульфат натрію), розчинник видаляють і залишок очищають за допомогою хроматографії на силікагелі (дихлорметан/метанол 1:0 -> 9:1). Вихід: 5,2 г (41 % від теоретичного) + + Мас-спектр (ІЕР ): m/z = 403 [M+NH4] Наступну сполуку одержують за аналогією із прикладом XXIV: (1) 1-Ціано-2-(4-циклопропілбензил)-4-(β-Dглюкопіраноз-1-ил)-бензол + Мас-спектр (ІЕР ): m/z = 413 [M+NH4] Відновлення аномерного вуглецевого центра відповідного проміжного продукту, одержаного при синтезі цієї сполуки, переважно проводять кисневмісними групами захищеного піранозного кільця. Кращими захисними групами є бензил, пметоксибензил, триметилсиліл, триетилсиліл, трет-бутилдиметилсиліл, триізопропілсиліл і аліл. Приклад XXV 1-Ціано-2-(4-циклопропілбензил)-4-(тетра-Oацетил-[бета]-D-глюкопіраноз-1-ил)-бензол У колбу, у яку поміщені стрижень для перемішування, 4-(2,3,4,6-тетра-О-ацетил-Dглюкопіраноз-1-ил)-2-(4трифторметилсульфонілоксибензил)-бензонітрил (4,4 г), дегазований толуол (12 мл) і дегазована вода (8 мл), які знаходяться в атмосфері аргону, додають циклопропілборонову кислоту (0,20 г), фосфат калію (5,0 г), трициклогексилфосфін (0,19 г) і на закінчення ацетат паладію(П) (76 мг). Суміш перемішують при 110 °С протягом 6 год і в цей час через щогодини додають циклопропілборонову кислоту (5×0,20 г). Після охолодження до кімнатної температури суміш розбавляють водним розчином гідрокарбонату натрію й екстрагують етилацетатом. Об'єднані екстракти сушать (сульфат натрію) і розчинник видаляють при зниженому тиску. Залишок хроматографують на силікагелі (циклогексан/етилацетат 20:1 -> 1:1). Вихід: 3,2 г (87% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 581[M+NH4] Приклад XXVI 4-(1-Гідроксициклопропіл-D-фенілборонова кислота 3,0 Μ Розчин етилмагнійброміду в діетиловомуу ефірі (7,6 мл) при перемішуванні додають до розчину ізопропоксиду титану(ІV) (2,2 мл) у діетиловому ефірі (70 мл), охолодженого до -78 °С. Одержаний розчин перемішують при -78 °С протягом 1,5 год, потім додають метиловий ефір 4 47 (4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)бензойної кислоти (2,0 г). Реакційну суміш нагрівають до температури навколишнього середовища й перемішують протягом ще 12 год. Потім додають 1 Μ водний розчин хлористоводневої кислоти й одержану суміш екстрагують етилацетатом. Об'єднані органічні екстракти сушать (сульфат натрію) і розчинник випарюють. Залишок розчиняють в ацетоні (60 мл) і додають 0,1 Μ водний розчин NH4OAc (50 мл), а потім NaIO4 (2,3 г). Одержану реакційну суміш перемішують при кімнатній температурі протягом 18 год. Після видалення ацетону залишок екстрагують етилацетатом. Об'єднані екстракти сушать (сульфат натрію) і розчинник випарюють. Залишок очищають за допомогою хроматографії на силікагелі (циклогексан/етилацетат). Вихід: 0,45 г (33% від теоретичного) Мас-спектр (ІЕР ): m/z = 223 [М+НСОО] Одержання кінцевих сполук: Порівняльний приклад 1 4-(β-D-глюкопіраноз-1-ил)-2-[4-((S)тетрагідрофураніл-3-окси)-бензил]-бензонітрил Суміш 1,00 г 1-хлор-2-[4-((S)тетрагідрофураніл-3-окси)-бензил]-4-(2,3,4,6тетра-О-ацетил-β-D-глюкопіраноз-1-ил)-бензолу, 0,16 г ціаніду натрію та 0,35 г броміду нікелю з 2,5 мл N-метил-2-піролідинону протягом 15 хв нагрівають у мікрохвильовій печі при 220 °С. Після охолодження до кімнатної температури додають воду й одержану суміш екстрагують етилацетатом. Після сушіння над сульфатом натрію та випарювання розчинника залишок розчиняють в 5 мл метанолу. Додають 4 мл 4 Μ водного розчину гідроксиду калію й розчин перемішують при температурі навколишнього середовища протягом 3 год. Розчин нейтралізують 1 Μ хлористоводневою кислотою й метанол випарюють. Залишок екстрагують етилацетатом, об'єднані екстракти сушать над сульфатом натрію й розчинник видаляють при зниженому тиску. Залишок очищають за допомогою хроматографії на силікагелі (дихлорметан/метанол 4:1). Вихід: 0,35 г (49% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 442 [М+Н] Сполуки прикладів 1, 2, 3 та 4 одержують аналогічно одержанню в порівняльному прикладі 1: Приклад 1: 2-(4-Етилбензил)-4-(β-D-глюкопіраноз-1-ил)бензонітрил 94454 48 Вихід: 65% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 401 [M+NH4] Цю сполуку також можна одержати аналогічно одержанню в прикладі 6 з використанням 4етилфенілборонової кислоти як компонента реакції сполучення. Приклад 2: 4-(β-D-глюкопіраноз1-ил)-2-(4-гідроксибензил)-бензонітрил Сполуки одержують із 2-(4-ацетоксибензил)-1хлор-4-(2,3,4,6-тетра-O-ацетил-β-D-глюкопіраноз1-ил)-бензолу Вихід: 30% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 389 [M+NH4] Сполуку також одержують перацетилуванням 2-(4-метоксибензил)-4-(β-D-глюкопіраноз-1-ил)бензонітрилу (сполука 1(8)) з наступним розщепленням простого ефіру за допомогою триброміду бору та дезацетилуваням. Приклад 3: 4-(β-D-глюкопіраноз-1-ил)-2-(4-метилбензил)бензонітрил Вихід: 59% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 387 [M+NH4] Цю сполуку також можна одержати аналогічно одержанню в прикладі 6 з використанням 4метилфенілборонової кислоти як компонента реакції сполучення. Приклад 4: 2-(4-Ціанобензил)-4-(β-D-глюкопіраноз-1-ил)бензонітрил Вихід: 58% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 398 [M+NH4] 49 Приклад 5: 4-(β-D-глюкопіраноз-1-ил)-2-(4-метоксіетоксибензил)-бензонітрил 2-Брометилметиловий ефір (85 мкл) додають до суміші 4-(β-D-глюкопіраноз-1-ил)-2-(4гідроксибензил)-бензонітрилу (0,30 г) і карбонату цезію (0,39 г) в 3 мл диметилформаміду. Перед тим як додати воду та розсіл суміш перемішують при 80 °С протягом 16 год. Одержану суміш екстрагують етилацетатом, об'єднані екстракти сушать над сульфатом натрію й розчинник видаляють при зниженому тиску. Залишок очищають за допомогою хроматографії на силікагелі (дихлорметан/метанол 1:0->5:1). Вихід: 0,19 г (49% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 430 [М+Н] Приклад 6: 4-(β-D-глюкопіраноз-1-ил)-2-(4трифторметоксибензил)-бензонітрил 94454 50 У деяких випадках вихід підвищується при використанні від 1,5 до 2,0 екв. боронової кислоти із пропорційним збільшенням кількості основи. Наступні сполуки одержують за аналогією із прикладом 6: Приклад 7: 4-(β-D-глюкопіраноз-1-ил)-2-(4трифторметилбензил)-бензонітрил Вихід: 47% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 441 [M+NH4] Приклад 8: 4-(β-D-глюкопіраноз-1-ил)-2-(4ізопропілбензил)-бензонітрил Вихід: 87% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 415 [M+NH4] Приклад 9: 4-(β-D-глюкопіраноз-1-ил)-2-(4-третбутилбензил)-бензонітрил У заповнену Аr колбу поміщають 2-бромметил4-(2,3,4,6-тетра-О-ацетил-D-глюкопіраноз-1-ил)бензонітрил (0,25 г), 4трифторметоксифенілборонову кислоту (0,20 г), карбонат калію (0,26) і суміш складу 3:1 дегазованих ацетону та води (4 мл). Суміш перемішують при кімнатній температурі протягом 5 хв, потім її охолоджують у бані з льодом. Потім додають паладійдихлорид (5 мг) і реакційну суміш перемішують протягом 16 год при температурі навколишнього середовища. Потім суміш розбавляють розсолом і екстрагують етилацетатом. Об'єднані екстракти сушать над сульфатом натрію й розчинник видаляють при зниженому тиску. Залишок розчиняють у метанолі (9 мл) і обробляють 4 Μ водним розчином гідроксиду калію (1 мл). Одержаний розчин перемішують при температурі навколишнього середовища протягом 1 год і потім нейтралізують 1 Μ хлористоводневою кислотою. Метанол випарюють і залишок розбавляють розсолом і екстрагують етилацетатом. Зібрані органічні екстракти сушать над сульфатом натрію й розчинник видаляють. Залишок хроматографують на силікагелі (дихлорметан/метанол 1:0 -> 8:1). Вихід: 0,145 г (69% від теоретичного) + + Мас-спектр (ІЕР ): m/z = 457 [M+NH4] Вихід: 66% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 429 [M+NH4] Приклад 10: 4-(β-D-глюкопіраноз-1-ил)-2-(4триметилсилілбензил)-бензонітрил Вихід: 70% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 445 [M+NH4] 51 Приклад 11: 4-(β-D-глюкопіраноз-1-ил)-2-(4метилсульфанілбензил)-бензонітрил Вихід: 47% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 419 [M+NH4] Приклад 12: 4-(β-D-глюкопіраноз-1-ил)-2-[4-(3-метилбут-1ил)-бензил]-бензонітрил Вихід: 69% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 443 [M+NH4] Приклад 13: 2-(4-Фтор-бензил)-4-(β-D-глюкопіраноз-1-ил)бензонітрил Вихід: 34% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 391 [M+NH4] Приклад 14: 2-(4-Хлор-бензил)-4-(β-D-глюкопіраноз-1-ил)бензонітрил Вихід: 32% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 407/409 (СІ) [M+NH4] Приклад 15: 2-(4-Дифторметокси-бензил)-4-(β-Dглюкопіраноз-1-ил)-бензонітрил Вихід: 32% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 439 [M+NH4] 94454 52 Приклад 16: 2-(4-Дифторметилбензил)-4-(β-Dглюкопіраноз-1-ил)-бензонітрил Вихід: 65% від теоретичного. + + Мас-спектр (ІЕР ): m/z - 423 [M+NH4] Приклад 17: (27-1) 2-(4-Циклопропілбензил)-4-(β-Dглюкопіраноз-1-ил)-бензонітрил + + Мас-спектр (ІЕР ): m/z = 413 [M+NH4] Сполуку одержують відповідно до прикладу 6 з використанням 4-циклопропілфенілборонової кислоти як компонента реакції сполучення. Вихід: 83% від теоретичного. Альтернативно, цю сполуку одержують, як описано в прикладі XXIV(l). Сполуку прикладу 17 також одержують за наступною методикою: Розчин 2-(4-циклопропіл-бензил)-4-(2,3,4,6тетра-О-ацетил-D-глюкопіраноз-1-ил)бензонітрилу (0,80 г) у метанолі (5 мл) і ТГФ (5 мл) обробляють водним розчином гідроксиду калію (4 моль/л, 5 мл). Розчин реакційної суміші перемішують при температурі навколишнього середовища протягом 1 год і потім нейтралізують 1 Μ хлористоводневою кислотою. Органічні розчинники випарюють і залишок розбавляють розсолом і екстрагують етилацетатом. Органічні екстракти сушать (сульфат натрію) і розчинник видаляють. Залишок хроматографують на силікагелі (дихлорметан/метанол 1:0 -> 9:1). Вихід: 0,54 г (96% від теоретичного) Приклад 18: 2-(4-Циклобутилбензил)-4-(β-D-глюкопіраноз1-ил)-бензонітрил Сполуку одержують відповідно до прикладу 6 з використанням 4-циклобутилборонової кислоти (одержуваної за аналогією із прикладом XXI) як компонента реакції сполучення. Вихід: 51% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 427 [M+NH4] 53 94454 54 Приклад 19: 4-(β-D-глюкопіраноз-1-ил)-2-(4-проп-1ілбензил)-бензонітрил Вихід: 64% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 415 [M+NH4] Приклад 20: 4-(β-D-глюкопіраноз-1-ил)-2-[4-(1гідроксициклопропіл)-бензил]-бензонітрил Цю сполуку можна одержати відповідно до прикладу 6 з використанням 4-(1гідроксициклопропіл)-фенілборонової кислоти як компонента реакції сполучення. Приклад 21: 4-(β-D-глюкопіраноз-1-ил)-2-(4-йодбензил)бензонітрил 1 Μ Розчин монохлориду йоду в дихлорметані (0,9 мл) додають до 4-(β-D-глюкопіраноз-1-ил)-2(4-триметилсилілбензил)-бензонітрилу (0,26 г), розчиненого в дихлорметані (5 мл). Розчин перемішують при кімнатній температурі протягом 1 год і потім реакцію зупиняють шляхом додавання водного розчину Na2S2O3 і водного розчину NaHCO3. Органічну фазу відокремлюють і водну фазу екстрагують етилацетатом. Об'єднані органічні фази сушать над сульфатом натрію й розчинник видаляють. Залишок хроматографують на силікагелі (дихлорметан/метанол 1:0 -> 8:1). Вихід: 0,15 г (88% від теоретичного). + + Мас-спектр (ІЕР ): m/z = 499 [M+NH4] Наступні сполуки можна одержати за аналогією із прикладом 20: Приклад 22: 2-(4-Бромбензил)-4-(β-D-глюкопіраноз-1-ил)бензонітрил Вихід: 79% від теоретичного. + + Мас-спектр (ІЕР ): m/z = 451/453 [M+NH4] Сполуку одержують за методикою прикладу 20 з використанням брому замість ІСl у дихлорметані. Приклад 23: 4-(β-D-глюкопіраноз-1-ил)-2-(4пентафторетилбензил)-бензонітрил Колбу, яка містить 4-(2,3,4,6-тетра-О-ацетил-βD-глюкопіраноз-1-ил)-2-(4-йодбензил)-бензонітрил (0,16 г), пентафторетилтриметилсилан (0,14 г), KF (43 мг), Cul (0,16 г), ДМФ (2 мл) в атмосфері аргону, нагрівають при 60 °С протягом 24 год. Потім додають водний розчин NaHCO3 і одержану суміш екстрагують етилацетатом. Об'єднані органічні фази сушать над сульфатом натрію й розчинник видаляють. Залишок розчиняють у метанолі (8 мл) і обробляють 4 Μ розчином КОН (0,8 мл). Розчин перемішують при кімнатній температурі протягом 1 год і потім розбавляють водним розчином NaHCO3. Після видалення метанолу при зниженому тиску залишок екстрагують етилацетатом, об'єднані органічні екстракти сушать і розчинник видаляють. Залишок хроматографують на силікагелі (дихлорметан/метанол 1:0 -> 8:1). Вихід: 0,08 г (69% від теоретичного). + + Мас-спектр (ІЕР ): m/z = 491 [M+NH4] Приклад 24: 4-(β-D-глюкопіраноз-1-ил)-2-(4метилсульфінілбензил)-бензонітрил 35% Водний розчин пероксиду водню (48 мкл) додають до 4-(β-D-глюкопіраноз-1-ил)-2-(4метилсульфанілбензил)-бензонітрилу (83 мг) в 1,1,1,3,3,3-гексафторізопропанолі (2 мл). Одержаний розчин перемішують при температурі навколишнього середовища протягом 1 год і потім реакцію зупиняють шляхом додавання водного розчину Na2S2O3 і водного розчину NaHCO3. Органічну фазу відокремлюють і водну фазу екстрагують етилацетатом. Об'єднані органічні фази сушать над сульфатом натрію й розчинник видаляють. Зали 55 шок хроматографують на силікагелі (дихлорметан/метанол 1:0 -> 5:1). Вихід: 24 мг (28% від теоретичного). + + Мас-спектр (ІЕР ): m/z = 418 [М+Н] Приклад 25: 4-(β-D-глюкопіраноз-1-ил)-2-(4метилсульфонілбензил)-бензонітрил 3-Хлорпероксибензойну кислоту (70%, 0,14 г) додають до 4-(β-D-глюкопіраноз-1-ил)-2-(4 94454 56 метилсульфанілбензил)-бензонітрилу (100 мг) у дихлорметані (2 мл), охолодженого в бані з льодом. Охолодну баню видаляють і одержаний розчин перемішують при температурі навколишнього середовища протягом 1 год. Після додавання водного розчину Na2S2O3 і водного розчину NaHCO3 органічну фазу відокремлюють і водну фазу екстрагують етилацетатом. Об'єднані органічні фази сушать над сульфатом натрію й розчинник видаляють. Залишок хроматографують на силікагелі (дихлорметан/метанол 1:0 -> 8:1). Вихід: 68 мг (63% від теоретичного). + + Мас-спектр (ІЕР ): m/z = 451 [M+NH4] Наступні сполуки одержують за аналогією з наведеними вище прикладами або за іншими методиками, відомими з літератури: 57 94454 58 59 Нижче описані деякі приклади препаратів, у яких термін "активна речовина" означає одну або більшу кількість сполук, пропонованих у даному винаході, включаючи їх проліки або солі. У випадку однієї з комбінацій з однією або більшою кількістю додаткових активних речовин, описаних вище, термін "активна речовина" також включає додаткові активні речовини. Приклад А Таблетки, які містять 100 мг активної речовини Склад: 1 таблетка містить: активна речовина 100,0мг лактоза 80,0 мг кукурудзяний крохмаль 34,0 мг полівінілпіролідон 4,0 мг стеарат магнію 2,0 мг 220,0 мг. Методика приготування: Активну речовину, лактозу та крохмаль змішують і рівномірно змочують водним розчином полівінілпіролідону. Вологу суміш пропускають через сито (комірки розміром 2,0 мм) і висушують у лотковій сушарці при 50°С, потім суміш ще раз пропускають через сито (комірки розміром 1,5 мм) і додають змащувальну речовину. Готову суміш пресують і одержують таблетки. Маса таблетки: 220 мг Діаметр: 10 мм, плоска по обидва боки, з фасками по обидва боки та з надрізом на одному боці. Приклад В Таблетки, які містять 150 мг активної речовини Склад: 1 таблетка містить: активна речовина 150,0 мг порошкоподібна лактоза 89,0 мг кукурудзяний крохмаль 40,0 мг колоїдний діоксид кремнію 10,0 мг полівінілпіролідон 10,0 мг стеарат магнію 1,0мг 300,0 мг. Приготування: Активну речовину, змішану з лактозою, кукурудзяним крохмалем та діоксидом кремнію, зво 94454 60 ложують 20% водним розчином полівінілпіролідону й пропускають через сито з комірками розміром 1,5 мм. Гранули, висушені при 45°С, ще раз пропускають через те ж сито й змішують із зазначеною кількістю стеарату магнію. Із суміші пресують таблетки. Маса таблетки: 300 мг Діаметр: 10 мм,плоска Приклад С Капсули із твердого желатину, які містять 150 мг активної речовини Склад: 1 капсула містить: активна речовина 150,0 мг кукурудзяний крохмаль (висушений) приблизно 180,0 мг лактоза (порошкоподібна) приблизно 87,0 мг стеарат магнію 3,0 мг приблизно 420,0 мг. Приготування: Активну речовину змішують із інертним наповнювачем, пропускають через сито з комірками розміром 0,75 мм і рівномірно перемішують із використанням придатного апарата. Готову суміш поміщають в капсули із твердого желатину 1 розміру. Капсула містить: приблизно 320 мг Оболонка капсули: капсула із твердого желатину 1 розміру. Приклад D Супозиторії, які містять 150 мг активної речовини Склад: 1 Супозиторій містить: активна речовина 150,0 мг поліетиленгліколь 1500 550,0 мг поліетиленгліколь 6000 460,0 мг поліоксіетиленсорбітанмоностеарат 840,0 мг 2000,0 мг. Приготування: Після плавлення маси для супозиторію в ній рівномірно розподіляють активну речовину й розплав виливають в охолоджені форми. Приклад Ε Ампули, які містять 10 мг активної речовини
ДивитисяДодаткова інформація
Назва патенту англійськоюGlucopyranosyl-substituted benzonitrile derivatives
Автори англійськоюEckhardt Matthias, Himmelsbach Frank, Eickelmann Peter, Sauer Achim, Thomas Leo
Назва патенту російськоюГлюкопиранозилзамещенные производные бензонитрила
Автори російськоюЭкхардт Маттиас, Химмельсбах Франк, Айкельманн Петер, Зауэр Ахим, Томас Лео
МПК / Мітки
МПК: A61K 31/351, C07D 309/10
Мітки: глюкопіранозилзаміщені, бензонітрилу, похідні
Код посилання
<a href="https://ua.patents.su/31-94454-glyukopiranozilzamishheni-pokhidni-benzonitrilu.html" target="_blank" rel="follow" title="База патентів України">Глюкопіранозилзаміщені похідні бензонітрилу</a>
Наступний патент: Оксадіазолідиндіонова сполука
Випадковий патент: Спосіб частотного керування асинхронним двигуном з несиметричними параметрами обмоток статора












