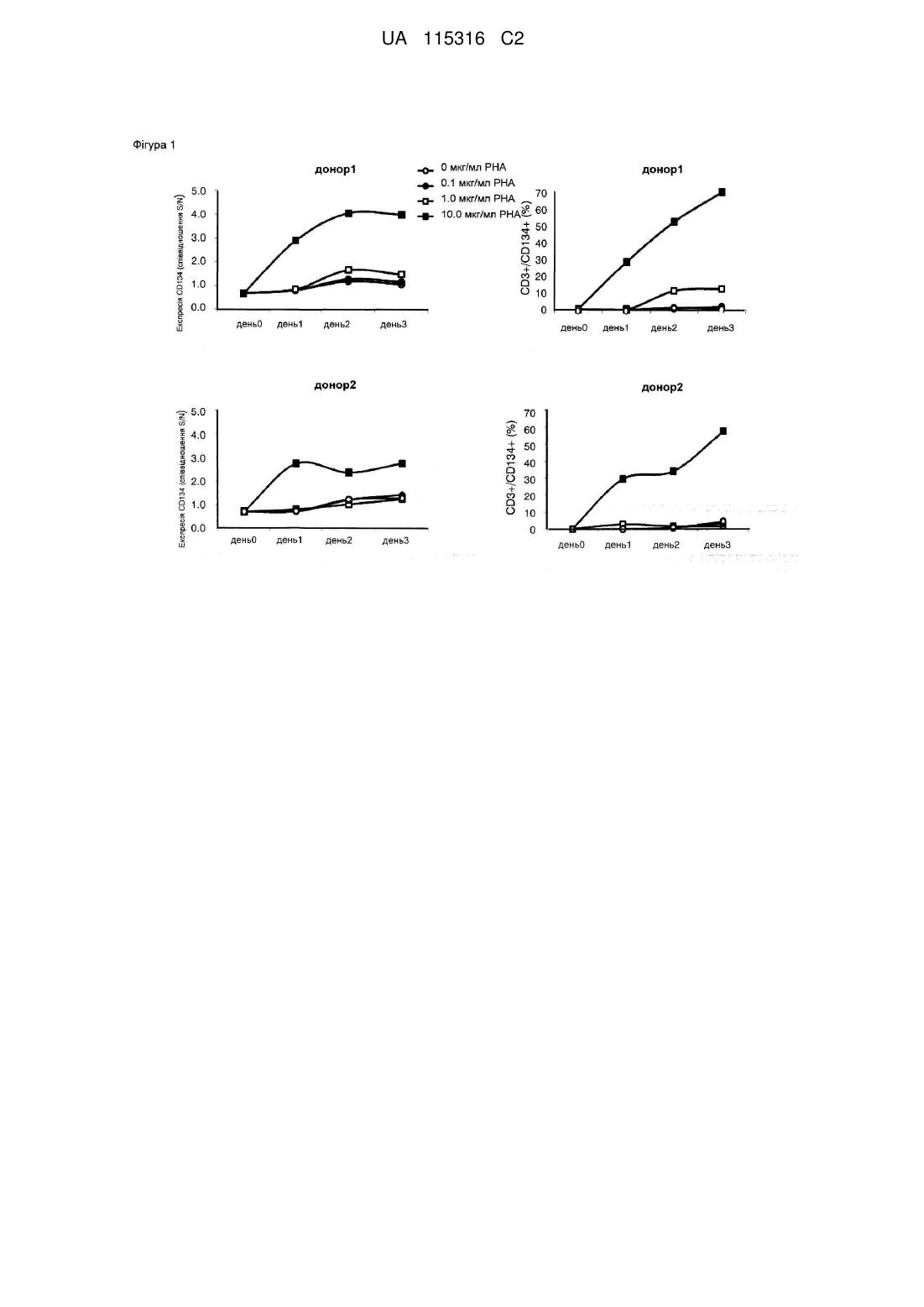
Зв’язувальна молекула, яка зв’язується з cd134 людини, та фармацевтична композиція, що її містить
Формула / Реферат
1. Зв’язувальна молекула, яка зв'язується з CD134 людини, при цьому зазначена зв’язувальна молекула являє собою антитіло або його антигензв’язуючий фрагмент, що містять:
(а) CDR1 важкого ланцюга, що містить амінокислотну послідовність SEQ ID NO: 6;
(b) CDR2 важкого ланцюга, що містить амінокислотну послідовність SEQ ID NO: 7;
(c) CDR3 важкого ланцюга, що містить амінокислотну послідовність SEQ ID NO: 8;
(d) CDR1 легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO: 9;
(е) CDR2 легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO: 10;
і
(f) CDR3 легкого ланцюга, що містить амінокислотну послідовність SEQ ID NO: 11.
2. Зв’язувальна молекула за п. 1, яка містить:
(a) варіабельну область важкого ланцюга, що містить послідовність амінокислот SEQ ID NO: 4 або варіант зазначеної послідовності, що містить 1, 2 або 3 заміни амінокислот в каркасній області; і/або
(b) варіабельну область легкого ланцюга, що містить послідовність амінокислот SEQ ID NO: 5 або варіант зазначеної послідовності, що містить 1, 2 або 3 заміни амінокислот в каркасній області.
3. Зв’язувальна молекула за будь-яким із попередніх пунктів, яка відрізняється тим, що зазначена зв’язувальна молекула не перешкоджає зв’язуванню рецептора CD134 людини (OX40) з лігандом OX40 людини (OX40L).
4. Зв’язувальна молекула за п. 3, яка відрізняється тим, що вона не перешкоджає імуностимулюючим і/або проліферативним реакціям ефекторних Т-клітин, що експресують CD134 людини, на OX40L людини.
5. Зв’язувальна молекула за п. 3, яка відрізняється тим, що вона підсилює імуностимулюючі та/або проліферативні реакції ефекторних Т-клітин, що експресують CD134 людини, на OX40L людини.
6. Зв’язувальна молекула за п. 3, яка відрізняється тим, що вона не перешкоджає реакціям, пов’язаним із супресорною функцією, регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини.
7. Зв’язувальна молекула за п. 3, яка відрізняється тим, що вона підсилює реакції, пов’язані з супресорною функцією, регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини.
8. Зв’язувальна молекула за п. 3, яка відрізняється тим, що вона не перешкоджає проліферативним реакціям регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини.
9. Зв’язувальна молекула за п. 3, яка відрізняється тим, що вона пригнічує проліферативні реакції регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини.
10. Зв’язувальна молекула за будь-яким із попередніх пунктів, яка являє собою антитіло людини або його антигензв’язуючий фрагмент.
11. Зв’язувальна молекула за будь-яким із попередніх пунктів, яка являє собою химерне, гуманізоване антитіло або антитіло DeImmunizedÔ, або їх антигензв’язуючий фрагмент.
12. Зв’язувальна молекула за будь-яким із попередніх пунктів, яка являє собою антитіло IgA, IgD, IgE, IgG або IgM, таке як IgG1, IgG2, IgG3 або IgG4.
13. Зв’язувальна молекула за будь-яким із пп. 1-11, яка являє собою антигензв’язуючий фрагмент антитіла.
14. Зв’язувальна молекула за п. 13, яка відрізняється тим, що зазначений антигензв’язуючий фрагмент антитіла вибраний з групи, яка складається з: фрагментів Fv і Fab-подібних фрагментів.
15. Зв’язувальна молекула за п. 14, яка відрізняється тим, що зазначений Fv фрагмент являє собою одноланцюговий Fv або Fv, що зв’язаний дисульфідними зв’язками.
16. Зв’язувальна молекула за п. 14, яка відрізняється тим, що зазначений Fab-подібний фрагмент являє собою фрагмент Fab, фрагмент Fab’ або фрагмент F(ab’)2.
17. Зв’язувальна молекула за будь-яким із попередніх пунктів, яка відрізняється тим, що зазначена зв’язувальна молекула являє собою рекомбінантне антитіло або його антигензв’язуючий фрагмент.
18. Зв’язувальна молекула за будь-яким із попередніх пунктів, яка відрізняється тим, що зазначена зв’язувальна молекула являє собою моноклональне антитіло або його антигензв’язуючий фрагмент.
19.Молекула нуклеїнової кислоти, що кодує зв’язувальну молекулу за будь-яким із попередніх пунктів.
20. Вектор, що містить щонайменше одну молекулу нуклеїнової кислоти за п. 19.
21. Клітина-хазяїн, що містить вектор за п. 20.
22. Клітина-хазяїн за п. 21, яка відрізняється тим, що зазначена клітина-хазяїн отримана з ссавця або комахи.
23. Спосіб отримання зв’язувальної молекули за будь-яким із пп. 1-18, який включає етапи (i) одержання молекул, що зв’язують CD134, і (ii) проведення скринінгу зазначених молекул з метою виявлення й отримання зв’язувальних молекул, які не перешкоджають зв’язуванню OX40L з CD134.
24. Спосіб за п. 23, який відрізняється тим, що етап (іі) включає виявлення зв’язувальних молекул, які зв’язуються з CD134 після впливу на CD134 насичуючої концентрації OX40L.
25. Спосіб за п. 23 або п. 24, який відрізняється тим, що зазначена зв’язувальна молекула являє собою моноклональне антитіло, і зазначений спосіб включає імунізацію тварини із застосуванням CD134 людини, отримання гібридом, що секретують антитіла до CD134, і скринінг гібридом, що виробляють антитіла до CD134.
26. Зв’язувальна молекула за будь-яким із пп. 1-18 для застосування при профілактиці або при лікуванні раку у суб’єкта, що потребує цього, або для зниження розміру пухлини або пригнічення росту ракових клітин у суб’єкта, або зниження або пригнічення розвитку метастатичного раку у суб’єкта, що страждає на рак.
27. Зв’язувальна молекула для застосування за п. 26, яка відрізняється тим, що зазначений рак вибраний з групи, яка складається з раку легенів, раку передміхурової залози, раку молочної залози, раку голови і шиї, раку стравоходу, раку шлунка, раку товстої кишки, раку ободової і товстої кишки, раку сечового міхура, раку шийки матки, раку матки, раку яєчників, раку печінки, раку крові та будь-якого іншого захворювання або розладу, що характеризується неконтрольованим ростом клітин.
28. Спосіб посилення імунної відповіді у суб’єкта-людини, який включає введення зазначеному суб’єкту-людині терапевтично ефективної кількості зв’язувальної молекули за будь-яким із пп. 1-18.
29. Спосіб за п. 28, який відрізняється тим, що зазначена посилена імунна відповідь включає збільшення імуностимулюючої/ефекторної функції ефекторних Т-лімфоцитів і/або придушення імуносупресорної функції регуляторних Т-лімфоцитів.
30. Фармацевтична композиція, яка містить зв’язувальну молекулу за будь-яким із пп. 1-18 у сполученні з одним або більше фармацевтично прийнятними розріджувачами або допоміжними речовинами.
31. Композиція за п. 30, яка відрізняється тим, що зазначена композиція підходить для парентерального введення в організм людини, наприклад внутрішньовенного, внутрішньом’язового, внутрішньошкірного, внутрішньочеревинного, внутрішньопухлинного, внутрішньоміхурового, внутрішньоартеріального, інтратекального, внутрішньокапсульного, внутрішньоочного, внутрішньосерцевого, транстрахеального, внутрішньосуглобового, підкапсульного, субарахноїдального, внутрішньоспінального, епідурального, внутрішньогрудинного або підшкірного введення.
Текст
Реферат: Винахід належить до зв’язувальної молекули, яка зв’язується з CD134, молекули нуклеїнової кислоти, що її кодує, вектору, клітини-хазяїна, способу одержання даної зв’язувальної молекули. Винахід також належить до фармацевтичної композиції, що містить зв’язувальну молекулу, та способу посилення імунної відповіді у суб’єкта. UA 115316 C2 (12) UA 115316 C2 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 Область техніки Даний винахід відноситься до антитіл, до використання таких антитіл, і зокрема до антитіл, які зв'язуються з CD134, для лікування раку. Рівень техніки Посилення протипухлинної функції Т-лімфоцитів представляє собою унікальний спосіб лікування раку. Існує велика кількість даних, що свідчать про те, що клітини пухлин "уникають" імунної системи, набуваючи активну імунну толерантність, головним чином за посередництва регуляторних Т-лімфоцитів (Tregs; Quezda et al. Immunol Rev 2011; 241:104-118). Таким чином, рівновага між ефекторними (тобто, прямим або непрямим знищенням клітин пухлини) Тлімфоцитами (Тефф) і тими, що викликають імунну толерантність (тобто, придушення ефекторної функції і виживання Тефф) регуляторними Т-лімфоцитами (Tрег), мабуть, являється критичним для ефективної протипухлинної імунотерапії. Інакше кажучи, ефективної протипухлинної імунної відповіді можна досягти шляхом посилення ефекторної функції Тефф та/або шляхом ослаблення пригнічуючої функції пухлина-специфічних Tрег. Ключовим рецептором, який, як було показано, що опосередковує такі реакції, являється рецептор CD134 (OX40) (Sugamura, K, Ishii, N, Weinberg, A. Therapeutic targeting of the effector T-cell co-stimulatory molecule OX40. Nature Rev Imm 2004; 4: 420-431). CD134 (також відомий, як OX40, TNFRSF4 і ACT35) являється членом підродини рецепторів фактору некрозу пухлини. Даний поверхневий ко-стимулюючий рецептор CD134 експресується на мембрані активованих Т-лімфоцитів і відіграє важливу роль в їх виживанні та функціонуванні. Присутність CD134-експресуючих Т-лімфоцитів було продемонстровано в різних злоякісних пухлинах людини і в дренуючих лімфатичних вузлах ракових пацієнтів (Ramstad et al. Am J Surg 2000; 179: 400-406; Vetto et al. Am J Surg 1997; 174: 258-265). Зшивання in vivo рецептора CD134 миші (або за допомогою розчинних гібридних білків з ліганду OX40 миші (OX40L)-імуноглобуліну, або за допомогою імітаторів OX40L миші, таких як CD134-специфічні антитіла) у мишей з пухлиною посилюється протипухлинний імунітет, що призводить до виживання без пухлини в моделях на мишах з різними лініями клітин злоякісних пухлин мишей, наприклад, лімфоми, меланоми, саркоми, раку товстої і ободової кишки, раку молочної залози і гліоми (Sugamura et al. Nature Rev Imm 2004; 4: 420-431). Було запропоновано посилювати імунну відповідь ссавців на антиген шляхом захоплення OX40R за допомогою застосування агента, що зв'язує OX40R (WO 99/42585; Weinberg, 2000). Хоча зазначений документ стосується головним чином до OX40R-зв'язуючих агентах, особливу увагу приділено застосуванню OX40L або його частини; розкриття анти-OX40 антитіл в їх контексті еквівалентно OX40L. Дійсно, коли група Weinberg перевела науковий пошук в рамках дослідження на нижчих приматах, вони знову свідомо обрали антитіло, яке зв'язується з OX40Lзв'язуючим сайтом і в цілому імітує OX40L. Al-Shamkhani et al. (Eur J Chem 1996; 26: 1695-1699) застосовували анти-OX40 антитіло під назвою OX86, яке не блокувало зв'язування OX40L, щоб визначити диференціальну експресію OX40 в активованих Т-лімфоцитах миші; Hirschhorn-Cymerman et al. (J Exp Med 2009; 206: 11031116) застосовували OX86 разом з циклофосфамідом в моделі на мишах в якості потенційної хіміотерапії. Однак не можна очікувати, що OX86 буде зв'язуватися з OX40 людини, і, коли передбачається вибір антитіла, яке могло би бути ефективним для організму людини, то опираючись на роботи Weinberg, можна вибрати антитіло, яке дійсно зв'язується з OX40Lзв'язуючим сайтом. Зшивання in vivo рецептора CD134 людини (за допомогою антитіл, що специфічно направлені проти CD134 людини, які взаємодіють з OX40L-зв'язуючим доменом на CD134 людину; Патент США 2009/0214560 A1) у мишей з важким поєднаним імунодефіцитом (SCID) призводить до посилення протипухлинного імунітету, що веде до зменшенню росту пухлин різних злоякісних пухлинних ліній клітин людини, наприклад, лімфоми, раку передміхурової залози, раку товстої і ободової кишки і раку молочної залози. Точний механізм протипухлинної імунної відповіді, опосередкованої зшиванням рецептора CD134 людини, у людей ще не з'ясований, але передбачається, що він опосередковується трансмембранним сигнальним шляхом CD134, який стимулюється взаємодією з OX40L. Така взаємодія опосередковується зв'язуванням тримірного OX40L з CD134. У поточній терапії при лікуванні протиракових пухлин застосування тримерізованоголіганду OX40 пропонується в якості більш ефективного засобу, ніж анти-OX40 антитіла (Morris et al. Mol Immunol 2007; 44: 3112-3121). Суть винаходу В даний час автори заявки несподівано виявили, що для того, щоб викликати опосередковану Т-лімфоцитами протипухлинну активність, можна застосовувати ізольовані 1 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 зв'язувальні молекули, які зв'язуються з CD134, причому зазначена зв'язувальна молекула не перешкоджає зв'язуванню рецептора CD134 людини (CD134) з лігандом OX40 (OX40L), що призводить до посилення імунної відповіді, що характеризується посиленням імуностимулюючої/ефекторної функції Т-ефекторних клітин та/або проліферацією зазначених клітин та/або придушенням імуносупресорної функції регуляторних Т-клітин. Отже, відповідно до даного винаходу запропоновані ізольовані зв'язувальні молекули, які зв'язуються з CD134 людини, причому зазначена зв'язувальна молекула не перешкоджає зв'язуванню рецептора CD134 людини (OX40) з лігандом OX40 (OX40L). Такі зв'язувальні молекули включають відповідні анти-CD134 антитіла, антиген-зв'язувальні фрагменти зазначених анти-CD134 антитіл і похідні зазначених анти-CD134 антитіл. Згідно з деякими варіантами реалізації зазначена зв'язувальна молекула зв'язується з CD134 людини з -7 Kd 1 × 10 або менше. Зв'язувальна молекула має агоністичну активність по відношенню до CD134 на поверхні ефекторних Т-клітин людини та/або антагоністичну активність по відношенню до CD134 на поверхні регуляторних Т-клітин людини. Згідно з деякими додатковими варіантами реалізації зазначена зв'язувальна молекула являється моноклональним антитілом людини, яка специфічно зв'язується з CD134 людини з Kd при 100 нмоль або менше, переважно менше ніж 50 нм, більш переважно менше ніж 20 нм. Також відповідно до даного винаходу запропонована композиція, яка містить одну або більше зв'язувальних молекул і фармацевтично прийнятну основу. Згідно з деякими варіантами реалізації зазначена зв'язувальна молекула являється моноклональним антитілом по відношенню до CD134 людини або його антиген-зв'язувальним фрагментом. Зазначена композиція може також містити додаткові фармацевтичні агенти, такі як імунотерапевтичний агент, хіміотерапевтичний агент і агенти для гормональної терапії. Також відповідно до даного винаходу запропоновано способи застосування зазначених зв'язувальних молекул для діагностики та лікування. Згідно з деякими варіантами реалізації запропоновано спосіб лікування або профілактики раку у ссавців, що включає введення вказаному ссавцю терапевтично ефективної кількості зв'язувальної молекули або композиції, що містить зв'язувальну молекулу, яка розкривається в даній заявці. Згідно з деякими варіантами реалізації запропоновано спосіб посилення імунної відповіді у ссавця, що включає введення вказаному ссавцю терапевтично ефективної кількості зв'язувальної молекули. Згідно з конкретними варіантами реалізації зв'язувальна молекула, що застосовується при реалізації зазначених способів, являється моноклональним антитілом до CD134 людини або його антигензв'язувальним фрагментом, що зв'язується з CD134 людини, причому вказане антитіло не перешкоджає зв'язуванню рецептора CD134 людини (OX40) з лігандом OX40 (OX40L). Також даний винахід відноситься до молекул нуклеїнових кислот, які кодують послідовність амінокислот зв'язувальної молекули, вектори, що містять такі нуклеїнові кислоти, клітинихазяїни, що містять зазначені вектори, і способи отримання зазначених зв'язувальних молекул. Також даний винахід забезпечує інші аспекти, які стануть очевидними з повного розкриття, включаючи пункти формули винаходу. Опис креслень Даний винахід описано з посиланнями на додані креслення: Фігура 1. Часовий хід і залежність "доза-ефект" для впливу PHA-M на експресію CD134 людини на поверхні Т-лімфоцитів людини. Фігура 2. Експресія CD134 людини на спочиваючих і PHA-M-активованих CD4 T-лімфоцитах. Фігура 3. Характеристики зв'язування антитіл миші до CD134 людини - клон ACT35, клон 12H3 і клон 20E5, на поверхні PHA-M-стимульованих Т-лімфоцитів людини, що експресують CD134. Фігура 4. Зв'язування антитіл миші до CD134 людини - клон 12H3 і клон 20E5, на поверхні PHA-M-стимульованих Т-лімфоцитів людини, що експресують CD134, CD4 T-лімфоцити і CD8 Tлімфоцити. Фігура 5. Перехресна конкуренція немічених антитіл миші до CD134 людини - клон 12H3 або клон 20E5 - з ПЕ-кон'югованими комерційними антитілами миші до CD134 людини - клон ACT35 або клон L106 на поверхні PHA-M-стимульованих Т-лімфоцитів людини, що експресують CD134. Фігура 6. Одночасне зв'язування антитіл миші до CD134 людини - клон 12H3 або клон 20E5 з OX40L людини на поверхні PHA-M-стимульованих Т-лімфоцитів людини, що експресують CD134. Фігура 7. Часовий хід ефекту при впливі стимулюючих сфер з антитілами по відношенню до CD3 людини / СВ28 людини на експресію CD134 людини на поверхні ефекторних Т-лімфоцитів людини (Тефф) і регуляторних Т-лімфоцитів (Трег). 2 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 Фігура 8. Залежність "доза-ефект" для впливу антитіл миші до CD134 людини - клон 12H3 або клон 20E5 - або OX40L людини на проліферацію PHA-M-стимульованих Т-лімфоцитів людини, що експресують CD134. Фігура 9. Ефект комбінації антитіл миші до CD134 людини - клон 12H3 - з OX40L людини, або антитіл миші до CD134 людини - клон 20E5 - з OX40L людини на проліферацію PHA-Mстимульованих Т-лімфоцитів людини, що експресують CD134. Фігура 10. Ефект впливу антитіл миші до CD134 людини - клон 12H3 або клон 20E5, або OX40L людини на проліферацію ефекторних Т-лімфоцитів людини, що експресують CD134, стимульованих стимулюючими сферами з антитілами до CD3 людини / до СВ28 людини. Фігура 11. Ефект впливу антитіл миші до CD134 людини - клон 12H3 або клон 20E5, або OX40L людини на проліферацію регуляторних Т-лімфоцитів людини, що експресують CD134, стимульованих стимулюючими сферами з антитілами до CD3 людини / до СВ28 людини. Фігура 12. Ефект антитіл миші до CD134 людини - клон 12H3 на опосредковану OX40L людини проліферацію ефекторних (А) і регуляторних (B) Т-лімфоцитів людини, що експресують CD134, стимульованих стимулюючими сферами з антитілами до CD3 людини / до СВ28 людини. Фігура 13. Ефект впливу антитіл миші до CD134 людини - клон 12H3 або клон 20E5, або OX40L людини на супресію проліферації ефекторних Т-лімфоцитів людини, що експресують CD134, опосередковану регуляторними Т-лімфоцитами людини, що експресують CD134. Фігура 14. Зв'язування химерного антитіла з IgG4κ людини і анти-CD134 людини - клон 20E5 - на (мінус і плюс IL-2) поверхні CD4 T-лімфоцитів і CD8 T-лімфоцитів, що експресують CD134 людини, стимульованих CD3/CD28 сферами. Фігура 15. Ефект химерного антитіла з IgG4κ людини і анти-CD134 людини - клон 20E5 - або OX40L людини на проліферацію PHA-M-стимульованих Т-лімфоцитів людини, що експресують CD134. Фігура 16. Залежність "доза-ефект" для впливу химерного антитіла з IgG4κ людини і антиCD134 людини - клон 20E5 - або OX40L людини на проліферацію PHA-M-стимульованих Тлімфоцитів людини, що експресують CD134. Фігура 17. Ефект комбінації химерного антитіла з IgG4κ людини і анти-CD134 людини - клон 20E5 - з OX40L людини на проліферацію PHA-M-стимульованих Т-лімфоцитів людини, що експресують CD134. Фігура 18. Ефект химерного антитіла з IgG4κ людини і анти-CD134 людини - клон 20E5 - або OX40L людини на проліферацію (мінус і плюс IL-2) T-лімфоцитів, що експресують CD134 людини, стимульованих CD3/CD28 сферами. Фігура 19. Зв'язування антитіл миші до CD134 людини - клони 12H3 і 20E5 - невідновленим і відновленим рекомбінантним білком CD134 людини: Fcγ людини. (A) Вивчалися невідновлювальні (a, b) і відновлювальні (c, d) умови. (B) Характер електрофоретичної рухливості рекомбінантного білка CD134 людини: Fcγ людини (rhuCD134) при невідновлювальних (a, b) і відновлювальних (c, d) умовах, що визначалися за допомогою забарвлення кумасі діамантовим блакитним. (C) Вестерн-блотинг рекомбінантного білка CD134 людини: Fcγ людини в невідновлювальних (a, b) і відновлювальних (c, d) умовах при впливі контрольного антитіла миші - ізотип IgG1κ (MIgG1) або антитіл миші до CD134 людини - клони 12H3 і 2E5 (m12H3 і m20E5, відповідно). Фігура 20. Схематичне зображення цистеїн-багатих доменів (CDR) у повнорозмірному CD134 людини (позначений як "CRD1") і в різних процесованих формах CD134 людини (позначені як "CRD2", "CRD3", "CRD4" і "процесований (tc) CDR4"). Фігура 21. Зв'язування антитіл миші до CD134 людини - клони 12H3 і 20E5 - на поверхні клітин лінії 293-F, тимчасово трансфікованих конструкцією повнорозмірного CD134 людини (позначений як "CRD1") або конструкціями різних процесованих форм CD134 людини (позначені як "CRD2", "CRD3", "CRD4" і "процесований (tc) CDR4"). Фігура 22. Зв'язування химерних антитіл з IgG4κ та/або IgG1κ людини і анти-CD134 людини клонів 12H3 і 20E5 - на поверхні клітин лінії 293-F, тимчасово трансфікованих конструкцією повнорозмірного CD134 людини (позначений як "CRD1") або конструкціями різних процесованих форм CD134 людини (позначені як "CRD2", "CRD3", "CRD4" і "процесований (tc) CDR4"). Фігура 23. Зв'язування антитіл миші до CD134 людини - клон 12H3 (А) і химерного антитіла з IgG4κ та/або IgG1κ людини і анти-CD134 людини - клон 12H3 (В) з пептидом, що отриманий з CD134 людини, який відповідає послідовності амінокислот процесованого А1-модуля субдомену CRD3 A1-модуль-CRD4 (відповідно до визначення Latza et al. Eur J Immunol 1994; 24: 677-683). Опис винаходу 3 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 Активація Т-лімфоцитів опосередковується не тільки антигенною стимуляцією через рецептори Т-лімфоцитів, але також і ко-стимулюючими сигналами через ко-стимулюючі молекули. Серед декількох ко-стимулюючих молекул ключову роль у виживанні і гомеостазі Тефекторів і Т-клітин пам'яті відіграє член сімейства рецепторів фактору некрозу пухлини (TNF) OX40 (CD134). У відповідності зі сформованими уявленнями про ко-стимуляцію OX40 взаємодія між OX40 і лігандом OX40 (OX40L) виникає, коли активовані Т-лімфоцити зв'язуються з професійними клітинами, що представляють антиген (АПК). Згодом за рахунок костимулюючого сигналу OX40 посилюються функції Т-лімфоцитів, включаючи вироблення цитокінів, експансію і виживання. Взаємодія між OX40 і OX40L виникає під час взаємодії Тлімфоцитів і дендритних клітин (ДК) - через 2-3 дні після розпізнавання антигену. Т-лімфоцити, що експресують OX40 також можуть взаємодіяти з клітинами, що експресують OX40L, відмінними від ДК, і отримують OX40-сигнал від клітин, які можуть забезпечувати значущі сигнали для генерування Т-клітин пам'яті, посилення відповіді Th2 і збільшення тривалості запальних реакцій. Таким чином, оптимальна взаємодія між OX40 і OX40L може бути сформована у два етапи: OX40L, експресований на поверхні активованих CD4 Т-лімфоцитів, взаємодіє з OX40, експресованими на поверхні інших відповідальних CD4 T-лімфоцитів, що веде до оптимального генерування CD4 T-клітин пам'яті (Soroosh et al., 2006), або OX40L, експресований на поверхні CD4+ А-клітинах може запускати виживання Th2-клітин за рахунок взаємодії з OX40 на поверхні Th2-клітин (Kim et al. 2003). Крім того, для розвитку in vivo Th2, але не розвитку Th1 вимагається експресія OX40L на поверхні В-лімфоцитів (Linton et al. 2003), і експресуючі OX40L огрядні клітини безпосередньо посилюють функцію Т-ефекторних лімфоцитів за рахунок взаємодії між OX40 на Т-лімфоцитах і OX40L на огрядних клітинах (Kashiwakura et al. J Immunol 2004; 173: 5247-5257; Nakae et al. J Immunol 2006; 176: 2238-2248). Крім того, клітини ендотелію також експресують OX40L (Imura et al. 1996), зв'язування OX40 з клітинами ендотелію може брати участь в судинному запаленні. Надмірні сигнали OX40, як до відповідальних Т-лімфоцитів, так і до регуляторних Т-лімфоцитів, призводять до пригнічення Трег-опосередкованої імуносупресії. Сигнали OX40, що переходять у реактивні Т-лімфоцити, надають їм стійкість до Трег-опосередкованої супресії. З іншого боку, сигнали OX40L, що переходять у Трег-лімфоцити, пригнічують Трег-супресорну функцію, хоча спірним залишається питання про те, чи можуть сигнали OX40 контролювати рівень експресії Foxp3 в Треглімфоцитах. Крім того, навмисна стимуляція OX40 призводить до придушення TGF-бетазалежного диференціювання Трег-лімфоцитів (включаючи Трег-лімфоцити). Таке придушення може опосередковуватися частково ефекторними цитокінами, такими як IL-4 і IFN-гама, виробленими ефекторними Т-лімфоцитами, стимульованими OX40. Важливо, що блокування OX40L явно сприяє диференціюванню Трег і викликає толерантність до трансплантату, яка може бути опосередкована Трег-лімфоцитами. Отже, OX40 являється потенційною молекулярною мішенею для контролювання аутоімунітету, опосередкованого Т-лімфоцитами. Крім того, в недавніх дослідженнях повідомлялося, що взаємодія між OX40L, що експресується огрядними клітинами, і OX40, що експресується Tрег-клітинами, може взаємно призводити до придушення функції огрядних клітин та супресорної функції Tрег (Gri et al. 2008; Piconese et al. 2009). Для імунологів експериментальною моделлю вибору являються миші, і дослідження їх імунних відповідей внесло колосальний внесок у розуміння роботи імунної системи людини. Загальна структура системи у миші і людини представляється досить близькою; проте також існують значні відмінності. Наприклад, у мишей CD134 експресується Tефф при активації, тоді як Tрег постійно експресують CD134 (Piconese et al. J Exp Med 2008; 205: 825-839). У людей CD134 експресується на поверхні як Tефф, так і Tрег, але тільки при активації (див. далі, наприклад, Приклад 2 (g), "Експресія CD134 на поверхні ефекторних та регуляторних Tлімфоцитів людини після стимуляції стимулюючими сферами з антитілом до CD3 людини/CD28 людини »). Крім того, Tрег миші індукують апоптоз Tефф миші, досягаючи супресії (Pandiyan et al. Nat Immunol 2007; 8: 1353; Scheffold et al. Nat Immunol 2007; 8: 1285-1287), тоді як Tрег людини не викликає апоптозу Tефф людини, досягаючи супресії (Vercoulen et al. Plos ONE 2009; 4: e7183). У сукупності зазначені дані показують, що роль CD134 у здійсненні супресорної функції Tрег в імунній системі людини і миші різна. Термін "зв'язувальна молекула" включає (1) антитіло, (2) антиген-зв'язувальний фрагмент антитіла і (3) похідну антитіла, згідно з визначенням що наведені у даній заявці. Термін "зв'язується з CD134" або "зв'язування з CD134" відноситься до зв'язування зв'язувальної молекули, згідно з визначенням в цій заявці, з рецептором CD134 в пробі in vitro, таким як проба BIAcore або Octet (поверхневий плазмонний резонанс). Переважно зазначена зв'язувальна 4 UA 115316 C2 -6 5 10 15 20 25 30 35 40 45 50 55 -7 молекула має афінність зв'язування (Kd) 1 × 10 м або менше, більш переважно менше 50 × 10 -7 м, ще більш переважно менше 1 × 10 м. Термін "ізольоване антитіло" або "ізолююча зв'язувальна молекула" відноситься до антитіла або до зв'язувальної молекули, яка: (1) не зв'язана з асоційованими з нею в природі компонентами, що супроводжують її у природному стані; (2) не містить інших білків того ж виду; (3) експресується клітиною іншого виду; або (4) не існує в природі. Приклади ізольованих антитіл включають антитіло до CD134, яке піддали афінному очищенню із застосуванням CD134, антитіло до CD134, яке було згенеровано за допомогою гібриду або інших ліній клітин in vitro, і антитіло до CD134 людини, отримане в організмі трансгенної тварини. Термін "агоніст" відноситься до зв'язувальної молекули, згідно з визначенням в цій заявці, яка при зв'язуванні з CD134 (1) стимулює або активує CD134, (2) посилює, сприяє, індукує, підвищує або збільшує час активності, присутності або функції CD134, або (3) посилює, сприяє, збільшує або індукує експресію CD134. Термін "антагоніст" відноситься до зв'язувальної молекули, згідно з визначенням в цій заявці, яка при зв'язуванні з CD134 (1) інгібує або пригнічує CD134, (2) інгібує або пригнічує активність, присутність або функцію CD134, або (3) інгібує або пригнічує експресію CD134. Термін "антитіло" відноситься до молекули імуноглобуліну, яка зазвичай складається з двох ідентичних пар поліпептидних ланцюгів, причому кожна пара має однин "важкий" (H) ланцюг і однин "легкий" (L) ланцюг. Легкі ланцюги антитіл людини класифікують на каппа (κ) і лямбда (λ). Важкі ланцюги класифікують на мю, дельта, гама, альфа або епсилон, і вони визначають ізотип антитіла - IgM, IgD, IgG, IgA і IgE, відповідно. Кожен важкий ланцюг складається з варіабельної області важкого ланцюга (тут скорочено називається HCVR або VH) і константної області важкого ланцюга. Константні області важкого ланцюга антитіл IgD, IgG і IgA складаються з трьох доменів CH1, CH2 і CH3, а константні області важкого ланцюга IgM і IgE складаються з чотирьох доменів CH1, CH2, CH3 і CH 4. Кожен легкий ланцюг складається з варіабельної області легкого ланцюга (тут скорочено називається LCVR або VL) і константної області легкого ланцюга. Константна область легкого ланцюга складається з одного домену CL. Константні області антитіл можуть опосередковувати зв'язування імуноглобуліну з тканинами або факторами організму-хазяїна, включаючи різні клітини імунної системи (наприклад, ефекторні клітини). Області VH і VL можна додатково поділити на гіперваріабельні області, іменовані областями, визначальними комплементарність (CDR), що перемежовуються з більш консервативними областями, які називають каркасними областями (FR). Кожна VH і VL складається із трьох CDR і чотирьох FR, розташованих в наступному порядку, з N-кінця до C-кінця: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Зазначені варіабельні області кожної пари важкого/легкого ланцюга (VH і VL), відповідно, утворюють зв'язуючий сайт антитіла. Співвідношення амінокислот з кожною областю або доменом відбувається відповідно з визначенням у публікації Kabat Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987 і 1991)) або ввідповідно з визначенням у публікації Chothia et al. Conformations of immunoglobulin hypervariable regions (Nature 1989; 342(6252):877-83). Термін "антитіло" включає антитіло, яке являється мультимірною формою антитіла, такою як димери, тримери або мультиміри вищого порядку. Він також включає антитіло, яке пов'язане або приєднанє до фрагменту - не антитіло. Крім того, термін "антитіло" не обмежується будь-яким конкретним способом отримання зазначеного антитіла. Наприклад, він включає моноклональні антитіла, рекомбінантні антитіла і поліклональні антитіла. Термін "похідне антитіло" або "похідне" антитіла відноситься до молекули, яка здатна зв'язуватися з тим же антигеном (тобто, CD134 людини), з яким зв'язується антитіло, і включає послідовність амінокислот зазначеного антитіла, пов'язаного з додатковим молекулярним фрагментом. Послідовність амінокислот антитіла, яка міститься в похідній зазначеного антитіла, може бути повнорозмірним антитілом або може бути частиною або частинами повнорозмірного антитіла. Зазначений додатковий молекулярний фрагмент може бути біологічною або хімічною молекулою. Приклади додаткових молекулярних фрагментів включають хімічні групи, пептиди, білки (такі як ферменти, антитіла), амінокислоти і хімічні сполуки. Зазначений додатковий молекулярний фрагмент може бути призначений для застосування в якості агента для детекції, мітки-маркера, терапевтичного або фармацевтичного агента. Послідовність амінокислот в антитілі може бути приєднана або пов'язана з додатковим фрагментом нековалентним зв'язком, хімічним зв'язком, шляхом генетичного злиття або іншим шляхом. Термін "похідне антитіло" також включає химерні антитіла, гуманізовані антитіла і молекули, які отримані на основі модифікацій послідовностей амінокислот антитіла CD134, таких як консервативні заміни, вставки і додавання амінокислот. 5 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "антиген-зв'язувальний фрагмент" антитіла відноситься до однієї або більше частин повнорозмірного антитіла, які зберігають здатність до зв'язування з тим же антигеном (тобто, CD134 людини), з яким зв'язується вказане антитіло. Також термін "антиген-зв'язувальний фрагмент" включає частину антитіла, яка являється частиною більш великої молекули, утвореної за рахунок ковалентної чи нековалентно взаємодії, або частину антитіла з одним або більше додатковими молекулярними фрагментами. Приклади додаткових молекулярних компонентів включають амінокислоти, пептиди або білки, такі як центральна область стрептавідину, яку можна застосовувати для отримання тетрамірної молекули scFv (Kipriyanov et al. Hum Antibodies Hybridomas 1995; 6(3): 93-101). Термін "химерне антитіло" відноситься до антитіла, що містить послідовності амінокислот, що отримані з двох або більше антитіл. Зазначені два або більше антитіл можуть бути з одного і того ж виду або з двох або більше різних видів. Термін "епітоп" відноситься до частини антигену, який здатний специфічно зв'язуватися з антитілом або рецептором T-лімфоцитів, або іншим чином взаємодіяти з молекулою. "Епітоп" також у техніці називають "антигенними детермінантом". Як правило, епітоп складається з хімічно активних поверхневих угруповань молекул, таких як амінокислоти або бічні ланцюги вуглеводів або цукрів. Епітоп може бути "лінійним" або "нелінійним/конформаційним". Після того, як визначено бажаний епітоп (наприклад, за допомогою картування епітопів), можна згенерувати антитіло до зазначеного епітопу. Генерування та опис властивостей антитіл також може дати інформацію про бажані епітопи. На підставі такої інформації потім можливо провести скринінг антитіл, щоб відібрати ті антитіла, які зв'язуються з одним і тим же епітопом, тобто шляхом проведення досліджень перехресного конкурування з метою пошуку антитіл, які конкурують за зв'язування один з одним, тобто, антитіла конкурують за зв'язування з антигеном. Термін "клітина-хазяїн" відноситься до клітини, в яку був введений вектор експресії. Зазначений термін включає не тільки клітину конкретного суб'єкта, але також і потомство такої клітини. Оскільки в наступних поколіннях можуть виникати певні модифікації або у зв'язку із впливом навколишнього середовища, або у зв'язку з мутаціями, таке потомство може бути не ідентичним до батьківської клітини, але все ж включено в термін "клітина-хазяїн". Термін "антитіло людини" відноситься до антитіла, що складається з послідовності амінокислот тільки з послідовностей імуноглобулінів людини. Антитіло людини може містити ланцюги вуглеводів з антитіла миші, якщо його отримують в організмі миші, в клітинах миші або в клітинах гібридоми, отриманої з клітин миші. Антитіла людини можна отримати різними способами, відомими в техніці. Термін "гуманізоване антитіло" відноситься до химерних антитіл, які містять амінокислотні залишки, що отримані з послідовності антитіла людини. Гуманізоване антитіло може містити деякі або всі CDR з тваринного антитіла, яке не є людиною в той час як структура і константні області зазначеного антитіла містять залишки амінокислот, що отримані з послідовностей антитіла людини. Термін "ссавець" відноситься до будь-якого виду тварин з класу ссавців. Приклади ссавців включають: людину; лабораторних тварин, таких як щури, миші, мавпи і морські свинки; домашніх тварин, таких як кролики, корови, вівці, кішки, собаки, коні і свині, і т.п. Термін "ізольована нуклеїнова кислота" відноситься до молекули нуклеїнової кислоти геномного походження, з кДНК або синтетичного походження, або їх поєднання, яка відокремлена від інших молекул нуклеїнових кислот, присутніх в природному джерелі зазначеної нуклеїнової кислоти. Переважно, "ізольована" нуклеїнова кислота не містить послідовностей, розташованих на 5' і 3'- кінцях розглянутої нуклеїнової кислоти в геномній ДНК організму, з якого була отримана дана нуклеїнова кислота. Термін "швидкість дисоціації" або "Kd" відноситься до рівноважної константи дисоціації взаємодії конкретного антитіла-антигену і застосовується для опису спорідненості зв'язування між лігандом (таким як антитіло) і білком (таким як CD134). Чим менше рівноважна константа дисоціації, тим більш міцно зв'язується ліганд, або вище спорідненість між лігандом і білком. Kd можливо виміряти за допомогою поверхневого плазмонного резонансу, наприклад, із застосуванням системи BIACORE 1 або Octet. Термін "антитіло до CD134" відноситься до антитіла, згідно з визначенням в цій заявці, здатному до зв'язування з CD134 людини. Терміни "рецептор OX40" і "рецептор CD134" в даній заявці являються взаємозамінними, і вони включають CD134 людини, а також його варіанти, ізоформи і гомологи видів. Відповідно зв'язувальні молекули людини, що розкриваються в даній заявці, в певних випадках також можуть зв'язуватися з CD134 видами, що відмінні від людини. В інших випадках зв'язувальні молекули можуть бути абсолютно специфічні відносно CD134 людини і можуть не проявляти 6 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 видову перехресну реактивність або перехресну реактивність іншого типу. Зокрема, вони не будуть зв'язуватися з CD134 миші або щурів. Термін "специфічно зв'язується з CD134 людини" позначає, що Kd зв'язувальної молекули відносно зв'язування з CD134 людини, переважно більше ніж у 10, більш ніж у 50, більш ніж або, найбільш переважно, більш ніж у 100 разів перевищує Kd для зв'язування, наприклад, з CD40 людини, що визначають за допомогою проби, що описана в даній заявці, або є відомою фахівцям у даній галузі техніки (наприклад, проба BIAcore). Визначення того, що конкретний агент специфічно зв'язується з рецептором OX40, можуть бути легко отримані альтернативно за допомогою стандартних процедур або за допомогою їх адаптації. Одна відповідна для аналізу проба in vitro заснована на процедурі Вестерн-блотингу (що описана у багатьох стандартних посібниках, включаючи "Antibodies, A Laboratory Manual" Harlow and Lane). Щоб визначити, що певний агент, що зв'язується з рецептором OX40, специфічно зв'язується з білком OX40 людини, весь білок клітини екстрагують з клітин ссавців, що не експресують антиген OX40, таких як клітини, відмінні від лімфоцитів (наприклад, клітини COS або CHO), трансформованих із застосуванням молекули нуклеїнової кислоти, яка кодує OX40. В якості негативного контролю з відповідних нетрансформованих клітин також екстрагують весь білок клітин. Далі зазначені препарати білка піддають електрофорезу на денатуруючому або неденатуруючому поліакриламідному гелі (PAGE). Згодом зазначені білки переносять на мембрану (наприклад. з нітроцелюлози) за допомогою Вестерн-блотингу, і агент, який потрібно тестувати, інкубують на зазначеній мембрані. Після промивання мембрани з метою видалення агента що неспецифічно зв'язався, наявність агента що зв'язався визначають із застосуванням антитіла, спрямованого на тестований агент, кон'югованого з агентом для детекції, таким як фермент лужної фосфатази; внесення субстрату 5-бром-4-хлор-3-індоліл-фосфату/нітро-синього тетразолію призводить до отримання щільного синього з'єднання за рахунок імунолокалізованої лужної фосфатази. За допомогою даного способу було показано, що агенти, які специфічно зв'язуються з OX40 людини, зв'язуються з областю OX40 людини (яка повинна бути локалізована в заданому положенні гелю, що визначається за його молекулярною масою) в екстракті з клітин, трансформованих OX40, тоді як в екстракті з нетрансформованих клітин спостерігалася низька ступінь зв'язування або його відсутність. Може виникати неспецифічне зв'язування агента з іншими білками, і воно може визначатися як слабкий сигнал на Вестернблотингу. Неспецифічна природа такого зв'язування може бути виявлена фахівцями в даній області техніки по слабкому сигналу, що надходить на Вестерн-блотинг, у порівнянні з сильним основним сигналом, що виникає внаслідок специфічного зв'язування агента/білка OX40 людини. В ідеальному випадку, агент, що зв'язується з рецептором, не повинен зв'язуватися з білком, екстрагованим з нетрансформованих клітин. Крім аналізу зв'язування із застосуванням екстрагованих білків передбачувані агенти, що зв'язуються з рецептором OX40 які можна тестувати з метою підтвердження їх здатності до зв'язування по суті тільки з рецептором OX40 in vivo шляхом кон'югації зазначеного агента з флуоресцентною міткою (такою як флуоресцеїн ізотіонат (FITC)) та аналізу його зв'язування з популяціями антиген-активованих CD4+T-лімфоцитів і неактивованих Т-лімоцитів за допомогою сортування клітин з порушенням флуоресценції (FACS). Агент, який зв'язується по суті тільки з рецептором OX40, може забарвлювати тільки активовані CD4+T-лімфоцити. Термін "вектор" в цій заявці відноситься до молекули нуклеїнової кислоти, здатної транспортувати іншу молекулу нуклеїнової кислоти в клітину-хазяїн. Приклади векторів включають плазміди, вектори на основі вірусів, косміди або вектори-фаги, а також вектори на основі оголеної ДНК або РНК. Деякі вектори здатні до автономної реплікації в клітині-хазяїні, в яку вони були введені. Деякі вектори можуть інтегруватися в геном клітини-хазяїна при введенні їх в клітину-хазяїн, і в результаті вони реплікуються разом з геномом хазяїна. Певні вектори здатні управляти експресією генів, з якими вони функціонально пов'язані, і, отже, вони можуть називатися "векторами експресії". У даній заявці двадцять традиційних амінокислот та їх скорочення позначаються згідно із загальноприйнятим вживанням. Згідно з даним винаходом запропоновані зв'язувальні молекули, які зв'язуються з CD134 людини, включаючи анти-CD134 антитіла, антиген-зв'язувальні фрагменти анти-CD134 антитіл і похідні анти-CD134 антитіл. Зазначені зв'язувальні молекули характеризуються щонайменше -6 однією з наступних функціональних властивостей: (a) зв'язуються з CD134 людини з Kd 1 × 10 м або менше і (b) не перешкоджають зв'язуванню рецептора CD134 людини (OX40) з лігандом OX40 (OX40L); (с) володіють агоністичною активністю щодо CD134 людини на ефекторних Тклітинах та/або антагоністичною активністю щодо CD134 людини на регуляторних Т-клітинах; (d) не зв'язуються з рецептором CD40 при концентрації до 500 нм; (e) не зв'язуються з 7 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 рецептором CD 137 при концентрації до 500 нм; (f) зв'язуються з рецептором CD271 при концентрації до 500 нм; (g) здатні підсилювати вироблення IL-2 ізольованими Т-лімфоцитами людини; (h) здатні підсилювати імунну відповідь; (i) здатні пригнічувати ріст клітин пухлини; і (j) надають терапевтичну дію при раку. Згідно з деякими варіантами реалізації зазначена -7 -8 зв'язувальна молекула зв'язується з CD134 людини з Kd 1 × 10 м або менше, Kd 1 × 10 м або -9 менше або 1 × 10 м або менше. Антитіла та інші зв'язувальні молекули відповідно до даного винаходу можна отримати за допомогою стандартних способів, і потім проводити скринінг з метою виявлення та отримання зв'язувальних молекул, які не перешкоджають зв'язуванню OX40L з CD134. Наприклад, можна відбирати зв'язувальні молекули, які зв'язуються з CD134, навіть коли CD134 був підданий впливу насичуючої концентрації OX40L. Згідно з одним варіантом реалізації даного винаходу запропоновано антитіло людини, яке зв'язується з CD134 людини. Згідно з деякими варіантами реалізації вказане антитіло людини являється моноклональним антитілом, яке специфічно зв'язується з CD134 людини з Kd 100 нм або менше, переважно 10 нмоль або менше, та/або володіє агоністичною активністю щодо CD134 людини на поверхні T-ефекторних клітин та/або антагоністичною активністю щодо CD134 людини на поверхні T-регуляторних клітин. Одним прикладом таких антитіл людини являється клон 12Н3 моноклональних антитіл людини. Послідовність амінокислот цілої варіабельної області важкого ланцюга і послідовності амінокислот трьох CDR варіабельної області важкого ланцюга (VH) клону 12Н3 антитіла наведені під номерами SEQ ID №:12 і 14-16, відповідно. Послідовність амінокислот цілої варіабельної області легкого ланцюга і послідовності амінокислот трьох CDR варіабельної області легкого ланцюга (VL) клону 12Н3 антитіла наведені під номерами SEQ ID №:13 і 17-19, відповідно. Іншим ілюстративним антитілом згідно з даним винаходом являється клон 20E5 моноклонального антитіла людини. Послідовність амінокислот цілої варіабельної області важкого ланцюга і послідовності амінокислот трьох CDR варіабельної області важкого ланцюга (VH) клону 20E5 антитіла наведені під номерами SEQ ID №:4 і 6-8, відповідно. Послідовність амінокислот цілої варіабельної області легкого ланцюга і послідовності амінокислот трьох CDR варіабельної області легкого ланцюга (VL) клону 20E5 антитіла наведені під номерами SEQ ID №:5 і 9-11, відповідно. Антитіла згідно з даним винаходом можуть містити одну або більше із зазначених CDR або одну або більше із зазначених CDR з 1, 2 або 3 замінами амінокислот на одну CDR. Такі заміни переважно являються "консервативними" замінами. Консервативні заміни, при яких забезпечується функціональна схожість амінокислот, добре відомі в техніці і описані, наприклад, у Таблиці 1 в WO 2010/019702, яка включена в дану заявку за допомогою посилання. За умови, що клон 12H3 і клон 20E5 зв'язуються з CD134 людини, послідовності VH і VL кожного з них можна "поєднувати і комбінувати" з іншими антитілами до CD134, утворюючи додаткові антитіла. Зв'язування таких "поєднаних і комбінованих" антитіл до CD134 людини можна тестувати із застосуванням аналізу зв'язування, відомого в техніці, включаючи аналіз, описаний в розділі "Приклади". В одному випадку, коли області VH і VL поєднують і комбінують, послідовність VH з конкретної пари VH/VL замінюють на послідовність структурно схожої VH. Аналогічно, в іншому випадку послідовність VL з конкретної пари VH/VL замінюють на послідовність структурно схожої VL. Молекули, що містять тільки одну з трьох областей CDR (у деяких випадках, навіть тільки одну CDR або її частину, особливо CDR3), здатні зберігати антиген-зв'язувальну активність антитіла, з якого була отримана дана CDR. Див, наприклад, Laune et al. JBC 1997; 272: 3093744; Monnet et al. JBC 1999; 274:3789-96; Qiu et al. Nature Biotechnology 2007; 25: 921-9; Ladner et al. Nature Biotechnology 2007; 25: 875-7; Heap et al. J Gen Virol 2005; 86: 1791-1800; Nicaise et al. Protein Science 2004; 13: 1882-91; Vaughan and Sollazzo Combinatorial Chemistry & High Throughput Screening 2001; 4:417-430; Quiocho Nature 1993; 362: 293-4; Pessi et al. Nature 1993; 362: 367-9; Bianchi et al. J Mol Biol 1994; 236: 649-59; and Gao et al. J Biol Chem 1994; 269: 3238993. Відповідно, одним варіантом реалізації даного винаходу являється антитіло до CD134 людини, яке містить: (а) варіабельну область важкого ланцюга, що містить послідовність амінокислот відповідно SEQ ID №:12; (b) варіабельну область легкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:13. Згідно з додатковим варіантом реалізації даного винаходу запропонована ізольована молекула, що зв'язуються з CD134, яка містить (a) CDR1 важкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:14; та/або (b) CDR2 важкого ланцюга, що 8 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 містить послідовність амінокислот у відповідності з SEQ ID №:15; та/або (c) CDR3 важкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:16. Згідно з додатковим варіантом реалізації даного винаходу запропонована ізольована молекула, що зв'язуються з CD134, яка містить (a) CDR1 легкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:14; та/або (b) CDR2 легкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:15; та/або (c) CDR3 легкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:16. Відповідно, з одним варіантом реалізації до даного винаходу являється ізольоване антитіло до CD134 людини, яке містить: (а) варіабельну область важкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:4; (b) варіабельну область легкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:5. Згідно з додатковим варіантом реалізації даного винаходу запропонована ізольована молекула, що зв'язуються з CD134, яка містить (a) CDR1 важкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:6; та/або (b) CDR2 важкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:7; та/або (c) CDR3 важкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:8. Згідно з додатковим варіантом реалізації даного винаходу запропонована ізольована молекула, що зв'язуються з CD134, яка містить (a) CDR1 легкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:9; та/або (b) CDR2 легкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:10; та/або (c) CDR3 легкого ланцюга, що містить послідовність амінокислот у відповідності з SEQ ID №:11. За умови, що клон 12H3 і клон 20E5 зв'язуються з CD134 людини, і антиген-зв'язувальну специфічність забезпечують головним чином області CDR1, CDR2 і CDR3, послідовності CDR1, CDR2 і CDR3 VH і послідовності CDR1, CDR2 і CDR3 VL можна "поєднувати і комбінувати" з отриманням додаткових антитіл. Наприклад, CDR з різних антитіл до CD134 можна поєднувати і комбінувати, хоча кожне антитіло зазвичай містить CDR1, CDR2 і CDR3 VH і CDR1, CDR2 і CDR3 VL. Зв'язування таких "поєднаних і комбінованих" антитіл до CD134 людини можна тестувати із застосуванням аналізу зв'язування, відомого в техніці, включаючи аналіз, що описаний в розділі "Приклади" (наприклад, ELISA, аналіз "Biacore"). В одному випадку, коли поєднують і комбінують CDR VH, послідовність CDR1, CDR2 та/або CDR3 з послідовності конкретного VH замінюють на послідовність(ності) структурно схожої CDR. Аналогічно, коли поєднують і комбінують CDR VH, послідовність CDR1, CDR2 та/або CDR3 з послідовності конкретного VL зазвичай заміняють на послідовність(ності) структурно схожої CDR. Фахівцям в даній галузі техніки повинно бути очевидно, що нові послідовності VH і VL можна створювати шляхом заміни однієї або більшої області CDR VH та/або VL на структурно подібні послідовності з послідовності CDR, що розкриваються в даній заявці. Клас(наприклад, IgG, IgM, IgE, IgA або IgD) і підклас (наприклад, IgG1, IgG 2, IgG 3 або IgG4) антитіл до CD134 можна визначити за допомогою відповідних способів, таких як ELISA або Вестерн-блотинг, а також за допомогою інших технологій. В якості альтернативи, клас і підклас можна визначити за допомогою секвенування всіх або частини константних доменів важких та/або легких ланцюгів зазначених антитіл, порівнюючи їх послідовності амінокислот з послідовностями амінокислот відомих імуноглобулінів різних класів і підкласів та визначаючи клас і підклас зазначених антитіл. Антитіла до CD134 можуть бути молекулою IgG, IgM, IgE, IgA або IgD. Наприклад, антитіла до CD134 можуть відноситися до IgG з підкласу IgG1, IgG 2, IgG 3 або IgG4. Таким чином, згідно з іншим аспектом даного винаходу запропоновано спосіб перетворення антитіла до CD134 певного класу або підкласу в антитіло іншого класу або підкласу. Зв'язувальні молекули відповідно до одного варіанту реалізації даного винаходу включають моноклональні антитіла, їх фрагменти, пептиди та інші хімічні групи. Моноклональні антитіла можна отримати за допомогою стандартного способу імунізації ссавця, після якої проводять виділення плазматичних D-лімфоцитів, що виробляють аналізовані моноклональні антитіла і злиття їх з клітинами мієломи. Згідно з різними варіантами реалізації зв'язуючий фрагмент може бути не справжнім антитілом, а міметиком антитіла (наприклад, на підставі каркасу, що не походить з антитіла), аптамерами РНК, малою молекулою або CovX-тілом. Слід розуміти, що міметики антитіл (наприклад, структури каркасу, що не походять з антитіла, що володіють високою стабільністю, при цьому допускаючи введення варіабельності в певні положення) можна застосовувати для створення молекулярних бібліотек, з яких можна отримувати зв'язуючі фрагменти. Фахівці в галузі біохімії повинні бути знайомі з багатьма 9 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 такими молекулами. Такі молекули можна застосовувати в якості зв'язуючого фрагменту в агенті відповідно до даного винаходу. Приклади міметиків антитіл обговорюються у Skerra et al. (2007, Curr. Opin. Biotech., 18: 295304) і включають: білки-міметики антитіл компанії "Affibody" (також звані тринектинамі; Nygren, 2008, FEBS J, 275, 2668-2676); CTLD (лектиноподібний домен C-типу) (також звані; InnovationsPharmac. Technol. (2006), 27-30); аднектини (також звані монотілами; Meth. Mol. Biol., 352 (2007), 95-109); антикаліни (Drug Discovery Today (2005), 10, 23-33); DAR-шпильки (анкирини; Nat. Biotechnol. (2004), 22, 575-582); авімери (Nat. Biotechnol. (2005), 23, 1556-1561); мікротіла (FEBS J, (2007), 274, 86-95); аптамери пептидів (Expert. Opin. Biol. Ther. (2005), 5, 783797); домени Куниця (J. Pharmacol. Exp. Ther. (2006) 318, 803-809); афіліни (Trends. Biotechnol. (2005), 23, 514-522). Відповідно, переважно, щоб міметик антитіла був вибраний з групи, що включає або складається з білків-міметиків антитіл компанії "Affibody", тетранектинів (CTLD), аднектинів (монотіл), антикалінів, DAR-шпильок (анкиринів), авімерів, iM-антитіл, мікротіл, аптамерів пептидів, доменів Куниця, аптамерів і афілінів. Під "малими молекулами»мається на увазі низкомолекулярна органічна сполука масою 900 Дальтон або менше. Хоча великі біополімери, такі як нуклеїнові кислоти, білки і полісахариди (такі як крохмаль або целюлоза) не включені в поняття "малі молекули", складові їх мономери (рибо - або дезоксирибонуклеотиди, амінокислоти і моносахариди, відповідно) і олігомери (тобто, короткі полімери, такі як динуклеотид, пептиди, такі як антиоксидант глутатіон, і дисахариди, такі як сахароза) включені в дане поняття. Отримання малих молекул описано у Mayes & Whitcombe, 2005, Adv. Drug Deliv. Rev. 57:1742-78 аnd Root-Bernstein & Dillon, 2008, Curr. Pharm. Des. 14:55-6 2. CovX-тіла створюють шляхом ковалентного з'єднання фармакофору через лінкер зі зв'язувальним сайтом специфічно сконструйованого антитіла, що призводить до ефективного перепрограмування зазначеного антитіла (Tryder et al., 2007, Bioorg. Med. Chem. Lett., 17: 501-6). В результаті одержують новий клас хімічних фрагментів, який утворюється, коли кожен компонент вносить бажані ознаки в інтактне CovX-тіло - зокрема, такий фрагмент володіє біологічною активністю, характерною для пептиду, і збільшеним часом напіввиведення, характерним для антитіла. Антитіла людини можна отримати кількома різними способами, включаючи застосування бібліотеки експресованих послідовностей імуноглобулінів людини (Stratagene Corp., La Jolla, California; Cambridge Antibody Technology Ltd., London, England) для отримання фрагментів антитіл людини (VH, VL, Fv, Fd, Fab або (Fab') 2) та застосування зазначених фрагментів для конструювання повного антитіла людини шляхом з'єднання з ним відповідної частини, із застосуванням технологій, схожих з технологіями отримання химерних антитіл. Антитіла людини також можна отримати у трансгенних мишей з імуноглобуліном людини в геномі. Таких мишей можна придбати, наприклад, у компанії "Abgenix, Inc.», Фремонт, Каліфорнія і "Medarex, Inc.», Аннандаль, Нью-Джерсі. Крім з'єднання областей Fv важкого і легкого ланцюга з утворенням одноланцюжкового пептиду, аналогічними способами можна конструювати і експресувати Fab (M.J. Evans et al. J Immunol Meth 1995; 184: 123-138). Антитіла DeImmunized (деімунізовані антитіла) являють собою антитіла, в яких були виключені потенційно імуногенні епітопи T-лімфоцитів, які описані в заявці на Міжнародний патент PCT/GB98/01473. Отже, очікується, що імуногенність у людей буде виключена або істотно знижена, коли такі антитіла будуть застосовувати in vivo. Такими способами можуть бути виключені свої імуногенні епітопи T-лімфоцитів (якщо такі мають місце бути) в зв'язувальних молекулах на основі імуноглобулінів. Всі повністю і частково людські антитіла, що описані вище, менш імуногенні, ніж повністю мишачі антитіла, або антитіла, що отримані від людини, як і фрагменти, і одноланцюгові антитіла. Всі зазначені молекули (або їх похідні), відповідно, з меншою ймовірністю викликають імунну або алергічну реакцію. Отже, вони більше підходять для введення людям in vivo, ніж повністю нелюдські антитіла, особливо, коли необхідно повторне або тривале введення. Біспецифічні антитіла можна застосовувати в якості агентів для перехресної зшивки між CD134 людини однієї і тієї ж клітини-мішені людини або CD134 людини на двох різних клітинахмішенях людини. Такі біспецифічні антитіла володіють однією специфічністю до кожного з двох різних епітопів на CD134 людини. Зазначені антитіла і спосіб їх отримання описані в Патенті США № 5,534,254 (Creative Biomolecules, Inc.). Різні варіанти реалізації біспецифічних антитіл, описані у вказаному патенті, включають зшивку одноланцюжкового Fv з пептидними зшиваючими агентами, включаючи Ser-Cys, (Gly)4-Cys, (His)6-(Gly)4-Cys, хелатуючі агенти і хімічні або дисульфідні зшивання, включаючи бісмалеімідгексан і бісмалеімідкапроїл. 10 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 Молекули, що відмінні від антитіл, можна або виділяти або шляхом скринінгу вибирати з бібліотек сполук традиційними способами. Автоматизована система для генерування та скринінгу бібліотеки сполук описана в Патентах США № 5,901,069 і 5,463,564. Більш сфокусований підхід має на увазі тривимірне моделювання сайту зв'язування та подальше отримання сімейства молекул, які задовольняють моделі. Потім їх піддають скринінгу з метою відбору молекул з оптимальними характеристиками зв'язування. Інший підхід полягає в генеруванні бібліотеки рекомбінантних пептидів і подальшому їх скринінгу з метою відбору пептидів, які зв'язуються з розглянутим епітопом CD134 людини. Див, наприклад, Патент США № 5,723,322. Даний епітоп - той самий, що зв'язується з моноклональними антитілами, описаними в прикладах далі. Фактично молекули можна згенерувати або виділити відносно легко відповідно до технологій, добре відомими в техніці, коли епітоп відомий. Згідно з додатковими варіантами реалізації запропоновані похідні будь-якого з антитіл до CD134 людини, описаних вище. Згідно одному конкретному аспекту похідну зазначеного антитіла отримують на підставі модифікацій послідовностей амінокислот клону 12H3 та/або клону 20E5. Послідовності амінокислот будь-яких областей ланцюгів антитіла можна модифікувати, наприклад, каркасні області, області CDR або константні області. Зазначені модифікації можна вводити за допомогою стандартних технологій, відомих в техніці, таких як сайт-направлений мутагенез і випадковий ПЛР-опосередкований мутагенез, і вони можуть включати природні, а також неприродні амінокислоти. Типи модифікацій включають вставки, делеції, заміни або їх поєднання, однієї або більше амінокислот антитіла до CD134. Згідно з деякими варіантами реалізації похідна антитіла містить 1, 2, 3 або 4 заміни амінокислот у CDR важкого ланцюга та/або одну заміну амінокислоти в CDR легкого ланцюга. Згідно з деякими варіантами реалізації похідна антитіла до CD134 містить одну або більше замін амінокислот в порівнянні з послідовністю амінокислот в послідовності генів людини ембріонального типу. Згідно конкретного варіанту реалізації одна або більше із зазначених замін у порівнянні з послідовністю ембріонального типу знаходяться в області CDR2 важкого ланцюга. Відповідно до іншого конкретного варіанту реалізації заміни амінокислот відносно послідовності ембріонального типу знаходяться в одному або більше положеннях, що збігаються з положеннями замін відносно послідовності ембріонального типу в антитілах клону 12H3 та/або клону 20E5. Згідно ще одному варіанту реалізації заміна амінокислот являється заміною одного або більше цистеїну в антитілі на другий залишок, наприклад, без обмежень аланін або серин. Цистеїн може бути канонічним або неканонічним цистеїном. Заміна може бути зроблена в CDR або в каркасній області варіабельного домену або в константному домені антитіла. Іншим типом заміни амінокислот являється виключення пар аспарагін-гліцин, які утворюють потенційні сайти дезамінування, шляхом заміни одного або більше із зазначених залишків. Ще в інших варіантах реалізації заміна амінокислоти являється консервативною заміною амінокислоти. Згідно з одним варіантом реалізації похідна антитіла містить 1, 2, 3 або 4 таких що йдуть підряд консервативних амінокислот в областях CDR важких ланцюгів у порівнянні з послідовностями амінокислот в клоні 12H3 та/або клоні 20E5. Іншим типом модифікацій антитіла до CD134 людини являється зміна вихідного характеру глікозилювання антитіла. Термін "зміна" відноситься до делеції одного або більше вуглеводних фрагментів, які виявляються в антитілі та/або до додавання одного або більше сайтів глікозилювання, які не присутні в зазначеному антитілі. Глікозильоване антитіло звичайно N-приєднане. "N-приєднане" означає приєднання вуглеводного фрагмента до бічного ланцюга залишку аспарагіну. Приклади інших модифікацій включають ацилювання, амідування, ацетилювання, поперечне зшивання, циклізацію, формілювання, гідроксилювання, йодування, метилювання, міристинування, утворення дисульфідних зв'язків, деметилювання, утворення ковалентних поперечних зшивок, утворення цистеїну, окислення, фосфорилювання, пренилювання, пегілювання, протеолітичний процесинг і сульфатації. Згідно з додатковим варіантом реалізації запропоновано похідну антитіла, яка містить антитіло до CD134, або його антиген зв'язуючий фрагмент, що описані в даній заявці, що пов'язані з додатковим молекулярним фрагментом. Приклади додаткових молекулярних фрагментів включають фармацевтичні агенти, пептиди або білки, а також агенти для детекції або мітки. Специфічні приклади фармацевтичних агентів, які можна з'єднувати з антитілом до CD134, включають цитотоксичні агенти або інші протипухлинні агенти, а також радіоактивні ізотопи. Специфічні приклади пептидів або білків, які можна з'єднувати з антитілом до CD134, включають антитіла, які можуть бути тими самими антитілами до CD134, або іншими антитілами. Специфічні приклади агентів для детекції або міток, які можна з'єднувати з 11 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 антитілами до CD134, включають (1) флуоресцентні сполуки, такі як флуоресцеїн, флуоресцеїн ізотіоцианат, фікоеритрин, родамін, 5-диметиламін-1-нафталенсульфонілу хлорид і люмінофор на основі комплексів лантанидів; (2) ферменти, такі як пероксидаза хрону, лужна фосфатаза, люцифераза і глюкозоксидаза; (3) біотин; (4) заздалегідь заданий поліпептидний епітоп, який розпізнається вторинним репортером, такий як парні послідовності лейцинової "блискавки", метал-зв'язуючі домени, епітопні мітки і сайти зв'язування для вторинних антитіл. Згідно з додатковим варіантом реалізації запропоновано похідну антитіла, яка являється мультимірною формою антитіла до CD134, такою як димери, тримери антитіл і мультиміри антитіл більш високого порядку або мономірні антитіла. Окремі мономіри в мультимірному антитілі можуть бути ідентичні або різні, тобто вони можуть бути геретомірними або гомомірними мультимірами антитіл. Мультимерізацію антитіл можна досягти за допомогою природної агрегації. Наприклад, деякий відсоток очищених препаратів антитіл (наприклад, очищені молекули IgG1) спонтанно утворюють агрегати білків, що містять гомодимери антитіл та інші мультиміри антитіл більш високого порядку. В якості альтернативи гомодимери антитіл можна сформувати за допомогою технологій хімічної сполуки, відомих в техніці. Відповідні зшиваючі засоби включають засоби, які являються гетеробіфункціональними, такими як m-малеїмідобензоіл-N-гідроксісукцинімідний ефір, N-сукцинімідил S-ацетіоацетат і сукцинімідил-4-(малеімідометил)циклогексан-1карбоксилат) або гомобіфункціональними (такими як дисукцинілімідил-суберат). Такі лінкери є у продажу. Також можна викликати мультимерізацію антитіл за допомогою технологій рекомбінантних ДНК, відомих в техніці. Згідно ще одному додатковому варіанту реалізації запропоновано похідну антитіла, яка являється химерним антитілом, що містить послідовність амінокислот антитіла до CD134 людини, описаного в даній заявці вище. Відповідно до іншого прикладу всі CDR химерного антитіла отримані з антитіл до CD134 людини. Відповідно до іншого прикладу в химерному антитілі поєднують CDR з більш ніж одним антитілом до CD134 людини.Також химерне антитіло може містити каркасні області, отримані з одного антитіла до CD134 людини і одну або більше CDR з одного або більше інших антитіл людини. Химерні антитіла можна згенерувати за допомогою стандартних способів, відомих в техніці. Згідно з деякими іншим конкретним варіантам реалізації зазначені химерні антитіла містять одну, дві або три CDR з варіабельної області важкого ланцюга або з варіабельної області легкого ланцюга антитіла, вибраного з антитіл клону 12H3 та/або клону 20E5. Приклади інших похідних антитіл, запропонованих відповідно до даного винаходу, включають одноланцюгові антитіла, діатіла, доменні антитіла, нанотіла і унітіла. Згідно з переважним варіантам реалізації зазначеними моноклональними антитілами можуть бути химерні антитіла, гуманізовані антитіла, антитіла людини, антитіла DeImmunized, одноланцюгові антитіла, фрагменти, включаючи Fab, F(ab') 2 Fv або інші фрагменти, які зберігають антиген-зв'язувальну функцію вихідного антитіла. Одноланцюгові антитіла ("ScFv") і спосіб їх отримання описаний в патенті США № 4,946,778. "Одноланцюгове антитіло" (scFv) складається з одного поліпептидного ланцюга, що містить домен VL, з'єднаний з доменом VH, причому домен VL і домен VH спаровуються, утворюючи при цьому одновалентну молекулу. Одноланцюгове антитіло можна отримати у відповідності зі способом, відомим в техніці (див., наприклад, Bird et al., (1988) Science 242:423-426 and Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). "Діатіло" складається з двох ланцюгів, причому кожен ланцюг складається з варіабельного домену важкого ланцюга, з'єднаного з варіабельним доменом легкого ланцюга на тому й самому поліпептидному ланцюзі, з'єднаного коротким пептидним лінкером, причому зазначені дві області на одному й тому самому ланцюзі не спаровуються один з одним, а спаровуються з комплементарними доменами на другому ланцюгу, утворючи біспецифічну молекулу. Способи отримання діатіл відомі в техніці (див., наприклад, Holliger P. et al., (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448 и Poljak R. J. et al., (1994) Structure 2:1121-1123). Доменні антитіла (dAb) представляють собою маленькі функціональні зв'язуючі одиниці антитіл, відповідні до варіабельним областям або важких, або легких ланцюгів антитіл. Доменні антитіла можна легко експресувати в системах на основі бактерій, дріжджів і ссавців. У техніці відома більш детальна інформація про доменні антитіла (див., наприклад, Патенти США № 6,291,158; 6,582,915; 6,593,081; WO 04/003019 і WO 03/002609). Нанотіла отримують з важких ланцюгів антитіл. Зазвичай нанотіло містить варіабельний домен і два константних домени (CH2 і CH3) і зберігає антиген-зв'язувальну здатність вихідного антитіла. Нанотіла можна отримати за допомогою способів, відомих в техніці (див., наприклад, Патенти США № 6,765,087, Патент США № 6,838,254, WO 06/079372). Унітіла складаються одного легкого ланцюга і одного важкого ланцюга антитіла IgG4. Унітіла 12 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 можна отримати шляхом видалення шарнірної області антитіл IgG4. Більш детальну інформацію про унітіла і способи їх отримання можна знайти в WO 2007/059782. Крім зв'язувального фрагменту молекули відповідно до даного винаходу можуть містити фрагмент для підвищення часу напіввиведення молекули in vivo, наприклад, без обмежень поліетиленгліколь (ПЕГ), сироватковий альбумін людини, групи глікозилювання, жирні кислоти і декстран. Такі додаткові фрагменти можна кон'югувати або поєднувати іншим чином зі зв'язувальним фрагментом, із застосуванням способів, добре відомих в техніці. Згідно з додатковим аспектом даного винаходу запропонована молекула нуклеїнової кислоти, що кодує послідовність амінокислот CD134-зв'язуювальної молекули згідно з першим аспектом даного винаходу. Послідовність амінокислот, кодована зазначеною молекулою нуклеїнової кислоти, може бути будь-якою частиною інтактного антитіла, такою як CDR, послідовністю, що містить один, два чи три CDR, або варіабельною областю важкого ланцюга або легкого ланцюга, або може бути повнорозмірним важким ланцюгом або легким ланцюгом. Згідно з деякими варіантами реалізації зазначена молекула нуклеїнової кислоти кодує послідовність амінокислот, яка містить (1) ділянку CDR3, зокрема ділянку CDR3 важкого ланцюга, антитіла клону 12H3 та/або клону 20E5; (2) варіабельну область важкого ланцюга або варіабельну область легкого ланцюга антитіла клону 12H3 та/або клону 20E5; або (3) важкий ланцюг або легкий ланцюг антитіла клону 12H3 та/або клону 20E. Згідно зіншим варіантом реалізації зазначена молекула нуклеїнової кислоти кодує поліпептид, який містить послідовність амінокислот, обрану з групи, що складається з SEQ ID №:12, 13, 14, 15, 16, 17, 18 або 19, або з групи, що складається з SEQ ID №:4, 5, 6, 7, 8, 9, 10 або 11. Молекули нуклеїнових кислот, що запропоновані в даномуі винаході, можна отримати з будь-якого джерела, який виробляє антитіло до CD134 відповідно до даного винаходу. мРНК з клітин, що виробляють антитіло до CD134, можна виділити за допомогою стандартних технологій, клонувати та/або ампліфікувати із застосуванням ПЛР і технологій конструювання бібліотек, і провести скринінг згідно до стандартних протоколів для отримання молекул нуклеїнових кислот, що кодують послідовність амінокислот антитіла до CD134. Вказану мРНК можна застосовувати для отримання кДНК для застосування полімеразної ланцюгової реакції (ПЛР) або кДНК-клонування генів антитіл. Згідно з одним варіантом реалізації молекулу нуклеїнової кислоти отримують з гібридоми, яка експресує антитіло до CD134, як описано вище, переважно гібридоми, у якої одним з партнерів по злиттю є клітина трансгенної тварини - не людини, яка експресує гени імуноглобулінів людини. Згідно з іншим варіантом реалізації зазначена гібридома отримана з нетрансгенної тварини - не людини. Молекулу нуклеїнової кислоти, що кодує важкий ланцюг антитіла до CD134, можна сконструювати шляхом об'єднання молекули нуклеїнової кислоти, що кодує варіабельну область важкого ланцюга з молекулою нуклеїнової кислоти, що кодує константну область важкого ланцюга. Аналогічним чином, молекулу нуклеїнової кислоти, що кодує легкий ланцюг антитіла до CD134, можна сконструювати шляхом об'єднання молекули нуклеїнової кислоти, що кодує варіабельну область легкого ланцюга, з молекулою нуклеїнової кислоти, що кодує константну область легкого ланцюга. Молекули нуклеїнових кислот, що кодують VH і VL ланцюги можна перетворити в гени повнорозмірного антитіла шляхом їх введення в вектори експресії, які вже кодують константні області важкого ланцюга і константні області легкого ланцюга, відповідно, так, щоб сегмент VH був функціонально зв'язаний з константною областю важкого ланцюга (CH) в межах вектора, а сегмент VL був функціонально зв'язаний з сегментом константної області легкого ланцюга (CL) в межах вектора. В якості альтернативи молекули нуклеїнових кислот, що кодують VH і VL ланцюги перетворюють в гени повнорозмірних антитіл шляхом з'єднання, тобто зшивання молекули нуклеїнової кислоти, яка кодує VH ланцюги, з молекулою нуклеїнової кислоти, що кодує VL і CL ланцюги. Того ж результату можна досягти, якщо застосовувати молекули нуклеїнових кислот, що кодують VL і CL ланцюги. Молекули нуклеїнових кислот, що кодують повнорозмірні важкі та/або легкі ланцюги, потім можна експресувати з клітки, в яку вони були введені, і можна виділяти антитіло до CD134. Молекули нуклеїнових кислот можна застосовувати для рекомбінантної експресії великих кількостей антитіл до CD134, як описано нижче. Зазначені молекули нуклеїнових кислот також можна застосовувати для отримання інших зв'язуючих молекул, запропонованих в даному винаході, таких як химерні антитіла, одноланцюгові антитіла, імуноадгезіни, діатіла, мутовані антитіла і похідні антитіл, що описані в інших розділах цієї заявки.Згідно з одним варіантом реалізації молекулу нуклеїнової кислоти застосовують в якості зонду або праймера для ПЛР для послідовностей специфічних антитіл. Наприклад, молекулу нуклеїнової кислоти - зонд можна застосовувати при реалізації способів діагностики, або молекулу нуклеїнової кислоти праймер можна застосовувати для ампліфікації областей ДНК, які можна застосовувати, серед 13 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 іншого, для виділення послідовностей нуклеотидів для застосування при отриманні варіабельних областей антитіл до CD134. Коли молекули ДНК, що кодують сегменти VH і VL антитіла до CD134 вже отримані, з вказаними молекулами ДНК можна проводити маніпуляції за допомогою технологій рекомбінантних ДНК, наприклад, перетворювати гени варіабельних областей в гени повнорозмірних ланцюгів антитіла, в гени фрагментів Fab або в ген scFv. Згідно з додатковим аспектом даного винаходу вектор, який містить молекулу нуклеїнової кислоти, описано вище в даній заявці. Зазначена молекула нуклеїнової кислоти може кодувати частину легкого ланцюга або важкого ланцюга (таку як CDR або варіабельну область), повнорозмірний легкий або важкий ланцюг, поліпептид, який містить частину або повнорозмірний важкий або легкий ланцюг, або послідовність амінокислот похідного або антигензв'язуючого фрагменту антитіла. Прикладом відповідного вектора експресії являється вектор, який кодує послідовність функціонально цілісної CH або CL імуноглобуліну, з відповідними сайтами рестрикції, сконструйованими так, щоб могла бути вставлена і експресуватися будь-яка послідовність VH або VL. Зазначений вектор експресії також може кодувати сигнальний пептид, який полегшує секрецію послідовності амінокислот ланцюга антитіла з клітиною-хазяїном. ДНК, що кодує вказану послідовність амінокислот ланцюга антитіла, можна клонувати у вектор так, щоб сигнальний пептид був пов'язаний з N-кінцем послідовності амінокислот ланцюга антитіла в одній рамці зчитування. Зазначений сигнальний пептид може бути сигнальним пептидом імуноглобуліну або гетерологічним сигнальним пептидом (тобто, сигнальним пептидом з білка не-імуноглобуліну). Крім послідовності нуклеотидів, що кодує послідовність амінокислот антитіла до CD134 (гени ланцюгів антитіла) вектори експресії несуть в собі регуляторні послідовності, які контролюють експресію зазначених генів ланцюгів антитіла. Дизайн зазначеного вектора експресії, включаючи послідовності, призначені для селекції, і регуляторні послідовності, може залежати від таких факторів, як вибір клітини-хазяїна, яку потрібно трансформувати, рівень експресії бажаного білка і так далі. Регуляторні послідовності для експресії в клітинах-хазяїнах ссавців, включають вірусні елементи, які керують експресією білка високого рівня в клітинах ссавців, такі як промотори та/або енхансери, отримані з довгих кінцевих повторів ретровірусів, цитомегаловірусу (CMV) (такі як промотор/енхансер CMV), вірусу мавп 40 (SV40) (такі як промотор/енхансер SV40), аденовірусу (наприклад, основний пізній промотор аденовірусу (AdMLP)), вірусу поліоми, і сильні промотори ссавців, такі як природні промотори імуноглобулінів і актину. Клітиною-хазяїном може бути клітина ссавців, комах, рослин, бактерій або дріжджів. Приклади відповідних ліній клітин-хазяїнів ссавців включають клітини яєчника китайського хом'ячка (CHO), клітини NSO, клітини PER-C6, клітини SP2, клітини HEK-293T, клітини NIH-3T3, клітини HeLa, клітини нирки новонародженого хом'ячка (BHK), клітини нирок африканської зеленої мавпи (COS), клітини печінково-клітинного раку людини (наприклад, Hep G2), клітини легенів людини, клітини А549 і цілий ряд інших ліній клітин. Приклади ліній клітин комах включають клітини Sf9 або Sf21. Приклади клітин рослин включають клітини тютюну звичайного, арабідопсису, мокриці, кукурудзи, пшениці, картоплі і т.д. Клітини-хазяїни бактерій включають E. coli і види Streptomyces. Приклади клітин-хазяїнів дріжджів включають Saccharomyces cerevisiae і Pichia pastoris. Послідовності амінокислот зв'язувальної молекули, що експресуються різними лініями клітин або в організмі трансгенних тварин можуть володіти різним профілем глікозилювання. Однак зв'язувальні молекули, які кодуються молекулами нуклеїнових кислот, що запропоновані у даній заявці, або містять послідовності амінокислот, що запропоновані в даній заявці, являються частиною даного винаходу, незалежно від профілю глікозилювання зазначених зв'язувальних молекул. Відповідно до іншого аспекту даного винаходу запропоновано спосіб отримання CD134зв'язуювальної молекули, згідно з визначенням, що приведено вище, за допомогою фагового відображення. Зазначений спосіб включає (a) синтезування бібліотеки антитіл людини на основі фага, (b) скринінг бібліотеки із застосуванням CD134 або його частини, (з) виділення фага, який зв'язується з CD134 або з його частиною, і (d) отримання антитіла з зазначеного фага. Один приклад способу отримання бібліотеки антитіл включає етап (a) імунізації тварини, відмінного від людини, що містить локуси імуноглобуліну людини з CD134 або з їх антигенними частинами для провокування імунної відповіді; (b) вилучення антитіл що виробляють клітини з імунізованих тварини; (c) виділення РНК, що кодує важкий і легкий ланцюги антитіл до CD134 з витягнутих клітин; (d) зворотного транскрибування зазначеної РНК з отриманням кДНК; (е) ампліфікації кДНК; і (f) вставки кДНК в вектор фагового відображення так, що зазначені антитіла 14 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 експресувалися на фагі. Рекомбінантні антитіла до CD134 людини або їх антиген-зв'язувальні фрагменти можна виділити за допомогою скринінгу в бібліотеці рекомбінантних комбінаторних антитіл. Зазначена бібліотека може бути бібліотекою фагового відображення scFv, що згенерована із застосуванням кДНК VL і VH людини, отриманих з мРНК, виділеної з Влімфоцитів. Способи отримання і скринінгу таких бібліотек відомі в техніці. Набори для генерування бібліотек відображення фага є у продажу. Відповідно до одного з переважного варіанту реалізації даного винаходу запропонована композиція, наприклад, фармацевтична композиція, що містить одну або поєднання зв'язувальних молекул, що описувані в даній заявці, і необов'язково фармацевтично прийнятну основу. Зазначені композиції можна отримати стандартними способами, відомими в техніці. Згідно з деякими варіантами реалізації зазначені композиції містять антитіло до CD134 або його антиген-зв'язувальний фрагмент. Відповідно до одного конкретного варіанту реалізації зазначена композиція містить антитіло клону 12H3 та/або клону 20E5, або антигензв'язувальний фрагмент якого-небудь з даних антитіл. Згідно з іншими варіантами реалізації зазначена композиція містить похідну антитіла клону 12H3 та/або клону 20E5. Термін "фармацевтично прийнятна основа" відноситься до будь-якої неактивної речовини, яка придатна для застосування у складі лікарської форми для доставки зв'язувальної молекули. Основою може бути антиадгезів, сполучна речовина, матеріал покриття, розпушувач, наповнювач або розчинник, консервант (такий як антиоксидант, антибактеріальний або протигрибковий агент), підсолоджувач, агент, що уповільнює всмоктування, змочувальну речовину, емульгатор, буфер і т.п. Непептидні молекули відповідно до даного винаходу можна вводити перорально, в тому числі, у складі суспензій, таблеток і подібних лікарських форм. Рідкі лікарські форми можна вводити шляхом інгаляцій ліофілізованих або розпорошених мікрокапсул. Також можна застосовувати супозиторії. Можна застосовувати додаткові фармацевтичні основи для контролювання тривалості дії молекул відповідно до даного винаходу. Дозування та режим введення для лікарської форми, яка була обрана, можна визначити за допомогою стандартних процедур, добре відомих в техніці. Такі процедури включають екстраполяцію оціночного режиму дозування з моделей, заснованих на тваринах, і наступне визначення оптимального дозування у людини в клінічних дослідженнях з підбору оптимальних доз. Зазначені композиції можуть бути в будь-якій зручній формі, такій як рідкі, напіврідкі і тверді лікарські форми. Різні лікарські форми зазначених композицій можна отримувати за допомогою стандартних технологій, відомих в техніці. Відносна кількість зв'язувальної молекули, що включається в композицію, може варіювати залежно від цілого ряду факторів, таких як бажані характеристики вивільнення, фармакодинаміки, специфічна зв'язувальна молекула і основи що застосовуються, і лікарська форма. Кількість зв'язувальної молекули в лікарській формі для одноразового введення, як правило, має бути такою, що викликає терапевтичний ефект, але може бути і меншою кількістю. Як правило, вказану кількість можна варіювати від приблизно 0,001 відсотка до приблизно 99 відсотків, від приблизно 0,1 відсотка до приблизно 70 відсотків, або від приблизно 1 відсотка до приблизно 30 відсотків від загальної маси лікарської форми. Крім зазначеної зв'язувальної молекули в композицію або в якості окремої частини в режим лікування можна включити одного або більше додаткових терапевтичних агентів. Приклади додаткових терапевтичних агентів розкриваються в даній заявці нижче. Фахівець у даній галузі техніки може без зусиль підібрати підходящу кількість додаткового терапевтичного агенту, якого потрібно включити у вказану композицію, і ним можна варіювати залежно від цілого ряду факторів, таких як застосовуваня конкретного агенту та основи, лікарська форма та бажані характеристики вивільнення та фармакодинаміки. Кількість додаткового терапевтичного агента, що включене в лікарську форму для одноразового введення, як правило, має бути таким, яке викликає терапевтичний ефект, але може бути також і меншою кількістю. Зв'язувальні молекули і фармацевтичні композиції, що містять зв'язувальну молекулу, запропоновані в даній заявці, застосовні для терапевтичних, діагностичних та інших цілей, таких як посилення імунної відповіді, лікування раку, підвищення ефективності інших протипухлинних засобів або підвищення ефективності вакцин, і володіють цілим рядом корисних властивостей, таких як застосування в якості медикаментів або діагностичних агентів. Так, згідно кращого аспекту даного винаходу запропоновані способи застосування зазначених зв'язувальних молекул або фармацевтичних композицій. Згідно з додатковим аспектом даного винаходу запропоновано спосіб модулювання опосередкованого CD134 людини протипухлинної імунної відповіді, включаючи посилення ефекторної функції Тефф людини, що експресують CD134 людини, та/або ослаблення 15 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 супресорної функції Трег людини, що експресують CD134 людини, із застосуванням зв'язуювальних молекул, які зв'язуються з CD134 людини, включаючи антитіла до CD134 людини, які (1) уникають взаємодії природного OX40L людини з рецептором CD134 людини та/або (2) не блокують сигнального шляху, опосередкованого CD134 людини, після заняття їх природним OX40L людини. Відповідно до іншого аспекту даного винаходу запропоновано спосіб модулювання опосередкованого CD134 людини протипухлинної імунної відповіді, причому зазначений спосіб не включає зв'язувальні молекули, які зв'язуються з CD134 людини, включаючи антитіла до CD134 людини, такі як імітатори, які взаємодіють зі сполучним доменом OX40L людини на рецептори CD134 людини та/або блокують сигнальні шляхи в CD134-клітинах людини з OX40L. У цьому винаході розкриваються зв'язувальні молекули, які зв'язуються з CD134 людини, включаючи антитіла до CD134 людини в цілях протипухлинної терапії. Антитіла до CD134 людини зв'язуються з позаклітинним доменом CD134 людини. Більш конкретно, антитіла до CD134 людини зв'язуються з областями, що не пов'язують OX40L (тобто, зазначені антитіла до CD134 людини не повністю блокують зв'язування OX40L з CD134 людини) на позаклітинному домені CD134 людини на активованих Еефa і Трег людини. Згідно одному конкретному аспекту запропоновано способи посилення імунної відповіді у ссавців, що включають введення вказаному ссавцю терапевтично ефективної кількості зв'язувальної молекули, описаної в даній заявці. Згідно з деякими варіантами реалізації зазначеною зв'язувальною молекулою є антитіло до CD134 або його антиген-зв'язувальний фрагмент, а вказаний ссавець являється людиною. Згідно з додатковим варіантом реалізації зазначена зв'язувальна молекула являється антитілом клону 12H3 та/або клону 20E5, або антиген-зв'язувальним фрагментом будь-якого з зазначених антитіл. Термін "посилення імунної відповіді" означає стимулювання, провокування, збільшення, посилення або підвищення будьякої відповіді імунної системи ссавця. Імунна відповідь може бути клітинною відповіддю (тобто, клітинно-опосередкованою, наприклад, опосередкованою цитотоксичними Т-лімфоцитами) або гуморальною відповіддю (тобто, відповіддю, опосередкованою антитілами) і може бути первинною або вторинною відповіддю. Приклади посилення імунної відповіді включають підвищення активності CD4+-Т-хелперів і генерування цитотоксичних Т-лімфоцитів. Посилення імунної відповіді можна оцінювати за цілою низкою показників in vitro або in vivo, що відомі фахівцям у даній галузі техніки, включаючи, але без обмежень, проби на цитотоксичні Тлімфоцити, виділення цитокінів (наприклад, вироблення IL-2), регресія пухлин, виживання тварин з пухлинами, вироблення антитіл, проліферація імунних клітин, експресія поверхневих маркерів клітин і цитотоксичність. Згідно з одним варіантом реалізації зазначений спосіб призводить до посилення клітинної імунної відповіді, зокрема відповіді цитотоксичних Тлімфоцитів. Відповідно до одного аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, причому при насичуючій концентрації зазначеної зв'язувальної молекули або вище, дія на зв'язування OX40L з CD134 знижується не більше ніж на 70 %, на клітинах, що експресують CD134 людини, що вимірюють за допомогою заснованого на флуоресценції проточно-цитометричного аналізу, описаного в Прикладі 2(f). Більш переважно, дія на зв'язування OX40L з CD134 знижується, але не більше ніж приблизно на 60 %, або приблизно 50 %, або приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше, або, переважно зменшення зв'язування взагалі не відбувається. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, причому при концентрації 70 нмоль зазначеної зв'язувальної молекули дія на зв'язування OX40L з CD134 знижується не більше ніж на 70 %, на клітинах, що експресують CD134 людини, що вимірюють за допомогою заснованого на флуоресценції проточно-цитометричного аналізу, описаного в Прикладі 2(f). Більш переважно, дія на зв'язування OX40L з CD134 знижується, але не більше ніж приблизно на 60 %, або приблизно 50 %, або приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше, або, переважно зменшення зв'язування взагалі не відбувається. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка конкурує за зв'язування з CD134 людини з антитілом, що містить (1) варіабельну область важкого ланцюга, що містить послідовність амінокислот SEQ ID №:12 і (2) варіабельну область легкого ланцюга, що містить послідовність амінокислот SEQ ID №:13, на що вказує перехресне конкурування між неміченою зазначеною зв'язувальною молекулою і вказаним антитілом з флуоресцентною міткою на PHA-стимульованих експресуючих CD134 людини Т-лімфоцитах, що вимірюють за допомогою проточної цитометрії (більш докладно описаної в Прикладі 2(e)). Переважно, зв'язування зазначеного антитіла при насичуючій концентрації або вище 16 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 знижується щонайменше приблизно на 50 %, або приблизно на 60 %, або приблизно на 70 %, або приблизно на 80 %, або приблизно на 90 % або більше, і переважно скасовується, коли проводять аналіз перехресного конкурування з вказаною зв'язувальною молекулою. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка конкурує за зв'язування з CD134 людини з антитілом, що містить (1) варіабельну область важкого ланцюга, що містить послідовність амінокислот SEQ ID №:4 і (2) варіабельну область легкого ланцюга, що містить послідовність амінокислот SEQ ID №:5, на що вказує перехресне конкурування між неміченою зазначеною зв'язувальною молекулою і вказаним антитілом з флуоресцентною міткою на PHA-стимульованих експресованих CD134 людини Т-лімфоцитах, що вимірюють за допомогою проточної цитометрії (більш докладно описаної в Прикладі 2(e)). Переважно, зв'язування зазначеного антитіла при насичуючій концентрації або вище знижується щонайменше приблизно на 50 %, або приблизно на 60 %, або приблизно на 70 %, або приблизно на 80 %, або приблизно на 90 % або більше, і переважно скасовується, коли проводять аналіз перехресного конкурування з вказаною зв'язувальною молекулою. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, причому дія на зв'язування OX40L з CD134 на клітинах, що експресують CD134 людини, зменшується не більше ніж приблизно на 70 %, або приблизно на 60 %, або приблизно 50 %, або приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше, причому зазначена зв'язувальна молекула також не перешкоджає імуностимулюючій та/або проліферативній відповіді OX40L в ефекторних Т-клітинах, що експресують CD134 людини. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, зазначена причому зв'язувальна молекула не перешкоджає зв'язуванню рецептору CD134 людини (OX40) з лігандом OX40L, і причому зазначена зв'язувальна молекула також не перешкоджає імуностимулюючій та/або проліферативній відповіді OX40L в ефекторних Т-клітинах, що експресують CD134 людини. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, причому дія на зв'язування OX40L з CD134 на Т-лімфоцитах, що експресують CD134 людини, зменшується не більше ніж приблизно на 70 %, або приблизно на 60 %, або приблизно 50 %, або приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше, і причому зазначена зв'язувальна молекула підсилює імуностимулюючу та/або проліферативну відповідь OX40L в ефекторних Т-клітинах, що експресують CD134 людини. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула яка зв'язується з CD134 людини, причому зазначена зв'язувальна молекула не перешкоджає зв'язуванню рецептору CD134 людини (OX40) з лігандом OX40L, і причому зазначена зв'язувальна молекула підсилює імуностимулюючу та/або проліферативну відповідь OX40L в ефекторних Т-клітинах, що експресують CD134 людини. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, причому дія на зв'язування OX40L з CD134 на Т-лімфоцитах, що експресують CD134 людини, зменшується не більше ніж приблизно на 70 %, або приблизно на 60 %, або приблизно 50 %, або приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше, і причому зазначена зв'язувальна молекула також не перешкоджає реакціям, пов'язаним з супресорною функцією, регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, причому зазначена зв'язувальна молекула не перешкоджає зв'язуванню рецептору CD134 людини (OX40) з лігандом OX40 (OX40L), і причому зазначена зв'язувальна молекула також не перешкоджає реакціям, пов'язаним з супресорною функцією, регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, причому дія на зв'язування OX40L з CD134 на Т-лімфоцитах, що експресують CD134 людини, зменшується не більше ніж приблизно на 70 %, або приблизно на 60 %, або приблизно 50 %, або приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше, і причому зазначена зв'язувальна молекула підсилює реакції, пов'язані з супресорною функцією, регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, причому зазначена зв'язувальна молекула не перешкоджає зв'язуванню рецептору CD134 людини (OX40) з лігандом OX40 (OX40L), і причому зазначена зв'язувальна молекула підсилює реакції, пов'язані з супресорною функцією, регуляторних Тклітин, що експресують CD134 людини, на OX40L людини. 17 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, причому дія на зв'язування OX40L з CD134 на Т-лімфоцитах, що експресують CD134 людини, зменшується не більше ніж приблизно на 70 %, або приблизно на 60 %, або приблизно 50 %, або приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше, і причому зазначена зв'язувальна молекула також не перешкоджає проліферативним реакціям, регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, причому зазначена зв'язувальна молекула не пригнічує і не перешкоджає зв'язуванню рецептора CD134 людини (OX40) з лігандом OX40 (OX40L), і причому зазначена зв'язувальна молекула також не перешкоджає проліферативним реакціям регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула яка зв'язується з CD134 людини, причому дія на зв'язування OX40L з CD134 на Т-лімфоцитах, що експресують CD134 людини, зменшується не більше ніж приблизно на 70 %, або приблизно на 60 %, або приблизно 50 %, або приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше, і причому зазначена зв'язувальна молекула пригнічує проліферативні реакції регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини. Відповідно до іншого аспекту даного винаходу запропонована зв'язувальна молекула, яка зв'язується з CD134 людини, причому зазначена зв'язувальна молекула не пригнічує і не перешкоджає зв'язуванню рецептору CD134 людини (OX40) з лігандом OX40 (OX40L), і причому зазначена зв'язувальна молекула пригнічує проліферативні реакції регуляторних Т-клітин, що експресують CD134 людини, на OX40L людини. Нижче описаний відповідний спосіб вимірювання одночасного зв'язування OX40L і антитіла до CD134 людини. Флуоресцентний сигнал FITC (середнє геометричне або середня інтенсивність флуоресценції (MFI)) зв'язування OX40L на PHA-стимульованих PBMC (мононуклеарних клітин периферичної крові), що експресують CD134, у відсутності антитіла до CD134 людини, приймають за 100 %. Флуоресцентний сигнал PE (MFI) антитіла до CD134 людини, що зв'язується з PHA-стимульованими PBMC, експресуючими CD134, у відсутності OX40L людини приймають за 100 %. Зменшення зазначеного флуоресцентного сигналу FITC і флуоресцентного сигналу PE, коли і OX40L людини, і антитіло до CD134 людини додають одночасно до PHA-стимульованим PBMC, експресуючих CD134 людини, переважно не повинно перевищувати приблизно 70 %, або приблизно на 60 %, або приблизно 50 %, або приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше. Нижче описаний відповідний спосіб вимірювання відсутності перешкоджання OX40Lопосредковані проліферативним реакціям Тефф. Включення міченого тритієм тимідину або BrdU в Тефф, експресуючі CD134 людини, після обробки OX40L людини приймають за 100 %. Зміна (тобто, спад або наростання) такого включення міченого тритієм тимідину або BrdU, коли і OX40L людини, і антитіло до CD134 людини одночасно додають до активованих (наприклад, PHA-стимульованим або стимульованим гранулами з антитілами до CD3/CD28) Тефф, експресуючих CD134 людини, переважно не повинно перевищувати приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше. Нижче описаний відповідний спосіб вимірювання посилення OX40L-опосередкованих проліферативних реакцій Tефф. Включення міченого тритієм тимідину або BrdU в Тефф, що експресують CD134 людини, після обробки OX40L людини приймають за 100 %. Посилення такого включення міченого тритієм тимідину або BrdU, коли і OX40L людини, і антитіло до CD134 людини одночасно додають до активованих (наприклад, PHA-стимульованим або стимульованим гранулами анти-CD3/CD28) Тефф, експресуючих CD134 людини, переважно перевищує приблизно 30 %, або приблизно 40 %, або приблизно 50 %, або приблизно 60 %, або приблизно 70 % або більше. Нижче описаний відповідний спосіб вимірювання відсутності перешкоджання OX40Lопосередкованою супресорною функцією Трег. Включення міченого тритієм тимідину або BrdU в Еефф, що експресують CD134 людини, які культивують спільно з Еефф, експресуючими CD134 людини (наприклад, співвідношення Тефф/Трег = 1:1), після обробки OX40L людини приймають за 100 %. Зміна (тобто, спад або наростання) такого включення міченого тритієм тимідину або BrdU, коли і OX40L людини, і антитіло до CD134 людини одночасно додають до активованих (наприклад, PHA-стимульованим або стимульованим гранулами анти-CD3/CD28) Тефф, експресуючих CD134 людини, які культивують спільно з Тефф, експресуючими СВ134 людини (наприклад, співвідношення Тефф/Трег = 1:1) переважно не повинно перевищувати приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше. 18 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 Нижче описаний відповідний спосіб вимірювання посилення OX40L-опосередкованою супресорною функцією Трег. Включення міченого тритієм тимідину або BrdU в Еефф, експресуючими CD134 людини, які культивують спільно з Еефф, експресуючими CD134 людини (наприклад, співвідношення Тефф/Трег = 1:1), після обробки OX40L людини приймають за 100 %. Посилення такого включення міченого тритієм тимідину або BrdU, коли і OX40L людини, і антитіло до CD134 людини одночасно додають до активованих (наприклад, PHAстимульованим або стимульованим гранулами з анти-CD3/CD28) Тефф, експресуючих CD134 людини, які культивують спільно з Тефф, експресуючими СВ134 людини (наприклад, співвідношення Тефф/Трег = 1:1) переважно перевищує приблизно 30 %, або приблизно 40 %, або приблизно 50 %, або приблизно 60 %, або приблизно 70 % або більше. Нижче описаний відповідний спосіб вимірювання відсутності перешкоджання OX40Lопосередкованою проліферативним реакціям Трег. Включення міченого тритієм тимідину або BrdU в Трег, експресуючими CD134 людини, після обробки OX40L людини приймають за 100 %. Зміна (тобто, спад або наростання) такого включення міченого тритієм тимідину або BrdU, коли і OX40L людини, і антитіло до CD134 людини одночасно додають до активованих (наприклад, PHA-стимульованим або стимульованим гранулами анти-CD3/CD28) Трег, експресуючих CD134 людини, переважно не перевищує приблизно 30 %, або приблизно 20 %, або приблизно 10 % або менше. Нижче описаний відповідний спосіб вимірювання придушення OX40L- опосередкованих проліферативних реакцій Трег. Включення міченого тритієм тимідину або BrdU в Трег, експресуючими CD134 людини, після обробки OX40L людини приймають за 100 %. Зменшення такого включення міченого тритієм тимідину або BrdU, коли і OX40L людини, і антитіло до CD134 людини одночасно додають до активованих (наприклад, PHA-стимульованим або стимульованим гранулами анти-CD3/D28) Трег, експресуючих CD134 людини, переважно перевищує приблизно 30 %, або приблизно 40 %, або приблизно 50 %, або приблизно 60 %, або приблизно 70 % або більше. Згідно ще одному аспекту даного винаходу запропоновано спосіб лікування раку у ссавців, що включає введення вказаному ссавцю терапевтично ефективної кількості зв'язувальної молекули, що описана в даній заявці. Згідно ще одному кращому варіанту реалізації даного винаходу зазначена зв'язувальна молекула являється антитілом клону 12H3 та/або клону 20E5, або антиген-зв'язувальним фрагментом одного будь-якого із зазначених антитіл. Згідно з додатковим варіантом реалізації вказаний ссавець являється людиною. Відповідно до іншого кращого варіанту реалізації даного винаходу запропоновано спосіб профілактики раку у ссавців, що включає введення вказаному ссавцю терапевтично ефективної кількості зв'язувальної молекули, що описана в даній заявці. Термін "попередження раку" або "профілактика раку" відноситься до уповільнення, придушення або попередження початку раку у ссавця, у якого початок онкогенезу або розвитку пухлини не має явно вираженого характеру, але визначається схильність до раку або, наприклад, за допомогою генетичного скринінгу, або іншим шляхом. Також даний термін включає лікування ссавця, який страждає передраковим захворюванням з метою припинення прогресування передракового захворювання з його переходом в рак, або сприяння його регресії. Приклади передракового захворювання включають гіперплазію, дисплазію і метаплазію. Згідно з деякими варіантами реалізації зазначена зв'язувальна молекула являється антитілом до CD134 або його фрагментом, що описано в даній заявці. Згідно з додатковим варіантом реалізації даного винаходу запропонована зв'язувальна молекула, яку вибирають з антитіла клону 12H3 та/або клону 20E5, або антиген-зв'язувального фрагмента будь-якого із зазначених антитіл. Згідно з додатковим варіантом реалізації вказаний ссавець являється людиною. За допомогою способу згідно з винаходом можна лікувати різні типи пухлин, включаючи злоякісні чи доброякісні та/або первинні або вторинні. Приклади таких типів раку відомі фахівцям в даній області техніки і перераховані в стандартних довідниках, таких як Merck Manual of DiagnosisAnd Therapy (опублікований компанією "Merck"). Згідно з іншим варіантом реалізації даного винаходу зазначені зв'язувальні молекули можна вводити самостійно в якості монотерапії, або вводити у поєднанні з одним або більше додатковими терапевтичними агентами або засобами. Так, згідно ще одному варіанту реалізації запропоновано спосіб лікування або профілактики раку за допомогою комбінованої терапії, причому вказаний спосіб включає введення зв'язувальної молекули, що розкривається в даній заявці, в поєднанні з одним або більше додатковими засобами або терапевтичними агентами. Термін "додатковий засіб" відноситься до засобу, який не включає зв'язувальну молекулу, 19 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 запропоновану в розкритті, як терапевтичного агента. Термін "додатковий терапевтичний агент" відноситься до будь-якого терапевтичного агента, відмінного від зв'язувальної молекули, запропонованій в даній заявці. Згідно з деякими варіантами реалізації зазначена зв'язувальна молекула являється антитілом до CD134 людини клону 12H3 та/або клону 20E5, або антигензв'язувальним фрагментом будь-якого із зазначених антитіл. Згідно одному конкретному аспекту даного розкриття запропоновано комбінована терапія для лікування раку у ссавця, яка включає введення вказаному ссавцю терапевтично ефективної кількості зв'язувальної молекули, запропонованої в даній заявці, в поєднанні з одним або більше терапевтичними агентами. Згідно з додатковим варіантом реалізації вказаний ссавець являється людиною. У поєднанні зі зв'язувальною молекулою можна застосовувати найрізноманітніші протипухлинні агенти. Фахівець у даній галузі техніки здатний уявити наявність і розробку інших протипухлинних засобів, які можна застосовувати в поєднанні зі способами і зв'язувальними молекулами згідно з даним винаходом і не повинен обмежуватися тими формами терапії, які вказані в даній заявці. Приклади категорій додаткових терапевтичних агентів, які можна застосовувати в комплексній терапії при лікуванні раку, включають: (1) хіміотерапевтичні агенти, (2) імунотерапевтичні агенти і (3) агенти гормональної терапії. Термін "хіміотерапевтичний агент" відноситься до хімічної або біологічної речовини, яка може викликати загибель ракових клітин, або перешкоджати поділу, відновленню, зростанню та/або функції ракових клітин. Приклади хіміотерапевтичних агентів включають агенти, що розкриваються в WO 2006/088639, WO 2006/129163 і US 2,006,015,3808, розкриття яких включено в дану заявку за допомогою посилання. Термін "імунотерапевничний агент" відноситься до хімічної або біологічної речовини, який посилює імунну відповідь ссавця. Приклади імунотерапевтичних агентів включають: бацили Кальметта-Герена (BCG); цитокіни, такі як інтерферони; вакцини, такі як персоналізована імунотерапія MyVax, Onyvax-P, онкофаг, GRNVACl, Favld, Провеген, GVAX, Ловаксин C, BiovaxID, GMXX і NeuVax; і такі антитіла як алемтузумаб (КАМПАТ), бевацизумаб (АВАСТИН), цетуксимаб (ЕРБІТУКС), гемтузумаб озогаміцин (МІЛОТАРГ), ібрітумомаб тіуксетан (ЗЕВАЛІН), панітумумаб (ВЕКТІБІКС), рітуксимаб (РІТУКСАН, МАБТЕРА), транстузумаб (ГЕРЦЕПТИН), тозітумомаб (БЕККСАР), тремелімумаб, CAT-3888 і антагоністичні антитіла до рецепторів CD40, які розкриваються в WO 2003/040170. Термін "агент для гормональної терапії" відноситься до хімічної або біологічної речовини, яка інгібує або виключає вироблення гормону, або інгібує або нейтралізує дію гормону на ріст та/або виживання ракових клітин. Приклади таких агентів, відповідних для реалізації способів згідно з цією заявкою, включають агенти, які розкриваються в US 20070117809. Приклади конкретних агентів для гормональної терапії включають тамоксифен (НОЛВАДЕКС), тореміфен (ФАРЕСТОН), фулвестран (ФАСЛОДЕКС), анастрозол (АРИМІДЕКС), екземестран (АРОМАЗІН), летрозол (ФЕМАРА), мегестрола ацетат (МЕГЕЙК), госелерін (ЗОЛАДЕКС) і лейпролід (ЛЮПРОН). Зв'язувальні молекули згідно з цим розкриттям можна також застосовувати в поєднанні з нелікарським гормональними засобами, такими як (1) хірургічні способи, які спрямовані на видалення частини органів або залоз, які беруть участь у виробленні гормону, таких як яєчники, яєчка, надниркові залози і гіпофіз, і (2) променева терапія, при якій органи або залози пацієнта піддають опроміненню в кількості, достатній для інгібування або усунення вироблення цільового гормону. Згідно з іншим варіантом реалізації даного винаходу запропоновано спосіб лікування або профілактики раку за допомогою комбінованої терапії, причому вказаний спосіб включає введення зв'язувальної молекули, що розкривається в даній заявці, і операцію з видалення пухлини. Вказану зв'язувальну молекулу можна вводити ссавцю перед, під час або після зазначеної операції. Комбінована терапія, що спрямована на лікування раку, також включає поєднання зв'язувальної молекули, запропонованої в даній заявці, з променевою терапією, такою як іонізуюча (електромагнітна) променева терапія (наприклад, рентгенівське або гамавипромінювання) і променева терапія пучком частинок (наприклад, випромінювання з високою лінійною передачею енергії). Джерело випромінювання може бути зовнішнім або внутрішнім по відношенню до організму ссавця. Вказану зв'язувальну молекулу можна вводити ссавцю перед, під час або після зазначеної променевої терапії. Зв'язувальні молекули і композиції, запропоновані в даній заявці, можна вводити будь-яким підходящим ентеральним або парентеральним шляхом введення. Термін "ентеральний шлях" введення має на увазі введення через будь-яку частину шлунково-кишкового тракту. Приклади ентерального шляху введення включають оральне введення через слизові оболонки, букальний і ректальний шлях, або внутрішньошлунковий шлях. Термін "парентеральний шлях" шлях 20 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 введення що відноситься до шляху введення, відмінному від ентерального. Відповідний шлях і спосіб введення може варіювати залежно від цілого ряду факторів, таких як специфічне антитіло, яке застосовують, бажана швидкість всмоктування, специфічна лікарська форма або форма дозування, яку застосовують, тип або тяжкість розладу, який лікують, специфічну ділянку дії і стан пацієнта, і фахівець в даній області техніки може легко підібрати такий спосіб. Термін "терапевтично ефективна кількість" зв'язувальної молекули відноситься до кількості, яка є ефективною для призначеної терапевтичної мети. Наприклад, в контексті посилення імунної відповіді "терапевтично ефективною кількістю" є будь-яка кількість, яка ефективно стимулює, провокує, збільшує, підвищує або сприяє будь-якій відповіді імунної системи ссавця. У контексті лікування раку "терапевтично ефективною кількістю" є будь-яка кількість, якої досить, щоб викликати будь-яку бажану чи корисну дію у ссавця, яку лікують, наприклад, придушення подальшого зростання або розповсюдження ракових клітин, загибель ракових клітин, придушення рецидиву раку, зменшення болю, пов'язаною з раком, або підвищення виживання ссавця. Згідно способу профілактики раку "терапевтично ефективною кількістю" являється будь-яка кількість, яка є ефективною для уповільнення, придушення або попередження початку раку у ссавця, якому вводять вказану зв'язувальну молекулу. Терапевтично ефективна кількість зв'язувальної молекули звичайно варіює в діапазоні від приблизно 0,001 до приблизно 500 мг/кг і більше, зазвичай від приблизно 0,05 до приблизно 100 мг/кг маси тіла зазначеного ссавця. Наприклад, вказана кількість може становити приблизно 0,3 мг/кг, 1 мг/кг, 5 мг/кг, 5 мг/кг, 10 мг/кг, 50 мг/кг або 100 мг/кг від маси тіла зазначеного ссавця. Згідно з деякими варіантами реалізації терапевтично ефективна кількість антитіла до CD134 людини варіює в діапазоні від 0,1 до 30 мг/кг від маси тіла ссавця. Фахівець у даній галузі техніки може легко підібрати точний рівень доз, який потрібно вводити, і такий рівень буде залежати від цілого ряду факторів, таких як тип або тяжкість розладу, який лікують, від конкретної застосовуваної зв'язувальної молекули, шляху введення, часу введення, тривалості лікування, конкретних застосовуваних додаткових засобів, віку, статі, патологічного стану, загального стану здоров'я і анамнезу пацієнта, якого потрібно лікувати, і подібних факторів, добре відомих в техніці. Зв'язувальну молекулу або композицію зазвичай вводять в декілька етапів. Інтервали між однократними дозами можуть складати, наприклад, раз на тиждень, раз на місяць, кожні три місяці або раз на рік. Приклади режимів лікування включають введення раз на тиждень, раз на два тижні, раз на три тижні, раз на чотири тижні, раз на місяць, раз в 3 місяці або раз на 3 або 6 місяців. Звичайні режими дозування для антитіла до CD134 людини включають 1 мг/кг від маси тіла або 3 мг/кг від маси тіла внутрішньовенно, із застосуванням одного з наступних графіків дозування: (i) шість доз раз на чотири тижні, потім раз на три місяці; (ii) раз на три тижні; (iii) 3 мг/кг від маси тіла один раз, потім 1 мг/кг від маси тіла раз на три тижні. Даний винахід додатково проілюстровано такими прикладами, які не призначені, щоб будьяким чином обмежити область даного винаходу. Навпаки, має бути ясно, що є місце для різних інших варіантів реалізації, модифікацій і еквівалентів, які після прочитання опису в даній заявці, можуть уявити собі фахівці в даній галузі техніки, не відхиляючись від духу даного винаходу та/або області формули винаходу. Приклади Приклад 1. Генерування моноклональних антитіл миші до CD134 людини (=OX40) (а). Генерування клітин комах Sf9, що експресують CD134 на своїй поверхні кДНК, що кодує білок CD134 людини (GenBank, ідентифікаданійний номер CAB96543.1; див. SEQ ID № 1) оптимізували для експресії в клітинах комах Sf9 (Spodotera frugiperda) і синтезували за допомогою GENEART, Регенсбург, Німеччина (див. SEQ ID № 2). Вказану кДНК субклонували в плазміду переносу на основі бакуловірусів pVL1393 (набір для трансфекції, кат. Номер 560129; "BD Biosciences"). Потім клітини комах Sf9 (ATCC) піддавали спільній трансфекції з плазмідою переносу pVL1393, що містить кДНК, що кодує CD134 людини, разом з ДНК бакуловірусів BaculoGold (набір для трансфекції BD), а потім інкубували при температурі 27º C протягом 4-5 днів. Після зазначеного етапу спільної трансфекції надосадову рідину відбирали і зберігали при температурі 4° C, і застосовували її для інфікування наступних клітин комах Sf9 для ампліфікації вірусу. Для даної мети клітки комах Sf9 трансфікували ампліфікованим рекомбінантним бакуловірусом, а потім інкубували при температурі 27º C протягом 3-5 днів. Зазначені клітки комах Sf9 відбирали, промивали стерильним ФСБ 6 (фосфатно-сольовим буфером), відбирали аліквоти 5 × 10 кліток/250 мкл в ФСБ і зберігали при температурі -80° C з метою отримання лізатів клітин. Перед зберіганням експресію CD134 людини на поверхні кліток комах Sf9 підтверджували із застосуванням кон'югованого з 21 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 фікоеритрину (PE) антитіла миші (1:10) до CD134 людини (клон ACT35; "BDBiosciences") і проточної цитометрії. (b). Імунізація та генерування моноклональних антитіл миші до CD134 людини Мишам BALB/c (самки, вік 6 тижнів; "Charles River Laboratories") підшкірно вводили ≈ 400 мкл лізату клітин комах Sf9, трансфікованих CD134 людини (аліквоту лізату клітин 250 мкл + 250 мкл повного ад'юванту Фрейнда; "Sigma") в День 0. Аналогічні підшкірні ін'єкції з введенням лізатів клітин комах Sf9, трансфікованих CD134 людини, і неповного ад'юванту Фрейнда ("Sigma") проводили в День 21 і День 42. У День 61 і День 62 проводили внутрішньочеревне введення бустер-дози лізатів клітин комах Sf9, трансфікованих CD134 людини, (250 мкл/миша) без ад'юванту. У День 65 спленоцити, що отримані від імунізованих мишей, об'єднували з клітинами мієломи SP 2/0 (ATCC) із застосуванням стандартної технології гібридоми, спочатку описаної Köhler and Milstein (Nature 1975; 256: p 495-497). Гібридоми, які виробляли антитіла (клас IgG миші) до CD134 людини (проводили скринінг за допомогою стандартного ELISA і проточної цитометрії із застосуванням гібридного білка рекомбінантної CD134 людини: Fcγ людини ("R&D Systems"), і бластні CD4 Т-лімфоцити, стимульовані PHA ("Roche") і експресуючі CD134 людини (див. Приклад 2 нижче) в якості мішеней, відповідно, вирощували, кріоконсервували і клонували шляхом граничного розведення. Специфічні моноклональні антитіла до CD134 людини очищали за допомогою колонок з білком G ("GE Healthcare"), і отримували в організмі миші моноклональні антитіла до CD134 людини-клон 12H3 (антитіло миші-ізотип IgG1κ; визначали за допомогою набору визначення изотипу моноклональних антитіл миші IsoStrip компанії "Roche") і клон 20E5 (антитіло миші-ізотип IgG1κ; те ж саме). Приклад 2. Опис властивостей моноклональних антитіл миші до CD134 людини-клонів 12H3 і 20E5 за допомогою проточної цитометрії (a) Експресія CD134 на Т-лімфоцитах людини, стимульованих PHA Мононуклеарні клітини периферичної крові людини (PBMC), що отримані від здорових донорів (за інформованою згодою), виділяли за допомогою центрифугування в градієнті 6 щільності на Lymphoprep (1.077 г/мл; "Nycomed"). Потім до 1-2 × 10 PBMC/мл у живильному середовищі RPMI-1640 ("Gibco") що містить 10 % фетальної сироватки телят ("Bodinco") і 50 мкг/мл гентаміцину ("Gibco") додавали 0, 0,1, 1,0 або 10,0 мкг/мл фітогемаглютиніну-М (PHA-M; "Roche") і інкубували при температурі 37° C/5 % CO2 протягом 1-3 днів. Після культивування 6 PBMC відбирали і поміщали при щільності 1-2 × 10 клітин/мл в охолоджений льодом фосфатно-сольовий буфер, що містить 0,1 % бичачого сироваткового альбуміну ("Sigma")/0,05 % NaN3 (PBS/BSA/NaN3) з додаванням 10 % змішаної сироватки людей (HPS; блокування рецепторів Fcγ; "BioWhittaker"). Клітини інкубували з 10 мкг/мл комерційного антитіла миші до CD134 людини-клон ACT35 (антитіло миші, ізотип IgG1; "BD Biosciences »,Альпен-аан-ден-Рійн, Голландія) протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини додатково інкубували з розведеними 1:200 PEкон'югованими антитілами кози до IgG миші ("Jackson ImmunoResearch") протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини інкубували з розведеними 1:20 антитілами миші до CD3 людини, кон'югованими з флуоресцеїну ізотіоціанатом (FITC) ("BD Biosciences") з метою виявлення Т-лімфоцитів протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА NaN 3 клітини фіксували в 2 % формальдегіді в ФСБ/БСА/NaN3 протягом 30 хвилин при температурі 4° C. Зв'язування антитіл вимірювали за допомогою проточної цитометрії (FACSCalibur; "BD Biosciences"). Як показано на фігурі 1 (n=1 від кожного донора), Т-лімфоцити людини, що отримані з периферичної крові, не стимульовані/в стані спокою, що не експресують ніяких CD134, однак + CD3 T-лімфоцити людини, стимульовані PHA, експресують на своїй поверхні CD134 із + залежністю від дози.При впливі 10 мкг / мл PHA рівень експресії CD134 на активованих CD3 Tлімфоцитах людини, мабуть, досягає плато в проміжку між "днем 1" і "днем 2", проте відсоток + + CD134 /CD3 T-лімфоцитів людини збільшується із залежністю від часу під час експерименту. (b). Експресія CD134 на субпопуляції CD4 Т-лімфоцитах людини, стимульованих PHA Генерували PHA-стимульовані (в концентрації 0 і 10 мкг/мл протягом 1 дня; див. вище) Tлімфоцити, що експресують CD134 людини. Клітини відбирали і поміщали при щільності 1-2 × 6 10 клітин/мл в охолоджений льодом ФСБ/БСА/NaN3 з додаванням 10 % HPS (блокування рецепторівFcγ; "BioWhittaker"). Клітини інкубували з розведеними 1:10 FITC-кон'югованими антитілами миші до CD4 ("BD Biosciences") або з розведеними 1:10 FITC-кон'югованими антитілами миші до CD8 ("BD Biosciences") у поєднанні з розведеними 1:10 комерційними PEкон'югованими антитілами миші до CD134 людини-клон ACT35 ("BD Biosciences") протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN 3 клітини фіксували в 22 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 2 % формальдегіді в ФСБ/БСА/NaN3 протягом 30 хвилин при температурі 4° C. Зв'язування антитіл вимірювали за допомогою проточної цитометрії (FACSCalibur; "BD Biosciences"). + Як показано на фігурі 2, експресія CD134 спостерігалася на стимульованих PHA CD4 T+ лімфоцитах людини, але не на спочиваючих CD4 T-лімфоцитах людини. На PHA-активованих + CD 8 T-лімфоцитах людини був показаний низький рівень експресії CD134, і ніякої експресії + CD134 не спостерігалося на спочиваючих CD8 T-лімфоцитах людини. (c). Зв'язування моноклональних антитіл миші до CD134 людини клонів 12H3 і 20E5 на PHAстимульованих T-лімфоцитах, що експресують CD134 людини. Генерували PHA-стимульовані (в концентрації 10 мкг/мл протягом 2 днів; див. вище) Tлімфоцити, що експресують CD134 людини. Клітини відбирали і поміщали при щільності 1-2 × 6 10 клітин/мл в охолоджений льодом ФСБ/БСА/NaN3 з додаванням 10 % HPS (блокування рецепторів Fcγ; "BioWhittaker"). Клітини інкубували з 0, 0,007, 0,02, 0,07, 0,2, 0,6, 1,9, 5,6, 16,7, 50,0 мкг/мл комерційного антитіла миші до CD134 людини-клону ACT35 (антитіло миші-ізотип IgG1; "BD Biosciences") і самостійно згенерованого антитіла миші до CD134 людини-клону 12H3 або клону 20E5 - протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини додатково інкубували з розведеними 1:200 PE-кон'югованими антитілами кози до IgG миші ("Jackson ImmunoResearch") протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини інкубували з розведеними 1:20 FITCкон'югованими антитілами миші до CD3 людини ("BD Biosciences") для виявлення T-лімфоцитів протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини фіксували в 2 % формальдегіді в ФСБ/БСА/NaN3 протягом 30 хвилин при температурі 4° C. Зв'язування антитіл вимірювали за допомогою проточної цитометрії (FACSCalibur; "BD Biosciences"). Як показано на фігурі 3 (середнє значення ± SD; результати, отримані для двох донорів), антитіла миші до CD134 людини клону ACT35, клону 12H3 і клону 20H5 насичували молекули CD134 людини на поверхні PHA-стимульованих CD3+T-лімфоцитах приблизно при 5,0-10,0 мкг/мл. На підставі даних для зазначених двох донорів половина максимального зв'язування спостерігалася при ≈ 0,5 мкг/мл для антитіла миші до CD134 людини клону 12Н3 і при ≈ 2,5 мкг/мл для антитіла миші до CD134 людини клону ACT35 і клону 20E5. (d). Зв'язування моноклональних антитіл миші до CD134 людини клонів 12H3 і 20E5 на PHA+ + стимульованих CD4 і CD8 T-лімфоцитах, що експресують CD134 людини. Генерували PHA-стимульовані (у концентрації 2 0 мкг/мл протягом 1 дня; див. вище) Tлімфоцити, що експресують CD134 людини. Клітини відбирали і поміщали при щільності 1-2 × 6 10 клітин/мл в охолоджений льодом ФСБ/БСА/NaN3 з додаванням 10 % HPS (блокування рецепторівFcγ; "BioWhittaker"). Клітини інкубували з 20,0 мкг/мл з контрольним антитілом миші ізотипу IgG1κ ("BD Biosciences") або з 20,0 мкг/мл моноклонального антитіла миші до CD134 людини клону 12H3 або клону 20E5 протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини додатково інкубували з розведеними 1:100 PEкон'югованими антитілами кози до IgG миші ("Jackson ImmunoResearch") протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини інкубували протягом 30 хвилин при температурі 4° C з розведеними 1:20 FITC-кон'югованими антитілами миші до CD4 людини ("BD Biosciences") або розведеними 1:20 FITC-кон'югованими антитілами миші до CD 8 людини ("BD Biosciences") для виявлення субпопуляцій T-лімфоцитів. Після активного промивання в ФСБ/БСА/NaN3 клітини фіксували в 2 % формальдегіді в ФСБ/БСА/NaN3 протягом 30 хвилин при температурі 4° C. Зв'язування антитіл вимірювали за допомогою проточної цитометрії (FACSCalibur; "BD Biosciences"). Як показано на фігурі 4, моноклональне антитіло миші до CD134 людини клону 12H3 або клону 20E5 демонструвало позитивне забарвлення на субпопуляції активованих CD4+Tлімфоцитів людини, і слабке забарвлення на субпопуляції активованих CD8+T-лімфоцитів людини. (e). Перехресна конкуренція немічених антитіл миші до CD134 людини клонів 12H3 і 20E5 з PE-кон'югованими комерційними антитілами миші до CD134 на стимульованих T-лімфоцитах, що експресують CD134 людини. Генерували PHA-стимульовані (в концентрації 10 мкг/мл або 20 мкг/мл протягом 4 днів або 1 дня, відповідно; див. вище) T-лімфоцити, що експресують CD134 людини. Клітини відбирали і 6 поміщали при щільності 1-2 × 10 клітин/мл в охолоджений льодом ФСБ/БСА/NaN3 з додаванням 10 % HPS (блокування рецепторів Fcγ; "BioWhittaker"). Клітини інкубували з 20 мкг/мл неміченого моноклонального антитіла миші до CD134 людини клону 12H3 або з 10 мкг/мл неміченого клону 20E5 протягом 30 хвилин при температурі 4° C. Потім клітини інкубували з розведеними 1:20 PE-кон'югованими комерційними антитілами миші до CD134 23 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 людини клону ACT35 ("BD Biosciences") або клону L106 ("BD Biosciences"; див. Також патент Godfrey) протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини фіксували в 2 % формальдегіді в ФСБ/БСА/NaN3 протягом 30 хвилин при температурі 4° C. Зв'язування PE-кон'югованих комерданійних антитіл до CD134 вимірювали за допомогою проточної цитометрії (FACSCalibur; "BD Biosciences"). Як показано на фігурі 5, попередня інкубація з неміченим антитілом миші до CD134 людини блокує зв'язування комерційного PE-кон'югованого антитіла миші до CD134 людини клону L106 з CD134 людини на PHA-стимульованих T-лімфоцитах. Попередня інкубація з неміченим антитілом миші до CD134 людини клону 20E5 в малому ступені блокує зв'язування комерційного PE-кон'югованого антитіла миші до CD134 людини клону L106 з CD134 людини на PHA-стимульованих T-лімфоцитах. Попередня інкубація з неміченим антитілом миші до CD134 людини клону 20E5 не демонструвала дії на зв'язування комерційного PE-кон'югованого антитіла миші до CD134 людини клону ACT35 з CD134 людини на PHA-стимульованих Tлімфоцитах. Зазначені результати продемонстрували, що антитіло миші до CD134 людини клону 12H3 специфічно розпізнавало CD134 людини (часткове блокування зв'язування клону L106) на PHAстимульованих T-лімфоцитах і зв'язувалось (ii) з епітопом на CD134 людини, що є несхожим з епітопом, який розпізнавався комерційним антитілом миші до CD134 людини клону L106. Зазначені результати також продемонстрували, що антитіло миші до CD134 людини клону 20E5 (i) специфічно розпізнавало CD134 людини (слабке блокування зв'язування клону L106) на PHAстимульованих T-лімфоцитах і зв'язувалося (ii) з епітопом на CD134 людини, що е несхожим з епітопом, який розпізнавався комерційним антитілом миші до CD134 людини клону L106. Крім того, зазначені результати продемонстрували, що антитіла миші до CD134 людини клону 12H3 і клону 20E, мабуть, розпізнавали епітопи CD134 людини на PHA-стимульованих T-лімфоцитах, які відрізнялися від епітопу, розпізнаваного комерційним антитілом миші до CD134 людини клону ACT35. Крім того, зазначені результати продемонстрували, що антитіла миші до CD134 людини клону 12H3 і клону 20E, мабуть, розпізнавали несхожі епітопи CD134 людини (що підтверджується частковим блокуванням у порівнянні зі слабким блокуванням зв'язування L106, відповідно) на PHA-стимульованих T-лімфоцитах. (f). Одночасне зв'язування рекомбінантного ліганду OX40 людини і антитіл миші до CD134 людини клонів 12H3 і 20E5 на PHA-стимульованих T-лімфоцитах, що експресують CD134 людини. Генерували PHA-стимульовані (в концентрації 10 мкг/мл протягом 1 дня; див. вище) Tлімфоцити, що експресують CD134 людини. Клітини відбирали і поміщали при щільності 1-2 × 6 10 клітин/мл в охолоджений льодом ФСБ/БСА/NaN3 з додаванням 10 % HPS (блокування рецепторів Fcγ; "BioWhittaker"). Клітини інкубували з 10,0 мкг/мл рекомбінантного ліганду OX40 людини з полігістидиновою міткою (OX40L; "R&D Systems") у поєднанні з 50,0 мкг/мл антитіла до полігістидину (IgG1, миші-клон AD 1.1.10; "R&D Systems") протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини потім інкубували з розведеними 1:100 FITC-кон'югованими антимишачимиі антитілами кози до IgG ("Jackson ImmunoResearch") протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN 3, клітини інкубували з 10,0 мкг/мл біотинилюванням (із застосуванням N-гідроксисукцинімідобіотину від компанії "Pierce") моноклонального антитіла миші до CD134 людини клону 12H3 або клону 20E5 протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини інкубували з розведеним 1:100 PE-кон'югованим стрептавідином ("Jackson ImmunoResearch") протягом 30 хвилин при температурі 4° C. Після активного промивання в ФСБ/БСА/NaN3 клітини фіксували в 2 % формальдегіді в ФСБ/БСА/NaN3 протягом 30 хвилин при температурі 4° C. Зв'язування OX40 людини з антитілами до CD134 людини вимірювали за допомогою проточної цитометрії (FACSCalibur; "BD Biosciences"). Як показано на фігурі 6, і моноклональне антитіло миші до CD134 людини клону 12H3, і моноклональне антитіло миші до CD134 людини клону 20E5 одночасно зв'язувалися з OX40L людини на PHA-стимульованих T-лімфоцитах, що експресують CD134 людини. Це вказує на те, що моноклональне антитіло миші до CD134 людини клону 12H3 і клону 20E5 не взаємодіють з епітопами в межах області зв'язування OX40L на рецепторах CD134 людини. Даний результат відрізняється від результату для комерційного моноклонального антитіла миші до CD134 людини клону L106 (Стенфордський університет/патент Godfrey EP 0,726,952 B1), яке розпізнавало епітоп в межах області зв'язування OX40L рецепторів CD134 людини (Taylor and Schwarz. J Immunol Methods 2001; 255: 67-72; Kirin & La Jolla Institute/патент Croft WO 2007/062235 A2). 24 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 (g). Експресія CD134 на ефекторних та регуляторних T-лімфоцитах людини після стимуляції стимулюючими гранулами з антитілами миші проти CD3 людини / CD28 людини. CD4 T-лімфоцити людини очищували із сукупності PBMC за допомогою позитивного відбору із застосуванням кон'югованих з мікрогранулами антитіл миші до CD4 людини ("Miltenyi Biotec") і магніту VarioMACS/колонок LS ("Miltenyi Biotec"). Потім зазначені CD4 T-лімфоцити забарвлювали FITC-кон'югованими антитілами миші до CD4 людини ("Dako") і PEкон'югованими антитілами миші до CD25 людини ("BD Biosciences"). CD4+/CD25 традиційні + багаті ефекторні T-лімфоцити (Tеф) і CD4 /CD25 регуляторні T-лімфоцити (Tрег) сортували за допомогою проточно-цитометричного клітинного сортувальника ("Beckman-Coulter"). Це 5 призводило до збагачення >95 % Tеф і >95 % Tрег. Tеф і Tрег поміщали при щільності 2,5 × 10 клітин/мл у живильне середовище RPMI-164/глутамакс ("Gibco") з додаванням 0,02 mM пірувату ("Gibco"), 100 Од/мл пеніциліну ("Gibco"), 100 мкг/мл стрептоміцину ("Gibco") і 10 % 4 інактивованої нагріванням HPS ((HPSi; із LMI). Потім клітини висівали при щільності 2,5 × 10 клітин/200 мкл/лунку в планшеті на 96 лунок з круглим дном ("Greiner") і стимулювали стимулюючими гранулами з антитілами миші на CD3 людини/ CD28 людини (гранули антиCD3/CD28; "Invitrogen") у співвідношенні 1 гранула/2 клітини в присутності 25 Од/мл рекомбінантного інтерлейкіну-2 людини (Proleukin® від компанії "Novartis Pharmaceuticals UK Ltd"), і культивували при температурі 37° C/5 % CO2 протягом 2-8 днів. Після культивування 6 клітини відбирали і поміщали при щільності 1-2 × 10 клітин/мл в охолоджений льодом ФСБ/0,2 % БСА і одночасно забарвлювали розведеними 1:50 FITC-кон'югованими антитілами миші до CD4 людини ("Dako"), розведеними 1:10 PE-кон'югованими антитілами миші до CD 25 людини ("BD Biosciences"), розведеними 1:50 ECD-кон'югованими антитілами миші до CD3 людини ("Beckman-Coulter"), розведеними 1:10 PE-Cy 5-кон'югованими антитілами миші до CD134 людини (клон ATC35; "BD Biosciences") і розведеними 1:10 PE-Cy 7-кон'югованими антитілами миші до CD127 людини ("BD Biosciences"). Зв'язування антитіл вимірювали за допомогою проточної цитометрії (FACSCalibur; "BD Biosciences"). Як показано на фігурі 7 (n=1 від кожного донора), Tеф і Tрег периферичної крові людини, очищені і нестимульовані/спочиваючі (день 0), що не експресують CD134, однак Tеф і Tрег людини, стимульовані анти-CD3/анти-CD28-гранулами експресують на своїй поверхні CD134. Експресія CD134 на активованих Tеф і Tрег людини досягають максимуму після 2 днів культивування і знижується після 5 і 8 днів культивування. Приклад 3. Опис біологічних властивостей моноклональних антитіл миші до CD134 людини клонів 12H3 і 20E5. (a). Проліферація PHA-стимульованих T-лімфоцитів, що експресують CD134 людини, після обробки антитілами миші до CD134 людини клонів 12H3 і 20E5. Генерували PHA-стимульовані (в концентрації 0 і 10 мкг/мл протягом 1 дня; див. вище) Tлімфоцити, що експресують CD134 людини. Клітини відбирали і суспендували з щільністю 1-2 × 6 10 клітин/мл у живильному середовищі RPMI ("Gibco"), що містить 10 % фетальної сироватки телят (Bodinco) і 50 мкг/мл гентаміцину ("Gibco"). Потім клітини розсіювали при щільності 0,1 × 6 10 клітин/100 мкл/лунку в планшеті на 96 лунок з плоским дном ("Corning") і впливали на них 0, 0,025, 0,25, 2,5, або 25, 0 мкг/мл моноклонального антитіла миші до CD134 людини клону 12H3 або моноклонального антитіла миші до CD134 людини клону 20E5, та/або в поєднанні з 0, 0,01, 0,1 або 1,0 мкг/мл рекомбінантного OX40L людини з полігістидиновою міткою (у присутності антитіла миші до полілізину в мольному співвідношенні 1:5; "R&D Systems") при температурі 37° C /5 % CO2 протягом 6 днів. Через 6 днів проліферацію клітин вимірювали за допомогою колориметричного ELISA для оцінки проліферації клітин (з включенням BrdU) ("Roche") і рідера для ELISA ("BioRad") на довжині хвилі 450 нм. Як показано на фігурі 8 (середнє значення ± SD, n=4 від одного донора), моноклональне антитіло миші до CD134 людини клону 12H3 і моноклональне антитіло миші до CD134 людини клону 20E5 в залежності від індукованої дози викликало проліферацію PHA-стимульованих Tлімфоцитів, що експресують CD134 людини. Моноклональне антитіло миші до CD134 людини клону 12H3 в залежності від індукованої дози викликало проліферацію при концентрації 0, 25, 2, 5 і 25 мкг/мл. Моноклональне антитіло миші до CD134 людини клону 12H3 в залежності від індукованої дози викликало проліферацію при концентрації 2, 5 і 25 мкг/мл. Крім того, OX40L людини в залежності від індукованої дози викликало проліферацію PHA-стимульованих Tлімфоцитів, що експресують CD134 людини. OX40L людини викликав проліферацію при негативні концентраціях 0,1 і 1,0 мкг/мл. Спочиваючі (без стимуляції PHA) CD134 T-лімфоцити людини не демонстрували ніяких реакцій проліферації після обробки моноклональним антитілом миші до CD134 людини клону 12H3, моноклональним антитілом миші до CD134 людини клону 20E5 або OX40L людини (дані не показані). 25 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як показано на фігурі 9 (середнє значення ± SD, n=2 від одного донора), моноклональне антитіло миші до CD134 людини клону 12H3 (при концентрації 2,5 і 25 мкг/мл) і моноклональне антитіло миші до CD134 людини клону 20E5 (при концентрації 2,5 і 25 мкг/мл), а також OX40L людини (при концентрації 1,0 мкг/мл) викликали проліферацію PHA-стимульованих Tлімфоцитів, що експресують CD134 людини. Необроблений контроль (тільки середовище) або контроль, оброблений антитілом миші изотипу IgG1κ (при концентрації 2,5 і 25 мкг/мл; "BD Biosciences"), що не демонстрували ніякої дії на проліферацію PHA-стимульованих Tлімфоцитів, що експресують CD134 людини. Поєднання моноклонального антитіла миші до CD134 людини клону 12H3 в концентрації 2,5 і 25 мкг/мл (або при більш низьких концентраціях; дані не показані) або моноклонального антитіла миші до CD134 людини клону 20E5 в концентрації 2,5 і 25 мкг/мл (або при більш низьких концентраціях; дані не показані) з OX40L людини в концентрації 1,0 мкг/мл (або при більш низьких концентраціях; дані не показані) не демонструє жодних взаємних впливів (тобто, синергічної або адитивної, або навіть інгібуючої дії) на проліферацію PHA-стимульованих T-лімфоцитів, що експресують CD134 людини. (b). Проліферація стимульованих гранулами з антитілами до CD3/CD28 людини ефекторних та регуляторних Т-лімфоцитів, що експресують CD134 людини, після обробки антитілами миші до CD134 людини клонів 12H3 і 20E5. CD4 T-лімфоцити людини очищали з сукупності PBMC за допомогою негативного відбору із застосуванням коктейлю антитіл миші ("BD Biosciences"), направлених на CD8 (клон RPA-T8), CD14 (клон M5E2), CD16 (клон 3G8), CD19 (клон 4G7), CD33 (клон P67.6), CD56 (клон B159) і CD235 a людини (HIR2). Після інкубації з Dynabeads®-кон'югованими антитілами вівці до IgG миші ("Invitrogen"), такі що не зв'язалися CD4 T-лімфоцити відбирали з концентратора магнітних частинок для динамічного аналізу MPC-6 ("Invitrogen"). З вказаної сукупності збагачених CD4 багаті негативні T-лімфоцитів CD25 Tрег і CD25 Tеф виділяли за допомогою MACS-сортування із застосуванням 10 мкл кон'югованих з мікрогранулами антитіл миші до CD25 людини ("Miltenyi 7 Biotec")/10 клітин і магніту MiniMACS/колонок MS ("Miltenyi Biotec") і VarioMACS магніту/колонок LS ("Miltenyi Biotec"). Це призводило до збагачення >9 0 % Tеф і 6 >9 0 % Tрег. Tеф і Tрег поміщали при щільності 0,25 × 10 клітин/мл у живильне середовище RPMI-1640/глутамакс ("Gibco") з додаванням 0,02 м пірувату ("Gibco"), 100 од/мл пеніциліну ("Gibco"), 100 мкг/мл стрептоміцину ("Gibco") і 10 % термоінактивованої HPSI. Потім Tеф і Tрег 4 6 розсіювали при щільності 2,5 × 10 клітин/200 мкл/лунку (тобто, 0,125 × 10 клітин/мл) в планшеті на 96 лунок з круглим дном ("Greiner") і стимулювали анти-CD3/CD28 гранулами ("Invitrogen") у співвідношенні 1 гранула/5 клітин з додаванням або без додавання 5,0 мкг/мл моноклонального антитіла миші до CD134 людини клону 12H3, 5,0 мкг/мл моноклонального антитіла миші до CD134 людини клону 20E5, 1,0 мкг/мл рекомбінантного OX40L людини з полігістидиновою міткою (у присутності антитіла миші до полілізину в мольному співвідношенні 1:5; "R&D Systems"), поєднання 5,0 мкг/мл моноклонального антитіла миші до CD134 людини клону 12H3 з 1,0 мкг/мл рекомбінантного OX40L людини з полігістидиновою міткою (у присутності антитіла миші до полілізину в мольному співвідношенні 1:5) або поєднання 5,0 мкг/мл моноклонального антитіла миші до CD134 людини клону 20E5 з 1,0 мкг/мл рекомбінантного OX40L людини з полігістидиновою міткою (у присутності антитіла миші до полілізину в мольному співвідношенні 1:5) при температурі 37° C/5 % CO2 протягом 4 або 5 днів. Через 4 або 5 днів проліферацію клітин вимірювали по включенню тимідину, міченого тритієм 0,5 мкКю, ("Perkin & Elmer") за допомогою β-лічильника ("Canberra-Packard"). Як показано на фігурі 10 (середнє значення ± SD), хоча анти-CD3/CD28 стимулюючі гранули самі по собі викликали значну проліферацію Теф людини, що експресують CD134 людини (тобто, середовище), моноклональне антитіло миші до CD134 людини клону 12H3 або OX40L людини викликали додаткову проліферацію стимульованих анти-CD3/CD28 гранулами Теф людини, що експресують CD134 людини. Моноклональне антитіло миші до CD134 людини клону 20E5 не викликало додаткової проліферації стимульованих анти-CD3/CD28 гранулами Теф людини, що експресують CD134 людини. Як показано на фігурі 11 (середнє значення + SEM від 5 донорів), моноклональне антитіло миші до CD134 людини клону 12H3 і моноклональне антитіло миші до CD134 людини клону 20E5 не викликали або викликали лише незначну проліферацію стимульованих анти-CD3/CD28 гранулами Tрег людини, що експресують CD134 людини, тоді як OX40L людини викликав дуже сильну проліферацію стимульованих анти-CD3/CD28 гранулами Tрег людини, що експресують CD134 людини. Як показано на фігурі 12A (середнє значення ± SD), моноклональне антитіло миші до CD134 людини клону 12H3 в поєднанні з OX40L людини не демонстрували ніяких взаємних впливів (тобто, синергічної або адитивної, або навіть інгібуючої дії) на стимульовані анти-CD3/CD28 26 UA 115316 C2 5 10 15 20 25 30 35 40 45 50 55 60 гранулами Tрег людини, що експресують CD134 людини. Крім того, моноклональне антитіло миші до CD134 людини клону 20E5 в поєднанні з OX40L людини не демонстрували ніяких взаємних впливів (тобто, синергічної або адитивної, або навіть інгібуючої дії) на стимульовані анти-CD3/CD28 гранулами Tрег людини, що експресують CD134 людини (дані не показані). Як показано на фігурі 12B (середнє значення ± SD), на відміну від дії, що спостерігається з проліферативними реакціями, що опосередковані OX40L людини, в стимульованих антиCD3/CD28 гранулами Tеф, що експресують CD134 людини, моноклональні антитіла миші до CD134 людини клону 12H3 суттєво пригнічують опосередковувані OX40L людини проліферативні проліферативними реакціями, опосредкованими OX40L людини, в стимульованих анти-CD3/CD28 гранулами Tрег, що експресують CD134 людини. (c). Супресорна функція стимульованих гранулами з антитілами до CD3/CD28 людини Tрегуляторних лімфоцитів, що експресують CD134 людини, після обробки антитілами миші до CD134 людини клонів 12H3 і 20E5. CD4 T-лімфоцити людини очищали із сукупності PBMC, і Теф і Tрег збагачували, як описано 6 в Прикладі 3(b), що наведено вище. Теф і Tрег поміщали при щільності 0,25 × 10 клітин/мл у живильне середовище RPMI-1640/глутамакс ("Gibco") з додаванням 0,02м пірувату ("Gibco"), 100 од/мл пеніциліну ("Gibco"), 100 мкг/мл стрептоміцину ("Gibco") і 10 % HPSI. Потім Теф 4 6 розсіювали при щільності 2,5 × 10 клітин/200 мкл/лунку (тобто, 0,125 × 10 Теф/мл) і 4 культивували їх спільно з супресорними Tрег з щільністю 0,25 × 10 супресорних Tрег/200 6 мкл/лунку (тобто, 0,125 × 10 Tрег/мл; співвідношення Теф/Tрег = 1:1) в планшетах на 96 лунок з круглим дном ("Greiner"). Зазначені спільні культури Теф/Tрег стимулювали гранулами антиCD3/CD28 ("Invitrogen") в концентрації 1 гранула/10 клітин з додаванням або без додавання 5,0 мкг/мл моноклонального антитіла миші до CD134 людини клону 12H3, 5,0 мкг/мл моноклонального антитіла миші до CD134 людини клону 20E5 і 1,0 мкг/мл рекомбінантного OX40L людини з полігістидиновою міткою (у присутності антитіла миші до полілізину в мольному співвідношенні 1:5; "R&D Systems") при температурі 37° C/5 % CO2 протягом 5 днів. Через 5 днів проліферацію клітин вимірювали по включенню тимідину, міченого тритієм 0,5 мкКю, ("Perkin & Elmer") за допомогою β-лічильника ("Canberra-Packard"). Як показано на фігурі 13 (середнє значення ± SD), Tрег людини придушували проліферативні реакції в Теф людини, що індуковані анти-CD3/CD28 гранулами (тобто, середовищем). Зазначена супресорна функція Tрег людини послаблювалася у присутності моноклональних антитіл миші до CD134 людини клону 12H3 або в присутності OX40L людини. Моноклональні антитіла миші до CD134 людини клону 20E5 не демонстрували ніякої дії на супресорну функцію Tрег людини. Приклад 4. Опис молекулярно-генетичних властивостей моноклональних антитіл миші до CD134 людини клонів 20E5 і 12H3. (a). Ізотипування і розщеплення білків по Едману. Клас імуноглобулінів миші і тип легких ланцюгів в моноклональних антитілах миші до CD134 людини клонів 20E5 і 12H3, очищених за допомогою білка G, визначали за допомогою набору для ізотипування моноклональних антитіл миші IsoStrip, і було показано, що обидва моноклональних антитіла миші до CD134 людини клонів 20E5 і 12H3 являються IgG1 миші з легкими ланцюгами. Після стандартного електрофорезу LDS-PAGE із застосуванням системи NuPage Novex заводського гелю ("Invitrogen") при умовах відновлювання (дитіотреітолу і нагрівання до температури 70° C) моноклональне антитіло миші до CD134 людини клону 2E5 піддавали електроблоттингу в мембрану з полівініледенфторидом для переносу (PDVF/Immobilon-P) і забарвлювали кумасі діамантовим блакитним ("BioRad"). Потім смуги важких і легких ланцюгів (50 кДа і 25 кДа, відповідно) вирізали з PVDF мембрани і застосовували для аналізу на основі розщеплювання білків по Едманду (проведеного компанією "Eurosequence", Гронінген, Нідерланди) з метою визначення послідовностей амінокислот з N-кінця. Результати показані під номерами SEQ ID №3 і SEQ ID №61 для моноклонального антитіла миші до CD134 людини клону 20E5. Було визначено одинадцять амінокислот на N-кінці важких ланцюгів і 11 амінокислот на N-кінці легких ланцюгів. (b). ПЛР-РВ. Клітини гібридоми клону 20E5 і 12H3 відбирали з культури клітин. Клітини відмивали ФСБ, 6 відбирали аліквоти у флакони, що містять 5 × 10 клітин, і зберігали у вигляді гранул при температурі -80° C. Гранули з клітинами застосовували для виділення РНК за допомогою набору RNeasy Mini Isolation ("QIAGEN"). Визначали концентрацію РНК (довжина хвилі 260 нм), і РНК зберігали при температурі -80° C. Сумарний вихід виділеної РНК: 27,3 мкг і 58,4 мкг для клону 20E5 і клону 12H3, відповідно (співвідношення A260/A280 для обох клонів 1,9). З 1мкг РНК 27 UA 115316 C2 5 за допомогою зворотної транскриптази синтезували кДНК, з застосуванням набору для синтезу TM кДНК RevertAid H Minus First Strand ("Fermentas") і зберігали її при температурі -20° C. На підставі ізотипу (каппа/IgG1 миші) і даних, що отримані при розщепленні по Едманду моноклонального антитіла до CD134 людини клону 20E5, для ампліфікації V-областей моноклонального антитіла до CD134 людини клону 20E5 були розроблені наступні праймери: № праймера * 201 266 203 204 259 260 265 Послідовність ** GACAGTTGGTGCAGCATCAG CACTGGATGGTGGGAAGATG GGCCAGTGGATAGACAGATG TGGACAGGGATCCAGAGTTC GCGAAGTACAAYTNCARCARWSNGG GCGTACAATTACARCARWSNGGNCC GCGATATACARATGACNCARAC SEQ ID № 39 40 41 42 43 44 45 Напрямок Ген антисмисловий антисмисловий антисмисловий антисмисловий такий що кодує такий що кодує такий що кодує mkappa mkappa mIgG1 mIgG1 20E5HC 20E5HC 20E5LC * номер відповідно до внутрішньої системи кодування "Bioceros"; ** вироджені праймери: N=A, C, G або T, Y=C або T, R=A або G, W=A або T, а S=G або C. 10 На підставі ізотипу (каппа/IgG1 миші) моноклонального антитіла до CD134 людини клону 12H3 і таких що кодують праймерів, що відпалюються з кДНК, що кодує сигнальні пептиди миші (частково на підставі Antibody Engineering Volume 1 Kontermann, Roland E.; Dübel, Stefan (Eds.), Springer LabManuals, 2nd ed., 2010), для ампліфікації V-областей моноклонального антитіла до CD134 людини клону 12H3 були розроблені наступні праймери: № Послідовність ** праймера* 416 CAGTGGATAGACAGATGGGGG 394 ACTGGATGGTGGGAAGATGG SEQ ID № Напрямок Ген 46 47 антисмисловий антисмисловий mIgG1 mkappa сигнальний пептид сигнальний пептид сигнальний пептид 405 ATGGGATGGAGCTRTATCATSYTCTT 48 такий що кодує 410 ATGGRATGGAGCKGGGTCTTTMTCTT 49 такий що кодує 389 ATGGGCWTCAAAGATGGAGTCACA 50 такий що кодує * номер відповідно до внутрішньої системи кодування "Bioceros"; ** вироджені праймери: N=A, C, G або T, Y=C або T, R=A або G, W=A або T, S=G або C, M=C або A, а K=G або T. 15 20 25 30 Праймери 201 і 266 являються антисмисловими і розроблені для відпалювання в межах константної області гену kappa миші в положенні 214-232 і 236-255, відповідно (на підставі номера доступу V00807 [версія V00807.1]). Праймери 203 і 204 являються антисмисловими і розроблені для відпалювання в межах константної області IgG1миші в положенні 115-134 і 221-240, відповідно (на підставі номера доступу J00453 [версія J00453.1]). Праймери 259 і 260 являються кодуючими виродженими праймерами (виродження, оответственно 512 і 256) і відпалюються на N-кінці (амінокислоти 1-8 та 2-9, відповідно) важкого ланцюга антитіла миші до CD134 людини клону 20E5 на підставі даних розщеплення по Едману. Праймер 265 являється кодуючим виродженим праймером (виродження 16) і відпалюється на N-кінці (амінокислоти 1-7) легкого ланцюга антитіла миші до CD134 людини клону 20E5 на підставі даних розщеплення по Едману. Праймер 416 являється антисмисловим і розроблений для відпалювання в межах константної області IgG1 в положеннях 111-131 (на підставі номера доступу J00453 [версія J00453.1]). Праймер 394 являється антисмисловим і розроблений для відпалювання в межах константної області гену kappa миші в положенні 115-134 і 221-240 235-254 (на підставі номера доступу V00807 [версія V00807.1]). 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti-cd134 (ox40) antibodies and uses thereof
Автори англійськоюSimons, Petrus Johannes, Boon, Louis
Автори російськоюСаймон Пэтрус Йоханнэс, Бун Луис
МПК / Мітки
МПК: A61K 39/395, C07K 16/28
Мітки: cd134, яка, композиція, зв'язувальна, фармацевтична, зв'язується, містить, людини, молекула
Код посилання
<a href="https://ua.patents.su/86-115316-zvyazuvalna-molekula-yaka-zvyazuehtsya-z-cd134-lyudini-ta-farmacevtichna-kompoziciya-shho-mistit.html" target="_blank" rel="follow" title="База патентів України">Зв’язувальна молекула, яка зв’язується з cd134 людини, та фармацевтична композиція, що її містить</a>