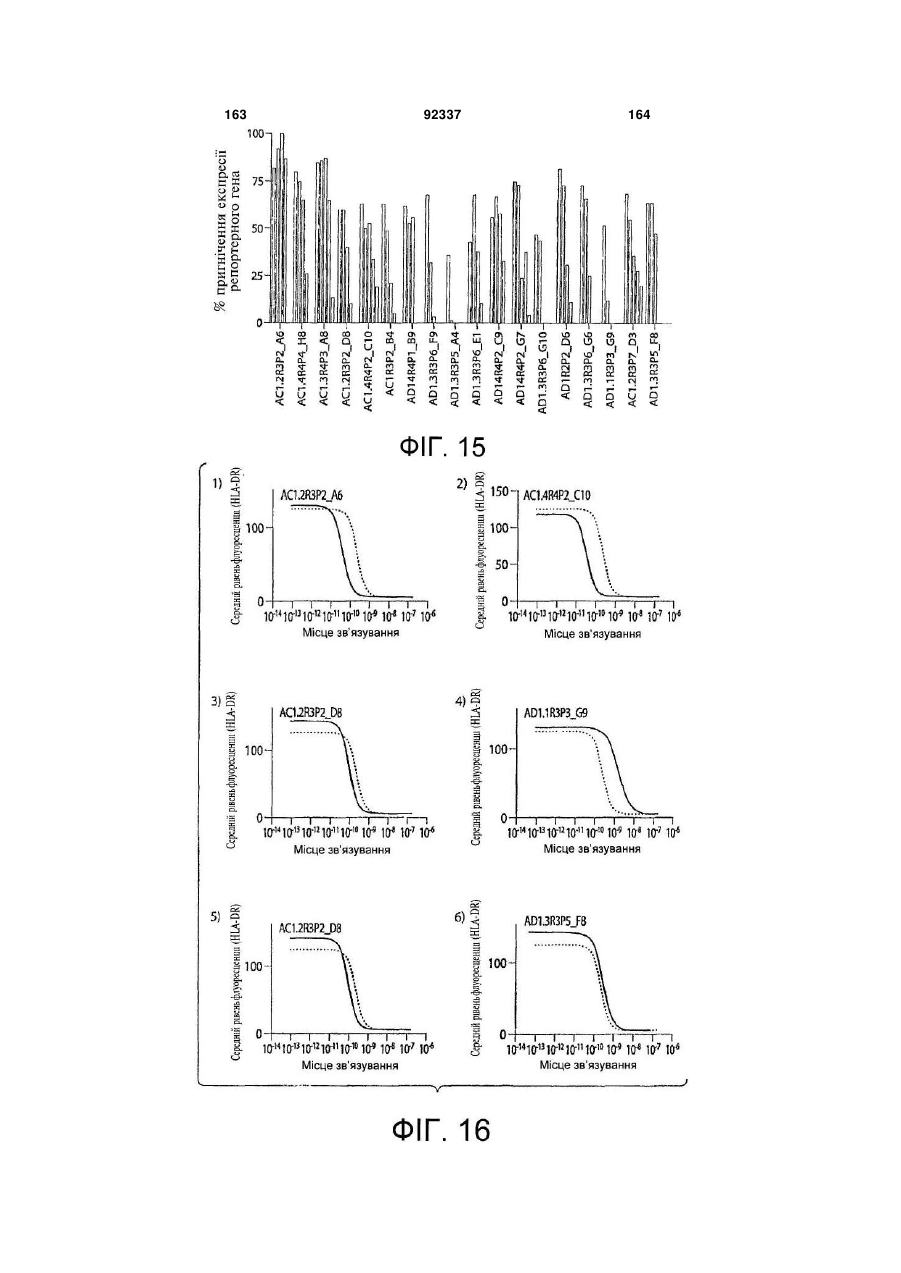
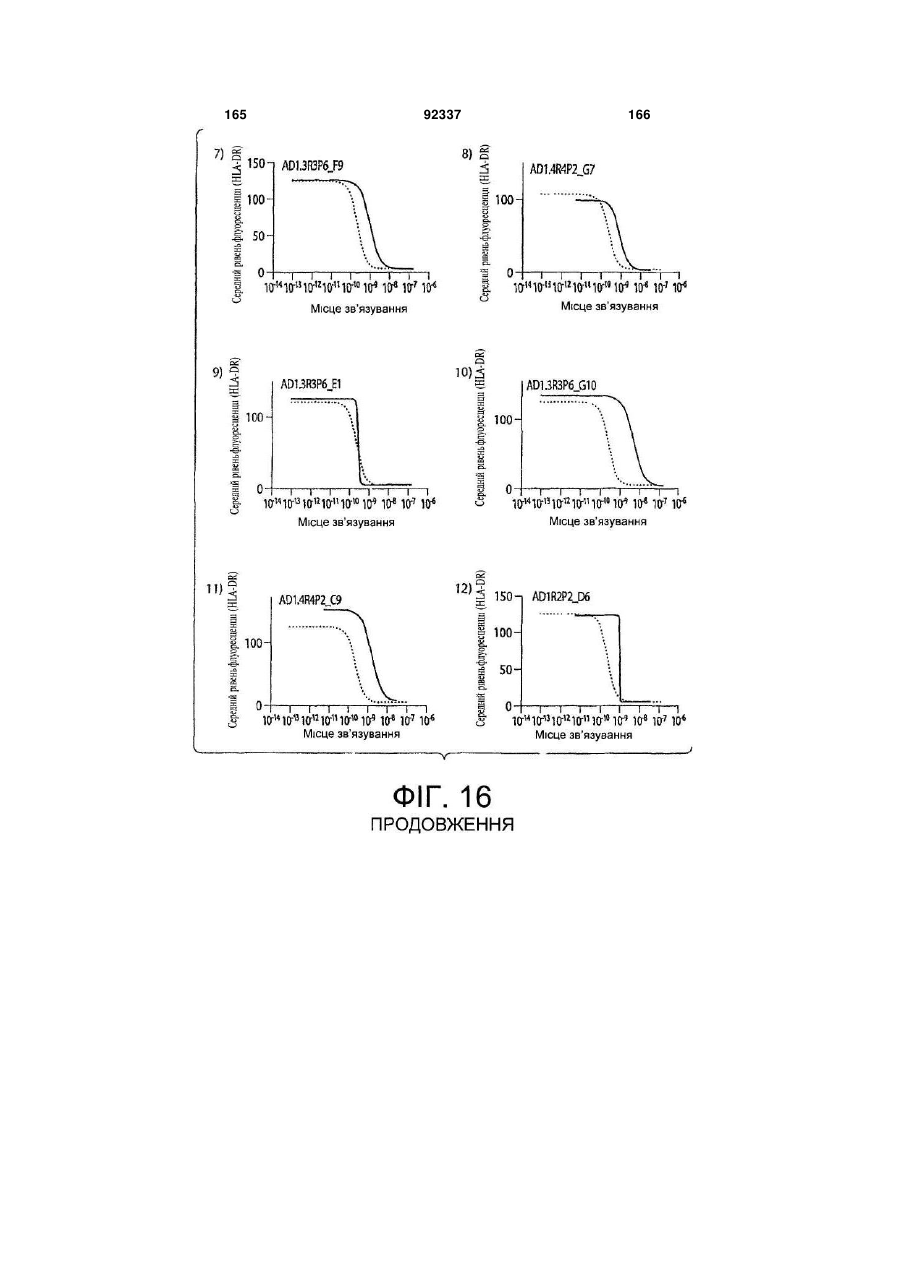
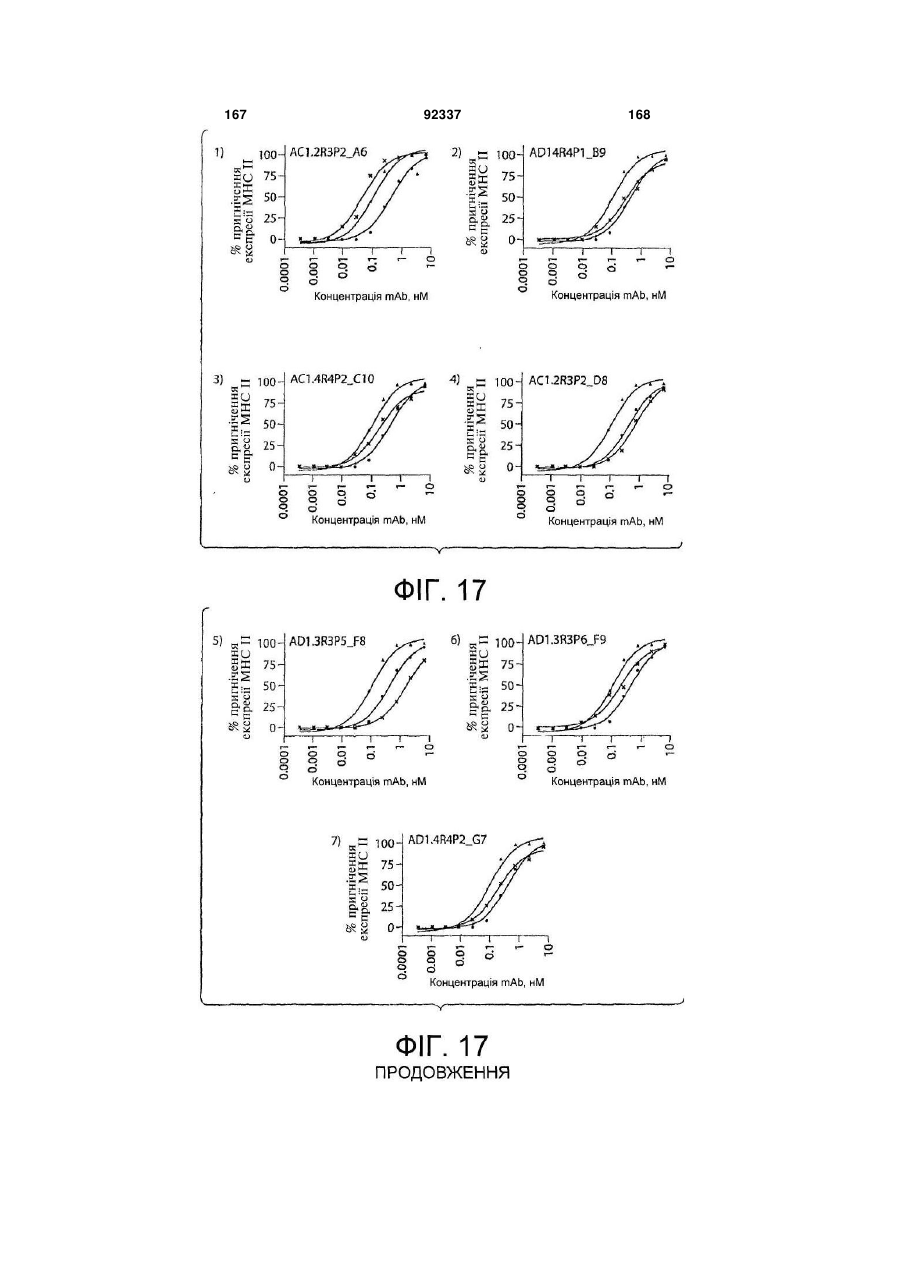
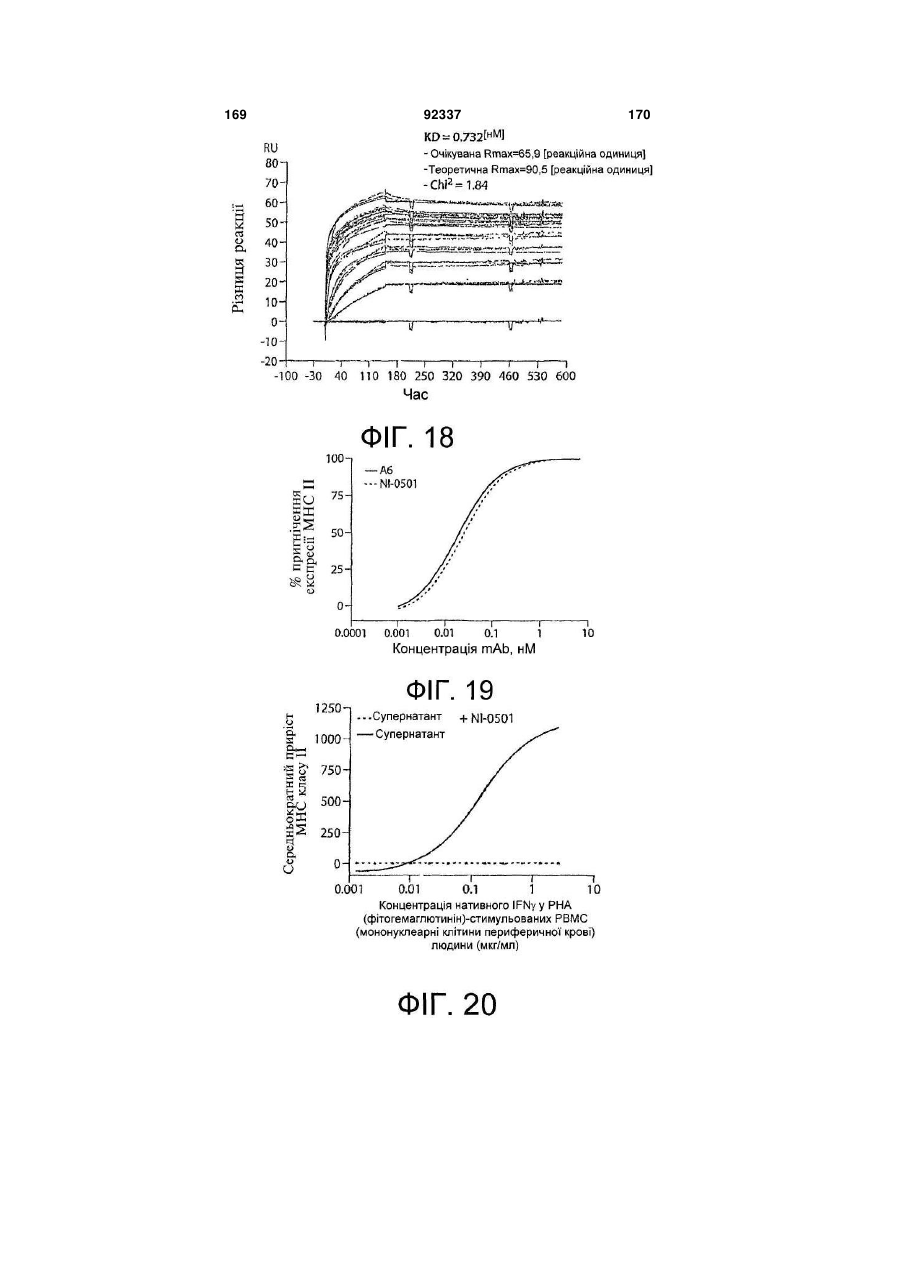
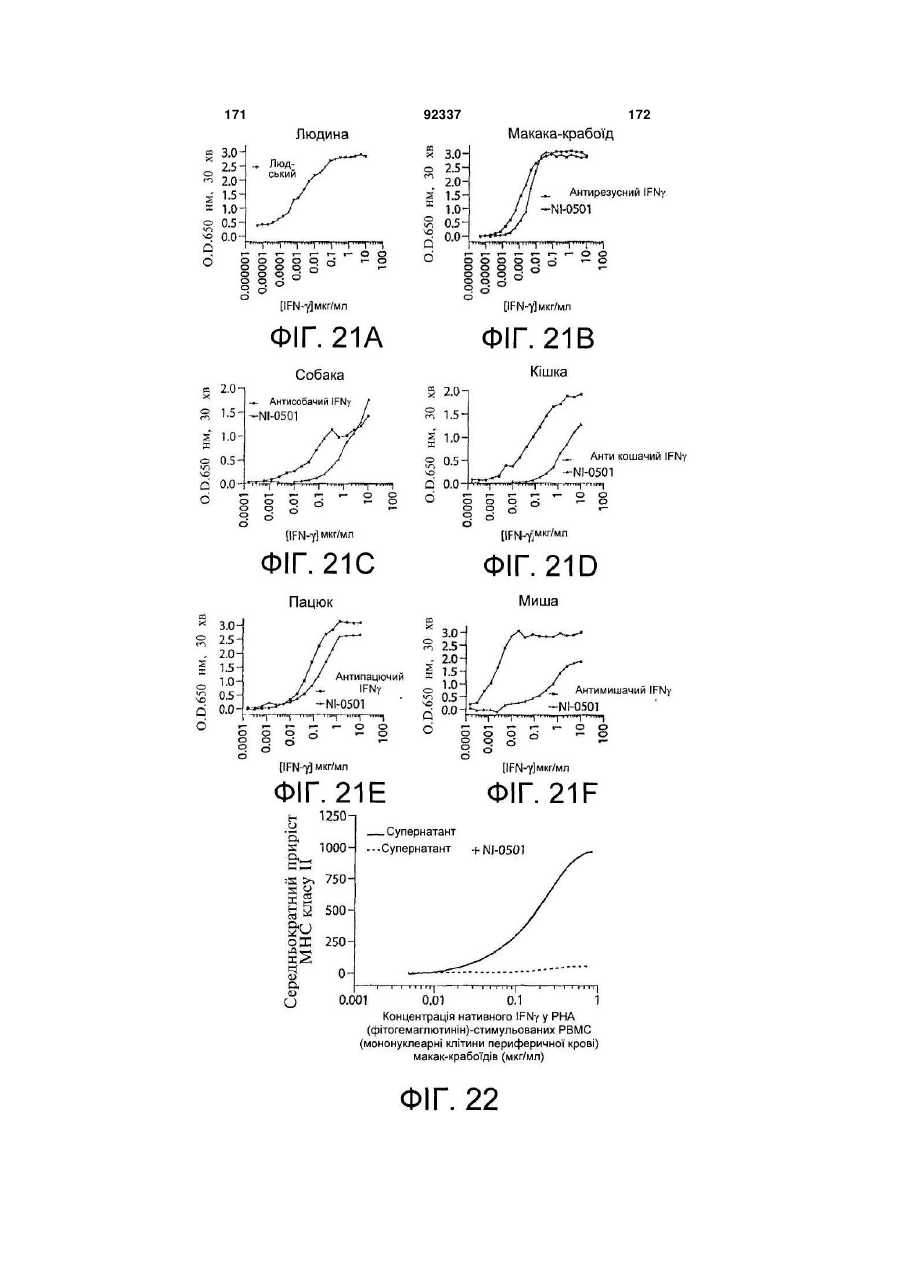
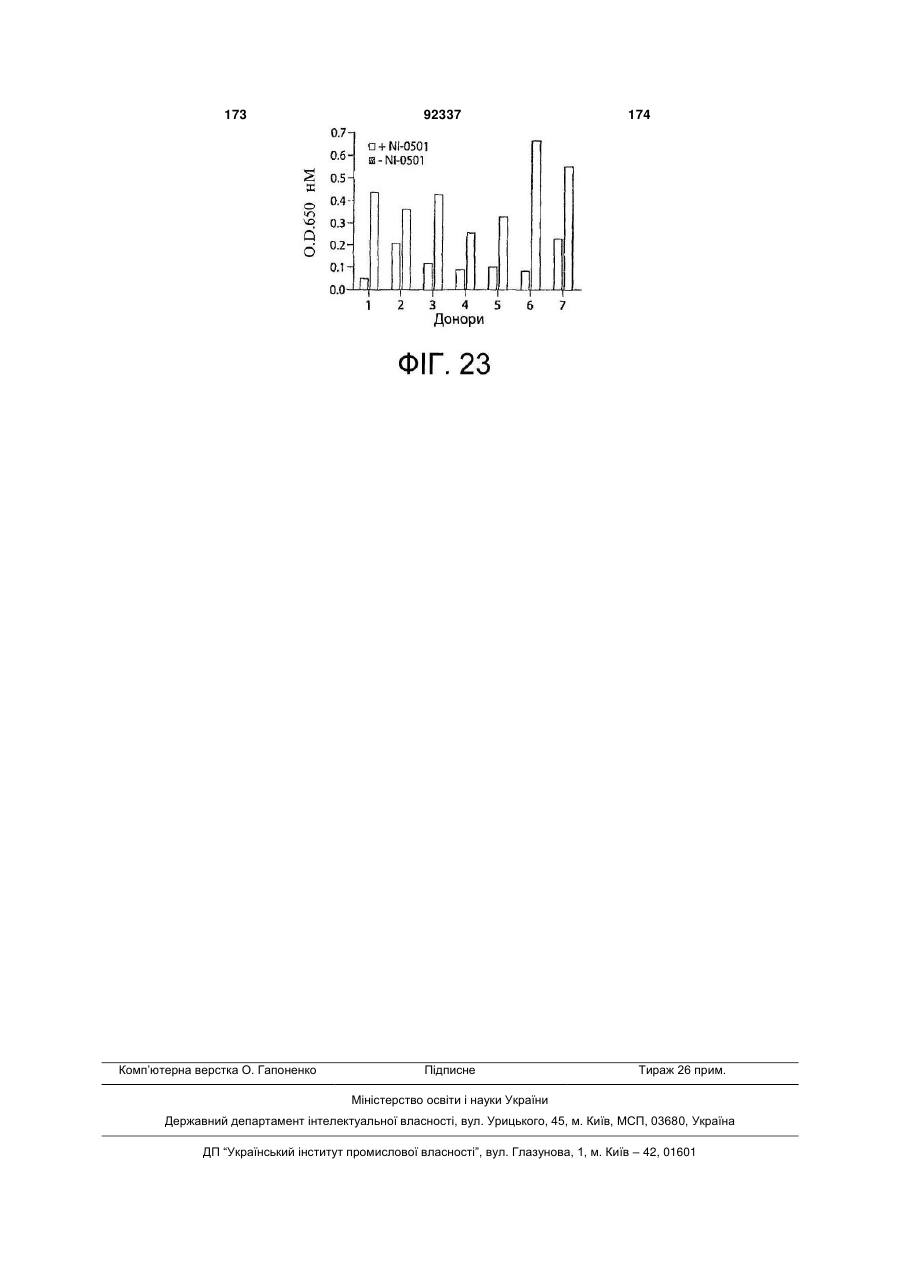
Виділене повністю людське моноклональне антитіло до гамма-інтерферону (ifng), фармацевтична композиція, що його містить, та спосіб полегшення інтенсивності симптому автоімунного захворювання або запального розладу
Номер патенту: 92337
Опубліковано: 25.10.2010
Автори: Елсон Грег, Ферлін Вальтер, Фішер Ніколас, Леже Олів'є
Формула / Реферат
1. Виділене повністю людське моноклональне анти-IFNg антитіло або його фрагмент, яке містить:
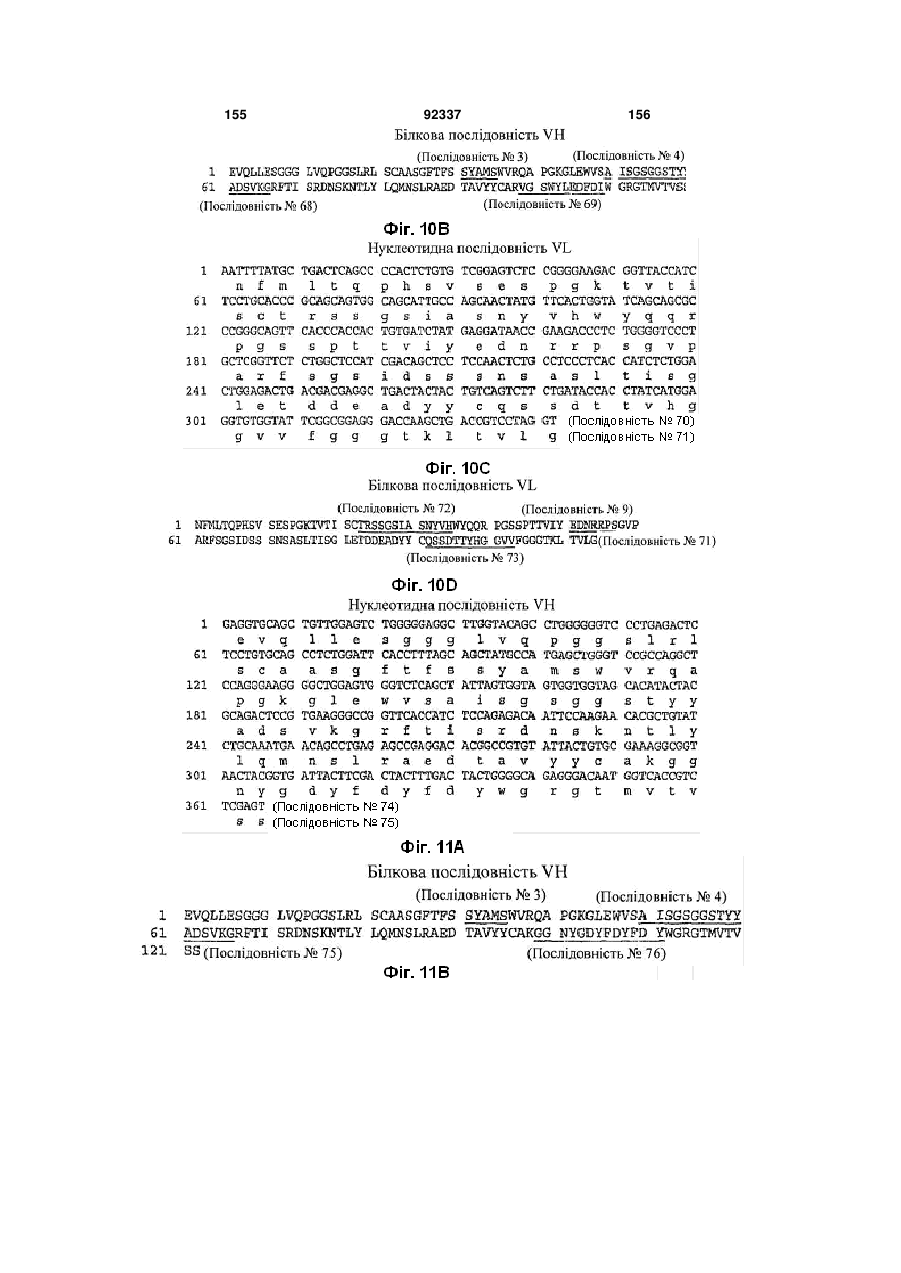
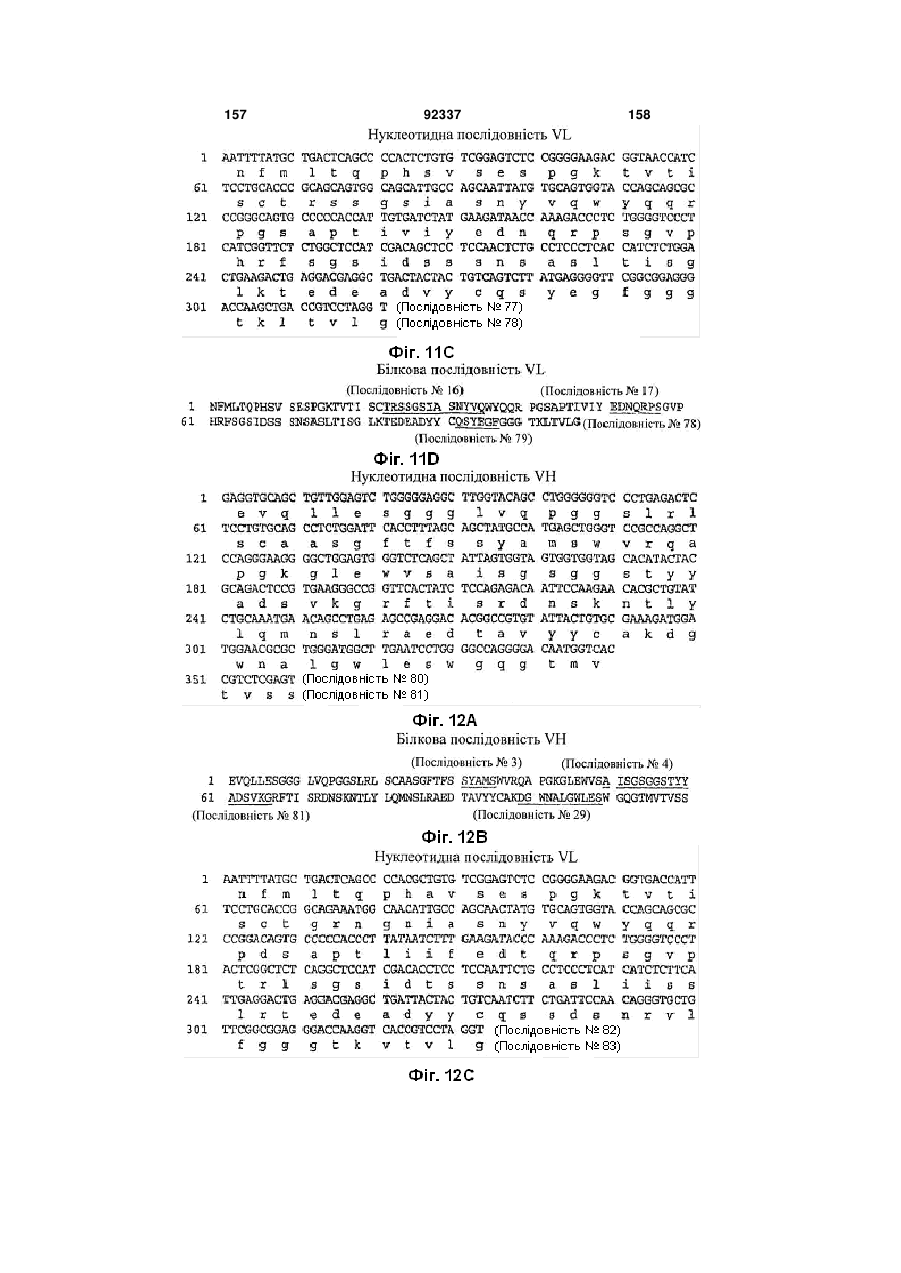
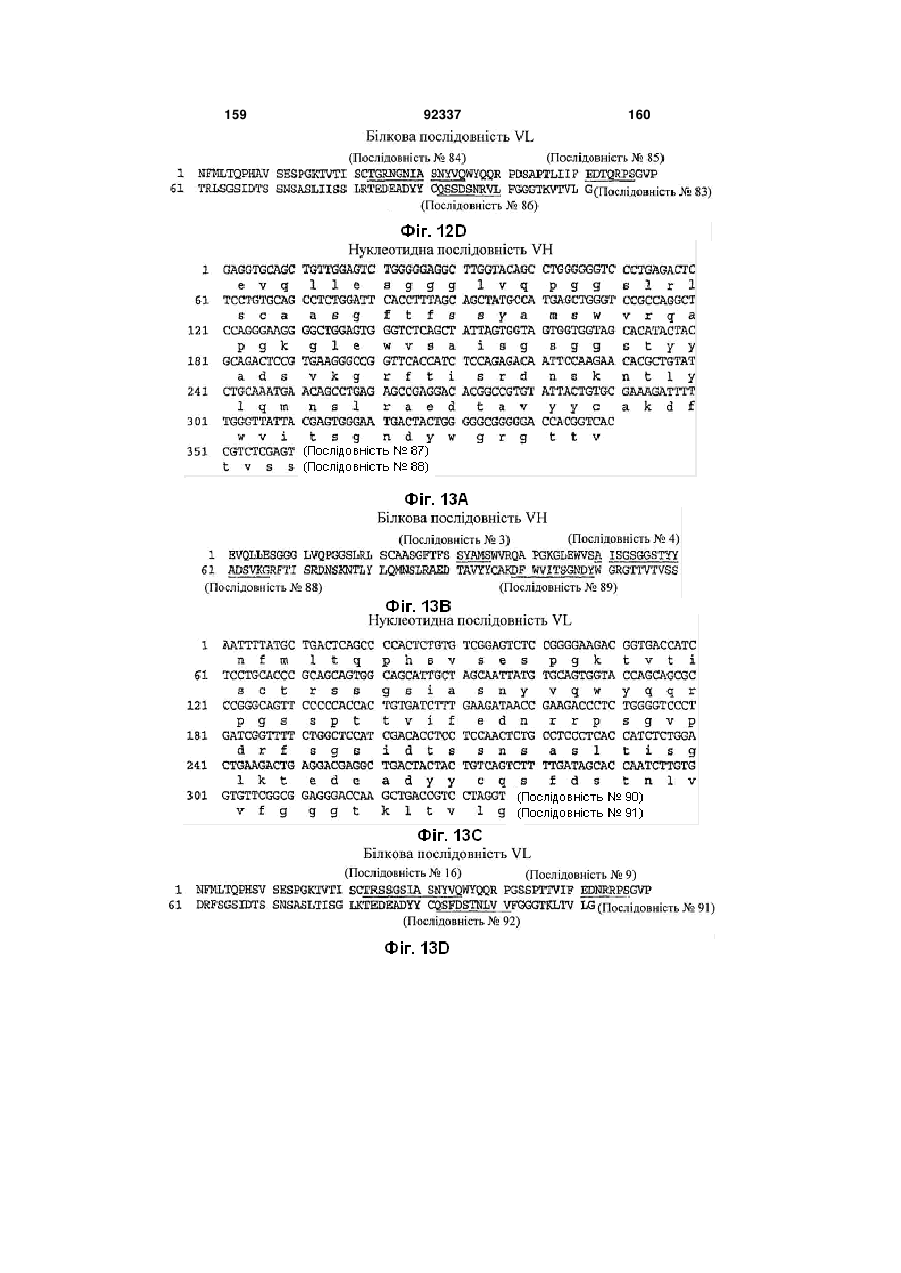
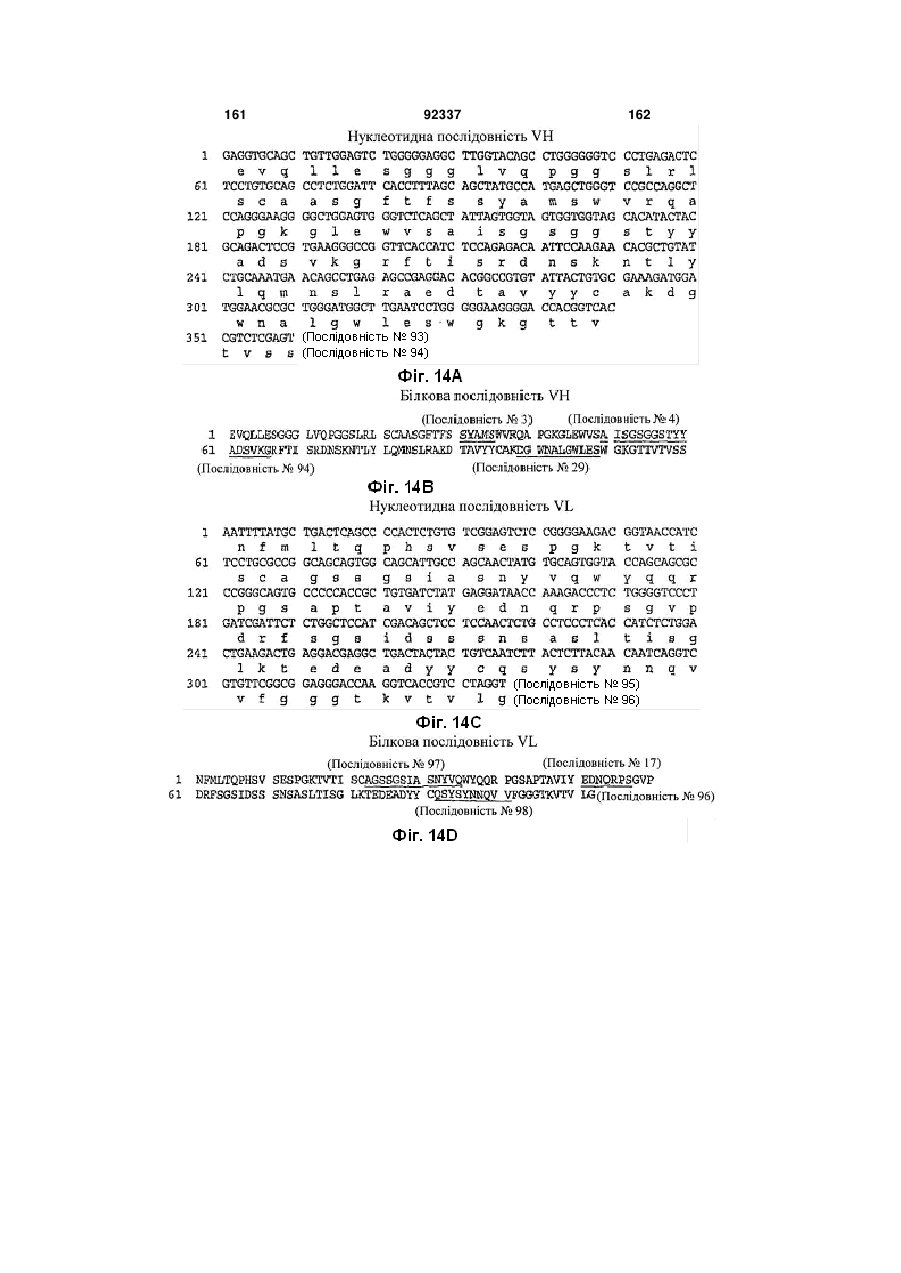
(a) VH CDR1 ділянку, що містить амінокислотну послідовність SYAMS (Послідовність № 3) або SNAMS (Послідовність № 43);
(b) VH CDR2 ділянку, що містить амінокислотну послідовність AISGSGGSTYYADSVKG (Послідовність № 4) або TLTGSGGTAYYADSVEG (Послідовність № 44), та
(c) VH CDR3 ділянку, що містить амінокислотну послідовність, вибрану з групи, яку складають DGSSGWYVPHWFDP (Послідовність № 5); DHSSGWYVISGMDV (Послідовність № 13); DLTVGGPWYYFDY (Послідовність № 21); DGWNALGWLES (Послідовність № 29); GTELVGGGLDN (Послідовність № 45); RSFDSGGSFEY (Послідовність № 64); VGSWYLEDFDI (Послідовність № 69); GGNYGDYFDYFDY (Послідовність № 76) та DFWVITSGNDY (Послідовність № 89),
причому згадане антитіло зв'язує IFNg.
2. Антитіло за п. 1, яке додатково містить:
(d) VL CDR1 ділянку, що містить амінокислотну послідовність, вибрану з групи, яку складають TRSSGSIASNYVQ (Послідовність № 8); TRSSGSIASNYVQ (Послідовність № 16); TRSGGSIGSYYVQ (Послідовність № 32); TRSSGTIASNYVQ (Послідовність № 39); TGSGGSIATNYVQ (Послідовність № 48); TGSSGSIASNYVQ (Послідовність № 55); TRSSGSIASNYVH (Послідовність № 72); TGRNGNIASNYVQ (Послідовність № 84); AGSSGSIASNYVQ (Послідовність № 97) та TRSSGSIVSNYVQ (Послідовність № 106);
(e) VL CDR2 ділянку, що містить амінокислотну послідовність, вибрану з групи, яку складають EDNQRPS (Послідовність № 9); EDNQRPS (Послідовність № 17); DDDQRPS (Послідовність № 25); DDKKRPS (Послідовність № 33); EDTQRPS (Послідовність № 85) та EDNRRPS (Послідовність № 107); і
(f) VL CDR3 ділянку, що містить амінокислотну послідовність, вибрану з групи, яку складають QSYDGSNRWM (Послідовність № 10); QSNDSDNVV (Послідовність № 18); QSYDSSNVV (Послідовність № 26); QSYDSNNLVV (Послідовність № 34); QSYDNSNHWV (Послідовність № 40); QSYDSDNHHVV (Послідовність № 49); QSYDSSNQEVV (Послідовність № 56); QSYDSNNFWV (Послідовність № 61); QSSDTTYHGGVV (Послідовність № 73); QSYEGF (Послідовність № 79); QSSDSNRVL (Послідовність № 86); QSFDSTNLVV (Послідовність № 92) та QSYSYNNQVV (Послідовність № 98).
3. Антитіло за п. 1, яке має ізотип IgG.
4. Антитіло за п. 2, яке містить VH CDR1 ділянку, що містить амінокислотну послідовність SYAMS (Послідовність № 3); VH CDR2 ділянку, що містить амінокислотну послідовність AISGSGGSTYYADSVKG (Послідовність № 4), VH CDR3 ділянку, що містить амінокислотну послідовність DGSSGWYVPHWFDP (Послідовність № 5); VL CDR1 ділянку, що містить амінокислотну послідовність TRSSGSIASNYVQ (Послідовність № 8); VL CDR2 ділянку, що містить амінокислотну послідовність EDNQRPS (Послідовність № 9), і VL CDR3 ділянку, що містить амінокислотну послідовність QSYDGSNRWM (Послідовність № 10).
5. Антитіло за п. 1, яке являє собою NI-0501.
6. Виділене повністю людське моноклональне антитіло, яке містить амінокислотну послідовність варіабельної ділянки важкого ланцюга, вибрану з групи, яку складають Послідовність № 2, Послідовність № 12, Послідовність № 20, Послідовність № 28, Послідовність № 36, Послідовність № 42, Послідовність № 51, Послідовність № 58, Послідовність № 63, Послідовність № 68, Послідовність № 75, Послідовність № 81, Послідовність № 88, Послідовність № 94 та Послідовність № 103, причому згадане антитіло зв'язує IFNg.
7. Антитіло за п. 6, яке додатково містить амінокислотну послідовність варіабельної ділянки легкого ланцюга, вибрану з групи, яку складають Послідовність № 7, Послідовність № 15, Послідовність № 23, Послідовність № 31, Послідовність № 38, Послідовність № 47, Послідовність № 54, Послідовність № 60, Послідовність № 66, Послідовність № 71, Послідовність № 78, Послідовність № 83, Послідовність № 91, Послідовність № 96 та Послідовність № 105, причому згадане антитіло зв'язує IFNg.
8. Антитіло за п. 7, яке містить VH CDR1 ділянку, що містить амінокислотну послідовність SYAMS (Послідовність № 3); VH CDR2 ділянку, що містить амінокислотну послідовність AISGSGGSTYYADSVKG (Послідовність № 4), VH CDR3 ділянку, що містить амінокислотну послідовність DGSSGWYVPHWFDP (Послідовність № 5); VL CDR1 ділянку, що містить амінокислотну послідовність TRSSGSIASNYVQ (Послідовність № 8); VL CDR2 ділянку, що містить амінокислотну послідовність EDNQRPS (Послідовність № 9), і VL CDR3 ділянку, що містить амінокислотну послідовність QSYDGSNRWM (Послідовність № 10).
9. Антитіло за п. 4, яке має ізотип IgG.
10. Фармацевтична композиція, що містить антитіло за п. 1 і носій.
11. Фармацевтична композиція, що містить антитіло за п. 4 і носій.
12. Спосіб полегшення інтенсивності симптому автоімунного захворювання або запального розладу, який включає введення антитіла за п. 1 суб'єкту, який цього потребує, у кількості, достатній для полегшення інтенсивності симптому автоімунного захворювання або запального розладу у згаданого суб’єкта.
13. Спосіб за п. 12, причому згаданим суб'єктом є людина.
14. Спосіб за п. 12, який відрізняється тим, що згадане антитіло містить VH CDR1 ділянку, що містить амінокислотну послідовність SYAMS (Послідовність № 3); VH CDR2 ділянку, що містить амінокислотну послідовність AISGSGGSTYYADSVKG (Послідовність № 4), VH CDR3 ділянку, що містить амінокислотну послідовність DGSSGWYVPHWFDP (Послідовність № 5); VL CDR1 ділянку, що містить амінокислотну послідовність TRSSGSIASNYVQ (Послідовність № 8); VL CDR2 ділянку, що містить амінокислотну послідовність EDNQRPS (Послідовність № 9), і VL CDR3 ділянку, що містить амінокислотну послідовність QSYDGSNRWM (Послідовність № 10).
15. Спосіб за п. 14, який відрізняється тим, що згаданим антитілом є NI-0501.
16. Спосіб за п. 12, причому згадане автоімунне захворювання або запальний розлад вибраний з групи, яку складають хвороба Крона, системний червоний вовчак, псоріаз, ревматоїдний артрит, васкуліт, атопічний дерматит і вторинний прогресуючий розсіяний склероз.
17. Спосіб за п. 12, який відрізняється тим, що згадане антитіло вводять внутрішньовенним шляхом.
18. Спосіб за п. 12, який відрізняється тим, що згадане антитіло вводять одночасно з другим агентом, вибраним з групи, яку складають:
(a) антицитокін, що розпізнає один або декілька цитокінів, вибраних з-посеред інтерлейкіну 1 (IL-1), IL-2, IL-4, IL-6, IL-12, IL-13, IL-15, IL-17, IL-18, IL-20, IL-21, IL-22, IL-23, IL-27 і IL-31;
(b) антихемокінний реагент, що розпізнає один або декілька цитокінів, вибраних з-посеред IL-1, IL-2, IL-4, IL-6, IL-12, IL-13, IL-15, IL-17, IL-18, IL-20, IL-21, IL-22, IL-23, IL-27 і IL-31;
(c) хемокіни, вибрані з-посеред МІР1-альфа, МІР1-бета, RANTES, MCP1, IP-10, ІТАС, MIG, SDF та фракталкіну.
19. Спосіб зниження експресії МНС класу II на клітині, який включає введення в контакт клітини з антитілом за п. 1 у кількості, достатній для зниження експресії МНС класу II на згаданій клітині.
20. Спосіб за п. 19, який відрізняється тим, що згаданою клітиною є клітина меланоми людини.
21. Спосіб за п. 19, який відрізняється тим, що згадане антитіло містить VH CDR1 ділянку, що містить амінокислотну послідовність SYAMS (Послідовність № 3); VH CDR2 ділянку, що містить амінокислотну послідовність AISGSGGSTYYADSVKG (Послідовність № 4), VH CDR3 ділянку, що містить амінокислотну послідовність DGSSGWYVPHWFDP (Послідовність № 5); VL CDR1 ділянку, що містить амінокислотну послідовність TRSSGSIASNYVQ (Послідовність № 8); VL CDR2 ділянку, що містить амінокислотну послідовність EDNQRPS (Послідовність № 9), і VL CDR3 ділянку, що містить амінокислотну послідовність QSYDGSNRWM (Послідовність № 10).
22. Спосіб за п. 21, який відрізняється тим, що згаданим антитілом є NI-0501.
23. Спосіб за п. 19, який відрізняється тим, що згадану клітину вводять у контакт із другим агентом, вибраним з групи, яку складають:
(а) антицитокін, що розпізнає один або декілька цитокінів, вибраних з-посеред інтерлейкіну 1 (IL-1), IL-2, IL-4, IL-6, IL-12, IL-13, IL-15, IL-17, IL-18, IL-20, IL-21, IL-22, IL-23, IL-27 і IL-31;
(b) антихемокінний реагент, що розпізнає один або декілька цитокінів, вибраних з-посеред IL-1, IL-2, IL-4, IL-6, IL-12, IL-13, IL-15, IL-17, IL-18, IL-20, IL-21, IL-22, IL-23, IL-27 і IL-31;
(c) хемокіни, вибрані з-посеред МІР1-альфа, МІР1-бета, RANTES, MCP1, IP-10, ІТАС, MIG, SDF тa фракталкіну.
Текст
1. Виділене повністю людське моноклональне анти-IFN антитіло або його фрагмент, яке містить: (a) VH CDR1 ділянку, що містить амінокислотну послідовність SYAMS (Послідовність № 3) або SNAMS (Послідовність № 43); (b) VH CDR2 ділянку, що містить амінокислотну послідовність AISGSGGSTYYADSVKG (Послідовність № 4) або TLTGSGGTAYYADSVEG (Послідовність № 44), та (c) VH CDR3 ділянку, що містить амінокислотну послідовність, вибрану з групи, яку складають DGSSGWYVPHWFDP (Послідовність № 5); DHSSGWYVISGMDV (Послідовність № 13); DLTVGGPWYYFDY (Послідовність № 21); DGWNALGWLES (Послідовність № 29); GTELVGGGLDN (Послідовність № 45); RSFDSGGSFEY (Послідовність № 64); 2 (19) 1 3 92337 4 вність DGSSGWYVPHWFDP (Послідовність № 5); (Послідовність № 8); VL CDR2 ділянку, що містить VL CDR1 ділянку, що містить амінокислотну посліамінокислотну послідовність EDNQRPS (Послідодовність TRSSGSIASNYVQ (Послідовність № 8); вність № 9), і VL CDR3 ділянку, що містить аміноVL CDR2 ділянку, що містить амінокислотну послікислотну послідовність QSYDGSNRWM (Послідодовність EDNQRPS (Послідовність № 9), і VL CDR3 вність № 10). 15. Спосіб за п. 14, який відрізняється тим, що ділянку, що містить амінокислотну послідовність QSYDGSNRWM (Послідовність № 10). згаданим антитілом є NI-0501. 5. Антитіло за п. 1, яке являє собою NI-0501. 16. Спосіб за п. 12, причому згадане автоімунне 6. Виділене повністю людське моноклональне анзахворювання або запальний розлад вибраний з титіло, яке містить амінокислотну послідовність групи, яку складають хвороба Крона, системний варіабельної ділянки важкого ланцюга, вибрану з червоний вовчак, псоріаз, ревматоїдний артрит, групи, яку складають Послідовність № 2, Послідоваскуліт, атопічний дерматит і вторинний прогревність № 12, Послідовність № 20, Послідовність № суючий розсіяний склероз. 17. Спосіб за п. 12, який відрізняється тим, що 28, Послідовність № 36, Послідовність № 42, Послідовність № 51, Послідовність № 58, Послідовзгадане антитіло вводять внутрішньовенним шляність № 63, Послідовність № 68, Послідовність № хом. 18. Спосіб за п. 12, який відрізняється тим, що 75, Послідовність № 81, Послідовність № 88, Послідовність № 94 та Послідовність № 103, причому згадане антитіло вводять одночасно з другим агентом, вибраним з групи, яку складають: згадане антитіло зв'язує IFN. (a) антицитокін, що розпізнає один або декілька 7. Антитіло за п. 6, яке додатково містить амінокицитокінів, вибраних з-посеред інтерлейкіну 1 (IL-1), слотну послідовність варіабельної ділянки легкого IL-2, IL-4, IL-6, IL-12, IL-13, IL-15, IL-17, IL-18, IL-20, ланцюга, вибрану з групи, яку складають ПослідоIL-21, IL-22, IL-23, IL-27 і IL-31; вність № 7, Послідовність № 15, Послідовність № (b) антихемокінний реагент, що розпізнає один або 23, Послідовність № 31, Послідовність № 38, Посдекілька цитокінів, вибраних з-посеред IL-1, IL-2, лідовність № 47, Послідовність № 54, ПослідовIL-4, IL-6, IL-12, IL-13, IL-15, IL-17, IL-18, IL-20, ILність № 60, Послідовність № 66, Послідовність № 21, IL-22, IL-23, IL-27 і IL-31; 71, Послідовність № 78, Послідовність № 83, Пос(c) хемокіни, вибрані з-посеред МІР1-альфа, МІР1лідовність № 91, Послідовність № 96 та Послідовбета, RANTES, MCP1, IP-10, ІТАС, MIG, SDF та ність № 105, причому згадане антитіло зв'язує фракталкіну. IFN. 19. Спосіб зниження експресії МНС класу II на клі8. Антитіло за п. 7, яке містить VH CDR1 ділянку, тині, який включає введення в контакт клітини з що містить амінокислотну послідовність SYAMS антитілом за п. 1 у кількості, достатній для зни(Послідовність № 3); VH CDR2 ділянку, що містить ження експресії МНС класу II на згаданій клітині. амінокислотну послідовність 20. Спосіб за п. 19, який відрізняється тим, що AISGSGGSTYYADSVKG (Послідовність № 4), VH згаданою клітиною є клітина меланоми людини. CDR3 ділянку, що містить амінокислотну послідо21. Спосіб за п. 19, який відрізняється тим, що вність DGSSGWYVPHWFDP (Послідовність № 5); згадане антитіло містить VH CDR1 ділянку, що місVL CDR1 ділянку, що містить амінокислотну послітить амінокислотну послідовність SYAMS (Послідовність TRSSGSIASNYVQ (Послідовність № 8); довність № 3); VH CDR2 ділянку, що містить аміноVL CDR2 ділянку, що містить амінокислотну послікислотну послідовність AISGSGGSTYYADSVKG довність EDNQRPS (Послідовність № 9), і VL CDR3 (Послідовність № 4), VH CDR3 ділянку, що містить ділянку, що містить амінокислотну послідовність амінокислотну послідовність DGSSGWYVPHWFDP QSYDGSNRWM (Послідовність № 10). (Послідовність № 5); VL CDR1 ділянку, що містить 9. Антитіло за п. 4, яке має ізотип IgG. амінокислотну послідовність TRSSGSIASNYVQ 10. Фармацевтична композиція, що містить антиті(Послідовність № 8); VL CDR2 ділянку, що містить ло за п. 1 і носій. амінокислотну послідовність EDNQRPS (Послідо11. Фармацевтична композиція, що містить антитівність № 9), і VL CDR3 ділянку, що містить аміноло за п. 4 і носій. кислотну послідовність QSYDGSNRWM (Послідо12. Спосіб полегшення інтенсивності симптому вність № 10). автоімунного захворювання або запального роз22. Спосіб за п. 21, який відрізняється тим, що ладу, який включає введення антитіла за п. 1 сузгаданим антитілом є NI-0501. б'єкту, який цього потребує, у кількості, достатній 23. Спосіб за п. 19, який відрізняється тим, що для полегшення інтенсивності симптому автоімунзгадану клітину вводять у контакт із другим агенного захворювання або запального розладу у згатом, вибраним з групи, яку складають: даного суб’єкта. (а) антицитокін, що розпізнає один або декілька 13. Спосіб за п. 12, причому згаданим суб'єктом є цитокінів, вибраних з-посеред інтерлейкіну 1 (IL-1), людина. IL-2, IL-4, IL-6, IL-12, IL-13, IL-15, IL-17, IL-18, IL-20, 14. Спосіб за п. 12, який відрізняється тим, що IL-21, IL-22, IL-23, IL-27 і IL-31; згадане антитіло містить VH CDR1 ділянку, що міс(b) антихемокінний реагент, що розпізнає один або тить амінокислотну послідовність SYAMS (Послідекілька цитокінів, вибраних з-посеред IL-1, IL-2, довність № 3); VH CDR2 ділянку, що містить аміноIL-4, IL-6, IL-12, IL-13, IL-15, IL-17, IL-18, IL-20, ILкислотну послідовність AISGSGGSTYYADSVKG 21, IL-22, IL-23, IL-27 і IL-31; (Послідовність № 4), VH CDR3 ділянку, що містить (c) хемокіни, вибрані з-посеред МІР1-альфа, МІР1амінокислотну послідовність DGSSGWYVPHWFDP бета, RANTES, MCP1, IP-10, ІТАС, MIG, SDF тa (Послідовність № 5); VL CDR1 ділянку, що містить фракталкіну. амінокислотну послідовність TRSSGSIASNYVQ 5 Галузь техніки, до якої належить винахід Цей винахід, взагалі, має відношення до повністю людських антитіл проти гамма-інтерферону, а також до способів їх застосування. Передумови створення винаходу Людський гамма-інтерферон (IFN, гамма-IFN) являє собою лімфокін, що продукується активованими Т-лімфоцитами і природними клітинамикілерами. Він демонструє антипроліферативні, противірусні та імуномодуляторні активності і зв'язується з IFN-R (рецептор гамма-інтерферону), гетеродимерним рецептором на більшості ембріональних клітин імунної системи та ініціює певну послідовність реакцій, наслідком яких є запалення. Відомо, що противірусна та імуномодуляторна активність IFN відіграє благотворні ефекти у цілому ряді клінічних станів. Існує однак багато клінічних обставин, за яких, як відомо, наслідком активності IFN є шкідливі ефекти. Наприклад, автоімунні захворювання асоціюються з високими рівнями IFN у крові та хворій тканині від автоімунних хворих. Активність IFN пов'язується також із такими хворобливими станами як кахексія та септичний шок. Таким чином, існує потреба у лікарських засобах, спрямованих проти активності IFN. Суть винаходу Цей винахід пропонує повністю людські моноклональні антитіла, конкретно спрямовані проти гамма-інтерферону (IFN, який у цьому описі згадується також як гамма-інтерферон). До числа типових моноклональних антитіл, опис яких наведено у цьому описі, належать: NI-0501; AC1.2R3P2_A6 (яке у цьому описі згадується також як "А6"); AC1.2R3P2_B4 (яке у цьому описі згадується також як "В4"); AD1.4R4P1_B9 (яке у цьому описі згадується також як "В9"); AD1.4R4P2_C9 (яке у цьому описі згадується також як "С9"); AC1.4R4P2_C10 (яке у цьому описі згадується також як "С10"); AC1.2R3P7_D3 (яке у цьому описі згадується також як "D3"); AD1.2R2P2_D6 (яке у цьому описі згадується також як "D6"); AC1.2R2P2_D8 (яке у цьому описі згадується також як "D8"); AD1.3R3P6_E1 (яке у цьому описі згадується також як "Е1"); AD1.3R3P5_F8 (яке у цьому описі згадується також як "F8"); AD1.3R3P6_F9 (яке у цьому описі згадується також як "F9"); AD1.4R4P2_G7 (яке у цьому описі згадується також як "G7"); AD1.1R3P3_G9 (яке у цьому описі згадується також як "G9"); та AD1.3R3P6_G10 (яке у цьому описі згадується також як "G10"). За альтернативним варіантом, моноклональним антитілом є антитіло, що зв'язується з тією самою антигенною детермінантою, що й NI-0501; AC1.2R3P2_B4; AD1.4R4P1_B9; AD1.4R4P2_C9; AC1.4R4P2_C10; AC1.2R3P7_D3; AD1.2R2P2_D6; AC1.2R2P2_D8; AD1.3R3P6_E1; AD1.3R3P5_F8; AD1.3R3P6_F9; AD1.4R4P2_G7; AD1.1R3P3_G9 або ADL3R3P6_G1O. Наведені вище антитіла у цьому описі згадуються, відповідно, як huIFN антитіла (людські антитіла проти 92337 6 гамма-інтерферону). huIFN антитіло містить варіабельну ділянку важкого ланцюга, що має амінокислотну послідовність із числа Послідовностей № 2, № 12, № 20, № 28, № 36, № 42, № 51, № 58, № 63, № 68, № 75, № 81, № 88, № 94 або № 103 та варіабельну ділянку легкого ланцюга, що має амінокислотну послідовність з числа Послідовностей № 7, № 15, № 23, № 31, № 38, № 47, № 54, № 60, № 66, № 71, № 78, № 83, № 91, № 96 або № 105. За варіантом, якому віддають перевагу, три гіперваріабельні ділянки (CDR) важкого ланцюга містять амінокислотну послідовність, яка є щонайменше на 90%, 92%, 95%, 97%, 98%, 99% або більше ідентичною до послідовності, вибраної з групи, до яку складають SYAMS (Послідовність № 3); AISGSGGSTYYADSVKG (Послідовність № 4); DGSSGWYVPHWFDP (Послідовність № 5); DHSSGWYVISGMDV (Послідовність № 13); DLTVGGPWYYFDY (Послідовність № 21); DGWNALGWLES (Послідовність № 29); SNAMS (Послідовність № 43); TLTGSGGTAYYADSVEG (Послідовність № 44); GTELVGGGLDN (Послідовність №45); RSFDSGGSFEY (Послідовність № 64); VGSWYLEDFDI (Послідовність № 69); GGNYGDYFDYFDY (Послідовність № 76) та DFWVITSGNDY (Послідовність № 89); і легкий ланцюг із трьома гіперваріабельними ділянками, що містять амінокислотну послідовність, яка є щонайменше на 90%, 92%, 95%, 97%, 98%, 99% або більше ідентичною до послідовності, вибраної з групи, яку складають амінокислотна послідовність TRSSGSIASNYVQ (Послідовність № 8); EDNQRPS (Послідовність № 9); QSYDGSNRWM (Послідовність № 10); TRSSGSIASNYVQ (Послідовність № 16); EDNQRPS (Послідовність № 17); QSNDSDNW (Послідовність № 18); DDDQRPS (Послідовність № 25); QSYDSSNW (Послідовність № 26); TRSGGSIGSYYVQ (Послідовність № 32); DDKKRPS (Послідовність № 33); QSYDSNNLW (Послідовність № 34); TRSSGTIASNYVQ (Послідовність № 39); QSYDNSNHWV (Послідовність № 40); TGSGGSIATNYVQ (Послідовність № 48); QSYDSDNHHW (Послідовність № 49); TGSSGSIASNYVQ (Послідовність № 55); QSYDSSNQEW (Послідовність № 56); QSYDSNNFWV (Послідовність № 61); TRSSGSIASNYVH (Послідовність №72); QSSDTTYHGGW (Послідовність № 73); QSYEGF (Послідовність № 79); TGRNGNIASNYVQ (Послідовність № 84); EDTQRPS (Послідовність № 85); QSSDSNRVL (Послідовність № 86); QSFDSTNLW (Послідовність № 92); AGSSGSIASNYVQ (Послідовність № 97); QSYSYNNQW (Послідовність № 98); TRSSGSIVSNYVQ (Послідовність № 106); EDNRRPS (Послідовність № 107). Згадане антитіло зв'язує IFN. До складу huIFN антитіл за цим винаходом входить VH CDR1 (гіперваріабельна ділянка 1 важкого ланцюга), що містить амінокислотну послідовність SYAMS (Послідовність № 3) або SNAMS (Послідовність № 43); VH CDR2, що містить аміно 7 92337 8 кислотну послідовність AISGSGGSTYYADSVKG послідовність, вибрану з групи, яку складають (Послідовність № 4) або TLTGSGGTAYYADSVEG DGSSGWYVPHWFDP (Послідовність № 5); (Послідовність № 44), та VH CDR3, що містить аміDHSSGWYVISGMDV (Послідовність № 13); нокислотну послідовність, вибрану з групи, яку DLTVGGPWYYFDY (Послідовність № 21); складають DGSSGWYVPHWFDP (Послідовність № DGWNALGWLES (Послідовність № 29); 5); DHSSGWYVISGMDV (Послідовність № 13); GTELVGGGLDN (Послідовність № 45); DLTVGGPWYYFDY (Послідовність № 21); RSFDSGGSFEY (Послідовність № 64); DGWNALGWLES (Послідовність № 29); VGSWYLEDFDI (Послідовність № 69); GTELVGGGLDN (Послідовність № 45); GGNYGDYFDYFDY (Послідовність № 76) та RSFDSGGSFEY (Послідовність № 64); DFWVITSGNDY (Послідовність № 89); VL CDR1, VGSWYLEDFDI (Послідовність № 69); що містить амінокислотну послідовність, вибрану з GGNYGDYFDYFDY (Послідовність № 76) та групи, яку складають TRSSGSIASNYVQ (ПослідоDFWVITSGNDY (Послідовність № 89). вність № 8); TRSSGSIASNYVQ (Послідовність № 16); TRSGGSIGSYYVQ (Послідовність № 32); До складу huIFN антитіл входить VL CDR1 (гіTRSSGTIASNYVQ (Послідовність № 39); перваріабельна ділянка 1 легкого ланцюга), що TGSGGSIATNYVQ (Послідовність № 48); містить амінокислотну послідовність, вибрану з TGSSGSIASNYVQ (Послідовність № 55); групи, яку складають TRSSGSIASNYVQ (ПослідоTRSSGSIASNYVH (Послідовність № 72); вність № 8); TRSSGSIASNYVQ (Послідовність № TGRNGNIASNYVQ (Послідовність № 84); 16); TRSGGSIGSYYVQ (Послідовність № 32); AGSSGSIASNYVQ (Послідовність № 97) і TRSSGTIASNYVQ (Послідовність № 39); TRSSGSIVSNYVQ (Послідовність № 106); VL TGSGGSIATNYVQ (Послідовність № 48); CDR2, що містить амінокислотну послідовність, TGSSGSIASNYVQ (Послідовність № 55); вибрану з групи, яку складають EDNQRPS (ПосліTRSSGSIASNYVH (Послідовність № 72); довність № 9); EDNQRPS (Послідовність № 17); TGRNGNIASNYVQ (Послідовність № 84); DDDQRPS (Послідовність № 25); DDKKRPS (ПосAGSSGSIASNYVQ (Послідовність № 97) та лідовність № 33); EDTQRPS (Послідовність № 85) TRSSGSIVSNYVQ (Послідовність № 106); VL та EDNRRPS (Послідовність № 107); і VL CDR3, CDR2, що містить амінокислотну послідовність, що містить амінокислотну послідовність, вибрану з вибрану з групи, яку складають EDNQRPS (Послігрупи, яку складають QSYDGSNRWM (Послідовдовність № 9); EDNQRPS (Послідовність № 17); ність № 10); QSNDSDNW (Послідовність № 18); DDDQRPS (Послідовність № 25); DDKKRPS (ПосQSYDSSNW (Послідовність № 26); QSYDSNNLW лідовність № 33); EDTQRPS (Послідовність № 85) (Послідовність № 34); QSYDNSNHWV (Послідовта EDNRRPS (Послідовність № 107); і VL CDR3, ність № 40); QSYDSDNHHW (Послідовність № 49); що містить амінокислотну послідовність, вибрану з QSYDSSNQEW (Послідовність № 56); групи, яку складають QSYDGSNRWM (ПослідовQSYDSNNFWV (Послідовність № 61); ність № 10); QSNDSDNW (Послідовність № 18); QSSDTTYHGGW (Послідовність № 73); QSYEGF QSYDSSNW (Послідовність № 26); QSYDSNNLW (Послідовність № 79); QSSDSNRVL (Послідовність (Послідовність № 34); QSYDNSNHWV (Послідов№ 86); QSFDSTNLW (Послідовність № 92) і ність № 40); QSYDSDNHHW (Послідовність № 49); QSYSYNNQW (Послідовність № 98). QSYDSSNQEW (Послідовність № 56); Важкий ланцюг huIFN антитіла одержують з QSYDSNNFWV (Послідовність № 61); QSSDTTYHGGW (Послідовність № 73); QSYEGF V-гена (ген варіабельної ділянки имуноглобуліну) (Послідовність № 79); QSSDSNRVL (Послідовність зародкової лінії, наприклад, гена зародкової лінії № 86); QSFDSTNLW (Послідовність № 92) та DP47 (IGHV3-23) (номер депонування GenBank QSYSYNNQW (Послідовність № 98). M99660) або нуклеїновокислотної послідовності, гомологічної до послідовності людського гена заДо складу huIFN антитіл входить, наприклад, родкової лінії DP47. Нуклеїновокислотна послідовVH CDR1, що містить амінокислотну послідовність ність гена зародкової лінії DP47 (IGHV3-23) вклюSYAMS (Послідовність № 3) або SNAMS (Послідочає, наприклад, нуклеїновокислотну послідовність, вність № 43); VH CDR2, що містить амінокислотну наведену нижче: послідовність AISGSGGSTYYADSVKG (Послідовність №4) або TLTGSGGTAYYADSVEG (Послідовність № 44); VH CDR3, що містить амінокислотну Легкий ланцюг huIFN антитіла одержують із гена варіабельної ділянки легкого ланцюга лямбда імуноглобуліну зародкової лінії, наприклад, IGLV6-57 або V1-22 (номер депонування GenBank Z73673) або нуклеїновокислотної послі довності, гомологічної до послідовності людського гена зародкової лінії IGLV6-57. Нуклеїновокислотна послідовність гена зародкової лінії IGLV657 включає, наприклад, нуклеїновокислотну послідовність, наведену нижче: 9 За іншим аспектом, винахід пропонує способи лікування, запобігання або полегшення інтенсивності симптому імунопатологічного захворювання шляхом введення суб'єкту huIFN антитіла. Наприклад, huIFN антитіла застосовують для лікування, запобігання або полегшення інтенсивності симптому, пов'язаного з імунопатологічними захворюваннями, наприклад, хворобою Крону, системним червоним вовчаком, псоріазом, саркоїдозом, ревматоїдним артритом, васкулітом, атопічним дерматитом і вторинним прогресуючим розсіяним склерозом. За факультативним варіантом, суб'єкту додатково вводять другий агент, наприклад (але без обмеження), антицитокінний або антихемокінний реагент, який розпізнає цитокіни, наприклад, інтерлейкін 1 (IL-1), IL-2, IL-4, IL-6, IL-12, IL-13, IL15, IL-17, IL-18, IL-20, IL-21, IL-22, IL-23, IL-27 і IL31 та/або хемокіни, наприклад, МІР1-альфа, МІР1бета, RANTES, MCP1, ІР-10, ІТАС, MIG, SDF та фракталкін. Згаданий суб'єкт страждає на або є схильним до розвитку імунопатологічного захворювання, наприклад, автоімунного захворювання або запального розладу. Короткий опис фігур Фіг. 1 являє собою ряд зображень нуклеотидної послідовності і амінокислотних послідовностей варіабельних ділянок легкого ланцюга і варіабельних ділянок важкого ланцюга huIFN антитіл NI0501 та AC1.2R3P2_A6. На Фіг. 1А зображена нуклеотидна послідовність, що кодує варіабельну ділянку важкого ланцюга NI-0501; на Фіг. 1В зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 1А. На Фіг. 1В підкреслені гіперваріабельні ділянки (CDR). На Фіг. 1С зображена нуклеотидна послідовність, що кодує варіабельну ділянку легкого ланцюга NI-0501; на Фіг. 1D зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 1С. На Фіг. 1D підкреслені гіперваріабельні ділянки. На Фіг. 1E зображена нуклеотидна послідовність, що кодує варіабельну ділянку важкого ланцюга AC1.2R3P2_A6; на Фіг. 1F зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 1E. На Фіг. 1F підкреслені гіперваріабельні ділянки (CDR). На Фіг. 1G зображена нуклеотидна послідовність, що кодує варіабельну ділянку легкого ланцюга AC1.2R3P2_A6; на Фіг. 1H зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 1G. На Фіг. 1Н підкреслені гіперваріабельні ділянки. Фіг. 2 являє собою ряд зображень нуклеотидної послідовності і амінокислотних послідовностей варіабельних ділянок легкого ланцюга і варіабельних ділянок важкого ланцюга huIFN антитіла 92337 10 AC1.2R3P2_B4. На Фіг. 2А зображена нуклеотидна послідовність, що кодує варіабельну ділянку важкого ланцюга; на Фіг. 2В зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 2А. На Фіг. 2В підкреслені гіперваріабельні ділянки. На Фіг. 2С зображена нуклеотидна послідовність, що кодує варіабельну ділянку легкого ланцюга; на Фіг. 2D зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 2С. На Фіг. 2D підкреслені гіперваріабельні ділянки. Фіг. 3 являє собою ряд зображень нуклеотидної послідовності і амінокислотних послідовностей варіабельних ділянок легкого ланцюга і варіабельних ділянок важкого ланцюга huIFN антитіла AD1.4R4P1_B9. На Фіг. 3А зображена нуклеотидна послідовність, що кодує варіабельну ділянку важкого ланцюга; на Фіг. 3В зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 3А. На Фіг. 3В підкреслені гіперваріабельні ділянки. На Фіг. 3С зображена нуклеотидна послідовність, що кодує варіабельну ділянку легкого ланцюга; на Фіг. 3D зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 3С. На Фіг. 3D підкреслені гіперваріабельні ділянки. Фіг. 4 являє собою ряд зображень нуклеотидної послідовності і амінокислотних послідовностей варіабельних ділянок легкого ланцюга і варіабельних ділянок важкого ланцюга huIFN антитіла AD1.4R4P2_C9. На Фіг. 4А зображена нуклеотидна послідовність, що кодує варіабельну ділянку важкого ланцюга; на Фіг. 4В зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 4А. На Фіг. 4В підкреслені гіперваріабельні ділянки. На Фіг. 4С зображена нуклеотидна послідовність, що кодує варіабельну ділянку легкого ланцюга; на Фіг. 4D зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 4С. На Фіг. 4D підкреслені гіперваріабельні ділянки. Фіг. 5 являє собою ряд зображень нуклеотидної послідовності і амінокислотних послідовностей варіабельних ділянок легкого ланцюга і варіабельних ділянок важкого ланцюга huIFN антитіла AC1.4R4P2_C10. На Фіг. 5А зображена нуклеотидна послідовність, що кодує варіабельну ділянку важкого ланцюга; на Фіг. 5В зображена амінокислотна послідовність, що кодується нуклеотидною послідовністю, зображеною на Фіг. 5А. На Фіг. 5В підкреслені гіперваріабельні ділянки. На Фіг. 5С зображена нуклеотидна послідовність, що кодує варіабельну ділянку легкого ланцюга; на Фіг. 5D зображена амінокислотна послідовність, що коду 11 92337 12 ється нуклеотидною послідовністю, зображеною ділянки. на Фіг. 5С. На Фіг. 5D підкреслені гіперваріабельні Фіг. 10 являє собою ряд зображень нуклеотиділянки. дної послідовності і амінокислотних послідовносФіг. 6 являє собою ряд зображень нуклеотидтей варіабельних ділянок легкого ланцюга і варіаної послідовності і амінокислотних послідовностей бельних ділянок важкого ланцюга huIFN антитіла варіабельних ділянок легкого ланцюга і варіабельAD1.3R3P5_F8. На Фіг. 10А зображена нуклеотидних ділянок важкого ланцюга huIFN антитіла на послідовність, що кодує варіабельну ділянку AC1.2R3E7_D3. На Фіг. 6А зображена нуклеотидна важкого ланцюга; на Фіг. 10В зображена амінокиспослідовність, що кодує варіабельну ділянку важлотна послідовність, що кодується нуклеотидною кого ланцюга; на Фіг. 6В зображена амінокислотна послідовністю, зображеною на Фіг. 10А. На Фіг. послідовність, що кодується нуклеотидною послі10В підкреслені гіперваріабельні ділянки. На Фіг. довністю, зображеною на Фіг. 6А. На Фіг. 6В підк10С зображена нуклеотидна послідовність, що реслені гіперваріабельні ділянки. На Фіг. 6С зокодує варіабельну ділянку легкого ланцюга; на Фіг. бражена нуклеотидна послідовність, що кодує 10D зображена амінокислотна послідовність, що варіабельну ділянку легкого ланцюга; на Фіг. 6D кодується нуклеотидною послідовністю, зображезображена амінокислотна послідовність, що кодуною на Фіг. 10С. На Фіг. 10D підкреслені гіперваріється нуклеотидною послідовністю, зображеною абельні ділянки. на Фіг. 6С. На Фіг. 6D підкреслені гіперваріабельні Фіг. 11 являє собою ряд зображень нуклеотиділянки. дної послідовності і амінокислотних послідовносФіг. 7 являє собою ряд зображень нуклеотидтей варіабельних ділянок легкого ланцюга і варіаної послідовності і амінокислотних послідовностей бельних ділянок важкого ланцюга huIFN антитіла варіабельних ділянок легкого ланцюга і варіабельAD1.3R3P6_F9. На Фіг. 11А зображена нуклеотидних ділянок важкого ланцюга hulFN антитіла на послідовність, що кодує варіабельну ділянку AD1.2R2P2_D6. На Фіг. 7 А зображена нуклеотидважкого ланцюга; на Фіг. 11В зображена амінокисна послідовність, що кодує варіабельну ділянку лотна послідовність, що кодується нуклеотидною важкого ланцюга; на Фіг. 7В зображена амінокиспослідовністю, зображеною на Фіг. 11А. На Фіг. лотна послідовність, що кодується нуклеотидною 11В підкреслені гілерваріабельні ділянки. На Фіг. послідовністю, зображеною на Фіг. 7А. На Фіг. 7В 11С зображена нуклеотидна послідовність, що підкреслені гіперваріабельні ділянки. На Фіг. 7С кодує варіабельну ділянку легкого ланцюга; на Фіг. зображена нуклеотидна послідовність, що кодує 11D зображена амінокислотна послідовність, що варіабельну ділянку легкого ланцюга; на Фіг. 7D кодується нуклеотидною послідовністю, зображезображена амінокислотна послідовність, що кодуною на Фіг. 11С. На Фіг. 11D підкреслені гіперваріється нуклеотидною послідовністю, зображеною абельні ділянки. на Фіг. 7С. На Фіг. 7D підкреслені гіперваріабельні Фіг. 12 являє собою ряд зображень нуклеотиділянки. дної послідовності і амінокислотних послідовносФіг. 8 являє собою ряд зображень нуклеотидтей варіабельних ділянок легкого ланцюга і варіаної послідовності і амінокислотних послідовностей бельних ділянок важкого ланцюга huIFN антитіла варіабельних ділянок легкого ланцюга і варіабельAD1.4R4P2_G7. На Фіг. 12А зображена нуклеотидних ділянок важкого ланцюга huIFN антитіла на послідовність, що кодує варіабельну ділянку AC1.2R2P2_D8. На Фіг. 8А зображена нуклеотидна важкого ланцюга; на Фіг. 12В зображена амінокиспослідовність, що кодує варіабельну ділянку важлотна послідовність, що кодується нуклеотидною кого ланцюга; на Фіг. 8В зображена амінокислотна послідовністю, зображеною на Фіг. 12А. На Фіг. послідовність, що кодується нуклеотидною послі12В підкреслені гіперваріабельні ділянки. На Фіг. довністю, зображеною на Фіг. 8А. На Фіг. 8В підк12С зображена нуклеотидна послідовність, що реслені гіперваріабельні ділянки. На Фіг. 8С зокодує варіабельну ділянку легкого ланцюга; на Фіг. бражена нуклеотидна послідовність, що кодує 12D зображена амінокислотна послідовність, що варіабельну ділянку легкого ланцюга; на Фіг. 8D кодується нуклеотидною послідовністю, зображезображена амінокислотна послідовність, що кодуною на Фіг. 12С. На Фіг. 12D підкреслені гіперваріється нуклеотидною послідовністю, зображеною абельні ділянки. на Фіг. 8С. На Фіг. 8D підкреслені гіперваріабельні Фіг. 13 являє собою ряд зображень нуклеотиділянки. дної послідовності і амінокислотних послідовносФіг. 9 являє собою ряд зображень нуклеотидтей варіабельних ділянок легкого ланцюга і варіаної послідовності і амінокислотних послідовностей бельних ділянок важкого ланцюга huIFN антитіла варіабельних ділянок легкого ланцюга і варіабельAD1.1R3P3_G9. На Фіг. 13А зображена нуклеотидних ділянок важкого ланцюга huIFN антитіла на послідовність, що кодує варіабельну ділянку AD1.3R3P6_E1. На Фіг. 9А зображена нуклеотидна важкого ланцюга; на Фіг. 13В зображена амінокиспослідовність, що кодує варіабельну ділянку важлотна послідовність, що кодується нуклеотидною кого ланцюга; на Фіг. 9В зображена амінокислотна послідовністю, зображеною на Фіг. 13А. На Фіг. послідовність, що кодується нуклеотидною послі13В підкреслені гіперваріабельні ділянки. На Фіг. довністю, зображеною на Фіг. 9А. На Фіг. 9В підк13С зображена нуклеотидна послідовність, що реслені гіперваріабельні ділянки. На Фіг. 9С зокодує варіабельну ділянку легкого ланцюга; на Фіг. бражена нуклеотидна послідовність, що кодує 13D зображена амінокислотна послідовність, що варіабельну ділянку легкого ланцюга; на Фіг. 9D кодується нуклеотидною послідовністю, зображезображена амінокислотна послідовність, що кодуною на Фіг. 13С. На Фіг. 13D підкреслені гіперваріється нуклеотидною послідовністю, зображеною абельні ділянки. на Фіг. 9С. На Фіг. 9D підкреслені гіперваріабельні Фіг. 14 являє собою ряд зображень нуклеоти 13 92337 14 дної послідовності і амінокислотних послідовносмакак-крабоїдів. тей варіабельних ділянок легкого ланцюга і варіаНа Фіг. 23 зображено графік, який відображає бельних ділянок важкого ланцюга huIFN антитіла здатність huIFN антитіла NI-0501 до блокування AD1.3R3P6_G10. На Фіг. 14А зображена нуклеотиіндукованого IFN продукування IP-10 у цільній дна послідовність, що кодує варіабельну ділянку крові. важкого ланцюга; на Фіг. 14В зображена амінокисДокладний опис лотна послідовність, що кодується нуклеотидною Цей винахід пропонує повністю людські монопослідовністю, зображеною на Фіг. 14А. На Фіг. клональні антитіла, конкретно спрямовані проти 14В підкреслені гіперваріабельні ділянки. На Фіг. гамма-інтерферону (IFN). Антитілами, які сукупно 14С зображена нуклеотидна послідовність, що згадуються у цьому описі, є huIFN антитіла. кодує варіабельну ділянку легкого ланцюга; на Фіг. huIFN антитіла є, наприклад антагоністами 14D зображена амінокислотна послідовність, що або інгібіторами IFN, які модулюють щонайменше кодується нуклеотидною послідовністю, зображеодну біологічну активність IFN. Біологічні активноною на Фіг. 14С. На Фіг. 14D підкреслені гілерварісті IFN включають, наприклад, зв'язування рецепабельні ділянки. тора IFN (IFN-R), модулювання, наприклад, Фіг. 15 являє собою графік, який відображає ослаблення або пригнічення експресії головного пригнічення експресії репортерного гена, індукокомплексу гістосумісності (МНС) класу II на поверваного IFN, за допомогою екстрактів периплазмахні клітин і модулювання, наприклад, ослаблення тичного scFv. Кількісно визначені екстракти scFv або пригнічення, проліферації клітин. Наприклад, пригнічували індукований IFN репортерний ген huIFN антитіла повністю або частково пригнічують дозозалежним чином. Для кожного клону scFv буактивність IFN шляхом часткового або повного ли випробувані різні концентрації (2,7 нМ, 0,68 нМ, блокування зв'язування IFN і рецептора IFN 0,17 нМ, 0,043 нМ та 0,011 нМ), як показано стовп(IFN-R). Вважається, що IFN антитіла повністю чиками над назвою кожного клону (концентрація пригнічують активність IFN у тому разі, коли різменшується зліва направо, дивись також наведевень активності IFN за присутності huIFN антитіну нижче Таблицю 3). ла знижується щонайменше на 95%, наприклад, Фіг. 16 являє собою зображення ряду графіків на 96%, 97%, 98%, 99% або 100%, порівняно з 1-12, що відображають пригнічення експресії індурівнем активності IFN за відсутності зв'язування з кованого IFN MHC (головний комплекс гістосумісhuIFN антитілом, опис якого наведено. Вважаєтьності) класу II на клітинах меланоми за допомогою ся, що IFN антитіла частково пригнічують активекстрактів scFv. Очищений повністю людський ність IFN у тому разі, коли рівень активності IFN scFv пригнічував експресію індукованого IFN MHC за присутності huIFN антитіла знижується менше II на клітинах меланоми. Зображені клони scFv (— ніж на 95%, наприклад, на 10%, 20%, 25%, 30%, ——) і мишачого mAb (моноклонального антитіла) 40%, 50%, 60%, 75%, 80%, 85% або 90%, порівня16С3 проти людського IFN (---). но з рівнем активності IFN за відсутності зв'язуФіг. 17 являє собою зображення ряду графіків 1-7, що відображають пригнічення експресії індування з huIFN антитілом, опис якого наведено. кованого IFN MHC класу II на клітинах меланоми На додаток до цього, huIFN антитіла за цим за допомогою екстрактів scFv, формат яких було винаходом пригнічують індуковану IFN експресію змінено на каркас повністю людського IgG. ОчиМНС класу II на клітинах (дивись, наприклад, Прищені моноклональні антитіла проти повністю людклад 4 і Приклад 5). За варіантом, якому віддають ського IgG пригнічували експресію індукованого перевагу, huIFN антитіла демонструють більше за IFN MHC II на клітинах меланоми. Зображені кло50% пригнічення індукованої IFN експресії МНС ни повністю людського IgG (-х-), мишачого mAb класу II у лінії клітин меланоми людини Ме67.8 при 16C3 проти людського IFN (-▲-) і мишачого моноконцентрації щонайменше 0,02 нМ. Наприклад, клонального антитіла МАВ285 проти людського згадані антитіла демонструють більше за 50% приIFN (фірма R&D Systems, Inc., Міннеаполіс, штат гнічення індукованої IFN експресії МНС класу II у Міннесота) (--). лінії клітин Ме67.8 при концентрації у межах від На Фіг. 18 зображено графік, який відображає 0,022 нМ до 0,044 нМ, наприклад, при концентрації 0,022 нМ, 0,028 нМ або 0,044 нМ. спорідненість huIFN антитіла NI-0501 до людськоhuIFN антитіла модулюють імунну реакцію го IFN. суб'єкта, наприклад, людини. За варіантом, якому На Фіг. 19 зображено графік порівняння активності антитіл, що продукуються клонами А6 та NIвіддають перевагу, huIFN антитіла модулюють 0501 (яке у цьому описі згадується також як "А6, адаптивну імунну відповідь суб'єкта. За варіантом, яке зазнало зворотної мутації до зародкової лінії" якому віддають більшу перевагу, huIFN антитіла або "зворотно мутоване А6"). модулюють клітинну або клітинноопосередковану На Фіг. 20 зображено графік, який відображає імунну реакцію, відому також, як реакція Тh1-типу активність huIFN антитіла NI-0501 проти нативноабо реакція, опосередкована Тh1. го людського IFN. Наприклад, huIFN антитіла, опис яких навеНа Фіг. 21A-21F зображено ряд графіків, які відено, модулюють, наприклад, знижують, пригнічують або запобігають розвитку надмірної Тh1дображають зв'язування huIFN антитіла NI-0501 з опосередкованої імунної реакції, наприклад, надрекомбінантним IFN різних видів. мірної Th1-опосередкованої імунної реакції, пов'яНа Фіг. 22 зображено графік, який відображає заної з автоімунним або запальним розладом, наздатність huIFN антитіла NI-0501 до нейтралізації приклад, з хворобою Крона, системним червоним активації МНС класу II, індукованої нативним IFN 15 92337 16 вовчаком, псоріазом, саркоїдозом, ревматоїдним жані шляхом імунізації тварини IFN, наприклад, артритом, васкулітом, атопічним дерматитом і мишачим або людським IFN (дивись, наприклад, вторинним прогресуючим розсіяним склерозом. номер депонування GenBank X13274) або його Термін "надмірна" Th-1-опосередкована імунна імуногенним фрагментом, похідною або варіантом. реакція, що вживається у цьому описі, означає За альтернативним варіантом, згадану тварину присутність підвищеного рівня Тh1 цитокіну(-ів), імунізують клітинами, трансфікованими вектором, наприклад, IL-2, IL-3, TNF (фактор некрозу пухщо містить молекулу нуклеїнової кислоти, що колин)-альфа (TNF) та IFN, у суб'єкта, порівняно з дує IFN, таким чином, що IFN експресується і рівнем продукування Th1 цитокіну у суб'єкта, який зв'язується з поверхнею трансфікованих клітин. За не страждає на захворювання або розлад, пов'яальтернативним варіантом, антитіла одержують заний-із надмірною Th1-опосередкованою імунною шляхом скринінгу бібліотеки, що містить послідовреакцією. Для віднесення Th1-опосередкованої ності антитіло- або антигензв'язувальних доменів імунної реакції до класу надмірних реакцій, визнадля зв'язування з IFN. Цю бібліотеку одержують, чають рівень продукування Th1 цитокіну, напринаприклад, у бактеріофазі шляхом злиття білка клад, шляхом визначення і аналізу рівня секретоабо пептиду з білком оболонки бактеріофага, що ваних цитокінів за допомогою ELISA експресується на поверхні складених фагових ча(твердофазний імуноферментний аналіз) або інстинок, та послідовностями кодувальної ДНК, що шого аналізу. містяться у частинках фага (тобто "бібліотека з huIFN антитіла, опис яких наведено, модупроявленням у фагах"). люють, наприклад, пригнічують, зменшують або huIFN антитіла за цим винаходом включають, запобігають переключенню класу на ізотип IgG, наприклад, гіперваріабельні ділянки (CDR) важконаприклад, IFN-індукованому переключенню клаго ланцюга, наведені нижче у Таблиці 1, гіперварісу. Ці huIFN антитіла модулюють, наприклад, приабельні ділянки легкого ланцюга, наведені у Табгнічують, запобігають або знижують інтенсивність лиці 2 та їх комбінації. Th1-опосередкованої реакції і, унаслідок цього, зменшують IFN-індуковане переключення. huIFN антитіла за цим винаходом були одерТаблиця 1 Послідовності VH клонів антитіл, що зв'язують і нейтоалізують IFN Назва клону NI-0501 AC1.2R3P2_A6 AC1.2R3P2_D8 AC1.4R4P2_C10 AC1.R3P2_B4 AD1.4R4P1_B9 AD1.3R3P5_F8 AD1.3R3P6_F9 AD1.3R3P6_E1 AD1.4R4P2_C9 AD1.4R4P2_G7 AD1.3R3P6_G10 AD1.R2P2_D6 AD1.1R3P3_G9 AC1.2R3P7_D3 VH CDR1 SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SYAMS (Послідовність № 3) SNAMS (Послідовність № 43) VH CDR2 AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) AISGSGGSTYYADSVKG (Послідовність № 4) TLTGSGGTAYYADSVEG (Послідовність № 44) VH CDR3 DGSSGWYVPHWFDP (Послідовність № 5) DGSSGWYVPHWFDP (Послідовність № 5) DGSSGWYVPHWFDP (Послідовність № 5) DGSSGWYVPHWFDP (Послідовність № 5) DHSSGWYVISGMDV (Послідовність № 13) DLTVGGPWYYFDY (Послідовність № :21) VGSWYLEDFDI (Послідовність № 69) GGNYGDYFDYFDY (Послідовність № 76) RSFDSGGSFEY (Послідовність № 64) DGWNALGWLES (Послідовність № 29) DGWNALGWLES (Послідовність № 29) DGWNALGWLES (Послідовність № 29) DGWNALGWLES (Послідовність № 29) DFWVTTSGNDY (Послідовність № 89) GTELVGGGLDN (Послідовність № 45) 17 92337 18 Таблиця 2 Послідовності VL клонів антитіл, що зв'язують і нейтралізують IFN Назва клону NI-0501 AC1.2R3P2_A6 AC1.2R3P2_D8 AC1.4R4P2_C10 AC1.R3P2_B4 AD1.4R4P1_B9 AD1.3R3P5_F8 AD1.3R3P6_F9 AD1.3R3P6_E1 AD1.4R4P2_C9 AD1.4R4P2_G7 AD1.3R3P6_G10 AD1.R2P2_D6 AD1.1R3P3_G9 AD1.2R3P7_D3 VL CDR1 TRSSGSIASNYVQ (Послідовність № 8) TRSSGSIVSNYVQ (Послідовність № 106) TRSSGSIVSNYVQ (Послідовність № 8) TRSSGTIASNYVQ (Послідовність № 39) TRSSGSIASNYVQ (Послідовність № 16) TRSSGSIVSNYVQ (Послідовність № 8) TRSSGSIASNYVH (Послідовність № 72) TRSSGSIASNYVQ (Послідовність № 16) TRSSGYIASSYVQ (Послідовність № 8) TRSGGSIGSYYVQ (Послідовність № 32) TGRNGNIASNYVQ (Послідовність № 84) AGSSGSIASNYVQ (Послідовність № 97) TGSSGSIASNYVQ (Послідовність № 55) TRSSGSIASNYVQ (Послідовність № 16) TGSGGSIATNYVQ (Послідовність № 48) Типовим huIFN моноклональним антитілом є антитіло NI-0501, опис якого наведено. Антитіло NI-0501 являє собою зворотномутований варіант антитіла AC1.2R3P2_A6. Термін "зворотномутований", який вживають у цьому описі, означає зворотну мутацію нуклеотиду або залишку амінокислоти до нуклеотиду або залишку, які знаходяться у відповідному положенні у ембріональній послідовності. Антитіло NI-0501 включає варіабельну ділянку важкого ланцюга (Послідовність № 2), що кодується нуклеїновокислотною послідовністю, яка зображена Послідовністю № 1, і варіабельну ділянку легкого ланцюга (Послідовність № 7), що кодується нуклеїновокислотною послідовністю, яка зображена Послідовністю № 6 (Фіг. 1A-1D). Амінокислоти, що входять до складу гіперваріабельних ділянок (CDR), за визначенням Чотья (Chothia) та інших, Е.А. Кебот (Е.А. Kabat) та інших, підкреслені на Фіг. 1В та Фіг. 1D. (Дивись Чотья K. (Chothia С.) та інші, Nature 342:877-883 (1989); Кебот Е.А. (Kabat Е.А.) та інші, Sequences of Proteins of Immunological Interest, п'яте видання, US Department of Health and Human Services, US Government Printing Office (1991)). Гіперваріабельні ділянки важкого ланцюга антитіла А6 мають наведені нижче послідовності: SYAMS (Послідовність № 3); AISGSGGSTYYADSVKG (Послідовність № 4) та DGSSGWYVPHWFDP (Послідовність № 5). Гіперваріабельні ділянки легкого ланцюга анти VL CDR2 EDNQRPS (Послідовність № 9) EDNRRPS (Послідовність № 107) EDNQRPS (Послідовність № 17) EDNQRPS (Послідовність № 17) EDNQRPS (Послідовність № 17) DDDQRPS (Послідовність № 25) EDNRRPS (Послідовність № 9) EDNQRPS (Послідовність № 17) EDDRRPS (Послідовність № 25) DDKKRPS (Послідовність № 33) EDTQRPS (Послідовність № 85) EDNQRPS (Послідовність № 17) EDNQRPS (Послідовність № 17) EDNRRPS (Послідовність № 9) EDNQRPS (Послідовність № 17) VL CDR3 QSYDGSNRWM (Послідовність № 10) QSYDGSNRWM (Послідовність № 10) QSYDSNNFWV (Послідовність № 61) QSYDNSNHWV (Послідовність № 40) QSNDSDNW (Послідовність № 18) QSYDSSNW (Послідовність № 26) QSSDTTYHGGW (Послідовність № 73) QSYEGF (Послідовність № 79) QSYDDTTPWV (Послідовність № 26) QSYDSNNLVV (Послідовність № 34) QSSDSNRVL (Послідовність № 86) QSYSYNNQVV (Послідовність № 98) QSYDSSNQEVV (Послідовність № 56) QSFDSTNLVV (Послідовність № 92) QSYDSDNHHVV (Послідовність № 49) тіла А6 мають наведені нижче послідовності: TRSSGSIASNYVQ (Послідовність № 8); EDNQRPS (Послідовність № 9) та QSYDGSNRWM (Послідовність № 10). Іншим типовим huIFN моноклональним антитілом є антитіло AC1.2R3P2_A6 ("А6"), опис якого наведено. Антитіло А6 включає варіабельну ділянку важкого ланцюга (Послідовність № 103), що кодується нуклеїновокислотною послідовністю, яка зображена Послідовністю № 102, і варіабельну ділянку легкого ланцюга (Послідовність № 105), що кодується нуклеїновокислотною послідовністю, яка зображена Послідовністю № 104 (Фіг. 1Е-1Н). Амінокислоти, що входять до складу гіперваріабельних ділянок (CDR), за визначенням Чотья (Chothia) та інших, Е.А. Кебот (Е.А. Kabat) та інших, підкреслені на Фіг. 1F та Фіг. 1H. (Дивись Чотья К. (Chothia С.) та інші, Nature 342:877-883 (1989); Кебот Е.А. (Kabat E.A.) та інші, Sequences of Proteins of Immunological Interest, п'яте видання, US Department of Health and Human Services, US Government Printing Office (1991)). Гіперваріабельні ділянки важкого ланцюга антитіла А6 мають наведені нижче послідовності: SYAMS (Послідовність № 3); AISGSGGSTYYADSVKG (Послідовність № 4) та DGSSGWYVPHWFDP (Послідовність № 5). Гіперваріабельні ділянки легкого ланцюга антитіла А6 мають наведені нижче послідовності: TRSSGSIVSNYVQ (Послідовність № 106); 19 92337 20 EDNRRPS (Послідовність № 107) та згадується також як "С10"); включає варіабельну QSYDGSNRWM (Послідовність № 10). ділянку важкого ланцюга (Послідовність № 36), що Антитіло AC1.2R3P2_B4 (яке у цьому описі кодується нуклеїновокислотною послідовністю, яка згадується також як "В4") включає варіабельну зображена Послідовністю № 35, і варіабельну діділянку важкого ланцюга (Послідовність № 12), що лянку легкого ланцюга (Послідовність № 38), що кодується нуклеїновокислотною послідовністю, яка кодується нуклеїновокислотною послідовністю, яка зображена Послідовністю № 11, і варіабельну дізображена Послідовністю № 37 (Фіг. 5A-5D). Амілянку легкого ланцюга (Послідовність № 15), що нокислоти, що входять до складу гіперваріабелькодується нуклеїновокислотною послідовністю, яка ної ділянки, за визначенням Чотья (Chothia) та зображена Послідовністю № 14 (Фіг. 2A-2D). Аміінших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, нокислоти, що входять до складу гіперваріабельпідкреслені на Фіг. 5В та Фіг. 5D. Гіперваріабельні ної ділянки, за визначенням Чотья (Chothia) та ділянки важкого ланцюга антитіла С10 мають наінших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, ведені нижче послідовності: SYAMS (Послідовпідкреслені на Фіг. 2В та Фіг. 2D. Гіперваріабельні ність № 3); AISGSGGSTYYADSVKG Послідовність ділянки важкого ланцюга антитіла В4 мають наве№ 4) та DSGSSGWYVPHWFDP (Послідовність № дені нижче послідовності: SYAMS (Послідовність 5). Гіперваріабельні ділянки легкого ланцюга анти№ 3); AISGSGGSTYYADSVKG (Послідовність № 4) тіла С10 мають наведені нижче послідовності: та DHSSGWYV1SGMDV (Послідовність № 13). TRSSGTIASNYVQ (Послідовність № 39); Гіперваріабельні ділянки легкого ланцюга антитіла EDNQRPS (Послідовність № 17) та В4 мають наведені нижче послідовності: QSYDNSNHWV (Послідовність № 40). TRSSGSIASNYVQ (Послідовність № 16); Антитіло AC1.2R3P7_D3 (яке у цьому описі EDNQRPS (Послідовність № 17) та QSNDSDNW згадується також як "D3"), включає варіабельну (Послідовність № 18). ділянку важкого ланцюга (Послідовність № 42), що Антитіло AD1.4R4P1_B9 (яке у цьому описі кодується нуклеїновокислотною послідовністю, яка згадується також як "В9"); включає варіабельну зображена Послідовністю № 41, і варіабельну діділянку важкого ланцюга (Послідовність № 20), що лянку легкого ланцюга (Послідовність № 47), що кодується нуклеїновокислотною послідовністю, яка кодується нуклеїновокислотною послідовністю, яка зображена Послідовністю № 19, і варіабельну дізображена Послідовністю № 46 (Фіг. 6A-6D). Амілянку легкого ланцюга (Послідовність № 23), що нокислоти, що входять до складу гіперваріабелькодується нуклеїновокислотною послідовністю, яка ної Ділянки, за визначенням Чотья (Chothia) та зображена Послідовністю № 22 (Фіг. 3А-3D). Аміінших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, нокислоти, що входять до складу гіперваріабельпідкреслені на Фіг. 6В та Фіг. 6D. Гіперваріабельні ної ділянки, за визначенням Чотья (Chothia) та ділянки важкого ланцюга антитіла D3 мають навеінших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, дені нижче послідовності: SNAMS (Послідовність підкреслені на Фіг. 3А та Фіг. 3D. Гіперваріабельні № 43); TLTGSGGTAYYADSVEG (Послідовність № ділянки важкого ланцюга антитіла В9 мають наве44) та GTELVGGGLDN (Послідовність № 45). Гіпедені нижче послідовності: SYAMS (Послідовність рваріабельні ділянки легкого ланцюга антитіла D3 № 3); AISGSGGSTYYADSVKG (Послідовність № 4) мають наведені нижче послідовності: та DLTVGGPWYYFDY (Послідовність № 21). ГіпеTGSGGSIATNYVQ (Послідовність № 48); рваріабельні ділянки легкого ланцюга антитіла В9 EDNQRPS (Послідовність № 17) та мають наведені нижче послідовності: QSYDSDNHHW (Послідовність № 49). TRSSGSIVSNYVQ (Послідовність № 8); DDDQRPS Антитіло AD1.2R2P2_D6 (яке у цьому описі (Послідовність № 25) та QSYDSSNW (Послідовзгадується також як "D6"), включає варіабельну ність № 26). ділянку важкого ланцюга (Послідовність № 51), що Антитіло AD1.4R4P2_C9 (яке у цьому описі кодується нуклеїновокислотною послідовністю, яка згадується також як "С9"); включає варіабельну зображена Послідовністю № 50, і варіабельну діділянку важкого ланцюга (Послідовність № 28), що лянку легкого ланцюга (Послідовність № 54), що кодується нуклеїновокислотною послідовністю, яка кодується нуклеїновокислотною послідовністю, яка зображена Послідовністю № 27, і варіабельну дізображена Послідовністю № 53 (Фіг. 7A-7D). Амілянку легкого ланцюга (Послідовність № 31), що нокислоти, що входять до складу гіперваріабелькодується нуклеїновокислотною послідовністю, яка ної ділянки, за визначенням Чотья (Chothia) та зображена Послідовністю № 30 (Фіг. 4A-4D). Аміінших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, нокислоти, що входять до складу гіперваріабельпідкреслені на Фіг. 7В та Фіг. 7D. Гіперваріабельні ної ділянки, за визначенням Чотья (Chothia) та ділянки важкого ланцюга антитіла D6 мають навеінших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, дені нижче послідовності: SYAMS (Послідовність підкреслені на Фіг. 4В та Фіг. 4D. Гіперваріабельні № 3); AISGSGGSTYYADSVKG (Послідовність № 4) ділянки важкого ланцюга антитіла С9 мають навета DGWNALGWLES (Послідовність № 29). Гіпердені нижче послідовності: SYAMS (Послідовність варіабельні ділянки легкого ланцюга антитіла D6 № 3); AISGSGGSTYYADSVKG (Послідовність № 4) мають наведені нижче послідовності: та DGWNALGWLES (Послідовність № 29). ГіперTGSSGSIASNYVQ (Послідовність № 55); варіабельні ділянки легкого ланцюга антитіла С9 EDNQRPS (Послідовність № 17) та мають наведені нижче послідовності: QSYDSSNQEW (Послідовність № 56). TRSGGSIGSYYVQ (Послідовність № 32); Антитіло AC1.2R2P2_D8 (яке у цьому описі DDKKRPS (Послідовність № 33) та QSYDSNNLW згадується також як "D8"), включає варіабельну (Послідовність № 34). ділянку важкого ланцюга (Послідовність № 58), що Антитіло AC1.4R4P2_C10 (яке у цьому описі кодується нуклеїновокислотною послідовністю, яка 21 92337 22 зображена Послідовністю № 57, і варіабельну дізображена Послідовністю № 77 (Фіг. 11A-11D). лянку легкого ланцюга (Послідовність № 60), що Амінокислоти, що входять до складу гіперваріабекодується нуклеїновокислотною послідовністю, яка льної ділянки, за визначенням Чотья (Chothia) та зображена Послідовністю № 59 (Фіг. 8A-8D). Аміінших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, нокислоти, що входять до складу гіперваріабельпідкреслені на Фіг. 11В та Фіг. 11D. Гіперваріабеної ділянки, за визначенням Чотья (Chothia) та льні ділянки важкого ланцюга антитіла F9 мають інших, 1989, Е.А. Кебот (ЕА. Kabat) та інших, 1991, наведені нижче послідовності: SYAMS (Послідовпідкреслені на Фіг. 8В та Фіг. 8D. Гіперваріабельні ність № 3); AISGSGGSTYYADSVKG (Послідовність ділянки важкого ланцюга антитіла D8 мають наве№ 4) та GGNYGDYFDYFDY (Послідовність № 76). дені нижче послідовності: SYAMS (Послідовність Гіперваріабельні ділянки легкого ланцюга антитіла № 3); AISGSGGSTYYADSVKG (Послідовність № 4) F9 мають наведені нижче послідовності: та DGSSGWYVPHWFDP (Послідовність № 5). ГіTRSSGSIASNYVQ (Послідовність № 16); перваріабельні ділянки легкого ланцюга антитіла EDNQRPS (Послідовність № 17) та QSYEGF (ПосD8 мають наведені нижче послідовності: лідовність № 79). TRSSGSIVSNYVQ (Послідовність № 8); EDNQRPS Антитіло AD1.4R4P2_G7 (яке у цьому описі (Послідовність № 17) та QSYDSNNFWV (Послідозгадується також як "G7"), включає варіабельну вність № 61). ділянку важкого ланцюга (Послідовність № 81), що Антитіло AD1.3R3P6_E1 (яке у цьому описі кодується нуклеїновокислотною послідовністю, яка згадується також як "Е1"), включає варіабельну зображена Послідовністю № 80, і варіабельну діділянку важкого ланцюга (Послідовність № 63), що лянку легкого ланцюга (Послідовність № 83), що кодується нуклеїновокислотною послідовністю, яка кодується нуклеїновокислотною послідовністю, яка зображена Послідовністю № 62, і варіабельну дізображена Послідовністю № 82 (Фіг. 12A-12D). лянку легкого ланцюга (Послідовність № 66), що Амінокислоти, що входять до складу гіперваріабекодується нуклеїновокислотною послідовністю, яка льної ділянки, за визначенням Чотья (Chothia) та зображена Послідовністю № 65 (Фіг. 9A-9D). Аміінших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, нокислоти, що входять до складу гіперваріабельпідкреслені на Фіг. 12В та Фіг. 12D. Гіперваріабеної ділянки, за визначенням Чотья (Chothia) та льні ділянки важкого ланцюга антитіла G7 мають інших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, наведені нижче послідовності: SYAMS (Послідовпідкреслені на Фіг. 9В та Фіг. 9D. Гіперваріабельні ність № 3); AISGSGGSTYYADSVKG (Послідовність ділянки важкого ланцюга антитіла Е1 мають наве№ 4) та DGWNALGWLES (Послідовність № 29). деш нижче послідовності: SYAMS (Послідовність Гіперваріабельні ділянки легкого ланцюга антитіла № 3); AISGSGGSTYYADSVKG (Послідовність № 4) G7 мають наведені нижче послідовності: та RSFDSGGSFEY (Послідовність № 64). ГіперваTGRNGNIASNYVQ (Послідовність № 84); ріабельні ділянки легкого ланцюга антитіла Е1 EDTQRPS (Послідовність № 85) та QSSDSNRVL мають наведені нижче послідовності: (Послідовність № 86). TRSSGSIVSNYVQ (Послідовність № 8); DDDQRPS Антитіло AD1.1R3P3_G9 (яке у цьому описі (Послідовність № 25) та QSYDSSNW (Послідовзгадується також як "G9"), включає варіабельну ність № 26). ділянку важкого ланцюга (Послідовність № 88), що Антитіло AD1.3R3P5_F8 (яке у цьому описі кодується нуклеїновокислотною послідовністю, яка згадується також як "F8"), включає варіабельну зображена Послідовністю № 87, і варіабельну діділянку важкого ланцюга (Послідовність № 68), що лянку легкого ланцюга (Послідовність № 91), що кодується нуклеїновокислотною послідовністю, яка кодується нуклеїновокислотною послідовністю, яка зображена Послідовністю № 67, і варіабельну дізображена Послідовністю № 90 (Фіг. 13A-13D). лянку легкого ланцюга (Послідовність № 71), що Амінокислоти, що входять до складу гіперваріабекодується нуклеїновокислотною послідовністю, яка льної ділянки, за визначенням Чотья (Chothia) та зображена Послідовністю № 70 (Фіг. 10A-10D). інших, 1989, Е.А. Кебот - (Е.А. Kabat) та інших, Амінокислоти, що входять до складу гіперваріабе1991, підкреслені на Фіг. 13В та Фіг. 13D. Гіпервальної ділянки, за визначенням Чотья (Chothia) та ріабельні ділянки важкого ланцюга антитіла G9 інших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, мають наведені нижче послідовності: SYAMS (Попідкреслені на Фіг. 10В та Фіг. 10D. Гіперваріабеслідовність № 3); AISGSGGSTYYADSVKG (Послільні ділянки важкого ланцюга антитіла F8 мають довність № 4) та DFWVITSGNDY (Послідовність № наведені нижче послідовності: SYAMS (Послідов89). Гіперваріабельні ділянки легкого ланцюга анність № 3); AISGSGGSTYYADSVKG (Послідовність титіла G9 мають наведені нижче послідовності: № 4) та VGSWYLEDFDI (Послідовність № 69). ГіTRSSGSIASNYVQ (Послідовність № 16); перваріабельні ділянки легкого ланцюга антитіла EDNRRPS (Послідовність № 9) та QSFDSTNLW F8 мають наведені нижче послідовності: (Послідовність № 92). TRSSGSIASNYVH (Послідовність № 72); Антитіло AD1.3R3P6_G10 (яке у цьому описі EDNRRPS (Послідовність № 9) та згадується також як "G10"), включає варіабельну QSSDTTYHGGW (Послідовність № 73). ділянку важкого ланцюга (Послідовність № 94), що Антитіло AD1.3R3P6_F9 (яке у цьому описі кодується нуклеїновокислотною послідовністю, яка згадується також як "F9"), включає варіабельну зображена Послідовністю № 93, і варіабельну діділянку важкого ланцюга (Послідовність № 75), що лянку легкого ланцюга (Послідовність № 96), що кодується нуклеїновокислотною послідовністю, яка кодується нуклеїновокислотною послідовністю, яка зображена Послідовністю № 74, і варіабельну дізображена Послідовністю № 95 (Фіг. 14A-14D). лянку легкого ланцюга (Послідовність № 78), що Амінокислоти, що входять до складу гіперваріабекодується нуклеїновокислотною послідовністю, яка льної ділянки, за визначенням Чотья (Chothia) та 23 92337 24 інших, 1989, Е.А. Кебот (Е.А. Kabat) та інших, 1991, тів, лікарських форм, їх доставки та лікування хвопідкреслені на Фіг. 14В та Фіг. 14D. Гіперваріаберих застосовують стандартні методи. льні ділянки важкого ланцюга антитіла G10 мають Слід розуміти, що наведені нижче терміни, які наведені нижче послідовності: SYAMS (Послідоввживаються у зв'язку з розкриттям, наведеним у ність № 3); AISGSGGSTYYADSVKG (Послідовність цьому описі, у разі відсутності інших вказівок, ма№ 4) та DGWNALGWLES (Послідовність № 29). ють такі значення: Гіперваріабельні ділянки легкого ланцюга антитіла Термін "антитіло", який вживають у цьому опиG10 мають наведеш нижче послідовності: сі, означає імуноглобулінові молекули та імунолоAGSSGSIASNYVQ (Послідовність № 97); гічно активні частини імуноглобулінових (Ig) молеEDNQRPS (Послідовність № 17) та QSYSYNNQW кул, тобто молекул, що містять (Послідовність № 98). антигензв'язувальний центр, який специфічно зв'язує (вступає до імунної реакції з) антиген(-ом). Такі До huIFN антитіл за цим винаходом належать антитіла включають (але без обмеження) поліклотакож антитіла, що містять амінокислотну послідональні, моноклональні, химерні, одноланцюгові вність варіабельної ділянки важкого ланцюга, яка є антитіла, Fab-, Fab'-, F(ab')2-фрагменти та бібліотеку щонайменше на 90%, 92%, 95%, 97%, 98%, 99% експресованих послідовностей Fab. Словосполуабо більше ідентичною до амінокислотної послідочення "специфічно зв'язує" або "вступає до імунної вності, зображеної Послідовністю № 2, № 12, № реакції з" означає, що згадане антитіло реагує з 20, № 28, № 36, № 42, № 51, № 58, № 63, № 68, № однією або декількома антигенними детермінан75, № 81, № 88, № 94 або № 103 (Фіг. 1-14) та/або тами бажаного антигену і не реагує (тобто не зв'яамінокислотну послідовність варіабельної ділянки зується) з іншими поліпетидами або зв'язується з легкого ланцюга, яка є щонайменше на 90%, 92%, іншими поліпептидами з набагато нижчою спорід95%, 97%, 98%, 99% або більше ідентичною до неністю (Kd>10-6). амінокислотної послідовності, зображеної ПосліВідомо, що основна структурна одиниця антидовністю № 7, № 15, № 23, № 31, № 38, № 47, № тіла включає тетрамер. Кожен тетрамер склада54, № 60, № 66, № 71, № 78, № 83, № 91, № 96 ється з двох ідентичних пар поліпептидних ланцюабо № 105 (Фіг. 1-14). гів, де кожна пара має один "легкий" ланцюг За альтернативним варіантом, моноклональ(приблизно 25 кДа) і один "важкий" ланцюг (прибним антитілом є антитіло, яке зв'язує ту саму антилизно 50-70 кДа). Амінокінцева частина кожного генну детермінанту, що і NI-0501, А6, В4, В9, С9, ланцюга включає варіабельну ділянку, що складаС10, D3, D6, D8, E1, F8, F9, G7, G9 або G10. ється приблизно з 100-110 або більше амінокислот У разі відсутності інших визначень, наукові та і яка відповідає, головним чином, за розпізнавання технічні терміни, що вживаються у зв'язку з цим антигену. Карбоксикінцева частина кожного ланвинаходом, будуть мати значення, які традиційно цюга визначає константну ділянку, яка відповідає, розуміються пересічними фахівцями у цій галузі головним чином, за ефекторну функцію. Людські техніки. На додаток до цього, якщо тільки іншого легкі ланцюги класифікуються як каппа і лямбда не потребує контекст, терміни у однині будуть легкі ланцюги. Важкі ланцюги класифікуються як включати множину, а терміни у множині будуть мю, дельта, гамма, альфа або іпсилон і визначавключати однину. Взагалі, умовні позначення, що ють ізотип антитіла як, відповідно, IgM, IgD, IgA та вживаються у зв'язку з культурами клітин і тканин, IgE. У межах легких і важких ланцюгів варіабельні і молекулярною біологією та хімією білків і олігоконстантні ділянки сполучаються "J"-фрагментом, або полінуклеотидів, а також гібридизацією та мещо містить приблизно 12 або більше амінокислот, тодиками, опис яких наводиться, є добре відомими причому важкий ланцюг включає також "D''і традиційно вживаними у цій галузі техніки. Для фрагмент, який складається приблизно з 10 або одержання рекомбінантної ДНК, синтезу олігонукбільше амінокислот. Дивись, взагалі, Fundamental леотидів, культивування і трансформації тканин Immunology, глава 7 (редактор Пол В. (Paul W.), 2застосовують стандартні методи (наприклад, елее видання, Raven Press, N.Y. (1989)). Варіабельні ктропорацію, ліпофекцію). Ферментативні реакції і ділянки кожної пари легкий/важкий ланцюги утвометоди очищення здійснюють за рекомендаціями рюють антигензв'язувальний центр антитіла. виробника або за традиційними методами, прийнТермін "моноклональне антитіло" (Mab) або ятими у цій галузі техніки або описаними у цьому словосполучення "композиція, що містить монокописі. Вищезгадані способи і процедури здійснюлональне антитіло", які вживають у цьому описі, ють, як правило, за традиційними методиками, означає популяцію молекул антитіл, яка включає добре відомими у цій галузі техніки, та за описом у молекули антитіл лише одного різновиду, що яврізних загальних і більш конкретніших джерелах, ляють собою специфічний продукт гена легкого на які посилаються і які обговорюються у цьому ланцюга і специфічний продукт гена важкого ланописі. Дивись, наприклад, Сембрук (Sambrook) та цюга. Зокрема, гіперваріабельні ділянки (CDR) інші, Molecular Cloning: A Laboratory Manual (2-е моноклонального антитіла є ідентичними в усіх видання, Cold Spring Harbor Laboratory Press, Cold молекул згаданої популяції. Моноклональні антиSpring Harbor, N.Y. (1989)). Термінологія, вживана тіла містять антигензв'язувальний центр, здатний у зв'язку з аналітичною хімією, хімією органічного до вступу до імунної реакції з конкретною антигенсинтезу, медичною і фармацевтичною хімією та ною детермінантою антигену, який характеризулабораторними процедурами і методами, опис ється специфічною зв'язувальною спорідненістю яких наведено, являє собою термінологію, добре до неї. відому і широко вживану у цій галузі техніки. Для Як правило, молекули антитіл, одержані від проведення хімічного синтезу, здійснення хімічних людей, належать до будь-якого з класів IgG, IgM, аналізів, виготовлення фармацевтичних препара 25 92337 26 IgA, IgE та IgD, які відрізняються один від одного вибраних поліпептидів здійснюють за допомогою природою важкого ланцюга, присутнього у молеспособів, добре відомих у цій галузі техніки. Одним кулі. Певні класи мають також підкласи, наприіз таких способів є визначення швидкості утворенклад, IgG1, IgG2 тощо. На додаток до цього, легкий ня і дисоціації комплексів антигензв'язувальна ланцюг у людей може бути каппа-ланцюгом або ділянка/антиген, де згадана швидкість залежить лямбда-ланцюгом. від концентрації партнерів, що утворюють комТермін "антигензв'язувальний центр" або "місплекс, спорідненості взаємодії та геометричних це зв'язування" означає частину молекули імуногпараметрів, які рівною мірою впливають на згадалобуліну, яка бере участь у зв'язуванні антигену. ну швидкість у обох напрямках. Таким чином, як Антигензв'язувальний центр утворюється залиш"константа збільшення швидкості" (Kon), так і "консками амінокислот N-кінцевих варіабельних ("V") танта зменшення швидкості" (Κoff) можуть бути ділянок важкого ("Н") і легкого ("L") ланцюгів. Три визначені шляхом обчислення концентрацій і факвисокодивергентні фрагменти у межах V-ділянок тичної швидкості асоціації та дисоціації. (Дивись важких і легких ланцюгів, які називають "гіперваріNature 361:186-187 (1993)). Співвідношення Kon/Κoff абельними ділянками", знаходяться між більш надає можливість відміни усіх параметрів, не поконсервативними фланкуючими фрагментами, в'язаних зі спорідненістю, і дорівнює константі дивідомими як "каркасні ділянки" або "FR". Таким соціації Kd. (Дивись, у цілому, Девіс (Davies) та чином, термін "каркасна ділянка" ("FR") означає інші, (1990), Annual Rev. Biochem. 59:439-473). Каамінокислотні послідовності які за природних умов жуть, що антитіло за цим винаходом специфічно знаходяться у імуноглобулінах між гіперваріабельзв'язується з антигенною детермінантою IFN у ними ділянками і є прилеглими до них. У молекулі тому разі, коли константа зв'язування у стані рівантитіл три гіперваріабельні ділянки легкого ланноваги (Kd) є 1 мкМ; за варіантом, якому віддають цюга і три гіперваріабельні ділянки важкого ланцюперевагу, є 100 нМ, за варіантом, якому віддають га взаєморозміщуються у тривимірному просторі з більшу перевагу, є 10 нМ і за варіантом, якому утворенням антигензв'язувальної поверхні. Згадавідцають найбільшу перевагу, знаходиться у мена антигензв'язувальна поверхня є комплементаржах від 100 пМ до приблизно 1 пМ, за даними ною до тривимірної поверхні зв'язуваного антигену аналізів, наприклад, аналізів зв'язування лігандів, і згадані три гіперваріабельні ділянки кожного з мічених радіоактивним ізотопом, або подібних важких і легких ланцюгів називають "гіперваріабеаналізів, відомих фахівцям у цій галузі техніки. льними ділянками" або "hv-ділянками" (CDR). РозФахівцям у цій галузі техніки буде зрозумілою поділ амінокислот до кожного домену відповідає можливість визначення, без зайвого експерименвизначенням, наведеним у роботі Кебот (Kabat), тування, чи має людське моноклональне антитіло Sequences of Proteins of Immunological Interest таку саму специфічність, що й людське монокло(National Institutes of Health, Bethesda, Меріленд нальне антитіло за цим винаходом (наприклад, (1987 і 1991)) або Чотья (Chothia), Леек (Lesk), J. моноклональне антитіло NI-0501, А6, В4, В9, С9, Mol. Вiol. 196:901-917 (1987), Чотья (Chothia) та С10, D3, D6, D8, E1, F8, F9, G7, G9 або G10) шляінші, Nature, 342:878-883 (1989). хом визначення того, чи перше згадане антитіло Термін "антигенна детермінанта", який вживаперешкоджає зв'язуванню другого згаданого антиють у цьому описі, включає будь-яку білкову дететіла з антигенним поліпептидом IFN. Якщо людрмінанту, здатну до специфічного зв'язування з ське моноклональне антитіло, що піддають випроімуноглобуліном, scFv або рецептором Т-клітини. буванню, конкурує з людським моноклональним Термін "антигенна детермінанта", який вживають у антитілом за цим винаходом, як показує зниження цьому описі, включає будь-яку білкову детермінанзв'язування людським моноклональним антитілом ту, здатну до специфічного зв'язування з імуногза цим винаходом, у такому разі два моноклоналобуліном або рецептором Т-клітини. Антигенні льні антитіла зв'язуються з тією самою, або тісно детермінанти, як правило, являють собою хімічно спорідненою, антигенною детермінантою. Інший активні поверхневі угрупування молекул, наприспосіб визначення, чи людське моноклональне клад, амінокислот або бічних ланцюгів цукрів і, як антитіло має специфічність людського моноклонаправило, мають специфічні об'ємні структурні хального антитіла за цим винаходом, полягає у порактеристики, а також специфічні зарядні характепередньому інкубуванні людського моноклональристики. Кажуть, що антитіло специфічно зв'язує ного антитіла за цим винаходом з антигенним антиген у тому разі, коли константа дисоціації є 1 поліпептидом IFN, з яким воно, за нормальних мкМ; за варіантом, якому віддають перевагу, 100 обставин, реагує, з подальшим доданням людсьнМ і за варіантом, якому віддають найбільшу пекого моноклонального антитіла, яке піддають виревагу, 10 нМ. пробуванню, для визначення, чи пригнічується Словосполучення "імунологічне зв'язування" здатність людського моноклонального антитіла, та "властивості імунологічного зв'язування", що яке піддають випробуванню, до зв'язування антивживаються у цьому описі, означають нековалентгенного поліпептиду IFN. Якщо людське моноклоні взаємодії того типу, які відбуваються між моленальне антитіло, яке піддають випробуванню, прикулою імуноглобуліну і антигеном, для якого згагнічується, у такому разі, з усією ймовірністю, воно даний імуноглобулін є специфічним. Сила або має таку саму, або функціонально еквіваленту спорідненість імунологічних зв'язувальних взаємоепітопну специфічність, що і моноклональне антидій може виражатись за допомогою константи дитіло за цим винаходом. соціації (Kd) взаємодії, де менше значення Kd Для продукування моноклональних антитіл, представляє більшу спорідненість. Кількісне виспрямованих проти білка, наприклад, білка IFN значення властивостей імунологічного зв'язування 27 92337 28 або проти його похідних, фрагментів, аналогів, тинну цитотоксичність. (Дивись Стевенсон гомологів або ортологів, застосовують різні спосо(Stevenson), Anty-Cancer Drug Design, 3:219-230 би, відомі у цій галузі техніки. (Дивись, наприклад, (1989)). довідник Antibodies: A Laboratory Manual, Гарлоу Ε. Цей винахід включає також Fv, Fab Fab' та F(ab')2 (Harlow Ε.), Лейн Д. (Lane D.), 1988, Cold Spring фрагменти huIFN, одноланцюгові huIFN антитіла, Harbor Laboratory Press, Cold Spring Harbor, NY, біспецифічні huIFN антитіла і гетерокон'юговані який включено до цього опису шляхом посилання). huIFN антитіла. Повністю людськими антитілами є молекули антиБіспецифічними антитілами є антитіла, які матіл, у яких послідовність як легких, так і важких ють зв'язувальні специфічності щонайменше до ланцюгів у повному обсязі, з включенням гіпервадвох різних антигенів. У цьому разі, однією зі зв'яріабельних ділянок, походить із людських генів. зувальних специфічностей є зв'язувальна специТакі антитіла у цьому описі називають "людськими фічність до IFN. Другою зв'язувальною мішенню є антитілами" або "повністю людськими антитілами". будь-який другий антиген і, за варіантом, якому Людські моноклональні антитіла одержують, навіддають перевагу, поверхневий мембранний біприклад, за методиками, опис яких наведено у лок або рецептор чи субодиниця рецептора. поданих нижче Прикладах. Людські моноклональні Способи одержання біспецифічних антитіл є антитіла можуть також одержуватись за допомовідомими у цій галузі техніки. Традиційно, основу гою способу тріом; способу одержання гібридом рекомбінантного продукування біспецифічних анлюдських В-клітин (дивись Козбор (Kozbor) та інші, титіл становить коекспресія двох пар імуноглобу1983, Immunol. Today, 4:72); та способу одержання лінових (важкого/легкого) ланцюгів, де два важкі гібридом EBV (вірус Епштейна-Барра) для продуланцюги мають різні специфічності (Мілстейн кування людських моноклональних антитіл (ди(Milstein), Куельо (Cuello), Nature, 305:537-539 вись, Коул (Cole) та інші, 1985, У: MONOCLONAL (1983)). Завдяки довільному аранжуванню важких і ANTIBODIES AND CANCER THERAPY, Alan RXiss, легких імуноглобулінових ланцюгів, ці гібридоми Inc., стор. 77-96). Людські моноклональні антитіла (квадроми) продукують потенційну суміш десяти можуть застосовуватись і можуть продукуватись різних молекул антитіл, лише одна з яких має прашляхом застосування людських гібридом (дивись, вильну біспецифічну структуру. Очищення правиКоут (Cote) та інші, 1983, Proc. Natl. Acad. Sci USA льної молекули здійснюють, як правило, шляхом 80:2026-2030) або шляхом трансформування людафінного хроматографування. Подібні методи розських В-клітин вірусом Епштейна-Барра in vitro кривають у WO 93/08829, опублікованій 13 травня (дивись, Коул (Cole) та інші, 1985, У: 1993 року, та у роботі Траунекер (Traunecker) та MONOCLONAL ANTIBODIES AND CANCER інших, ЕМВО J., 10:3655-3659 (1991). THERAPY, Alan R.Liss, Inc., стор. 77-96). Варіабельні домени антитіла з бажаними спеАнтитіла очищають за добре відомими метоцифічностями зв'язування (антигензв'язувальні дами, наприклад, засобами афінної хроматографії центри антитіла) можуть лігуватись із послідовносіз застосуванням білка А або білка G, які забезпетями константних доменів імуноглобуліну. Літучують одержання, головним чином, IgG фракції вання, за варіантом, якому віддають перевагу, імунної сироватки. Після цього, або за альтернавідбувається з константним доменом важкого лантивним варіантом, специфічний антиген, що є міцюга імуноглобуліну, що містить щонайменше часшенню необхідного імуноглобуліну, або його антитину шарнірних ділянок СН2 і СН3. Перевага відгенна детермінанта, можуть іммобілізовуватись на дається тому, щоб під час щонайменше одного колонці для очищення імуноспецифічного антитіла літування мати першу константу ділянку (СН1) шляхом імуноафінного хроматографування. Очиважкого ланцюга, що містить сайт, необхідний для щення імуноглобулінів обговорюється, наприклад, зв'язування легкого ланцюга. ДНК, що кодують у роботі Д. Вілкінсон (D. Wilkinson) (The Scientist, літування важкого ланцюга імуноглобуліну і, у разі опубліковано The Scientist, Inc., Philadelphia PA, необхідності, легкого ланцюга імуноглобуліну, том 14, № 8 (17 квітня 2000 року), стор. 25-28). вводять до окремих векторів експресії і котрансфіАнтитіло за цим винаходом бажано модифікукують до відповідного організму-хазяїна. Додаткові вати щодо його ефекторних функцій з метою підподробиці одержання біспецифічних антитіл дисилення, наприклад, ефективності згаданого антивись, наприклад, у роботі Суреш (Suresh) та інші, тіла при лікуванні імунопатологічних захворювань. Methods in Enzymology, 121:210 (1986). Наприклад, до Fc-ділянки може(-уть) бути введеЗа іншим варіантом підходу, опис якого навений(-і) залишок(-ки) цистеїну, що уможливить дено у WO 96/27011, поверхня розділу між парою утворення на цій ділянці дисульфідного зв'язку між молекул антитіл може розроблятись таким чином, ланцюгами. Одержане подібним чином гомодимещоб збільшити до максимального рівня відсоток рне антитіло може мати поліпшену інтерналізаційгетеродимерів, які одержують із культури рекомбіну здатність та/або підвищену здатність до комнантних клітин. Поверхня розділу, якій віддають племент опосередкованого убивання клітин і перевагу, містить щонайменше частину ділянки антитілозалежну клітинну цитотоксичність (ADCC) CH3 константного домену антитіла. За цим спосо(Дивись, Карон (Сагоп) та інші, J. Exp. Med., бом, один або декілька невеликих бічних ланцюгів 176:1191-1195 (1992) та Шопс (Shopes), J. амінокислот із поверхні розділу молекули першого Immunol., 148:2918-2922 (1992)). За альтернативантитіла замінюють на більші бічні ланцюги (наним варіантом, засобами генної інженерії може приклад, тирозин або триптофан). Компенсаторні бути сконструйованим антитіло, що має подвійні "порожнини" ідентичного розміру або за розміром Fc-ділянки і, завдяки цьому, посилену інтенсивподібні великому(-им) бічному(-им) ланцюга(-ам) ність лізису комплементу та антитілозалежну кліутворюють на поверхні розділу молекули другого 29 92337 30 антитіла шляхом заміни великих бічних ланцюгів ти утворення пар між двома доменами на одному амінокислоти на менші (наприклад, аланін або й тому самому ланцюзі. Відповідно, домени VH і VL треонін). Цим забезпечується механізм підвищенодного фрагмента примушені утворювати пари з ня виходу гетеродимеру, порівняно з іншими некомплементарними доменами VL і VH іншого фрабажаними кінцевими продуктами, наприклад, гогмента, з одержанням завдяки цьому двох антигемодимерами. нзв'язувальних центрів. Повідомляли також про Біспецифічні антитіла можуть одержуватись як іншу стратегію одержання фрагментів біспецифічнепроцесовані антитіла або фрагменти антитіл них антитіл шляхом застосування одноланцюгових (наприклад, F(ab')2 біспецифічні антитіла). СпосоFv (sFv) димерів. Дивись Грубер (Gruber) та інші, J. би одержання біспецифічних антитіл із фрагментів Immunol, 152:5368 (1994). антитіл були описані у літературі. Наприклад, бісПередбачаються антитіла більше ніж із двома пецифічні антитіла можуть бути одержані за доповалентностями. Наприклад, можуть бути одержані могою хімічного зв'язування. Бреннан (Brennan) та триспецифічні антитіла. Тутт (Tutt) та інші, J. інші, Science, 229:281 (1985), описує метод, за Immunol., 147:160 (1991). яким інтактні антитіла піддають протеолітичному Типові біспецифічні антитіла можуть зв'язуварозщепленню з одержанням Р(аb')2-фрагментів. Ці тись із двома різними антигенними детермінантафрагменти відновлюють у присутності дитіолового ми, щонайменше одна з яких походить із білкового комплексоутворювального агента, арсеніту натрію, антигену за цими винаходом. За альтернативним для стабілізування сусідніх дитіолів і запобігання варіантом, антиантигенне плече молекули імуногутворенню міжмолекулярних дисульфідних зв'язлобуліну може комбінуватись із плечем, яке зв'яків. Після цього одержані Fab'-фрагменти перетвозується з ініціювальною молекулою на лейкоциті, рюють на похідні тіонітробензоату (TNB). Після наприклад, молекулою Т-клітинного рецептора цього одну з похідних Fab'-TNB повторно перетво(наприклад, CD2, IFN, CD28 або В7) або Fcрюють на Fab'-тіол шляхом відновлення меркапрецепторами IgG (FcR), наприклад, FcRI (CD64), тоетиламіном і змішують з еквімолярною кількістю FcRII (IFN2) та FcRIII (CD 16), таким чином, щоб іншої похідної Fab'-TNB з одержанням біспецифічзосередити клітинні захисні механізми на клітині, ного антитіла. Одержані біспецифічні антитіла мощо експресує конкретний антиген. Біспецифічні жуть застосовуватись як агенти для вибіркової антитіла можуть також застосовуватись для спряіммобілізації ферментів. мування цитотоксичних агентів на клітини, що ексНа додаток до цього, Fab'-фрагменти можуть пресують конкретний антиген. Ці антитіла мають безпосередньо виділятись з Е.coli і хімічним шляантигензв'язувальне плече і плече, яке зв'язує хом сполучатись з одержанням біспецифічних анцитотоксичний агент або радіонуклідний хелатор, титіл. Шалабі (Shalaby) та інші, J. Exp. Med. наприклад, EOTUBE, DPTA, DOTA або ТЕТА. Інше 175:217-225 (1992), описує продукування молекубіспецифічне антитіло, яке становить інтерес, зв'яли F(ab')2 повністю гуманізованого біспецифічного зує білковий антиген, опис якого наведено, і додаантитіла. Кожен Fab'-фрагмент нарізно секретуватково зв'язує тканинну тромбокіназу (TF). вся з Е.coli і його піддавали безпосередньому хіміГетерокон'юговані антитіла також входять до чному сполученню in vitro з одержанням біспециобсягу цього винаходу. Гетерокон'юговані антитіла фічного антитіла. Одержане таким чином складаються з двох ковалентно сполучених антибіспецифічне антитіло було здатним до зв'язувантіл. Такі антитіла були, наприклад, запропоновані ня з клітинами, що надекспресували рецептор для спрямування клітин імунної системи проти ЕrbВ2, і нормальними людськими Т-клітинами, а небажаних клітин (патент США № 4,676,980) та також до ініціювання літичної активності людських для лікування ВІЛ-інфекції (WO 91/00360; WO цитотоксичних лімфоцитів проти мішеней, роль 92/200373; ЕР 03089). Передбачається, що згадані яких відігравали пухлини молочної залози людей. антитіла можуть бути одержані in vitro за допомоБули описані також різні способи одержання і гою відомих способів хімії синтезу білків, у тому виділення фрагментів біспецифічних антитіл безчислі способів, що залучають агенти зшивання. посередньо з культури рекомбінантних клітин. НаНаприклад, імунотоксини можуть конструюватись приклад, біспецифічні антитіла продукують із заіз застосуванням реакції обміну дисульфідних стосуванням лейцинових лінкерів (Костельні зв'язків або шляхом утворення тіоефірного зв'язку. (Kostelny) та інші, J. Immunol, 148 (5): 1547-1553 Прикладами придатних для цієї мети реактивів є (1992)). Лейцинові лінкерні пептиди з білків Fos і імінотіолат і метил-4-меркаптобутирімідат, а також Jun літували до Fab'-частин двох різних антитіл реактиви, розкриті, наприклад, у патенті США № шляхом злиття генів. Гомодимери антитіл віднов4,676,980. лювали на шарнірній ділянці до мономерів із поЦей винахід має також відношення до імунодальшим повторним окисненням з одержанням кон'югатів, які являють собою антитіло, кон'юговагетеродимерів антитіл. Цей спосіб може також не із цитотоксичним агентом, наприклад, токсином застосовуватись для продукування гомодимерів (наприклад, ферментативно активним токсином антитіл. Метод "половинчастого антитіла", описабактеріального, грибкового, рослинного або тваний Холлінгер (Hollinger) та іншими, Proc. Natl. ринного походження чи їхніми фрагментами) або Acad. Sci. USA, 90:6444-6448 (1993), надає альтерадіоактивним ізотопом (тобто радіокон'югат). рнативний механізм одержання фрагментів біспеФерментативно активні токсини і їхні фрагменцифічних антитіл. Фрагменти містять варіабельний ти, які можуть застосовуватись, включають А ландомен важкого ланцюга (VH), сполучений з варіацюг дифтерійного токсину, незв'язувальні активні бельним доменом легкого ланцюга (VL) лінкером, фрагменти дифтерійного токсину, А ланцюг екзоякий є занадто коротким для того, щоб уможливитоксину (з Pseudomonas aeruginosa), А ланцюг 31 92337 32 рицину, А ланцюг абрину, А ланцюг модецину, Янсен (Jansen) та інші, Immunological Reviews альфа-сарцин, білки Aleurites fordii, білки діантину, 62:185-216 (1982); Вітетта (Vitetta) та інші, Science білки Phytolaca аmеrісаnа (РАРІ, РАРII та PAP-S), 238:1098 (1987)). Лінкери, яким віддають перевагу, інгібітор Momordica charantia, курцин, кротин, інгібіописані у літературі. (Дивись, наприклад, Рамактор Sapaonaria qfficinalis, гелонін, мітогеллін, рестрішнан С. (Ramakrishnan S.) та інші, Cancer Res., риктоцин, феноміцин, еноміцин та трикотецени. 44:201-208 (1984), який описує застосування MBS Для продукування радіокон'югованих антитіл дос(М-малеімідобензоїл-N-гідроксисукцинімідного тупними є різноманітні радіонукліди. Прикладами є складного ефіру). Дивись також патент США № 212 Ві, 131І, 131Іn, 90Y тa 186Re. 5,030,719, який описує застосування галогенованої Кон'югати антитіла і цитотоксичного агента похідної ацетилгідразиду, сполученої з антитілом одержують за допомогою різноманітних біфункціоза допомогою олігопептидного лінкера). До числа нальних білоксполучних агентів, наприклад, Nлінкерів, яким віддають особливу перевагу, налесукцинімідил-3-(2-піридилдитіол)пропіонату жать: (і) EDC (гідрохлорид 1-етил-3-(3(SPDP), імінотіолану (IT), біфункціональних похіддиметиламінопропіл)карбодііміду; (іі) SMPT (4них імідоефірів (наприклад, моногідрохлориду дисукцинімідилоксикарбоніл-альфа-метил-альфа-(2метиладипімідату), активних складних ефірів (напіридиддитіо)толуол) (компанія Pierce Chem. Co., приклад, дисукцинімідилсуберату), альдегідів номер за каталогом (21558G); (ііі) SPDP (сукцині(наприклад, глутаральдегіду), біс-азидосполук (намідил-6-[3-(2-піридилдитіо)прошонамідо]гексаноат приклад, біс-(n-азидобензоїл)гександіаміну), похі(компанія Pierce Chem. Co., номер за каталогом дних біс-діазонію (наприклад, біс-(n21651G); (iv) сульфо-LC-SPDP (сульфосукцинімідіазонійбензоїл)етилендіаміну), діізоціанатів (надил-6-[3-(2-піридилдитіо)пропіонамідо]гексаноат] приклад, толуол-2,6-діізоціанату) та біс-активних (компанія Pierce Chem. Co., номер за каталогом сполук фтору (наприклад, 1,5-дифтор-2,42165-G) та (ν) сульфо-NHS (Nдинітробензолу). Наприклад, рициновий імунотокгідроксисульфосукцинімід; компанія Pierce Chem. син можна одержати, як описано у Вітетта (Vitetta) Co., номер за каталогом 24510), кон'югований з та інші, Science, 238:1098 (1987) Мічена вуглецемEDC. 14 1-ізотіоціанатобензил-3Лінкери, опис яких наведено вище, містять метилдіетилентриамінпентаоцтова кислота (MXскладові, що мають різні невід'ємні властивості, DTPA) є типовим хелатоутворювальним агентом наслідком чого є одержання кон'югатів із різними для кон'югування радіонуклеотиду з антитілом. фізико-хімічними властивостями. Наприклад, (Дивись WO 94/11026). складні ефіри сульфо-NHS алкілкарбоксилатів є Пересічним фахівцям у цій галузі техніки буде більш стійкими, аніж складні ефіри сульфо-NHS зрозуміло, що велика кількість можливих складоароматичних карбоксилатів. Складні ефіри NHS, вих може сполучатись з одержаними антитілами що містять лінкери, є менш розчинними, аніж або з іншими молекулами за цим винаходом. (Дискладні ефіри сульфо-NHS. На додаток до цього, вись, наприклад, "Conjugate Vaccines", лінкер SMPT містить стерично утруднений дисуContributions to Microbiology and Immunology, Дж.М. льфідний зв'язок і може утворювати кон'югати з Круз (J.M. Cruse) та Р.Е.Льюїс-молодший (R.E. підвищеною стабільністю. Дисульфідні зв'язки, як Lewis, Jr.) (редактори), Carger Press, New York правило, є менш стабільними, аніж інші зв'язки, (1989), яку у повному обсязі включено до цього оскільки дисульфідний зв'язок розщеплюється in опису шляхом посилання). vitro, унаслідок чого він є менш доступним для Сполучення здійснюють за допомогою будькон'югування. Сульфо-NHS, зокрема, може підвиякої хімічної реакції, яка буде з'єднувати дві молещувати стабільність карбодіімідних зв'язків. Каркули доти, доки антитіло і інший фрагмент зберібодіімідні зв'язки (наприклад, EDC), у разі застосугають свої відповідні активності. Цей зв'язок може вання у сполученні із сульфо-NHS, утворюють включати багато хімічних механізмів, наприклад, складні ефіри, які є більш стійкими до гідролізу, ковалентне зв'язування, афінне зв'язування, інтераніж сама реакція карбодіімідного сполучення. каляцію, координатне зв'язування і комплексоТермін "виділений полінуклеотид", що вживаутворювання. Зв'язком, якому віддається перевається у цьому описі, означає полінуклеотид геномга, є, однак, ковалентне зв'язування. Ковалентне ного, кДНК або синтетичного походження чи деякі зв'язування забезпечується або безпосереднім його комбінації, де згаданий "виділений полінуклеконденсуванням існуючих бічних ланцюгів, або отид", унаслідок свого походження, (1) не асоціювключенням зовнішніх місткових молекул. Багато ється із цілим або частиною полінуклеотиду, у бівалентних або полівалентних зв'язувальних агеякому "виділений полінуклеотид" знаходиться за нтів є придатними для сполучення білкових молеприродних умов, (2) є функціонально зв'язаним із кул, наприклад, антитіл за цим винаходом, з іншиполінуклеотидом, з яким він не є зв'язаним за прими молекулами. Наприклад, репрезентативними родних умов, або (3) не зустрічається у природі, як сполучними агентами можуть бути такі органічні частина більшої послідовності. сполуки, як тіоефіри, карбодііміди, складні сукциТермін "виділений білок", який згадується у німідні ефіри, діізоціанати, глутаральдегід, діазоцьому описі, означає білок кДНК, рекомбінантної бензоли і гексаметилендіаміни. Цей перелік не РНК або синтетичного походження чи деякі його вважається вичерпним для сполучних агентів різкомбінації, де згаданий "виділений білок", унасліних класів, відомих у цій галузі техніки, а, скоріше, док свого походження або джерела одержання, (1) являє собою приклад більш поширених сполучних не асоціюється з природними білками, (2) є вільагентів. (Дивись Кіллен (Killеn) та Ліндстром ним від інших білків з того самого джерела, напри(Lindstrom), Jour. Immun., 133:1335-2549 (1984); клад, є вільним від мишачих білків, (3) експресу 33 92337 34 ється клітиною іншого виду, або (4) не зустрічаєтьЗа варіантом, якому віддають перевагу, довжина ся у природі. олігонуклеотидів становить від 10 основ до 60 осТермін "поліпептид" вживається у цьому описі нов, а за варіантом, якому віддають найбільшу як узагальнюючий термін для означення нативного перевагу, вони мають у довжину 12 основ, 13 осбілка, фрагментів або аналогів послідовності полінов, 14 основ, 15 основ, 16 основ, 17 основ, 18 пептиду. Так, фрагменти нативного білка і аналоги основ, 19 основ або від 20 основ до 40 основ. Оліє видами роду поліпептидів. Поліпептиди, яким гонуклеотиди є, як правило, одноланцюговими, віддають перевагу за цим винаходом, включають наприклад, для зондів, хоча олігонуклеотиди моважкі ланцюги молекул людського імуноглобуліну, жуть бути і дволанцюговими, наприклад, для зазображені на Фіг. 1В, Фіг. 2В, Фіг. 3В і Фіг. 4В та стосування при конструюванні гена-мутанту. Олілегкі ланцюги молекул людського імуноглобуліну, гонуклеотиди за цим винаходом є смисловими або зображені на Фіг. 1D, Фіг. 2D, Фіг. 3D і Фіг. 4D, а антисмисловими олігонуклеотидами. також молекули антитіл, які одержали шляхом Термін "природні нуклеотиди", що вживається комбінацій, що містять важкі ланцюги молекул імуу цьому описі, включає дезоксирибонуклеотиди і ноглобуліну з легкими ланцюгами молекул імуногрибонуклеотиди. Термін "модифіковані нуклеотилобуліну, наприклад, каппа легкі ланцюги молекул ди", що вживається у цьому описі, включає нуклеімуноглобуліну і навпаки, а також їхні фрагменти і отиди з модифікованими або заміненими цукровианалоги. ми групами тощо. Термін "олігонуклеотидні Термін "природний", який вживають у цьому зв'язки", що вживається у цьому описі, включає описі у разі посилання на об'єкт, означає, що цей олігонуклеотидні зв'язки, наприклад, фосфоротіооб'єкт може бути знайденим у природі. Наприклад, ат, фосфородитіоат, фосфороселеноат, фосфополіпептидна або полінуклеотидна послідовність, родиселеноат, фосфороанілотіоат, фосфоранілаприсутня у організмі (у тому числі віруси), що може дат, фосфороімідат тощо. Дивись, наприклад, бути виділена з джерела у природі і не була умисЛапланш (LaPlanche) та інші, Nucl. Acids Res., но модифікована людиною у лабораторії або 14:9081 (1986); Стек (Stec) та інші, J. Am. Chem. якимсь іншим чином, є природною. Soc, 106:6077 (1984), Стейн (Stein) та інші, Nucl. Термін "функціонально зв'язаний", що вживаAcids Res., 16:3209 (1988), Зон (Zon) та інші, Anti ється у цьому описі, означає , положення подібним Cancer Drug Design, 6:539 (1991); Зон (Zon) та інші, чином описаних компонентів, що знаходяться у Oligonucleotides and Analogues: A Practical взаємозв'язку, який надає їм можливість функціоApproach, cтop. 87-108 (під редакцією Ф. Екстейн нування призначеним їм способом. Регулярна по(F. Eckstein), Oxford University Press, Oxford слідовність, "функціонально зв'язана" з кодувальEngland (1991); Стек (Stec) та інші, патент США № ною послідовністю, є лігованою таким чином, що 5,151,510; Ульман (Uhlmann), Пейман (Peyman), експресія кодувальної послідовності забезпечуChemical Reviews, 90:543 (1990). Олігонуклеотид ється за умов, сумісних зі згаданою регулярною може включати мітку для виявлення, у разі необпослідовністю. хідності. Термін "регулярна послідовність", що вживаТермін "вибірково гібридизуватись", що вживається у цьому описі, означає полінуклеотидні посється у цьому описі, означає "специфічно зв'язувалідовності, які є необхідними для здійснення екстись з можливістю виявлення". Полінуклеотиди, пресії та процесування кодувальних олігонуклеотиди і їхні фрагменти, за цим винахопослідовностей, з якими вони є лігованими. Придом, вибірково гібридизуються з нуклеїновокислорода таких регулярних послідовностей різниться у тними ланцюгами за умов гібридизації і промиванзалежності від організму-хазяїна. У прокаріотів такі ня, які зводять до мінімуму суттєву кількість регулярні послідовності, як правило, включають зв'язування, що піддається виявленню, з неспепромотор, центр зв'язування рибосом і термінатор цифічними нуклеїновими кислотами. Суворі умови транскрипції; у еукаріотів, як правило, такі регуляможуть застосовуватись для забезпечення умов рні послідовності включать промотори і термінатор вибіркової гібридизації, які є відомими у цій галузі транскрипції. Термін "регулярні послідовності" техніки і обговорюються у цьому описі. Взагалі, включає, як мінімум, усі складові, присутність яких гомологія нуклеїновокислотних послідовностей між є обов'язковою для експресії і процесування і мополінуклеотидами, олігонуклеотидами та фрагмеже також включати додаткові складові, присутність нтами за цим винаходом і нуклеїново кислотною яких є бажаною, наприклад, лідерні послідовності і послідовністю, яка становить інтерес, буде досягапослідовності партнера гібридизації. Термін "політи щонайменше 80%, а за більш типовим варіаннуклеотид", що вживається у цьому описі, означає том, якому віддають перевагу, ступінь гомології полімерну сполуку, утворену залишками монокукбуде підвищуватись щонайменше до рівня 85%, леотидів, довжиною щонайменше 10 основ, які є 90%, 95%, 99% і 100%. Дві амінокислотні послідорибонуклеотидами або дезоксинуклеотидами чи вності є гомологічними, якщо між цими послідовмодифікованою формою нуклеотиду будь-якого ностями існує часткова або повна ідентичність. типу. Згаданий термін включає однониткові і двоНаприклад, 85% гомологія означає, що 85% амінониткові форми ДНК. кислот є ідентичними, коли дві послідовності впоТермін "олігонуклеотид", що вживається у рядковано розміщують для максимальної сумісноцьому описі, включає природні і модифіковані нуксті. Двониткові розриви (у будь-якій з двох леотиди, зв'язані разом природними і штучними послідовностей, які суміщують) є припустимими, олігонуклеотидними зв'язками. Олігонуклеотиди причому перевагу віддають максимальній кількості являють собою підгрупу полінуклеотидів, довжина довжин розривів для суміщення, яка дорівнює 5 яких, як правило, становить 200 основ або менше. або менше, і більшу перевагу віддають 2 або ме 35 92337 36 нше. За альтернативним варіантом, якому відданих нуклеотидних положень або 6 амінокислот, де ється перевага, дві білкові послідовності (або пополінуклеотидна послідовність або амінокислотна ліпептидні послідовності, одержані з них, довжипослідовність може порівнюватись з еталонною ною щонайменше у 30 амінокислот) є послідовністю, що складається із щонайменше 18 гомологічними, у тому значенні, у якому цей термін суміжних нуклеотидів або 6 амінокислотних послівживають у цьому описі, якщо їхня оцінка вирівнюдовностей і де частина полінуклеотидної послідовання у балах перевищує 5 (у стандартних одинивності у порівняльному вікні може включати доцях відхилення), у разі застосування програми дання, делеції, заміни тощо (тобто двониткові ALIGN із картою мутаційних даних і штрафними розриви) (20% або менше), порівняно з еталонною балами за двонитковий розрив 6 або більше. Дипослідовністю (яка не містить додань або делецій), вись Дейхоф М.О. (DayhofFM.O.) у Atlas of Protein для оптимального вирівнювання двох послідовноSequence and Structure, стор. 101-110 (том 5, стей. Оптимальне впорядковане розміщення посNational Biomedical Research Foundation (1972)) і лідовностей для вирівнювання порівняльного вікна Додаток 2 до цього тому, стор. 1-10. Дві послідовможе здійснюватися за допомогою алгоритму лоності або їхні частини, за варіантом, якому віддакальної гомології Сміт (Smith) і Уотермен ють більшу перевагу, є гомологічними, якщо іден(Waterman), Adv. Appl. Math., 2:482 (1981), за дотичність їхніх амінокислот, у разі оптимального помогою алгоритму порівняльного аналізу гомоловирівнювання із застосуванням програми ALIGN, гії Нідлмен (Needleman) і Вунш (Wunsch), J. Mol. перевищує або дорівнює 50%. Термін "відповідає", Віоl., 48:443 (1970), за допомогою методу досліщо вживається у цьому описі, означає, що полінудження для встановлення подібності Пірсон клеотидна послідовність є гомологічною (тобто є (Pearson) і Ліпмен (Lipman), Proc. Nail. Acad. Sci. ідентичною, не суворо еволюційно спорідненою) (U.S.A.), 85:2444 (1988), за допомогою комп'ютериусій або частині еталонної полінуклеотидної посзованого застосування цих алгоритмів (GAP, лідовності, або що поліпептидна послідовність є BESTFIT, FASTA та TFASTA у пакеті програм ідентичною еталонній поліпептидній послідовності. Wisconsin Genetics Software Package Release 7.0, У протилежність до цього, термін "комплементар(Genetics Computer Group, 575 Science Dr., ний", що вживається у цьому описі, означає, що Madison, штат Вісконсін), пакет програм комплементарна послідовність є гомологічною Geneworks або Мас Vector) або шляхом огляду, і цілій або частині еталонної полінуклеотидної посвибирають найкраще впорядковане розміщення лідовності. Для ілюстрації, нуклеотидна послідов(тобто таке, наслідком якого є найвищий відсоток ність "ТАТАС" відповідає еталонній послідовності гомології у порівняльному вікні), що забезпечуєть"ТАТАС" і є комплементарною еталонній послідовся різними методами. ності "GTATA". Термін "ідентичність послідовностей" означає, Наведені нижче терміни вживають для опису шо дві полінуклеотидні або амінокислотні послідовзаємозв'язків послідовностей між двома або деківності є ідентичними (тобто на основі порівняння лькома полінуклеотидними або амінокислотними нуклеотидів або залишків) у порівняльному вікні. послідовностями: "еталонна послідовність", "порі"Відсоток ідентичності послідовностей" обчислювняльне вікно", "ідентичність послідовностей", "віють шляхом порівняння двох оптимально впоряддсоток ідентичності послідовностей" та "суттєва ковано розміщених послідовностей у порівняльноідентичність". "Еталонною послідовністю" є визнаму вікні, з визначенням кількості положень, у яких чена послідовність, що застосовується як основа у обох послідовностях знаходяться ідентичні нукдля порівняння послідовностей. Еталонна послілеїновокислотні основи (наприклад, А, Т, С, G, U довність може бути підгрупою більшої послідовноабо І) або залишки, з одержанням кількості сумісті, наприклад, як сегмент непроцесованої кДНК щених положень, поділом кількості суміщених поабо послідовності гена, наведеної у лістингу посложень на загальну кількість положень у порівнялідовностей, або може являти собою повну кДНК льному вікні (тобто розмір вікна) і множенням чи послідовність гена. Взагалі, еталонна послідоврезультату на 100 для одержання відсотка ідентиність має щонайменше 18 нуклеотидів або 6 амічності послідовностей. Термін "суттєва ідентичнокислот у довжину, часто щонайменше 24 нукленість", що вживається у цьому описі, означає хараотиди або 8 амінокислот і часто щонайменше 48 ктеристику полінуклеотидної або амінокислотної нуклеотидів або 16 амінокислот у довжину. Оскільпослідовності, де згаданий полінуклеотид або аміки з двох полінуклеотидів або амінокислотних поснокислота містить послідовність, що має ідентичлідовностей кожен(-на) може (1) включати посліність послідовностей щонайменше 85%, за варіандовність (тобто частину повного полінуклеотиду том, якому віддають перевагу, ідентичність або повної амінокислотної послідовності), що є послідовностей щонайменше 90-95%, в більшості подібною між двома молекулами і (2) може додатвипадків відсоткову ідентичність послідовностей ково включати послідовність, яка різниться між щонайменше 99%, порівняно з еталонною послідвома полінуклеотидами або амінокислотними довністю у порівняльному вікні із щонайменше 18 послідовностями, порівняння послідовностей між нуклеотидних (6 амінокислотних) положень, часто двома (або декількома) молекулами здійснюють, у вікні із щонайменше 24-48 нуклеотидних (8-16 як правило, шляхом порівняння послідовностей амінокислотних) положень, де відсоток ідентичнодвох молекул у "порівняльному вікні" для ідентисті послідовностей обчислюють шляхом порівнянфікації і порівняння місцевих ділянок подібності ня еталонної послідовності з послідовністю, яка послідовностей. Термін "порівняльне вікно", що може включати делеції або додання, які у цілому вживається у цьому описі, означає абстрактний складають 20% або менше від еталонної послідосегмент, що складається із щонайменше 18 суміжвності у порівняльному вікні. Згадана еталонна 37 92337 38 послідовність може бути підгрупою більшої посліпою амінокислот, що мають основні бічні ланцюги, довності. є лізин, аргінін і гістидин; і групою амінокислот, що Двадцять традиційних амінокислот і їхні скомають сірковмісні бічні ланцюги, є цистеїн та метірочення, вживані у цьому описі, відповідають траонін. Замісними консервативними амінокислотнидиційному застосуванню. Дивись Immunology - A ми групами, яким віддають перевагу, є: валінSynthesis (2-е видання, Е.С. Голуб (E.S. Golub) та лейцин-ізолейцин, фенілаланін-тирозин, лізинД.Р. Грен (D.R. Gren) (редактори), Sinauer аргінін, аланін-валін, глутамінова кислотаAssociates, Sunderland, штат Массачусетс (1991)). аспарагінова кислота і аспарагін-глутамін. Стереоізомери (наприклад, D-амінокислоти) дваЯк обговорюється у цьому описі, незначні змідцяти традиційних амінокислот, штучні амінокисни амінокислотних послідовностей антитіл або молекул імуноглобулінів передбачаються як такі, лоти, наприклад, -, -двозаміщені амінокислоти, що охоплюються цим винаходом, за умови, що у N-алкільні амінокислоти, молочна кислота та інші разі змін амінокислотна послідовність зберігається нетрадиційні амінокислоти, можуть також бути щонайменше на 75%, за варіантом, якому віддапридатними складовими для поліпептидів за цим ють перевагу, щонайменше на 80%, 90%, 95%, а винаходом. Приклади нетрадиційних амінокислот за варіантом, якому віддають найбільшу перевагу, включають: 4-гідроксипролін, -карбоксиглутамат, на 99%. Передбачаються, зокрема, консервативні -Ν,Ν,Ν-триметиллізин, -Ν-ацетиллізин, Оамінокислотні заміни. Консервативними замшами фосфосерин, N-ацетилсерин, N-формілметіонін, 3є заміни, які відбуваються у сімействі амінокислот, метилгістидин, 5-гідроксилізин, -Ν-метиларгінін які є спорідненими за своїми бічними ланцюгами. та інші подібні амінокислоти та імінокислоти (наГенетично закодовані амінокислоти, як правило, приклад, 4-гідроксипролін). У позначенні поліпеппідрозділяються на сімейства: (1) кислими амінотидів, що вживаються у цьому описі, лівостороннім кислотами є аспартат, глутамат; (2) основними напрямком є амінокінцевий напрямок, а правостоамінокислотами є лізин, аргінін, гістидин; (3) непороннім напрямком є карбоксикінцевий напрямок, лярними амінокислотами є аланін, валін, лейцин, відповідно до стандартного застосування і звичаю. ізолейцин, пролін, фенілаланін, метіонін, триптоПодібним чином, якщо не вказано інше, лівосфан і (4) незарядженими полярними амінокислотороннім кінцем однониткових полінуклеотидних тами є гліцин, аспарагін, глутамін, цистеїн, серин, послідовностей є 5'-кінець; лівосторонній напрямок треонін, тирозин. До гідрофільних амінокислот двониткових полінуклеотидних послідовностей належать аргінін, аспарагін, аспартат, глутамін, називають 5'-напрямком. Напрямок 5'3' додання глутамат, гістидин, лізин, серин і треонін. До гідтранскриптів РНК, що виникають, називають нарофобних амінокислот належать аланін, цистеїн, прямком транскрипції. Ділянки послідовності нитки ізолейцин, лейцин, метіонін, фенілаланін, пролін, ДНК, що мають таку саму послідовність, що і РНК, триптофан, тирозин і валін. Іншими сімействами і які знаходяться у 5' положенні відносно 5'-кінця амінокислот є (і) серин і треонін, які являють сотранскрипту РНК, називають "послідовностями 3'бою аліфатично-гідроксильне сімейство; (іі) аспа5'-напряму", ділянки послідовності нитки ДНК, що рагін і глутамін, які являють собою амідовмісне мають таку саму послідовність, що і РНК, і які знасімейство; (ііі) аланін, валін, лейцин і ізолейцин, які ходяться у 3' положенні відносно 3'-кінця транскявляють собою аліфатичне сімейство; та (iv) фенірипту РНК, називають "послідовностями 5'-3'лаланін, триптофан і тирозин, які являють собою напряму". ароматичне сімейство. Наприклад, виправданим є Щодо поліпептидів, термін "суттєва ідентичочікування того, що окрема заміна лейцину на ізоність" означає, що дві пептидні послідовності, у лейцин або валін, аспартату на глутамат, треоніну разі оптимального впорядкованого розміщення, на серин або подібна заміна амінокислоти на струнаприклад, за допомогою програм GAP або ктурно споріднену амінокислоту не буде мати сутBESTFIT із застосуванням мас відсутніх двониткотєвого впливу на зв'язування або властивості одевих розривів, мають ідентичність послідовностей ржаної у результаті молекули, зокрема, якщо щонайменше 80%, за варіантом, якому віддають заміна не залучає амінокислоти, яка знаходиться у перевагу, ідентичність послідовностей щонайменмежах каркасної ділянки. Чи забезпечить амінокише 90%, за варіантом, якому віддають більшу песлотна заміна одержання функціонального пептиревагу, ідентичність послідовностей щонайменше ду, може легко бути визначено шляхом випробу95%, і за варіантом, якому віддають найбільшу вання специфічної активності поліпептидної перевагу, ідентичність послідовностей щонайменпохідної. Докладний опис аналізів наводиться. ше 99%. Фрагменти або аналоги антитіл або молекул імуЗа варіантом, якому віддають перевагу, полоноглобулінів можуть бути легко одержані пересічження залишків, які не є ідентичними, різняться ними фахівцями у цій галузі техніки. Аміно- і карконсервативними амінокислотними замшами. боксикінці фрагментів або аналогів, яким віддають Консервативні амінокислотні заміни означають перевагу, знаходяться поблизу меж функціональвзаємозамінність залишків, що мають однакові них доменів. Структурні і функціональні домени бічні ланцюги. Наприклад, групою амінокислот, що можуть бути ідентифіковані шляхом порівняння мають аліфатичні бічні ланцюги, є гліцин, аланін, даних щодо нуклеотидних та/або амінокислотних валін, лейцин та ізолейцин; групою амінокислот, послідовностей із суспільними або приватними що мають аліфатично-гідроксильні бічні ланцюги, базами даних із послідовностями. За варіантом, є серин і треонін; групою амінокислот, що мають якому віддають перевагу, методи комп'ютеризоваамідовмісні бічні ланцюги, є аспарагін і глутамін; ного порівняння застосовуються для ідентифікугрупою амінокислот, що мають ароматичні бічні вання ділянок послідовностей або запрогнозоваланцюги, є фенілаланін, тирозин і триптофан; гру 39 92337 40 них конформаційних доменів білків, які зустрічатей: (1) специфічне зв'язування з IFN за відповідються у інших білків відомої структури та/або фунних умов зв'язування, (2) здатність до блокування кції. Відомими є методи ідентифікування білкових зв'язування відповідного IFN або (3) здатність до послідовностей, які укладаються у відому тривиміпригнічення росту клітин, що експресують IFN, in рну структуру. Боуі (Bowie) та інші, Science 253:164 vitro або in vivo. За типовим варіантом, аналоги (1991). Так, вищенаведені приклади демонструполіпептидів містять консервативну амінокислотну ють, що фахівці у цій галузі техніки можуть розпізаміну (або додання чи делецію), порівняно з признати ділянки послідовностей і структурні конфорродною послідовністю. Аналоги, як правило, мамації, які можуть застосовуватись для визначення ють у довжину щонайменше 20 амінокислот, за структурних і функціональних доменів за цим виваріантом, якому віддають перевагу, мають у довнаходом. жину 50 амінокислот або більше, і часто їхня довАмінокислотними замшами, яким віддають пежина може дорівнювати довжині непроцесованого ревагу, є заміни, які: (1) знижують ступінь сприйняприродного поліпептиду. тливості до протеолізу, (2) знижують ступінь Аналоги пептидів широко застосовують у фасприйнятливості до окиснення, (3) знижують стурмацевтичній промисловості як непептидні лікарпінь зв'язувальної спорідненості до утворення білські засоби з властивостями, аналогічними власкових комплексів, (4) знижують ступінь зв'язувальтивостям матричного пептиду. Непептидні сполуки них спорідненостей і (5) надають або модифікують подібних типів називають "пептидними міметикаінші фізико-хімічні або функціональні властивості ми" або "пептидоміметиками". Фушер Дж. таких аналогів. Аналоги можуть включати різнома(Fauchere J.), Adv. Drug Res., 15:29 (1986), Вебер нітні мутеїни послідовності, за виключенням при(Veber), Фрейдінгер (Freidinger), TINS, стор. 392 родної пептидної послідовності. Наприклад, одно(1985); Еванс (Evans) та інші, J. Med. Chem., разова амінокислотна заміна або численні 30:1229 (1987). Такі сполуки часто розробляють за амінокислотні заміни (за варіантом, якому віддадопомогою комп'ютеризованого молекулярного ють перевагу, консервативні амінокислотні заміни) моделювання. Пептидні міметики, що є структурно можуть здійснюватись у природній послідовності подібними до терапевтично придатних пептидів, (за варіантом, якому віддають перевагу, на ділянці можуть застосовуватись для здійснення еквівалеполіпептиду за межами домену(-ів), що утворює нтного терапевтичного або профілактичного ефекміжмолекулярні контакти). Консервативна амінокиту. Взагалі, пептидоміметики є структурно подібслотна заміна не повинна суттєво змінювати струними до зразкового поліпептиду (тобто ктурних характеристик вихідної послідовності (наполіпептиду, що має біохімічну властивість або приклад, замінна амінокислота не повинна мати фармакологічну активність), наприклад, людського схильності до руйнування спіралі, яка існує у вихіантитіла, але має один або декілька пептидних дній послідовності, або до руйнування вторинної зв'язків, факультативно замінених на зв'язок, вибструктури інших типів, яка характеризує вихідну раний з групи, яку складають: -CH2NH-, -CH2S-, послідовність). Приклади визнаних у цій галузі СН2-СН2-, -СН=СН- (цис і транс), -СОСН2-, техніки вторинних і третинних структур поліпептиСН(ОН)СН2- та -CH2SO-, способами, добре відодів описані у Proteins, Structures and Molecular мими у цій галузі техніки. Систематична заміна Principles (під редакцією Крайтон (Creighton), W.H. однієї або декількох амінокислот консенсусної поFreeman and Company, New York (1984); слідовності на D-амінокислоту того самого типу Introduction to Protein Structure (під редакцією К. (наприклад, D-лізин замість L-лізину) може застоБранден (С. Branden) і Дж. Туз (J. Tooze), Garland совуватись для одержання більш стійких пептидів. Publishing, New York, N.Y. (1991); Торнтон На додаток до цього, конформаційно обмежені (Thornton) та інші, Nature, 354:105 (1991). пептиди, що містять консенсусну послідовність Термін "поліпептидний фрагмент", який вжиабо по суті варіацію ідентичної консенсусної посвають у цьому описі, означає поліпептид, що має лідовності, можуть бути одержані за допомогою амінокінцеву та/або карбоксикінцеву делецію, але способів, відомих у цій галузі техніки (Різо (Rizo), де залишкова амінокислотна послідовність є іденГіраш (Gierasch), Ann. Rev. Biochem., 61:387 тичною відповідним положенням природної послі(1992)); наприклад, шляхом додання внутрішніх довності, як визначають, наприклад, за непроцезалишків цистеїну, здатних до утворення внутрішсованою послідовністю кДНК. Фрагменти, як ньомолекулярних дисульфідних місткових зв'язків, правило, мають у довжину щонайменше 5 аміноякі циклізують пептид. кислот, 6 амінокислот, 8 амінокислот або 10 аміноТермін "агент" вживають у цьому описі для покислот, за варіантом, якому віддають перевагу, значення хімічної сполуки, суміші хімічних сполук, їхня довжина становить щонайменше 14 амінокисбіологічної макромолекули або екстракту, одержалот, за варіантом, якому віддають більшу переваного з біологічних матеріалів. гу, їхня довжина становить щонайменше 20 аміноТерміни "мітка" або "мічений", які вживають у кислоти, як правило, їхня довжина становить цьому описі, означають включення маркера, що щонайменше 50 амінокислот, а за варіантом, якопіддається виявленню, наприклад, шляхом вклюму віддають більшу перевагу, їхня довжина станочення амінокислоти, міченої радіоактивним ізотовить навіть щонайменше 70 амінокислот. Термін пом, або приєднання до поліпептиду біотинілова"аналог", який вживають у цьому описі, означає ного фрагмента, який може бути виявлений поліпептиди, які містять сегмент щонайменше з 25 міченим авідином (наприклад, стрептавідин, що амінокислот, що є по суті ідентичним частині вимістить флуоресцентний маркер або має фермензначеної амінокислотної послідовності і який має тативну активність, яка може бути виявлена оптищонайменше одну з наведених нижче властивосчними або калориметричними методами). За пев 41 92337 42 них ситуацій, мітка або маркер можуть також бути huIFN антитіло одержують, наприклад, за метерапевтичним препаратом. У цій галузі техніки тодиками, опис яких подано у прикладах, наведевідомими є різноманітні способи мічення поліпепних нижче. IgG huIFN антитіло одержують, напритидів і глікопротеїнів, які можуть застосовуватись. клад, шляхом перетворення клону scFv на IgG Прикладами міток для поліпептидів є (але без обформат (дивись, наприклад, Приклад 6) За альтемеження) наведені нижче: радіоізотопи або радіорнативним варіантом, таке huIFN антитіло одернукліди (наприклад, 3Н, 14С, 15N, 35S, 90Y, 99Тс, 111Іn, жують, наприклад, за допомогою методів прояв125 131 І, І), флуоресцентні мітки (наприклад, FITC лення у фагах із застосуванням антитіл, що (флуоресцинізотіоціанат), родамін, лантанідні люмістять лише людські послідовності. Такі варіанти мінофори), ферментативні мітки (наприклад, перопідходу є добре відомими у цій галузі техніки, наксидаза з хрону, n-галактозидаза, люцифераза, приклад, у WO 92/01047 та патенті США № лужна фосфатаза), хемілюмінесцентні сполуки, 6,521,404, які включено до цього опису шляхом біотиніловані групи, попередньо визначені поліпепосилання. За цим варіантом підходу, комбінаторптидні антигенні детермінанти, які розпізнаються ну бібліотеку фага, що несе довільні пари легких і вторинною репортерною групою (наприклад, посважких ланцюгів, перевіряють за допомогою прилідовності лейцинових лінкерних пар, центри зв'яродного або рекомбінантного джерела IFN або зування "вторинних" антитіл, домени зв'язування його фрагментів. металу, мітки антигенних детермінант). За деякиhuIFN антитіло продукують способом, де щоми варіантами здійснення, мітки приєднуються за найменше одна стадія згаданого способу включає допомогою спейсерних груп різної довжини для імунізацію трансгенної тварини (окрім людини) зменшення потенційної стеричної невідповідності. людським IFN білком. Деякі з ендогенних локусів Термін "фармацевтичний засіб або лікарський заважких та/або каппа легких ланцюгів цієї ксеногенсіб", який вживають у цьому описі, означає хімічну ної тварини (окрім людини) були блоковані і є несполуку або композицію, здатну до індукування здатними до реаранжування, необхідного для бажаного терапевтичного ефекту у разі відповідпродукування генів, що кодують імуноглобуліни у ного введення хворому. відповідь на антиген. На додаток до цього, щоІнші хімічні терміни у цьому описі вживають вінайменше один людський локус важкого ланцюга і дповідно до традиційного вживання у цій галузі, щонайменше один людський локус легкого ланцюприклади якого наводяться у словнику хімічних га були стабільно трансфіковані до згаданої тватермінів The McGraw-Hill Dictionary of Chemical рини. Таким чином, у відповідь на введений антиTerms (під редакцією Паркер С. (Parker S.), ген, людські локуси реаранжуються для McGraw-Hill, San Francisco (1985)). продукування генів, що кодують людські варіабеТермін "протипухлинний засіб" вживають у льні ділянки, імуносдецифічні відносно згаданого цьому описі для означення засобів, функціональна антигену. Завдяки цьому, у разі імунізації, ксеновластивість яких полягає у пригніченні розвитку генна миша продукує В-клітини, які секретують або прогресування пухлини у людини, зокрема, повністю людські імуноглобуліни. злоякісного (ракового) ураження, наприклад, карУ цій галузі техніки є добре відомими різномациноми, саркоми, лімфоми або лейкозу. Властивінітні способи одержання ксеногенних тварин стю протипухлинних засобів часто є пригнічення (окрім людини). Дивись, наприклад, патенти США метастазів. № 6,075,181 та № 6,150,584. За однією зі стратеСловосполучення "по суті чистий", яке вживагій, ксеногенні (людські) гени важких і легких ланють у цьому описі, означає цільовий різновид у цюгів імуноглобулінів вволять до зародкової лініїпереважному присутньому різновиді (тобто на мохазяїна (наприклад, сперматозоїдів або овоцитів) і, лярній основі кількість цього різновиду є більшою на окремих стадіях, функціональність відповідних за кількість будь-якого іншого окремо взятого різгенів-хазяїв блокують шляхом інактивації із застоновиду у цій композиції), а, за варіантом, якому суванням гомологічної рекомбінації. Людські гени віддають перевагу, по суті очищеною фракцією є важких і легких ланцюгів імуноглобулінів реконсткомпозиція, де цільовий різновид становить щоруюють у відповідному еукаріотному або прокаріонайменше приблизно 50% (на молярній основі) від тному мікроорганізмі, і одержані фрагменти ДНК усіх присутніх макромолекулярних різновидів. вводять до відповідного хазяїна, наприклад, до Взагалі, по суті чиста композиція буде містити пронуклеусів запліднених мишачих овоцитів або більше за приблизно 80% від усіх макромолекуляембріональних стовбурових клітин. Інактивація рних різновидів, присутніх у згаданій композиції, за ендогенних імуноглобулінових локусів хазяїна заваріантом, якому віддають більшу перевагу, більбезпечується спрямованим руйнуванням відповідше за приблизно 85%, 90%, 95% та 99%. За варіаних локусів шляхом гомологічної рекомбінації у нтом, якому віддають найбільшу перевагу, цільоклітинах-хазяях, зокрема, ембріональних стовбувий різновид очищають до суттєвої однорідності рових клітинах або пронуклеусах запліднених ми(забруднювальні різновиди не можуть бути виявшачих овоцитів. Спрямоване руйнування може лені у згаданій композиції за допомогою традиційвключати спричинення пошкодження або введенних способів виявлення), де згадана композиція ня делеції до локусу-мішені або делеції у межах складається по суті з одного макромолекулярного локусу-мішені, що супроводжується інсерцією до різновиду. згаданого локусу, наприклад, інсерцією селективТермін "хворий" включає людину і ветеринарні ного маркера. У разі ембріональних стовбурових суб'єкти. Термін "суб'єкт" включає людей та інших клітин, одержують химерних тварин, які частково ссавців. походять від модифікованих ембріональних стовЛюдські антитіла і гуманізація антитіл бурових клітин і є здатними до передачі генетич 43 92337 44 них модифікацій через зародкову лінію. Парування подана 28 квітня 1994 року), № 08/376,279 (яка хазяїв із введеними людськими імуноглобуліновибула подана 20 січня 1995 року), № 08/430,938 ми локусами з лініями з інактивованими ендоген(яка була подана 27 квітня 1995 року), № ними локусами забезпечить одержання тварин, які 08/464,584 (яка була подана 5 липня 1995 року), будуть продукувати виключно ксеногенні, напри№ 08/464,582 (яка була подана 5 липня 1995 роклад, людські, антитіла. ку), № 08/463,191 (яка була подана 5 липня 1995 За альтернативною стратегією, принаймні чароку), № 08/462,837 (яка була подана 5 липня стини людських локусів важких і легких ланцюгів 1995 року), № 08/486,583 (яка була подана 5 липімуноглобулінів застосовують для безпосередньої ня 1995 року), № 08/486,587 (яка була подана 5 заміни відповідних ендогенних локусів імуноглобулипня 1995 року), № 08/486,859 (яка була подана лінів шляхом гомологічної рекомбінації в ембріо5 липня 1995 року), № 08/462,513 (яка була поданальних стовбурових клітинах. Наслідком цього є на 5 липня 1995 року), № 08/724,752 (яка була одночасна інактивація і заміна ендогенного імуноподана 2 жовтня 1996 року) та № 08/759,620 (яка глобуліну. Після цього одержують химерних твабула подана 3 грудня 1996 року) та патентах США рин, у яких клітини, одержані з ембріональних сто№ 6,162,963, № 6,150,584, № 6,144,598, № вбурових клітин, можуть додавати свій внесок до 6,075,181 та № 5,939,598 і патентах Японії № зародкових ліній. 3068180 В2, № 3068506 В2 та № 3068507 В2. ДиНаприклад, клон В-клітин, що експресує людвись також Мендес (Mendez) та інші, Nature Genetics, 15:146-156 (1997) та Грін (Green) і Якоське анти-IFN антитіло, видаляють із ксеногенної бовіц (Jakobovits), J. Exp. Med., 188:483-495 (1998). тварини (окрім людини) та імморталізують за доДивись також європейський патент № ЕР 0463151 помогою різних способів, відомих у цій галузі техВ1, опублікований 12 липня 1996 року, заявку на ніки. Такі В-клітини можуть бути одержані безпоміжнародний патент WO 94/02602, опубліковану 3 середньо з крові згаданої тварини або з лютого 1994 року, заявку на міжнародний патент лімфоїдних тканин, із включенням (але без обмеWO 96/34096, опубліковану 31 жовтня 1996 року, ження) селезінки, мигдаликів, лімфатичних вузлів і WO 98/24893, опубліковану 11 липня 1998 року, кісткового мозку. Одержані подібним чином імморWO 00/76310, опубліковану 21 грудня 2000 року. талізовані В-клітини можуть розмножуватись і куЗа альтернативним варіантом, інші застосувальтивуватись in vitro з одержанням великих, клініли варіант підходу з "мінілокусом". За варіантом чно застосовних кількостей huIFN антитіла. За підходу з мінілокусом, екзогенний Ig локус імітують альтернативним варіантом, гени, що кодують імушляхом включення частин (окремих генів) з Ig лоноглобуліни з однією або декількома людськими кусу. Таким чином, один або декілька VH генів, варіабельними ділянками, можуть виділятись і один або декілька DH генів, один або декілька JH експресуватись у клітинах іншого типу, у тому чисгенів, константну ділянку мю і другу константну лі (але без обмеження), у системі культивування ділянку (за варіантом, якому віддають перевагу, клітин ссавців, для безпосереднього одержання константну ділянку гамма) об'єднують у формі антитіл або їх окремих ланцюгів, що складаються з генно-інженерної конструкції для введення твариодноланцюгових Fv-молекул. ні. Цей варіант підходу описують у патенті США № На додаток до цього, уся популяція повністю 5,545,807 на ім'я Сурані (Surani) та інших, патентах людських анти-IFN антитіл, продукованих ксеноСША № 5,545,806, № 5,625,825, № 5,625,126, № генною твариною (окрім людини), може перевіря5,633,425, № 5,661,016, № 5,770,429, № 5,789,650, тись для ідентифікування одного такого клону з № 5,814,318, № 5,877,397, № 5,874,299 та № оптимальними характеристиками. Такі характери6,255,458, кожен на ім'я Лонберг (Lonber) та Кей стики включають, наприклад, зв'язувальну спорід(Кау), патентах США № 5,591,669 та № 6,023,010 неність до людського IFN білка, стабільність взана ім'я Крімпенфорт (Krimpenfort) та Берне (Berns), ємодії, а також ізотип повністю людського антипатентах США № 5,612,205, № 5,721,367 та № IFN антитіла. Клони усієї популяції, які мають ба5,789,215 на ім'я Берне (Berns) та інші, патенті жані характеристики, у подальшому застосовують США № 5,643,763 на ім'я Чой (Choi) і Данн (Dunn), як джерело нуклеотидних послідовностей, що козаявках компанії GenPharm на міжнародний патент дують бажані варіабельні ділянки, для подальшого реєстраційні № 07/574,748, яка була подана 29 маніпулювання з метою продукування антитіл із серпня 1990 року, № 07/575,962, яка була подана такими характеристиками у інших системах клітин 31 серпня 1990 року, № 07/810,279, яка була поіз застосуванням традиційних рекомбінантних або дана 17 грудня 1991 року, № 07/853,408, яка була трансгенних методів. подана 18 березня 1992 року, № 07/904,068, яка Подібна загальна стратегія була продемонстбула подана 23 липня 1992 року, № 07/990,860, рована у зв'язку з одержанням перших ліній яка була подана 16 грудня 1992 року, № XenoMouse (ксеногенних мишей), як було опуб08/053,131, яка була подана 26 квітня 1993 року, ліковано у 1994 році. Дивись Грін (Green) та інші, № 08/096,762, яка була подана 22 червня 1993 Nature Genetics, 7:13-21 (1994). Цей підхід додатроку, № 08/155,301, яка була подана 18 листопада ково обговорюють і описують у заявках на патент 1993 року, № 08/161,739, яка була подана 3 грудня США № 07/466,008 (яка була подана 12 січня 1990 1993 року, № 08/165,699, яка була подана 10 грудроку), № 07/610,515 (яка була подана 7 листопада ня 1993 року, №08/209,741, яка була подана 9 бе1990 року), № 07/919,297 (яка була подана 24 черрезня 1994 року. Дивись також європейський павня 1992 року), № 07/922,649 (яка була подана 30 тент № 0546073 В1, міжнародні заявки на патент червня 1992 року), № 08/031,801 (яка була подана WO 92/03918, WO 92/22645, WO 92/22647, WO 15 березня 1993 року), №08/112,848 (яка була по92/22670, WO 93/12227, WO 94/00569, WO дана 27 серпня 1993 року), № 08/234,145 (яка була 45 92337 46 94/25585, WO 96/14436, WO 97/13852 та WO становить інтерес, може бути ампліфікована за 98/24884 і патент США № 5,981,175. Дивись, додадопомогою полімеразної ланцюгової реакції із затково, Тейлор (Taylor) та інші, 1992, Чен (Chen) та стосуванням специфічних праймерів (патенти інші, 1993, Туайон (Тuаillоn) та інші, 1993, Чой США № 4,683,195 та № 4,683,202). За альтерна(Choi) та інші, 1993, Лонберг (Lonberg) та інші, тивним варіантом, створюють і перевіряють біблі(1994), Тейлор (Taylor) та інші, (1994), Туайон отеку для виділення послідовності, яка становить (Тuаillоn) та інші, (1995), Фішвілд (Fishwild) та інші, інтерес. Після цього послідовність ДНК, яка кодує (1996). варіабельну ділянку антитіла, гібридизують із Перевага варіанту підходу з мінілокусом полялюдськими послідовностями константних ділянок. гає у швидкості, з якою можуть бути одержані і Послідовності людських генів константних ділянок введені тваринам генно-інженерні конструкції, до можна знайти у Кебот (Kabat) та інші, (1991), складу яких входять частини Ig локусу. Відповідно, Sequences of Proteins of Immunological Interest, однак, значний недолік варіанту підходу з мінілопублікація N.I.H. № 91-3242. Гени людської С ділякусом полягає у тому, що, теоретично, шляхом нки є легко доступними з відомих клонів. При вивведення невеликої кількості V, D і J генів ввоборі ізотипу будуть керуватись бажаними ефектодиться недостатня різноманітність. Дійсно, опублірними функціями, наприклад, зв'язуванням кована робота, як видається, підтримує це занепокомплементу або активністю у антитілозалежній коєння. Одержання В-клітин і продукування клітинній цитотоксичності. Ізотипами, яким віддаантитіл тваринами за варіантом підходу з мінілоють перевагу, є lgG1, IgG3 та IgG4. Застосовувакусом видається занадто уповільненим. Унаслідок тись можуть будь-які людські константні ділянки цього, дослідження, пов'язане із цим винаходом, легкого ланцюга, каппа або ламбда. Після цього постійно спрямовувалось на введення великих химерне гуманізоване антитіло експресують трачастин Ig локусу з метою досягнення більшого диційними способами. розмаїття і у намаганні відновити імунний спектр Фрагменти антитіл, наприклад, Fv, F(ab')2 і тварин. Fab, можна одержати шляхом розщеплення інтакБуло також продемонстровано продукування тного білка, наприклад, за допомогою протеази людських антитіл мишами, яким, шляхом злиття або шляхом хімічного розщеплення. За альтернамініатюрних клітин, були введеш великі частини тивним варіантом, конструюється скорочений ген. хромосом або хромосоми у цілому. Дивись заявки Наприклад, химерний ген, що кодує частину на європейський патент № 773288 та № 843961. F(аb')2-фрагмента, повинен включати послідовносРеакція на людські антимишачі антитіла (НАті ДНК, що кодують домен СН1 і шарнірну ділянку МА) примусила цю галузь промисловості звернуΗ ланцюга, за якими буде знаходитись кодон, що тись до одержання химерних або іншим чином термінує трансляцію, для одержання скороченої гуманізованих антитіл. Незважаючи на те, що химолекули. мерні антитіла мають людську константну ділянку Консенсусні послідовності Н, L і J ділянок мота імунокомпетентну варіабельну ділянку, очікужуть застосовуватись для конструювання олігонують, що на людські антихимерні антитіла (НАСА) клеотидів для застосування у ролі праймерів для також будуть спостерігатись певні реакції, зокревставляння придатних сайтів рестрикції до J діляма, у разі постійного або багатодозового застосунки для подальшого літування сегментів V ділянки вання цього антитіла. Таким чином, бажано було б до сегментів людської С ділянки. кДНК С ділянки може модифікуватись сайт-спрямованим мутагенадати повністю людські антитіла проти IFN для незом для розміщення сайту у аналогічному полозведення нанівець занепокоєнь та/або ефектів женні у людській послідовності. реакції на НАМА або НАСА. Вектори експресії включають плазміди, ретроПродукування антитіл зі зниженою імуногеннівіруси, YACs (штучні дріжджові хромосоми), епісостю також здійснюється шляхом гуманізації і метоми EBV (вірус Епштейн-Барра) тощо. Зручним векдів проявлення із застосуванням відповідних бібтором є вектор, який кодує функціонально повну ліотек. Буде зрозуміло, що мишачі антитіла або людську СН або CL імуноглобулінову послідовантитіла від інших видів можуть бути гуманізованість із відповідними сайтами рестрикції, сконструними або приматизованими за допомогою методів, йованими таким чином, що будь-яка VH або VL-31 добре відомих у цій галузі техніки. Дивись, наприпослідовність може бути легко вставленою і ексклад, Вінтер (Winter) та Гарріс (Harris), Immunol. пресованою. У таких векторах сплайсинг, як праToday, 14:43-46 (1993) і Райт (Wright) та інші, Crit. вило, відбувається між донорною точкою сплайсиReviews in Immunol, 12125-12168 (1992). Антитіло, нгу у вставленій J ділянці та акцепторного точкою яке становить інтерес, може бути сконструйоване сплайсингу, що передує людській С ділянці, а таза допомогою методів рекомбінантних ДНК для кож на ділянках сплайсингу, які знаходяться у мезаміни ділянок СН1, СН2, CH3, шарнірних ділянок жах людських СН екзонів. Поліаденілування і терта/або каркасної ділянки на відповідну людську мінація транскрипції відбувається на нативних послідовність (дивись WO 92102190 та патенти хромосомних сайтах у 5'-3'-напрямку відносно коСША № 5,530,101, № 5,585,089, № 5,693,761, № дувальник ділянок. Одержане химерне антитіло 5,693,792, № 5,714,350 і № 5,777,085). У цій галузі може приєднуватись до будь-якого сильного протехніки відомим також є застосування Ig кДНК для мотора, у тому числі довгих кінцевих повторів конструювання химерних імуноглобулінових генів (LTR) ретровірусу, наприклад, раннього промотора (Лю (Liu) та інші, P.N.A.S., 84:3439 (1987) і J. SV-40 (мавпячий вірус-40) (Окаяма (Okayama) та Immunol, 139:3521 (1987)). мРНК виділяють із гібінші, Mol. Cell. Bio., 3:280 (1983)), довгого кінцевого ридоми або іншої клітини, що продукує антитіло, і повтору вірусу саркоми Рауса (Горман (Gorman) та застосовують для продукування кДНК. кДНК, яка 47 92337 48 інші, P.N.A.S., 79:6777 (1982)) і довгого кінцевого Methods, 4:72-81 (1994), Райт (Wright) і Гарріс повтору вірусу мишачого лейкозу Молоні (Гросс(Harris), дивись вище, а у зв'язку з (ііі), дивись, нашедл (Grosschedl) та інші, Cell, 41:885 (1985)). приклад, Траунекер (Traunecker) та інші, Int. J. Зрозумілим буде також те, що можуть застосовуCancer (Додаток), 7:51-52 (1992). ватись нативні Ig промотори тощо. У зв'язку з імунотоксинами, антитіла можуть На додаток до цього, людські антитіла або анмодифікуватись таким чином, щоб відігравати титіла від інших видів можуть одержуватись за роль імунотоксинів, із застосуванням методів, додопомогою методів проявлення, у тому числі (без бре відомих у цій галузі техніки. Дивись, наприобмеження), проявлення у фагах, проявлення у клад, Вітетта (Vitetta), Immunol. Today, 14:252 ретровірусах, проявлення у рибосомах та інших (1993). Дивись також патент США № 5,194,594. У методів, із застосуванням методів, добре відомих зв'язку з одержанням антитіл, мічених радіоактиву цій галузі техніки, і одержані молекули можуть ним ізотопом, такі модифіковані антитіла можуть піддаватись додатковому визріванню, наприклад, також легко одержуватись із застосуванням мето"визріванню афінності", оскільки такі методи є додів, які є добре відомими у цій галузі техніки. Дибре відомими у цій галузі техніки. Райт (Wright) і вись, наприклад, Юнгханс (Junghans) та інші, у Гарріс (Harris), дивись вище, Хейн (Hanes) і Плукто Cancer Chemotherapy and Biotherapy, 655-686 (2-е (Plucthau), PEAS USA, 94:4937-4942 (1997) (прояввидання, редактори Чафнер (Chafner) та Лонго лення у рибосомах), Пармлі (Раrmlеу) і Сміт (Longo), Lippincott Raven (1996)). Дивись також (Smith), Gene, 73:305-318 (1998) (проявлення у патенти США № 4,681,581, № 4,735,210, № фагах), Скотт (Scott), TIB5, 17:241-245 (1992), Кві5,101,827, № 5,102,990, (RE 35,500), № 5,648,471 рла (Cwirla) та інші, PNAS USA, 87:6378-6382 та № 5,697,902. Кожен з імунотоксинів та кожна з (1990), Рассел (Russel) та інші, Nucl Acids молекул, мічених радіоактивним ізотопом, могли б, Research, 21:1081-1085 (1993), Хоганбум ймовірно, убивати клітини, що експресують IFN, і, (Hoganboom) та інші, Immunol. Reviews, 130:43-68 зокрема, ті клітини, для яких є ефективними анти(1992), Чізвел (Chiswell) та Маккафферті тіла за цим винаходом. (McCafferty), TIBTECH; 10:80-8A (1992) та патент У зв'язку з одержанням терапевтичних пептиСША № 5,733,743. У разі, якщо методи проявлендів, шляхом застосування структурної інформації, ня застосовують для продукування антитіл, які не пов'язаної з IFN та антитілами проти нього, нає людськими, такі антитіла можуть гуманізуватись, приклад, антитілами за цим винаходом або переяк описувалось вище. віркою пептидних-бібліотек, можуть бути одержані За допомогою цих методів можуть бути одертерапевтичні пептиди, спрямовані проти IFN. Рожані антитіла проти клітин, що експресують IFN, зробка і перевірка пептидних терапевтичних засосамих IFN, форм IFN, антигенних детермінант бів обговорюється у Хутен (Houghten) та інші, або їхніх пептидів та бібліотеки еспресованих посBiotechniques, 13:412-421 (1992), Хутен (Houghten), лідовностей (дивись, наприклад, патент США № PNAS USA, 82:5131-5135 (1995), Пінала (Pinalla) 5,703,057), які у подальшому можуть перевірятись, та інші, Biotechniques, 13:901-905 (1992), Блейк як описано вище, для ідентифікування активнос(Blake) та Лізі-Девіс (Litzi-Davis), BioConjugate тей, описаних вище. Chem., 3:510-513 (1992). Імунотоксини і молекули, Конструювання і одержання інших терапевтимічені радіоактивним ізотопом, можуть також бути чних засобів одержані, і подібним чином, у зв'язку з пептидними За цим винаходом і виходячи з активності анфрагментами, як обговорювалось вище у зв'язку з титіл, які продукуються і характеристики яких наантитілами. Припускаючи, що молекула IFN (або ведені у цьому описі відносно IFN, полегшується форма, наприклад, сплайсований варіант або розробка інших способів терапевтичного діяння і змінна форма) є функціонально активною у хворотерапевтичних засобів, окрім складових, якими є бливому процесі, можливим буде також конструюантитіла. До числа таких способів терапевтичного вання гена і антисмислових лікарських засобів для діяння і терапевтичних засобів (без обмеження) неї за допомогою традиційних методів. Такі спосоналежать сучасні засоби на основі антитіл, наприби терапевтичного діяння можуть застосовуватись клад, біспецифічних антитіл, імунотоксини і лікардля модулювання функції IFN. У зв'язку із цим, ські засоби, мічені радіоактивними ізотопами, розантитіла за цим винаходом полегшують розробку і робка пептидних терапевтичних засобів, застосування пов'язаних із цим функціональних генотерапія, зокрема, внутрішньоклітинними антианалізів. Розробка і стратегія застосування антистілами, антисмислові лікарські засоби і невеликі мислових лікарських засобів докладно обговорюмолекули. ється у заявці на міжнародний патент WO У зв'язку з біспецифічними антитілами, напри94/29444. Розробка і стратегія застосування геноклад, можуть бути одержані біспецифічні антитіла, терапії є добре відомими. Однак, зокрема, застощо містять (і) два кон'юговані антитіла, з яких одне сування генотерапевтичних методів, що залучамає специфічність до IFN, а інше до другої молеють внутрішньоклітинні антитіла, може виявитись кули, (іі) одне антитіло, один із ланцюгів якого є особливо вигідною. Дивись, наприклад, Чен (Chen) специфічним до IFN, а другий ланцюг є специфічта інші, Human Gene Therapy, 5:595-601 (1994) і ним до другої молекули або (ііі) одноланцюгове Мараско (Marasco), Gene Therapy, 4:11-15 (1997). Загальна розробка і міркування, пов'язані з геноантитіло, яке має специфічність до IFN та іншої терапевтичними засобами, також обговорюються у молекули. Такі біспецифічні антитіла можуть бути заявці на міжнародний патент WO 97/38137. одержані за допомогою методів, які є добре відомими, наприклад, у зв'язку з (і) та (іі), дивись, наЗнання, здобуті із структури молекули IFN та приклад, Фангер (Fanger) та інші, Immunol. її взаємодій з іншими молекулами за цим винахо 49 92337 50 дом, наприклад, антитілами за цим винаходом, та Терапевтичні композиції за цим винаходом, які інші, можуть застосовуватись для раціональної містять huIFN антитіло за цим винаходом, засторозробки додаткових терапевтичних засобів. У совують для лікування або полегшення інтенсивцьому відношенні, раціональні методи розробки ності симптому, пов'язаного з імунопатологією, лікарських засобів, наприклад, рентгенівська криснаприклад, з автоімунним захворюванням або заталографія, автоматизоване молекулярне модепальним розладом. лювання (САММ), методика кількісного та якісного Наприклад, введення huIFN антитіла суб'єкту, визначення взаємодії структура-активність що страждає на хворобу Крона (CD), може впли(QSAR), і подібні методи можуть застосовуватись вати безпосередньо на імунокомпетентні клітини, для концентрування зусиль, спрямованих на розщо спричинюють захворювання, із забезпеченням, робку лікарських засобів. Раціональна розробка тим самим, швидкого втручання з мінімальною надає можливість прогнозування білкових або сисупресією імунної системи. Введення huIFN антинтетичних структур, які можуть взаємодіяти з мотіла суб'єкту, що страждає на системний червоний лекулою або її специфічними формами, які можуть вовчак, є іншим медичним показанням, яке надає застосовуватись для модифікування або модулюможливість модифікування імунокомпетентних вання активності IFN. Такі структури можуть бути клітин, які несуть відповідальність за згадану хвосинтезовані хімічним шляхом або експресовані у робу. Введення huIFN антитіла, повністю людсьбіологічних системах. Цей варіант підходу розглякого білка, суб'єкту, що страждає на псоріаз, видається у роботі Капсі (Capsey) та інших, ключає необхідність лікування хворих за Genetically Engineered Human Therapeutic Drugs допомогою більш агресивних лікарських засобів (Stockton Press, NY (1988)). На додаток до цього, (наприклад, метотрексату), які мають добре задокомбінаторні бібліотеки можуть розроблятись, сикументовані небажані побічні ефекти (наприклад, нтезуватись і застосовуватись у програмах перевіпошкодження печінки). Введення huIFN антитіла рки, наприклад, високоефективних програмах суб'єкту, що страждає на ревматоїдний артрит, є скринінгу. іншим медичним показанням, яке надає можлиВведення терапевтичних засобів і композицій вість модулювання наступної генерації і функції Буде зрозуміло, що терапевтичні засоби за Th-опосередкованої відповіді, що індукує захворюцим винаходом будуть вводитись із відповідними вання. носіями, наповнювачами та іншими компонентами, Автоімунні захворювання включають, наприякі включають до складу композицій для забезпеклад, синдром набутого імунодефіциту (СНІД, який чення поліпшеного перенесення, доставки, толеявляє собою вірусне захворювання з автоімунною рантності тощо. Численні відповідні композиції складовою), вогнищеву алопецію, анкілозивний можна знайти у фармакологічному довіднику, віспондилоартрит, антифосфоліпідний синдром, домому усім фахівцям у галузі фармацевтичної автоімунну хворобу Аддісона, автоімунну гемоліхімії: Remington's Pharmaceutical Sciences (15-е тичну анемію, автоімунний гепатит, автоімунне видання, Mack Publishing Company, Easton, штат захворювання внутрішнього вуха (AIED), автоімунПенсільванія (1975), зокрема, у його розділі 87 ний лімфопроліферативний синдром (ALPS), авто(Блау (Blaug), Сеймур (Seymour)). Ці композиції імунну тромбоцитопенічну пурпуру (АТР), хворобу охоплюють, наприклад, порошки, пасти, мазі, жеБехчета, кардіоміопатію, синдром черевної мальле, що містять лікарські засоби, воски, масла, ліпіабсорбції-герпетоформний дерматит; синдром ди, ліпіди (катіонні або аніонні), що містять мікрохронічного перевтомлення з дисфункцією імунної сфери (наприклад, Lipofectin), кон'югати ДНК, системи (CFIDS), хронічну запальну демієлінізуюбезводні абсорбційні пасти, емульсії типу масла у чу поліневропатію (CIPD), рубцевий пемфігоїд, воді і води у маслі, емульсії карбоваксу (поліетисиндром холодової аглютинації, синдром CRST, ленгліколі різної молекулярної маси), напівтверді хворобу Крона, хворобу Дего, юнацький дерматогелі і напівтверді суміші, що містять карбовакс. міозит, дискоїдний червоний вовчак, ідіопатичну Будь-яка з вищезгаданих сумішей може бути прикріоглобулінемію змішаного типу, фіброміалгіюдатною для лікування за цим винаходом, за умови, фіброміозит, хворобу Грейвса, хворобу Гійєнащо активна складова композиції не інактивується у Барре, тиреощит Хашимото, ідіопатичний фіброз згаданій композицій, а згадана композиція є фізіолегень, ідіопатичну тромбоцитопенічну пурпуру логічно прийнятною і сумісною зі шляхом введен(ІТР), нефропатію IgA-типу, інсулінозалежний цукня. Дивись також Балдрік П. (Baldrick P.), ровий діабет, юнацький інфекційний артрит (хво"Pharmaceutical excipient development: the need for роба Стілла-Шоффара), юнацький ревматоїдний preclinical guidance". Regul. Toxicol Pharmacol., 32 артрит, хворобу Меньєра, дифузну хворобу сполу(2):210-218 (2000), Ванг В. (Wang W.), чної тканини змішаного типу, розсіяний склероз, "Lyophilization and development of solid protein важку псевдопаралітичну міастенію, злоякісну Pharmaceuticals". Int. J. Pharm. 203 (1-2):1-60 анемію, нодозний поліартеріїт, поліхондрит, плю(2000), Чармен В.Н. (Charman W.N.), "Lipids, ригландулярний синдром, ревматичну поліміалгію, lipophilic drugs, and oral drug delivery-some поліміозит і дерматоміозит, початкову агаммоглоemerging concepts", J. Pharm. Sci., 89 (8):967-978 булінемію, первинний біліарний цироз печінки, (2000), Пауелл (Powell) та інші, "Compendium of псоріаз, псоріатичний артрит, феномен Рейно, excipients for parenteral formulations", PDA J. Pharm. синдром Рейтера, ревматизм, ревматоїдний артSci. Technol, 52:238-311 (1998)та посилання у рит, саркоїдоз, склеродермію (прогресуючий сисцьому описі для додаткової інформації відносно темний склероз (PSS), відомий також як системний композицій, наповнювачів та носіїв, добре відомих склероз (SS)), синдром Гужеро-Шегрена, синдром фахівцям із фармацевтичної хімії. ригідної людини, системний червоний вовчак, син 51 92337 52 дром Такаясу, темпоральний артеріприклад, запалення, пропасницю, втрату апетиту, їт/гігантоклітинний артеріїт, неспецифічний виразвтрату маси, симптоми, пов'язані із черевною поковий коліт, увеїт, вітиліго і гранулематоз Вегенерожниною, наприклад, біль у черевній порожнині, ра. діарею або запір, біль у суглобах (артралгія), втоЗапальні розлади включають, наприклад, хромлюваність, висип, анемію, підвищену чутливість нічні і гострі запальні розлади. Приклади запальдо холоду (синдром Рейно), м'язову слабкість, них розладів включають хворобу Альцгеймера, м'язову втому, зміни шкірного або тканинного тоастму, атопічну алергію, алергію, атеросклероз, нусу, задишку або інші відхилення у характері дибронхіальну астму, екзему, гломерулонефрит, хання, біль у грудях або скорочення м'язів грудної реакцію "трансплантат проти хазяїна", гемолітичну клітини, аномальну частоту серцевих скорочень анемію, остеоартрит, сепсис, інсульт, трансплан(наприклад, підвищену або знижену), світлочутлитацію тканини або органів, васкуліт, діабетичну вість, нечіткість зору або інші порушення зору і ретинопатію і пошкодження легень, викликане ослаблене функціонування органів. апаратом штучної вентиляції легень. Терапевтичні композиції huIFN антитіла ввоhuIFN антитіла модулюють імунну відповідь дять суб'єкту, що страждає на імунопатологічний розлад, наприклад, автоімунне захворювання або суб'єкта, наприклад, людини. Наприклад, huIFN запальний розлад. Суб'єкта, що страждає на автоантитіла, опис яких наведено, модулюють, наприімунне захворювання або запальний розлад, встаклад, ослаблюють, пригнічують або відвертають новлюють за допомогою способів, відомих у цій надмірну Th-1-опосередковану імунну реакцію, галузі техніки. Наприклад, суб'єктів, що стражданаприклад, надмірну Th-1-опосередковану імунну ють на автоімунне захворювання, наприклад, хвореакцію, пов'язану з автоімунним або запальним робу Крона, вовчак або псоріаз, встановлюють за розладом, наприклад, із хворобою Крону, системдопомогою будь-якого із цілого ряду клінічних ним червоним вовчаком, псоріазом, саркоїдозом, та/або лабораторних аналізів, наприклад, об'єктиревматоїдним артритом, васкулітом, атопічним вного обстеження, рентгенографічного досліджендерматитом і вторинним прогресуючим розсіяним ня і аналізів крові, сечі і калу, для оцінки імунного склерозом. У разі надмірної Th-1-опосередкованої статусу. Наприклад, хворих, що страждають на імунної реакції, Th1 цитокін(-и), наприклад, IL-2, ILвовчак, встановлюють, наприклад, за допомогою 3, TNF-альфа (TNF-) та IFN, є присутнім(-и) у аналізу антиядерних антитіл (ANA) для визначенсуб'єкта на рівні, вищому за рівень продукування ня присутності у крові автоантитіл до ядер клітин. Th1 цитокіну у суб'єкта, що не страждає на захвоХворих, що страждають на хворобу Крону, встанорювання або розлад, пов'язаний з надмірною Th-1влюють, наприклад, за допомогою серії аналізів опосередкованою імунною реакцією. Для класифіверхнього відділу шлунково-кишкового тракту (GI) кування Th-1-опосередкованої імунної реакції як та/або колоноскопії для визначення стану тонкого і надмірної, оцінюють рівень продукування Th-1 товстого відділу кишечнику, відповідно. Хворих, цитокіну, наприклад, шляхом визначення і аналіщо страждають на псоріаз, встановлюють, напризування рівнів секретованих цитокінів за допомоклад, за допомогою мікроскопічного дослідження гою ELISA або іншого аналізу. тканини, зразок якої відбирають на ураженій діляhuIFN антитіла, опис яких наведено, застосонці шкіри, у той час як хворих, що страждають на вують також для модулювання, наприклад, пригніревматоїдний артрит, встановлюють, наприклад, чення, зменшення або запобігання переключення за допомогою аналізів крові та/або рентгенографікласу на IgG ізотип, наприклад, IFN-індукованого чних чи інших візуальних досліджень. переключення класу. Ці huIFN антитіла модулюВведення huIFN антитіла хворому, що стражють, наприклад, пригнічують, відвертають або дає на імунопатологічний розлад, наприклад, автоослаблюють, надмірну Th-1-опосередковану реакімунне захворювання або запальний розлад, здійцію і, унаслідок цього, зменшують IFN-індуковане снюють у разі одержання будь-якого із цілого ряду переключення. лабораторних або клінічних результатів. НаприЗа одним із варіантів здійснення, композиції, клад, введення huIFN антитіла хворому, що стращо містять huIFN антитіла, застосовані для лікуждає на імунопатологічний розлад, наприклад, вання імунопатологічного розладу, вводять у поавтоімунне захворювання або запальний розлад, єднанні з одним із цілого ряду антицитокінних або вважається успішним, якщо полегшується інтенсиантихемокінних реагентів. Відповідні антицитокінні вність, ослаблюється, пригнічується або не розвиабо антихемокінні реагенти розпізнають, напривається до подальшого, тобто гіршого, стану один клад, цитокіни, наприклад, інтерлейкін 1 (IL-1), ILабо декілька симптомів, пов'язаних із розладом. 2, IL-4, IL-6, IL-12, IL-13, IL-15, IL-17, IL-18, IL-20, ILВведення huIFN антитіла хворому, що страждає 21, IL-22, IL-23, IL-27 і IL-31 та/або хемокіни, нана імунопатологічний розлад, наприклад, автоімуприклад, МІР1-альфа, МІР1-бета, RANTES, MCP1, нне захворювання або запальний розлад, вважаIP-10, ITAC, MIG, SDF та фракталкін. ється успішним, якщо розлад, наприклад, автоімуЦей винахід пропонує також способи лікування нний розлад, вступає до стадії ремісії або не або полегшення інтенсивності симптому, пов'язарозвивається до подальшого, тобто гіршого, стану. ного з імунопатологічним розладом. Наприклад, Діагностичні і профілактичні композиції композиції за цим винаходом застосовують для Повністю людські анти-IFN Mabs (моноклоналікування або полегшення інтенсивності симптому льні антитіла) за цим винаходом застосовують у будь-якого з автоімунних захворювань і запальних діагностичних і профілактичних композиціях. За розладів, опис яких наведено. Симптоми, пов'язані одним із варіантів здійснення, huIFN Mab за цим з імунопатологічними розладами, включають, навинаходом вводять хворим, що належать до групи 53 92337 54 ризику розвитку одного з вищезгаданих автоімунпризначені до включення шляхом посилання. Зганих захворювань. Схильність хворого до одного дування публікацій і патентних документів не приабо декількох із вищезгаданих автоімунних захвозначене для визнання того, що будь-який з них рювань може визначатись за допомогою генотипналежить до відомого рівня техніки і не являє соних, серологічних або біохімічних маркерів. бою жодного визнання щодо їх вмісту або дати За іншим варіантом здійснення цього винахопублікації. Після наведення письмового опису цього винаходу, фахівцям у цій галузі техніки буде ду, huIFN антитіло вводять людям, у яких діагносзрозуміло, що цей винахід може мати цілий ряд товане одне або декілька з вищезгаданих автоімуваріантів здійснення і що вищенаведений опис і нних захворювань. У разі постановки діагнозу, наведені нижче приклади мають ілюстративне huIFN антитіло вводять для полегшення або обепризначення, а не обмеження формули винаходу, рнення ефектів автоімунітету. яка додається. Антитіла за цим винаходом є також корисними Приклади для виявлення IFN у зразках від хворих і, відповіНаведені нижче приклади, у тому числі проведно, є придатними як діагностичні засоби. Напридені експерименти і одержані результати, надаклад, huIFN антитіла за цим винаходом застосоються виключно з ілюстративною метою і не повують у аналізах in vitro. наприклад, ELISA винні розглядатись як такі, що обмежують обсяг (твердофазний імуноферментний аналіз), для вицього винаходу. значення рівнів IFN у зразку від хворого. Приклад 1: Клонування, експресія і очищення За одним із варіантів здійснення, huIFN антилюдського гамма-інтерферону тіло за цим винаходом іммобілізують на твердій Клонування основі (наприклад, лунці (лунках) титраційного Послідовність, що відповідає зрілій послідовмікропланшета). Антитіло за цим винаходом відігності людського гамма-інтерферону (hlFN, рає роль іммобілізованого антитіла для будь-якого huIFN), ампліфікували з людської кДНК за допоIFN, який може бути присутнім у експериментальмогою полімеразної ланцюгової реакції (PCR) із ному зразку. Перед введенням в контакт іммобілізастосуванням специфічних олігонуклеотидів. зованого антитіла зі зразком від хворого, тверду Продукт ампліфікації піддавали очищенню на луноснову прополіскують і обробляють блокувальним ках із гелем і клонували у експресійному векторі агентом, наприклад, білком норки або альбуміном, рЕТ41 (компанія Novagen, San Diego, штат Калідля запобігання неспецифічної абсорбції досліфорнія). Згаданий вектор додатково модифікували джуваної речовини. для введення Avitag (компанія Avidity, Denver, У подальшому лунки обробляють експерименштат Колорадо) та окта-гістидинової мітки на Стальним зразком, у якому припускається присуткінці hlFN, що надавало можливість in vivo біотиність антигену, або розчином, що містить стандарнілування білка і очищення за допомогою ІМАС тну кількість антигену. Таким зразком може бути, (афінна хроматографія на колонці з іммобілізованаприклад, проба сироватки від суб'єкта, у якого ним іоном металу). припускають присутність рівнів циркулюючого анЕкспресія тигену, які вважаються придатними для діагностуКлітини Е.coli лінії BL21 трансформували одвання патології. Після промивання експериментаночасно з вектором рЕТ41с-hlFN і вектором льного зразка або стандарту, тверду основу pACYC184-BirA, який кодує фермент ВігА, необобробляють другим антитілом, яке мітять із можхідний для in vivo біотинілування послідовності ливістю виявлення. Мічене друге антитіло відіграє Avitag. Відбирали поодинокі колонії, стійкі до роль ідентифікаційного антитіла. Визначають ріканаміцину (50 мкг/мл) та хлорамфеніколу (10 вень виявної мітки і концентрацію IFN антигену у мкг/мл), і застосовували їх для інокуляції закваски експериментальному зразку визначають шляхом у LB (живильне середовище Луріа, канаміцин, 50 порівняння зі стандартною кривою, яку одержали мкг/мл/хлорамфенікол, 10 мкг/мл) з культивуванза допомогою стандартних зразків. ням впродовж ночі при температурі 37°С. Буде зрозуміло, що, виходячи з результатів, Наступного дня згадану культуру застосовуваякі одержали за допомогою huIFN антитіл за цим ли для інокуляції (розведення 1:100) 400 мл кульвинаходом при проведенні in vitro діагностичного тури LB (канаміцин, 50 мкг/мл/хлорамфенікол, 10 аналізу, можна встановити стадію захворювання мкг/мл), доповненої 50 мкМ розчином біотину. Зга(наприклад, автоімунного або запального розладу) дану культуру культивували при температурі 37°С у суб'єкта, виходячи з рівнів експресії IFN антигезі струшуванням (240 об/хв) до одержання OD600 ну. Для даного захворювання, проби крові відби0,6. На цьому етапі додавали ізопропіл-бета-Dрають у суб'єктів, які були діагностовані, як такі, тіогалактопіранозид (IPTG) до кінцевої концентращо знаходяться на різних стадіях розвитку захвоції 1 мМ, а культуру додатково інкубували впрорювання та/або у різних часових точках лікування довж 3 год за тих самих умов. Клітини центрифузахворювання. Застосовуючи набори проб, які гували при 4000 об/хв впродовж 20 хв, а осад забезпечують статистично значущі результати для заморожували при температурі -20°С. За цих умов кожної стадії прогресування або лікування, визнапо суті весь hlFNy був нерозчинним і знаходився у чають діапазон концентрацій антигену, які можуть тільцях включення. вважатись характерними для кожної стадії. Очищення Усі публікації та патентні документи, згадані у Бактеріальні осади відтаювали, ресуспендуцьому описі, включені до нього шляхом посилання вали у 8 мл реактиву Bugbuster, що містив 8 мкл таким чином, як нібито кожна окрема публікація бензонази (Benzonaze, компанія Novagen), і інкуабо документ були б конкретно та індивідуально бували при кімнатній температурі впродовж 30 хв. 55 92337 56 Розчин центрифугували впродовж 30 хв при 15000 маси до об'єму) знежиреного молока впродовж 1 g при температурі 4°С. Осад, що містив тільця год при кімнатній температурі на роторному змівключення, ресуспендували у 7 мл солюбілізаційшувачі. Після цього блокований фаг відокремлюного буфера (50 мМ розчин трис-НСІ, рН 7,4, 300 вали на вкритих стрептавідином магнітних кульках мМ розчин NaCl, 20 мМ розчин імідазолу, 5 мМ (Dynal M-280) впродовж 1 год при кімнатній температурі на роторному змішувачі. Потім відокремлерозчин -меркаптоетанолу, 6 Μ розчин гуанідинуний фаг інкубували з in vivo біотинілованим hlFN НСІ). Ресуспендований матеріал центрифугували при температурі 4°С впродовж 30 хв при 15000 g. (100 нМ) впродовж 2 год при кімнатній температурі Дві хелатувальні колонки місткістю 5 мл Ні на роторному змішувачі. Кульки захоплювали за Trap (компанія Amersham, Buckinghamshire, Ангдопомогою магнітної підставки з подальшими чолія), заповнені NiSO4 і зрівноважені солюбілізаційтирма промиваннями PBS/0,1% твій 20 і 3 проминим буфером, об'єднували за інструкціями виробванням PBS. Після цього кульки безпосередньо ника. Супернатант після стадії центрифугування додавали до 10 мл клітин TG1 на стадії експоненфільтрували на 0,45 мкм мембрані і вводили у ційного росту та інкубували впродовж 1 год при колонку за допомогою перистальтичного насоса зі температурі 37°С із повільним струшуванням (100 швидкістю 1 мл/хв. Після цього колонки підключаоб/хв). Аліквоту інфікованих TG1 піддавали серійли до первинної хроматографічної системи АKТА ному розведенню для титрування селекційного для повторного укладання та елюювання білка на виходу. Залишок інфікованих TG1 центрифугували колонках. Іммобілізований білок промивали 35 мл при 3000 об/хв впродовж 15 хв, ресуспендували у солюбілізаційного буфера із швидкістю 1 мл/хв. 0,5 мл середовища 2TY-AG (середовище 2ΤΥ Лінійний градієнт солюбілізаційного буфера із зро(триптон-дріжджовий екстракт), що містить 100 стаючою концентрацією буфера для повторного мкг/мл ампіциліну і 2% глюкози), і висівали на укладання (50 мМ розчин трис-НСІ, рН 7,4, 300 мМ планшети з агаром (2TYAG) для проведення біорозчин NaCl) вводили із швидкістю 1 мл/хв впрологічних аналізів. Після інкубування впродовж ночі довж 1 год до початку введення 100% буфера для при температурі 30°С на планшети додавали 10 повторного укладання. Після цього колонку додатмл середовища 2TYAG, клітини зішкрібали з поково промивали 25 мл буфера для повторного верхні і переносили у 50 мл поліпропіленову проукладання. Після цього повторно укладений білок бірку. До суспензії клітин додавали 2TYAG, що елюювали з колонки за допомогою елюювального містило 50% гліцерину, з одержанням 17% кінцебуфера (50 мМ розчин трис-НСІ, 300 мМ розчин вої концентрації гліцерину. Аліквоти циклу селекції NaCl, 400 мМ розчин імідазолу). Білкові фракції зберігали при температурі -80°С. об'єднували і знесолювали на колонках PD10 Селекція на поверхні клітин (компанія Amersham), зрівноважених PBS (забуАліквоти бібліотек фага scFv (1012 бляшкотвірферений фосфатом фізіологічний розчин). Після них одиниць), які були одержані від компанії цього знесолений білок розділяли на аліквоти і Cambridge Antibody Technology (Cambridge, Ангзберігали при температурі -80°С. лія), блокували PBS, що містив 3% (у відношенні Приклад 2: Клітини, що експресують гаммамаси до об'єму) знежиреного молока впродовж 1 інтерферон на клітинній поверхні год при кімнатній температурі на роторному зміКультури клітин яєчника китайського хом'ячка шувачі. Після цього блокований фаг відокремлю(СНО) (доступні від АТСС (Американська колекція вали впродовж 1 год при температурі 37°С/5% СО2 типових культур)) стабільно трансфікували мічена клітинах СНО, трансфікованих порожнім вектоною с-mус кДНК людського IFN. кДНК субклонуром pDisplay (у колбі Т75 з 80% злиттям), який вали у плазмідах pCDNA 3.1 (компанія Invitrogen, попередньо був блокований PBS, що містив 2% (у Carlsbad, штат Каліфорнія), що містять гени стійвідношенні маси до об'єму) знежиреного молока. кості до неоміцину. Трансфектанти відбирали за Потім відокремлений фаг інкубували з клітинами допомогою цього антибіотику, і подальше сортуCHO-pDisplay-hlFN впродовж 1 год при кімнатній вання клітин здійснювали засобами протокової температурі з обережним струшуванням. Після цитометрії із застосування анти-6His антитіла цього клітини десять разів промивали за допомо(компанія Sigma). Поверхневу експресію людськогою PBS. Зв'язаний фаг елюювали шляхом безпого IFN підтверджували засобами протокової цисереднього додання 10 мл клітин TG1 на стадії тометрії із застосуванням анти-IFN mAb (клон експоненційного росту до колби Т75 та інкубували В27, компанія Becton Dickinson, Franklin Lakes, впродовж 1 год при температурі 37°С із повільним штат Нью-Джерсі). струшуванням. Аліквоту інфікованих TG1 піддаваПриклад 3: Скринінг бібліотек людського scFv ли серійному розведенню для титрування селекЗагальні методики конструювання і маніпулюційного виходу. Інфіковані TG1 центрифугували вання бібліотеками людського scFv описані у ропри 3000 об/хв впродовж 15 хв, ресуспендували у боті Вохен (Vaughan) та інші (Nat. Biotech. 1996, 0,5 мл середовища 2TY-AG (середовище 2ΤΥ 14:309-314), яку у повному обсязі включено до (триптон-дріжджовий екстракт), що містить 100 цього опису шляхом посилання. Бібліотеки людсьмкг/мл ампіциліну і 2% глюкози), і висівали на кого scFv перевіряли проти hlFN за наведеною планшети з агаром (2TYAG) для проведення біонижче методикою. логічних аналізів. Після інкубування впродовж ночі Селекція у рідкій фазі при температурі 30°С на планшети додавали 10 Аліквоти бібліотек фага scFv (1012 бляшкотвірмл середовища 2TYAG, клітини зішкрібали з поних одиниць), які були одержані від компанії верхні і переносили у поліпропіленову пробірку Cambridge Antibody Technology (Cambridge, Ангмісткістю 50 мл. До суспензії клітин додавали лія), блокували PBS, що містив 3% (у відношенні 57 92337 58 мікропланшет, що містив 150 мкл середовища 2TYAG, що містило 50% глщерину, з одержанням 17% кінцевої концентрації глщерину. Аліквоти цик2TYAG (2% глюкози)/лунку, і культивували при лу селекції зберігали при температурі -80°С. температурі 30°С (120 об/хв) впродовж ночі. НаЗбереження фага ступного дня 5 мкл культури переносили на інший 100 мкл суспензії клітин, яку одержали на попланшет, що містив 45 мкл dH2O і перемішували. передніх циклах селекції, додавали до 20 мкл Після цього планшети заморожували при температурі -20°С. Після відтаювання 1 мкл цієї суспензії 2TYAG і культивували при температурі 37°С з застосовували для ампліфікування за допомогою перемішуванням (240 об/хв) до досягнення OD600 PCR (полімеразна ланцюгова реакція) із застосу0,3-0,5. Після цього культуру суперінфікували ванням стандартної методики PCR із праймером, (3,31010) фагом-помічником МK13K07 і інкубували специфічним для pCANTAB6: mycseq, 5'впродовж 1 год при температурі 37°С (150 об/хв). CTCTTCTGAGATGAGTTTTTG-3' (Послідовність № Після цього середовище замінювали шляхом 100) та gene3leader, 5'центрифугування клітин при 2000 об/хв впродовж TTATTATTCGCAATTCCTTTAGTTGTTCCT-3' (Пос10 хв, видалення середовища і ресуспендування лідовність № 101). осаду у 20 мл 2ΤY-ΑΚ (ампіцилін, 100 мкг/мл; Реакційні суміші очищали у 96-лунковому фоканаміцин, 50 мкг/мл). Після цього культуру вирорматі за допомогою системи Montage РСR96 щували впродовж ночі при температурі 30°С (240 (компанія Мillіроrе). 5 мкл елюйованої ДНК секвеоб/хв). нували із застосуванням праймерів mycseq та Збереження моноклонального фага для ELISA gene3leader. Поодинокі клони переносили на титраційний Одержання периплазматичного scFv для промікропланшет, що містив 150 мкл середовища ведення функціональних тестів 2TYAG (2% глюкози)/лунку, і культивували при Окремі клони інокулювали у глибокі лунки титтемпературі 37°С (100-120 об/хв) впродовж 5-6 раційного мікропланшета, що містили 0,9 мл серегод. До кожної лунки додавали фаг-помічник довища 2TYAG (0,1% глюкози)/лунку, і культивуМ13KО7 для одержання множинності зараження вали при температурі 37°С впродовж 5-6 год (250 (МОI) 10 (тобто 10 фагових частинок на кожну кліоб/хв). Після цього додавали 100 мкл/лунку 0,2 мМ тину у культурі) та інкубували при температурі розчину IPTG (ізопропілтіогалактозид) у середо37°С (100 об/хв) впродовж 1 год. Після завершенвищі 2ΤΥ з одержанням кінцевої концентрації ня культивування планшети центрифугували при 0,02 мМ IPTG. Після цього планшети інкубували 3200 об/хв впродовж 10 хв. Супернатант обережно впродовж ночі при температурі 30°С із струшуванвидаляли, клітини ресуспендували у 150 мкл сеням при 250 об/хв. Планшети з глибокими лунками редовища 2ΤΥΑΚ і культивували впродовж ночі центрифугували при 2500 об/хв впродовж 10 хв, і при температурі 30°С (120 об/хв). Для проведення супернатант обережно видаляли. Осад ресуспенELISA (твердофазний імуноферментний аналіз), дували у 150 мкл буфера TES (50 мМ трис/НСІ (рН фаг блокують шляхом додання 150 мкл подвійної 8), 1 мМ EDTA (етилендіамінтрифтороцтова кисконцентрації PBS, що містить 5% порошкового лота) (рН 8), 20% цукрози, доповнений повним знежиреного молока, з подальшим інкубуванням інгібітором протеаз, компанія Roche). Гіпотонічний при кімнатній температурі впродовж 1 год. Після шок здійснювали шляхом додання 150 мкл розбацього планшети центрифугували впродовж 10 хв вленого буфера TES (TES розбавляли водою у при 3000 об/хв, і супернатант, що містив фагові співвідношенні 1:5) і інкубування на льоду впрочастинки, застосовували для проведення ELISA. довж 30 хв. Після цього планшети центрифугували Твердофазний імуноферментний аналіз фага при 4000 об/хв впродовж 10 хв для видалення Планшети для проведення ELISA (Maxisorb, клітин і дебрісу. Супернатанти обережно переноNUNC) сенсибілізували впродовж ночі 2 мкг/мл сили на інший титраційний мікропланшет і зберігаhlFN у PBS. Контрольні планшети сенсибілізували ли на льоду для негайної перевірки за допомогою 2 мкг/мл BSA (сироватковий альбумін великої рофункціональних аналізів або ELISA. гатої худоби). Після цього планшети блокували 3% Очистка scFv у великому масштабі знежиреного молока/PBS при кімнатній темпераЗакваску у 1 мл 2TYAG інокулювали однією турі впродовж 1 год. Планшети тричі промивали колонією зі свіжої штрихової культури на планшеPBS/0,05% твій 20 перед перенесенням попередтах з агаром та 2TYAG і інкубували зі струшуванньо блокованих супернатантів, що містили фаг, і ням (240 об/хв) при температурі 37°С впродовж 5 інкубуванням впродовж 1 год при кімнатній темпегод. 0,9 мл цієї культури застосовували для інокуратурі. Після цього планшети тричі промивали ляції 400 мл культури на тому самому середовищі PBS/0,05% твій 20. У кожну лунку додавали 50 мкл і культивували впродовж ночі при температурі 3% знежиреного молока/PBS, що містив HRP (пе30°С з енергійним струшуванням (300 об/хв). роксидаза з хрону)-кон'юговане анти-М13 антитілр Наступного дня культуру індукували шляхом Μ14 (компанія Amersham, розведення 1:10000). додання 400 мкл 1М розчину IPTG і додатково Після інкубування при кімнатній температурі впроінкубували впродовж 3 год. Клітини збирали шлядовж 1 год, планшети промивали 5 разів хом центрифугування при 5000 об/хв впродовж 10 PBS/0,05% твій 20. Після цього перевіряли резульхв при температурі 4°С. Осаджені клітини ресустати ELISA шляхом додання 50 мкл ТМВ (тетрапендували у 10 мл буфера TES, що мав темпераметилбензидин) (компанія Sigma) та 50 мкл 2-н. туру розтавання льоду, доповненого інгібіторами розчину H2SO4 для припинення реакції. Інтенсивпротеаз, як описано вище. Осмотичний шок здійсність абсорбції зчитували при 450 нм. нювали шляхом додання 15 мл розбавленого (1:5) Секвенування фагових клонів буфера TES і інкубування впродовж 1 год на льоПоодинокі клони переносили на титраційний 59 92337 60 ду. Клітини центрифугували при 10000 об/хв впроОчищені scFv розділяли на аліквоти і зберігали довж 20 хв при температурі 4°С для осадження при температурі -20°С та 4°С. дебрису. Супернатант обережно переносили у Приклад 4: Пригнічення екстрактами scFv іннову пробірку. До супернатанту додавали імідазол дукованої гамма-інтерфероном експресії репортез одержанням 10 мМ кінцевої концентрації. У кожрного гена ну пробірку додавали 1 мл смоли Ni-NTA (компанія Екстракти периплазматичних scFv різних Qiagen), зрівноваженої у PBS, та інкубували на huIFN антитіл були одержані, як описано вище. роторному змішувачі при температурі 4°С (20 Високопродуктивний відбірковий аналіз, що груноб/хв) впродовж 1 год. тується на клітинах, застосовували для ідентифіПробірки центрифугували при 2000 об/хв кування scFv (одноланцюговий варіабельний фравпродовж 5 хв, і супернатант обережно видаляли. гмент) блокаторів активності IFN. Репортерний Осаджену смолу ресуспендували у 10 мл холодноген (люцифераза світляків), стимульований IFNго (4°С) буфера 1 для промивання (50 мМ розчин індуцибельним промотором GBP1, трансфікували NaH2PO4, 300 мМ розчин NaCl, 10 мМ розчин імідо лінії клітин меланоми людини Ме67.8. До кульдазолу, рН до 8,0). Суспензію завантажували у тури клітин одночасно додавали як scFv, так і IFN. колонку РоІурrер (компанія Biorad). Для промиванПісля інкубування протягом 6 год здійснювали ня колонки самопливом застосовували 8 мл холоаналіз люциферазного репортерного гена. scFv, дного буфера 2 для промивання (50 мМ розчин здатні до пригнічення індукції люциферази світляNaH2PO4, 300 мМ розчин NaCl, 20 мМ розчин іміків, зберігали для додаткових досліджень. дазолу, рН до 8,0). scFv елюювали з колонки 2 мл Декілька екстрактів scFv пригнічували IFNбуфера для елюювання (50 мМ розчин NaH2PO4 індукований репортерний ген дозозалежним чином 300 мМ розчин NaCl, 250 мМ розчин імідазолу, рН (Фіг. 15). Для кожного клону scFv, зображеного на до 8,0). Фракції аналізували шляхом абсорбування Фіг. 15, випробували різні концентрації (2,7 нМ, при 280 нм, і білоквмісні фракції об'єднували пе0,68 нМ, 0,17 нМ, 0,043 нМ і 0,011 нМ), як показано ред буферним обміном на знесолювальній колонці стовпчиками над назвою кожного клону (зменшенPD10 (компанія Amersham), зрівноваженій PBS. ня концентрації зліва направо). Відсоткове пригніscFv у PBS аналізували засобами SDS-PAGE чення, що демонструвалось кожним екстрактом (електрофорез у поліакриламідному гелі у присутscFv при різних вказаних концентраціях, наведено ності додецилсульфату натрію) і піддавали кількіу поданій нижче Таблиці 3. сному визначенню шляхом абсорбції при 280 нм. Таблиця 3 Відсоткове пригнічення експресії IFN-індукованого репортерного гена периплазматичними екстрактами scFv [scFv] нМ А6 2,7 82 0,68 92 0,17 100 0,043 87 0,011 0 Н8 80 75 65 26 0 А8 85 86 87 65 13 D8 С10 В4 60 63 63 60 50 49 40 53 21 10 34 5 0 19 0 В9 62 53 56 0 0 F9 68 32 3 0 0 Приклад 5: Пригнічення scFv індукованої гамма-інтерфероном експресії МНС класу II Протоковий цитометричний аналіз застосовували для ідентифікування повністю людських IgG антитіл або їхніх фрагментів, здатних до блокування IFN-індукованої експресії молекул МНС класу II. Після висівання клітин Ме67.8, до культур додавали 5 нг/мл рекомбінантного людського IFN у присутності різних концентрацій повністю людських анти-IFN моноклональних антитіл-кандидатів. Після культивування впродовж 48 год, клітини забарвлювали антилюдським МНС класу II антитілом (HLA-DR), міченим флуоресціюючою міткою, і аналізували за допомогою FACSCalibur. Таким чином, була визначена ІС50 (де пригнічується 50% IFN-індукованої експресії МНС класу II, тобто 50% пригнічувальна концентрація) для кожного антитіла-кандидата. Очищені повністю людські scFv одержували, як описано вище у Прикладі 1. Ефект scFv на IFNіндуковану експресію МНС класу II на клітинах меланоми оцінювали за допомогою протокового А4 36 1 0 0 0 Е1 43 68 38 10 0 С9 56 67 58 33 0 G7 G10 D6 75 47 82 73 44 73 24 0 31 38 0 11 4 0 0 G6 73 66 25 0 0 G9 52 12 0 0 0 D3 69 55 36 28 20 F8 64 64 48 0 0 цитометричного аналізу, що гуртується на клітинах, опис якого було наведено вище. Ці scFv пригнічували IFN-індуковану експресію МНС класу II на клітинах меланоми. (Фіг. 16, Графіки 1-12). Здатність цих клонів scFv до пригнічення IFNіндукованої експресії МНС класу II на клітинах меланоми порівнювали з мишачим антилюдським IFN mAb, яке у цьому описі згадується як 16С3. На Фіг. 16 зображені клони scFv (—) і мишачого антилюдського IFN mAb 16C3 (······). Приклад 6: Реформатування scFv до формату IgG Очищені повністю людські scFv одержували, як описано вище у Прикладі 1. VH і VL послідовності вибраних scFv ампліфікували зі специфічними олігонуклеотидами шляхом введення лідерної послідовності та Hindlll рестрикційного сайту на 5' кінці. АраІ або Avrll сайт вводили на 3' кінці послідовності важкого і легкого ланцюга, відповідно. Ампліфіковані VH послідовності розщеплювали HindIII/АраІ і клонували у pCon_gamma1 експресійному векторі (компанія LONZA, Basel, Швейца
ДивитисяДодаткова інформація
Назва патенту англійськоюFully isolated human anti-interferon gamma monoclonal antibody, pharmaceutical composition containing thereof and method of amelioration of a symptom associated with an immune-related disorder
Автори англійськоюFerlin Walter, Fischer Nicolas, Elson Greg, Leger Olivier
Назва патенту російськоюВыделенное полностью человеческое моноклональное антитело к гамма-интерферону (ifng), фармацевтическая композиция, которая его содержит, и способ облегчения интенсивности симптома автоиммунного заболевания или воспалительного расстройства
Автори російськоюФерлин Вальтер, Фишер Николас, Элсон Грег, Леже Оливье
МПК / Мітки
МПК: A61P 37/00, C07K 16/24, A61K 39/395
Мітки: спосіб, антитіло, містить, інтенсивності, фармацевтична, гамма-інтерферону, композиція, розладу, ifng, людське, симптому, повністю, запального, захворювання, полегшення, моноклональне, автоімунного, виділене
Код посилання
<a href="https://ua.patents.su/87-92337-vidilene-povnistyu-lyudske-monoklonalne-antitilo-do-gamma-interferonu-ifng-farmacevtichna-kompoziciya-shho-jjogo-mistit-ta-sposib-polegshennya-intensivnosti-simptomu-avtoimunnogo-z.html" target="_blank" rel="follow" title="База патентів України">Виділене повністю людське моноклональне антитіло до гамма-інтерферону (ifng), фармацевтична композиція, що його містить, та спосіб полегшення інтенсивності симптому автоімунного захворювання або запального розладу</a>
Попередній патент: Моторний плавзасіб з пристроєм керування
Наступний патент: Протиугінний пристрій для візка
Випадковий патент: Спосіб відбору птиці за онтохронним індексом