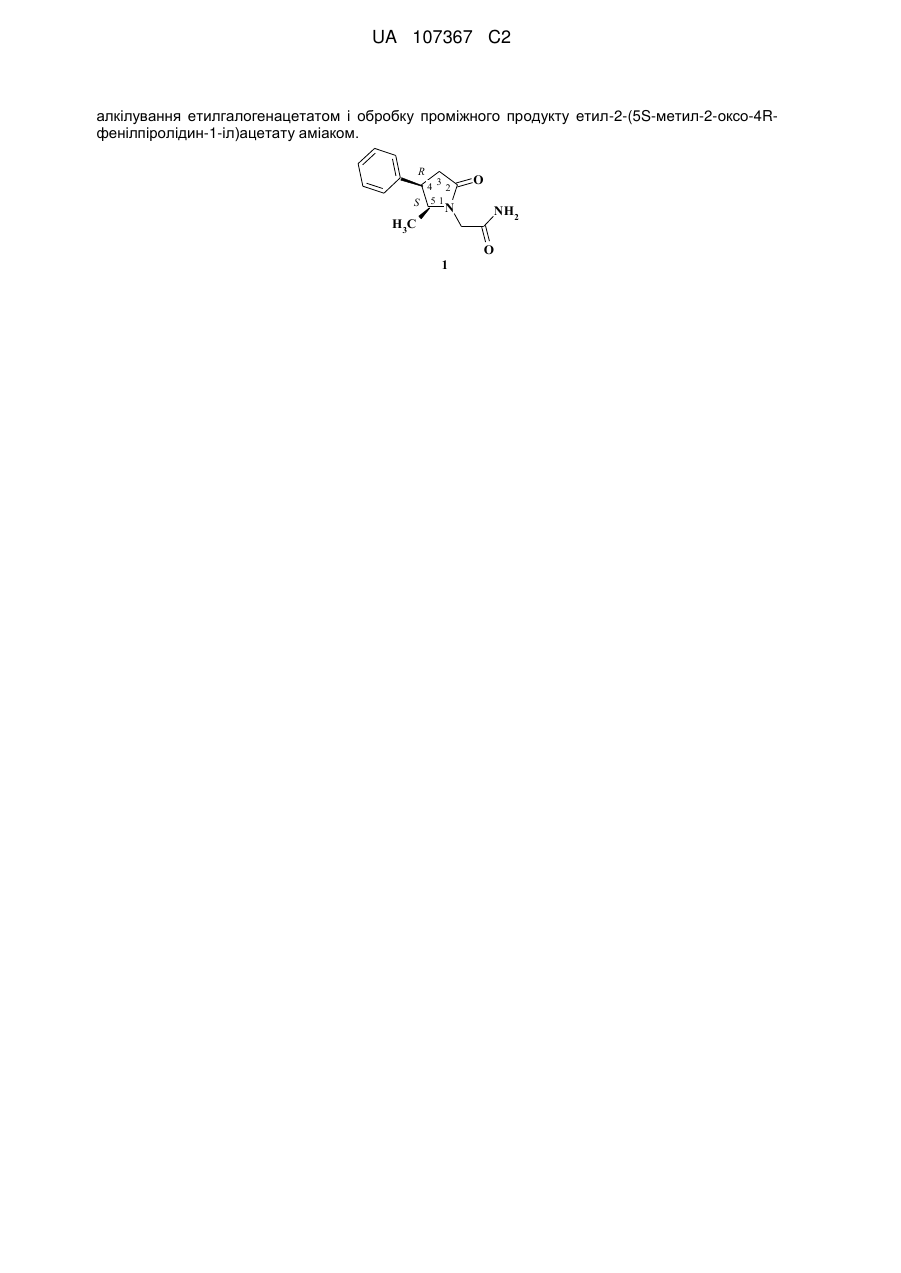
4r,5s-енантіомер 2-(5-метил-2-оксо-4-фенілпіролідин-1-іл)ацетамід з ноотропною активністю
Номер патенту: 107367
Опубліковано: 25.12.2014
Автори: Калвіньш Іварс, Лєбєдєвс Антонс, Чернобровійс Алєксандрс, Ворона Максімс, Звейнісе Ліга, Дамброва Майя, Веінбергс Грігорійс
Формула / Реферат
1. Сполука 2-(5S-метил-2-оксо-4R-фенілпіролідин-1-іл)ацетамід, що має структуру (І)
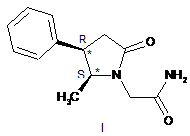 .
.
2. Сполука за п. 1 для використання як медикаменту.
3. Сполука за п. 1 для використання як ноотропного медикаменту.
4. Сполука за п. 1 для використання як підсилювача когнітивної діяльності.
5. Сполука за п. 1 для використання в лікуванні когнітивних розладів.
6. Процес одержання сполуки (І) за п. 1, за яким здійснюють наступні етапи:
a) приєднання 2-нітропроп-1-енілбензолу до діетилмалонату в присутності складного каталізатора, який складається з хірального 2,2'-циклопропіліденбісоксазоліну, магнію трифлату і органічної основи;
b) перетворення діетил-2-(2-нітро-1R-фенілпропіл)малонату на енантіомерний 5S-метил-4R-фенілпіролідин-2-он шляхом гідрогенізації при тиску водню від 3 до 60 атм. діетил-2-(2-нітро-1R-фенілпропіл)малонату в присутності Ni Ренея, розділення діастереоізомерної суміші етил-5-метил-2-оксо-4(R)-фенілпіролідин-3(S)-карбоксилату на окремі 5S,4R- і 5R,4-енантіомери, декарбоксилування етил-5(S)-метил-2-оксо-4(R)-фенілпіролідин-3(S)-карбоксилату;
c) заміщення водню в амідній групі 5S-метил-4R-фенілпіролідин-2-ону на іон натрію у відповідному органічному розчиннику;
d) N-алкілування N-металованого 5S-метил-4R-фенілпіролідин-2-ону ефірами галогензаміщеної оцтової кислоти у відповідному органічному розчиннику;
e) амідування етил-2-(5S-метил-2-оксо-4R-фенілпіролідин-1-іл)ацетату аміаком у відповідному розчиннику.
7. Процес зап. 6, де на етапі а) хіральним 2,2'-циклопропіліден-біс(оксазоліном) є (3аR,3'аR,8аS,8'аS)-2,2'-циклопропілідебіс-[3а,8а]-дигідро-8Н-індено-[1,2-d]-оксазол.
8. Процес за п. 6, де на етапі а) органічну основу вибирають з групи, що містить морфолін, N-метилморфолін, 1,1,3,3-тетраметилгуанідин та їх суміші.
9. Процес за п. 6, де на етапі b) органічний розчинник для розділення діастереоізомерної суміші етил-5(R,S)-метил-2-оксо-4(R)-фенілпіролідин-3(S)-карбоксилату шляхом кристалізації вибирають з групи, яка містить метанол, етанол, ізопропанол та їх суміші.
10. Процес за п. 6, де на етапі b) основу для гідролізу етил-5(S)-метил-2-оксо-4(R)-фенілпіролідин-3(S)-карбоксилату вибирають з групи, яка містить гідроокис натрію і гідроокис калію.
11. Процес за п. 6, де на етапі b) температуру декарбоксилування 5(S)-метил-2-оксо-4(R)-фенілпіролідин-3(S)-карбоксилату в розчині ізопропілацетату в присутності паратолуолсульфонової кислоти підтримують від 50 до 88 °C.
12. Процес за п. 6, де на етапі с) іон натрію вводять в амідну групу 5S-метил-4R-фенілпіролідин-2-ону за допомогою гідриду натрію або етилату натрію.
13. Процес за п. 6, де на етапі d) ефір галогензаміщеної оцтової кислоти вибирають з групи ефіру бромоцтової кислоти або ефіру хлороцтової кислоти.
14. Процес за п. 6, де на етапі e) амідування етил-2-(5S-метил-2-оксо-4R-фенілпіролідин-1-іл)ацетату здійснюють у водному аміаку або його суміші з відповідним органічним розчинником.
15. Процес за п. 6, де на етапі е) амідування етил-2-(5S-метил-2-оксо-4R-фенілпіролідин-1-іл)ацетату здійснюють у відповідному органічному розчиннику шляхом його насичення газоподібним аміаком.
16. Процес за п. 14 або 15, де органічний розчинник, який використовують для реакцій, вибирають з групи, яка містить метанол, етанол, пропанол, хлороформ, метиленхлорид, етилацетат і 1,4-діоксан.
Текст
Реферат: Даний винахід стосується 5S,4R-eнантіомера 2-(5-метил-2-оксо-4-фенілпіролідин-1іл)ацетаміду з активністю посилення когнітивної діяльності високої фармакологічної дії і способу його приготування, який передбачає синтез 5S-метил-4R-фенілпіролідин-2-ону, його N UA 107367 C2 (12) UA 107367 C2 алкілування етилгалогенацетатом і обробку проміжного продукту етил-2-(5S-метил-2-оксо-4Rфенілпіролідин-1-іл)ацетату аміаком. R 432 S 51 N H3C O NH2 O 1 UA 107367 C2 5 10 15 20 25 Галузь техніки Цей винахід стосується отримання і використання 4R, 5S-енантіомеру 2-(5-метил-2-оксо-4фенілпіролідин-1-іл)-ацетаміду для застосування в якості ноотропного медикаменту. Рівень техніки Відомо, що препарати, які посилюють когнітивну діяльність, сприяють здатності розподіляти увагу, а також надбанню, зберіганню і пошуку інформації та пом'якшенню порушення когнітивних функцій, пов'язаних з травмами голови, інсультом, віком і віковими патологіями. Про рацемічну молекулу 2-(5-метил-2-оксо-4-феніл-піролідин-1-іл)-ацетаміду, що є структурним похідним пірацетаму, згадувалось в 2001 році (M. V. Berestovitskaya, M. M. Zobachova, B. M. Novikov, O. S. Vasil'eva, N. V. Usik, S. M. Aleksandrova, I. N. Turenkov. International Conference on the Synthesis of Nitrogen Heterocycles, Moscov, Oct. 9-12, 2001, vol. 1, pp. 229-233). Однак жодних даних щодо хімічної структури чи біологічних властивостей цієї сполуки не наводилось. В ЕР 2013166 B (AKCIJU SABIEDRIBA OLAINFARM) 10.03.2010 був описаний R-енантіомер N-карбамоїлметил-4-феніл-2-піролідинон, який відрізняється від заявленого тут тільки відсутністю 5-метильної групи з нейротропною активністю. Суть винаходу У відповідності до даного винаходу, фармакологічні дослідження рацемічного 2-(5-метил-2оксо-4-феніл-піролідин-1-іл)-ацетаміду, який має два хіральних центри в позиціях 4 і 5 піролідонового кільця, неочікувано виявили його досить багатообіцяючі властивості посилювати когнітивну діяльність. Однак, коли ми приготували окремий 4R, 5S-енантіомер 2-(5-метил-2оксо-4-феніл-піролідин-1-іл)-ацетамід і піддали його ноотропному дослідженню, він дивовижно і неочікувано виявився значно більше фармакологічно активним у порівнянні з материнською рацемічною сполукою. У відповідності до даного винаходу, ми описуємо спосіб приготування 4R, 5S-енантіомеру 2(5-метил-2-оксо-4-феніл-піролідин-1-іл)-ацетамід формули 1 з властивостями посилювати когнітивну діяльність високої фармакологічної цінності: R 4 3 2 S 51 O N NH2 H3C O 1 30 , який є новою хімічною сполукою з ноотропною активністю. У відповідності до даного винаходу, хімічна схема приготування 2-(5S-метил-2-оксо-4Rфеніл-піролідин-1-іл)-ацетаміду (1) включає синтез 4R, 5S-енантіомеру 5-метил-4фенілпіролідин-2-ону (2) і введення ацетамідної групи в позицію 1 піролідонового кільця: R S H3C R O S N H O N H3C 1 35 40 O NH2 2 . В літературі документовані методи приготування рацемічного 5-метил-4-фенілпіролідин-2ону і його розділення на енантіомерну суміш еритро- і трео-ізомерів (Colonge J., Pouchol J.M., Bull. Soc. Chim., 1962, 598-603; Langlois M… et. al. Bull. Soc. Chim., 1971, 2976-2982; Lesniak S., Pasternak B., Tetrahedron Lett., 2005, 46, 3093-3095). Однак нам не вдалось знайти жодного письмового свідчення щодо розділення рацемічного 5-метил-4-фенілпіролідин-2-ону на окремі енантіомери чи їх прямого синтезу з хіральних чи не хіральних хімічних речовин. У відповідності до даного винаходу, цю проблему було вирішено шляхом асиметричної реакції приєднання за Міхаелем 2-нітропроп-1-енілбензолу (3) до диетил малонату (3) в присутності складного каталізатора, який складається з хірального 2,2'-циклопропіліден-біс 1 UA 107367 C2 оксазоліну 5, магнію трифлату і органічної основи, що приводить до утворення диетил 2-[2(R, S)-нітро-1R-фенілпропил]-малонатної діастереоізомерної суміші (6): 5 10 15 20 25 Отриманий проміжний продукт 6 було перетворено на 5S-метил-4R-фенілпіролідин-2-он (2) шляхом послідовного здійснення наступних етапів (дивись схему далі): а) приєднання 2-нітропроп-1-енілбензолу до диетил малонату в присутності складного каталізатора, який складається з хірального 2,2'-циклопропіліден-біс-оксазоліну, магнію трифлату і органічної основи; b) перетворення диетил 2-(2-нітро-1R-фенілпропил]-малонату на енантіомерний 5S-метил4R-фенілпіролідин-2-он шляхом гідрогенізації диетил 2-(2-нітро-1R-фенілпропил]-малонату в присутності ренеєвського Ni, розділення діастереоізомерної суміші етил 5-метил-2-оксо-4(R)фенілпіролідин-3(S)-карбоксилату на окремі 5S, 4R- і 5R, 4-енантіомери, декарбоксилування етил 5(S)-метил-2-оксо-4(R)-фенілпіролідин-3(S)-карбоксилату; с) заміщення водню в амідній групі 5S-метил-4R-фенілпіролідин-2-ону на іон натрію у відповідному органічному розчиннику; d) N-алкілування N-металованого 5S-метил-4R-фенілпіролідин-2-ону ефірами галогензаміщеної оцтової кислоти у відповідному органічному розчиннику; е) амідування етил 2-(5S-метил-2-оксо-4R-феніл-піролідин-1-іл)-ацетату аміаком у відповідному розчиннику. Перетворення 5S-метил-4R-фенілпіролідин-2-ону (2) на 2-(5S-метил-2-оксо-4R-фенілпіролідин-1-іл)-ацетамід (1) передбачало заміщення водню в групі NH сполуки 2 натрієм, алкілування металованого піролідин-2-ону 13 етиловим ефіром галогензаміщеної оцтової кислоти і обробку проміжного продукту етил 2-(5S-метил-2-оксо-4R-фенілпіролідин-1-іл)-ацетату (14) аміаком у відповідному розчиннику. 2 UA 107367 C2 NaH R HalCH2COOEt O 2 S H3C R S N H 14 R S H3C N H3C 13 NH4OH O O OEt O N O NH2 Hal = Cl, Br 1 5 10 15 20 25 30 35 40 45 У відповідності до даного винаходу, порівняльна фармакологічна оцінка 2-(4R-феніл-2оксопіролідин-1-іл)ацетаміду, рацемічного 2-(5-метил-2-оксо-4-феніл-піролідин-1-іл)-ацетаміду і 2-(5S-метил-2-оксо-4R-феніл-піролідин-1-іл)-ацетаміду з використанням стандартного тесту на пасивне уникнення довела високу ефективність оптично активного 2-(5S-метил-2-оксо-4Rфенілпіролідин-1-іл)-ацетаміду (1) в якості підсилювача навчальної пам'яті. Відповідно, 2-(5S-метил-2-оксо-4R-феніл-піролідин-1-іл)-ацетамід може застосовуватись як високоефективний агент для використання в якості медикаменту з ноотропною активністю. Докладний опис винаходу Об'єм цього винаходу не повинен обмежуватись робочими прикладами, які призначені тільки для демонстраційних цілей. Спеціаліст в цій галузі зможе реалізувати цей винахід, базуючись на інформації, розкритій в даній патентній заявці. Наступні приклади є ілюстративними і жодним чином не обмежують даний винахід. Приклади Приклад 1 Розчин (3aR, 3'aR, 8aS, 8'aS)-2,2'-циклопропиліден-біс-[3a, 8a]-дигідро-8H-індено-[1,2-d]оксазолу (420 мг; 1,18 мМ) в хлороформі (стабілізований вуглеводнем) (5 мл), магнію трифлат (378 мг; 0. 1,18 мМ) і воду (25 мкл) помістили в 250-мл реакційну колбу при кімнатній температурі, і цю суміш перемішували в атмосфері аргону впродовж 1 години. Потім до неї додали молекулярні сита (1,0 г) і 1,4-діоксан (30 мл) і перемішування продовжували ще 30 хвилин. Отриману суспензію розвели 45 мл розчину хлороформу, який містив діетилмалонат (1,67 г; 10,2 мМ), 2-нітропроп-1-енілбензол (1,63 г; 10,0 мМ) і морфолін (46 мкл). Реакційну суміш перемішували при кімнатній температурі. Конверсію і вибірковість визначали за допомогою хіральної ВЕРХ [Chiralpak IC, 4,6 × 250 мм, 1,0 мл/хв., елюент i-PrOH-Гексан (1:9)], виконуючи аналіз кожні 24 години. Після завершення реакції реакційну суміш розвели гексаном (50 мл), перемішували 20 хвилин і відфільтрували тверду фазу. Фільтрат промили 5 % водною HCl (2 × 50 мл), розсолом (2 × 50 мл) і висушили над безводним Na2SO4. Сушильний реагент видалили фільтрацією, а розчин концентрували під зниженим тиском. Залишок очистили за допомогою колонкової хроматографії на кремнеземі з використанням етилацетату/гексану (1:10), збираючи фракції з Rf=0,28. Вихід 87 % (2,8 г). Отримана жовта тверда речовина з низькою температурою плавлення, згідно хіральної ВЕРХ, є сумішшю еритро- і трео-ізомерів диметил 2-(2-нітро-1R-фенілпропил)-малонату у співвідношенні 3:1. Оптична чистота: 93 %. 1 H ЯМР (CDCl3), δ, чнм (J, Гц): 0,85 (2,25 H, t, J=7,0 еритро-CH2CH3); 0,93 (0,75 H, t, J=7,0 трео-CH2CH3); 1,15-1,27 (3H, m, CH2CH3); 1,29 (0,75 H, d, J=6,8; трео-CH3CNO2); 1,37 (2,25 H, d, J=6,8; еритро-CH3CNO2); 3,63-3,93 (3H, m, CH2CH3, COCHCO); 4,07-4,29 (3H, m, CH2CH3, PhCH, ); 4,29-5,06 (0,25H, m, трео-CHNO2); 5,07-5,16 (0.75H, m, еритро-CHNO2); 6,99-7,28 (5H, m, C6H5). Приклад 2 Заміщення морфоліну в прикладі 1 N-метилморфоліном привело до утворення диетил 2-(2нітро-1R-фенілпропил)-малонату у вигляді суміші еритро- і трео-ізомерів 3:1. Оптична чистота: 94 %. Вихід 85 %. Приклад 3 Заміщення морфоліну в прикладі 1 сумішшю морфоліну (46 мкл) і тетра-метилгуанідину (46 мкл) привело до утворення диетил 2-(2-нітро-1R-фенілпропил)-малонату у вигляді суміші еритро- і трео-ізомерів 3:1. Оптична чистота: 95 %. Вихід 87 %. Приклад 4 3 UA 107367 C2 5 10 15 20 25 30 35 40 45 50 55 Суспензію диетил 2-(2-нітро-1R-фенілпропил)-малонату (2,34 г; 7,22 мМ) в етиловому спирті (50 мл) і 1 мл 50 % пульпи ренеєвського Ni у воді при перемішуванні піддавали гідрогенізації при 50 °C і 50 атм. впродовж 18 годин. Після завершення реакції реакційну суміш охолодили, каталізатор відфільтрували і промили з використанням 30 мл етилового спирту. Фільтрат концентрували під зниженим тиском. Залишок очистили за допомогою рідинної колонкової хроматографії на силікагелі з використанням CH2Cl2/EtOH (10:1 1:10), збираючи фракції з 1 Rf=0,28. Вихід 80 % (1,43 г). Отримана біла тверда речовина, згідно зі спектрами H ЯМР, являє собою суміш еритро- і трео-ізомерів етил 5-метил-2-оксо-4(R)-фенілпіролідин-3(S)-карбоксилат у відношенні 17:3. Вихід 80 % (1,43 г). 1 H ЯМР (CDCl3), δ, чнм (J, Гц): 0,76 (2,55 H, d, J=6,3 еритро-5-CH3); 1,18-1,23 (3,45 H, m, трео-5-CH3 і CH2CH3); 3,73 (1H, d, J=9,0; 3-H); 4,02-4,22 (4H, m, CH2CH3, 4-H, 5-H); 6,23 (1H, br. s, NH); 7,09-7,33 (5H, m, C6H5). Рекристалізація отриманого продукту з етилового спирту привела до виділення 785 мг 5Sметил-4R-феніл-2-піролідинон-3S-карбоксилату. Температура плавлення 141-143 °C. Аналіз: Обчислено для C14H17NO3 (247,30) C 68,00; H 6,93; N 5,66. Встановлено: C 67,93; H 6,87; N 5,64. 1 H ЯМР (CDCl3), δ, чнм (J, Гц): 0,76 (3 H, d, J=6,3 еритро-5-CH3); 1,18-1,23 (3 H, m, CH2CH3); 3,73 (1H, d, J=9,0; 3-H); 4,02-4,22 (4H, m, CH2CH3, 4-H, 5-H); 6,23 (1H, br. s, NH); 7,09-7,33 (5H, m, C6H5). Приклад 5 До розчину етил 5S-метил-4R-феніл-2-піролідинон-3(S)-карбоксилату (900 мг, 4,00 мМ) в метиловому спирту (50 мл) додали гідроокис калію (672 мг, 12 мМ), і отриману суміш нагрівали зі зворотним холодильником впродовж 3 годин. Реакційну суміш охолодили і випарили під зниженим тиском. Залишок розчинили в 20 мл води, водний розчин промили етилацетатом (3 × 30 мл), відрегулювали до рН 2 розведеною HCl і випарили під зниженим тиском. Отриманий залишок суспендували в розчині EtOH/CH2Cl2 (1:1), перемішували впродовж 1 години, профільтрували, а фільтрат випарили під зниженим тиском. Залишок розчинили в розчині ізопропилацетату (40 мл) і пара-толуолсульфонової кислоти (100 мг). Отриману суміш нагрівали зі зворотним холодильником впродовж 24 годин, охолодили і концентрували під зниженим тиском. Залишок очистили за допомогою рідинної колонкової хроматографії на силікагелі з використанням CH2Cl2/EtOH (20:1), збираючи фракції з Rf=0,40. Отримана жовта тверда речовина, згідно хіральній ВЕРХ, являє собою еритро-ізомер 5S-метил-4R-фенілпіролідин-2ону. Вихід 65 % (455 мг). Аналіз: Обчислено для C11H13NO (175,23) C 75,40; H 7,48; N 7,99. Встановлено: C 75,63; H 7,55; N 8,07. 1 H ЯМР (CDCl3), δ, чнм (J, Гц): 0,75 (3,00 H, d, J=6,5 5-CH3); 2,55-2,69 (2H, m, 3-CH2); 3,643,72 (1H, m, 4-H); 3,96-4,04 (1H, m, 5-H); 6,78 (1H, br. s, NH); 7,07-7,33 (5H, m, C6H5). Приклад 6 Заміна гідроокису калію в прикладі 5 на гідроокис натрію привела до утворення 5S-метил4R-феніл-2-піролідинону. Вихід 62 %. Приклад 7 Розчин 5S-метил-4R-феніл-2-піролідинону (351 мг; 2,00 мМ) в толуолі (30 мл) додали до суспензії гідриду натрію (56 мг; 2,35 мМ) в толуолі (30 мл). Цю суміш при перемішуванні нагрівали при 80÷90 °C впродовж 30 хвилин, після чого охолодили до кімнатної температури. Етил бромацетат (368 мг; 2,20 мМ) додали до реакційної суміші, яку нагрівали при 110÷120 °C впродовж 6 годин, а потім концентрували під зниженим тиском. Залишок розчинили в толуолі (30 мл). Отриманий розчин промили 5 % водною HCl (2 × 50 мл), розсолом (2 × 50 мл) і висушили над безводним Na2SO4. Сушильний реагент видалили фільтрацією, а розчин концентрували під зниженим тиском. Залишок очистили за допомогою колонкової хроматографії на кремнеземі з використанням CH2Cl2/MeOH (20:1). Фракції з Rf=0,48 збирали і випаровували під зниженим тиском, щоб отримати етил 2-(5S-метил-2-оксо-4R-феніл-піролідин-1-іл)-ацетат (381 мг, 73 %) у вигляді безбарвної олії. 1 H ЯМР (CDCl3), δ, чнм (J, Гц): 0,72 (3,00 H, d, J=6,6 5-CH3); 1,23 (3H, t, J=7,0; CH2CH3); 2,602,91 (2H, d, J=8,5; 3-CH2); 3,65-3,74 (1H, m, 4-H); 3,66 (2H, d, J=17,7; NCH2COO); 4,01-4,10 (1H, m, 5-H); 4,10-4,20 (2H, m, CH2CH3); 4,38 (1H, d, J=17,7; NCH2COO); 7,09-7,31 (5H, m, C6H5). Приклад 8 Заміна гідриду натрію в прикладі 7 етилатом натрію привела до утворення етил 2-(5Sметил-2-оксо-4R-феніл-піролідин-1-іл)-ацетату з виходом 68 %. 60 4 UA 107367 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 9 Заміна етил бромацетату в прикладі 7 етил хлорацетатом привела до утворення етил 2-(5Sметил-2-оксо-4R-феніл-піролідин-1-іл)-ацетату з виходом 70 %. Приклад 10 Заміна толуолу в прикладі 7 гексаном привела до утворення етил 2-(5S-метил-2-оксо-4Rфеніл-піролідин-1-іл)-ацетату з виходом 71 %. Приклад 11 Заміна толуолу в прикладі 7 бензолом привела до утворення етил 2-(5S-метил-2-оксо-4Rфеніл-піролідин-1-іл)-ацетату з виходом 70 %. Приклад 12 Заміна толуолу в прикладі 7 1,4-діоксаном привела до утворення етил 2-(5S-метил-2-оксо4R-феніл-піролідин-1-іл)-ацетату з виходом 72 %. Приклад 13 Заміна толуолу в прикладі 7 дихлорметаном привела до утворення етил 2-(5S-метил-2-оксо4R-феніл-піролідин-1-іл)-ацетату з виходом 67 %. Приклад 14 Розчин етил 2-(5S-метил-2-оксо-4R-феніл-піролідин-1-іл)-ацетату (350 мг; 1,34 мМ) в метиловому спирті (30 мл) насичували газоподібним аміаком впродовж 5 годин. Реакційну суміш концентрували під зниженим тиском, а залишок очистили за допомогою колонкової хроматографії з використанням CH2Cl2/EtOH (20:1). Фракції з Rf=0,32 збирали і випаровували під зниженим тиском, щоб отримати 2-(5S-метил-2-оксо-4R-феніл-піролідин-1-іл)-ацетамід (249 мг, 80 %) у вигляді білої твердої речовини, рекристалізованої з води. Температура плавлення 169171 °C. Обчислено для C13H16N2O2 (232,28) C 67,22; H 6,94; N 12,06. Встановлено: C 67,31; H 6,99; N 12,10. 1 H ЯМР (CDCl3), : 0,77 (3,00 H, d, J=6,6 5-CH3); 2,62-2,81 (2H, m, 3-CH2); 3,66-3,75 (1H, m, 4H); 3,75 (1H, d, J=16, NCH2COO); 3,98-4,08 (1H, m, 5-H); 4,04 (1H, d, J=16, NCH2COO); 5,48 і 6,29 (2H, br.s, br.s, NH2); 7,07-7,32 (5H, m, C6H5). Приклад 15 Заміна газоподібного аміаку в прикладі 13 25 % водним амонієм привела до утворення 2(5S-метил-2-оксо-4R-феніл-піролідин-1-іл)-ацетаміду з виходом 78 %. Приклад 16 Заміна метилового спирту в прикладі 13 етиловим спиртом привела до утворення 2-(5Sметил-2-оксо-4R-феніл-піролідин-1-іл)-ацетаміду з виходом 81 %. Приклад 17 Заміна метилового спирту в прикладі 13 n-пропанолом привела до утворення 2-(5S-метил-2оксо-4R-феніл-піролідин-1-іл)-ацетаміду з виходом 77 %. Приклад 18 Рацемічний 2-(5S-метил-2-оксо-4R-феніл-піролідин-1-іл)-ацетамід було отримано шляхом Nметилкарбомоїлування 5-метил-4-фенілпіролідин-2-ону. 1 H ЯМР (CDCl3), : 0,77 (1,50 H, d, J=6,6 еритро-5-CH3); 1,23 (1,50 H, d, J=6,3 трео-5-CH3); 2,53-2,86 (2H, m, 3-CH2); 3,66-3,75 (1H, m, 4-H); 3,75 (0,5H, d, J=16, еритро-NCH2COO); 3,86 (0,5H, d, J=16, трео-NCH2COO); 3,95 (0,5H, d, J=16, трео-NCH2COO); 3,98-4,08 (1H, m, 5-H); 4,04 (0,5H, d, J=16, еритро-NCH2COO); 5,48 і 6,29 (2H, br.s, br.s, NH2); 7,07-7,32 (5H, m, C6H5). Біологічні тести Навчання і пам'ять Тест на пасивне уникнення було проведено на апараті типу човникової коробки (Ugo Basile, Італія) з двома сполученими відділами однакового розміру (20 × 10 × 16 см) і сітчастою підлогою з нержавіючої сталі (перетинки на відстані 0,7 см одна від одної). Правий відділ (шоковий) був пофарбований чорним, щоб отримати темну камеру. Лівий відділ був пофарбований білим і освітлювався 100-Вт лампою, встановленою на кришці з плексигласу. Між цими відділами були передбачені підйомні дверцята (5 × 4 см). Першого дня (тренувальне випробування) мишей поміщали в освітлений відділ і через 60 сек. відкривали дверці між двома відділами. Коли миші входити у темне відділення всіма чотирма лапами, дверцята автоматично зачинялись і через сітчасту підлогу миші отримували удар електричним струмом (0,1 мA; 3 сек.), якого не можна було уникнути. Автоматично вимірювалась латенція до переходу в темне відділення (тренувальна затримка). Через 24 години (день 2) проводився тест на запам'ятовування. Мишей поміщали в світле (безпечне) відділення з можливістю доступу в темне (в межах 10 сек.) впродовж періоду 300 сек. (час відсічення). Автоматично вимірювалась латенція до переходу в темне відділення (тривалість утримування). 5 UA 107367 C2 5 Вплив 2-(4R-феніл-2-оксопіролідин-1-іл)ацетаміду, рацемічного 2-(5-метил-2-оксо-4-фенілпіролідин-1-іл)-ацетаміду і 2-(5S-метил-2-оксо-4R-феніл-піролідин-1-іл)-ацетаміду на збереження реакції пасивного уникнення (пам'ять) оцінювався у самців мишей ICR. Дані, представлені в Таблиці 1, демонструють вплив 2-(4R-феніл-2-оксопіролідин-1іл)ацетаміду, рацемічного 2-(5-метил-2-оксо-4-феніл-піролідин-1-іл)-ацетаміду і 2-(5S-метил-2оксо-4R-феніл-піролідин-1-іл)-ацетаміду на пам'ять в завданні на пасивне уникнення у мишей. Таблиця 1 Вплив введених сполук на пам'ять в завданні на пасивне уникнення у мишей Сполуки Контроль (сольовий розчин) 2-(4R-феніл-2-оксопіролідин-1-іл)ацетамід 2-(5-метил-2-оксо-4-феніл-піролідин-1-іл)-ацетамід, рацемічний 2-(5S-метил-2-оксо-4R-феніл-піролідин-1-іл)-ацетамід 10 15 20 Латентний період, сек. 62,76,2 94,927,6 74,219,9 *#$ 170,641,9 Сполуки вводились інтраперитонеально в дозі 46 мкмоль/кг за 60 хвилин до тренувального випробування (день 1). Контрольна група, якій вводили сольовий розчин, піддавалась тестуванню одночасно з групами, що отримували тестові сполуки. Статистичний аналіз виконувався як t-тест Стьюдента. Дані представлені як середнє значення ± стандартна похибка середнього значення. * # $ p< 0,05; p
ДивитисяДодаткова інформація
Автори англійськоюKalvinsh, Ivars, Lebedevs, Antons, Chernobrovijs, Aleksandrs, Dambrova, Maija, Zvejniece, Liga, Vorona, Maksims, Veinbergs, Grigorijs
Автори російськоюКалвиньш Иварс, Лебедевс Антонс, Чернобровийс Александрс, Дамброва Майя, Звейнисе Лига, Ворона Максимс, Веинбергс Григорийс
МПК / Мітки
МПК: A61P 25/00, A61P 25/28, A61K 31/4015, C07D 207/263
Мітки: активністю, 2-(5-метил-2-оксо-4-фенілпіролідин-1-іл)ацетамід, ноотропною, 4r,5s-енантіомер
Код посилання
<a href="https://ua.patents.su/9-107367-4r5s-enantiomer-2-5-metil-2-okso-4-fenilpirolidin-1-ilacetamid-z-nootropnoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">4r,5s-енантіомер 2-(5-метил-2-оксо-4-фенілпіролідин-1-іл)ацетамід з ноотропною активністю</a>
Попередній патент: Оптичний низькочастотний фільтр для діагностики та лікування амбліопії та диплопії
Наступний патент: Спосіб одержання каталізатора депероксидації
Випадковий патент: Спосіб зневоднення озерного сапропелю