Мультибіосенсорна система для одночасного визначення концентрацій глюкози, креатиніну та сечовини
Номер патенту: 114584
Опубліковано: 10.03.2017
Автори: Солдаткін Олексій Петрович, Пилипонський Ігор Ігорович, Марченко Світлана Володимирівна, Солдаткін Олександр Олексійович, Павлюченко Олексій Сергійович, Мамчур Ольга Олегівна, Кукла Олександр Леонідович
Формула / Реферат
Мультибіосенсорна система для одночасного визначення концентрацій глюкози, креатиніну та сечовини, що складається з трьох потенціометричних біосенсорів, перший з яких має два рН-чутливі польові транзистори, на один з яких нанесена робоча мембрана на основі глюкозооксидази, селективна до глюкози, на другий нанесена референтна мембрана, другий біосенсор, також має два рН-чутливі польові транзистори, на один з яких нанесена робоча мембрана на основі креатиніндеамінази, селективна до креатиніну, на другий нанесена референтна мембрана, третій біосенсор також складається з двох рН-чутливих польових транзисторів, на один з яких нанесена робоча мембрана на основі рекомбінантної уреази, селективна до сечовини, на другий нанесена референтна мембрана, а вказані три біосенсори оптимізовані для одночасної роботи та призначені для підключення до аналого-цифрового іонно-сенсорного вимірювача параметрів рідких середовищ, а виходи цього приладу підключені до відповідних входів комп'ютера.
Текст
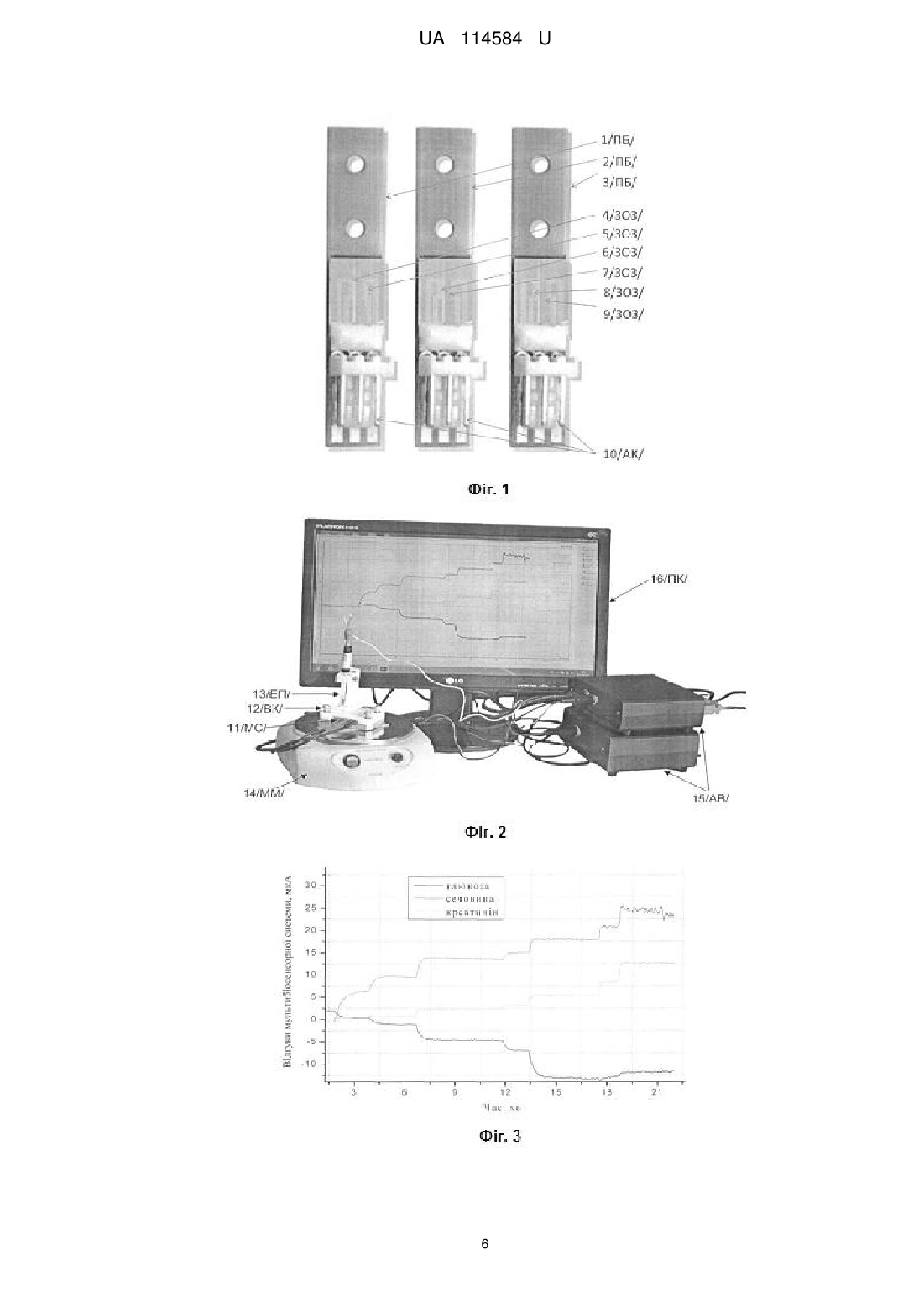
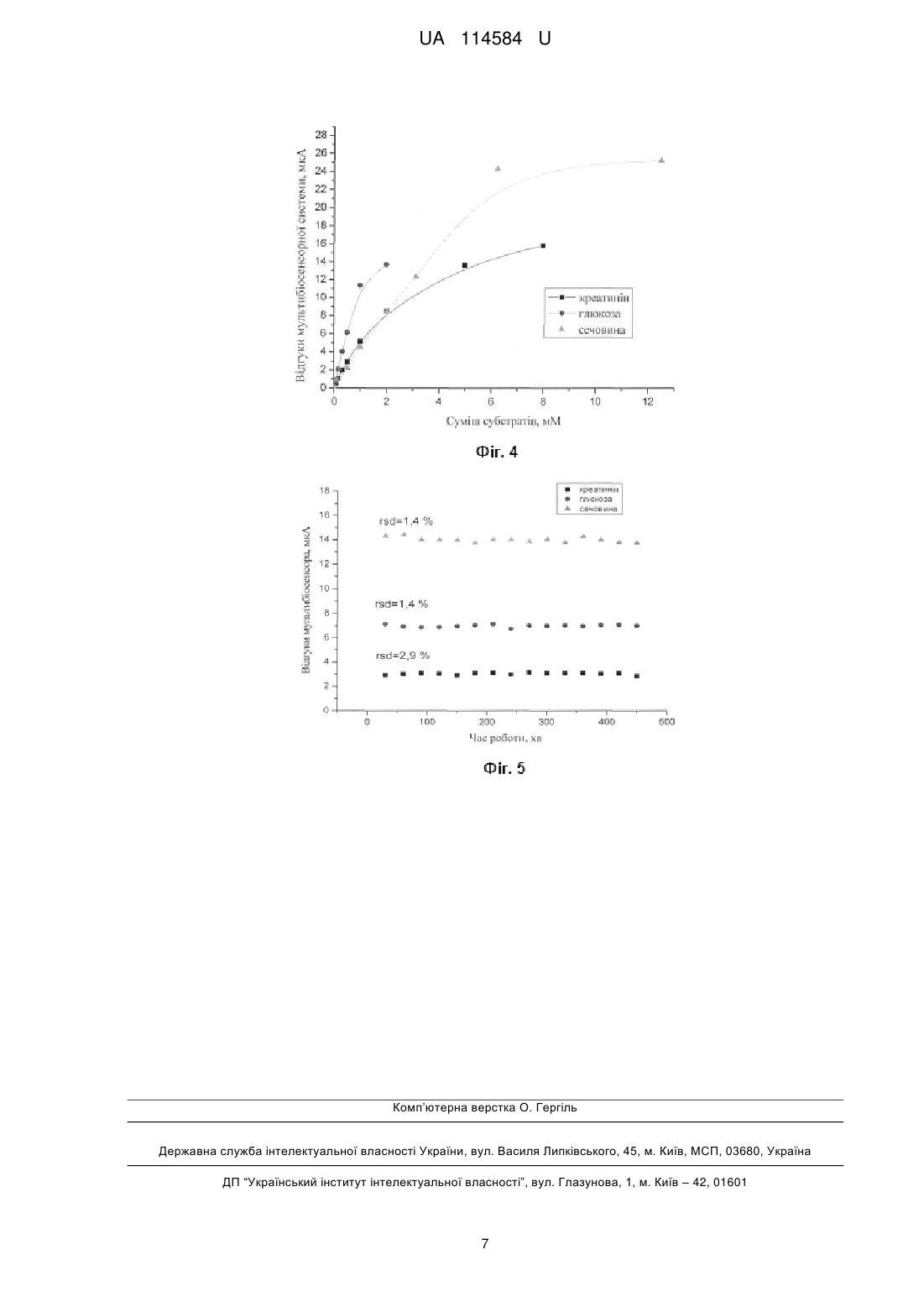
Реферат: Мультибіосенсорна система для одночасного визначення концентрацій глюкози, креатиніну та сечовини складається з трьох потенціометричних біосенсорів. Перший з біосенсорів має два рН-чутливі польові транзистори, на один з яких нанесена робоча мембрана на основі глюкозооксидази, селективна до глюкози, на другий нанесена референтна мембрана. Другий біосенсор також має два рН-чутливі польові транзистори, на один з яких нанесена робоча мембрана на основі креатиніндеамінази, селективна до креатиніну, на другий нанесена референтна мембрана. Третій біосенсор також складається з двох рН-чутливих польових транзисторів, на один з яких нанесена робоча мембрана на основі рекомбінантної уреази, селективна до сечовини, на другий нанесена референтна мембрана. Вказані три біосенсори оптимізовані для одночасної роботи та призначені для підключення до аналого-цифрового іонно-сенсорного вимірювача параметрів рідких середовищ, а виходи цього приладу підключені до відповідних входів комп'ютера. UA 114584 U (12) UA 114584 U UA 114584 U 5 10 15 20 25 30 35 40 45 50 55 60 Пропонована корисна модель належить до галузі медицини та охорони здоров'я, і може бути використана з метою вивчення стану нирок під час процедури гемодіалізу у хворих на цукровий діабет (ЦД), а саме визначення вмісту глюкози креатиніну та сечовини в сироватці крові хворих на ниркову недостатність, спричинену ЦД, а більш конкретно до мультибіосенсорної системи для одночасного визначення концентрацій глюкози, креатиніну та сечовини. Широка розповсюдженість ЦД у всьому світі призвела до стрімкого збільшення числа пацієнтів з хронічними діабетичними ускладненнями, серед яких діабетичне враження нирок діабетична нефропатія (ДН). Терміном "діабетична нефропатія" визначають хронічне ускладнення ЦД, яке відмічають в однієї треті хворих. Захворювання характеризується специфічним враженням ниркової паренхіми, що призводить до формуванням вузликового чи дифузного гломерулосклерозу. Частота розвитку ДН коливається від 25 до 40 % при ЦД 1 типу і від 12 до 26 % при ЦД 2 типу [1-3]. В США і Японії ДН займає перше місце за розповсюдженням серед всіх захворювань нирок (35-40 %). В країнах Європи хворі на ДН складають 20-25 % кількості пацієнтів, що потребують гемодіалізу [4]. Значною проблемою у хворих на ЦД є контроль глікемії. Негативними є як високі, так і низькі концентрації глюкози. Особливо небезпечною є гіпоглікемія, що може розвиватися під час процедури гемодіалізу, внаслідок видалення глюкози із кровотоку. Використання глюкозовмісних розчинів, постійний моніторинг рівня глюкози в крові під час сеансів рекомендовані для зниження ризику розвитку гіпоглікемічних станів у хворих на цукровий діабет, які перебувають в умовах хронічного гемодіалізу [5, 6]. Крім цього для контролю ефективності процедури гемодіалізу та для зменшення часу перебування пацієнта в незручних умовах, необхідний постійний контроль основних уремічних токсинів - сечовини та креатиніну [79]. В сучасній лабораторній діагностиці для кількісного аналізу зазначених метаболітів існують колориметричні методи аналізу. Наприклад, для колориметричного визначення глюкози використовують кольорові реакції між глюкозою та концентрованою сірчаною кислотою; глюкозою, концентрованою сірчаною кислотою і антроном чи а-нафтолом, чи тимолом, або ж хромотроповою кислотою. Для сечовини колориметричними реагентами є діацетилмонооксим, фталальдегід, нафтилетилендіамін, хромотропова кислота [10]. Найпоширенішим колориметричним визначенням креатині є реакція Яффе з використанням пікринової кислоти [11-13]. Проте наведені методи є досить складними у використанні: необхідний контроль температури, рН, що значно сповільнює аналіз, крім того існує велика кількість інтерферентів, взаємодія з якими призводить до хибних результатів. Необхідно проводити додаткову обробку біозразків: адсорбцію, екстракцію, діаліз, депротеїнізацію, використовувати ферменти, щоб видалити інтерферуючі речовини. Деякі речовини, що використовують в кольорових реакціях є дуже токсичними, деякі вибухонебезпечні. Даний шлях призводить до зниження точності та підвищення вартості аналізу зазначених метаболітів. Окрім колориметричного визначення концентрацій глюкози, сечовини та креатиніну існує друга група методів більш специфічних, які ґрунтуються на ферментативних реакціях з колориметричною детекцією. Для глюкози відомі найпоширеніші два методи: глюкозооксидазний та гексокіназний. Для сечовини всі сучасні ферментативні методиґрунтуються на використанні ферменту уреази. Метод складається з двох етапів. На першому при гідролізі сечовини утворюється іон амонію, концентрацію якого (другий етап) визначають з використанням послідовних ферментативних реакцій, потенціометричних методів чи технології "сухої хімії" [14]. У ферментативних колориметричних методах визначення креатиніну використовують креатиніназу, що каталізує гідроліз креатиніну до креатину, який потім визначають в креатинкіназній реакції. Ферментативні оптичні методи є специфічними і чутливими, але їх застосування для визначення концентрацій глюкози, сечовини і креатиніну обмежене нестійкістю ферментів при зберіганні та експлуатації, складністю методики аналізу, а також високою вартістю обладнання і затратних матеріалів, крім того необхідна наявність висококваліфікованого персоналу. До того ж неможливість одночасного аналізу всіх трьох метаболітів в польових умовах. На сьогоднішній день існує декілька мультибіосенсорних систем для одночасного визначення сечовини, креатиніну та глюкози [15, 16]. В основі роботи першої системи лежать EIS-сенсори, в процесі іммобілізації використовують мікросферовий альгінат як носій ферментів [15]. Описана мультибіосенсорна система дуже складна в виробництві та проведенні аналізу. Сама сенсорна система громіздка за рахунок використання багатошарового принципу конструкції. Друга мультибіосенсорна система є найбільш близькою до запропонованої заявки 1 UA 114584 U 5 10 15 20 25 30 35 40 45 50 [16]. Однак, описана мультибіосенсорна система, працює з використанням амперметричного методу аналізу, що свідчить про погану селективність аналізу відносно електроактивних речовин. Крім цього дана мультибіосенсорна система характеризується вузьким лінійним діапазоном визначення креатиніну, глюкози, сечовини в діапазонах 0,2-5; 0,2-10; і 0,5-20 мМ, відповідно. Крім цього система була слабо відтворена в межах 5-8 % від відносного стандартного відхилення. В основу запропонованої корисної моделі поставлено задачу створення такої мультибіосенсорної системи для одночасного визначення концентрацій глюкози, креатиніну та сечовини, яка б дозволила з більшою селективністю без впливу електороактивних речовин, кращою відтворюваністю з похибкою вимірювання менше 3 % від відносного стандартного відхилення та ширшим лінійним діапазоном роботи визначати концентрації глюкози, креатиніну та сечовини в зразках сироватки крові. Поставлена задача вирішується запропонованою мультибіосенсорною системою для одночасного визначення концентрацій глюкози, креатиніну та сечовини, що складається з трьох потенціометричних біосенсорів, перший з яких має два рН-чутливі польові транзистори, на один з яких нанесена робоча мембрана на основі глюкозооксидази, селективна до глюкози, на другий нанесена референтна мембрана, другий біосенсор, також має два рН-чутливі польові транзистори, на один з яких нанесена робоча мембрана на основі креатиніндеамінази, селективна до креатиніну, на другий нанесена референтна мембрана, третій біосенсор також складається з двох рН-чутливих польових транзисторів, на один з яких нанесена робоча мембрана на основі рекомбінантної уреази, селективна до сечовини, на другий нанесена референтна мембрана, а вказані три біосенсори оптимізовані для одночасної роботи та призначені для підключення до аналого-цифрового іонно-сенсорного вимірювача параметрів рідких середовищ, а виходи цього приладу підключені до відповідних входів комп'ютера. Використання в роботі перетворювачів на основі рН-чутливих польових транзисторів, дозволяло проводити більш селективний аналіз зразків за рахунок нівелювання впливу електроактивних речовин. Використання в роботі методу іммобілізації ферментів в парах глутарового альдегіду дало можливість розробити мультибіосенсорну систему, що характеризувалась високою відтворюваностю сигналу з похибкою вимірювання не більше 3 %. А використання в складі одного з біосенсорів рекомбінантної уреази розширило лінійний діапазон роботи мультибіосенсорної системи. В основі роботи мультибіосенсорної система для одночасного визначення концентрацій глюкози, креатиніну та сечовини лежать реакції ферментативного гідролізу: ГОД β-D-глюкоза + О2 + Н2О → D-глюконолактон + Н2О2 (1) + D-глюконова кислота + Н2О залишок кислоти + Н (2) Уреаза + + Сечовина + 2Н2О + Н → 2NH4 + НСО3(3) Креатиніндеіміназа + + Креатинін + Н2О Н → N-метилгідантоїн +NH4 (4) В ході ферментативних реакцій (1-4) змінюється концентрація протонів, що призводить до зміни рН розчина та відповідно, виникнення сигналу, який ми і реєструємо на рН-ПТ. Суть корисної моделі пояснюється графічними матеріалами, де: на фіг. 1 показано зовнішній вигляд трьох потенціометричних біосенсорів в складі мультибіосенсорної системи для одночасного визначення концентрацій глюкози, креатиніну та сечовини; на фіг. 2 показано блок-схему портативної потенціометричної біосенсорної системи для визначення концентрації глюкози, креатиніну та сечовини; на фіг. 3 показано типові відгуки мультибіосенсорної системи для одночасного визначення концентрацій глюкози, креатиніну та сечовини на додавання субстратів; на фіг. 4 наведено графіки залежності величин відгуків мультибіосенсорної системи для одночасного визначення концентрацій глюкози, креатиніну та сечовини від концентрації відповідних субстратів; на фіг. 5 наведено графіки відтворюваності відгуків мультибіосенсорної системи для одночасного визначення концентрацій глюкози, креатиніну та сечовини. Мультибіосенсорна система для аналізу глюкози, креатиніну та сечовини складається з трьох потенціометричних біосенсорів 1, 2, 3 /ПБ/ (Фіг.1) на основі рН-ПТ. Перший біосенсор 1 /ПБ/ має два рН-ПТ (зигзагоподібні області затворів) - 4, 5 /ЗОЗ/. На 4-й /ЗОЗ/ рН-ПТ нанесено робочу мембрану з глюкозооксидозою, селективною до глюкози. Другий біосенсор 2 /ПБ/ також має два рН-ПТ (зигзагоподібні області затворів) - 6, 7/303/, на 6/303/ нанесено робочу мембрану 2 UA 114584 U 5 10 15 20 25 30 35 40 45 50 55 60 з креатиніндеіміназою, селективною до креатиніну. Третій біосенсор 3/ПБ/ також має два рН-ПТ (зигзагоподібні області затворів) - 8, 9/ЗОЗ/, на 8/ЗОЗ/ нанесено робочу мембрану з рекомбінантною уреазою, селективною до сечовини. На другий транзистор (5, 7, 9/ЗОЗ/) усіх трьох біосенсорів (1, 2, 3) /ПБ/ нанесено типові референтні мембрани на основі сироваткового альбуміну бика. Зигзагоподібна геометрія затворних областей транзисторів має відношення довжини каналу до його ширини рівним 100, що забезпечує достатній рівень крутизни перехідної + характеристики, р -дифузійні з контактами до стоку і витоку кожного з транзисторів виведені на край чипа, як і виводи до вбудованих мікроелектродів порівняння. Алюмінієві контактні площини до усіх транзисторних виходів, виведені на край кожного з чипів - 10 /АК/. Вказана мультибіосенсорна система для одночасного визначення концентрацій глюкози, креатиніну та сечовини 11 /МС/ (Фіг. 2) вмонтована до спеціальної вимірювальної комірки 12/ВК/ з під'єднаним електродом порівняння 13/ЕП/. Сама вимірювальна комірка 12/ВК/ встановлена на магнітну мішалку 14/ММ/ для постійного перемішування в ході аналізу. Під час вимірювання мультибіосенсорна система для одночасного визначення концентрацій глюкози, креатиніну та сечовини 11/МС/ підключена до відповідних входів аналого-цифрового іонно-сенсорного вимірювача параметрів рідких середовищ 15/АВ/, розробленого та виготовленого в Інституті фізики напівпровідників ім. B.C. Лашкарьова НАН України [17], що працює по схемі прямого вимірювання струму в каналі польових транзисторів з активним навантаженням. Виходи приладу 15/АВ/ підключені до відповідних входів персонального комп'ютера 16/ПК/. Пропонована мультибіосенсорна система для одночасного визначення концентрацій глюкози, креатиніну та сечовини працює наступним чином. Попередньо виготовляли біоселективні мембрани. Для створення гелю для ферментної мембрани першого біосенсора (чутливого до глюкози) готували розчин з вмістом 20 % глюкозооксидази, 20 % сироваткового альбуміну бика (БСА), 10 % гліцерину у 20 мМ фосфатному буфері, рН 7,4. Гель для ферментної мембрани другого біосенсора (чутливого до креатиніну) робили таким же чином, але замість глюкозооксидази додавали 20 % креатиніндеімінази, 0,2 % ДЕАЕ-декстрану та 2 % лактитол. Гель для ферментної мембрани третього біосенсора (чутливого до сечовини) робили з 10 % рекомбінантної уреази, 10 % БСА, 10 % гліцерину, 0,2 % ДЕАЕ-декстрану та 2 % лактитолу. До складу гелів додавався гліцерин для стабілізації ферментів при іммобілізації та запобігання передчасному підсиханню біомембран, нанесених на поверхні перетворювачів. В свою чергу, сироватковий альбумін бика, ДЕАЕ-декстран та лактитол в складі ферментних мембран відігравали роль стабілізуючих агентів для ферментів. Далі, на робочі поверхні перетворювачів наносили приготовлені заздалегідь гелі і витримували в парах глутарового альдегіду (ГА) 10-30 хвилин. Таким чином, ферментна мембрана, нанесена на робочу область першого біосенсора складалась з 20 мМ фосфатного буфера, рН 7,4, та з наступних інгредієнтів у такомуїх співвідношенні (у мас %): 15-25 глюкозооксидаза, 15-25 БСА, 5-15 гліцерин, Ферментна мембрана, нанесена на робочу область другого біосенсора складалась з 20 мМ фосфатного буфера, рН 7,4, та з наступних інгредієнтів у такому їх співвідношенні (у мас. %): 15-25 креатиніндеіміназа, 15-25 БСА, 5-15 гліцерин, 1-2,5 лактитол, 0,1-0,3 ДЕАЕ-декстран. Ферментна мембрана, нанесена на робочу область третього біосенсора, складалась з 20 мМ фосфатного буфера, рН 7,4, та з наступних інгредієнтів у такому їх співвідношенні (у мас. %): 5-15 рекомбінантна уреаза, 5-15 БСА, 5-15 гліцерин, 1-2,5 лактитол, 0,1-0,3 ДЕАЕ-декстран. Ідентичні референтні мембрани наносились на робочі області обох біосенсорів, і складались з 20 мМ фосфатного буфера, рН 7,4, та з наступних інгредієнтів у такому їх співвідношенні (у мас. %): 15-45 БСА, 3 UA 114584 U 5 10 15 20 25 30 35 40 45 50 55 60 5-15 гліцерин. Співвідношення компонентів біоселективних мембран біосенсорної системи було отримано експериментально. Його підібрали для покращення аналітичних характеристик біосенсорів, таких як селективність, чутливість, операційна стабільність та ін. Після іммобілізації в парах ГА усі три біосенсори в складі мультибіосенсорної системи висушували 15 хвилин на повітрі за кімнатної температури. Перед початком роботи для видалення надлишку глутарового альдегіду та незв'язаних компонентів мембран біосенсори відмивали протягом 10-20 хвилин у робочому буфері, в якому і проводились подальші досліди. Мультибіосенсорну систему для одночасного визначення концентрацій глюкози, креатиніну та сечовини заздалегідь під'єднану до портативного потенціометричного приладу, поміщали до вимірювальної комірки об'ємом 1 мл, заповненої 5 мМ фосфатним буфером, рН 7,4, та витримували декілька хвилин для отримання стабільних базових ліній. Потім додавали певну аліквоту модельного розчину глюкози, отримували сигнал біосенсора на основі глюкозооксидази. Далі додавали певну аліквоту модельного розчину креатиніну, отримували сигнал другого біосенсора на основі креатиніндеімінази. Потім додавали певну аліквоту модельного розчину сечовини, отримували сигнал другого біосенсора на основі рекомбінантної уреази. Сигнали від мультибіосенсорної системи автоматично обробляються комп'ютером і виводяться у графічному вигляді. Графічне зображення відгуків мультибіосенсорної систему для одночасного визначення концентрацій глюкози, креатиніну та сечовини на додавання субстратів наведено на фіг. 3. Приклад аналізу вмісту сечовини та креатиніну в розчині. Визначення концентрації глюкози, креатиніну та сечовини проводили в 5 мМ фосфатному буферному розчині, рН 7,4, при кімнатній температурі. Використовувалась робоча комірка відкритого типу об'ємом 1 мл з інтенсивним перемішуванням. Перед початком роботи датчики з іммобілізованими мембранами деякий час (приблизно 20-30 хв.) відмивали від надлишків незв'язаного ГА до стабілізації базової лінії. Концентрацію субстратів змінювали, додаючи певні аліквоти вихідних концентрованих розчинів глюкози, сечовини та креатиніну. Після отримання кожного відгуку мультибіосенсорну систему відмивали від продукту, змінюючи робочий буфер мінімум 3 рази кожні 2 хв. Шляхом додавання різної кількості модельних концентрованих розчинів глюкози, креатиніну та сечовини було побудовано калібрувальні криві для визначення концентрації усіх трьох субстратів (Фіг.4). Визначення концентрацій глюкози, креатиніну та сечовини в аналізованих зразках сироватки крові здійснювали за калібрувальною кривою (Фіг. 4). Додавали аліквоту проби до вимірювальної комірки та отримували відгуки мультибіосенсорної системи для одночасного визначення концентрацій глюкози, креатиніну та сечовини. Далі за калібрувальними кривими вираховували концентрацію відповідного аналіту в невідомій пробі. Як і очікувалось, запропонована мультибіосенсорна система для одночасного визначення концентрацій глюкози, креатиніну та сечовини, виходячи з експериментальних даних, була більш селективною порівняно з відомим амперметричним аналогом [16], оскільки слабо чутлива до електроактивних речовин. Також мультибіосенсорна система характеризувалась ширшим ніж у найбільш близького до запропонованої заявки мультибіосенсора лінійним діапазоном визначення концентрацій глюкози, креатиніну та сечовини в діапазонах з 0,08 до 1 мМ, з 0,08 до 2 мМ та 0,5 до 10 мМ, відповідно. Крім цього заявлена мультибіосенсорна система була добре відтворюваною в межах 1,5-3 % від відносного стандартного відхилення (Фіг. 5), що порівняно з відомим мультибіосенсором, приблизно, в 3-5 разів краще. Джерела інформації: 1. Бабенко А.Ю., Байрашева В.К. Диабетическая нефропатия // Медицинский совет. - 2015. № 7. - С. 32-43. 2. Каджарян В.Г., Капшитарь Н.И., Бидзиля ПП., Соловьюк А.О. Оценка эффективности терапии сулодексидом дибетической нефропатии III стадии у пациентов с сахарным диабетом 2 типа // Запорожский медицинский журнал - 2013. - № 4 (79). - С. 85-89. 3. Майданник В.Г., Бурлака Є.А. Стан метаболічно-гіпоксичних порушень при діабетичній нефропатії у дітей // Експериментальна та клінічна фізіологія і біохімія. - 2015. - № 4. - С. 47-55. 4. Готье С.В. Сахарный диабет 1 типа, диабетическая нефропатия: возможности трансплантологии // Вестник РАМН. - 2012. - № 1. - с. 54-60. 5. Noritsugu Wada N., Mori К., Nakagawa С., Sawa J., Kumeda Y., Shoji Т., Emoto M., Masaaki Inaba M. Improved Glycemic Control with Teneligliptin in Patients with Type 2 Diabetes Mellitus on Hemodialysis: Evaluation by Continuous Glucose Monitoring // Journal of Diabetes and its Complications. -2015. - Vol. 29. - P. 1310-1313. 4 UA 114584 U 5 10 15 20 25 30 6. Abea M., Higuchib Т., Moriuchia M., Okamuraa M., Tei R., Naguraa C., Takashima H., Kikuchic F., Tomitad H., Okada K. Efficacy and safety of saxagliptin, a dipeptidyl peptidase-4 inhibitor, in hemodialysis patients with diabetic nephropathy: A randomized open-label prospective trial // Diabetes Research and Clinical Practice. - 2016. - Vol. 116. - P. 244-252. 7. Bioanalytical system for control of hemodialysis treatment based on potentiometric biosensor for urea and creatinine / A. Radomska, R. Koncki, K. Pyrzynska [et al.] // Analytica Chimica Acta. 2004. - Vol. 523. - P. 193-200. 8. Gutierrez M. Bioelectronic tonque for the simultaneous determination of urea, creatinine and alkaline ions in clinical samples / M. Gutierrez, S. Alegret, M. del Valle // Biosensors and Bioelectronics. - 2008. - Vol. 23. - P. 795-802. 9. Measurement of urea, creatinine and urea to creatinine ratio using enzyme based chemical current conveyor (CCCII+) / P. Pookaiyaudom, P. Seelanan, F.J. Lidgey [et al.] // Sensors and Actuators B. - 2011. - Vol. 153. - P. 453-459. 10. Jurkiewicz M., Alegret S., Almirall J., Garcia M., Fabregas E., Development of a biparametric bioanalyser for creatinine and urea. Validation of the determination of biochemical parameters associated with hemodialysis // Analyst. - 1998. - Vol. 123. - P. 1321-1327. 11. Jaffe M. Uber den Niederschlag, welchen Pikrinsaure in normalem Harn erzeugt und uber eine neue Reaktion des Kreatinins / M. Jaffe // Zeitschrift fur physiologische Chemie. - 1886. - Vol. 10. - P. 391-400. 12. Khan G.F. A highly sensitive amperometric creatinine sensor / G.F. Khan, W. Wernet // Analytica Chimica Acta. - 1997. - Vol. 351. - P. 151-158. 13. Killard A.J. Creatinine biosensors: principles and designs / A.J. Killard, S.M. Smyth // Trends in Biotechnology. - 2000. - Vol. 18, № 10. - P. 433-437. 14. http://www.terramedica.spb.ru/1d4 2007/slepushiva.htm. 15. Lin Y.-H., Wang S.-H., Wu M.-H., Pan T.-M, Lai C.-S., Luo J.-D., Chiou C.-C. Integrating solidstate sensor and microfluidic devices for glucose, urea and creatinine detection based on enzymecarrying alginate microbeads // Biosensors and Bioelectronics. - 2013. - Vol. 43. - P. 328-335. 16. Rui C.-S., Ogawa H.-L, Sonomoto K., Kato Y. Multifunctional flow-injection biosensor for the simultaneous measurement of creatinine, glucose and urea // Biosci. Biotech. Biochem. - 1993. -Vol. 57. - P. 191-194. 17. О.Л. Кукла, О.С. Павлюченко, О.В. Бушма, Ю.В. Голтвянський, СВ. Дзядевич, О.П. Солдаткін, Патент України на корисну модель "Аналого-цифровий іонно-сенсорний вимірювач параметрів рідких середовищ", UA № 48359 МПК G01N 27/26, 27/27, заявл.26.10.2009, опубл. 10.03.2010, Бюл. № 5. 35 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 40 45 Мультибіосенсорна система для одночасного визначення концентрацій глюкози, креатиніну та сечовини, що складається з трьох потенціометричних біосенсорів, перший з яких має два рНчутливі польові транзистори, на один з яких нанесена робоча мембрана на основі глюкозооксидази, селективна до глюкози, на другий нанесена референтна мембрана, другий біосенсор, також має два рН-чутливі польові транзистори, на один з яких нанесена робоча мембрана на основі креатиніндеамінази, селективна до креатиніну, на другий нанесена референтна мембрана, третій біосенсор також складається з двох рН-чутливих польових транзисторів, на один з яких нанесена робоча мембрана на основі рекомбінантної уреази, селективна до сечовини, на другий нанесена референтна мембрана, а вказані три біосенсори оптимізовані для одночасної роботи та призначені для підключення до аналого-цифрового іонно-сенсорного вимірювача параметрів рідких середовищ, а виходи цього приладу підключені до відповідних входів комп'ютера. 50 5 UA 114584 U 6 UA 114584 U Комп’ютерна верстка О. Гергіль Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G01N 33/50, C12Q 1/54, G01N 27/27, C12Q 1/58, C12Q 1/50, G01N 27/26
Мітки: мультибіосенсорна, концентрацій, креатиніну, глюкози, одночасного, визначення, сечовини, система
Код посилання
<a href="https://ua.patents.su/9-114584-multibiosensorna-sistema-dlya-odnochasnogo-viznachennya-koncentracijj-glyukozi-kreatininu-ta-sechovini.html" target="_blank" rel="follow" title="База патентів України">Мультибіосенсорна система для одночасного визначення концентрацій глюкози, креатиніну та сечовини</a>
Попередній патент: Спосіб одностороннього контактного точкового зварювання
Наступний патент: Система запобігання виникненню аварійних ситуацій інженерних мереж приміщень
Випадковий патент: Спосіб перфорації мульчуючої рулонної полімерної плівки