Засіб для профілактики судинних захворювань, які обумовлені дією глікопротеїнзв’язаних пероксидів
Номер патенту: 26973
Опубліковано: 28.02.2000
Автори: ЕЛЬСТНЕР Еріх Ф., МЕЙЕР Брітта, ШНАЙДЕР Вернер
Формула / Реферат
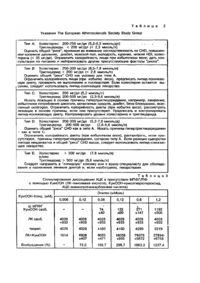
Применение магний-пиридоксаль-5-фосфат глютамината, при необходимости содержащего марганцевую соль, в качестве средства для профилактики сосудистых заболеваний, обусловленных действием гликопротеинсвязанных пероксидов.
Текст
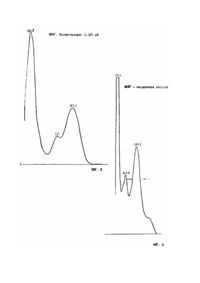
Изобретение касается применения магний-пиридоксаль-5'-фосфат-глютамината для предупреждения болезней, вызываемых LDL-связанными пероксидами и приводящих к повреждению сосудов. В последние четыре десятилетия в западных индустриальных странах наблюдается быстрый рост нарушений обмена веществ, главным образом, нарушений жирового обмена веществ. Основная причина этого - в чрезмерной пище и/или употреблении жирных продуктов при одновременном ограниченном движении. При этих условиях увеличивается содержание холестерина и др. липидов в крови и в результате возрастает вероятность атеросклеротических сердечных и периферийных сосудистых заболеваний. Известно, что повышенные уровни холестерина в крови вызывают появление артериальных сосудистых склерозов. Гиперхолестеромия - нарушение обмена веществ, которое всегда сопровождает гиперлипидамию. Патогенетически различные, но симптоматически сходные клинические картины гиперлипидамии (замутнение сыворотки хилус - микронами) и гиперхолестерамии (увеличение содержания холестерина в плазме крови до уровня более 200мг%) суммированы в общие понятия гиперлипопротеинамия или гиперлипидамия. Для лечения гиперхолестерамии преимущественно используются производные арилоксиуксусной кислоты, в особенности, - этиловые эфиры альфа-(h-хлорфенокси)-изомасляной кислоты, а также производные никотиновой кислоты. Кроме того, в описании патента DE-PS 24 61 742 говорится об использовании для лечения и профилактики гиперхолестерамии глютаминовых эфиров пиридоксин-5'-фосфорной кислоты. При характеристике клинической картины гиперхолестерамии или гиперлипидамии необходимо учесть, что сосудистые заболевания вероятны для подвергающейся опасности группы лиц-группы "риска" - а именно куриль щиков, диабетиков, престарелых, с высоким кровяным давлением, лиц, испытывающих сильные волнения (стрессы). Это является следствием присутствия в крови повышенной концентрации пероксидов, связанных с LDL (липопротеин низкой плотности). Эти LDL - связанные пероксиды вызывают и ускоряют образование атеромы и атеросклеротических "бляшек" в сосудах и могут рассматриваться как случай диабетической ангиопатии. Наличие повышенных концентраций пероксадированных продуктов и их взаимосвязь с повреждениями сосудов описаны J. М. С. Gutteridge et al. in Trends in Biochemical Sciences, April 1990, p. 129 - 135. D. W. Morel et al. in Journal of Lipid Research, Vol. 30, 1989, p. 1827 - 1834. Известно, что атеросклеротические изменения в сосудах являются результатом эндотелийных повреждений и патогенез продолжается следующим образом: эндотелийное повреждение - пластинчатая адгезия - размножение клеток одинаковой силы - отложение липида. Первая стадия - эндотелийное повреждение - может иметь множество случаев, а именно: механическое повреждение рассекающими силами, в случае гипертонии: химическое повреждение холестерином при гиперхолестерамии, и, в частности, токсическое повреждение (отравление) из-за заражений крови. Полагают, что другие направления почти идентичны с тремя указанными типами поражений. Результат эндотелийного повреждения, также как последующего жирового отложения (и в) клетками артериальной системы, повышенное скопление тромбоклеток, сопровождаемое размножением клеток одинаковой силы, приводящее к дальнейшему увеличенному накоплению липопротеинов в соединительной ткани основного вещества, образованию комплекса с аминоглицаном глюкозы в соединительной ткани и нарушениям обмена веществ на клеточном уровне. Затем образование кальция в пораженных зонах завершает все изменения, которые, в конечном счете, вызывают сужение сосудов. Исследования, выполненные на гиперхолестеромичных кроликах и крысах В. Шнейдером в его диссертации (завершенной в 1987г.) в Университете Йоханна Гутенберга, Майнц, показали, что при введении относительно высоких концентраций магний-пиридоксаль-5'-фосфат-глютамината (МПФГ) снижаются концентрации липида в аорте. Но эта работа не дает каких-либо сведений по механизму, который приводит к образованию сосудистой атеромы в группах "риска" (согласно результатам В.Шнейдера), и нельзя заключить, что образование атеромы может быть предупреждено исключением имеющихся в крови загрязнений. В прошлом предполагали, что пероксиды в крови могут инициировать нарушения обмена веществ. У. П. Шнейберг и др. в J. Biol. Chem., Vol. 264, No 26, p. 15216 to 15223 (1989) указали на наличие окислительно-модифицированных LDL в качестве рецепторов этого. Настоящим изобретением доказывается (на основании целеустремленных опытов), что это вызвано LDL - связанными пероксидами. Опытами, проведенными in vitro, могла быть внесена ясность в один из механизмов, лежащий в основе токсического эндотелийного повреждения, и было показано, что, возможно, вводить эти пероксиды, а их применение безвредно. Предмет изобретения - фармацевтическое обеспечение LDL -связанных пероксидов для того, чтобы избежать и/или замедлить сосудистые повреждения, в частности, образование атером или артериосклеротических образований в артериальных сосудах, также как ангиопатических заболеваний в случае диабета. Предметом настоящего изобретения при этом, в частности, является фармацевтическое обеспечение указанных выше случаев при отсутствии диагнозов гиперлипидамии или гиперхолестерамии. Указанная выше цель достигается согласно изобретению, использованием магний-пиридоксаль-5'-фосфатглютамината с получением лекарственного препарата, пригодного для профилактики болезней, вызываемых сосудистыми повреждениями. В частности, согласно изобретению, предотвращаются атероматозы, также как и ангиопатические болезни у подверженных заболеваниям групп лиц, включающих диабетиков, курильщиков, престарелых, гипертоников и лиц, испытывающих стрессы. Магний-пиридоксаль-5'-фосфат-глютаминат - вещество, которое предпочтительно было использовано для снижения повышенного содержания жира в крови. Вещество (МПФГ) известно под торговым названием Седалипидр и распространяется фирмой Steigerwald Arzneimittelwerk, Darmstadt. До сих пор было известно, что магний-пиридоксаль5'-фосфат-глюминат действует как радикальный интерцептор в крови и поэтому возможно предотвращение цепной реакции, вызванной пероксидом липида. На основе этого эффекта (как радикального интерцептора) использование МПФГ пригодно для профилактики сосудистых повреждений, в особенности, при отсутствии гиперлипидамии и/или гиперхолестерамии. МПФГ является производным пиридоксина и имеет следующую формулу: В определенном смысле изобретения подверженными риску заболевания группами лиц являются, в частности, куриль щики, диабетики, лица с высоким давлением крови, также как и испытывающие сильные волнения (например, спортсмены), престарелые. Согласно изобретению, соединение МПФГ вводится лицам "риска", имеющим высокую концентрацию LDLсвязанных пероксидов, однако не испытывающим симптомы гиперлипидами и/или гиперхолестерамии. Эти симптомы обычно определяются на основе холестерина и триглицерида. В Европе, также как и в США, существуют рекомендации по уровням холестерина и триглицерида, которые могут считаться нормальными. Эта ссылка относится к рекомендациям National Cholesterol Education Programme (NCEP) США и указаниям The European Atherosclerosis Society Study Group. В табл.1 и 2 приведены значения нормальных уровней холестерина и триглицерида, а также рекомендации по лечению: Существуют также подобные опубликованные рекомендации British Cardiac Society Working Group on Coronary Prevention, the British Hyperlipidemia Association and the Canadian Consensus Conference on Cholesterol. Из данных, приведенных в таблицах, ясно, что имеются незначительные отличия в значениях уровня "вредного" холестерина. Тем не менее, полезно достижение уровней ниже пограничных или в средней зоне между еще нормальным и повышенным уровнями, с помощью введения МПФГ, согласно изобретению, что благотворно сказывается для всех групп лиц, подверженных заболеванию, имеющих высокий уровень LDL-связанных пероксидов. Хотя не определена граница уровня холестерина, вызывающего гиперлипидамию, предполагаю, согласно общему подходу, что примерно 240мг/дл (в соответствии с рекомендациями США) или 250мг/дл (в соответствии с рекомендациями EG) могут быть приняты как начало гиперлипидамии. Следовательно, при введении МПФГ, согласно изобретению, достигаются значения ниже указанных уровней холестерина. Заявители выполнили исследования, ясно показывающие, что у группы лиц "риска" наблюдаются высокие уровни LDL-связанных пероксидов. Было также показано, что при добавлении МПФГ исчезают симптомы, характерные для LDL-связанных пероксидов. Таким образом, было выявлено, что применение МПФГ пациентами, отнесенными к группе "риска", является оправданным и полезным. При ускорении образования атеромы, особенно, у указанной выше группы лиц, предполагают следующий механизм, который подтверждается описанными ниже опытами in vitro: LDL окисляется кислород-содержащим реагентом (перокисный радикал О2-, гидроксил-радикал ОН), в частности, пероксидом, который присутствует в крови, с образованием LDL-пероксида. Этот LDL-пероксид, в основном, не абсорбируется макрофагами, но связывает отработанный рецептор, который отлагается в эндотелийных клетках (см. литературу, названную выше - Steinbrecheretal). В этом случае LDL-отложения образуются на эндотелиальных клетках, которые затем притягивают дальнейшие липидные отложения. Дальнейшее повреждение сосудов эндотелиальных клеток вызывается окислением глютатиона пероксидом и/или LDL-связанным пероксидом. Это окисление может привести к гибели клеток, т.к. клетка не может больше поддерживать окислительно-восстановительный потенциал (Kuzuya К. et. al. in Biochem. Biophys. Res. Comm., Vol. 163, No. 3, 1989, p. 1466 - 1472). Следующие сведения позволяют более детально объяснить механизм влияния МПФГ на LDL-связанный пероксид. Исследования, проведенные на основе насыщенной кислоты, связанной пероксидами, показывают, что последняя разлагается в присутствии МПФГ и становится поэтому безвредной. На фиг.1 показан спектр линолевой кислоты (0,88мМ). Основной пик - при 211нм, в то время как около 232 имеется наименьший пик, характеризующий присутствие наибольшее количество окисленной линолевой кислоты; на фиг.2 – спектр МПФГ (концентрация 0,125мМ), который имеет пики при 222, 327 и 387; на фиг.3 - спектр раствора линолевой кислоты и МПФГ. Этот спектр имеет пики при 211, 243 и 289нм. Пик, полученный ранее (на рис.1) при 232, незначительно присутствует на рис.3. Вместо этого, на рис.3 показано два новых пика при 243 и 289нм. Следующая схема отражает предполагаемый механизм процесса окисления насыщенной кислоты, как описано, например, J.M.C. Gutteridje et al. In Trends in Biochemical Sciences, April, 1990, p. 130: Первоначальное воздействие на мостиковую группу СН2 - оказывается Н'- радикалом. Это вызывает перегруппировку с образованием сопряженных двойных связей. Результатом является образование радикала насыщенной кислоты, который образует в присутствии кислорода пероксидный радикал. В присутствии следующей молекулы насыщенной кислоты образуется гидропероксид насыщенной кислоты, а также радикал насыщенной кислоты, благодаря чему начинается цепная реакция. Реакционная схема, показанная выше, может служить подтверждением (при 234нм) диеновой реакции. На фиг.1 - 3 может быть заключено, что пик для окисленной линоленовой кислоты исчезает при 232нм (фиг.1) за счет прибавления МПФГ в концентрации 0,125мМ (фиг.1), что вызывает прекращение цепной реакции, приведенной выше, и поэтому прогресс болезни также прекращается. Для разложения гидропероксида в присутствии вещества МПФГ, применяемого в соответствии с изобретением", предполагается следующий механизм с участием марганца как катализатора: Доказательство протекания этой реакции разложения возможно с использованием вещества-индикаторааминоциклопропан-карбоновой кислоты (АЦК). АЦК - основное вещество, из которого в организме образуется этилен. Выделяющийся этилен может быть определен количественно. Разложение гидропероксида может быть подтверждено, например, с гидропероксидом кумоле. АЦК служит индикатором. Предполагают, что реакция протекает через амин в пиридоксальфосфат, который вызывает образование радикала. Этот радикал инициирует разложение АЦК на С2Н4, СО2 и цианид. Следующие эксперименты показывают стимулирование диссоциации АЦК с МЛФГ в присутствии гидропероксида кумоле. (КумООН). При одном и том же времени были выполнены сравнительные испытания с соответствующими количествами (молярные отношения) пиридоксальфосфата) (ПФ). Пример. Были приготовлены следующие растворы в буферном фосфате (0,1М) рН, 7,4, с различными концентрациями гидропероксида кумоле. Загрузка: фосфат-буфер 0,1М, рН 7,4 АЦК 1,0мМ МПФГ 0,5мМ Мn2+ 0,1мМ ЛК 0,88мМ КумООН 0,006 - 1,2мМ дист, вода 2мл Фиг.4а, в показывают возбуждение диссоциации АЦК с помощью МПФГ или ПФ зависимости от концентрации КумООН. При диссоциации АЦК с пиридоксальфосфатом наблюдалось умеренное выделение этилена, в противоположность случаю с МПФГ, при более низкой концентрации кумолгидропероксида (0,006мМ). При 0,12нм КумООН в присутствии МПФГ было обнаружено возбуждение диссоциации АЦК на 70%. При концентрации 0,6 - 1,2мМ отмечены высокие возбуждающие эффекты в присутствии МПФГ, в сравнении с ПФ.
ДивитисяДодаткова інформація
Назва патенту англійськоюAgent for prophylaxis of the vascular diseases coused by the action of glycoproteinconnected peroxides
Назва патенту російськоюСредство для профилактики сосудистых заболеваний, обусловленных действием гликопротеинсвязанных пероксидов
МПК / Мітки
МПК: A61K 31/435, A61K 31/675
Мітки: пероксидів, судинних, засіб, захворювань, обумовлені, глікопротеїнзв'язаних, дією, профілактики
Код посилання
<a href="https://ua.patents.su/9-26973-zasib-dlya-profilaktiki-sudinnikh-zakhvoryuvan-yaki-obumovleni-diehyu-glikoprotenzvyazanikh-peroksidiv.html" target="_blank" rel="follow" title="База патентів України">Засіб для профілактики судинних захворювань, які обумовлені дією глікопротеїнзв’язаних пероксидів</a>
Попередній патент: Веломобіль
Наступний патент: Спосіб безперервного виготовлення панелей типу “сендвіч” та пристрій для його здійснення
Випадковий патент: Викопувальний орган коренезбиральної машини