Кристалічна структура лікарського препарату у формі таблеток на основі міансерину гідрохлориду
Номер патенту: 37553
Опубліковано: 25.11.2008
Автори: Дубіна Олег Вячеславович, Приходько Роман Миколайович, ШТЕЙНГАРТ Марк Вольфович
Формула / Реферат
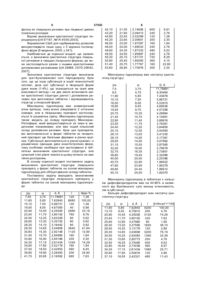
1. Кристалічна структура лікарського препарату у формі таблеток на основі міансерину гідрохлориду:
![]()
![]()
d, Å
І
І відн., %
7,50
3,75
11,78691
120
1,38
11,60
5,80
7,62843
8680
100,00
15,10
7,55
5,86721
120
1,38
19,00
8,50
4,67000
40
0,98
20,90
10,45
4,25000
2880
33,18
23,40
11,70
3,80152
760
8,76
24,50
12,25
3,63328
80
0,92
26,60
13,30
3,35102
80
0,92
28,20
14,10
3,16442
80
0,92
29,30
14,65
3,04808
3640
41,94
30,60
15,30
2,92148
1120
12,90
31,40
15,70
2,84885
160
1,84
33,80
16,90
2,65186
200
2,30
34,30
17,15
2,61434
1240
14,29
35,60
17,80
2,52179
160
1,84
37,00
18,50
2,42953
560
6,45
39,80
19,90
2,26483
200
24,90
41,70
20,85
2,16592
680
7,83
42,10
21,05
2,14626
600
6,91
43,20
21,60
2,09413
240
2,76
44,80
22,40
2,02299
120
1,38
45,20
22,60
2,00601
200
2,30
46,00
23,00
1,97297
160
1,84
48,00
24,00
1,89533
240
2,76
48,60
24,30
1,87333
480
5,53
49,00
24,50
1,85897
240
2,76
50,20
25,10
1,81731
720
8,29
50,80
25,40
1,80000
360
4,15
51,40
25,70
1,77767
160
22,90
53,60
26,80
1,70978
200
2,30.
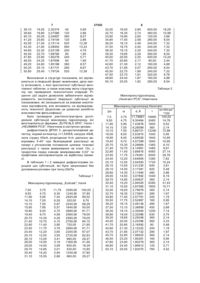
2. Кристалічна структура за п. 1, яка відрізняється тим, що міансерину гідрохлорид має наступну кристалічну структуру:
![]()
![]()
D, Å
7,5
3,75
11,78691
9,5
4,75
9,30464
11,90
5,95
7,43678
15,10
7,55
5,86721
16,00
8,00
5,53915
18,90
9,45
4,69526
19,40
9,70
4,57299
20,70
10,35
4,28864
21,40
10,70
4,14991
22,80
11,40
3,89816
23,50
11,75
3,78361
24,40
12,20
3,64605
25,10
12,55
3,54593
26,10
13,05
3,41230
28,10
14,05
3,17381
29,00
14,50
3,07892
31,10
15,55
2,87565
32,00
16,00
2,79679
32,70
16,35
2,73851
38,80
19,40
2,32086
40,00
20,00
2,25396
45,70
22,85
1,98522
47,80
23,90
1,90279
48,80
24,40
1,86612
50,10
25,05
1,82070.
3. Кристалічна структура за п. 1, яка відрізняється тим, що міансерину гідрохлорид в таблетках з кальцію дифосфатдигідратом має на 40-80 % в залежності від бреггівського кута меншу інтенсивність, ніж в субстанції.
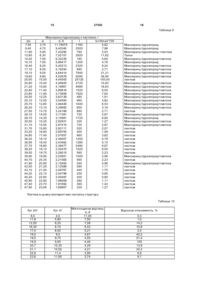
4. Кристалічна структура за п. 1, яка відрізняється тим, що кальцію дифосфатдигідрат має наступну кристалічну структуру:
![]()
![]()
d, Å
І
I=I/I max*100
11,60
5,80
7,62843
4200
100,00
13,10
6,55
6,75812
200
4,76
20,90
10,45
4,25026
3120
74,29
23,40
11,70
3,80152
320
7,62
25,60
12,80
3,47960
80
1,90
26,40
13,20
3,37595
1600
38,10
28,50
14,25
3,13179
120
2,86
29,30
14,65
3,04808
3200
76,19
30,50
15,25
2,93083
1360
32,38
31,30
15,65
2,85773
200
4,76
32,50
16,25
2,75490
400
9,52
32,80
16,40
2,73038
360
8,57
34,30
17,15
2,61434
1080
25,71
35,80
17,90
2,50816
120
2,86
37,10
18,55
2,42321
480
11,43
39,10
19,55
2,30374
40
0,95
39,60
19,80
2,27580
120
2,86
40,10
20,05
2,24857
360
8,57
41,20
20,60
2,19104
120
2,86
42,00
21,00
2,15114
520
12,38
43,30
21,65
2,08953
560
13,33
44,60
22,30
2,03159
200
4,76
45,40
22,70
1,99764
80
1,90
47,80
23,90
1,90279
240
5,71
48,50
24,25
1,87695
80
1,90
49,20
24,60
1,85188
360
8,57
50,20
25,10
1,81731
280
6,67
50,80
25,40
1,79724
520
12,38.
Текст
УКРАЇНА (19) UA (11) 37553 (13) U (51) МПК (2006) A61K 9/20 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ОПИС ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ в идається під в ідпов ідальність в ласника патенту ДО ПАТЕНТУ НА КОРИСНУ МОДЕЛЬ (54) КРИСТАЛІЧНА СТРУКТУРА ЛІКАРСЬКОГО ПРЕПАРАТУ У ФОРМІ ТАБЛЕТОК НА ОСНОВІ МІАНСЕРИНУ ГІДРОХЛОРИДУ 1 2 3. Кристалічна структура за п. 1, яка відрізняється тим, що міансерину гідрохлорид в таблетках з кальцію дифосфатдигідратом має на 40-80 % в залежності від бреггівського кута меншу інтенсивність, ніж в субстанції. 4. Кристалічна структура за п. 1, яка відрізняється тим, що кальцію дифосфатдигідрат має наступну кристалічну структур у: 2Q 11,60 13,10 20,90 23,40 25,60 Q 5,80 6,55 10,45 11,70 12,80 d, Å 7,62843 6,75812 4,25026 3,80152 3,47960 І 4200 200 3120 320 80 I=I/I max*100 100,00 4,76 74,29 7,62 1,90 U І відн., % 1,38 100,00 1,38 0,98 33,18 8,76 0,92 0,92 0,92 41,94 12,90 1,84 2,30 14,29 1,84 6,45 24,90 7,83 6,91 2,76 1,38 2,30 1,84 2,76 5,53 2,76 8,29 4,15 22,90 2,30. (13) І 120 8680 120 40 2880 760 80 80 80 3640 1120 160 200 1240 160 560 200 680 600 240 120 200 160 240 480 240 720 360 160 200 D, Å 11,78691 9,30464 7,43678 5,86721 5,53915 4,69526 4,57299 4,28864 4,14991 3,89816 3,78361 3,64605 3,54593 3,41230 3,17381 3,07892 2,87565 2,79679 2,73851 2,32086 2,25396 1,98522 1,90279 1,86612 1,82070. 37553 d, Å 11,78691 7,62843 5,86721 4,67000 4,25000 3,80152 3,63328 3,35102 3,16442 3,04808 2,92148 2,84885 2,65186 2,61434 2,52179 2,42953 2,26483 2,16592 2,14626 2,09413 2,02299 2,00601 1,97297 1,89533 1,87333 1,85897 1,81731 1,80000 1,77767 1,70978 Q 3,75 4,75 5,95 7,55 8,00 9,45 9,70 10,35 10,70 11,40 11,75 12,20 12,55 13,05 14,05 14,50 15,55 16,00 16,35 19,40 20,00 22,85 23,90 24,40 25,05 (11) Q 3,75 5,80 7,55 8,50 10,45 11,70 12,25 13,30 14,10 14,65 15,30 15,70 16,90 17,15 17,80 18,50 19,90 20,85 21,05 21,60 22,40 22,60 23,00 24,00 24,30 24,50 25,10 25,40 25,70 26,80 2Q 7,5 9,5 11,90 15,10 16,00 18,90 19,40 20,70 21,40 22,80 23,50 24,40 25,10 26,10 28,10 29,00 31,10 32,00 32,70 38,80 40,00 45,70 47,80 48,80 50,10 UA 2Q 7,50 11,60 15,10 19,00 20,90 23,40 24,50 26,60 28,20 29,30 30,60 31,40 33,80 34,30 35,60 37,00 39,80 41,70 42,10 43,20 44,80 45,20 46,00 48,00 48,60 49,00 50,20 50,80 51,40 53,60 2. Кристалічна структура за п. 1, яка відрізняється тим, що міансерину гідрохлорид має наступну кристалічну стр уктуру: (19) (21) u200810742 (22) 28.08.2008 (24) 25.11.2008 (46) 25.11.2008, Бюл.№ 22, 2008 р. (72) ШТЕЙНГАРТ МАРК ВОЛЬФОВИЧ, U A, ПРИХОДЬКО РОМАН МИКОЛАЙОВИЧ, U A, ДУБІНА ОЛЕГ ВЯЧЕСЛАВОВИЧ, U A (73) ПРИХОДЬКО РОМАН МИКОЛАЙОВИЧ, UA, ДУБІНА ОЛЕГ ВЯЧЕСЛАВОВИЧ, U A (57) 1. Кристалічна структура лікарського препарату у формі таблеток на основі міансерину гідрохлориду: 26,40 28,50 29,30 30,50 31,30 32,50 32,80 34,30 35,80 37,10 39,10 39,60 13,20 14,25 14,65 15,25 15,65 16,25 16,40 17,15 17,90 18,55 19,55 19,80 3 3,37595 3,13179 3,04808 2,93083 2,85773 2,75490 2,73038 2,61434 2,50816 2,42321 2,30374 2,27580 37553 1600 120 3200 1360 200 400 360 1080 120 480 40 120 38,10 2,86 76,19 32,38 4,76 9,52 8,57 25,71 2,86 11,43 0,95 2,86 Корисна модель належить до галузі медицини, а саме, до психіатрії, де як антидепресивний препарат використовується міансерину гідрохлорид формули H3C N N H i енантіомер HCL Емпірична формула: С18Н21СlN2 Молекулярна маса: 300,8 Хімічна назва: (RS)-2-метил-1, 2, 3, 4, 10, 14bгексагідродибензо[с,f]пиразинол[1,2-a]азепину гідрохлорид Субстанція розчинна в 2-диметиленхлориді, повільно розчинна у воді та мало розчинна в спирті. Міансерину гідрохлорид являє собою кристалічний порошок білого або майже білого кольору. Микроскопія порошків різних виробників показує, що кристали можуть мати різну форму. Порошок фірми „HEUMANN PCS", Німеччина: складається з ізодіаметричних пластинок (квадратних, прямокутних). Розмір основної фракції 23мкм, причому є невелика кількість кристалів розміром до 40´50мкм. Кристали агреговані, агрегати та окремі кристали непрозорі. Порошок фірми „EUTICALS SPA", Італія: складається із основної фракції більшого розміру: 510мкм. У патенті [US №3,534,041, C07D 241/04,1970], запропоновано спосіб синтезу цієї субстанції під назвою GB-94. Детальні дослідження фармакологічних властивостей були приведені в [US №4,128,641, А61 К31/495, 1978]. Міансерину гідрохлорид - це антидепресивний препарат, який належить до групи піперазино-азепінових сполук і відрізняється від трициклічних антидепресантів (ТЦА). У хімічній структурі міансерину гідрохлориду відсутній боковий ланцюжок, характерний для ТЦА, який, як вважається, відповідає за їх антихолінергічну активність. Міансерину гідрохлорид підвищує центральну норадренергічну нейротрансмісію 40,10 41,20 42,00 43,30 44,60 45,40 47,80 48,50 49,20 50,20 50,80 20,05 20,60 21,00 21,65 22,30 22,70 23,90 24,25 24,60 25,10 25,40 2,24857 2,19104 2,15114 2,08953 2,03159 1,99764 1,90279 1,87695 1,85188 1,81731 1,79724 4 360 120 520 560 200 80 240 80 360 280 520 8,57 2,86 12,38 13,33 4,76 1,90 5,71 1,90 8,57 6,67 12,38. шляхом ауторецепторної блокади та пригнічення зворотного захоплення норадреналіну. Було також виявлено взаємодію препарату з серотоніновими рецепторами центральної нервової системи (ЦНС). Антидепресивний ефект подібний до ефекту інших сучасних антидепресантів. Більше того, препарат має анксіолітичну (протитривожну) дію, що важливо при лікуванні хворих на депресію у поєднанні з тривожністю. Седативний ефект міансерину гідрохлориду, пов'язаний з впливом його на альфа-1-адренорецептори і Н-1-гістамінові рецептори, дає можливість застосовувати його для лікування порушень сну в рамках депресії. Міансерину гідрохлорид добре переноситься пацієнтами, в тому числі людьми похилого віку та тими, хто має серцево-судинні захворювання. При застосуванні в терапевтичних дозах міансерину гідрохлорид практично не має антихолінергічної активності і, відповідно, впливу на серцевосудинну систему. При передозуванні він спричинює значно менше кардіотоксичних ефектів порівняно з ТЦА. Міансерину гідрохлорид не виявляє взаємодії з симпатоміметичними і гіпотензивними препаратами, дія яких пов'язана з впливом на бета-адренорецептори (наприклад, бетанідин) чи альфа-адренорецептори (наприклад, клонідин або метилдопа). Фармакокінетика. Після перорального прийому міансерину гідрохлорид швидко всмоктується. Максимальні концентрації міансерину гідрохлориду в плазмі досягаються через 3 години після прийому препарату. Його біодоступність становить 20%. З білками плазми міансерину гідрохлорид зв'язується приблизно на 95%. Період напіввиведення становить 21-61 год, тому застосовувати препарат достатньо один раз на добу. Стабільна концентрація міансерину гідрохлориду в плазмі досягається впродовж 6 діб його прийому. Міансерину гідрохлорид метаболізується і виділяється із сечею та фекаліями протягом 7-9 діб. Основними шляхами біотрансформації є деметилювання і окислення, з подальшою кон'югацією метаболітів. Для багатьох лікарських препаратів вважається за необхідне визначення кристалічної структури лікарської субстанції, особливо в тих випадках, коли можливе утворення різних поліморфних структур. Так, в патенті [UA №57089, А61Р 25/04, 2003] фірми MERCK визначають кристалічну стр уктуру при застосуванні похідних морфоліну або тіомор 5 37553 6 фоліну як лікарських речовин при лікуванні деяких 42,10 21,05 2,14626 600 6,91 психічних розладів. 43,20 21,60 2,09413 240 2,76 Відомо визначення кристалічної структури пе44,80 22,40 2,02299 120 1,38 ріндаприлу [UA 57187, А61К 45/00,2003]. 45,20 22,60 2,00601 200 2,30 Фармакопея США для карбамазепіну дозволяє 46,00 23,00 1,97297 160 1,84 використовува ти лише одну з 5 відомих полімор48,00 24,00 1,89533 240 2,76 фних форм [5 видання, 2005, с.341]. 48,60 24,30 1,87333 480 5,53 Найближчою до корисної моделі, що заявля49,00 24,50 1,85897 240 2,76 ється, є визначена кристалічна структура лікарсь50,20 25,10 1,81731 720 8,29 кої речовини в твердих лікарських формах, де во50,80 25,40 1,80000 360 4,15 на застосовується разом з іншими кристалічними 51,40 25,70 1,77767 160 22,90 допоміжними речовинами [UA 28988, C07D 209/42, 53,60 26,80 1,70978 200 2,30 2007]. Зазначена кристалічна структура визначена Міансерину гідрохлорид має наступну кристадля трет-бутиламінової солі періндоприлу. Крім лічну стр уктур у того, що це інша субстанція в іншій технологічній системі, доза цієї субстанції в лікарській формі D, Å 2Q Q дуже мала (1-4%), що знаходиться на грані меж 7,5 3,75 11,78691 можливості методу і не дає змоги встановити змі9,5 4,75 9,30464 ни кристалічної структури діючої і допоміжних ре11,90 5,95 7,43678 човин при виготовлені таблеток і відтворюваність 15,10 7,55 5,86721 структур у лікарській формі. 16,00 8,00 5,53915 Міансерину гідрохлорид має асиметричний 18,90 9,45 4,69526 атом вуглецю, тому може утворювати 2 оптичних 19,40 9,70 4,57299 ізомери, але в лікарському препараті застосову20,70 10,35 4,28864 ється їх рацемічна суміш. Міансерину гідрохлорид 21,40 10,70 4,14991 також входить до складу препарату Міансерин22,80 11,40 3,89816 Ратіофарм, який використовується за тими ж ме23,50 11,75 3,78361 дичними показниками, але має інший кількісний 24,40 12,20 3,64605 склад допоміжних речовин. Крім цих препаратів, 25,10 12,55 3,54593 він виготовляється в формі таблеток як генерич26,10 13,05 3,41230 ний препарат ще багатьма фірмами в різних краї28,10 14,05 3,17381 нах. Субстанція виготовляється в різних країнах і є 29,00 14,50 3,07892 рацемічною сумішшю двох енантіотропних форм, 31,10 15,55 2,87565 тому особливо необхідно при застосуванні в таб32,00 16,00 2,79679 летках визначення кристалічної структури, але 32,70 16,35 2,73851 сучасний стан рівня техніки в цьому питанні не має 38,80 19,40 2,32086 таких досліджень. 40,00 20,00 2,25396 В основу корисної моделі поставлено задачу 45,70 22,85 1,98522 визначення кристалічної структури лікарського 47,80 23,90 1,90279 препарату у формі таблеток на основі міансерину 48,80 24,40 1,86612 гідрохлориду для обґрунтуванню складу таблеток. 50,10 25,05 1,82070 Поставлену задачу вирішують визначенням кристалічної структури лікарського препарату у Міансерину гідрохлорид в таблетках з кальціформі таблеток на основі міансерину гідрохлориєм дифосфатдигідратом має на 40-80% в залежду: ності від брегівського кута меншу інтенсивність, ніж в субстанції. d, Å І Івідн % Кальцію дифосфатдигідрат має наступну кри2Q Q сталічну структур у 7,50 3,75 11,78691 120 1,38 11,60 5,80 7,62843 8680 100,00 d, Å І I=I/Imax*+*100 15,10 7,55 5,86721 120 1,38 2Q Q 19,00 8,50 4,67000 40 0,98 11,60 5,80 7,62843 4200 100,00 20,90 10,45 4,25000 2880 33,18 13,10 6,55 6,75812 200 4,76 23,40 11,70 3,80152 760 8,76 20,90 10,45 4,25026 3120 74,29 24,50 12,25 3,63328 80 0,92 23,40 11,70 3,80152 320 7,62 26,60 13,30 3,35102 80 0,92 25,60 12,80 3,47960 80 1,90 28,20 14,10 3,16442 80 0,92 26,40 13,20 3,37595 1600 38,10 29,30 14,65 3,04808 3640 41,94 28,50 14,25 3,13179 120 2,86 30,60 15,30 2,92148 1120 12,90 29,30 14,65 3,04808 3200 76,19 31,40 15,70 2,84885 160 1,84 30,50 15,25 2,93083 1360 32,38 33,80 16,90 2,65186 200 2,30 31,30 15,65 2,85773 200 4,76 34,30 17,15 2,61434 1240 14,29 32,50 16,25 2,75490 400 9,52 35,60 17,80 2,52179 160 1,84 32,80 16,40 2,73038 360 8,57 37,00 18,50 2,42953 560 6,45 34,30 17,15 2,61434 1080 25,71 39,80 19,90 2,26483 200 24,90 35,80 17,90 2,50816 120 2,86 41,70 20,85 2,16592 680 7,83 37,10 18,55 2,42321 480 11,43 39,10 39,60 40,10 41,20 42,00 43,30 44,60 45,40 47,80 48,50 49,20 50,20 50,80 19,55 19,80 20,05 20,60 21,00 21,65 22,30 22,70 23,90 24,25 24,60 25,10 25,40 7 2,30374 2,27580 2,24857 2,19104 2,15114 2,08953 2,03159 1,99764 1,90279 1,87695 1,85188 1,81731 1,79724 37553 40 120 360 120 520 560 200 80 240 80 360 280 520 0,95 2,86 8,57 2,86 12,38 13,33 4,76 1,90 5,71 1,90 8,57 6,67 12,38 Визначення в стр уктурі показників, які відтворюються в лікарській формі незмінними, дали змогу встановити, з якої кристалічної субстанції виготовлені таблетки, а також можливу зміну структури під час проведення технологічних операцій. Рішення цієї задачі дозволило забезпечити відтворюваність застосованої лікарської субстанції за показниками, які залишаються за межами аналітичних сертифікатів, але впливають на відтворюваність технології. Додатково це дозволяє запобігти можливостям фальсифікації. Було проведено рентгеноструктурне дослідження субстанцій міансерину гідрохлориду, які виготовляються фірмами „EUTICALS SPA", Італія і „HEUMANN PCS", Німеччина в наступних умовах: дифрактометр ДРОН 3, дисцинтиляційний детектор, мідний антикатод l=1,5405Å, напруга 40кВ, сила струму 40мА, розміщення Q-Q, діапазон вимірювань 5-40° при безперервній реєстрації на папері з уточненням положення шляхом точкової реєстрації з часом вимірювання на етапі 10с, з приростом перед кожним вимірюванням 0,02° та графітовим монохроматором на відбитому промені. В таблицях 1 і 2 наведені дифрактограми порошків цих субстанцій, які були запресовані без допоміжних речовин при тиску 20кПа Таблиця 1 Міансерину гідрохлорид, „Euticals", Італія 7,50 9,50 11,90 14,10 15,10 15,90 18,90 19,40 20,70 21,40 22,80 23,50 24,40 25,10 26,10 28,00 29,00 29,70 30,40 31,10 3,75 4,75 5,95 7,05 7,55 7,95 9,45 9,70 10,35 10,70 11,40 11,75 12,20 12,55 13,05 14,00 14,50 14,85 15,20 15,55 11,79 9,30 7,44 6,28 5,87 5,57 4,70 4,58 4,29 4,15 3,90 3,79 3,65 3,55 3,41 3,19 3,08 3,01 2,94 2,88 3280,00 1240,00 2920,00 320,00 2240,00 1640,00 2680,00 2560,00 2560,00 2760,00 720,00 2680,00 2200,00 2720,00 960,00 1360,00 600,00 520,00 1240,00 960,00 100,00 37,80 89,02 9,76 68,29 50,00 81,71 78,05 78,05 84,15 21,95 81,71 67,07 82,93 29,27 41,46 18,29 15,85 37,80 29,27 8 32,00 32,70 33,80 34,80 36,20 37,50 38,30 39,30 40,00 41,70 42,60 43,70 45,50 47,50 48,80 50,10 16,00 16,35 16,90 17,40 18,10 18,75 19,15 19,65 20,00 20,85 21,30 21,85 22,75 23,75 24,40 25,05 2,80 2,74 2,65 2,58 2,48 2,40 2,35 2,29 2,25 2,17 2,12 2,07 1,99 1,91 1,87 1,82 600,00 360,00 120,00 280,00 240,00 240,00 240,00 280,00 400,00 80,00 160,00 280,00 240,00 320,00 160,00 280,00 18,29 10,98 3,66 8,54 7,32 7,32 7,32 8,54 12,20 2,44 4,88 8,54 7,32 9,76 4,88 8,54 Таблиця 2 Міансерину гідрохлорид, „Heumann PCS", Німеччина Міансерину гідрохлорид Heumann Io=I/Imax* d, Å І 2Q Q *100 7,5 3,75 11,78691 16800 100,00 9,50 4,75 9,30464 2480 14,76 11,90 5,95 7,43678 1600 9,52 14,10 7,05 6,28099 360 2,14 15,10 7,55 5,86721 12240 72,86 16,00 8,00 5,53915 1000 5,95 18,90 9,45 4,69526 1840 10,95 19,40 9,70 4,57299 1840 10,95 20,70 10,35 4,28864 1360 8,10 21,40 10,70 4,14991 1480 8,81 22,80 11,40 3,89816 4560 27,14 23,50 11,75 3,78361 5000 29,76 24,40 12,20 3,64605 1280 7,62 25,10 12,55 3,54593 1720 10,24 26,10 13,05 3,41230 640 3,81 28,10 14,05 3,17381 920 5,48 28,60 14,30 3,11945 480 2,86 29,00 14,50 3,07892 1040 6,19 29,70 14,85 3,00637 360 2,14 30,40 15,20 2,94025 5280 31,43 31,10 15,55 2,87565 1800 10,71 32,00 16,00 2,79679 360 2,14 32,70 16,35 2,73851 280 1,67 34,80 17,40 2,57791 200 1,19 35,50 17,75 2,52867 160 0,95 36,20 18,10 2,48136 280 1,67 37,50 13,15 3,38856 450 2,68 38,30 19,15 2,35000 1200 7,14 38,80 19,40 2,32086 630 3,75 39,30 19,65 2,29248 360 2,14 40,00 20,00 2,25396 560 3,33 41,70 20,85 2,16592 80 0,48 42,60 21,30 2,12222 200 1,19 43,70 21,85 2,07132 280 1,67 45,70 22,85 1,98522 360 2,14 46,50 23,25 1,95291 160 0,95 47,80 23,90 1,90279 360 2,14 48,80 24,40 1,86612 120 0,71 50,10 25,05 1,82070 760 4,52 9 37553 10 Порошки мають майже однакові міжплощинні дифрактограми трет-бутиламінової солі періндопвідстані в кристалічних структурах, тобто мають рилу. одну кристалічну форму, але для деяких міжплоВизначення кристалічної структури таблеток, щинних відстаней (тобто для деяких брегівських що знаходяться в ринковому обігу, дозволяють кутів) мають дуже значну різницю в показнику інобґрунтувати склад таблеток, який би вирішив не тенсивності і відносної інтенсивності, ніяк не обутільки технологічне розв'язання тих недоліків, які мовлену умовами експерименту. Цей специфічний мають сучасні таблетовані препарати міансерину для міансерину гідрохлориду ефект є наслідком гідрохлориду, а також встановити зміни кристалічтого, що міансерину гідрохлорид є сумішшю двох ної структури діючої і допоміжних речовин і відтвоенантіотропів. рюваність структур при виготовлені таблеток. Таким чином кристалічна структура міансериСтруктурні дослідження особливо важливі для ну гідрохлориду має такі найбільш істотні показниміансерину гідрохлориду, тому що він є сумішшю ки або може бути одним із енантіомерів, і можливі перевтілення енантіотропних форм. Ці результати Таблиця 3 не можуть бути прогнозовані апріорі. До складу таблеток Леривон, Міансеринd, Å Ратіофарм та інших генеричних препаратів вхо2Q Q дять: міансерину гідрохлорид -10-20%, кальцію 607,5 3,75 11,78691 75%, та аморфні допоміжні речовини - крохмаль, 9,5 4,75 9,30464 метилцелюлоза, аеросил, магнію стеарат - в суку11,90 5,95 7,43678 пності до 100% В патенті [USA 5441747 Р de Haas 15,10 7,55 5,86721 et al 15 aug.1995 424/465, A61K09/16, A61K09/20, 16,00 8,00 5,53915 A61K009/20] доведено, що використання кальцію 18,90 9,45 4,69526 дифосфатдигідрату стабілізує хлористоводневу 19,40 9,70 4,57299 сіль міансерину, яка може під час виготовлення та 20,70 10,35 4,28864 зберігання таблетки під дією вологи змінювати 21,40 10,70 4,14991 колір. 22,80 11,40 3,89816 При вирішенні цих завдань необхідно встано23,50 11,75 3,78361 вити, який з багатьох сортів кальцію дифосфатди24,40 12,20 3,64605 гідрату використовується в таблетках В таблицях 25,10 12,55 3,54593 4 і 5 показані дифрактограми двох сортів цієї до26,10 13,05 3,41230 поміжної речовини, які частіш за все використову28,10 14,05 3,17381 ються в промисловому виробництві таблеток. 29,00 14,50 3,07892 31,10 15,55 2,87565 Таблиця 4 32,00 16,00 2,79679 32,70 16,35 2,73851 кальцію дифосфатдигідрат DI-CAFOS PF С 9238,80 19,40 2,32086 40,00 20,00 2,25396 02 45,70 22,85 1,98522 I=I/Imax* d, Å І 2Q Q 47,80 23,90 1,90279 *100 48,80 24,40 1,86612 11,60 5,80 7,62843 4200 100,00 50,10 25,05 1,82070 13,10 6,55 6,75812 200 4,76 20,90 10,45 4,25026 3120 74,29 Визначення структури таблеток може бути ви23,40 11,70 3,80152 320 7,62 рішено порівняльним аналізом дифрактограм усіх 25,60 12,80 3,47960 80 1,90 кристалічних компонентів, які входять до складу 26,40 13,20 3,37595 1600 38,10 таблеток з міансерину гідрохлоридом з дифракто28,50 14,25 3,13179 120 2,86 грамами цих таблеток. Результати аналізу не мо29,30 14,65 3,04808 3200 76,19 жуть бути передбачені ані спеціалістами з фарма30,50 15,25 2,93083 1360 32,38 цевтичної те хнології, ані спеціалістами з 31,30 15,65 2,85773 200 4,76 рентгеноструктурного аналізу тому, що склад таб32,50 16,25 2,75490 400 9,52 летки утворює єдиний, емпірично складений ком32,80 16,40 2,73038 360 8,57 плекс кристалічної лікарської субстанції з криста34,30 17,15 2,61434 1080 25,71 лічними і аморфними допоміжними речовинами, 35,80 17,90 2,50816 120 2,86 який в сукупності, за умов технологічної перероб37,10 18,55 2,42321 480 11,43 ки, забезпечує ви щевказану фармакологічну дію. В 39,10 19,55 2,30374 40 0,95 цій багатокомпонентній системі можуть виникати 39,60 19,80 2,27580 120 2,86 нові фазові перевтілення, бо навіть в чистих суб40,10 20,05 2,24857 360 8,57 станціях різних виробників, як видно з таблиць 1 41,20 20,60 2,19104 120 2,86 та 2, при однаковій кристалічній формі є різниця в 42,00 21,00 2,15114 520 12,38 інтенсивності відтворення рентгенівського випро43,30 21,65 2,08953 560 13,33 мінювання на різних брегівських кута х. До цього 44,60 22,30 2,03159 200 4,76 часу таких дослідів в фармацевтичній технології 45,40 22,70 1,99764 80 1,90 майже не проводилось, за виключенням патенту 47,80 23,90 1,90279 240 5,71 [UA 28988 (прототип)], в якому досліджувались 48,50 24,25 1,87695 80 1,90 49,20 24,60 1,85188 360 8,57 50,20 50,80 25,10 25,40 11 1,81731 1,79724 37553 280 520 6,67 12,38 32,90 34,90 35,50 36,10 38,30 39,20 40,20 41,10 41,90 42,80 43,20 43,80 44,70 45,70 46,50 47,50 48,80 49,30 Таблиця 5 Кальцію дифосфатдигідрат DI-C AFOS С 92-14 2Q Q d, Å I=n*400 13,20 17,90 20,30 20,90 22,20 24,30 25,70 26,60 27,10 28,70 30,30 31,20 32,60 6,60 8,95 10,15 10,45 11,10 12,15 12,85 13,30 13,55 14,35 15,15 15,60 16,30 6,70715 4,95525 4,37450 4,25026 4,00422 3,66273 3,46629 3,35102 3,29032 3,11042 2,94972 2,86666 2,74668 280 80 20 40 60 80 240 3680 280 440 2840 240 1000 I=I/Imax* *100 7,61 2,17 0,54 1,09 1,63 2,17 6,52 100,00 7,61 11,96 77,17 6,52 27,17 16,45 17,45 17,75 18,05 19,15 19,60 20,10 20,55 20,95 21,40 21,60 21,90 22,35 22,85 23,25 23,75 24,40 24,65 12 2,72231 2,57075 2,52867 2,48801 2,35000 2,29810 2,24321 2,19614 2,15605 2,11277 2,09413 2,06683 2,02728 1,98522 1,95291 1,91411 1,86612 1,84835 1080 40 80 600 60 240 680 440 320 200 160 120 140 200 40 440 160 680 29,35 1,09 2,17 16,30 1,63 6,52 18,48 11,96 8,70 5,43 4,35 3,26 3,80 5,43 1,09 11,96 4,35 18,48 В таблицях 6 та 7 приведені дифрактограми Лерівону та Міансерину-Ратіофарм Таблиця 6 Лерівон 6,75 4,93 100,00 0,83 1,25 0,78 1,25 1,35 39,48 7,5 9,5 11,70 15,10 16,30 18,00 18,80 19,40 20,80 3,75 4,75 5,85 7,55 8,15 9,00 9,40 9,70 10,40 11,7869 9,30464 7,56345 5,86710 5,43330 4,92795 4,71990 4,57530 4,27046 520 380 7700 64 96 60 96 104 3040 23,60 11,80 3,76976 640 8,31 24,20 24,80 25,50 29,40 30,60 31,40 32,40 34,30 37,10 12,10 12,40 12,75 14,70 15,30 15,70 16,20 17,15 18,55 3,67764 3,59000 3,49302 3,03794 2,92148 2,84885 2,76317 2,61434 2,42321 40 40 280 3480 1280 170 40 1440 680 0,52 0,52 3,64 45,19 16,62 2,21 0,52 18,70 8,83 37,80 18,90 2,37993 60 0,78 39,70 19,85 2,27030 800 10,39 41,60 42,20 20,80 21,10 2,17090 2,14141 584 600 7,58 7,79 43,20 21,60 2,09413 240 3,12 45,40 22,70 1,99764 400 5,19 46,10 23,05 1,96892 160 2,08 48,10 48,70 49,20 50,30 50,80 24,05 24,35 13,15 25,15 25,40 1,89162 1,86971 3,38856 1,81393 1,79724 320 500 280 720 216 4,16 6,49 3,64 9,35 2,81 Міансерину гідрохлорид Міансерину гідрохлорид Міансерин+дифосфат Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію сфатдигідрат Міансерину гідрохлорид Міансерину гідрохлорид Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Міансерин+дифосфат Кальцію дифосфат Кальцію дифосфат Міансерину гідрохлорид + кальцію сфатдигідрат Міансерину гідрохлорид + кальцію сфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію сфатдигідрат Міансерину гідрохлорид + кальцію сфатдигідрат Міансерину гідрохлорид + кальцію сфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат дифо дифодифо дифодифодифо 13 37553 14 Таблиця 7 Міансерину гідрохлорид –ратиофарм 2Q 7,60 9,50 11,70 Q 3,80 4,75 5,85 d, Å 11,63204 9,30464 7,56345 І 152 104 9400 1,62 1,08 100 15,10 16,20 18,10 18,80 19,50 20,90 23,50 7,50 8,00 9,05 9,40 9,75 10,45 11,75 5,90610 5,53915 4,90095 4,72001 4,55213 4,25026 3,78557 120 112 60 190 150 3320 800 1,28 1,19 0,64 2,02 1,60 35,32 8,51 24,40 25,10 26,40 12,20 12,55 13,20 3,64794 3,54777 3,37595 120 100 80 1,28 1,06 0,85 28,20 14,10 3,16442 160 1,70 29,50 30,50 31,40 34,30 37,10 39,70 41,60 42,20 43,30 14,75 15,25 15,70 17,15 18,55 19,85 20,80 21,10 21,65 3,02787 2,93083 2,84885 2,61434 2,42321 2,27030 2,17090 2,14141 2,08953 3800 1640 300 3160 1200 160 640 720 240 40,43 17,45 3,19 33,62 12,77 1,70 6,81 7,66 2,55 45,30 22,65 2,00182 120 1,28 48,10 48,50 49,10 50,20 50,80 53,50 24,05 24,25 24,55 25,10 25,40 26,75 1,98162 1,87695 1,85541 1,81731 1,79724 1,71274 280 450 280 840 320 160 2,98 4,79 2,98 8,94 3,40 1,70 З порівняння результатів в таблицях 4-7 можна зробити висновок, що в цих лікарських препаратах застосовується кальцію дифосфатдигідрат DI-CAFOS PF С 92-02. Порівняння даних таблиць 1, 2 з таблицями 6 і 7 показує, що інтенсивність ліній міансерину гідрохлориду в таблетках значно менша, ніж в самій субстанції в перерахунку на кількісний зміст його в таблетках. По даних таблиць 6 і 7 в таблетках самостійно проявляються такі міжплощинні відстані міансерину гідрохлориду: Таблиця 8 2Q 7,50 9,50 15,10 16,20 d, Å 11,7869 9,30464 5,8671 5,53915 Іо=І/Іmах*100 Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид Кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Міансерин+дифосфат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Міансерину гідрохлорид + кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат Кальцію дифосфатдигідрат 18,80 19,40 24,40 25,10 4,72001 4,5753 3,6479 3,5478 Для тих, міжплощинних відстаней міансерину гідрохлориду, які накладаються на структури кальцію дифосфатдигідрату також спостерігається значне зменшення інтенсивності, ніж це можна очікувати теоретично, виходячи з правила адитивності. Для того, щоб визначити вплив кристалічних наповнювачів іншої хімічної структури досліджено в ти х же самих умовах таблетки міансерину гідрохлориду, виго товлені за патентом [US №4,128,641, А61К31/495, 1978], в якому пропонувався склад таблеток з використанням як допоміжної речовини - молочного цукру - лактози. Ці дані наведені в таблиці 9. 15 37553 16 Таблиця 9 2Q 7,50 9,40 11,90 12,60 14,00 15,10 16,40 17,10 19,10 19,60 20,00 20,80 21,20 22,80 23,80 24,50 25,10 25,70 26,20 27,50 28,10 28,70 30,50 31,10 31,70 33,20 34,80 36,20 36,90 37,70 38,20 39,50 39,90 40,70 41,90 42,50 43,10 44,20 45,20 45,80 47,40 47,90 Міансерину гідрохлорид з лактозою, г d, Å І Io=I/Imax*100 Q 3,75 11,78079 1160 4,62 4,70 9,40340 2000 7,96 5,95 7,43292 760 3,03 6,30 7,02151 2920 11,62 7,00 6,32235 160 0,64 7,55 5,86417 1200 4,78 8,20 5,40213 2320 9,24 8,55 5,18254 680 2,71 9,55 4,64414 7840 31,21 9,80 4,52678 9280 36,94 10,00 4,44000 25120 100,00 10,40 4,26825 2720 10,83 10,60 4,18861 4680 18,63 11,40 3,89816 1520 6,05 11,90 3,73659 1920 7,64 12,25 3,63139 480 1,91 12,55 3,54593 960 3,82 12,85 3,46449 1640 6,53 13,10 3,39950 800 3,18 13,75 3,24168 680 2,71 14,05 3,17381 720 2,87 14,35 3,10881 1720 6,85 15,25 2,92931 320 1,27 15,55 2,87415 720 2,87 15,85 2,82111 520 2,07 16,60 2,69700 400 1,59 17,40 2,57657 960 3,82 18,10 2,48007 1200 4,78 18,45 2,43462 1280 5,10 18,85 2,38477 2480 9,87 19,10 2,35470 1520 6,05 19,75 2,28015 560 2,23 19,95 2,25821 1000 3,98 20,35 2,21565 560 2,23 20,95 2,15493 240 0,96 21,25 2,12588 280 1,11 21,55 2,09767 440 1,75 22,10 2,04798 200 0,80 22,60 2,00497 200 0,80 22,90 1,98009 280 1,11 23,70 1,91692 360 1,43 23,95 1,89807 320 1,27 Міансерину гідрохлорид Міансерину гідрохлорид Міансерину гідрохлорид +лактоза Тальк Міансерину гідрохлорид+лактоза Міансерину гідрохлорид Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза лактоза Міансерину гідрохлорид+лактоза Міансерину гідрохлорид Міансерину гідрохлорид+лактоза Міансерину гідрохлорид+лактоза лактоза лактоза лактоза лактоза лактоза лактоза лактоза лактоза Міансерину гідрохлорид+лактоза лактоза Міансерину гідрохлорид+лактоза лактоза лактоза лактоза лактоза лактоза лактоза лактоза Лактоза в цьому препараті має наступну структур у Таблиця 10 Кут 2Q° Кут Q° 8,0 11,8 12,50 16,30 17,0 19,0 19,5 19,9 20,7 21,1 22,8 23,8 4,0 5,90 6,25 8,15 8,50 9,5 9,75 9,95 10,35 10,55 11,4 11,90 Міжплощинна відстань d, Å 11,05 7,50 7,08 5,43 5,21 4,67 4,55 4,46 4,29 4,21 3,90 3,74 Відносна інтенсивність, % 0,3 1,0 14,2 10,8 2,4 42,2 51,4 100 13,9 24,3 6,8 9,1 17 37553 18 Продовження таблиці 10 Кут 2Q° Кут Q° 25,0 25,50 26,1 27,3 28,2 28,9 30,2 31,0 31,6 33,1 34,5 34,8 35,5 36,1 36,8 37,5 38,1 38,5 39,3 39,9 40,6 41,8 42,3 43,0 44,1 45,7 47,2 47,9 48,8 49,5 50,2 51,8 12,50 12,75 13,05 13,65 14,10 14,45 15,1 15,5 15,80 16,55 17,25 17,40 17,75 18,05 18,40 18,75 19,05 19,25 19,65 19,95 20,3 20,9 21,15 21,5 22,05 22,85 23,60 23,95 24,40 24,75 25,10 25,90 Міжплощинна відстань d, Å 3,56 3,49 3,41 3,27 3,16 3,09 2,96 2,88 2,83 2,71 2,60 2,58 2,53 2,49 2,44 2,40 2,36 2,34 2,29 2,26 2,22 2,16 2,14 2,10 2,05 1,98 1,93 1,90 1,87 1,84 1,82 1,76 Порівняння результатів інтенсивності відтворення рентгенівського випромінювання міансерину гідрохлориду на різних міжплощинних відстанях в таблицях 6, 7 і 9 показує, що в таблетках з кальцієм дифосфатдигідратом спостерігається значне зниження інтенсивності, чого немає в таблетках з лактозою. Лише при запису дифрактограм табле Комп’ютерна в ерстка А. Крижанівський Відносна інтенсивність, % 3,4 7,8 4,0 5,4 4,0 1,0 1,0 3,7 3,0 2,7 5,7 5,4 3,0 4,7 7,8 14,2 9,1 5,4 3,0 5,1 3,4 1,7 2,7 3,4 2,7 2,0 2,0 3,0 1,0 1,7 3,0 1,7 ток міансерину гідрохлориду в режимі чутливості 2*103 можливе визначення присутності міансерину гідрохлориду в таблетках і їх кількісний склад. Якщо цей склад розраховувати по значеннях адитивності інтенсивності, то він становить не більше 50% істинного змісту. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline structure of drug in form of tablets based on mianserine hydrochloride
Автори англійськоюShteinhart Mark Volfovych, Prykhodko Roman Mykolaiovych, Dubyna Oleh Viacheslavovych
Назва патенту російськоюКристаллическая структура лекарственного препарата в форме таблеток на основе миансерина гидрохлорида
Автори російськоюШтейнгарт Марк Вольфович, Приходько Роман Николаевич, Дубина Олег Вячеславович
МПК / Мітки
МПК: A61K 9/20
Мітки: кристалічна, форми, таблеток, міансерину, структура, основі, препарату, гідрохлориду, лікарського
Код посилання
<a href="https://ua.patents.su/9-37553-kristalichna-struktura-likarskogo-preparatu-u-formi-tabletok-na-osnovi-mianserinu-gidrokhloridu.html" target="_blank" rel="follow" title="База патентів України">Кристалічна структура лікарського препарату у формі таблеток на основі міансерину гідрохлориду</a>