Стероїди із фторованим 17a-алкільним ланцюгом, які мають антигестагенну дію, та фармацевтична композиція
Номер патенту: 66783
Опубліковано: 15.06.2004
Автори: Шнейдер Мартін, Неєф Гюнтер, ШВЕДЕ Вольфганг, Фурманн Ульрік, Хесс-Стумпп Хьольгер, Клар Ульріх, Клеве Арвед, Шваліц Крістоф
Формула / Реферат
1.17α- фторалкільні стероїди загальної формули І
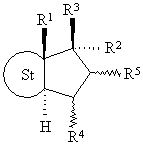 , (I)
, (I)
у якій R1 являє собою метильну або етильну групу,
R2 являє собою залишок формули CnFmHo, де n дорівнює 2, 3, 4, 5 або 6, m > 1 і m+o = 2n+1,
R3 являє собою вільну, етерифіковану або естерифіковану гідроксильну групу,
R4 і R5 кожний означає атом водню, а обидва разом утворюють додатковий зв'язок або являють собою метиленову групу,
St означає стероїдну циклічну систему АВС часткової формули А, В або С
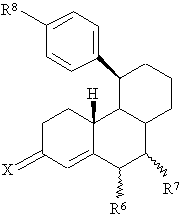 , (A)
, (A)
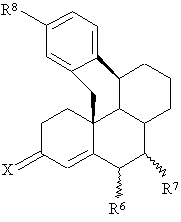 , (B)
, (B)
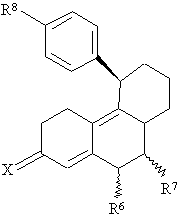 , (C)
, (C)
де
R6 являє собою атом водню, прямоланцюгову С1-С4- або розгалужену С3-С4алкільну групу або атом галогену,
R7 являє собою атом водню, прямоланцюгову С1-С4- або розгалужену С3-С4алкільну групу, або, якщо St означає стероїдну циклічну систему АВС часткової формули А або В, то R6 і R7 обидва разом, крім того, утворюють додатковий зв’язок,
Х означає атом кисню, гідроксііміногрупу =N~OH або два атоми водню,
R8 являє собою залишок Y або необов'язково багаторазово заміщений групою Y арильний залишок, де Y означає атом водню, атом галогену, -ОН, -NO2, -N3, -CN, -NR9aR9b, -NHSO2R9, -CO2R9 , С1-С10алкільну, С1-С10алкокси-, С1-С10алканоїлокси-, бензоїлокси-, С1-С10алканоїльну, С1-С10гідроксіалкільну або бензоїльну групу, a R9a і R9b є ідентичними або різними й аналогічно R9 означають атом водню або С1-С10алкільну групу,
і у випадку залишків -NR9aR9b також їх фізіологічно прийнятної солі з кислотами, а у випадку залишків –CO2R9 при R9, що означає атом водню, а також їх фізіологічно прийнятної солі з основами.
2. 17α - фторалкільні стероїди за п. 1, де St означає стероїдну циклічну систему часткової формули А.
3. 17α - фторалкільні стероїди за п. 1, де St означає стероїдну циклічну систему часткової формули В.
4. 17α - фторалкільні стероїди за п. 1, де St означає стероїдну циклічну систему часткової формули С.
5. 17α - фторалкільні стероїди за п. 1, де n дорівнює 2, 3 або 4.
6. 17α - фторалкільні стероїди за п. 5, де о дорівнює 0.
7. 17α - фторалкільні стероїди за п. 6, де n дорівнює 2.
8. 17α - фторалкільні стероїди за п. 1, де R3 являє собою вільну гідроксильну групу.
9. 17α - фторалкільні стероїди за п. 1, де R8 являє собою один із залишків Y.
10. 17α - фторалкільні стероїди за п. 9, де Y являє собою С1-С10ацильну групу.
11. 17α - фторалкільні стероїди за п. 10, де Y являє собою формільну, ацетильну або пропіонільну групу.
12. 17α - фторалкільні стероїди за п. 9, де Y являє собою С1-С10гідроксіалкільну групу.
13. 17α - фторалкільні стероїди за п. 12, де Y являє собою гідроксиметильну або 1-гідроксіетильну групу.
14. 17α - фторалкільні стероїди за п. 9, де Y являє собою гідроксильну групу.
15. 17α - фторалкільні стероїди за п. 9, де Y являє собою ацетилоксигрупу.
16. 17α - фторалкільні стероїди за п. 9, де Y являє собою метоксикарбонільну групу.
17. 17α - фторалкільні стероїди за п. 1, де R8 являє собою заміщений групою Y арильний залишок.
18. 17α - фторалкільні стероїди за п. 17, де арильний залишок являє собою феніл, нафталініл, фураніл, бензофураніл, тієніл або піридиніл.
19. 17α - фторалкільні стероїди за п. 18, де R8 являє собою 4-ціанфенільний залишок.
20. 17α - фторалкільні стероїди за п. 18, де R8 являє собою 4-галогенфенільний залишок.
21. 17α - фторалкільні стероїди за п. 20, де R8 являє собою 4-фторфенільний залишок.
22. 17α - фторалкільні стероїди за п. 1, де R4 і R5 кожний являє собою атом водню.
23. 17α - фторалкільні стероїди за п. 1, де R4 і R5 обидва разом утворюють додатковий зв'язок.
24. 17α - фторалкільні стероїди за п. 1, де R6 і R7 кожний являє собою атом водню.
25. 17α - фторалкільні стероїди за п. 1, які вибрано з групи:
11β-(4-ацетилфеніл)-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он;
4'-[17β-гідрокси-3-оксо-17α-(1,1,2,2,2-пентафторетил)естр-4-ен-11β-іл][1,1'-біфеніл]-4-карбонітрил;
11β-(4'-фтор[1,1'-біфеніл]-4-іл)-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он;
17β-гідрокси-17α -(1,1,2,2,2-пентафторетил)-11β-[4-(3-піридиніл)феніл]естр-4-ен-3-он;
11β-(4-ацетилфеніл)-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)естра-4,15-дієн-3-он;
4'-[17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)естра-4,15-дієн-11β-іл][1,1'-біфеніл]-4-карбонітрил;
11β-(4'-фтор[1,1'-біфеніл]-4-іл)-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)естра-4,15-дієн-3-он;
17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)-11β-[4-(3-піридиніл)феніл]естра-4,15-дієн-3-он;
11β-(4-ацетилфеніл)-17β-гідрокси-17α-( 1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он;
4'-[17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-11β-іл][1,1'-біфеніл]-4-карбонітрил;
11β-(4'-фтор[1,1'-біфеніл]-4-іл)-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он;
17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)-11β-[4-(3-піридиніл)феніл]естра-4,9-дієн-3-он;
11β-(4-ацетилфеніл)-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)естра-4,9,15-триєн-3-он;
4'-[17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)естра-4,9,15-триєн-11β-іл][1,1'-біфеніл]-4-карбонітрил;
11β-(4'-фтор[1,1'-біфеніл]-4-іл)-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)естра-4,9,15-триєн-3-он;
17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)-11β-[4-(3-піридиніл)феніл]естра-4,9,15-триєн-3-он;
6'-ацетил-9,11α-дигідро-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естр-4-ен-3-он;
4-[9,11α-дигідро-17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естр-4-ен-6'-іл]бензонітрил;
9,11α-дигідро-6'-(4-фторфеніл)-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естр-4-ен-3-он;
9,11α-дигідро-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)-6'-(3-піридиніл)-4'Н-нафт[3',2',1':10,9,11]ecтp-4-eн-3-oн;
6'-ацетил-9,11α-дигідро-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]ecтpа-4,15-дiєн-3-oн;
4-[9,11α-дигідро-17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естра-4,15-дієн-6'-іл]бензонітрил;
9,11α-дигідро-6'-(4-фторфеніл)-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естра-4,15-дієн-3-он;
9,11α-дигідро-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)-6'-(3-піридиніл)-4'Н-нафт[3',2',1':10,9,11]естра-4,15-дієн-3-он;
17β-гідрокси-11β-(4-гідроксифеніл)-17α-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он;
17β-гідрокси-11β-(4-гідроксифеніл)-17α-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он;
9,11α-дигідро-6'-17β-дигідрокси-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естр-4-ен-3-он;
11β-[4-(ацетилокси)феніл]-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он;
11β-[4-(ацетилокси)феніл]-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он;
6'-(ацетилокси)-9,11α-дигідро-17β-гідрокси-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]ecтp-4-eн-3-oн;
17β-гідрокси-11β-[4-(гідроксиметил)феніл]-17α-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он;
17β-гідрокси-11β-[4-(гідроксиметил)феніл]-17α-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он;
9,11α-дигідро-17β-гідрокси-6'-(гідроксиметил)-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]ecтp-4-eн-3-oн;
4-[17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-11β-іл]бензальдегід;
4-[17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)естр-4-ен-11β-іл]бензальдегід;
9,11α-дигідро-17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естр-4-ен-6'-ал;
метиловий ефір 4-[17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-11β-іл] бензойної кислоти;
метиловий ефір 4-[17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)естр-4-ен-11β-іл] бензойної кислоти;
метиловий ефір 9,11α-дигідро-17β-гідроксі-3-оксо-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естр-4-ен-6'-карбонової кислоти;
17β-гідрокси-11β-[4-(1-гідроксіетил)феніл]-17α-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он;
17β-гідрокси-11β-[4-(1-гідроксіетил)феніл]-17α-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он;
9,11α-дигідро-17β-гідрокси-6'-(1-гідроксіетил)-17α-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естр-4-ен-3-он.
26. Фармацевтичний препарат, який містить принаймні один 17α-фторалкільний стероїд загальної формули І за п. 1 і один фармацевтично прийнятний носій.
27. Фармацевтичний препарат за п. 26, який містить додатково принаймні одну сполуку з антиестрогенною дією.
28. 17α-фторалкільний стероїд загальної формули І за п. 1, що застосовують для виготовлення лікарських засобів.
29. 17α-фторалкільний стероїд загальної формули І за п. 28, що застосовують у поєднанні зі сполукою з антиестрогенною дією.
Текст
Даний винахід належить до стероїдів із фторованим 17a-алкільним ланцюгом, які мають антигестагенну дію. Він стосується способу одержання цих стероїдів, фармацевтичних препаратів, що їх містять, а також стосується їхнього використання для виготовлення лікарських засобів. Об'єктом винаходу є 17a-фторалкільні стероїди загальної формули І у якої R1 являє собою метальну або етильну групу, R2 являє собою залишок формули CnFmHo, де n дорівнює 2, 3, 4, 5 або 6, m>1 і m+0=2n+1, R3 являє собою вільну, егерифіковану або естерифіковану гідроксильну групу, R4 і R5 кожний позначає атом водню, а обидва разом утворюють додатковий зв'язок або являють собою метиленову групу, St позначає стероїдну циклічну систему ABC часткової формули А, В або С де R6 являє собою атом водню, прямоланцюгову С1-С4- або розгалужену С3-С4алкільну групу або атом галогену, R7 являє собою атом водню, прямоланцюгову С1-С4- або розгалужену С3-С4алкільну групу, або, якщо St позначає стероїдну циклічну систему ABC часткової формули А або В, то R6 і R7 обидва разом, крім того, утворюють додатковий зв'язок, X позначає атом кисню, гідроксііміноугруповання =N~OH або два атоми водню, R8 являє собою залишок Υ або необов'язково багаторазово заміщений групою Υ арильний залишок, де Υ позначає атом водню, атом галогену, -ОН, -NO2, -N3, -CN, -NR9aR9b, -NHSO2R9, -CO2R9, С1-С10алкільну, С1С10алкокси-, С1-С10алканоїлокси-, бензоїлокси-, С1-С10алканоїльну, С1-С10гідроксіалкільну або бензоїльну групу, a R9a і R9b є ідентичними або різними й аналогічно R9 позначають атом водню або С1-С10алкільну групу, і у випадку залишків -ΝR9аR9b належить також до їхніх фізіологічно прийнятних солей із кислотами, а у випадку залишків -CО2R9 при R9, що позначає атом водню, також до їхніх фізіологічно прийнятних солей з основами. Зазначені для залишків R6 і R7 хвилясті лінії означають, що відповідний замісник може перебувати в aабо b-положенні. Під зазначеними в контексті даного опису як R6 і R7 алкільними групами розуміють метил, етил, н- або ізопропіл, н-, ізо- або трет-бутил. Стосовно інших С1-С10алкільних груп Y, R9, R9a, R9b, на додаток до названих значень варто назвати також вищі гомологи, такі, наприклад, як пентил, неопентил, групи від гексильної до децильної. Під поняття "С1-С10алкільні групи" підпадають і карбоциклічні або алкілциклоалкільні групи з числом атомів вуглецю до 10, наприклад, циклопропіл, циклопентил, циклогептил, метилциклопропіл, метилциклопентил або метилциклогексил. До бажаніших у всіх вищевказаних випадках належать метальна або етильна групи. С1-С10алкоксигрупи являють собою похідні вищезгаданих алкільних груп із подовженим одним атомом кисню ланцюгом, тобто, наприклад, метокси, етокси, н- або ізопропокси, н-, ізо- або трет-бутокси. Під С1-С10алканоїлом розуміють ацильні залишки прямоланцюгових і розгалужених С 1С10алканкарбонових кислот, тобто, наприклад, форміл, ацетил, пропіоніл, бутирил або ізобутирил і т.д. С1-С10алканоїлоксизалишки являють собою вищезазначені алканоїльні залишки з подовженим одним атомом кисню ланцюгом, тобто ацетилокси, пропіонілокси, бутирилокси. Якщо як замісник зазначено атом галогену, то під цим розуміють атом фтору, хлору або брому. Бажанішим із них є фтор. Для залишків R2 варто віддати перевагу перфторованим бічним ланцюгам з довжиною n, що дорівнює 2-4, а з-поміж них у свою чергу найбажанішим є пентафторетильний фрагмент. R3 являє собою передусім вільну гідроксильну групу. У випадку етерифікованої або естерифікованої гідроксильної групи як 17b-замісник остання бажано етерифікована С 1-С10алкільною групою або естерифікована С1-С10алканоїльною групою. Для цих алкільної, відповідно алканоїльної груп підходять ті ж значення, що зазначено вище. Етерифікацію, відповідно естерифікацію гідроксильної групи здійснюють за методами, відомими фахівцеві в даній галузі техніки. R4 і R5 переважно позначають кожний атом водню, а обидва разом утворюють додатковий зв'язок. Якщо R8 позначає групу Y, то остання являє собою бажано С1-С10алканоїльну або (1-гідрокси)-С1С10алкільну групу, причому особливо бажанішими є їхні (цих груп) ацетил і пропіоніл. До бажаніших карбоциклічних або гетероциклічних арильних залишків належать феніл, 1- або 2 нафталініл, 2- або 3-фураніл, 2- або 3-бензофураніл, 2- або 3-тієніл, 2-, 3-або 4-піридиніл. Заміщеними арильними залишками R8 варто назвати насамперед 4-ціанфеніл і 4-галогенфеніл, передовсім 4фторфеніл. Серед усіх зазначених для R8 як бажаніші залишки особливо придатне його значення Y, де Υ у свою чергу найліпше позначає ацетил. Відповідно до винаходу до найбажаніших належать подані нижче такі сполуки: 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он; 4'-[17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-11b-іл][1,1-біфеніл]-4-карбонітрил; 11b-(4-фтор[1,1'-біфеніл]-4-іл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он; 17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-11b-[4-(3-піридиніл)феніл]естр-4-ен-3-он; 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естра-4,15-дієн-3-он; 4'-[17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)естра-4,15-дієн-11b-іл][1,1’-біфеніл]-4-карбонітрил; 11b-(4’-фтор[1,1’-біфеніл]-4-іл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естра-4,15-дієн-3-он; 17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-11b-[4-(3-піридиніл)феніл]естра-4,15-діен-3-он; 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он; 4'-[17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-11b-іл][1,1’-біфеніл]-4-карбонітрил; 11b-(4'-фтор[1,1'-біфеніл]-4-іл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он; 17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-11b-[4-(3-піридиніл)феніл]естра-4,9-дієн-3-он; 11b-(4-aцетилфeніл)-17b-riдpoкcи-17a-(1,1,2,2,2-пентафторетил)естра-4,9,15-триєн-3-он; 4'-[17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)естра-4,9,15-триєн-11b-іл][1,1'-біфеніл]-4карбонітрил; 11b-(4'-фтор[1,1'-біфеніл]-4-іл)-17b-riдpoкcи-17a-(1,1,2,2,2-пентафторетил)естра-4,9,15-триєн-3-он; 17b-гiдpoкcи-17a-(1,1,2,2,2-пeнтaфтopeтил)-11b-[4-(3-пipидиніл)фeніл]ecтpa-4,9,15-триєн-3-он; 6'-ацетил-9,11a-дигідро-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1':10,9,11]естр-4-ен-3он; 4-[9,11a-дигідро-17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3',2',1’:10,9,11]естр-4-ен-6’іл]бензонітрил; 9,11a-дигідро-6'-(4-фторфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-4'Ннафт[3’,2’,1’:10,9,11]естер-4-ен-3-он; 9,11a-дигідро-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-6'-(3-тридиніл)-4'Н-нафт[3’,2’,1’:10,9,11]естер4-ен-3-он; 6'-ацетил-9,11a-дигідро-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]естра-4,15дієн-3-он; 4-[9,11a-дигідро-17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]естра-4,15діен-6'-іл]бензонітрил: 9,11a-дигідро-6'-(4-фторфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-4'Ннафт[3’,2’,1’:10,9,11]естра-4,15-дієн-3-он; 9,11a-дигідро-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-6'-(3-піридиніл)-4'Ннафт[3’,2’,1’:10,9,11]естра-4,15-дієн-3-он; 17b-гідрокси-11b-(4-гідроксифеніл)-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он; 17b-гідрокси-11b-(4-гідроксифеніл)-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он; 9,11a-дигідро-6'-17b-дигідрокси-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]естр-4-ен-3-он; 11b-[4-(ацетилокси)феніл]-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он; 11b-[4-(ацетилокси)феніл]-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он; 6'-(ацетилокси)-9,11a-дигідро-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]естр4-ен-3-он; 17b-гідрокси-11b-[4-(гідроксиметил)феніл]-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он; 17b-гідрокси-11b-[4-(гідроксиметил)феніл]-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он; 9,11a-дигідро-17b-гідрокси-6'-(гідроксиметил)-17a-(1,1,2,2,2-пентафторетил)-4'Ннафт[3’,2’,1’:10,9,11]естр-4-ен-3-он; 4-[17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-11b-іл]бензальдегід; 4-[17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-11b-іл]бензальдегід; 9,11a-дигідро-17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]естр-4-ен-6'ал; метиловий ефір 4-[17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-11b-іл]бензойної кислоти; метиловий ефір 4-[17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-11b-іл]бензойної кислоти; метиловий ефір 9,11a-дигідро-17bр-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)-4'Ннафт[3’,2’,1’:10,9,11]естр-4-ен-6'-карбонової кислоти; 17b-гідрокси-11b-[4-(1-гідроксіетил)феніл]-17a-(1,12,2,2-пеіггафторетил)естра-4,9-дієн-3-он; 17b-гідрокси-11b-[4-(1-гідроксіетил)феніл]-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он; 9,11a-дигідро-17b-гідрокси-6'-(1-гідроксіетил)-17a-(1,1,2,2,2-пентафторетил)-4'Ннафт[3’,2’,1’:10,9,11]естр-4-ен-3-он. Уведення фторованих бічних ланцюгів у положенні 17a здійснюють аналогічно методам, які багаторазово описано для інших бічних ланцюгів, шляхом нуклеофільного приєднання металоорганічної сполуки формули MCnFmHo до 17-кетону загальної формули II, де Μ являє собою такий метал, наприклад, як Li, Na, К, Mg-галоген (галоген = СІ, Вr, І) або інші метали, a n, m і о мають значення, яке вже зазначено в загальній формулі І. Бажанішим є приєднання реагентів Гриньяра (CnFmHoMg-галоген), відповідно літійорганічних сполук типу LiCnFmHo. Для введення перфторованих бічних ланцюгів особливо придатним є метод генерування літійорганічних реагентів, здійснюваний, виходячи з відповідних йодидів, за допомогою комплексу метиллітій/бромід літію (див. Journ. Org. Chem. 1987, 52, 2481 і Tetrahedron Lett. 1985, 26, 5243). Зазначені в загальній формулі II замісники R1, R4, R5 і St мають значення, які зазначено вище в загальній формулі І, причому функціональні групи, що містяться в St, в разі потреби можуть захищатися за допомогою методів, відомих фахівцеві в даній галузі техніки. Зокрема карбонільні групи, як, наприклад, 3кетоугруповання, здебільшого можна захищати відповідним чином, наприклад, за рахунок утворення відповідного кеталю або шляхом відновлення до гідроксильної групи і необов'язково переведення цієї гідроксильної групи в простий або складний ефір. Кетальзахисною групою можна назвати, наприклад, етилендіокси- або 2,2-диметилпропілен-1,3-діоксигрупу. Однаковою мірою прийнятні й інші звичайні кетозахисні групи. У випадку захищеної гідроксильної групи останню можна захистити, наприклад, у формі метоксиметилового, метоксіетилового, тетрагідроксипіранілового або силілового ефіру. Відщеплення захисної групи й окислювання вільної гідроксильної групи призводить до звільнення кетогрупи. Потім на відповідній стадії після приєднання 17a-бічного ланцюга захисні групи за відомою технологією видаляють і в разі потреби гідроксильну групу окислюють до сполученої кетогрупи. Приєднання 17a-бічного ланцюга можна проводити вибірково також у присутності інших вільних карбонільних груп, у тому числі і 3-кетогрупи. Матеріали загальної формули II, що служать як вихідні для одержання сполук загальної формули І, описано в цілому ряді патентів, патентних заявок і в інших публікаціях: ЕР-А 0057115, ЕР-А 0129499, ЕР-А 02592489, ЕР-А 0186834, ЕР-А 0447014, ЕР-А 0116974, ЕР-А 0190759, ЕР-А 0147361, ЕР-А 192598. ЕР-А 0283428, ЕР-А 0404283, WO-A 89/00578, WO-A 91/18917, WO-A 91/18918, WО-A 92/11277, WO-A 92/11278, WO-A 93/23020, Steroids 44 (1984), 349; можна посилатися і на інші, відомі спеціалістові джерела, що стосуються даного питання. У вищевказаних охоронних документах описано введення залишків, подібних до залишків R4, R5, R6, R7 8 і R , які заявляються в даному винаході. У принципі приєднання бічного ланцюга можна здійснювати на будь-якій проміжній стадії синтезу за допомогою вільної 17-кетогрупи. У випадку введення фторованого 17a-алкільного бічного ланцюга на одній із ранніх проміжних стадій синтезу інші зазначені в St залишки R6, R7 і R8 можна вводити у присутності цього 17a-бічного ланцюга за відомими методами, що їх описано, зокрема, у вищезгаданих патентах, патентних заявках та інших публікаціях. Нові сполуки загальної формули І є цінними фармакологічними біологічно активними речовинами. Вони відрізняються винятково високою антигестагенною ефективністю. Вони являють собою конкурентних антагоністів прогестерону, оскільки витискують прогестерон із його рецептора. Водночас, якщо вони і виявляють інші ендокринні побічні дії, як, наприклад, андрогенна, естрогенна або антиглюкокортикоїдна активність, то лише вкрай незначною мірою. Тому сполуки за винаходом можуть застосовуватися в медичних цілях. Сполуки з антигестагенною дією (конкурентні антагоністи прогестерону) вперше набули популярності в 1982р. (див. RU 486=ЕР-А 0057115) і дотепер їх неодноразово описували, зокрема в зазначених вище джерелах. Проте серед усіх описаних у публікаціях сполук відсутні такі з багаторазово фторованим 17aалкільним бічним ланцюгом, який містить принаймні 2 атоми вуглецю, і лише в WO 83/03099 ідеться про те, що пропоновані в цій заявці 3-кето-D4'9-1,9-норстероїди можуть нести 17a-алкільний бічний ланцюг, який необов'язково може заміщуватися атомом галогену. Фтор у свою чергу як галоген узагалі не згадується. Таким чином, конкретних прикладів стосовно 17a-алкільного ланцюга, який містить принаймні 2 атоми вуглецю, на сьогодні немає. Активні речовини такого типу з яскраво вираженою антигестагенною активністю придатні для провокування абортів (викиднів) з огляду на те, що вони витискують із рецептора прогестерон, необхідний для зберігання вагітності. Тому їхня цінність і перспективність для застосування з метою контролю фертильності (репродуктивної здатності) після статевих зносин цілком очевидні. Пропоновані у винаході сполуки загальної формули І можуть застосовуватися також для виготовлення препаратів, призначених для запобігання вагітності (контрацепції) у жінок (пор. WO-A 93/23020 і WO-A 93/21927). Крім того, їх можна застосовувати для боротьби з порушеннями життєво важливих циклів, зумовлених гормональними причинами, для ініціювання менструації і стимулювання пологів. Стосовно інших показань до застосування у сфері гінекології можна назвати гормонозамінну терапію (WO-A 94/18983), лікування болів, що супроводжують дисменорію, і ендометріозу (ЕР-а 0266303), а також для лікування міом. Сполуки за винаходом на позитивних рецепторах прогестерону під час дослідження на моделях раку молочної залози в гризунів і людини виявляють високу протипухлинну активність. їхня антипроліферативна дія спостерігалася in vitro на лінії T47D ракових клітин молочної залози людини. In vivo ефекти, які інгібують розвиток пухлини, було підтверджено на пухлині МХТ грудної залози миші і на моделях карциноми грудної залози пацюка, індукованої хімічним шляхом за допомогою НММ (N-нітрозометилсечовини) або ДМБА (диметилбензантрацену). Сполуки за винаходом придатні тому для найбільш ефективного лікування гормонозалежних карцином, таких, наприклад, як рак молочної залози, на позитивних рецепторах прогестерону. Пропоновані у винаході сполуки можуть застосовуватися для терапії гормонозалежних злоякісних пухлин як при первинній терапії, так і при повторній терапії, насамперед при недостатності тамоксифену. Сполуки загальної формули І, які мають антигестагенну дію, за винаходом можуть застосовуватися також у поєднанні зі сполуками, які мають антиестрогенну дію, для виготовлення фармацевтичних препаратів, призначених для лікування гормонозалежних пухлин (пор. ЕР-А 0310542), для стимулювання пологів, для переривання вагітності, а також для лікування гінекологічних порушень (пор. ЕР-А 0310541) і для контрацепції в жінок (пор. WO 96/19997). При лікуванні гормонозалежних пухлин антигестаген і антиестроген можуть уводитися в організм одночасно або послідовно. Під час послідовного введення бажано починати з антиестрогену, а потім переходити до антигестагену. Для комбінованого застосування з антигестагенами відповідно до винаходу можна використовувати при цьому, наприклад, такі антиестрогени: тамоксифен, ІСІ 182.780 (= 7a [9(4,4,5,5,5-пеятафторпентилсульфініл)ноніл]естра-1,3,5(10)-триєн-3,17b-діол), що їх описано в РСТ/ЕР97/О4517, антиестрогенні сполуки й інгібітори ароматази, наприклад, фадрозол, форместан, летрозол, анастрозол або атаместан. Експериментальному дослідженню були піддані такі антигестагени: А: 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он (приклад 1); Б: 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он (приклад 3); В: 6'-ацетил-9,11a-дигідро-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]естр-4ен-3-он (приклад 5); Г: 11b-[4-(диметиламіно)феніл]-17b-гідрокси-17a-(1-пропіл)естра-4,9-дієн-3-он (RU 38486); Д: 11b-(4-ацетилфеніл)-19,24-динор-17,23-епокси-17a-хола-4,9,20-триєн-3-он (Org 33628). Усі подані нижче тести проводили за відомими методами на пацюках. Тест на абортування s.c. і р.о.: див., наприклад, БР-А 0283428. Тест на андроген р.о.: стимулювання росту простати у ваговому вираженні за допомогою випробуваної сполуки, лікарська форма у формі розчину: s.c. бензилбензоат/рицинова олія (1+4); р.о. NaCl-Myrj; відома сполука для порівняння: пропіонат тестостерону. Аж до дозування 10мг випробувана сполука/тварина/день стимулювання росту простати практично не спостерігалося. Тест на дослідження росту матки р.о. на естрогенну дію: стимулювання росту матки у ваговому вираженні за допомогою випробуваної сполуки, лікарська форма у формі розчину: s.c. бензилбензоат/касторова олія (1+4); р.о. NaCl-Myrj; опрацювання оваріектомованих тварин протягом трьох днів; параметри: ріст матки у ваговому вираженні і висота епітелію ендометрію; вагінальний мазок негативний; відома сполука для порівняння: естрадіол 0,1мкг. Антитимолізний р.о. на антиглюкокортикоїдну дію: див., наприклад, ЕР-А 0283428 Тест на абортування пацюка, s. с, доза [мг/тварина/день] (n абортованих/n загальне) Тест на абортування пацюка, р.о., доза [мг/тварина/день] (n абортованих/n загальне) Тест на андроген, пацюк, р.о., доза [мг/тварина/день] (% стимулювання росту простати) Тест на ріст матки пацюка, р.о., доза [мг/тварина/день] (% стимулювання росту матки) Антитимолізний тест, пацюк, р.о., доза [мг/тварина/день] (% скасування індукованої дексаметазоном супресії тимусу) Сполука А Сполука Б 0,3 (4/4) 0,3 (4/4) 0,1 (4/4) 0,1 (4/4) 0,03 (4/4) 0,03 (4/4) 0,3 (4/4) 0,1 (4/4) 0,03 (4/4) 3 (3,3) 1 (4,8) 10 (3,7) 10 (11,5) 3 (7,4) 1 (6,0) Сполука В Сполука Г Сполука Д 0,3 (4/4) 3 (4/4) 0,3 (4/4) 0,1 (4/4) 1 (3/4) 0,1 (3/4) 0,03 (4/4) 0,3 (0/6) 0,03 (0/4) 0,3 (4/4) 0,1 (4/4) 0,3 (4/4) 3 (4/4) 0,3 (4/4) 0,1 (4/4) 0,03 (4/4) 1 (2/4) 0,1 (4/4) 0,03 (4/4) 0,01 (4/4) 0,3 (0/4) 0,03 (0/4) 0,003 (4/4) 10 (7,2) 10 (4,4) 3 (0) не визнач. 3 (2,9) 3 (5,6) 1 (2,1) 1 (1,6) 1 (4,0) 10 (2,4) 10 (2,6) 10 (4,4) 10 (6,4) 3 (1,3) 10 (18,2) 22 (18,8) 10 (76) 10 (44,7) 3 (21,6) 6,7 (31,6) 3 (79) 3 (19,1) 1 (1,2) 2,2 (7,2) 1 (19) 1 (4,3) Примітка: "не визнач." означає не визначали. Відповідно до вищевикладеного, винахід належить також до лікарських засобів на основі фармацевтично прийнятних, тобто в застосовуваному дозуванні нетоксичних сполук загальної формули І, необов'язково в поєднанні з антиестрогеном, разом із звичайними допоміжними речовинами і носіями. Даний винахід стосується далі використання сполук загальної формули І, необов'язково в поєднанні з антиестрогеном, для виготовлення лікарських засобів. Із сполук за винаходом за відомими методами галеніки можуть виготовлятися фармацевтичні препарати для ентерального, черезшкірного, парентерального або місцевого призначення. Їх можна вводити в організм у формі таблеток, драже, желатинових капсул, гранулятів, супозиторіїв, імплантатів, призначених для ін'єкції стерильних водних або олійних розчинів, суспензій або емульсій, мазей, кремів і гелів або за допомогою внутрішньовагінальних (наприклад, вагінальних кілець) або внутрішньоматочних систем (песарії, спіралі). При цьому активну(ні) речовину(ни) можна змішувати зі звичайними використовуваними в галеніці допоміжними речовинами, такими, наприклад, як гуміарабік, тальк, крохмаль, маніт, метилцелюлоза, лактоза, і тензидами (ПАВ), як, наприклад, Tween або Myrj, стеарат магнію, із водними або неводними носіями, похідними парафіну, змочувачами, диспергаторами, емульгаторами, консервантами й ароматизаторами як корегентів смаку (наприклад, ефірні олії). Уніфікована доза містить активну(ні) речовину(ни) у кількості від 0,1 до 100мг. Добова доза сполук за винаходом складає для людини від 0,1 до 400мг. Нижче даний винахід докладніше пояснено на прикладах. Приклад 1 11bр-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он 1а) 3,3;17,17-біс[1,2-етандіілбіс(окси)]-11b-[4-[[(1,1,2,2,3,3,4,4,4 нонафторбутил)сульфоніл]окси]феніл]естр-5-ен До розчину з 6г 4-[3,3;17,17-біс[1,2-етандіілбіс(окси)]естр-5-ен-11b-іл] фенолу, одержання якого описано в WO 91/18917 і WO 91/18918, у 100мл абсолютного тетрагідрофурану при 0°С додають 9,2мл 1,6молярного розчину бутиллітію в гексані. Далі лишають протягом 30 хвилин при 0°С для перемішування, після чого додають 5мл 1,1,2,2,3,3,4,4,4-нонафтор-1-бутансульфонілфториду. Потім перемішують протягом 1 години при 0°С. Реакційну суміш зливають на насичений водний розчин гідрокарбонату натрію. Потім екстрагують етилацетатом, промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і концентрують під вакуумом. Після колонкової хроматографії сирого продукту на силікагелі за допомогою суміші гексан/етилацетат одержують 8,2г сполуки 1а) у формі білої пінистої речовини. 1 Н-ЯΜΡ (CDCІ 3): d = 7,45 d (J=9Гц, 2H, арил); 7,17 d (J=9Гц, 2Н, арил); 5,55 розшир, d (J=5Гц, 1Н, Н-6); 4,00-3,80 m (8Н, кеталь); 3,50 розшир, dd (J=7Гц+5Гц, 1Н, H-11);O,53 s (3H, H-18). 1б) 3,3-[1,2-етандіілбіс(окси)]-11 b-[4-[[(1,1,2,2,3,3,4,4,4-нонафторбутил)сульфоніл]окси]феніл]естр-5-ен17-он 8,2г описаної в 1а) сполуки перемішують із 22г силікагелю і 2мл насиченого водного розчину щавлевої кислоти в 85мл дихлорметану протягом 5 годин при кімнатній температурі. Потім фільтрують через броунмілерит. Далі концентрують під вакуумом і сирий продукт очищають шляхом кристалізації з діізопропілового ефіру. Таким шляхом одержують 5,3г зазначеної в заголовку 1б) сполуки у формі білих кристалів. 1 Н-ЯМР (CDCІ 3): d = 7,45 d (J=9Гц, 2H, арил); 7,19 d (J=9Гц, 2Н, арил); 5,59 розшир, d (J=5Гц, 1Н, Н-6); 4,00-3,88 m (4H, кеталь); 3,52 розшир, dd (J=7Гц+5Гц, 1Н, H-11); 0,55 s (3H, H-18). 1в) 3,3-[1,2-етандіілбіс(окси)]-11b-[4-[[(1,1,2,2,3,3,4,4,4-нонафторбутил)сульфоніл]окси]феніл]-17a(1,1,2,2,2-пентафторетил)естр-5-ен-17b-ол 1мл конденсованого пентафторетиліодиду змішують із розчином із 691мг сполуки 1б) у 10мл абсолютного діетилового ефіру при -780°С. При цій температурі додають 4,77мл 1,5-молярного розчину комплексу метиллітій-бромід літію в діетиловому ефірі. Потім перемішують протягом 1 години при -78°С, після чого реакційну суміш зливають на насичений водний розчин гідрокарбонату натрію. Далі екстрагують етилацетатом, промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і концентрують під вакуумом. Після хроматографії отриманого сирого продукту на силікагелі за допомогою суміші з гексану/етилацетату одержують 719мг зазначеної в заголовку 1в) сполуки у формі білої пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,45 d (J=9Гц, 2H, арил); 7,19 d (J=9Гц, 2Н, арил); 5,54 розшир, d (J=5Гц, 1Н, Н-6); 3,88-4,00 m (4H, кеталь); 3,53 розшир, dd (J=7Гц+5Гц, 1Н, H-11); 0,60 s (3H, H-18). 1г) 11b-(4-ацетилфеніл)-3,3-[1,2-етандіілбіс(окси)]-17a-1,1,2,2,2-пентафторетил)естр-5-ен-17b-ол Розчин із 719мг сполуки 1в), 0,45мл (1-етоксіетеніл)трибутилстанану, 41мг тетракіс(трифенілфосфін) паладію (0), 263мг хлориду літію і 0,1мл піридину в 12мл діоксану кип'ятять протягом 1,5 години з оберненим холодильником. Потім реакційну суміш зливають на воду. Далі екстрагують етилацетатом і до органічної фази додають насичений водний розчин хлориду амонію і 3мл насиченого водного розчину щавлевої кислоти. Далі перемішують протягом 30 хвилин при кімнатній температурі, після чого органічну фазу відокремлюють і промивають насиченим водним розчином гідрокарбонату натрію і насиченим водним розчином хлориду натрію. Потім сушать над сульфатом натрію і концентрують під вакуумом. Після колонкової хроматографії отриманого сирого продукту на силікагелі за допомогою суміші з гексану/етилацетату одержують 440мг зазначеної в заголовку 1г) сполуки. 1 Н-ЯМР (CDCІ 3): d = 7,88 d (J=9Гц, 2Н, арил); 7,47 d (J=9Гц, 2Н, арил); 5,55 розшир, d (J=5Гц, 1Н, Н-6); 3,88-4,00 m (4H, кеталь); 3,55 розшир, dd (J=7Гц+5Гц, 1Н, Н-11); 2,61 s (3Н, ацетил); 0,62 s (3Н, Н-18). 1д) 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естр-4-ен-3-он 440мг сполуки 1г) розчиняють у 10мл ацетону, після чого додають 1мл 4н. водної соляної кислоти і перемішують протягом 1,5 години при кімнатній температурі. Потім реакційну суміш зливають на насичений розчин гідрокарбонату натрію. Далі екстрагують дихлорметаном, органічну фазу промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і концентрують під вакуумом. Після колонкової хроматографії отриманого сирого продукту на силікагелі за допомогою суміші з гексану/етилацетату одержують 311мг зазначеної в заголовку 1д) сполуки у формі пінистої речовини білого кольору. 1 Н-ЯМР (CDCІ 3): d = 7,89 d (J= 9Гц, 2H, арил); 7,53 d (J=9Гц, 2Н, арил); 5,89 розшир, s (1Н, Н-4); 3,50 розшир, dd (J=7Гц+5Гц, 1H, Н-11); 2,84 m (1H, Н-10); 2,60 s (3Н, ацетил); 0,70 s (3Н, Н-18). Приклад 2 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,3,3,4,4,4-нонафторбутил)естр-4-ен-3-он 2а) 3,3,-[1,2-етандіілбіс(окси)]-17a-(1,1,2,2,3,3,4,4,4-нонафторбутил)-11b-[4-[[1,1,2,2,3,3,4,4,4нонафторбутил)сульфоніл]окси]феніл]естр-5-ен-17b-ол Аналогічно прикладу 1в) 691мг сполуки 1б) у 15мл абсолютного діетилового ефіру піддають взаємодії з реагентом, утвореним із 0,52мл 1-іод-1,1,2,2,3,3,4,4,4-нонафторбутану і 1,67мл 1,5-молярного розчину комплексу метиллітій-бромід літію в діетиловому ефірі. Після хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 838мг зазначеної в заголовку 2а) сполуки у формі пінистої речовини білого кольору. 1 Н-ЯМР (CDCІ 3): d = 7,44 d (J=9Гц, 2H, арил); 7,18 d (J=9Гц, 2Н, арил); 5,55 розшир, d (J=5Гц, 1Н, Н-6); 3,88-4,00 m (4H, кеталь); 3,53 розшир, dd (J=7Гц+5Гц, 1Н, H-11); 0,61 s (3H, H-18). 2б) 11b-(4-ацетилфеніл)-3,3-[1,2-етандіілбіс(окси)]-17a-(1,1,2,2,3,3,4,4,4-нонафторбутил)естр-5-ен-17bол Аналогічно прикладу 1г) 838мг сполуки 2а) піддають взаємодії з 0,46мл (1етоксіетеніл)трибутилстанану, 43мг тетракіс(трифенілфосфін)паладію (0), 272мг хлориду літію і 0,1мл піридину в 12мл діоксану. Після перероблення й оброблення насиченим водним розчином хлориду амонію і насиченого водного розчину щавлевої кислоти і після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 505мг зазначеної в заголовку 2б) сполуки у формі пінистої речовини білого кольору. 1 Н-ЯМР (CDCІ 3): d = 7,85 d (J=9Гц, 2H, арил); 7,46 d (J=9Гц, 2Н, арил); 5,55 розшир, d (J=5Гц, 1Н, Н-6); 3,88-4,00 m (4Н, кеталь); 3,55 розшир, dd (J=7Гц+5Гц, 1Н, Н-11); 2,61 s (3Н, ацетил); 0,63 s (3Н, Н-18). 2в) 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,3,3,4,4,4-нонафторбутил)естр-4-ен-3-он Аналогічно прикладу 1д) 505мг сполуки 2б) піддають взаємодії з 4н. соляної кислоти в ацетоні. Після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 372мг зазначеної в заголовку 2в) сполуки у формі пінистої речовини білого кольору. 1 Н-ЯМР (CDCІ 3): d = 7,89 d (J=9Гц, 2H, арил); 7,55 d (J=9Гц, 2Н, арил); 5,88 розшир, s (1Н, Н-4); 3,51 розшир, dd (J=7Гц+5Гц, 1Н, Н-11); 2,85 m (1Н, Н-10); 2,60 s (3Н, ацетил); 0,70 s (3Н, Н-18). Приклад 3 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он 3а) 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-17a-(1,1,2,2,2-пентафторетил)-11b-[4-(2,5,5-триметил-1,3діоксолан-2-іл)феніл]-5a-естр-9-ен-5,17b-діол Аналогічно прикладу 1в) 1,08г 3,3-[2,2-диметил-1,3-пропандііл-біс(окси)]-5-гідрокси-11b-[4-(2,5,5триметил-1,3-діоксолан-2-іл)феніл]-5a-естр-9-ен-17-ону, одержання якого описано в ЕР 0190759, приклад 6с), у 19мл абсолютного діетилового ефіру піддають взаємодії з реагентом, утвореним із 1,9мл 1-іод1,1,2,2,2-пентафторетану і 8,7мл 1,5-молярного розчину комплексу метиллітій-бромід літію в діетиловому ефірі. Після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 644мг зазначеної в заголовку 3а) сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,29 d (J=9Гц, 2H, арил); 7,23 d (J=9Гц, 2Н, арил); 4,42 s (1H, 5-ОН); 4,35 розшир, d (J=7Гц, 1Н Н-11); 1,52 s (3Н, арилкеталь); 1,26 s (3Н, арилкеталь); 1,04 s (3Н, 3-кеталь); 0,89 s (3Н, 3кеталь); 0,57 s (3Н, арилкеталь); 0,51 s (3Н, Н-18). 3б) 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он 635мг сполуки, описаної в 3а), перемішують у 9мл метанолу з 0,4мл водної напівконцентрованої сірчаної кислоти протягом 2 годин при кімнатній температурі. Потім зливають на насичений водний розчин гідрокарбонату натрію і екстрагують етилацетатом. Органічну фазу промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію, фільтрують і концентрують під вакуумом. Після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 428мг зазначеної в заголовку сполуки у формі безбарвної пінистої речовини. tпл 260,4°С (діізопропіловий ефір), [a]D22=+181,3° (СНСІ 3, с=0,535). Приклад 4 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетилч)естра-4,9,15-триєн-3-он 4а) 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-17a-(1,1,2,2,2-пентафторетил)-11b-[4-(2,5,5-триметил-1,3діоксолан-2-іл)феніл]-5a-естра-9,15-дієн-5,17b-діол Аналогічно прикладу 1в) 1,15г 3,3-[2,2-диметил-1,3-пропандііл-біс(окси)]-5-гідрокси-11b-[4-(2,5,5триметил-1,3-діоксолан-2-іл)феніл]-5a-естра-9,15-дієн-17-ону, одержання якого описано в WO 89/00578, приклад 1b), у 20мл абсолютного діетилового ефіру і 10мл абсолютного тетрагідрофурану піддають взаємодії з реагентом, утвореним із 2,0мл 1-іод-1,1,2,2,2-пентафторетану і 9,3мл 1,5-молярного розчину комплексу метиллітій-бромід літію в діетиловому ефірі. Після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 1,16г зазначеної в заголовку 4а) сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,31 d (J=9Гц, 2Н, арил); 7,24 d (J=9Гц, 2Н, арил); 6,31 розшир, d (J=6Гц, 1H, H-15); 5,58 розшир, ddd (J=6Гц+3,5Гц+1,5Гц, 1H, Н-16); 4,49 s (1H, 5-ОН); 4,40 розшир, d (J=8Гц, 1H, Н-11); 1,52 s (3Н, арилкеталь); 1,26 s (3Н, арилкеталь); 1,03 s (3Н, 3-кеталь); 0,89 s (3Н, 3-кеталь); 0,68 s (3Н, Н-18); 0,58 s (3Н, арилкеталь). 4б) 11b-(4-ацетилфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естра-4,9,15-триєн-3-он 1,15г описаної в 4а) сполуки за способом, описаної в прикладі 3б), піддають у 16,5мл метанолу взаємодії з 0,73мл водної напівконцентрованої сірчаної кислоти, одержуючи в результаті 572мг зазначеної в заголовку сполуки у формі безбарвної пінистої речовини. tпл 213,9°С (діізопропіловий ефір), [a]D22 = +210,5 (СНС13, с=0,615). Приклад 5 9,11a-дигідро-6'-(4-торфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]естр4-ен-3-он 5а) 9,11a-дигідро-3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]6'-[[(1,1,2,2,3,3,4,4,4нонафторбутил)сульфоніл]окси]-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]-5a-естран-5,17bдіол Розчин із приблизно 4мл пентафторетиліодиду в 20мл простого безводного ефіру змішують при -78°С в атмосфері сухого аргону з 13,4мл 1,7-молярного розчину трет-бутиллітію в гексані і перемішують протягом 30 хвилин. Потім краплями додають розчин із 2,0г (2,62молі) 9,11a-дигідро-3,3-[2,2-диметил-1,3пропандіілбіс(окси)]-5-гідрокси-6’-[[(1,1,2,2,3,3,4,4,4-нонафторбутил)сульфоніл]окси]-4'Ннафт[3’,2’,1’:10,9,11]-5a-естран-17-ону, отриманого за способом, аналогічно описаному в DE 4216003 (приклад 1b), у 60мл безводного толуолу і лишають протягом 2 годин для нагрівання до -10°С. Потім зливають у насичений водний розчин гідрокарбонату натрію, декілька разів екстрагують етилацетатом, об'єднані органічні екстракти промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. Отриманий після фільтрації і видалення розчинника залишок очищають за допомогою хроматографії на приблизно 300мл тонкоподрібненого силікагелю за допомогою системи градієнтів із гексану і етилацетату. Таким шляхом виділяють 1,40г (1,59молів, 61%) зазначеної в заголовку 5а) сполуки у формі безбарвної твердої речовини, а також 730мг (0,96молів, 36%) вихідного матеріалу. 1 Н-ЯМР (CDCІ 3): d = 0,41 (3Н), 0,93 (3Н), 1,00 (3Н), 1,20-1,36 (2Н), 1,42-1,81 (11Н), 1,93 (2Н), 2,07-2,28 (3Н), 2,31-2,48 (1H), 2,61-2,77 (2Н), 3,15 (1H), 3,21 (1H), 3,45-3,65 (4Н), 4,48 (1H), 6,98 (1H), 7,04 (1H), 7,47 (1H) част. /млн. 5б) 9,11a-дигідро-3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-6'-(4-фторфеніл)-17a-(1,1,2,2,2пеотафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]-5a-естран-5,11b-діол Розчин із 400мг (453мкмолі) отриманої відповідно до прикладу 5а) сполуки в суміші з 7мл безводного толуолу і 3мл безводного етанолу змішують послідовно з 43мг хлориду літію, 0,66мл 2М розчину карбонату натрію, 82мг (4-фторфеніл)боронової кислоти, 50мг тетракіс(трифенілфосфін) паладію (0) і нагрівають в атмосфері аргону протягом 1,5 години до 95°С. Потім реакційну суміш розводять водою, екстрагують етилацетатом, об'єднані органічні екстракти промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. Отриманий після фільтрації і видалення розчинника залишок очищають за допомогою хроматографії на приблизно 150мл тонкоподрібненого силікагелю за допомогою системи градієнтів із гексану і етилацетату. Таким шляхом виділяють 264мг (389мкмолів, 86%) зазначеної в заголовку 5б) сполуки у формі безбарвної твердої речовини. 1 Н-ЯМР (CDCІ 3): d = 0,49 (3Н), 0,93 (3Н), 0,99 (3Н), 1,21-1,28 (18Н), 2,30-2,47 (1Н), 2,76 (2Н), 3,17 (1Н), 3,26 (1Н), 3,47-3,66 (4Н), 4,48 (1Н), 7,11 (2Н), 7,23 (1Н), 7,33 (1Н), 7,45 (1Н), 7,54 (2Н) част. /млн. 5в) 9,11a-дигідро-6’-(4-фторфеніл)-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-4'Ннафт[3’,2’,1’:10,9,11]естр-4-ен-3-он Розчин із 260мг (383мкмолі) отриманої відповідно до прикладу 5б) сполуки в 13мл ацетону змішують із 700мкл водної 4н. соляної кислоти і нагрівають протягом 4 годин до 500°С. Потім цю суміш зливають у насичений водний розчин гідрокарбонату натрію, декілька разів екстрагують дихлорметаном, об'єднані органічні екстракти промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. Отриманий після фільтрації і видалення розчинника залишок очищають за допомогою хроматографії на приблизно 100мл тонкоподрібненого силікагелю за допомогою системи градієнтів із гексану і етилацетату. Таким шляхом виділяють 206мг (359мкмолів, 94%) зазначеної в заголовку сполуки у формі кристалічної твердої речовини. 1 Н-ЯМР (CDCІ 3): d = 0,55 (3Н), 1,22 (1Η), 1,33-1,50 (2H), 1,54-1,89 (5H), 1,92-2,54 (8Н), 2,66 (1Н), 2,81 (1Н), 2,87 (1Н), 3,31 (1Н), 3,43 (1Н), 5,90 (1Н), 7,12 (2Н), 7,27 (1Н), 7,37 (1Н), 7,45-7,60 (3Н) част. /млн. Приклад 6 6'-ацетил-9,11a-дигідро-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]естр-4-ен3-он Розчин із 600мг (680мкмолів) отриманої відповідно до прикладу 5а) сполуки в 7мл безводного Ν,Νдиметилформаміду послідовно змішують в атмосфері сухого аргону з 69мг хлориду літію, 381мкл (1етоксіетеніл)трибутилстанану, 25мг тетракіс(трифенілфосфін)паладію (0) і нагрівають протягом 1,5 години до 110°С Після охолодження змішують із 10мл ацетону, 1,5мл водної 4н. соляної кислоти, витримують протягом 2 годин при 230°С, після чого нагрівають ще протягом 3 годин до 500°С. Потім зливають у насичений водний розчин гідрокарбонату натрію, декілька разів екстрагують дихлорметаном, об'єднані органічні екстракти промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. З отриманого після фільтрації і видалення розчинника залишку шляхом кристалізації з дихлорметану й ацетону одержують 206мг зазначеної в заголовку сполуки, що містить ще забруднювальні домішки, яку піддають подальшому очищенню на 10 аналітичних тонкошарових пластинах. Як розчинник служить суміш із гексану і етилацетату, а як елюент - суміш із дихлорметану і метанолу. У результаті виділяють 160мг (306мкмолів, 45%) зазначеної в заголовку сполуки у формі безбарвної твердої речовини. 1 Н-ЯМР (CDCІ 3): d = 0,47 (3Н), 1,21 (1Н), 1,31-1,51 (2Н), 1,53-1,85 (5Н), 1,98 (2Н), 2,12-2,52 (6Н), 2,54 (3Н), 2,64 (1Н), 2,82 (1Н), 2, 88 (1Н), 3,31 (1Н), 3,42 (1Н), 5,91 (1Н), 7,54 (1Н), 7,71 (1Н), 7,77 (1Н) част. /млн. Приклад 7 4-[9,11a-дигідро-17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]естр-4-ен-6'іл]бензонітрил 7а) 4-[9,11a-дигідро-5,17b-гідрокси-3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-17a-(1,1,2,2,2пентафторетил)-4’Н-нафт[3’,2’,1’:10,9,11]-5a-естран-6’-іл]бензонітрил 400мг (453мкмолі) отриманої відповідно до прикладу 5б) сполуки аналогічно прикладу 5б) піддають взаємодії з 4-(5,5-диметил-1,3,2-діоксаборинан-2-іл)бензонітрилом і після переробки й очищення виділяють 301мг (439мкмолів, 97%) зазначеної в заголовку 7а) сполуки у формі кристалічної твердої речовини. 7б) 4-[9,11a-дигідро-17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)-4'Н-нафт[3’,2’,1’:10,9,11]естр-4ен-6'-іл]бензонітрил 296мг (431мкмоль) отриманої відповідно до прикладу 7а) сполуки перетворюють аналогічно прикладу 5в) і після переробки й очищення виділяють 228мг (392мкмолі, 91%) зазначеної в заголовку сполуки у формі кристалічної твердої речовини. 1 Н-ЯМР (CDCІ 3): d = 0,53 (3Н), 1,22 (1Н), 1,35-1,51 (2Н), 1,55-1,88 (5Н), 1,92-2,14 (3Н), 2,14-2,53 (5Н), 2,65 (1Н), 2,81 (1Н), 2,88 (1Н), 3,32 (1Н), 3,45 (1Н), 5,91 (1Н), 7,32 (1Н), 7,42 (1Н), 7,55 (1Н), 7,70 (4Н) част./млн. Приклад 8 17b-гідрокси-11b-(4-гідроксифеніл)-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он 8а) 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-5-гідрокси-11b-[4-(фенілметокси)феніл]-5a-естр-9-ен-17-он 1,17г магнієвої стружки завантажують в атмосфері захисного газу в 4мл абсолютного тетрагідрофурану і змішують з одною краплею 1,2-диброметану. Після початку реакції повільно додають по краплях розчин із 12,7г 1-бром-4-(фенілметокси) бензолу (одержання див. Journ. Amer. Chem. Soc. 42, 657 (1920)) у 80мл абсолютного тетрагідрофурану. Реакційну суміш нагрівають із зворотним холодильником до повного перетворення магнію. Потім прохолоджують до 0°С і змішують із 2,39г хлориду міді(1). Далі повільно додають краплями інший розчин із 3г 3,3,-[2,2-диметил-1,3-пропандіілбіс(окси)]-5,10-епокси-5а,10a-естр9(11)-ен-17-ону (одержання див. Tetrahedron Lett. 26, 2069-2072 (1985)) у 80мл абсолютного тетрагідрофурану. Реакційну суміш перемішують протягом ночі при кімнатній температурі, після чого зливають на насичений водний розчин хлориду амонію. Водну фазу екстрагують етилацетатом, органічні фази об'єднують, промивають їх насиченим водним розчином хлориду натрію і сушать їх над сульфатом натрію. Потім фільтрують і концентрують під вакуумом. Після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 3,7г зазначеної в заголовку 8а) сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,50-7,27 m (5Н, бензил); 7,13 d (J=9Гц, 2H, арил); 6,88 d (J=9Гц, 2Н, арил); 5,02 s (2H, бензил); 4,45 s (1H, 5-ОН); 4,27 розшир, d (J=6,5Гц, 1Н, Н-11); 1,06 s (3Н, 3-кеталь); 0,87 s (3Н, 3кеталь); 0,50 s (3Н, Н-18). 8б) 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-17a-(1,1,2,2,2-пентафторетил)-11b-[4(фенілметокси)феніл]-5a-естр-9-ен-5,17b-діол Аналогічно прикладу 1в) 1,35г описаної в 8а) сполуки в 48мл абсолютного толуолу піддають взаємодії з реагентом, утвореним із 1,18г 1-іод-1,1,2,2,2-пентафторетану і 2,4мл 1,5-молярного розчину комплексу метиллітій-бромід літію в діетиловому ефірі. Після колонкової хроматографії на силікагелі за допомогою суміші гексану/етилацетату одержують 730мг зазначеної в заголовку 8б) сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,50-7,30 m (5Н, бензил); 7,12 d (J=9Гц, 2H, арил); 6,88 d (J=9Гц, 2Н, арил); 5,02 s (2Н, бензил); 4,45 s (1Н, 5-ОН); 4,29 розшир, d (J=6Гц, 1Н, Н-11); 1,06 s (3Н, 3-кеталь); 0,87 s (3Н, 3-кеталь); 0,56 s (3Н, Н-18). 8в) 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-17a-(1,1,2,2,2-пентафторетил)-11b-(4-гідроксифеніл)-5aестр-9-ен-5,17b-діол 730мг отриманої в 8б) сполуки розчиняють у 11мл метанолу і змішують із 341мг форміату амонію і 73мг 10%-ного паладію на активованому вугіллі. Реакційну суміш перемішують протягом 2 годин при кімнатній температурі, після чого фільтрують через Celite. Залишок старанно промивають етилацетатом. Фільтрат концентрують під вакуумом. Таким шляхом одержують 631мг зазначеної в заголовку 8в) сполуки, яку в сировій формі використовують у наступній реакції. 8г) 17b-гідрокси-11b-(4-гідроксифеніл)-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он 631мг описаної в 8в) сполуки аналогічно описаному в 3б) способові піддають у 11мл метанолу взаємодії з 0,48мл водної напівконцентрованої сірчаної кислоти, одержуючи в результаті 428мг зазначеної в заголовку сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,00 d (J=9Гц, 2Н, арил); 6,75 d (J=9Гц, 2Н, арил); 5,94 розшир, s (1Н, ОН); 5,80 s (1Н, Н-4); 4,38 розшир, d (J=7Гц, 1Н, Н-11); 0,61 s (3Н, Н-18). Приклад 9 11b-[4-(ацетилокси)феніл]-17b-гідрокси-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он 300мг описаної в 8г) сполуки розчиняють у 12мл піридину і протягом 4 годин перемішують при кімнатній температурі з 61мкл ангідриду оцтової кислоти. Потім реакційну суміш зливають на насичений водний розчин хлориду амонію. Водну фазу екстрагують етилацетатом, органічні фази об'єднують, промивають їх насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. Далі фільтрують і концентрують під вакуумом. Після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 248мг зазначеної в заголовку сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,18 d (J=9Гц, 2H, арил); 7,02 d (J=9Гц, 2Н, арил); 5,79 s (1Н, Н-4); 4,45 розшир, d (J=6Гц, 1Н, Н-11); 2,29 s (3Н, ацетил); 0,61 s (3Н, Н-18). Приклад 10 17b-гідрокси-11b-[4-(гідроксиметил)феніл]-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он 10а) 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-5-гідрокси-11b-[4-[(метоксиметокси)метил]феніл]-5a-естр9-ен-17-он З 6,0г 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-5,10-епокси-5a,10a-естр-9(11)-ен-17-ону в 160мл абсолютного тетрагідрофурану, 22,32г 1-бром-4-[(метоксиметокси)метил]бензолу (одержання див. Synth. Commun. 20, 1469-1472 (1990)) у 160мл абсолютного тетрагідрофурану, 2,35г магнієвої стружки в 10мл абсолютного тетрагідрофурану і 4,78г хлориду міді(1) за способом, аналогічно описаному в 8а), після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 7,14г зазначеної в заголовку 10а) сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,27 d (J=9Гц, 2H, арил); 7,24 d (J=9Гц, 2Н, арил); 4,72 s (2Н, ацеталь); 4,56 s (2H, бензил); 4,48 s (1Н, 5-ОН); 4,33 розшир, d (J=6,5Гц, 1Н, Н-11); 3,42 s (3Н, метокси); 1,07 s (3Н, 3-кеталь); 0,87 s (3Н, 3-кеталь); 0,49 s (3Н, Н-18). 10б) 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-17a-(1,1,2,2,2-пентафторетил)-11b-[4[(метоксиметокси)метил]феніл]-5a-естр-9-ен-5,17b-діол Аналогічно прикладу 1в) 4,85г описаної в 10а) сполуки в 200мл абсолютного толуолу піддають взаємодії з реагентом, утвореним із 18,2г 1-іод-1,1,2,2,2-пентафторетану і 43,3мл 1,5-молярного розчину комплексу метиллітій-бромід літію в діетиловому ефірі. Після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 4,13г зазначеної в заголовку 10б) сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,25 d (J=9Гц, 2H, арил); 7,20 d (J=9Гц, 2Н, арил); 4,71 s (2H, ацеталь); 4,54 s (2Н, бензил); 4,46 s (1Н, 5-ОН); 4,32 розшир, d (J=6Гц, 1Н, Н-11); 3,41 s (3Н, метокси); 1,06 s (3Н, 3-кеталь); 0,86 s (3Н, 3-кеталь); 0,52 s (3Н, Н-18). 10в) 17b-гідрокси-11b-[4-(гідроксимвтил)феніл]-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он 4,13г описаної в 10б) сполуки за способом, аналогічно описаному в 3б), піддають у 65мл метанолу взаємодії з 2,84мл водної напівконцентрованої сірчаної кислоти, одержуючи в результаті 2,26г зазначеної в заголовку сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,27 d (J=9Гц, 2H, арил); 7,17 d (J=9Гц, 2Н, арил); 5,78 s (1Н, Н-4); 4,64 s (2Н, бензил); 4,45 розшир, d (J=6,5Гц, 1Н, Н-11); 0,59 s (3Н, Н-18). Приклад 11 4-[17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)естра-4,9-діен-11b-іл] бензальдегід 497мг отриманої в прикладі 10в) сполуки перемішують із 431мг хлорохромату піридинію в 10мл дихлорметану протягом 2 годин при кімнатній температурі, після чого фільтрують крізь силікагель. Залишок ретельно промивають етилацетатом і фільтрат концентрують під вакуумом. Після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 415мг зазначеної в заголовку сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 9,97 s (1Н, форміл); 7,81 d (J=9Гц, 2Н, арил); 7,39 d (J=9Гц, 2Н, арил); 5,81 s (1Н, Н4); 4,52 розшир, d (J=7Гц, 1Н, Н-11); 0,58 s (3Н, Н-18). Приклад 12 Метиловий ефір 4-[17b-гідрокси-3-оксо-17a-(1,1,2,2,2-пентафторетил)естра-4,9-діен-11b-іл]бензойної кислоти Розчин із 125мг отриманої в прикладі 11 сполуки в 2,5мл метанолу додають до 81,4мг ціаніду калію в 1,25мл метанолу, після чого до реакційної суміші додають 390мг оксиду марганцю (IV) і 22мл крижаної оцтової кислоти і потім усю суміш перемішують протягом 1 години при кімнатній температурі. Далі фільтрують через Celiteo, фільтрат розчиняють за допомогою етилацетату/води і водну фазу екстрагують етилацетатом. Об'єднані органічні фази промивають водою і насиченим водним розчином хлориду натрію, сушать над сульфатом натрію, фільтрують і концентрують під вакуумом. Після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 120мг зазначеної в заголовку сполуки у формі безбарвної пінистої речовини. 1 Н-ЯМР (CDCІ 3): d = 7,94 d (J=9Гц, 2H, арил); 7,27 d (J=9Гц, 2Н, арил); 5,79 s (1Н, Н-4); 4,49 розшир, d (J=6Гц, 1Н, Н-11); 3,89 s (3Н, метокси); 0,57 s (3Н, Н-18). Приклад 13 17b-гідрокси-11b-[4-(1-гідроксіетил)феніл]-17a-(1,1,2,2.2-пентафторетил)естра-4,9-дієн-3-он 13а) 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-5-гідрокси-11b-[4-[1-[(тетрагідро-2Н-піран-2іл)окси]етил]феніл]-5a-естр-9-ен-17-он Із 1,6г 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-5,10-епокси-5a,10а-естр-9(11)-ен-17-ону в 40мл абсолютного тетрагідрофурану, 7,4г 2-[1-(4-бромфеніл)етокси]тетрагідро-2Н-пірану (одержання див. Arzneimitt. Forsch. 25, 1495-1501 (1975)) у 40мл абсолютного тетрагідрофурану, 1,3г магнієвої стружки в 2мл абсолютного тетрагідрофурану і 1,3г хлориду міді(1) за способом, аналогічно описаному в прикладі 8а), після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 2,06г зазначеної в заголовку 13а) сполуки у формі суміші діастереомерів у положенні ацеталю і бензилу. 1 Н-ЯМР (CDCІ 3): d = 7,28 d (J=9Гц, 2H, арил); 7,18 d (J=9Гц, 2Н, арил); 4,90-4,72 m (2Н, ацеталь і бензиловий ефір); 4,44 s (1Н, 5-OH); 4,30 розшир, d (J=6,5Гц, 1Н, H-11); 1,45/1,42 d (J=6Гц, 3Н, метил); 1,05 s (3Н, 3-кеталь); 0,87 s (3Н, 3-кеталь); 0,46 s (3Н, Н-18). 13б) 3,3-[2,2-диметил-1,3-пропандіілбіс(окси)]-17a-(1,1,2,2,2-пентафторетил)-11b-[4-[1-[(тетрагідро-2Нпірану-2-іл)окси]етил]феніл]-5a-естр-9-ен-5,17b-діол Аналогічно прикладу 1в) 1,45г описаної в 13а) сполуки в 50мл абсолютного толуолу піддають взаємодії з реагентом, утвореним із 4,9г 1-іод-1,1,2,2,2-пентафторетану і 11,7мл 1,5-молярного розчину комплексу метиллітій-бромід літію в діетиловому ефірі, і після колонкової хроматографії на силікагелі за допомогою суміші з гексану/етилацетату одержують 1,22г зазначеної в заголовку 13б) сполуки у формі суміші діастереомерів у положенні ацеталю і бензилу. 1 Н-ЯМР (CDCІ 3): d = 7,28 d (J=9Гц, 2H, арил); 7,18 d (J=9Гц, 2Н, арил); 4,90-4,74 m (2Н, ацеталь і бензиловий ефір); 4,42 s (1Н, 5-ОН); 4,31 розшир, d (J=6,5Гц, 1Н, Н-11); 1,46/1,42 d (J=6Гц, 3Н, метил); 1,05 s (3Н, 3-кеталь); 0,87 s (3Н, 3-кеталь); 0,51 s (3Н, Н-18). 13в) 17b-гідрокси-11b-[4-(1-гідроксіетил)феніл]-17a-(1,1,2,2,2-пентафторетил)естра-4,9-дієн-3-он 1,22г описаної в 13б) сполуки за способом, аналогічно описаному в прикладі 3б), піддають у 18мл метанолу взаємодії з 778мкл водної напівконцентрованої сірчаної кислоти, одержуючи в результаті 693мг зазначеної в заголовку сполуки у формі безбарвної пінистої речовини, що являє собою суміш епімерів за бензилкарбінолом. 1 Н-ЯМР (CDCІ 3): d = 7,28 d (J=9Гц, 2H, арил); 7,15 d (J=9Гц, 2Н, арил); 5,79 s (1Н, Н-4); 4,88 розшир, q (J=6Гц, 1Н, бензил); 4,45 розшир, d (J=6Гц, 1Н, Н-11); 1,49 d (J=6Гц, 3Н, метил); 0,60 s (3Н, Н-18).
ДивитисяДодаткова інформація
Назва патенту англійськоюAntigestagenic steroids
Автори англійськоюSchwede Wolfgang, Cleve, Arwed, Klar, Ulrich
Назва патенту російськоюАнтигестогенные стероиды
Автори російськоюШведе Вольфганг
МПК / Мітки
МПК: C07J 1/00, C07J 53/00, A61P 5/36, A61K 31/56, C07J 43/00, C07J 41/00
Мітки: дію, фторованим, фармацевтична, антигестагенну, 17a-алкільним, композиція, ланцюгом, мають, стероїди
Код посилання
<a href="https://ua.patents.su/9-66783-sterodi-iz-ftorovanim-17a-alkilnim-lancyugom-yaki-mayut-antigestagennu-diyu-ta-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Стероїди із фторованим 17a-алкільним ланцюгом, які мають антигестагенну дію, та фармацевтична композиція</a>
Попередній патент: Термоелектричний елемент
Наступний патент: Спосіб переетерифікації жиру і/або олії біологічного походження шляхом алкоголізу та моноефіри жирних кислот
Випадковий патент: Склад апрету текстильного матеріалу для виготовлення головних уборів












