Похідні імідазолу, що мають спорідненість до активності a2-рецепторів, фармацевтична композиція та спосіб лікування
Номер патенту: 49847
Опубліковано: 15.10.2002
Автори: Сакслунд Раймо, Хілліля Мааріт, Коккрофт Віктор, Карьялайнен Арто, Хухтала Пааво, Вурстер Зігфрід, Савола Юха-Матті, Кар'ялайнен Ар'я, Елоранта Майре
Формула / Реферат
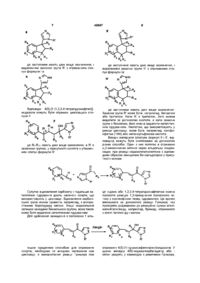
1. Похідне імідазолу, яке є сполукою формули І
, (I)
де
n означає 0 або 1
R1 означає гідроген або С1-С4-алкіл
R2 означає гідроген або R2 і R3 разом утворюють подвійний зв'язок
R3 означає гідроген або С1-С4-алкіл, або R2 і R3 разом утворюють подвійний зв'язок
R4 означає гідроген, С1-С4-алкіл, гідроксильну групу або С1-С4-алкоксильну групу
R5 означає гідроген або С1-С4-алкіл, або R4 і R5 разом із атомом карбону, з яким вони з'єднані, утворюють карбонільну групу.
R6, R7 і R8 однакові або різні й позначають незалежно гідроген, С1-С4-алкіл або С2-С4-алкеніл, С3-С7-циклоалкіл, гідроксильну групу, С1-С4-алкоксильну групу, С1-С4-гідроксіалкіл, тіол, С1-С4-алкілтіогрупу, С1-С4-алкілтіол, галоген, трифлуорметил, нітрогрупу або необов'язково заміщену аміногрупу
Х означає -CHR9- (CHR10)m-
m означає 0 або 1, та
R9 і R10 однакові або різні й означають незалежно гідроген або С1-С4-алкіл;
або їх фармацевтичнo придатні естер або сіль.
2. Похідне за п. 1, що відрізняється тим, що n=m=0.
3. Похідне за п. 1 або 2, що відрізняється тим, що кожен із R6, R7 i R8 є гідроген.
4. Похідне за п. 1 або 2, що відрізняється тим, що R6 є С1-С4-алкіл у положенні 4 чи 6 кільця індану, a R7 і R8 є гідроген.
5. Похідне за п. 1 або 2, що відрізняється тим, що R6 є С1-С4-алкоксильна група в положенні 7 кільця індану, a R7 і R8 є гідроген.
6. Похідне за п. 1, що відрізняється тим, що n=0 і m=1, і R3-R10 усі є гідроген.
7. Похідне за п. 1, що відрізняється тим, що n=1 і m=0.
8. Похідне за п. 7, що відрізняється тим, що R1 є метил або етил.
9. Похідне за п. 7 або 8, що відрізняється тим, що кожен із R6, R7 і R8 є гідроген.
10. Похідне за п. 7 або 8, що відрізняється тим, що R6 є гідроксильна група в положенні 4 або 6 кільця індану, a R7 і R8 є гідроген.
11. Похідне за п. 7 або 8, що відрізняється тим, що R6 є гідроксильна група в положенні 5 кільця індану, R7 є гідроксильна група або С1-С4-алкіл або С1-С4-гідроксіалкіл у положенні 6 кільця індану, R8 є гідроген.
12. Похідне за п. 1, що відрізняється тим, що n=m=1.
13. Похідне за п. 12, що відрізняється тим, що R5-R8 усі є гідроген.
14. Похідне за п. 12, що відрізняється тим, що R6 є гідроксильна група в положенні 7 кільця 1,2,3,4-тетрагідронафталіну, a R7 і R8 є гідроген.
15. Похідне за будь-яким із пп. 1-14, що відрізняється тим, що його використовують як лікарський засіб.
16. Фармацевтично придатна композиція, що містить похідне за будь-яким із пп. 1-14 і фармацевтично придатний носій.
17. Похідне за будь-яким із пп. 1-14, що відрізняється тим, що його використовують у лікуванні організму людини або тварини.
18. Похідне, визначене за будь-яким із пп. 1-14, для використання у лікуванні гіпертензії, глаукоми, хронічного та гострого болю, мігрені, діареї, застуди (нежиті), ішемії, звикання до хімічних речовин, тривоги, особливо передопераційної тривоги, і різних неврологічних, м'язово-кістякових, психічних і пов'язаних з пізнавальною здатністю порушень або як допоміжний засіб при анестезії.
19. Похідне за будь-яким із пп. 1-14, що відрізняється тим, що його використовують у виробництві лікарського засобу для застосування у лікуванні гіпертензії, глаукоми, хронічного та гострого болю, мігрені, діареї, застуди (нежиті), ішемії, звикання до хімічних речовин, тривоги, особливо передопераційної тривоги і різних неврологічних, м'язово-кістякових, психічних і пов'язаних з пізнавальною здатністю порушень.
20. Похідне, за будь-яким із пп. 1-14, що відрізняється тим, що його використовують у виробництві лікарського засобу для застосування як допоміжного засобу при анестезії.
21. Спосіб лікування гіпертензії, глаукоми, хронічного та гострого болю, мігрені, діареї, застуди (нежиті), ішемії, звикання до хімічних речовин, тривоги, особливо передопераційної тривоги і різних неврологічних, м'язово-кістякових, психічних і пов'язаних із пізнавальною здатністю порушень шляхом уведення суб'єкту, що потребує такого лікування, ефективної кількості похідного за будь-яким із пп. 1-14.
Текст
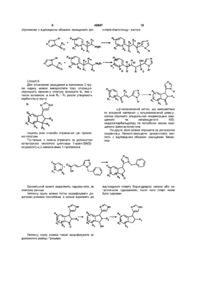
1 Похідне імідазолу, яке є сполукою формули NH , (І) Де п означає 0 або 1 Ri означає гідроген або Сі-С4-алкіл R2 означає гідроген або R2 і R3 разом утворюють подвійний зв'язок R3 означає гідроген або Сі-С4-алкіл, або R2 і R3 разом утворюють подвійний зв'язок R4 означає гідроген, Сі-С4-алкіл, гідроксильну групу або Сі-С4-алкоксильну групу Rs означає гідроген або Сі-С4-алкіл, або R4 і Rs разом із атомом карбону, з яким вони з'єднані, утворюють карбонільну групу F?6, R7 і Rs однакові або різні й позначають незалежно гідроген, Сі-С4-алкіл або С2-С4-алкеніл, С3-С7циклоалкіл, гідроксильну групу, Сі-С4-алкоксильну групу, Сі-С4-пдроксіалкіл, тіол, Сі-С4-алкілтюгрупу, Сі-С4-алкілтюл, галоген, трифлуорметил, нітрогрупу або необов'язково заміщену аміногрупу X означає -CHR9- (CHRio) m m означає 0 або 1, та Rg і R-іо однакові або різні й означають незалежно гідроген або Сі-С4-алкіл, або їх фармацевтично придатні естер або сіль 2 Похідне за п 1, що відрізняється тим, що n=m=0 3 Похідне за п 1 або 2, що відрізняється тим, що кожен із R6, R71 Rs є гідроген 4 Похідне за п 1 або 2, що відрізняється тим, що R6 є Сі-С4-алкіл у положенні 4 чи 6 кільця індану, а R71 Rs є гідроген 5 Похідне за п 1 або 2, що відрізняється тим, що R6 є Сі-С4-алкоксильна група в положенні 7 кільця індану, a R71 Rs є гідроген 6 Похідне за п 1, що відрізняється тим, що п=0 і т = 1 , і R3-R10 усі є гідроген 7 Похідне за п 1, що відрізняється тим, що п=1 і т=0 8 Похідне за п 7, що відрізняється тим, що Ri є метил або етил 9 Похідне за п 7 або 8, що відрізняється тим, що кожен із R6, R71 Rs є гідроген 10 Похідне за п 7 або 8, що відрізняється тим, що R6 є гідроксильна група в положенні 4 або 6 кільця індану, a R71 Rs є гідроген 11 Похідне за п 7 або 8, що відрізняється тим, що R6 є гідроксильна група в положенні 5 кільця індану, R7 є гідроксильна група або Сі-С4-алкіл або Сі-С4-пдроксіалкіл у положенні 6 кільця індану, Rs є гідроген 12 Похідне за п 1, що відрізняється тим, що n=m=1 13 Похідне за п 12, що відрізняється тим, що R5Rs усі є гідроген 14 Похідне за п 12, що відрізняється тим, що R6 є гідроксильна група в положенні 7 кільця 1,2,3,4тетрапдронафталшу, a R71 Rs є гідроген 15 Похідне за будь-яким із пп 1 -14, що відрізняється тим, що його використовують як лікарський засіб 16 Фармацевтично придатна композиція, що містить похідне за будь-яким із пп 1-14 і фармацевтично придатний носій 17 Похідне за будь-яким із пп 1 -14, що відрізняється тим, що його використовують у лікуванні організму людини або тварини О 00 49847 18 Похідне, визначене за будь-яким із пп 1-14, для використання у лікуванні гіпертензії, глаукоми, хронічного та гострого болю, мігрені, діареї, застуди (нежиті), ішемії, звикання до ХІМІЧНИХ речовин, тривоги, особливо передопераційної тривоги, і різних неврологічних, м'язово-кістякових, ПСИХІЧНИХ І пов'язаних з пізнавальною здатністю порушень або як допоміжний засіб при анестезії 19 Похідне за будь-яким із пп 1-14, що відрізняється тим, що його використовують у виробництві лікарського засобу для застосування у лікуванні гіпертензії, глаукоми, хронічного та гострого болю, мігрені, діареї, застуди (нежиті), ішемії, звикання до ХІМІЧНИХ речовин, тривоги, особливо передопераційної тривоги і різних неврологічних, м'язово кістякових, ПСИХІЧНИХ і повязаних з пізнавальною здатністю порушень 20 Похідне, за будь-яким із пп 1 -14, що відрізняється тим, що його використовують у виробництві лікарського засобу для застосування як допоміжного засобу при анестезії 21 Спосіб лікування гіпертензії, глаукоми, хронічного та гострого болю, мігрені, діареї, застуди (нежиті), ішемії, звикання до ХІМІЧНИХ речовин, тривоги, особливо передопераційної тривоги і різних неврологічних, м'язово-кістякових, ПСИХІЧНИХ І пов'язаних із пізнавальною здатністю порушень шляхом уведення суб'єкту, що потребує такого лікування, ефективної КІЛЬКОСТІ похідного за будь-яким із пп 1-14 Даний винахід відноситься до заміщених 4(5)(1 -інданіл, 1 -інданілметил та 1 -інданіл метилен)імідазолам і 4(5)-[1-(1,2,3,4-тетрапдронафтил, 1,2,3,4-тетрапдронафтилметил і 1,2,3,4тетрапдронафтилметилен]імідазолам та до їх ізомерів, фармацевтичне придатних солей і естерів Він ВІДНОСИТЬСЯ також до способу їх отримання, застосування і до вміщуючих їх фармацевтичних композицій Сполуки згідно з винаходом мають спорідненість відносно альфа2-рецепторів, причому більшість з них є дуже вибірковими альфа2агоністами Тому їх можна застосовувати у лікуванні гіпертензії, глаукоми, мігрені, діареї, ішемії, звикання до ХІМІЧНИХ речовин (таких як тютюн і наркотики) і різних неврологічних, м'язовоскелетних, психічних і пов'язаних з пізнавальною здатністю порушень, а також в якості седативних і аналгезуючих агентів, назальних проти застій них засобів і допоміжних засобів при анестезії Gregory G В , et аі описують в J Org Chem , (1990), 55, 1479 - 1483 нову стадію синтезу для похідних 1 -фенілалкіл-1 -(4-імідазоліл)-1,2,3, 4тетрапдронафталшу, які можна застосовувати як непептидні антагоністи рецептора ангіотензина II ПОХІДНІ імідазола згідно з винаходом являють собою або сполуки формули 1 Rs означає гідроген або Сі-С4-алкіл, або R4 і Rs разом з атомом карбону, з яким вони сполучені, утворюють карбонільну групу, F?6, R7 і Rs однакові або різні і означають незалежно гідроген, Сі-С4-алкіл або С2-С4-алкеніл, СзС7-циклоалкіл, гідрокси групу, С1-С4- алкоксигрупу, Сі-С4-пдроксіалкіл, тіол, Сі-С4-алкілтюгрупу, d С4-алкілтюл, галоген, трифлуорметил, нітрогрупу або необов'язково заміщену аміногрупу, X означає-CHRio-(CHRii)m m означає 0 або 1,а Rg і R-іо однакові чи різні і означають незалежно гідроген або Сі-С4-алкіл, або їх фармацевтичне придатнтй естер або сіль Терміни, що тут використано, мають такі значення Галоген являє собою хлор, бром або флуор, краще, хлор або флуор Групи Сі-С4-алкіл, С1-С4алкокси- і С2-С4-алкеніл і т п можуть бути групами з розгалуженим або нерозгалуженим ланцюгом Сз-С7-циклоалкіл являє собою насичену циклічну вуглеводневу групу, що має переважно 3-5 атомів карбону Необов'язково заміщена аміногрупа являє собою аміногрупу, яка є незаміщеною або заміщена Сі-С4-алкілом Коли m = n = 0 7. 1 в який п означає 0 або 1, Ri означає гідроген або Сі-С4-алкіл, F 2 означає гідроген, або F 2 і R3 разом утво? ? рюють подвійний зв'язок, F 3 означає гідроген, або Сі-С4-алкіл або F 2 і ? ? F 3 разом утворюють подвійний зв'язок, ? F 4 означає гідроген, Сі-С4-алкіл, гідрокси- або ? Сі-С4-алкокси групу, 4 З R3, бажано, гідроген, R4, бажано, гідроген, гідрокси- або С1-С4алкоксигруп, така, як етоксигрупа, Rs, бажано, є гідрогеном або R4 і Rs разом з атомом карбону, з яким вони сполучені, утворюють карбонільну групу, R6 бажано - гідроген, Сі-С4-алкіл, такий як метил, етил, трет-бугил, гідроксильна група або така Сі-С4-алкоксигрупа, як метоксигрупа Наприклад, R6 може бути таким Сі-С4-алкілом у положенні 4, 5 або 6, як 4-метил, 4-трет-бутил, 5-метил, 6-метил, 6-етил, 6-трет-бутил, 6-ізобутил, гідроксил в положенні 5 або положенні 7, або таким С1-С4алкоксилом у положенні 5, 6 або 7, як 5-, 6- або 7 49847 метоксил Бажаніше F?6 є гідрогеном, 4-метилом, 6метилом або 7-метоксилом R7, бажано, є гідрогеном, Сі-С4-алкілом, таким як, наприклад, метил або трет-бутил, гідроксильною групою або Сі-С4-алкоксилом, наприклад, метоксилом Наприклад, R7 може бути таким d С4-апкілом в положенні 5, б або 7, як 5-метил, 7метил, 6-трет-бутил, 7-пдроксил або 7-метоксил Бажаніше, R7 - гідроген Rs, бажано є гідрогеном, гідрокси групою або таким Сі-С4-алкоксилом, як метоксил Наприклад, R6 може бути 6-пдроксилом або 7-пдроксилом, таким Сі-С4-алкоксилом в положенні 6, як 6метоксил, Rg, бажано, є гідрогеном або метилом Коли п = 1 і m = 0 R1, бажано, є гідрогеном, метилом або етилом, R2, R31 R9, бажано - гідроген, R4 і Rs, бажано, є гідрогеном або метилом R6, бажано, є гідрогеном, Сі-С4-алкілом, таким як метил або трет-бутил, гідроксилом, С1-С4алкоксилом, таким як метоксил, або С1-С4пдроксіалкілом, таким як гідрокси метил, або галогеном Наприклад, R6 може бути Сі-С4-алкілом в положенні 4 або 5, таким як 4- або 5-метил, або 4або 5-трет-бутил, 4-, 5-, 6- або 7-пдроксилом, d С4-алкоксилом у положенні 5, 6 або 7, таким як 5-, 6- або 7-метоксил, або Сі-С4-гщроксіалкшом у положенні 5, таким як 5-пдроксиметил R6 може бути галогеном в положенні 5 або 6, таким як 5- чи 6флуор, або 5- чи 6-бром Бажаніше R6 є 4-, 5- або 6-пдроксильною групою R7, бажано, переважно є гідрогеном, С1-С4алкілом, гідроксильною групою, С-і-С4-алкоксі, С г С4-пдроксіалкілом або галогеном Наприклад, R7 може бути Сі-С4-алкілом в положенні 5, 6 або 7, таким як 5- або 7-метил або 5- або 6-трет-бутил, 5або 6-пдроксі або Сі-С4-алкоксі в положенні 6, таким як 6-метоксі, Сі-С4-пдроксіалкілом в положенні 6, таким як 6-пдроксиметил, або галогеном в положенні 5, таким як 5-бром Бажаніше R7 є гідрогеном, 6-трет-бутил ом, 6пдрокси або 6-пдроксиметилом Rs, бажано, є гідрогеном, Сі-С4-алкілом, гідроксильною чи Сі-С4-алкоксильною групою або галогеном, наприклад, Сі-С4-алкілом в положенні 7, таким як 7-метил або 7-трет-бугил, 6- або 7пдроксилом або Сі-С4-алкоксилом у положенні 6, таким як 6-метоксил, або галогеном в положенні 7, таким як 7-бром Особливо бажано, коли R6 є гідроксильною групою у положенні 4 або б кільця індану, a R7 і Rs є гідрогеном або R6 є гідроксильною групою у положенні 5 кільця ждану, a R7 є гідроксильною групою, Сі-С4-алкілом або Сі-С4-пдроксіалкілом у положенні 6 кільця індану, таким як 6-трет-бутил або 6-пдроксиметил, a Rs є гідрогеном Коли n = m = таким як, наприклад, метил R6, бажано, знаходиться в положенні 5, 6 або 7 R6, бажано, є гідрогеном, гідроксильною групою, Сі-С4-алкоксилом, наприклад, метоксилом, або галогеном Наприклад, R6 може бути 5-, 6- або 7-метоксилом, 6- або 7-пдроксиломабо галогеном в положенні 6, таким як 6-бром R7, бажано, знаходиться в положенні 7 R7, бажано, є гідрогеном або Сі-С4-апкілом, таким як, наприклад, 1-трет-бутил, або 7пдроксилом Rs, бажано, знаходиться в положенні 8 Rs, бажано, є гідрогеном або галогеном, таким як 8-бром Коли п = 0 і m = 1 R1, R2, R3, R5, R91 Rio, бажано, є гідрогеном R6, бажано, є гідрогеном або галогеном, наприклад, хлором R6 може бути галогеном в положенні 5, таким як, наприклад, 5-хлор Даний винахід включає в свої рамки всі можливі ізомери і стереоізомери, зокрема, Z і Е (цис- і транс-ізомери) і енантюмери Сполуки формули (1) утворюють солі приєднання кислот як з органічними, так і з неорганічними кислотами Типовими солями приєднання кислот є хлориди, броміди, сульфати, нітрати, фосфати, сульфонати, форміати, тартрати, малеати, цитрати, бензоати, саліцилати, аскорбати Крім того, сполуки, в яких один або кілька R4-R8 являють собою пдроксигрупу, утворюють естери і солі з лужними і лужноземельними металами Типові естери включають нижчі алкілові естери, такі як метиловий, етиловий і пропіловий естери Сполуки згідно з винаходом можуть бути отримані за допомогою наступних способів (Потрібно визначити, що у нижченаведених формулах, коли імідазольна група є захищеною, захисна група R' (бензил або тритил) може бути приєднана до будь-якого з двох атомів азоту імідазольного кільця ВІДПОВІДНО ДО ЦЬОГО, використання 1 бензил-5-імідазолкарбальдепда як вихідної речовини призводить до 1,5-заміщених похідних, тоді як у разі використання тритила заміщення має місце в основному в 1,4-положеннІ) Синтез 4(5)-(1-шданіл)імідазолів і ВІДПОВІДНИХ 4 (5)-[1-(1,2,3,4-тетрапдронафтил)]імідазолів Спосіб а Сполуки формули 1, де п = 0, а ш = 0 або 1, можуть бути отримані каталізуємою кислотою циклізацією захищених або незахищених 4(5)-(1пдрокси-3-фенілпропіл-або 1-пдрокси-4фенілбутил)імідазолів формул II і ІГ ВІДПОВІДНО Таким чином, 4(5)-{1-шданіл)імідазоли можуть бути отримані циклізацією сполук формули II 8 S А Ri, R2, R3, R5, R91 Rio, бажано, є гідрогеном, R4, бажано, є гідрогеном або Сі-С4-алкілом, де R3-R9 мають дані вище зазначення, a R' є захисною групою, у присутності кислоти з утворенням сполук формули III 49847 де заступники мають дані вище зазначення, і видаленням захисної групи R' з отриманням сполук формули І а ВІДПОВІДНІ 4(5)-[1-(1,2,3,4-тетрапдронафтил)] імідазоли можуть бути отримані циклізацією сполуки ІГ де R3-R10 мають дані вище зазначення, a R' є захисною групою, у присутності кислоти з утворенням сполук формули ІІГ де заступники мають дані вище зазначення, і видаленням захисної групи R' з отриманням сполук формули Іа' де заступники мають дані вище зазначення Захисна група R' може бути, наприклад, бензилом або тритилом Коли R' є тритилом, його можна видалити за допомогою кислоти, а коли захисна група є бензилом, його можна видалити каталітичним гідруванням Кислотою, що використовують у реакції циклізації, може бути, наприклад, поліфосфатна (ПФК) або метансульфонова кислота ВИХІДНІ матеріали (сполуки формул II і ІГ, ВІДПОВІДНО) можуть бути синтезовані за допомогою різних способів Один з них полягає в отриманні а,р-ненасичених кетонів через альдольну конденсацію, при реакції імідазолілалкілкетона з ВІДПОВІДНИМ образом заміщеним бензальдегідом у присутності основи Супутнє відновлення карбонілу і подальше каталітичне гідрування дають насичені спирти, що використовують у циклізації Відновлення карбонільної групи можна провести, наприклад, з використанням боропдриду натрію Якщо імідазольний залишок заміщено бензильною групою, вона також може бути видалена каталітичним гідруванням Для здійснення заміщення в положенні 1 кіль ця індана або 1,2,3,4-тетрапдронафталіна можна провести реакцію 1,2-приєднання проміжного кетону з нуклеофілом перед гідруванням Це зручно виконувати за допомогою реакції Гріньяра, яку проводять додаванням до реакційної суміші алкілмагнійгалогеніду, наприклад, броміду, отриманого з алкіл галоген іду і магнію Іншим придатним способом для отримання спиртів, необхідних як вихідних матеріалів при циклізації, є використання реакції Гріньяра при отриманні 4(5)-(1-пд-роксифенілалкіл)імідазолів У цьому випадку 4(5)-імідазолкарбальдепд або кетон уводять у взаємодію з реактивом Гріньяра, 9 отриманим з ВІДПОВІДНИМ образом заміщеного фе 49847 10 нілалкілгалогеніду і магнію Спосіб б Для отримання заміщення в положенні 3 групи індану можна використати таку операцію отримують проміжну сполуку формули ІЬ, яка є також активною, в якій R4 і Rs разом утворюють карбонільну групу о Існують різні способи отримання цієї проміжної сполуки По-перше, и можна отримати за допомогою каталізуємої кислотою циклізації 1-арил-3[4(5)імідазоліл]-а,р-ненасичених-1-пропанонів 8 Бензильний захист видаляють гідруванням, як описано раніше Кетонну групу можна потім модифікувати додатково різними способами, її можна відновити до Кетонну групу можна також модифікувати за допомогою реакції Гріньяра s О а,р-ненасичений кетон, що використано як вихідний матеріал у вищезазначеній реакції, можна отримати альдольною конденсацією заміщеного чи незаміщеного 4(5)імідазолкарбальдепду та потрібним чином заміщеного фенілалкілкетона По-друге, його можна отримати за допомогою конденсації бензил-заміщеної уроканшової кислоти з ВІДПОВІДНИМ образом заміщеним бензолом О ВІДПОВІДНОГО спирту боропдридом натрію або каталітичним гідруванням, після чого спирт може бути пдрован 49847 11 12 отримані з ВІДПОВІДНОГО спирту у концентрованій СОЛЯНІЙ КИСЛОТІ • он « Ці сполуки можуть бути потім перетворені у сполуки формули І, де n = m = 0, F?4 є алкілом, a Rs є гідрогеном, каталітичним гідруванням, як описано вище Сполуки формули ІЬ, в яких R4 являє собою алкоксил, a Rs являє собою гідроген, можуть бути Синтез 4{5)-(шдан-І-ілметил)імідазолів і 4(5){шдан-1-ілметилен)імідазолів і ВІДПОВІДНИХ тетрапдронафтильных похідних Спосіб г Отримання 4(5)-(шдан-1 -ілметил)- і індан-1 ілметилен)-імідазола і відповідної тетрапдронафтильної структури може бути виконано за допомо N C V Спосіб в Наступний спосіб синтезу 4(5)-(1шданіл)імідазолів формули І полягає у використанні літійованого імідазола в реакції ароматичного електрофільного заміщення з 1-шданоном (ІМІдазолом, який біс-захищено згідно зі способом, описаним Kudzma et al, in Synthesis, (1991), р 1021) Захист може бути видалено обробкою кислотою, яка індукує одночасну втрату води Подвійний зв'язок відновлюють каталітичним гідруванням, як описано вище гою так званої реакції McMurry, в якій імідазолкарбальдепд або -кетон взаємодіє з 1-шданоном Ця реакція каталізується титаном низької валентності Після конденсації може слідувати гідрування подвійного зв'язку і одночасне елімінування захисної групи в імідазольному КІЛЬЦІ l M RT Сполуки згідно з винаходом можна уводити ентерально, місцеве або парентерально Парентеральне введення використовують, наприклад, коли сполуки надають в якості седативних або транквілізуючих агентів у зв'язку з різними КЛІНІЧНИМИ операціями і для аналгезії або посилення анестезії Сполуки згідно з винаходом можуть бути приготовані окремо або разом з іншим активним інгредієнтом та/або фармацевтичне придатним розріджувачем або носієм у вигляді фармацевтичних форм з різними одиничними дозами, наприклад, таблеток, капсул, розчинів, емульсій, порошків тощо, за допомогою загальноприйнятих способів Фармацевтичні носи, які застосовують, вибирають з огляду на передбачуваний спосіб уведення Так, тверді носи включають лактозу, сахарозу, желатин і агар, тоді як рідкі носи звичайно включають воду, сироп, арахісове і оливкове масло КІЛЬКІСТЬ активного інгредієнту варіює від 0,01 до 75масс % в залежності від типу лікарської форми Відповідна пероральна доза для сполук згідно з винаходом залежить від декількох таких чинників, як конкретна сполука, яку вводять, вигляд, вік і стать підлягаючого лікуванню суб'єкта, стан і спосіб уведення ВІДПОВІДНО, доза для парентерального введення звичайно дорівнює від 0,5мкг/кг до 10мг/кг на добу, а доза для перорального введення - від 5мкг/кг до 100мг/кг для дорослої особі чоловічої статі Запропоновано також сполуку згідно з винаходом або її естер чи сіль для використання в способі лікування людини або тварини Запропоновано також сполуку згідно з винаходом або и естер чи сіль для використання в лікуванні гіпертензії, глаукоми, хронічного і гострого болю, мігрені, діареї, простуди (нежиті), ішемії, звикання до ХІМІЧНИХ речовин, тривоги, особливо доопераційної тривоги, і різних неврологічних м'язово-скелетних, психічних і пов'язаних з пізнавальною здатністю порушень, або як допоміжної добавки для анестезії Запропоновано також використання сполуки згідно з винаходом або и естеру чи солі при приготуванні лікарського засобу для лікування гіпертензії, глаукоми, хронічного і гострого болю, мігрені, діареї, простуди (нежиті), ішемії, звикання до ХІМІЧНИХ речовин, тривоги, особливо доопераційної тривоги, і різних невроло 14 13 49847 пчних м'язово-скелетних, психічних і пов'язаних з ЗО хвилин інкубації при 25°С проби фільтрували пізнавальною здатністю порушень або як допоміжчерез фільтр зі скляного волокна і фільтри тричі ної добавки при анестезії промивали по 4 мл охолодженого льодом буфера для промивки, що складається з ЮмМ Трис-НСІ, Крім того, винахід відноситься до способу лірН 7,7 Потім фільтри сушили, просочували сцинкування гіпертензії, глаукоми, хронічного і гострого тиляційною сумішшю і підраховували в сцинтиляболю, мігрені, діареї, простуди (нежиті), ішемії, ційному лічильнику Експериментальні дані аналізвикання до ХІМІЧНИХ речовин, тривоги, особливо зували з використанням комерційної комп'ютерної доопераційної тривоги, і різних неврологічних м'япрограми нелінійних найменших квадратів зово-скелетних, психічних і пов'язаних з пізнаваLIGAND льною здатністю порушень шляхом введення суб'єкту, потребуючому такого лікування, ефективної Кожну сполуку випробовували, щонайменше, у КІЛЬКОСТІ сполуки даного винаходу або и фармацетрьох незалежних експериментах на и спорідневтичне придатного естеру чи солі ність до аг або ои-адренорецепторів неокортексу пацюка Результати наведено у Таблиці 2 Результати випробувань 1 Альфа2-агонізм в щурячій моделі СІМ'ЯВИВІдного протоку пацюка Таблиця 2 Альфа2-агонізм визначали із застосуванням виділених, електрично стимульованих частин проСпорідненість до аг або ои-адренорецепторів стати препарата СІМ'ЯВИВІДНОГО протоку пацюка неокортекса пацюка (Virtanen et al Arch Int Phar-macodyn et Ther, 297 (1989), pp 190 - 204) У цій моделі альфа2-агоніст аг-селективність здатний інгібувати м'язові скорочення, що електСполуки рКіои проти рКі(Х2 рично індукуються активацією пресинаптичних ои-селективності альфа2-адренорецепторів і зменшенням, таким 1 8 44 7 31 14 чином, секреції на моторному трансмітері Відомий 2 8 70 6 61 126 альфа2-агоніст дексмедетомідин використали як 3 8 35 6 21 142 еталонну речовину Результати показані в таблиці 4 7 39 6 85 3 1, де альфа2- агоністический ефект представлено у вигляді величини pD2 (негативне логарифма 5 8,42 6,48 90 молярної концентрації сполуки, що дає 50% від максимальне інгібування) Були перевірені такі Наступні приклади ілюструють отримання спосполуки лук згідно з винаходом Приклад 1 4-(6-Трет-бутилшдан-1 -іл)-1 Н1 Гідрохлорид 4-(4-метилшдан-1 -іл)-1 Німідазол імідазола а) 3-(4-Трет-бутилфеніл)-1 -(1 Н-імідазол-4-іл)2 Гідрохлорид 3-(1 Н-імідазол-4-ілметил)пропан-1-ол шдан-5-ола Розчин 4-трет-бутилбензальдепду (5,7г), 1-(33 Гідрохлорид 4-[1 -(індан-1 -іл)-етил]-1 Нбензил-ЗН-імідазол-4-іл)етанону (7,0г) і 48% гідроімідазола ксид натрію (2,0мл) у метанолі (60мл) нагрівають 4 Гідрохлорід 8-(1 Н-імІдазол-4-ілметил)при 60 - 65°С протягом 11 годин Потім реакційну 5,6,7,8-тетрапдронафталш-2-ола суміш охолоджують на льодяній бані Отриманий 5 Дексмедетомідин (еталонна сполука) осад відфільтровують і твердий проміжний продукт 1-{3-бензил-ЗН-імідазол-4-іл)-3-(4-грегТаблиця 1 бутилфеніл)-пропен-1-он промивають метанолом Вихід 10,0Г Альфа2-агонізм in vitro Проміжний продукт розчиняють в суміші етанолу (170мл) і концентрованої соляної кислоти Сполуки Величина pD2 (Змл) Реакційну суміш пдруют при 50 - 60°С з па1 8,1 ± 0 , 2 ладієм на вугіллі як каталізатором до припинення 2 8,5 ± 0 , 1 споживання водню Суміш фільтрують і фільтрат 3 8,9 ± 0 , 3 випаровують досуха Залишок розчиняють у воді і 4 7,0 ± 0 , 1 підлужують гідроксидом натрію Потім продукт 5 8,4 ± 0 , 1 екстрагують метиленхлоридом, який промивають водою, сушать сульфатом натрію і випаровують 2 Тести зв'язування досуха Продукт перетворюють в його пдрохлориСПОРІДНЄНІСТЬ ПО ВІДНОШЄННІЮ ДО (Х2дну сіль в етилацетаті з застосуванням сухого адренорецепторів і ои-адренорецепторів оцінювахлороводню Вихід 6,8М ли визначенням витіснення 1 нМ 3H-RX821002 (0,2) 1 Н ЯМР (как соль НСІ, MeOH-d4) 1 29 (с, 9Н), або 0,1 нМ 3Н-празосину (ои) з а-адренорецепторів 2 06-2 13 (м, 2Н), 2 62-2 78 (м, 2Н), 4 77 {т, 1Н), у мембранах неокортексу пацюка Для цієї мети 7 13(м, 2Н), 7 30(м, 2Н), 7 40 (с, 1Н), 8 79 (с, 1Н) мембрани шкубували з різними концентраціями б) 4-(6-Трет-бугилшдан-1 -іл)-1 Н-імідазол сполук, які тестують, що знаходяться в діапазоні Суміш 3-(4-трет-бугилфеніл)-І-(1Н-імідазол-4концентрацій п'яти порядків величин Неспецифічіл)-пропан-1-ола (2,0г) і метансульфонової кислоти не зв'язування визначали з 10 мкМ фентоламіном (ЗОмл) нагрівають при 60°С протягом 5 хвилин Мембрани використовували при концентрації білка Потім реакцію гасять вилиттям суміші у воду з 2мг/мл в загальному об'ємі 250мкл Буфер для льодом Кислий розчин підлужують розчином гідінкубації складався з 50мМ Трис-НСІ, рН 7,7 Після 15 4-(5,7-Диметоксмндан-1-іл)-1Н-імідазол 1 Н Я М Р (як сіль НСІ, MeOH-d 4 ) 2 09-2 20 (м, 1Н), 2 52-2 65 (м, 1Н), 2 87-3 11 (м, 2Н), 3 69 (с, 1Н), 3 78 (с, 1Н), 4 49-4 54 (м, 1Н), 6 37 (с 1Н), 6 50 (с, 1Н), 7 08(с, 1Н), 8 73(с, 1Н) Приклад 2 4-(1-Метилшдан-1-іл)-1Н-імідазол а) 2-(3-Бензил-ЗН-імідазол-4-іл)-4-фенілбутан 16 2-ол 1,0г магнійових стружок заливають 5мл сухого тетрапдрофурана До цієї суміші додають 7,8г (2брометил)бензолу в ЗОмл сухого тетрапдрофурану при такій швидкості, що підтримується рівна реакція Потім суміш нагрівають зі зворотним холодильником протягом 1 години Після охолодження до кімнатної температури додають по краплях 3,0г 1-(3-бензил-ЗН-імідазол-4-іл)-етанолу в 20мл тетрапдрофурану до реактиву Гріньяра і реакційну суміш нагрівають зі зворотним холодильником протягом 1 години Охолоджену реакційну суміш виливають в холодний розбавлений розчин соляної кислоти Обробка цієї суміші дає неочищений продукт, який перекристалізовують з етилацетату Вихід 3,3Г 49847 роксиду амонію і екстрагують етилацетатом Об'єднані органічні шари промивають водою, сушать сульфатом натрію і випаровують досуха при зниженому тиску Неочищений продукт очищають флеш-хроматографією, з елююванням сумішшю метиленхлорид-метанол Продукт кристалізують з етилацетату Вихід 220мг 1 Н ЯМР (MeOH-d4) 1 24 (с, 9Н), 2 07-2 20 (м, 1Н), 2 43-2 54 (м, 1Н), 2 81-3 01 (м, 2Н), 4 35 (т, 1Н), 6 74 (с, 1Н), 7 09 (cs, 1Н), 7 14-7 21 (м 2Н), 7 60 (с, 1Н) Тим же способом отримували наступні сполуки 4-(Індан-1-іл)-1Н-імідазол 1 НЯМР(СОСІ 3 ) 2 08-2 19 (м, 1Н), 2 41-2 51 (м, 1Н), 2 80-2 95 (м, 2Н), 4 37 (т, 1Н), 6 65 (с, 1Н), 7 07-7 21 (ш, 4Н) 7 25(с, 1Н) 4-(4-метилшдан-1 -іл)-1 Н-імідазол Т пл пдрохлориду153 - 156°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 2 08-2 20 (м, 1Н), 2 30 (cs, ЗН), 2 58-2 69 (м, 1Н), 2 87-3 10 (м, 2Н), 4 59 (т, 1Н), 6 89 (д, J=7 0 Гц, 1Н), 7 05-7 13 (м, 2Н), 7 30(с, 1Н), 8 83(с, 1Н) 4-(6-Метилшдан-1-іл)-ІН-імідазол 1 ЯМР (як сіль НСІ, MeOH-d4) 2 07-2 20 (м, 1Н), 2 28 (с, ЗН), 2 55-2 66 ( т , 1Н), 2 89-3 08 (м, 2Н), 4 53(т, 1Н), 6 88(с, 1Н), 7 06 (д, J=7 8 Гц, 1Н), 7 19 (д, J=7 8 Гц, 1Н), 7 ЗО (с, 1Н), 8 79 (с, 1Н) 4-(6-етилшдан-1 -іл)-1 Н-імідазол 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 17 (т, ЗН), 2 08-2 21 (м, 1Н), 2 55-2 67 (м, ЗН), 2 90-3 10 (м, 2Н), 4 56 (т, 1Н), 6 91 (с, 1Н), 7 08 (д, J=7 7 Гц, 1Н), 7 22 (д, J=7 7 Гц, 1Н), 7 32 (с, 1Н), 8 85 (с, 1Н) 4-(4,5-Диметилшдан-1 -іл)-1 Н-імідазол Т -пл пдрохлориду 161 - 164°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 2 06-2 18 (м, 1Н), 2 22 (с, ЗН), 2 26 (с, ЗН), 2 56-2 68 (м, 1Н), 2 87-3 11 (м, 2Н), 4 55 (т, 1Н), 6 78 (д, J=7 6 Гц, 1Н), 6 99 (д, J=7 6 Гц, 1Н), 7 27 (с, 1Н), 8 80 (с, 1Н) 4-(5,7-Диметілшдан-1 -іл)-1 Н-імідазол 1 Н ЯМР (СОСІз) 2 07 (с, ЗН), 2 07-2 22 (т, 1Н), 2 31 (s, ЗН), 2 40-2 53 (м, 1Н), 2 77-2 87 (т, 1Н), 2 94-3 05 (м, 1Н), 4 44 (м, 1Н), 6 55 (с, 1Н), 6 80 (с, 1Н), 6 94(с, 1Н), 7 53(с, 1Н) 4-(2,4-Диметилшдан-1 -іл)-1 Н-імідазол 1Н ЯМР (CDCI3) 1 23 (д, ЗН) 2 28 (с, ЗН), 2 46-2 55 (м, 2Н), 3 05-3 16 (м, 1Н), 3 92 (д, 1Н), 6 81 -6 83 (м, 2Н), 6 95-7 09 (м, 2Н), 7 56 (с, 1Н) 4-(5-Метоксмндан-1-іл)-1Н-імідазол Т пл 180 184 °С 1 Н ЯМР (COCI3+MeOH-d4) 2 09-2 19 (м, 1Н), 2 48-2 59 (м, 1Н), 2 87-2 98 (м, 2Н), 3 79 (с, ЗН), 4 35 (т, 1Н), 6 69-6 73 (м, 2Н), 6 82 (д, J=2 0 Гц, 1Н), 7 03 (д, J=8 2 Гц, 1Н), 7 53 (с, 1Н) 4-(7-Метоксмндан-1 -іл)-1 Н-імідазол 1 ЯМР (CDCI3) 2 20-2 50 (м, 2Н), 2 83-2,98 (м, 2Н), 3 82 (sc, ЗН), 4 50-4 54 (м, 1Н), 6 66-6 72 (м, 2Н), 6 86 (д, J=7 7 Гц, 1Н), 7 16 (т, J=7 7 Гц, 1Н), 7 43 (с, 1Н) 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 67 (с, ЗН), 2 01 -2 08 (мт, 2Н), 2 37-2 48 (м, 1Н), 2 57-2 71 (м, 1Н), 5 75 (дд, 2Н), 6 97-7 42 (м, 10Н), 7 50 (с, 1Н), 8 75 (с, 1Н) б) 2-(1 Н-імідазол-4-іл)-4-фенілбуган-2-ол 3,3г 2-(3-бензил-ЗН-імідазол-4-іл)-4фенілбутан-2-ола розчиняють в ЮОмл етанолу Реакційний розчин гідрують при 50°С з 10% паладієм на вугіллі як каталізатором протягом 4,5 годин Обробка цієї реакційної суміші дає неочищений продукт, який перекристалізовують з етилацетату, Вихід 2,0м 1 ЯМР (MeOH-d4) 1 56 (с, ЗН), 2 01-2 13 (м, 2Н), 2 37-2 47 (м, 1Н), 2 53-2 64 (м, 1Н), 6 96 (с, 1Н), 7 07-7 13 (м, ЗН), 7 18-7 23 (м, 2Н), 7 61 (с, 1Н) в) 4-(1 -Метилшдан-1 -іл)-1 Н-імідазол Суміш 2-(1 Н-імідазол-2-іл)-4-фенілбутан-2-ола (0,5г) і метансульфонової кислоти (12мл) нагрівають при 100°С протягом 35 хвилин Охолоджену реакційну суміш виливають у воду і підлужують розчином гідроксиду натрію Продукт екстрагують етилацетатом, який промивають водою, сушать сульфатом натрію і випаровують при зниженому тиску Продукт перетворюють в його пдрохлоридну сіль в етилацетаті з використанням сухого хлороводню Вихід 387мг, т пл 164-171 °С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 67 (с, ЗН), 2 21-2 30 (м, 1Н), 2 40-2 50 (м, 1Н), 2 96-3 1 1 (м, 2Н), 7 06-7 33 (м, 5Н), 8 84 (с, 1Н) Приклад 3 4-(5хлор-1,2,3,4тетрапдронафталш-1-іл)-1Н-імідазол а) 4-(2-Хпорфеніл)-1 -(1 Н-імідазол-4-іл)-бутан1-ол 3,3г магнійової стружки заливають 40мл сухого тетрапдрофурану До цієї суміші додають 32,0г 1(3-бромпропіл)-2-хлорбензолу (отриманого згідно Ваддаг, FG et аі„ J Chem Soc , 1959, 1027) в ЮОмл сухого тетрапдрофурану з такою швидкістю, щоб підтримувати рівну реакцію Коли магнійові стружки прореагували, розчин охолоджують до кімнатної температури Потім додають по краплях 4,3г імідазол-4-карбальдепду в 40мл сухого тетрапдрофурану до реактиву Гріньяра і реакційну суміш нагрівають зі зворотним холодильником протягом 1 години Охолоджену реакційну суміш виливають в холодний розбавлений розчин соляної кислоти Тетрапдрофуран відганяють при зниженому тиску і залишок охолоджують Отриманий залишок фільтрують і промивають водою Неочищений продукт перекристалізовують з етанолу 17 49847 Вихід 8,0м Т пл пдрохлоридної солі 152 - 154°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 65-1 91 (м, 4Н), 2 80 (т, 2Н), 4 82, (т, 1Н), 714-7 35 (м, 4Н), 7 40(с, 1Н), 8 83(с, 1Н) б) 4-(5-Хлор-1,2,3,4-тетрапдронафталш-1-іл)1Н-імідазол Суміш пдрохлориду 4-(2-хлорфеніл)-1 -(1Німідазол-4-іл)-буган-1-ола (1,0г) і метансульфоновоі кислоти (15мл) нагрівають при 100°С протягом 2 годин Охолоджену реакційну суміш виливають у воду і підлужують розчином гідроксиду натрію Продукт екстрагують етилацетатом, який промивають водою, сушать сульфатом натрію і випаровують при зниженому тиску Неочищений продукт перекристалізовують з етилацетату Вихід 0,4г, тпл, 165-169°С 1 Н ЯМР (CDCI3) 1 74-1 83 (м, 2Н), 1 95-2 15 (м, 2Н), 2 70-2 91 (м, 2Н), 4 19 (т, 1Н), 6 49 (с, 1Н), 6 96-7 05 (м, 2Н), 7 21 -7 24 (м, 1Н), 7 54 (с, 1Н) Приклад 4 4-(1,2,3,4-Тетрапдронафталш)-1 Німідазол 4-(5-Хлор-1,2,3,4-тетрапдронафталш-1-іл)-1Німідазол (ЗООмг) розчиняють в етанолі (15мл) Реакційний розчин гідрують при 50°С з 10% паладієм на вугіллі як каталізатором протягом 8 годин Суміш фільтрують для видалення каталізатора і фільтрат випаровують при зниженому тиску Залишок розчиняють у воді і підлужують розчином гідроксиду натрію Продукт екстрагують метиленхлоридом, який промивають водою, сушать сульфатом натрію і випаровують при зниженому тиску Неочищений продукт перекристалізовують з етилацетату Вихід 169мг, т пл 105-110°С 1 Н ЯМР (СОСІз) 1 70-1 85 (м, 2Н), 2 05-2 11 (м, 2Н), 2 78-2 86 (м, 2Н), 4 21 (т, 1Н), 6 59 (с, 1Н), 7 04-7 14 (м, 4Н), 7 52(с, 1Н) Приклад 5 3-(1 Н-імідазол-4-іл)-5ізобутилшдан-1 -ол а) 3-(3-Бензил-ЗН-імідазол-4-іл)-1 -(4ізобутилфеніл)-пропен-1 -он Розчин 4-ізобутилацетофенону (2,0г), 3бензил-ЗН-імідазол-4-карбальдепду (2,1г) і 48% гідроксиду натрію (0,65мл) у метанолі (20мл) нагрівають при 55 - 60°С протягом 6 годин Потім реакційну суміш охолоджують на льодяній бані Отриманий осад фільтрують і промивають метанолом Виход 2,5 г 1 Н ЯМР (CDCI3) 0 91 (д, 6Н), 1 85-1 95 (м, 1Н), 2 54 (д, 2Н), 5 28 (с, 2Н), 7 12-714 (м, 2Н), 7 23 (д, J=8 2 Гц 2Н), 7 30-7 41 (м, 4Н), 7 60-7 68 (м, ЗН), 7 80 (д, J=8 2 Гц, 2Н) б) 3-(3-Бензил-ЗН-імідазол-4-іл)-5ізобутиліндан-1-он Суміш 3-(3-бензил-ЗН-імідазол-4-іл)-1-(4ізобутилфеніл)-пропен-1-она (2,4г) і метансульфонової кислоти (40мл) нагрівають при 120°С протягом 40 хвилин Обробка цієї реакційної суміші дає неочищений продукт, який очищають флешхроматографією з елююванням розчином метиленхлорид-метанол Вихід 0,5 г 1 Н ЯМР (CDCI3) 0 89 (д, 6Н), 1 81-1 91 (м, 1Н), 2 34 (дд, J=18 8 Гц, J=4 0 Гц, 1Н), 2 51 (д, 2Н), 2 80 (дц, J=18 8 Гц, J=7 9 Гц, 1Н), 4 44-4 48 (м, 1Н), 5 03-5 16 (м, 2Н), 6 64 (с, 1Н), 7 05-7 08 (м, 2Н), 7 13 (с, 1Н), 7 22 (д, J=7 8 Гц, 1Н), 7 26-7 39 (м, ЗН), 7 57 (с, 1Н), 7 68 (д, J=7 8 Гц, 1Н) 18 в) 3-(1 Н-1М1дазол-4-1л)-5-13обутилшдан-1 -ол 3-(3-Бензил-ЗН-імідазол-4-іл)-5-ізобутиліндан1-он розчиняють в етанолі (15мл) Реакційний розчин гідрують при 50°С з 10% паладієм на вугіллі як каталізатором до припинення споживання водню Суміш фільтрують для видалення каталізатора і фільтрат випаровують при зниженому тиску Неочищений продукт містить цис- і транс-ізомери Ізомери очищають флеш-хроматографією 1 Н ЯМР (цис-ізомер, CDCI3) 0 85 (д, 6Н), 1 741 84 (м, 1Н), 2 15-2 20 (м, 1Н), 2 40 (д, 2Н), 2 692 79 (м, 1Н), 4 33 (д, 1Н), 5 16 (д, 1Н), 6 91 (с, 1Н), 6 93 (с, 1Н), 7 02 (д, J=7 7 Гц, 1Н), 7 39 (д, J=7 7 Гц, 1Н), 7 42 (с, 1Н) 1 Н ЯМР (транс-ізомер, CDCI3) 0 85 (д, 6Н), 1 74-1 84 (м, 1Н), 2 35-2 46 (м, 4Н), 4 60 (т, 1Н), 5 26 (т, 1Н), 6 65 (с, 1Н), 6 95 (с, 1Н), 7 04 (д, J=7 7 Гц, 1Н), 7 33 (д, J=7 7 Гц, 1Н), 7 46 (с, 1Н) Приклад 6 3-(1 Н-імідазол-4-іл)-5-метокси-6,7диметилшдан-1-он а) 3-(3-Бензил-ЗН-імідазол-4-іл)-5-метокси-6,7диметилшдан-1-он Суміш 2,3-диметиланізола (2,0г), 3-(3-бензилЗН-імідазол-4-іл)-акриловоі кислоти (3,4г) і метансульфонової кислоти (60мл) нагрівають при 90 95°С протягом 45 хвилин Охолоджену реакційну суміш виливають у воду і підлужують розчином гідроксиду натрію Продукт екстрагують етилацетатом, який промивають водою, сушать сульфатом натрію і випаровують при зниженому тиску Неочищений продукт очищають флешхроматографією з елююванням розчином метиленхлорид-метанол Вихід 1,1г 1 Н ЯМР (CDCI3) 2 13 (с, ЗН), 2 35 (дд, J=18 5 Гц, J=4 1 Гц, 1Н), 2 61 (с, ЗН), 2 81 (дд, J=18 5 Гц, J=8 2 Гц, 1Н), 3 76 (с, ЗН), 4 34-4 38 (м, 1Н), 5 05 (с, 2Н), 6 52 (с, 1Н), 6 72 (с, 1Н), 7 00-7 05 (м, 2Н), 7 29-7 36 (м, ЗН), 7 56 (с, 1Н) б) 3-(1Н-імідазол-4-іл)-5-метокси-6,7диметилшдан-1-он 3-(3-Бензил-ЗН-імідазол-4-іл)-5-метокси-6,7диметилиншдан-1-он (1,1 г) розчиняють в етанолі (90мл) Реакційний розчин гідрують при 50 - 55°С з 10% паладієм на вугіллі як каталізатором протягом 7 годин Суміш фільтрують для видалення каталізатора і фільтрат випаровують при зниженому тиску Продукт перетворюють в його пдрохлоридну сіль в етилацетаті з використанням сухого хлороводню Вихід 0,6г, т пл 258-261 °С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 2 16 (с, ЗН), 2 62 (с, ЗН), 2 68 (дд, J=18 7 Гц, J=4 0 Гц, 1Н), 3 18 (дд, J=18 7 Гц, J=8 3 Гц, 1Н), 3 87 (с, ЗН), 4 77-4 81 (м, 1Н), 6 81 (с, 1Н), 7 43 (с, 1Н), 8 85 (с, 1Н) За допомогою того ж способу отримували наступну сполуку 3-(1Н-імідазол-4-іл)-5-метокси-4,7диметилшдан-1-он 1 Н ЯМР (CDCI3) 1 96 (с, ЗН), 2 64 (дд, J=18 6 Гц, J=2 1 Гц, 1Н), 2 65 (с, ЗН), 3 13 (дд, J=18 6 Гц, J=8 4 Гц, 1Н), 3 90 (с, ЗН), 4 57-4 61 (м, 1Н), 6 47 (с, 1Н), 6 68 (с, 1Н),7 50(с, 1Н) Приклад 7 3-(1Н-імідазол-4-іл)5-метокси-6,7диметилшдан-1-ол 3-(1Н-імідазол-4-іл)-5-метокси-6,7диметилшдан-1-он (0,53г) розчиняють в етанолі (30мл) і додають 0,3г боропдриду натрію, Суміш 19 49847 перемішують при 35 - 40°С протягом 7 годин Потім приблизно 20мл етанолу відганяють і додають ЗОмл води Розчин екстрагують етилацетатом Об'єднані етилацетатні екстракти промивають водою, сушать сульфатом натрію і випаровують при зниженому тиску Продукт є сумішшю цис- і транс-ізомерів (приблизно 85 15) Кристалізація продукту з етилацетату дає цис-ізомер, т пл 184 189°С 1 Н ЯМР (цис-ізомер, CDCI3) 2 09-2 14 (м, 1Н), 2 11 (с, ЗН), 2 38 (с, ЗН), 2 69-2 77 (м, 1Н), 3 73 (с, ЗН), 4 31 (д, 11Н), 5 26 (д, 1Н), 6 48 (с, 1Н), 6 90 (с, 1Н), 7 43(с, 1Н) Приклад 8 4-(6-Метокси-4,5-диметилшдан-4іл)-1Н-імідазол 3-(1Н-імідазол-4-іл)-5-метокси-6,7диметилшдан-1-ол (0,29г) розчиняють у суміші етанолу (ЗОмл) і концентрованої соляної кислоти (0,2мл) Розчин гідрують при 50 - 55°С з 10% паладієм на вугіллі як каталізатором до припинення споживання водню Суміш фільтрують і фільтрат випаровують досуха Залишок кристалізують з суміші етилацетату і етанолу Т пл 174 - 177°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 2 05-2 17 (м, 1Н), 2 11 (с, ЗН), 2 21 (с, ЗН), 2 54-2 66 (м, 1Н), 2 82-3 05 (м, 2Н), 3 71 (с, ЗН), 4 55 (т, 1Н), 6 50 (с, 1Н), 7 27(с, 1Н), 8 79(с, 1Н) За допомогою того ж способу отримували наступну сполуку 4-(6-Ізобутилшдан-1 -іл)-1 Н- імідазол 1 Н ЯМР (як сіль НСІ.МеОН-сЦ) 0 86 (д, 6Н), 1 73-1 83 (м, 1Н), 2 11-2 18 (м, 1Н), 2 42 (д, 2Н), 2 58-2 65 (м, 1Н), 2 97-3 31 (м, 2Н), 4 56 (т, 1Н), 6 85 (с, 1Н), 7 04 (д, J=7 6 Гц, 1Н), 7 22 (д, J=7 6 Гц, 1Н), 7 ЗО (с, 1Н), 8 83(с, 1Н) Приклад 9 3-(1 Н-імідазол-4-іл)-6,7диметилшдан-5-ол Сумішпдрохлориду 4-(6-метокси-4,5диметилшдан-1-іл)-1Н- імідазолу (0,29г) і бромоводневої кислоти (15мл) нагрівають при перемішуванні із зворотним холодильником протягом 40 хвилин Охолоджену реакційну суміш виливають у воду і підлужують розчином гідроксиду амонію Продукт екстрагують етилацетатом, який промивають водою, сушать сульфатом натрію і випаровують досуха Неочищений продукт очищають флеш-хроматографією і кристалізують з етилацетату Тпл 198-202°С 1 Н ЯМР (COCI3+MeOH-d4) 2 02-2 13 (м, 1Н), 2 13 (с, ЗН), 2 18 (с, ЗН), 2 43-2 54 (м, 1Н), 2 712 82 (м, 1Н), 2 86-2 96 (м, 1Н), 4 33 (т, 1Н), 6 49 (с, 1Н)(6 75(с, 1Н), 7 50(с, 1Н) За допомогою того ж способу отримували наступні сполуки 5-Гідрокси-3-(1Н-імідазол-4-іл)-6,7диметилшдан-1-он 1 Н ЯМР (MeOH-d4) 2 12 (с, ЗН), 2 58 (с, ЗН), 2 67 (дд, J=18 4 Гц, J=4 1 Гц, 1Н), 3 02 (дд, J=18 4 Гц, J=8 0 Гц, 1Н), 4 43-4 47 (м, 1Н), 6 59 (с, 1Н), 6 90 (с, 1Н), 7 62 (с, 1Н) 1 -(1 Н-імідазол-4-іл)-шдан-5-ол Т пл 210220°С 1 Н Я М Р (MeOH-d4) 2 04-2 17 (м, 1Н), 2 41-2 52 (м, 1Н), 2 77-2 97 (м, 2Н), 4 27 (т, 1Н), 6 55 (дд, J=8 1 Гц, J=2 3 Гц, 1Н), 6 67 (д, J=2 3 Гц, 1Н), 6 70 (с, 1Н), 6 84 (д, J=8 1 Гц, 1Н), 7 57 (с, 1Н) 20 3-(1 Н-імідазол-4-іл)-шдан-4-ол Т пл 142 145°С 1 Н ЯМР (COCI3+MeOH-d4) 2 13-2 26 (м, 1Н), 2 49-2 60 (м, 1Н) 2 89-3 08 (м, 2Н), 4 54 (т, 1Н), 6 71 -6 76 (м, ЗН), 7 06 (т, J=7 6 Гц, 1Н), 7 55 (с, 1Н) 3-(1Н-імідазол-4-іл)-індан-4,6-діол 1 Н Я М Р (MeOH-d4) 2 10-2 21 (м, 1Н), 2 39-2 51 (м, 1Н), 2 71-2 95 (м, 2Н), 4 34-4 39 (м, 1Н), 6 10(д, J=1 9 Гц, 1Н), 6 20 (д, J=1 9 Гц, 1Н), 6 64 (с, 1Н), 7 59 (с, 1Н) Приклад 10 4-(3-Етокси-6-метокси-4,5диметилшдан-1 -іл)-1 Н-імідазол (цис-ізомер) 3-(1Н-імідазол-4-іл)-5-метокси-6,7диметилшдан-1-ол (цис-ізомер, 0,1г) розчиняють в суміші етанолу (20мл) і концентрованої соляної кислоти (2мл) Розчин перемішують при 25°С протягом 1 години Обробка цієї реакційної суміші дає неочищений продукт, який очищають флешхроматографією з використанням суміші метиленхлорид-метанол в якості елюенту 1 Н ЯМР (CDCI3) 1 31 (т, J=7 0 Гц, ЗН), 2 12 (с, ЗН) 2 20-2 25 (м, 1Н), 2 32 (с, ЗН), 2 51-2 60 (м, 1Н), 3 72 (к, J=7 0 Гц, 2Н), 3 73 (с, ЗН), 4 40 (д, 1Н), 4 96 (д, 1Н), 6 52 (с, 1Н), 6 93 (с, 1Н), 7 41 (с, 1Н) Приклад 11 4-(Індан-1-іл)-1Н-імідазол а) 4-(ЗН-шден-1-іл)-1Н-імідазол До розчину 1-(І\І,г\І-діметілсульфамоіл-1Німідазола (1,9г, отриманого згідно Chadwick, DJ and Ngochindo, R L, J Chem Soc , Perkm Trans , 1984, 481) в сухому тетрапдрофурані (90мл) при 70°С в атмосфері азоту при перемішуванні додають по краплях 2,5М бутиллітій у гексані (5,1мл) Через ЗО хвилин додають третбутилдиметилсилілхлорид (2,0г) в сухому тетрапдрофурані (5мл) і суміші дають нагрітися до 25°С Через 1,5 години суміш знову охолоджують до 70°С і обробляють 2,5М бутиллітієм в гексані (5,3мл) Після ЗО хвилин додають 1-шданон (2,1г) у сухому тетрапдрофурані (5мл) і суміші дають нагрітися до кімнатної температури Потім реакційну суміш гасять насиченим розчином МагСОз (2мл) і розчинник видаляють при зниженому тиску Залишок розчиняють в метиленхлориді і промивають водою, сушать сульфатом натрію і випаровують досуха при зниженому тиску Біс-захищену проміжну сполуку нагрівають зі зворотним холодильником з 2Н соляною кислотою (200мл) протягом 2 годин Охолоджений розчин підлужують розчином гідроксиду амонію і екстрагують метиленхлоридом Органічний шар промивають водою, сушать сульфатом натрію і розчинник видаляють при зниженому тиску Неочищений продукт очищають флеш-хроматографією з використанням суміші метиленхлорид-метанол в якості елюенту Продукт перетворюють в пдрохлоридну сіль в розчині етилацетат/етанол, т пл 232 - 240°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 3 66 (д, 2Н), 7 07 (т, 1Н), 7 31-7 43 (м, 2Н), 7 59 (д, 1Н), 7 68 (д, 1Н), 8 03(с, 1Н), 9 06(с, 1Н) б) 4-(Індан-1-іл)-1 Н-імідазол Гідрохлорид 4-(ЗН-инден-1 -іл)-1 Н-імідазола (80мг) розчиняють в етанолі (бмл) Реакційний розчин гідрують при 40 - 50°С з 10% паладієм на вугіллі як каталізатором до припинення споживання водню Обробка цієї реакційної суміші дає неочищений продукт, який очищають флеш 21 49847 хроматографією з використанням суміші метиленхлорид-метанол в якості елюенту 1 НЯМР(СОСІ 3 ) 2 08-2 19 (м, 1Н), 2 41-2 51 (м, 1Н), 2 80-2 95 (м, 2Н), 4 37 (т, 1Н), 6 65 (с, 1Н), 7 07-7 21 (м, 4Н), 7 25(с, 1Н) За допомогою того ж способу отримували наступну сполуку 4-(6-Метоксмндандан-1-іл)-1Німідазол 1 Н ЯМР (як сіль НСІ, MeOH-d4) 2 08-2 20 (м, 1Н), 2 56-2 67 (м, 1Н), 2 80-2 97 (м, 2Н), 3 72 (с, ЗН), 4 53 (т, 1Н), 6 71 (д, J=1 9 Гц, 1Н), 6 75 (дд, J=8 3 Гц, J=1 9 Гц, 1Н), 6 92 (с, 1Н), 7 15 (д, J=8 З Гц, 1Н), 8 82 (с, 1Н) Приклад 12 4-(Індан-1-іл)-1Н-імідазол Тетрахлорид титану (17,2г) при перемішуванні додають по краплях до суспензії порошкоподібного цинку (11,9г у тетрапдрофурані (100мл) при охолоджуванні льодом в атмосфері азоту Суміш нагрівають зі зворотним холодильником протягом 1 години Після охолоджування до кімнатної температури в суміш додають 1-шданон (2,0г) і 3бензил-ЗН-імідазол-4-карбальдепд (4,2г) у тетрапдрофуране (ЗОмл) Суміш нагрівають зі зворотним холодильником при перемішуванні протягом 3 годин Охолоджену реакційну суміш підлужують розбавленим розчином гідроксиду натрію Суспензію фільтрують і фільтрат випаровують досуха при зниженому тиску Залишок, що містить неочищений проміжний продукт 1-бензил-5-(шдан-1іліденметил)-1 Н-імідазол, очищають флешхроматографією Очищений проміжний продукт (0,8г) розчиняють в суміші етанолу (ЗОмл), води (2мл) і концентрованої соляної кислоти (0,5мл) Реакційну суміш гідрують при 50 - 60°С з 10% паладієм на вугіллі як каталізатором до припинення споживання водню Суміш фільтрують і фільтрат випаровують досуха Залишок розчиняють у воді і підлужують гідроксидом натрію Потім продукт екстрагують метиленхлоридом, який промивають водою, сушать сульфатом натрію і випаровують досуха Продукт перетворюють у пдрохлорид в етилацетаті з використанням сухого хлороводню Вихід 0,5Г, Т ПЛ 182-183°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 74-1 81 (м, 1Н), 2 22-2 29 (м, 1Н), 2 80-2 95 (м, ЗН), 3 17 (дд, J=15 1 Гц, J=5 7 Гц, 1Н), 3 48-3 53 (м, 1Н), 7 127 23 (м, 4Н), 7 26 (с, 1Н), 8 79 (с, 1Н) За допомогою того ж способу отримували наступні сполуки 4-(6-Метоксиндан-1-ілметил)-1Німідазол Т пл пдрохлориду 197 - 200°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 72-1 84 (м, 1Н), 2 19-2 31 (м, 1Н), 2 70-2 89 (м, ЗН), 3 16 (дд, J=14 9 Гц, J=5 5 Гц, 1Н), 3 42-3 51 (м, 1Н), 3 74 (с, ЗН), 6 68 (д, J=2 2 Гц, 1Н), 6 74 (дд, J=8 2 Гц, и=2 2Гц, 1Н), 7 10 (д, J=8 2 Гц, 1Н), 7 27 (с, 1Н), 8 82 (с, 1Н) Охолоджену реакційну суміш підлужують розбавленим розчином гідроксиду натрію Суспензію фільтрують і фільтрат випаровують досуха при зниженому тиску Залишок, що містить неочищений проміжний продукт 1-бензил-5-(шдан-1іліденметил)-1Н-імідазол, очищають флешхроматографією Очищений проміжний продукт (0,8г) розчиня 22 ють в суміші етанолу (ЗОмл), води (2мл) і концентрованої соляної кислоти (0,5мл) Реакційну суміш гідрують при 50 - 60°С з 10% паладієм на вугіллі як каталізатором до припинення споживання водню Суміш фільтрують і фільтрат випаровують досуха Залишок розчиняють у воді і підлужують гідроксидом натрію Потім продукт екстрагують метиленхлоридом, який промивають водою, сушать сульфатом натрію і випаровують досуха Продукт перетворюють у пдрохлорид в етилацетаті з використанням сухої соляної кислоти Вихід 0,5Г, Т ПЛ 182-183°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 74-1 81 (м, 1Н), 2 22-2 29 (м, 1Н), 2 80-2 95 (м, ЗН), 3 17 (дд, J=15 1 Гц, J=5 7 Гц, 1Н), 3 48-3 53 (м, 1Н), 7 127 23 (м, 4Н), 7 26 (с, 1Н), 8 79 (с, 1Н) За допомогою того ж способу отримували наступні сполуки 4-(6Метоксмндан-1-ілметил)-1Н-імідазол Т пл пдрохлориду 197 - 200°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 72-1 84 (м, 1Н), 2 19-2 31 (м, 1Н), 2 70-2 89 (м, ЗН), 3 16 (дц, J=14 9 Гц, J=5 5 Гц, 1Н), 3 42-3 51 (м, 1Н), 3 74 (с, ЗН), 6 68 (д, J=2 2 Гц, 1Н), 6 74 (дц, J=8 2 Гц, и=2 2Гц, 1Н), 7 10 (д, J=8 2 Гц, 1Н), 7 27 (с, 1Н), 8 82 (с, 1Н) 4-(5-Метоксишдан-1-илметил)-1Н-імідазол Т пл пдрохлориду 204 - 206°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 71-1 83 (м, 1Н), 2 19-2 31 (м, 1Н), 2 75-2 94 (м, ЗН), 3 13 (дц, J=15 0 Гц J= 5 5 Гц, 1Н), 3 40-3 49 (м, 1Н), 3 75 (с, ЗН), 6 70 (дд, J=8 3 Гц, J=2 2 Гц, 1Н), 6 78 (д, J =2 2 Гц, 1Н), 7 00 (д, J=8 3 Гц, 1Н), 7 26 (с, 1Н), 8 82(с, 1Н) 4-(5,6- Діметоксііндан)-1Н Т пл пдрохлориду 193-197°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 72-1 84 (м, 1Н), 2 20-2 32 (м, 1Н), 2 75-2 88 (м, ЗН), 3 15 (дд, J=15 1 Гц, J=5 2 Гц, 1Н), 3 41 -3 50 (м, 1Н), 3 77 (с, ЗН), 3 79 (с, ЗН), 6 73 (с, 1Н), 6 84 (с, 1Н), 7 26 (с, 1Н), 8 82 (с, 1Н) 4-(6-Метокси-4,5-диметилшдан-1-ілметил)-1Німідазол Т пл пдрохлориду 194 - 197°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 70-1 81 (м, 1Н), 2 09 (с, ЗН), 2 15 (с, ЗН), 2 17-2 29 (м, 1Н), 2 69-2 89 (м, ЗН), 3 14 (дд, J=15 1 Гц, J=5 7 Гц, 1Н), 3 42-3 50 (м 1Н), 3 74 (с, ЗН), 6 54 (с, 1Н), 7 24 (с, 1Н), 8 81 (с, 1Н) 4-(6-Метокси-4,7-диметилшдан-1-ілметил)-1 Німідазол Т пл пдрохлориду 168 - 175°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 88-1 94 (м, 1Н) 2 07 (с, ЗН) 2 09-2 18 (м, 1Н), 2 19 (с, ЗН), 2 69-2 77 (м, ЗН) 2 90 (дд, J=15 2 Гц, J=4 7 Гц, 1Н), 3 51 -3 57 (м, 1Н), 3 77 (с, ЗН) 6 60 (с, 1Н), 7 21 (с, 1Н), 8 80 (с, 1Н) 4-(6-Метокси-5-метилшдан-1-ілметил)-1Німідазол Т пл пдрохлориду 183 - 186°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 71-1 82 (м, 1Н), 2 13 (с, ЗН), 2 18-2 29 (м, 1Н), 2 70-2 89 (м, ЗН), 3 16 (дд, J=15 0 Гц, J=5 4 Гц, 1Н), 3 42-3 50 (м, 1Н), 3 76 (с, ЗН), 6 65 (с, 1Н), 6 95 (с, 1Н), 7 26 (с, 1Н), 8 82 (с, 1Н) 4-(6-Флуоршдан-1 -ілметил)-1 Н-імідазол Т пл пдрохлориду 215 - 222°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 76-1 88 (м, 1 Н), 2 23-2 35 (м, 1Н), 2 76-2 92 (м, ЗН), 318 (дц, 23 49847 J=15 3 Гц, J=5 3 Гц, 1H), 3 46-3 56 (м, 1Н), 6 866 92 (м, 2Н), 7 17-7 20 (м, 1Н), 7 31 (с, 1Н), 8 83 (с, 1Н) 4-(5-флуоршдан-1 -ілметил)-1 Н-імідазол Т пл пдрохлориду 185 - 189°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 76-1 88 (м, 1Н), 2 23-2 35 (м, 1Н), 2 79-2 98 (м, ЗН), 3 16 (дц, J=15 3 Гц, J=5 3 Гц, 1Н), 3 43-3 53 (м, 1Н), 6 836 96 (м, 2Н), 7 08-7 13 (м, 1Н), 7 29 (с, 1Н), 8 82 (с, 1Н) 4-(4Метоксііндан-1-ілметил)-1Н-імідазол Т пл пдрохлориду 202 - 210°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 73-1 82 (м, 1Н), 2 18-2 30 (м, 1Н), 2 72-2 89 (м, ЗН), 3 14 (дц, J=15 0 Гц, J=5 5 Гц, 1Н), 3 48-3 56 (м, 1Н), 3 80 (с, ЗН), 6 72-6 78 (м, 2Н), 7 14(т, 1Н), 7 24 (с, 1Н), 8 79 (с, 1Н) 4-(6-Метокси-7-метилшдан-1-ілметил)-1Німідазол Т пл пдрохлориду 152 - 158°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 86-1 93 (м, 1Н), 2 11 (с, ЗН), 2 12-2 20 (м, 1Н), 2 68-2 96 (м, 4Н), 3 52-3 59 (м, 1Н), 3 79 (с, ЗН), 6 75 (д, J=8 2 Гц, 1Н), 6 99 (д, J=8 2 Гц, 1Н), 7 22 (с, 1Н), 8 79 (с, 1Н) 4-(7-Метоксііндан-1-ілметил)-1Н-імідазол 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 82-1 90 (м, 1Н), 2 09-2 19 (м, 1Н) 2 72-2 91 (м, ЗН), 3 14 (дд, J=14 9 Гц, J=4 8 Гц, 1Н) 3 59-3 74 (м, 1Н), 3 76 (с, ЗН), 6 72-6 80 (м, 2Н), 6 96 (с, 1Н), 7 31 (т, IH), 8 38 (с, 1Н) 4-(5,6-Диметокси-3,3-диметилшдан-1-ілметил)1 Н-імідазол 1 Н ЯМР (CDCI3) 1 12 (с, ЗН), 1 28 (с, ЗН), 1 63 (дц, J=12 5 Гц, J=8 3 Гц, 1Н), 2 09 (дц, J=12 5 Гц, J=7 5 Гц, 1Н), 2 72 (дд, J=14 6 Гц, J=9 0 Гц, 1Н), 3 16 (дц, J=14 6 Гц, J=5 5 Гц, 1Н), 3 47-3 52 (м, 1Н), 3 78 (с, ЗН), 3 86 (с, ЗН), 6 61 (с, 1Н), 6 66 (с, 1Н), 6 82 (с, 1Н), 7 58 (с, 1Н) 4-(5-Трет-бутиліндан-1-ілметил)-1Н-імідазол 1 Н ЯМР (CDCI3) 1 32 (с, 9Н), 1 71-1 83 (м, 1Н), 2 19-2 30 (м, 1Н), 2 73-2 87 (м, ЗН), 3 08 (дд, J=14 7 Гц, J=5 6 Гц, 1Н), 3 44-3 53 (м, 1Н), 6 81 (с, 1Н), 7 09 (д, J=7 8 Гц, 1Н), 7 20 (дд, J=7 8 Гц, J=1 5 Гц, 1Н), 7 26 (д, J=1 5 Гц, 1Н), 7 55 (с, 1Н) 4-(6-Метокси-3,3-диметилшдан-1-ілметил)-1Німідазол 1 Н ЯМР (CDCI3) 111 (с, ЗН), 1 27 (с, ЗН), 1 63 (дд J=12 5 Гц, J=8 9 Гц, 1Н), 2 06 (дд, J=12 5 Гц, J=7 5 Гц, 1Н), 2 72 (дд, J=14 7 Гц, J=9 0 Гц, 1Н), 3 19 (дд, J=14 7 Гц, J=5 4 Гц, 1Н), 3 47-3 55 (м, 1Н), 3 74 (с, ЗН), 6 67 (д, J=2 2 Гц, 1Н), 6 74 (дд, J=8 2 Гц, J=2 2 Гц, 1Н), 6 83 (с, 1Н), 7 03 (д, J=8 2 Гц, 1Н), 7 58 (с, 1Н) Приклад 13 4-[1-(Індан-1-іл)-етил]-1Н-імідазол Процедуру прикладу 12 повторюють, за винятком того, що замість 3-бензил-ЗНімідазолкарбальдепду використовують 1-(3бензил-ЗН-імідазол-4-іл)-етанон Продукт містить два діастереомера ad i be (78% ad і 22% be) ^H ЯМР (як сіль НСІ, MeOH-d4) 1 23 (д, J=7 1 Гц, -CH3, be діастереомер), 1 38 (д, J=7 1 Гц, -СН3, ad діастереомер), 1 81-2 32 (м, 2Н), 2 70-2 87 (м, 2Н), 3 29-3 39 (м, 1Н), 3 47-3 57 (м, 1Н), 6 98-7 30 (м, 5Н), 8 77 (с, 1Н, ad діастереомер), 8 84 (с, 1Н, be діастереомер) За допомогою того ж способу отримували на 24 ступне заміщене похідне 4-[1-(6-метоксмндан-1іл)-етил]-1 Н-імідазол Реакційна суміш містить два діастереомера ad і be, які розділяють флеш-хроматографією з елююванням розчином метиленхлорид-метанол 1 Н ЯМР (ad діастереомер як сіль НСІ, МеОНd4) 1 37 (д, J=7 1 Гц, ЗН), 1 83-1 94 (м 1Н), 2 202 33 (м, 1Н), 2 58-2 77 (м, 2Н), 3 30-3 39 (м, 1Н), 3 43-3 49 (м, 1Н), 3 74 (с, ЗН), 6 63 (д, J=2 4 Гц, 1Н), 6 73 (дд, J=8 2 Гц, J=2 4 Гц, 1Н), 7 05 (д, J=8 2 Гц, 1Н), 7 13 (с, 1Н), 8 74 (с, 1Н) 1 Н ЯМР (be діастереомер як сіль НСІ, МеОНd4) 1 23 (д, J=7 1 Гц, ЗН), 1 90-2 01 (м, 1Н), 2 052 16 (м, 1Н), 2 70-81 (м, 2Н), 3 29-3 39 (м, 1Н), 3 433 54 (м, 1Н), 3 72 (с, ЗН), 6 54 (д, J=2 4 Гц, 1Н), 6 73 (дд, J=8 2 Гц, J=2 4 Гц, 1Н), 7 11 (д, J=8 2 Гц, 1Н), 7 32 (с, 1Н), 8 84 (с, 1Н) Приклад 14 4-(5-Трет-бутил-6-метоксмндан-1ілметил)-1 Н-імідазол Сірчану кислоту (0,5мл) додають до суміші пдрохлориду 4-(6-метоксііндан-1-ілметил)-1Німідазола (50мг) і трет-бутанола (2мл) Суміш перемішують при 35 - 40°С протягом 10 годин Потім реакційну суміш виливають у воду і підлужують гідроксидом натрію Продукт екстрагують метиленхлоридом, який промивають водою, сушать сульфатом натрію і випаровують досуха Залишок, що складається з неочищеного продукту, перетворюють у пдрохлорид в етилацетаті Вихід 23мг, т п л 174-184°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 33 (с, 9Н), 171-183 (м, 1Н), 2 19-2 31 (м, 1Н) 2 73-2 89 (м, ЗН), 3 15 (дд, J=15 0 Гц, J=5 1 Гц, 1Н), 3 40-3 50 (м 1Н), 3 77 (с, ЗН), 6 69 (с, 1Н),7 11 (с, 1Н), 7 27 (с, 1Н), 8 81 (с, 1Н) За допомогою того ж способу отримують наступну сполуку 4-{6-трет-бутил-5-метоксмндан-1-іл метил)-1 Н-імідазол 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 ЗО (с, 9Н), 1 73-1,84 (м, 1Н), 2 21-2 33 (м, 1Н) 2 75-2 94 (м, ЗН), 3 05 (дд, J=14 9 Гц, J=6 3 Гц, 1Н), 3 35-3 45 (м, 1Н), 3 80 (с, ЗН), 6 83 (с, 1Н), 6 86 (с, 1Н), 7 23 (с, 1Н), 8 81 (с, 1Н) 5,7Ди-трет-бутил-1Н-імідазол-4-ілметил)шдан-4-ол 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 39 (с, 9Н), 1 41 (с, 9Н), 1 87-1 93 (м, 1Н), 2 01-2 06 (м, 1Н), 2 66-2 75 (м, ЗН), 2 89-2 95 (м, 1Н), 3 82-3 89 (м, 1Н), 7 15(с, 1Н), 7 33(с, 1Н), 8 77(с, 1Н) 6-трет-Бутил-1 -(1 Н-імідазол-4-іл)-шдан-5-ол 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 32 (с, 9Н), 2 06-2 15 (м, 1Н), 2 52-2 63 (м, 1Н), 2 82-3 02 (м, 2Н), 4 46 (т, 1Н), 6 69 (с, 1Н), 6 88 (с, 1Н), 7 25 (с, 1Н), 8 79(с, 1Н) 4-(6-трет-Бутил-4-метилшдан-1 -іл)-1 Німідазол Тпл пдрохлориду 235 - 242°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 25 (с, 9Н), 2 09-2 19 (м, 1Н), 2 57-2 67 (м, 1Н), 2 84-3 07 (м, 2Н), 4 55 (т, 1Н), 6 91 (с, 1Н), 7 12 (с, 1Н), 7 25 (с, 1Н),8 74(с, 1Н) 5,7-Ди-трет-бутил-3-(1Н-імідазол-4-іл)-шдан-4ол Тпл пдрохлориду 216 - 222°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 35 (с, 9Н), 139 (с, 9Н), 2 11-2 18 (м, 1Н), 2 44-2 52 (м, 1Н), 3 06-3 16 (м, 2Н), 4 59-4 63 (м, 1Н), 6 78 (с, 1Н), 7 23(с, 1Н), 8 75(с, 1Н) 25 Приклад 15 49847 3-(1Н-імідазол-4-ілметил)-шдан-5 ол Суміш пдрохлориду 4-(6-метоксишдан-1ілметил)-1Н-імідазолу (140мг) і 48% бромоводневоі кислоти (7мл) нагрівають при перемішуванні із зворотним холодильником протягом 45 хвилин Охолоджену реакційну суміш виливають у воду і підлужують розчином гідроксиду амонію Продукт екстрагують етилацетатом, який промивають водою, сушать сульфатом натрію і випаровують досуха Неочищений продукт перетворюють в його пдрохлоридну сіль в етилацетаті Т пл 206 208°С 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 70-1 81 (м, 1Н), 2 18-2 29 (м, 1Н), 2 70-2 88 (м, ЗН), 3 12 (дц, J=15 3 Гц, J=5 8 Гц, 1Н), 3 38-3 46 (м, 1Н), 6 53(д, J =2 2 Гц, 1Н), 6 60 (дд, J=8 1 Гц, J=2 2 Гц, 1Н), 7 01 (д, J=8 1 Гц, 1Н), 7 27 (с, 1Н), 8 81 (с, 1Н) За допомогою того ж способу отримували наступні сполуки 1 -(1 Н-імідазол-4-ілметил)-шдан-5-ол Т пл пдрохлориду 159-1 61 °С 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 69-1 80 (м, 1Н), 2 17-2 29 (м, 1Н), 2 71-2 89 (м ЗН), 3 11 (дд, J=14 8Гц, J=5 7Гц, 1Н), 3 35-3 45 (м, 1Н) 6 57 (дд, J=8 1 Гц, J=2 2 Гц, 1Н), 6 64 (д, J=2 2 Гц, 1Н), 6 89 (д, J=8 1 Гц, 1Н), 7 24 (с, 1Н), 8 79 (с, 1Н) 1 -(1 Н-імідазол-4-іметил)-індан-5,6-діол 1 Н Я М Р (як сіль НСІ, MeOH-d 4 ) 1 67-1 78 (м, 1Н), 2 15-2 27 (м, 1Н), 2 65-2 85 (м, ЗН), 3 05 (дд, J=15 1 Гц, J=5 8 Гц, 1Н), 3 30-3 40 (м, 1Н), 6 51 (с, 1Н), 6 63 (с, 1Н) 7 24 (с, 1Н), 8 80 (с, 1Н) 6-трет-Бутил-3-(1Н-1М1дазол-4-илметил)-шдан5-ол 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 35 (с, 9Н), 1 69-1 79 (м, 1Н), 2 18-2 28 (м, 1Н), 2 69-2 86 (м, ЗН), 3 08 (дд, J=15 0 Гц, J=6 0 Гц, 1Н), 3 35-3 43 (м, 1Н), 6 46 (с, 1Н), 7 04 (с, 1Н), 7 26 (с, 1Н), 8 81 (с, 1Н) 6-трет-Бутил-1-(1Н-1М1дазол-4-1лметил)-шдан5-ол Т пл пдрохлориду 229 - 230°С 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 32 (с, 9Н), 1 72-1 81 (м, 1Н), 2 18-2 29 (м, 1Н), 2 72-2 87 (м, ЗН), 3 03 (дд, J=15 1 Гц, J=6 5 Гц, 1Н), 3 32-3 40 (м, 1Н), 6 59 (с, 1Н), 6 79 (с, 1Н), 7 23 (с, 1Н), 8 81 (с, 1Н) 3-(1Н-імідазол-4-ілметил)-6,7-диметилшдан-5ол Т пл пдрохлориду 229 - 238°С 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 66-1 78 (м, 1Н), 2 08 (с, ЗН), 2 13 (с, ЗН), 2 14-2 26 (м, 1Н), 2 66-2 85 (м, ЗН), 3 06 (дд, J=15 1 Гц, J=5 8 Гц, 1Н), 3 35-3 43 (м, 1Н), 6 39 {с, 1Н), 7 22 (с, 1Н), 8 79 (с, 1Н) 3-(1 Н- імідазол-4-ілметил)-4,7-диметилшдан-5ол 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 85-1 93 (м, 1Н), 2 07 (с, ЗН), 2 11 (с, ЗН), 2 11-2 20 (м, 1Н), 2 65-2 77 (м, ЗН), 2 90 (дд, J=15 1 Гц, и=4 6Гц, 1Н), 3,49-3 57 (м, 1Н), 6 47 (с, 1Н), 7 19 (с, 1Н), 8 79 (с, 1Н) 3-[1 -(1 Н-імідазол-4-іл)-етил]-шдан-5-ол (суміш двох діастереомерів ad i be) 1 H ЯМР (основа, CDCI 3 +Me0H-d 4 ) 1 12 (д, J=7 0 Гц, -СНз, ad діастереомер), 1 22 (д, J=7 1 Гц, -СНз, be діастереомер) 3-(1Н-імідазол-4-ілметил)-6-метилшдан-5-ол 26 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 68-1 79 (м, 1Н), 2 13 (с, ЗН), 2 15-2 27 (м, 1Н), 2 68-2 86 (м, ЗН), 3 08 (дц, J=15 3 Гц, J=5 8 Гц, 1Н), 3 36-3 43 (м, 1Н), 6 49 (с, 1Н), 6 90 (с, 1Н), 7 25 (с, 1Н), 8 81 (с, 1Н) 1 -(1 Н-імідазол-4-ілметил)-шдан-4-ол Т пл пдрохлориду 199 - 205°С 1 Н ЯМР (MeOH-d 4 ) 1 68-1 80 (м, 1Н), 2 10-2 22 (м, 1Н), 2 60-2 86 (м, ЗН), 3 00 (дд, J=14 6 Гц, J=5 3 Гц, 1Н), 3 38-3 48 (м, 1Н), 6 56 (д, J=7 8 Гц, 1Н), 6 62 (д, J=7 8 Гц, 1Н), 6 71 (с, 1Н) 6 94 (т, J=7 8 Гц, 1Н), 7 56 (с, 1Н) 3-(1 Н- імідазол-4-илметил)-шдан-4-ол 1 Н ЯМР (як сіль НСІ, МеОН- d 4 ) 1 78-1 87 (м, 1Н), 2 12-2 22 (м, 1Н), 2 78-2 92 (м, ЗН), 3 24 (дд, J=15 3 Гц, J=5 3 Гц, 1Н), 3 59-3 65 (м, 1Н), 6 56 (д, J=7 7 Гц, 1 Н), 6 68 (д, J=7 7 Гц, 1Н), 6 99 (т, J=7 7 Гц, 1Н), 7 15 (с, 1Н), 8 75 (с, 1Н) 3-(1Н-імідазол-4-ілметил)-1,1-диметилшдан5,6-дюл 1 Н ЯМР (MeOH-d 4 ) 1 09 (с, ЗН), 1 24 (с, ЗН), 1 54 (дд, J=12 4 Гц, J=8 5 Гц, 1Н), 1 98 (дд, J=12 4 Гц, J=7 4 Гц, 1Н), 2 60 (дд, J=14 5 Гц, J=9 0 Гц, 1Н), 3 07 (дд, J=14 5 Гц, J=5 5 Гц, 1Н), 3 36-3 41 (м, 1Н), 6 54 (с, 2Н), 6 79 (с, 1Н), 7 65 (с, 1Н) 3-(1Н-імідазол-4-іл метил )-1,1-диметилшдан5-ол 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 14 (с, ЗН), 1 29 (с, ЗН), 1 59 (дд, J=12 5 Гц, J=8 8 Гц, 1Н), 2 06 (дд, J=12 5 Гц, J=7 5 Гц, 1Н), 2 80 (дд, J=15 1 Гц, J=9 3 Гц, 1Н), 3 27 (дд, J=15 1 Гц, J=5 2 Гц, 1Н), 3 45-3 55 (м, 1Н), 6 56 (д, J=2 0 Гц, 1Н), 6 65 (дд, J=8 1 Гц, J=2 0 Гц, 1Н), 6 96 (д, J=8 1 Гц, 1Н), 7 32 (с, 1Н), 8 83 (с, 1Н) Приклад 16 4-(1,2,3,4-Тетрапдрояафталін-1ілметил)-1 Н-імідазол Процедуру прикладу 12 повторюють, за винятком того, що замість 1-шданона використовують 1тетралон Т пл пдрохлоридної солі 185 - 188°С 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 59-1 93 (м, 4Н), 2 70-2 80 (м, 2Н), 2 96 (дд, J=14 8 Гц, J=9 5 Гц, 1Н), 3 08-3 22 (м, 2Н), 7 08-7 14 (м, 4Н), 7 25 (с, 1Н), 8 81 (с, 1Н) За допомогою того ж способу отримували наступні сполуки 4-(5-Метокси-1,2,3,4-тетрапдронафталш-1ілметил)-1 Н-імідазол Т пл пдрохлориду 210 - 218°С 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 58-1 64 (м, 1Н), 1 71-1 86 (м, ЗН), 2 50-2 60 (м, 1Н), 2 66-2 74 (м, 1Н), 2 96 (дд, J=14 8 Гц, J=9 5 Гц, 1Н), 3 05-3 18 (м, 2Н), 3 79 (с, ЗН), 6 73-6 77 (м, 2Н), 7 09 (т, 1Н), 7 25 (с, 1Н), 8 81 (с, 1Н) 4-(б-Метокси-1,2,3,4-тетрапдронафталш-1ілметил)-1 Н-імідазол Т пл пдрохлориду 184 - 1 9 1 °С 1 Н ЯМР (як сіль НСІ, MeOH-d 4 ) 1 58-1 88 (м, 4Н), 2 70-2 76 (м, 2Н), 2 93 (дд, J=14 5 Гц, J=9 2 Гц, 1Н), 3 04-3 32 (м, 2Н), 3 74 (с, ЗН), 6 63 (д, J=2 5 Гц, 1Н), 6 69 (дд, 8 4 Гц, J=2 5 Гц, 1Н), 7 03 (д, J=8 4 Гц, 1Н ), 7 24 (с, 1Н), 8 81 (с, 1Н) 4-(7-Метокси-1,2,3,4-тетрапдронафталш-1ілметил)-1 Н-імідазол Т пл пдрохлориду 180 183°С 1 Н ЯМР (як основа, CDCI 3 ) 1 59-1 82 (м, 4Н), 2 64-2 68 (м, 2Н), 2 85 (дд, J=14 6 Гц, J=9 3 Гц, 1Н), 27 49847 3 01 (дд, J=14 6 Гц, J=4 8I~4, 1Н), 3 12-3 17 (м, 1Н), 3 72 (с, ЗН), 6 68-6 71 (м, 2Н), 6 78 (с, 1Н), 6 977 00(м, 1Н), 7 56 (с, 1Н) 4-(4-Метил-1,2,3,4-тетрапдронафталш-1ілметил)-1 Н-імідазол Продую" являє собою суміш двох ізомерів ad і be (85% ad і 15% be) 1 H ЯМР (як сіль НСІ, MeOH-d4) 1 25 (d, J=7 0 Гц, -CH3, be ізомер), 1 30 (d, j=7 0 Гц, -CH3, ad ізомер), 1 50-2 10 (м, 4Н), 2 80-3 04 (м, 2Н), 3 10-3 20 (м, 2H), 7 10-7 26 (M, 5H), 8 83 (c, 1H) Приклад 17 4-(7-грег-Бутил-6-метокси-1,2,3,4геграг/дронафталш-1-ілметил)-1Н-імідазол Сірчану кислоту (0,75мл) додають до суміші пдрохлориду 4-(6-метокси-1,2,3,4тетрапдронафталш-1-ілметил)-1Н-імідазола (75мг) і трет-буганола (Змл) Суміш перемішують при 35 40°С протягом 15 годин Реакційну суміш виливають у воду і підлужують гідроксидом натрію Продукт екстрагують метиленхлоридом, який промивають водою, сушать сульфатом натрію і випаровують досуха Залишок, що складається з неочищеного продукту, перетворюють у пдрохлоридну сіль в етилацетаті Вихід 40мг 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1-28 (с, 9Н), 1 65-1 95 (м, 4Н), 2 70-2 80 (м, 2Н), 2 87-3 10 (м, 3), З 78 (с, ЗН), 6 63 (с, 1Н), 6 79 (с, 1Н), 7 22 (с, 1Н), 8 81 (с, 1Н) Приклад 18 5-(1Н-імідазол-4-ілметил)-5 6 7 8тетрапдро-нафталш-2-ол Суміш 4-(6-метокси-1,2,3,4тетрапдронафталш-1-ілметил)-1Німідазола (220мг) і 48% бромоводневої кислоти (11мл) нагрівають при перемішуванні зі зворотним холодильником протягом 1 години Охолоджену реакційну суміш виливають у воду і підлужують розчином гідроксиду амонію Продукт екстрагують етилацетатом, який промивають водою, сушать сульфатом натрію і випаровують досуха Неочищений продукт перетворюють у пдрохлоридну сіль в етилацетаті Вихід 130МГ, Т ПЛ 200 - 205°С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 54-1 90 (м, 4Н), 2 62-2 72 (м, 2Н), 2 88-3 11 (м, ЗН), 6 51 (д, J=2 5 Гц, 1Н), 6 56 (дд, J=8 3 Гц, J=2 5 Гц, 1Н), 6 94 (д, J=8 3 Гц, 1Н), 7 23 (с, 1Н), 8 81 (с, 1Н) За допомогою того ж способу отримували наступну сполуку 8-(1Н-імідазол-4-ілметил)-5,6,7,8тетрапдронафталш-2-ол Т пл гідро хлориду 245 251 °С 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 53-1 89 (м, 4Н), 2 60-2 70 (м, 2Н), 2 90-2 99 (м, 1Н), 3 05-3 12 (м, 2Н), 6 55-6 60 (м, 2Н), 6 90 (d, J=8 0 Гц, 1Н), 7 24 (с, 1Н), 8 80 (с, 1Н) Приклад 19 6Бром-3-(1 Н-імідазол-4ілметил)-шдан-5-ол Бром (130мг, 1екв) додають при перемішуванні по краплях до суспензії пдрохлориду 3-(1Німідазол-4-ілметил)-шдан-5-ола (130мг) в оцтовій кислоті (бмл) Суміш перемішують при 20 - 23°С протягом 3 годин Потім реакційну суміш виливають у воду і підлужують розчином гідроксиду амонію Продукт екстрагують етилацетатом, який промивають водою, сушать сульфатом натрію і випаровують досуха Продукт очищають флешхроматографією з використанням суміші метилен 28 хлорид-метанол в якості елюенту і потім перетворюють у пдрохлоридну сіль у розчині етилацетатетанол 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 71-1 83 (м, 1Н), 2 18-2 30 (м, 1Н), 2 72-2 89 (м, ЗН), 3 10 (дд, J=14 9 Гц, J=5 9 Гц, 1Н), 3 36-3 46 (м, 1Н), 6 65 (с, 1Н), 7 29(с, 2Н), 8 81 (с, 1Н) Приклад 20 1,3-Дібром-8-(1 Н-імідазол-4ілметил)-5,6,7,8-тетрапдронафталш-2-ол Бром (190мг, 2екв) додають по краплях при перемішуванні до суспензії пдрохлориду 8-(1 Німідазол-4-ілметил)-5,6,7,8-тетрапдронафталін-2ола (150мг) в оцтовій кислоті (5мл) Суміш перемішують при 20 - 23°С протягом 3 годин Потім реакційну суміш виливають у воду і підлужують розчином гідроксиду амонію Продукт екстрагують етилацетатом, який промивають водою, сушать сульфатом натрію і випаровують досуха Продукт очищають флеш-хроматографією з використанням суміші метиленхлорид-метанол в якості елюенту і потім перетворюють у пдрохлоридну сіль у розчині ети л а цетат-ета н ол 1 Н ЯМР (MeOH-d4) 1 51-1 93 (м, 4Н), 2 56-2 75 (м, ЗН), 2 99 (дд, J=14 8 Гц, J=3 2 Гц, 1Н), 3 30-3 33 (м 1Н), 6 88 (с, 1Н) 7 23 (с, 1Н), 7 61 (с, 1Н) За допомогою того ж способу отримували наступні сполуки 4,6-Дибром-3-(1Н-імідазол-4-ілметил)-шдан-5ол 1 Н ЯМР (MeOH-d4) 1 95-2 16 (м, 2Н), 2 58-2 89 (м, ЗН), 3 02{дд, J=14 6 Гц, J=3 5 Гц, 1Н), 3 45-3 52 (м, 1Н), 6 72 (с, 1Н), 7 23 (с, 1Н), 7 62 (с, 1Н) 5,7- Дибром-1 -(1 Н-імідазол-4-ілметил)-шдан-4ол 1 Н ЯМР (як сіль НСІ, MeOH-d4) 1 93-2 01 {м, 1Н), 2 19-2 33 (м, 1Н), 2 80-3 07 {м, ЗН), 3 12 (дд, J=15 2 Гц, J=4 9 Гц, 1Н), 3 51 -3 59 (м 1Н), 7 25 (с, 1Н), 7 46 (с, 1Н), 8 82 (с, 1Н) Приклад 21 6- Пдроксиметил-3-(1Н-імідазол4-ілметил)-шдан-5-ол а) 1-(1Н-імідазол-4-ілметил)-6-метоксііндан-5карбальдепд Хлорид олова (IV) (1,60г) додають по краплях при перемішуванні до розчину дихлорметилметилового етеру (0,68г) у метиленхлориді (12мл) з охолоджуванням льодом в атмосфері азоту Розчин перемішують при 0°С протягом 1 години перед додаванням розчину 4-(6-метоксишдан-1-ілметил)1Н-імідазола (0,60г) у метиленхлориді (4мл) Отриманій суміші дають нагрітися до температури навколишнього середовища при перемішуванні протягом 4 годин Потім суміш виливають в холодну воду і підлужують розчином гідроксиду амонію Продукт екстрагують метиленхлоридом, який промивають водою, сушать сульфатом натрію і випаровують досуха Неочищений продукт очищають флеш-хроматографією з використанням суміші метиленхлорид-метанол в якості елюенту 1 НЯМР(СОСІз) 1 78-1 90 (м, 1Н), 2 21-2 31 (м, 1Н), 272-2 86 (м, ЗН), 3 04 (дд, J=14 5 Гц, J=6 0 Гц, 1Н), 3 50-3 61 (м, 1Н), 3 85 (с, ЗН), 6 75 (с, 1Н), 6,79 (с, 1Н), 7 61 (с, 1Н), 7 66 (с, 1Н), 10 40 (с, 1Н) б) 6-Пдрокси-1 -(1 Н-імідазол-4-ілметил)-шдан5-карбальдепд 1,0М розчин триброміду бору в метиленхлориді (2мл) додають по краплях при перемішуванні 29 49847 до розчину 1 -(1 Н-імідазол-4-ілметил)-6метоксмндан-5-карбальдепду (144мг) в метиленхлориді (10мл) при - 70°С в атмосфері азоту Після цього додавання суміші дають нагрітися до кімнатної температури і перемішують протягом 3 годин Потім суміш виливають у холодну воду і підлужують розчином гідроксиду амонію Продукт екстрагують метиленхлоридом, який промивають водою, сушать сульфатом натрію і випаровують досуха Неочищений продукт очищають флешхроматографією з використанням суміші метиленхлорид-метанол в якості елюєнта і кристалізують з етилацетату 1 НЯМР(СОСІ 3 ) 1 76-1 88 (м, 1Н), 2 20-2 32 (м, 1Н), 2 71-2 91 (м, ЗН), 3 02(дд, J=14 7 Гц, J=5 9 Гц, 1Н), 3 44-3 54 (м, 1Н), 6 73 (с, 1Н), 6 76 (с, 1Н), 7 36 (с, 1Н), 7 54 (с, 1Н), 9 81 (с, 1Н) в) 6 -Пдроксиметил-3-(1Н-імідазол-4-ілметил)шдан-5-ол Боропдрид натрію (8мг) додають до розчину 6пдрокси-1 -(1 Н-імідазол-4-ілметил)-шдан-5карбальдепду (44мг) в етанолі (6мл) Суміш перемішують при кімнатній температурі протягом 1 години і потім виливають у воду Продукт екстрагують етилацетатом, який промивають водою, сушать сульфатом натрію і випаровують досуха Неочищений продукт очищають флешхроматографією з використанням суміші метиленхлорид-метанол в якості елюєнта і кристалізують з етилацетату 1 Н ЯМР (CDCI3+ MeOH-d4) 1 66-1 77 (м, 1Н), 2 12-2 23 (м, 1Н), 2 62-2 81 (м ЗН), 2 93 (дд, J=14 7 Гц J=5 7 Гц, 1Н), 3 30-3 40 (м, 1Н), 4 68 (с, 2Н), 6 58 (с, 1Н), 6 70 (с, 1Н), 6 97 (с, 1Н), 7 49 (с 1Н) Приклад 22 6-Пдроксиметил-1-(1Н-імідазол-4ілметил)-шдан-5-ол а) 3-(1Н-імідазол-4-ілметил)-6-метоксііндан-5карбальдепд Хлорид олова (IV) (800мг) додають по краплях при перемішуванні до розчину дихлорметилметилового етеру (343мг) у метиленхлориді (8мл) з охолоджуванням льодом в атмосфері азоту Розчин перемішують при 0°С протягом 1 години перед додаванням розчину 4-(5-метоксмндан-1-ілметил)1Н-імідазолу (300мг) у метиленхлориді (4мл) Отриманій суміші дають нагрітися до температури навколишнього середовища при перемішуванні протягом 4 годин Потім суміш виливають в холодну воду і підлужують розчином гідроксиду амонію Обробка цієї суміші дає неочищений продукт, який очищають флеш-хроматографією і перекристалізовують з етилацетату 1 НЯМР(СОСІ 3 ) 1 78-1 90 (м, 1Н), 2 22-2 33 (м, 1Н), 273-296 (м, ЗН), 305 (дд, и=146Гц, и=5 5Гц, 1Н), 3 43-3 53 (м, 1Н), 3 90(с, ЗН), 6 76(с, 1Н), 6 84(с, 1Н), 7 52(с, 1Н), 7 61 (с, 1Н), 10 39(с, 1Н) б) 6-Гідрокси-3-(1 Н-імідазол-4-ілметил)-шдан5-карбальдепд 1,0М розчин триброміду бору у метиленхлориді (3,9мл) додають по краплях при перемішуванні до розчину 3-(1Н-імідазол-4-ілметил)-6метоксмндан-5-карбальдепду (318мг) в метиленхлориді (15мл) при - 70°С в атмосфері азоту Після ЗО цього додавання суміші дають нагрітися до кімнатної температури і перемішують протягом 3 годин Потім суміш виливають в холодну воду і підлужують розчином гідроксиду амонію Обробка суміші дає неочищений продукт, який очищають флешхроматографією і п єре кристал і зо вують з етилацетату 1 НЯМР(СОСІ 3 ) 1 77-1 89 (м, 1Н), 2 22-2 34 (м, 1Н), 2 75-2 90 (м, ЗН), 3 01 (дд, J=14 6 Гц, J=6 2 Гц, 1Н), 3 47-3 56 (м, 1Н), 6 77 (с, 1Н), 6 83 (с, 1Н), 7 20 (с, 1Н), 7 61 (с, 1Н), 9 76 (с, 1Н) в) 6-Пдроксиметил-1-(1Н-імідазол-4-ілметил)шдан-5-ол Боропдрид натрію (10мг) додають у розчин 6пдрокси-3-(1Н-імідазол-4-іл метил)шдан-5карбальдепда (58мг) в етанолі (10мл) Суміш перемішують при кімнатній температурі протягом 1 години і потім виливають у воду Обробка суміші дає неочищений продукт, який очищають флешхроматографією і пере кристал і зо вують з етилацетату 1 Н ЯМР (MeOH-d4) 1 62-1 72 (м, 1Н), 2 08-2 19 (м, 1Н), 2 59-2 76 (м, ЗН), 2 99 (дд, J=14 4 Гц, J=5 2 Гц, 1Н) 3 28-3 38 (м, 1Н), 4 59 (с, 2Н), 6 62 (с, 1Н), 6 73 (с, 1Н), 7 01 (с, 1Н), 7 58 (с, 1Н) Приклад 23 3-[1 -(1 Н-імідазол-4-іл)-пропіл]шдан-5-он а) 4-Й -(6-Метоксмндан-1 -іл)-пропіл]-1 Німідазол Повторюють процедуру прикладу 12, за винятком того, що замість З-бензил-ЗН-імідазол-4карбальдепду використовують 1-(3-бензил-ЗНімідазол-4-іл)-пропан-1 -он і замість 1 -інданона використовують 6-метоксмндан-1-он Продукт є сумішшю двох діастереомерів (1 1) 1 Н ЯМР (як сіль НСІ, MeOH-d4) 0 86 (т, ЗН), 0 92 (т, ЗН), 1 65-1 95 (м, 4Н), 1 98-2 08 (м, 2Н), 2 15-2 25 (м, 2Н), 2 50-2 73 (м, 4Н), 2 96-3 04 (м, 1Н), 3 10-318 (м, 1Н), 335-350 (м, 2Н), 369 (с, ЗН), 3 78 (с, ЗН), 6 38 (д, J=2 3 Гц, 1Н), 6 68-6 73 (м, 2Н), 6 85 (д, J=2 3 Гц 1Н), 7 03 (д, J=8 2 Гц, 1Н), 7 06 (д, J=8 2 Гц 1Н), 7 23 (с, 1Н), 7 28 (с, 1Н), 8 74 (с, 1Н), 8 85 (с, 1Н) б) 3-[1-(1Н-імідазол-4-іл)-пропіл] -шдан-5-ол Суміш 4-[1 -(6-метоксмндан-1 -іл)-пропіл]-1 Німідазола (174мг) і 48% бромоводневої' кислоти (9мл) нагрівають при перемішуванні зі зворотним холодильником протягом 50 хвилин Охолоджену реакційну суміш виливають у воду і підлужують розчином гідроксиду амонію Продукт екстрагують етилацетатом, який промивають водою, сушать сульфатом натрію і випаровують досуха Неочищений продукт очищають флеш-хроматографією з використанням суміші метиленхлорид-метанол в якості елюенту Продукт є сумішшю двох діастереомерів (1 1) 1 Н Я М Р (MeOH-d4) 0,79 (т, ЗН), 0 84 (т, ЗН), 1 60-2 14 (м, 8Н), 2 51-2 63 (м, 4Н), 2 78-2 85 (м, 2Н), 3 27-3 38 (м, 2Н), 6 31 (д, J=2 2 Гц, 1Н), 6 516 55 (м, 2Н), 6 59 (с, 1Н), 6 64 (с, 1Н), 6 68 (д, J=2,2 Гц, 1Н), 6 89 (д, J=8 5 Гц, 1Н), 6 92 (д, J=8 5 Гц, 1Н), 7 52 (с, 1Н), 7 59 (с, 1Н) 31 49847 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 32
ДивитисяДодаткова інформація
Назва патенту англійськоюImidazole derivatives having affinity for a2 receptors, pharmaceutical composition and curing method
Автори англійськоюHuhtala Paavo
Назва патенту російськоюПроизводные имидазола, которые имеют родственность к активности a2-рецепторов, фармацевтическая композиция и способ лечения
Автори російськоюХухтала Пааво
МПК / Мітки
МПК: A61P 9/12, A61P 25/00, A61P 27/06, A61P 25/06, C07D 233/54, A61K 31/415, A61P 27/00, A61K 31/00, A61P 9/00, C07D 233/58, A61K 31/4164
Мітки: лікування, спорідненість, композиція, спосіб, мають, фармацевтична, похідні, активності, a2-рецепторів, імідазолу
Код посилання
<a href="https://ua.patents.su/16-49847-pokhidni-imidazolu-shho-mayut-sporidnenist-do-aktivnosti-a2-receptoriv-farmacevtichna-kompoziciya-ta-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні імідазолу, що мають спорідненість до активності a2-рецепторів, фармацевтична композиція та спосіб лікування</a>
Попередній патент: Обладнання для виготовлення сирових шин для транспортних засобів
Наступний патент: Спосіб очищення підземних вод
Випадковий патент: Пристрій для визначення механічних напружень у феромагнітних конструкціях