Алкілзаміщені 1,4-біс-(5-арилоксазоліл-2)бензоли як органічні люмінофори з підвищеною розчинністю в органічних розчинниках
Номер патенту: 77020
Опубліковано: 16.10.2006
Автори: Афанасіаді Людмила Михайлівна, Мусатов Володимир Іванович, Десенко Сергій Михайлович, Лисова Інна Вікторівна
Формула / Реферат
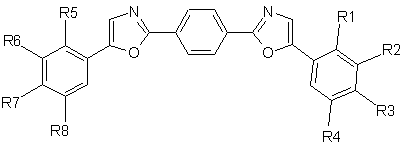
Алкілзаміщені 1,4-біс(5-арилоксазоліл-2)бензоли загальної формули І:
 ,
,
(І)
де R1=СН3, R2=R3=R4=R5=R6=R7=R8=H;
R2=СН3, Rl=R3=R4=R5=R6=R7=R8=H;
R2=R3=СН3, R1=R4=R5=R6=R7=R8=H;
R1=R4=R5=R8=CH3, R2=R3=R6=R7=Η;
R1=R3=R5=R7=CH3, R2=R4=R6=R8=H;
R2=R3=R6=R7=СН3, R1=R4=R5=R8=H;
R1=R2=R3=R5=R6=R7=СН3, R4=R8=Η;
R3=R7=С(СН3)3, R1=R2=R4=R5=R6=R8=H,
як органічні люмінофори з підвищеною розчинністю в органічних розчинниках.
Текст
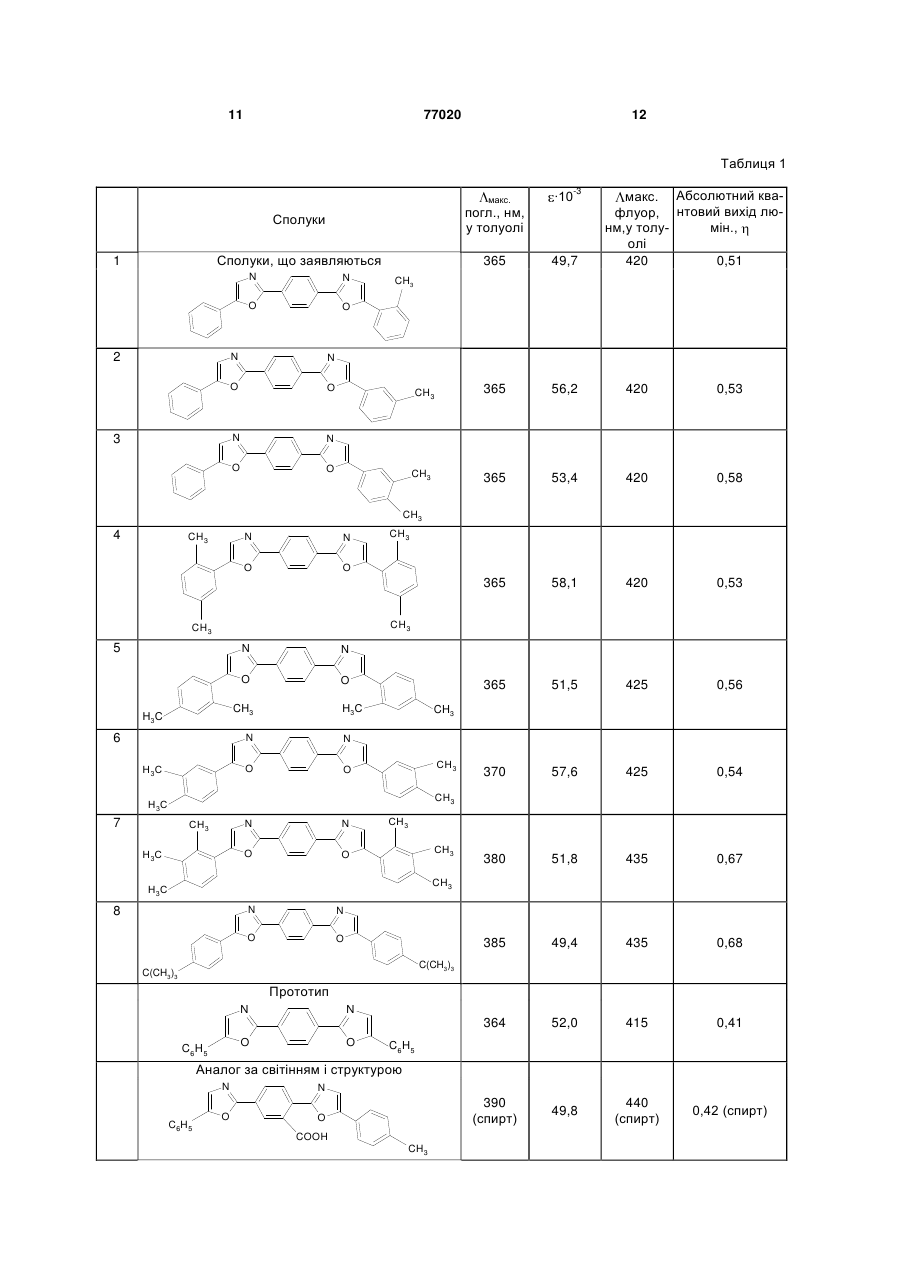
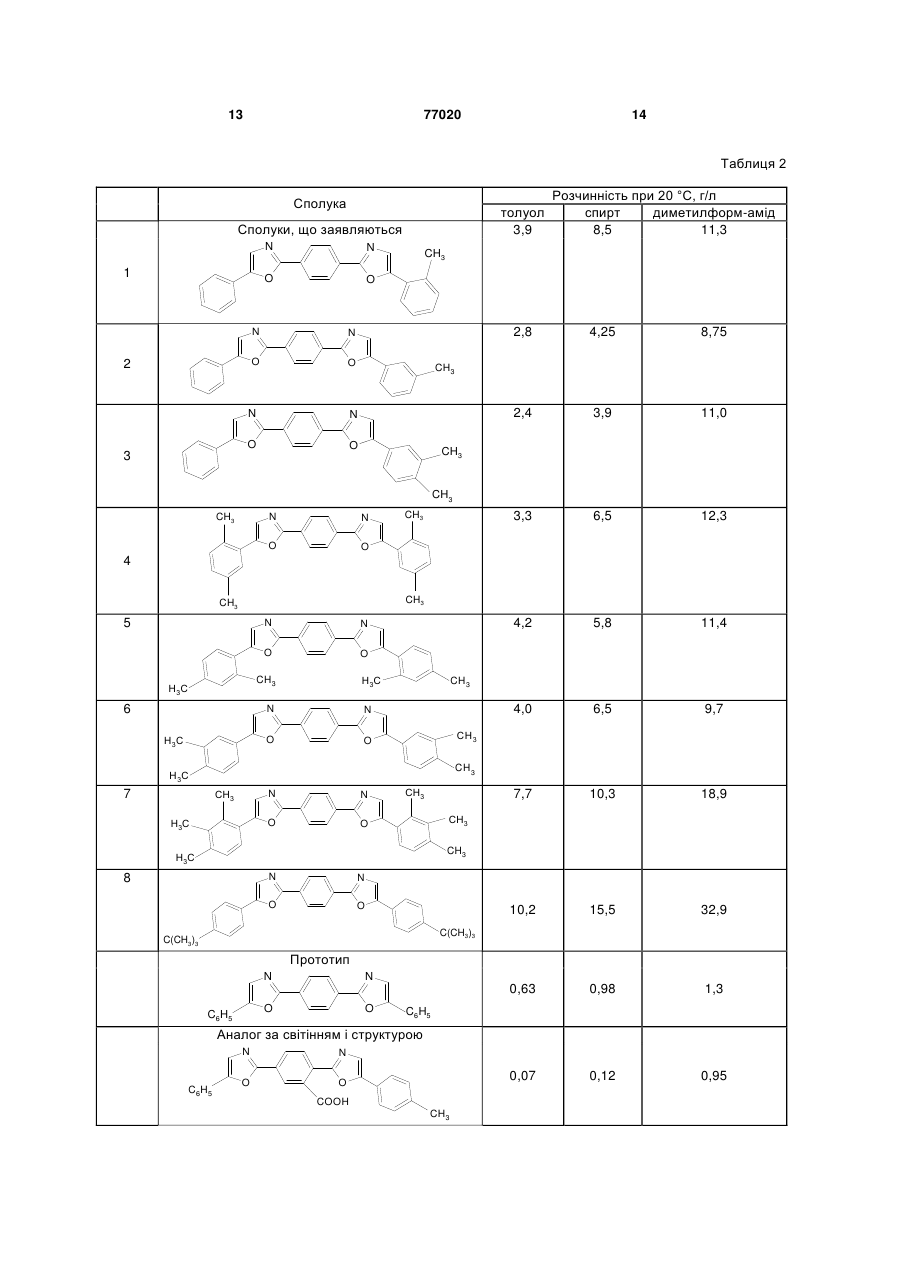
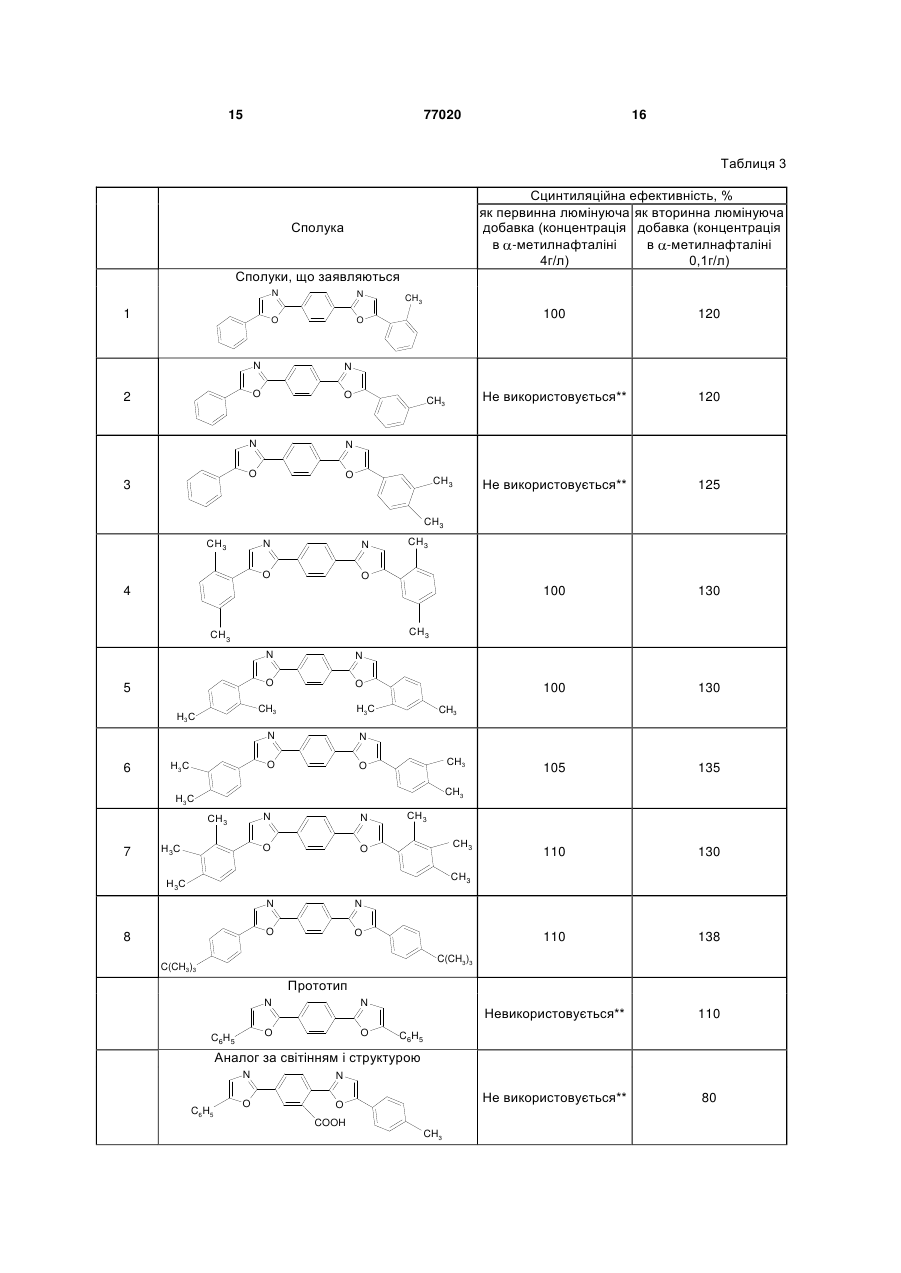
Алкілзаміщені 1,4-біс(5-арилоксазоліл2)бензоли загальної формули І: 3 77020 в якості люмінуючих добавок в органічних сцинтиляторах, оптичних вибілювачах синтетичних і полімерних матеріалів, при одержанні денних флуоресцентних пігментів і барв та інших цілей. Сполуки, що заявляються, у літературі не описані. Найближчим аналогом до заявляємих сполук І є 2-(5-фенілоксазо-ліл-2)-5-(2-арилоксазоліл-2) бензоли [А.С. 1078859, С09К11/06, 1982] загальної формули II. N C6H5 N O O COOH Ar , (ІІ) Їх одержують із 4-(5-фенілоксазоліл-2) фталевого ангідриду і відповідних гідрохлоридів аміноацетофенонів з наступною циклодегідратацією утворених ациламідів 4-(5фенілоксазоліл-2) фталевої кислоти у концентрованій сірчаній кислоті. Максимуми люмінесценції цих сполук лежать в синьо-блакитній області 440-450нм, абсолютні квантові виходи люмінесценції у толуолі складають 0,40-0,47. До недоліків аналога слід віднести дуже низьку розчинність у органічних розчинниках. Так, розчинність 2-(5-фенілоксазоліл-2)-5-[5-(4метилфенілоксазоліл-2) бензойної кислоти ( макс. люмінесцен ції у спирті 440нм, абсолютний квантовий вихід люмінесценції 0,42 ) при 20°С складає: віл толуолу - 0,07г, в 1л етанолу - 0,12г, в 1л диметил-формамиду - 0,95г. Ось чому використання органічних люмінофорів формули II обмежується застосуванням їх лише у водних лужних середовищах, в яких вони розчиняються і мають достатньо інтенсивну люмінесценцію. У сцинтиляційній техніці внаслідок низької розчинності в сцинтиляційних розчинниках (толуол, ксилол, метилнафта лін та інші) ці люмінофори не використовуються. Крім цього, недостатньо високий квантовий вихід люмінесценції ( 0,4) перешкоджає широкому використанню цих речовин. Серед симетричних похідних фенілоксазолілбензолу відомий люмінофор синьо-фіолетового світіння 1,4-біс(5-фенілоксазоліл-2)бензол (РОРОР) [Б.М. Красовицкий, Л.М. Афанасиади. Препаративная химия органических люминофоров. Харьков, «Фолио». - 1997. - С.89]. Він трудно розчиняється у бензолі, толуолі, піридині. Не розчиняється у воді. Максимум поглинання цієї сполуки у толуолі - 364нм, коефіцієнт молярного поглинання - 52000. Максимум люмінесценції у толуолі лежить при довжині хвилі 415нм, абсолютний квантовий вихід люмінесценції складає 0,41. Максимум люмінесценції РОРОР лежить в області максимальної чутливості фотоелектронних помножувачів, які найчастіше використовуються у сцинтиляційній техніці, що обумовлює його широку потребу в указаних областях, наприклад, при створенні рідких і пластмасових сцинтиляторів. 4 Відомий люмінофор одержують конденсацією дихлорангідриду терефталевої кислоти і аміноацетофенону гідрохлориду з наступною циклодегідратацією утвореного ациламіду в сірчаній кислоті. Недоліком відомого люмінофору є його дуже низька розчинність в органічних розчинниках. При кімнатній температурі розчинність РОРОР у толуолі складає всього лише 0,63г/л, що дозволяє використовувати його тільки в якості змішувача спектрів (вторинної люмінуючої добавки) у рідких та пластмасових сцинтиляторах. Для використання відомого люмінофору в якості первинної люмінуючої добавки його розчинність в інертних розчинниках, що використовуються у сцинтиляційній техніці, повинна перевищувати 4г/л. Це обмежує області застосування РОРОРа. Крім того, слід відзначити, що максимум люмінесценції РОРОР лежить в синьо-фіолетовій області, а інтенсивність люмінесценції відомого люмінофора порівняльне невисока ( 0,41) , що також обмежує його широке використання в тих областях науки, де необхідно довгохвильове та інтенсивне світіння у розчинах. Цей відомий люмінофор прийнято нами за прототип, тому що він є найбільш близьким до сполук, що заявляються, за структурою. Задача винаходу, що заявляється, складається у виявленні серед 1,4-біс(5-арилоксазоліл-2) бензолів сполук, що мають більш високу розчинність в органічних розчинниках і більш довгохвильову і інтенсивну люмінесценцію у цих середовищах. Рішення цієї задачі досягається розробкою модифікованої хімічної структури, вираженої загальною формулою І R6 N N O R5 R1 O R2 R3 R7 R8 R4 , (І) де R1=СН3 R2=R3=R4=R5=R6=R7=R8=Н; R2=СН3 R1=R3=R4=R5=R6=R7=R8=Н; R2=R3=СН3 R1=R4=R5=R6=R7=R8=Н; R1=R4=R5=R8=СН3 R2=R3=R6=R7=Н; R1=R3=R5=R7=СН3 R2=R4=R6=R8=Н; R2=R3=R6=R7=СН3 R1=R4=R5=R8=Н, R1=R2=R3=R5=R6=R7=СН3 R4=R8=Н; R3=R7=С(СН3)3 R1=R2=R4=R5=R6=R8=Н. Сполуки І вміщають у своїй видозміненій структурі метильні та трет-бутильні групи, що знаходяться у різних сполученнях в кінцевих фенільних кільцях молекули 1,4-біс(5-арилоксазоліл2)бензолу. Це приводить до підвищення розчинності сполук заявляємої структури в органічних розчинниках, зміщенню максимуму люмінесценції в більш довгохвильову область і виникненню більш інтенсивної люмінесценції в синьо-блакитній області спектру, що досягається введенням різної кількості метильних груп в різні положення сполук заявляємої структури. При збільшенні кількості метильних груп у молекулах сполук І різко зростає їх розчинність в органічних розчинниках при кімна 5 тній температурі і їх інтенсивність люмінесценції у розчинах. Сполуки, що заявляються, загальної формули І на відміну від прототипу і аналога за світінням не мають недоліків, що притаманні вказаним структурам. Це передбачає широке використання їх в сцинтиляційній техніці при створенні нових органічних сцинтиляторів в лазерній техніці, використання в якості ефективних люмінуючих добавок в денних флуоресцентних пігментах і фарбах і таке інше. Сполуки загальної формули І - алкілзаміщені 1,4-біс(5-арилоксазо-ліл-2)бензолу одержують взаємодією терефталевої кислоти з п'ятихлористим фосфором, наступною конденсацією утвореного продукту з відповідними моно-, ді- та триалкілзаміщеними со-аміноацетофенону і циклодегідратацією у концентрованій сірчаній кислоті. Одержані алкілзаміщені 1,4-біс(5арилоксазоліл-2)бензолу синтезовано вперше. Структуру цих сполук доказано фізико-хімічними методами, підтверджено даними елементного аналізу і спектральними методами. Сполуки І піддавали очищенню на хроматографічній колонці на оксиді алюмінію (елюент - толуол, ксилол) з наступною перекристалізацією із відповідних розчинників. Нижче винахід ілюструється прикладами. Приклад 1 Одержання 1-(5-фенілоксазоліл-2)-4-[5-(2метилфеніл)-оксазоліл-2] бензолу (табл.1, поз.1). 25,1г (0,1М) 4-(5-фенілоксазоліл-2)бензойної кислоти кип'ятять у 200мл хлористого тіонілу впродовж 2 годин. Надлишок хлористого тіонілу відганяють у вакуумі водоструминного насосу, залишок розчиняють у 300мл бензолу. До цього розчину додають 18,5г (0,1М) гідрохлориду 2 метил аміноацетофенону у 185мл води, а потім краплями 10% Nа2СО3 до слабо лужної реакції (pH 9) на лакмус. Випадає осад, що відфільтровують, промивають водою, сушать і розчиняють у 10-кратній (за масою) кількості концентрованої Н2SO4. Одержаний розчин витримують 2 години при кімнатній температурі, виливають на лід. Осадок відфільтровують, промивають водою до нейтральної реакції на лакмус. Технічний продукт очищають хроматографуванням бензольного розчину на Аl2О3. Безбарвні кристали з температурою плавлення 203°С. Вихід: 19,6г (52%). Вихідні дані: Знайдено, %: С 79,90; Н 4,28; N 7,51. C25H17N2O2. Обчислено, %: С 79,57; Н 4,50; N 7,42. ЯМР спектр (DMSO-d6): (м.ч.) 7,76; 7,93 (2Н, с, оксазольні ядра); 8,24 (4Н, с, 1,4-феніленове ядро); 7,67 (1Н, м, Н6 - першого кінцевого фенільного ядра); 7,20-7,91 (8Н, м, першого і другого кінцевих фенільних ядер); 2,31 (3Н, с, метильна група першого кінцевого фенольного ядра). УФ спектр поглинання (толуол): макс. 365нм, x 10 3 49,7 . 77020 6 Спектр люмінесценції (толуол): макс. 420нм. Абсолютний квантовий вихід люмінесценції у толуолі - 0,51. Приклад 2 Одержання 1-(5-фенілоксазоліл-2)-4-[5-(3метил феніл)оксазоліл-2]бензолу (табл.1, поз.2). Продукт одержують за методикою, аналогічною тій, що описано у прикладі 1. Вихідні дані: Вихід 16,2г (43%). Т.пл. 191-192°С. Знайдено, %: С 79,64; Н 4,58; N 7,28. C25H17N2О2. Обчислено, %: С 79,57; Н 4,50; N 7,42. ЯМР спектр (DMSO-d6): (м. ч.) 7,79; 7,90 (2Н, с, оксазольні ядра); 8,23 (4Н, с, 1,4феніленове ядро); 7,18-7,97 (9Н, м, перше і друге кінцеві фенільні ядра); 2,29 (3Н, с, метильна група першого кінцевого фенольного ядра). УФ спектр поглинання (толуол): макс. 365нм, x 10 3 56,2 . Спектр люмінесценції (толуол): макс. 420нм. Абсолютний квантовий вихід люмінесценції у толуолі - 0,53. Приклад 3 Одержання 1-(5-фенілоксазоліл-2)-4-[(3,4диметил-феніл)оксазоліл-2] бензолу (табл.1, поз.3). Продукт одержують за методикою, аналогічною тій, що описано у прикладі 1. Для реакції беруть: 25,1г (0,1М) 4-(5фенілоксазоліл-2)бензойної кислоти, 20г (0,1 М) гідрохлориду 3,4 диметил аміноацетофенону . Вихідні дані: Вихід 18,8г (48%). Т.пл. 208-210°С. Знайдено, %: С 79,71; Н 5,15; N 6,98. С26H20N2O2. Обчислено, %: С 79,59; Н 5,10; N 7,14. ЯМР спектр (DMSO-d6): (м.ч.) 7,81; 7,91 (2Н, с, оксазольні ядра); 8,23 (4Н, с, 1,4-феніленове ядро); 7,66 (1Н, м, Н6 першого фенільного кінцевого ядра); 7,25-7,9 (7Н, м, першого і другого кінцевого фенільних ядер); 2,26 (3Н, с, метильна група); 2,29 (3Н, с, метильна група). УФ спектр поглинання (толуол): макс. 365нм, x 10 3 53,4 . Спектр люмінесценції (толуол): макс. 420нм. Абсолютний квантовий вихід люмінесценції у толуолі - 0,58. Приклад 4 Одержання 1,4-біс[5-(2,5диметилфеніл)оксазоліл-2]-бензолу (табл.1, поз.4). Суміш 12,4г (0,075М) терефталевої кислоти і 31,3г (0,15М) РСl5 нагрівають 2 години при 100°С. Потім розплав кип'ятять ще 2 години і відганяють РОСl3. Залишок розчиняють у 75мл діоксану, краплями додають розчин 20г (0,1М) гідрохло2,5 диметил аміноацетофенону риду в 150мл льодяної води. До реакційної суміші одночасно приливають 100мл 10%-ного розчину 7 Nа2СО3, розмішують 3 години при 20°С, додають ще 75мл 10%-ного Na2CO3. Витримують 12 годин, осад відфільтровують, промивають льодяною водою, сушать. Сухий продукт розчиняють у концентрованій H2SO4 (на 1г продукту беруть 10мл кислоти), перемішують 1,5 години при кімнатній температурі і виливають на льод. Осад фільтрують, промивають льодяною водою до нейтральної реакції промивних вод, сушать. Очищають хроматографуванням толуольного розчину на Аl2О3. Вихідні дані: Вихід 19,2г (61%). Т.пл. 229-230°С. Знайдено, %: С 80,39; Н 5,58; N 6,56. C28H24N2O2. Обчислено, %: С 80,00; Н 5,71; N 6,66. ЯМР спектр (DMSO-d6): (м.ч.) 7,68 (2Н, с, оксазольні ядра); 8,25 (4Н, с, 1,4-феніленове ядро); 7,68 (2Н, м, Н6, Н'6 кінцевих фенільних ядер); 7,26 (2Н, м, Н4, Н4 кінцевих фенільних ядер); 7,14 (2Н, м, Н3, Н'3 кінцевих фенільних ядер); 2,36 (6Н, с, метильна група); 2,41 (6Н, с, метильна група). УФ спектр поглинання (толуол): макс. 365нм, x 10 3 58,1 . Спектр люмінесценції (толуол): макс. 420нм. Абсолютний квантовий вихід люмінесценції у толуолі - 0,53. Приклад 5 Одержання 1,4-біс[5-(2,4диметилфеніл)оксазоліл-2]-бензолу (табл.1, поз.5). Продукт одержують за методикою, аналогічною тій, що описано у прикладі 4. Для реакції беруть 12,4г (0,075М) терефталевої кислоти, 31,3г (0,15М) РСІ5, 20 г (0,1М) 2,4-диметил-соаміноацетофенону гідрохлориду. Вихідні дані: Вихід 18,2г (58%). Т.пл. 251-252°С. Знайдено, %: С 79,84; Н 5,93; N 6,38. С28Н24N2O3. Обчислено, %: С 80,00; Н 5,71; N 6,66. ЯМР спектр (DMSO-d6): (м.ч.) 7,63 (2Н, с, оксазольні ядра); 8,23 (4Н, с, 1,4-феніленове ядро); 7,75 (2Н, м, Н6, Н'6 кінцевих фенільних ядер); 7,16 (2Н, м, Н5, Н5 кінцевих фенільних ядер); 7,19 (2Н, м, Н3, Н'3 кінцевих фенільних ядер); 2,32 (6Н, с, метильна група); 2,39 (6Н, с, метильна група). УФ спектр поглинання (толуол): макс. 365нм, x 10 3 515 . , Спектр люмінесценції (толуол): макс. 420нм. Абсолютний квантовий вихід люмінесценції у толуолі - 0,56. Приклад 6 Одержання 1,4-біс[5-(3,4диметилфеніл)оксазоліл-2]-бензолу. Одержують за методикою, аналогічною тій, що описано у прикладі 4, із 12,4г (0.075М) терефталевої кислоти, 31,3г (0,15М) РСl5, 20г (0,1М) гідрохлориду 2,4-диметил-со-аміноацетофенону. Вихідні дані: Вихід 22,3г (71%). Т.пл 208-210°С. Знайдено, %: С 79,79; Н 6,07; N 6,88. C28H24N2O2. 77020 8 Обчислено, %: С 80,00; Н 5,71; N 6,66. ЯМР спектр (DMSO-d6): (м.ч.) 7,81 (2Н, с, оксазольні ядра); 8,22 (4Н, с, 1,4-феніленове ядро); 7,66 (2Н, м, H2, Н'2 кінцевих фенільних ядер); 7,59 (2Н, м, Н6, Н'6 кінцевих фенільних ядер); 7,27 (2Н, м, Н5, Н'5 кінцевих фенільних ядер); 2,27 (6Н, с, метильна група); 2,30 (6Н, с, метильна група). УФ спектр поглинання (толуол): макс. 370нм, x 10 3 57,6 . Спектр люмінесценції (толуол): макс. 425нм. Абсолютний квантовий вихід люмінесценції у толуолі - 0,54. Приклад 7 Одержання 1,4-біс[5-(2,3,4триметилфеніл)оксазоліл-2]-бензолу (табл.1, поз.7). Одержують за методикою, аналогічною тій, що описано у прикладі 4, із 12,4г (0.075М) терефталевої кислоти, 31,3г (0,15М) РСl5, 21,3г (0,1М) гідро хлориду 2,3,4-три метил аміноацетофенону . Вихідні дані: Вихід 14,7г (44%). Т.пл. 278-280°С. Знайдено, %: С 75,5; Н 6,09; N 6,49. С30Н28N2O2. Обчислено, %: С 75,0; Н 6,25; N 6,25. ЯМР спектр (DMSO-d6): (м.ч.) 7,67 (2Н, с, оксазольні ядра); 8,25 (4Н, с, 1,4-феніленове ядро); 7,54 (2Н, д, І=8,0Гц, Н6, Н'6 кінцевих фенольних ядер); 7,23 (2Н, д, І=8,0Гц, Н5, H'5 кінцевих фенільних ядер); 2,26 (3Н, с, метильна група); 2,31 (3Н, с, метильна група); 2,37 (3Н, с, метильна група). УФ спектр поглинання (толуол): макс. 380нм, x 10 3 518 . , Спектр люмінесценції (толуол): макс. 435нм. Абсолютний квантовий вихід люмінесценції у толуолі - 0,67. Приклад 8 Одержання 1,4-біс[5-(4трет.бутилфеніл)оксазоліл-2]бензолу (табл.1, поз.8). Одержують за методикою, аналогічною тій, що описано у прикладі 4, із 12,4г (0,075М) терефталевої кислоти, 31,3г (0,15М) РСl3 і 22,7г (0,1М) гідро хлориду 4 трет.бутил аміноацетофенону . Вихідні дані: Вихід 10,7г (47%). Т.пл. 283-285°С. Знайдено, %: С 80,41; Н 7,1; N 6,0. C32H32N2O2. Обчислено, %: С 80,7; Н 6,7; N 5,85. ЯМР спектр (DMSO-d6): (м.ч.) 7,85 (2Н, с, оксазольні ядра); 8,24 (4Н, с, 1,4-феніленове ядро); 7,79 (4Н, д, І=8,1Гц кінцевих фенільних ядер); 7,53 (4Н, д, І=8,1 Гц кінцевих фенільних ядер); 1,31 (18Н, с, трет. бутильні групи кінцевих фенільних ядер). УФ спектр поглинання (толуол): макс. 385нм; x 10 3 52,0 . Спектр люмінесценції (толуол): макс. 435нм. Абсолютний квантовий вихід люмінесценції у толуолі - 0,68. 9 Іспити алкілзаміщених 1,4-біс(5-арилоксазоліл2)бензолу в якості органічних люмінофорів. Спектри УФ поглинання і люмінесценції виміряно у толуолі, визначено абсолютні квантові виходи люмінесценції у толуолі. Виміряно спектри ядерномагнітного резонансу в дейтерованому диметилсульфоксиді. Визначено розчинність сполук, що заявляються, у толуолі, етанолі і диметилформаміді. Одночасно проведено вимірювання розчинності у цих розчинниках прототипу і аналога за структурою і світінням. Спектри люмінесценції виміряно на установці, яка складається із дзеркального монохроматора ЗМР-3, фотоелектронного помножувача ФЕП-18, мікроамперметра М-95; джерелом збудження була лампа СВДШ-500, із спектра якої виділяли лінію збудження 365нм. Абсолютні квантові виході люмінесценції визначали методом рівного поглинання. Константи люмінесценції сполук, що заявляються, прототипу і аналога за структурою і світінням представлено у таблиці 1. Із даних опису заявки і таблиці 1 видно, що сполуки, що заявляються, з урахуванням їх більш високої розчинності в розчинниках можуть бути використані в якості ефективних люмінофорів синьо-блакитного світіння в органічних розчинниках при кімнатній температурі. Вони люмінесціюють у видимій області спектра з високими квантовими виходами люмінесценції, приблизно в 1,5 рази вище, ніж у прототипу. Це дає можливість використовувати їх при одержанні органічних (рідких і пластмасових) сцинтиляторів, у денних флуоресцентних пігментах і фарбах, в якості оптичних вибілювачів, активних середовищ рідких лазерів і інше. Основною перевагою сполук, що пропонуються, є їх підвищена розчинність в органічних розчинниках. У таблиці 2 приведено порівняльні дані з розчинності сполук, що заявляються, прототипу і аналога за структурою і світінням. Як видно із даних таблиці 2, розчинність сполук, що заявляються, загальної формули І, в 1л толуолу і спирту при 20°С приблизно в 4-16 разів, віл диметилформаміду в 8-35 разів перевищує розчинність прототипу (розчинність аналога за структурою і світінням в 1л толуолу - в 35-145 разів, віл етилового спирту - в 30-130 разів, в 1л диметилформаміду 10-85 разів менше, ніж розчинність сполук, що заявляються). Поява більш інтенсивної люмінесценції в органічних розчинниках у сполук, що заявляються, є 77020 10 слідством особливостей модифікованої хімічної структури цих сполук. Це досягається введенням в молекулу прототипу алкільних (моно-, ди-, три метил- і трет.бутильної) груп несиметричного і симетричного складу. При цьому максимуми люмінесценції сполук, що заявляються, зсуваються у довгохвильову область спектра (420-435нм) у порівнянні з прототипом (415нм) при суттєвому зростанні абсолютних квантових виходів люмінесценції (у сполук, що заявляються, 0,51-0,68, у прототипу 0,41). Підвищена розчинність і висока інтенсивність люмінесценції сполук, що пропонуються, в органічних розчинниках при кімнатній температурі дає можливість використовувати їх в рідких сцинтиляторах як в якості первинної, так і в якості вторинної люмінуючих добавок. Так, прототип і аналог за світінням і структурою внаслідок низької розчинності в органічних розчинниках (менш 4г/л) не використовуються в рідких сцинтилляторах. Сполуки, що пропонуються, розчинність яких в сцинтиляційному розчиннику метилнафта лін - складає більш 4г/л, можуть з успіхом використовуватися в якості первинної люмінуючої добавки у рідких сцинтиляторах. У таблиці 3 наведено сцинтиляційні характеристики сполук, що пропонуються, загальної формули І в сцинтиляційному розчиннику метилнафта лін , що має дуже високу оптичну прозорість. Із даних таблиці 3 видно, що сполуки І можуть використовуватися також і в якості вторинної люмінуючої добавки. За сцинтиляційною ефективністю сполуки І перевищують прототип на 20-30%, аналог за світінням і структурою - на 40-60%. Таким чином, сполуки загальної формули І, як видно із опису заявки і таблиць 1-3, мають такі переваги перед прототипом: - більш високу розчинність в органічних розчинниках при кімнатній температурі; - більш високу інтенсивність люмінесценції в органічних розчинниках; - можливість використання їх у рідких сцинтиляторах як у якості первинної, так і в якості вторинної люмінуючих добавок з високими сцинтиляційними характеристиками; - з'явилася можливість використання сполук, що заявляються, в рідких сцинтиляторах в якості первинної люмінуючої добавки з довгохвильовою люмінесценцією без використання вторинної люмінуючої добавки, що значно удешевить вартість таких сцинтиляторів. 11 77020 12 Таблиця 1 макс. Сполуки Сполуки, що заявляються 1 ∙10-3 погл., нм, у толуолі макс. Абсолютний квафлуор, нтовий вихід люнм,у толумін., олі 420 0,51 365 56,2 420 0,53 365 53,4 420 0,58 58,1 420 0,53 365 51,5 425 0,56 370 57,6 425 0,54 380 51,8 435 0,67 49,4 435 0,68 364 52,0 415 0,41 390 (спирт) 49,8 440 (спирт) 0,42 (спирт) O N O N N O CH3 N O 3 49,7 385 O 2 N 365 365 N O CH3 CH3 CH3 4 CH3 N N O CH3 O CH3 CH3 5 N N O O H3 C CH3 H3C 6 N N O H3 C CH3 O CH3 CH3 H3C 7 CH3 N O H3C N CH3 O CH3 CH3 H3C 8 N N O O C(CH3)3 C(CH3)3 Прототип N N O C6H5 O C6H5 Аналог за світінням і структурою N C6H5 N O O COOH CH3 13 77020 14 Таблиця 2 Сполука толуол 3,9 Сполуки, що заявляються N O 1 N Розчинність при 20 °С, г/л спирт диметилформ-амід 8,5 11,3 O CH3 3,9 11,0 6,5 12,3 4,2 5,8 11,4 4,0 6,5 9,7 7,7 10,3 18,9 10,2 15,5 32,9 0,98 1,3 0,07 0,12 0,95 CH3 N N O 3 8,75 3,3 O 4,25 2,4 N O 2 2,8 0,63 N O CH3 CH3 CH3 N N O CH3 O 4 CH3 CH3 5 N N O O H3 C CH3 H3C 6 N N O H3 C CH3 O CH3 CH3 H3C 7 CH3 N O H3C N CH3 O CH3 CH3 H3C 8 N N O O C(CH3)3 C(CH3)3 Прототип N O C6H5 N O C6H5 Аналог за світінням і структурою N C6H5 N O O COOH CH3 15 77020 16 Таблиця 3 Сцинтиляційна ефективність, % як первинна люмінуюча як вторинна люмінуюча добавка (концентрація добавка (концентрація в -метилнафталіні в -метилнафталіні 4г/л) 0,1г/л) Сполука Сполуки, що заявляються N N O 1 O CH3 N Не використовується** 125 130 130 105 135 110 130 110 138 Невикористовується** 110 Не використовується** CH3 80 N O 3 120 100 O Не використовується** N O 2 120 100 N 100 O CH3 CH3 CH3 N N O CH3 O 4 CH3 CH3 N O 5 N O H3 C CH3 H3C N 6 N O H3 C CH3 O CH3 CH3 H3C CH3 7 N O H3C N CH3 O CH3 CH3 H3C N O 8 N O C(CH3)3 C(CH3)3 Прототип N O C6H5 N O C6H5 Аналог за світінням і структурою N C6H5 N O O COOH CH3 17 77020 18 * В якості первинної люмінуючої добавки з концентрацією 4г/л в -метилнафталіні використовується 2(4-біфеніліл)-5-фенілоксазол (ВРО) ** Внаслідок низької розчинності в -метилнафталіні (
ДивитисяДодаткова інформація
Назва патенту англійськоюAlkyl substituted 1,4-bis(5-aryloxazolyl-2) benzols as organic luminophors with increased solubility in organic dissolvents.
Автори англійськоюAfanasiadi Liudmyla Mykhailivna, Desenko Serhii Mykhailovych, Lysova Inna Viktorivna, Musatov Volodymyr Ivanovych
Назва патенту російськоюАлкилзамещенные 1,4-бис-(5-арилоксазолил-2)бензолы как органические люминофоры с повышенной растворимостью в органических растворителях
Автори російськоюАфанасиади Людмила Михайловна, Десенко Сергей Михайлович, Дэсэнко Сергей Михайлович, Лисова Инна Викторовна, Мусатов Владимир Иванович
МПК / Мітки
МПК: C07D 263/32, C09K 11/06, C07D 413/10
Мітки: підвищеною, 1,4-біс-(5-арилоксазоліл-2)бензоли, алкілзаміщені, люмінофори, розчинністю, органічних, органічні, розчинниках
Код посилання
<a href="https://ua.patents.su/9-77020-alkilzamishheni-14-bis-5-ariloksazolil-2benzoli-yak-organichni-lyuminofori-z-pidvishhenoyu-rozchinnistyu-v-organichnikh-rozchinnikakh.html" target="_blank" rel="follow" title="База патентів України">Алкілзаміщені 1,4-біс-(5-арилоксазоліл-2)бензоли як органічні люмінофори з підвищеною розчинністю в органічних розчинниках</a>
Попередній патент: Спосіб та пристрій для зниження взаємного зношення рейки та коліс залізничного транспорту
Наступний патент: Спосіб одержання кристалічного дегідрату габапентину форми в, кристалічні дегідрати габапентину форми а та форми в
Випадковий патент: Пристрій для відокремлення домішок від коренеплодів