Застосування антагоністів фактора пухлинного некрозу для лікування або профілактики ендометріозу
Номер патенту: 78483
Опубліковано: 10.04.2007
Автори: Мартеллі Фабріціо, Д''антоніо Мауро, Борреллі Франческо
Формула / Реферат
Застосування антагоніста TNF, який запобігає або інгібує сигналізацію рецептора TNF, разом з фармацевтично прийнятним носієм при одержанні фармацевтичної композиції для лікування або профілактики ендометріозу. Застосування антагоніста TNF, який запобігає або інгібує сигналізацію рецептора TNF, разом з фармацевтично прийнятним носієм при одержанні фармацевтичної композиції для підвищення частоти імплантації і фертильності шляхом зменшення ендометріозних уражень. Застосування за п. 1 або 2, в якому вказаний антагоніст є секвестуючим антагоністом. Застосування за п. 1 або 2, в якому вказаний антагоніст є антагоністом сигналізації. Застосування за будь-яким з пп. 1-3, в якому вказаний антагоніст TNF являє собою поліпептид, здатний зв'язувати специфічний епітоп TNF таким чином, що TNF більше не здатний зв'язуватися з пов'язаним з мембраною рецептором TNF. Застосування за п. 5, в якому антагоніст TNF являє собою його рецепторну молекулу, похідне або фрагмент, який зв'язується з TNF. Застосування за п. 6, в якому рецепторна молекула вибрана з групи, яка складається з: TNF-RI і TNF-RII. Застосування за п. 6, в якому рецепторна молекула являє собою позаклітинний домен TNF-RI. Застосування за п. 6, в якому рецепторна молекула являє собою людський розчинний рекомбінантний TNF-RI. Застосування за п. 6, в якому рецепторна молекула являє собою багатовимірну молекулу рецептора TNF або її функціональну частину. Застосування за п. 10, в якому багатовимірна молекула рецептора TNF включає весь або функціональну частину двох або більше позаклітинних доменів рецепторів TNF, зв'язаних за допомогою одного або декількох поліпептидних лінкерів. Застосування за п. 6, в якому рецепторна молекула являє собою злиту молекулу імунорецептора або її функціональну частину. Застосування за п. 12, в якому злита молекула імунорецептора включає весь або функціональну частину рецептора TNF і ланцюг імуноглобуліну. Застосування за будь-яким з пп. 1-3, в якому антагоніст TNF являє собою антитіло проти TNF або його фрагмент. Застосування за п.14, в якому моноклональне антитіло вибрано з групи, що складається з: химерного моноклонального антитіла, гуманізованого моноклонального антитіла або його фрагмента. Спосіб лікування або профілактики ендометріозу, який включає введення пацієнтці терапевтично ефективної дози антагоніста TNF, який запобігає або інгібує сигналізацію рецептора TNF. Спосіб за п. 16, в якому антагоніст TNF являє собою його рецепторну молекулу або її похідне, або фрагмент, який зв'язується з TNF. Спосіб за п. 17, в якому рецепторна молекула вибрана з групи, яка складається з: TNF-RI і TNF-RII. Спосіб за п. 16, в якому антагоніст TNF являє собою антитіло проти TNF або його фрагмент.
Текст
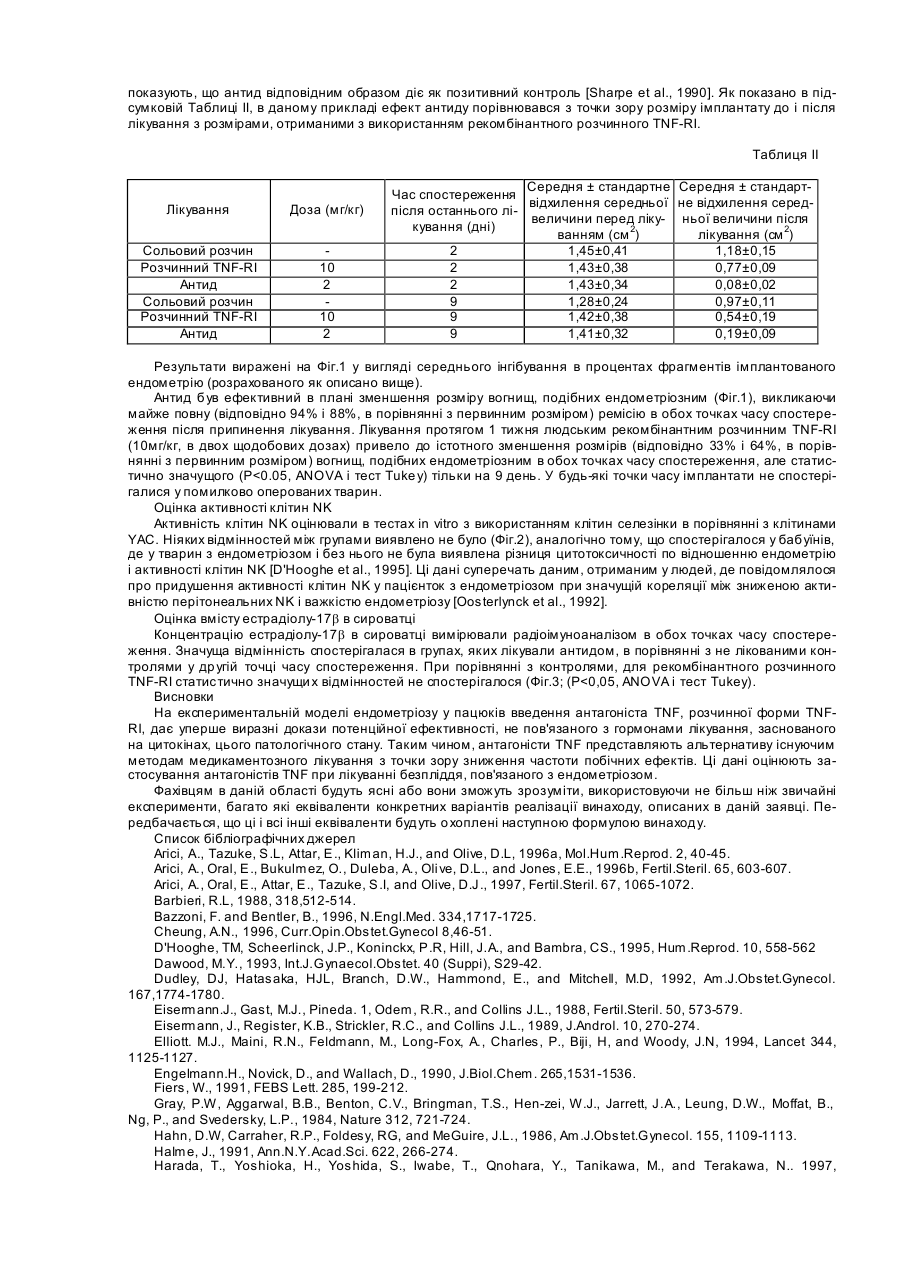
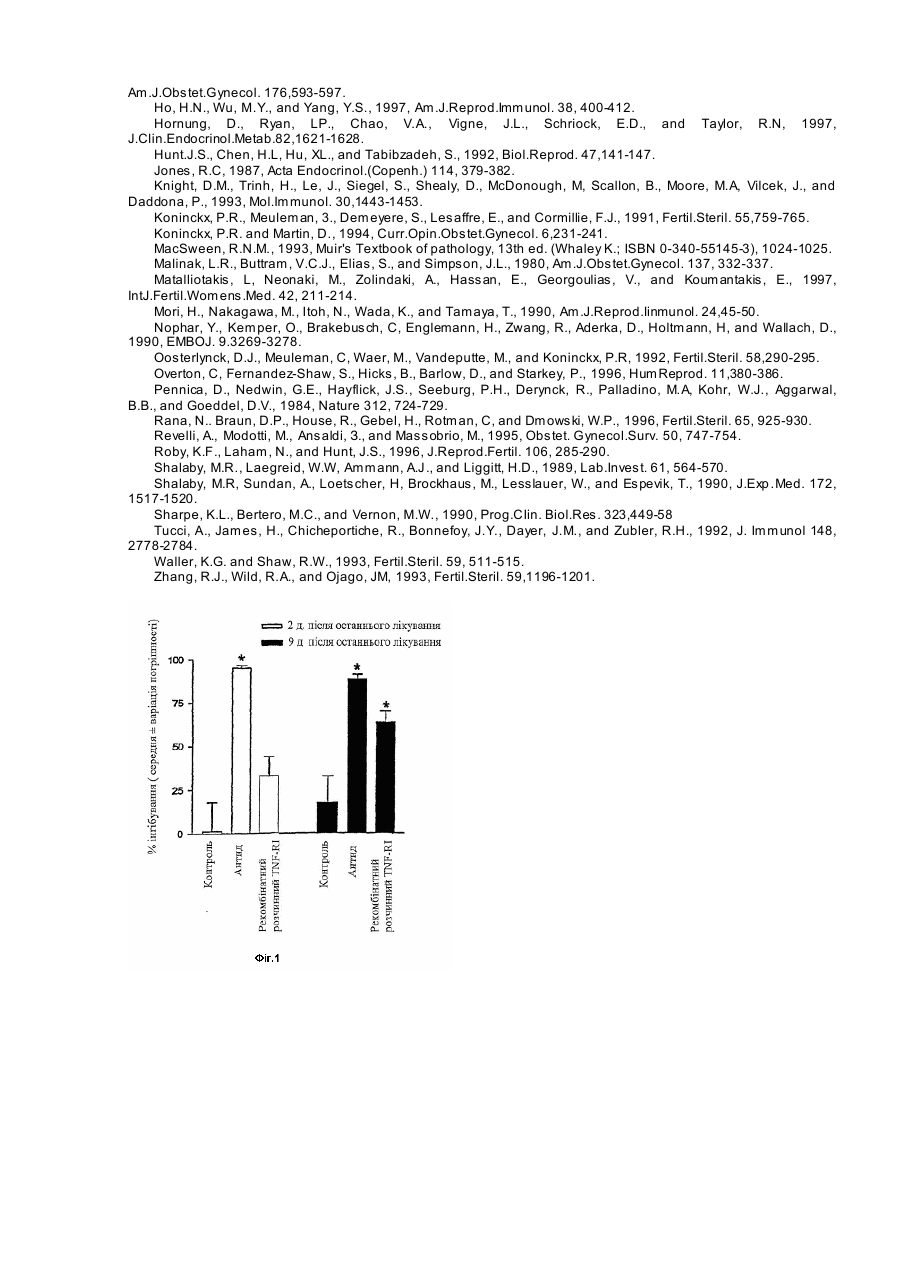
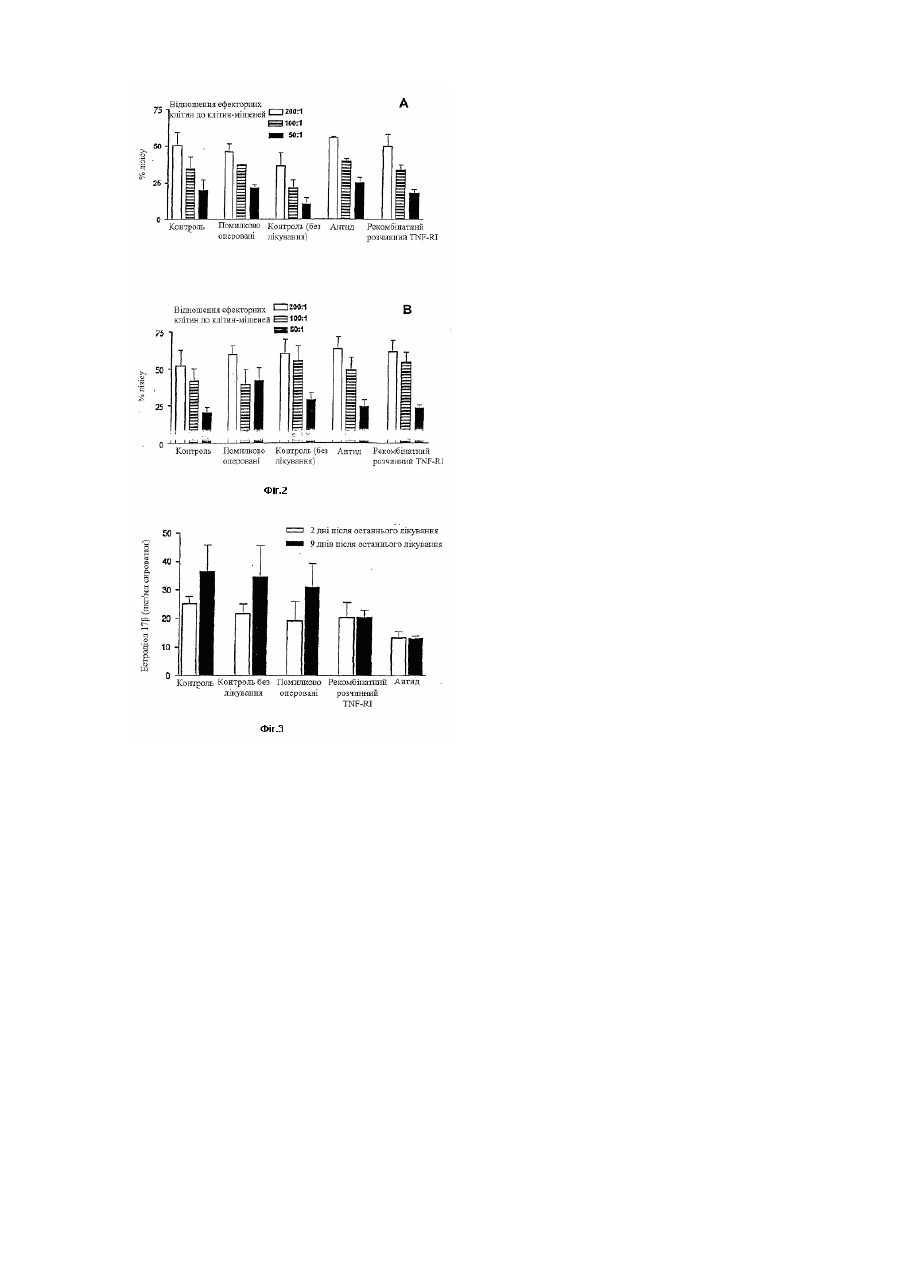
Антагоністи фактора пухлинного некрозу (TNF) вводяться в терапевтично ефективних дозах для лікування і/або профілактики ендометріозу. Антагоністи даного винаходу звичайно вибрані серед різних класів молекул, але переважно представляють розчинні рецептори TNF. Антагоністи можуть застосовуватися для того, щоб викликати зворотний розвиток ендометріозних поразок і, при комбінації з іншими активними інгредієнтами, для полегшення течії споріднених розладів, подібних безпліддю. Ендометріоз представляє захворювання жіночих статевих органів, що характеризується наявністю залоз і строми ендометрію поза порожниною ендометрію і маточною м'язовою тканиною. Анатомічними дільницями, що найчастіше вражаються є яєчники, маточно-крестцеві зв'язки, тазова черевина, ректо-вагінальна перегородка, шийка матки, піхва, фалопієви тр уби і вульва. Загалом, вірогідна глибока інфільтрація ендометріозу з ректо-вагінальної перегородки в підлягаючі тканини, і він може бути не видний на поверхні. Іноді можна зустріти осередки ендометріозу у позаяєчникових дільницях, таких як легені, сечовий міхур, шкіра, плевра і лімфовузли. Ендометріозні поразки носять прогресуючий характер; спочатку вони мають вигляд прозорих пухирців, які потім стають червоними і протягом періоду декількох років прогресують в чорні, фібротичні поразки [MacSween, 1993]. Ендометріоз вважається доброякісним захворюванням, але іноді ендометріозні поразки стають злоякісними. Як і при інших видах злоякісних поразок, розвиток новоутворень, що відбуваються з ендометріозу, пов'язаний з супутніми процесами, що залучають зміни факторів росту і/або регуляції онкогенів [Cheung, 1996]. Ендометріоз є одним з самих поширених гінекологічних захворювань з поширеністю серед жінок репродуктивного віку: це захворювання виявляється приблизно у 5-10% жінок в репродуктивному віці [Barbieri., 1988]. Для росту, що продовжується, включаючи ектопічні дільниці локалізації, ендометріозна тканина повністю залежить від естрогену. Отже, ендометріоз рідко зустрічається перед початком менструацій і після менопаузи, коли у жінок є недостатність естрогену. Ендометріозна гормональна чутливість лежить в основі деяких з найбільш поширених симптомів, якими є біль в області таза і дисменорея. Ендометріоз виникає з клітин ендометрію, які дисемінували з матки в інші дільниці, куди можуть проникати і де можуть рости життєздатні клітини. Для пояснення початкового поширення клітин було запропоновано два можливих механізми. Ретроградна менструація, феномен, що часто з устрічається серед жінок з менструальними циклами, забезпечує можливість для фрагментів, що відкріпилися від ендометрію, досягти через менструальну рефлюксну рідину розташовані поблизу структури в статевому апараті. Альтернативно, для пояснення наявності ендометріозу в дільницях, відмінних від статевих стр уктур, клітини ендометрію можуть розповсюджуватися через маточні вени і доставлятися через лімфатичну систему (гематогенна або лімфатична дисемінація). Цьому поширенню можуть також сприяти гінекологічні хірургічні втр учання [MacSween, 1993]. Крім дисемінації клітин ендометрію, сприйнятливість жінок до ендометріозу можуть визначати інші чинники, такі як генетична схильність [Malinak et al., 1980], а також імунологічні зміни [Але et al., 1997]. Оскільки під час менструації у всі х жінок клітини ендометрію часто видні в перитонеальній рідині, у ссавців повинні бути механізми, що ймовірно відносяться до імунної системи, з метою уникнення початку ендометріозу. Загалом, клітини ендометрію, які уникають імунної реакції господаря і мають адекватну естрогенну стимуляцію, можуть проліферувати з утворенням великих, макроскопічно видимих поразок. Тому ендометріоз розглядається як динамічний процес, при якому постійно утворюються нові поразки, в той час, як існуючі поразки можуть рости або руйнуватися під впливом імунної реакції господаря. Запальна реакція, звичайно пов'язана з ендометріозом, змінює перітонеальне середовище, оскільки є збільшений об'єм перітонеальної рідини і зростає і кількість, і активність перітонеальних макрофагів. Тому моноцитарна/макрофагальна система була запропонована як така, що грає ключову роль в розвитку ендометріозу. Секреторні продукти макрофагів, включаючи RANTES [Hornung et al., 1997], інтерлейкін-б [Harada et al., 1997], інтерлейкін-8 [Arici et al., 1996a], альфа-фактор пухлинного некрозу [Overton et al., 1996], моноцитарний хемотаксичний білок-1 [Arici et al., 1997], були в більш високих концентраціях виявлені в перітонеальній рідині жінок, уражених цим захворюванням. Було показано, що у жінок з ендометріозом мали місце імунологічні зміни, але не було доведено, чи відповідальні ці процеси за розвиток ендометріозу або є результатом запалення, викликаного ендометріозом [Rana et al., 1996]. Знання про ендометріоз і його зв'язки з іншими розладами в цей час поки обмежені навіть на рівні діагностики. Хоч ендометріоз розглядається як одна з головних причин безпліддя, дослідження патофізіології захворювання суперечливі і не остаточні. Існує низька кореляція між ступенем больового синдрому або безпліддям і важкістю захворювання, оскільки ранні поразки є більш метаболічно активними. При рівні безпліддя вище, ніж у здорової популяції, дослідженням на кроликах показано, що хірургічно викликаний ендометріоз приводить до зниження фертильності з 75% до 25% [Hann et al., 1986]. У пацієнток з болями в області таза ендометріоз виявлений у 71% випадків, в той час як у пацієнток з болями в області таза і безпліддям у 84% випадків був діагностований ендометріоз [Koninckx et al., 1991]. Загалом, безпліддя може бути виявлене, коли ендометріоз має такий поширений характер, що може порушити нормальну вагінальну структуру, тоді як при мінімальних виявах ендометріозу частота вагітності нормальна. Ендометріоз може також різним чином вплинути на фертильність. Зростає вміст всіх посередників лейкоцитів, таких як інтерлейкін-6, інтерферон і фактор пухлинного некрозу, несприятливо впливаючи на взаємодію яйцеклітини і сперми. Було виявлено, що зразки сироватки, отримані у жінок з ендометріозом, володіють ембріотоксичною дією на моделях мишачих ембріонів і інгібують рухливість сперматозоїдів in vitro [Halrne, 1991], причому даний ефект посилюється при доданні рекомбінантного альфа-фактора пухлинного некрозу [Eisermarm, 1989]. Однак ці дослідження не були направлені на проблему впливу ци токінів на прогресування ендометріозу, а лише показали вплив таких молекул на життєздатність клітин зародка і плоду. У цей час використовуються два види лікування ендометріозу: гормональна терапія і хірургічне лікування. Сучасна фармакологічна терапія ендометріозу вимагає гормонального придушення вироблення естрогену з тим, щоб бідне гормональне середовище блокувало зростання ектопічної тканини. Відносно лікування, пов'язаного з ендометріозом безпліддя, гормональна терапія у пацієнток з мінімально вираженим захворюванням не має доведеного сприятливого ефекту, хоч інші дослідження показали збільшення частоти вагітності [Arici et al., 1996b]. Різні види гормональної терапії включали високу дозу прогестогенів, комбінації естрогену і прогестерону (з використанням пілюль, що містять високу дозу оральних контрацептивів, або ОКЦ, по схемі «помилкової вагітності»), даназол (андрогенне похідне етистерону) і, пізніше, агоністи гонадо-тропін-релізинг гормону (ГРГ). Ці види гормональної терапії ефективно впливають на больовий синдром в області таза і викликають об'єктивний зворотний розвиток поразок, але при цьому необхідно дотримуватися декількох запобіжних заходів. Естроген може стимулювати і викликати проліферацію тканини ендометрію, оскільки він може бути нездібний реагувати на прогестерон навіть у високих дозах, так що ОКЦ може дати часткове полегшення у обмеженого числа пацієнток [Dawood, 1993]. Сприяючі розвитку вагітності засоби можуть спровокувати безладну кровотечу (50%) нарівні з депресією, прибавкою маси тіла і затримкою рідини. Даназол придушує різні реакції, що викликають ендометріоз, включаючи зниження рівня розчинного альфа-фактора пухлинного некрозу, бетаінтерлейкіну-1 і CD8 в сироватці [Matalliotakis, 1997; Mori. 1990], інгібування нового стероїдогенезу і витіснення естрадіолу з його рецептора. Даназол може полегшити симптоми приблизно у 66-100% пацієнток, страждаючих больовим синдромом, але частота рецидивів в строк до 4 років становить приблизно 40%-50%. Іншими недоліками терапії даназолом є надбавка маси тіла і андрогенні побічні ефекти, які можуть спричинити припинення даної терапії пацієнтками, кількість яких досягає 80% [Barbieri, 1988]. Аналоги ГРГ, які діють шляхом усунення естрогенного стимулу до зростання всіх тканин, чутливи х до естрогену, є більш потужними і тривало діючими, чим нативний ГРГ. Побічні ефекти аналогів ГРГ, як зниження щільності кісткової тканини і частота рецидивів через 5 років до 50%, головним чином повторні по відношенню до глибокої гіпоестрогенемії [Waller and Shaw, 1993]. У залежності від ступеня захворювання, хірургічне втр учання може бути консервативним, якщо бажана фертильність, або може привести до видалення матки, труб і яєчників у разі важкого захворювання. У будьякому випадку навіть обмежене хірургічне лікування приводить до значного зменшення фертильності. Частота вагітності після операції загалом знаходиться в діапазоні від 35% до 65%, тому пацієнтки для досягнення нормального запліднення потребують індукції овуляції і внутрішньоматочному заплідненні [Koninckx and Martin, 1994]. Клінічні повідомлення показують, що після лапаротомії і резекції ендометріозу в межах 5 років 40% пацієнток вимагали повторної операції. Навіть після агресивного хірургічного втр учання рецидив больового синдрому внаслідок ендометріозу продовжує бути істотною проблемою. Деякі причини неспроможності хірургічного лікування можуть включати неповну резекцію з наявністю або нерозпізнаних, або повністю не виявлених поразок. Багато які поразки є мікроскопічними і не можуть візуалізуватися, незважаючи на збільшення, що забезпечується лапароскопом. Тому не можна чекати, що тільки хірургічне втр учання вилікує це захворювання [Revelli et al., 1995]. Внаслідок цього так багато пацієнток з ендометріозом страждають від нестач традиційних методів лікування (включаючи наслідки гормонального дисбалансу, високу частоту рецидивів і безпліддя). Тому представляє інтерес надання альтернативних методів лікування ендометріозу. Можливий підхід до лікування може бути представлений застосуванням імуномодулюючих молекул, які могли б і пом'якшити ступінь ендометріозних поразок, і поліпшити імунологічну ситуацію. Такий підхід вважався виправданим для лікування загальних симптомів [Rana et al., 1996], але відсутні експериментальні докази, які вказують на те, який цитокін серед цитокінів з порушеними рівнями експресії після ендометріозу, міг би бути переважною мішенню для лікувальних втр учань. Як було сказано раніше, одним з декількох продуктів секреції макрофагів, що беруть участь в ендометріозній запальній реакції, є фактор пухлинного некрозу (далі скорочено TNF). TNF, що визначається також як кахектин, є плейотропним цитокіном, що вивільняється активованими Т клітинами і макрофагами. TNF є членом цитокінової мережі інтерферону, інтерлейкіну і колонієстимулюючого фактора, яка грає ключову роль в сигнальній системі відносно патогенезу багатьох інфекційних і запальних захворювань, викликаючи ряд прозапалювальних змін, включаючи продукцію іншого цитокіну і адгезійної молекули [Fiers, 1991]. Для зручності термін TNF буде по всьому тексту даної заявки спільно означати альфа і бета фактор пухлинного некрозу від тварин і людей разом з такими, що зустрічаються їх природно алелями TNF-альфа [Pennica et al., 1984]. TNF-бета, що іменується також, лімфотоксином, має аналогічну активність, але продукується різними типами клітин (лімфоцитами і природними клітинами-кілерами) у відповідь на антигенні або мітогенні стимули [Gray et al., 1984]. TNF експресується у вигляді зрілого білка 17кДа, який активний як тример. Цей комплекс надає свою біологічну дію шляхом агрегації своїх клітин рецепторів, що знаходяться на поверхні, які опосередковують специфічні ефекти в різних органах і тканинах. В ендометрії експресія TNF залежить від дільниці і менструального циклу [Hunt et al., 1992] і викликає апоптоз в ендометрії експериментальних тварин [Shalaby et al., 1989]. Прилипання клітин строми ендометрію до мезотеліальних клітин значно збільшувалося попередньою обробкою мезотеліальних клітин TNF [Zhang et al., 1993], підтверджуючи таким чином положення про те, що TNF може брати участь в ініціації і/або розвитку ендометріозу. TNF реалізовує свою активність, яка потрібна для нормального розвитку і функції імунної системи, скріпленням сімейства пов'язаних з мембраною рецепторних молекул, включаючи рецептор р55 TNF, який також визначається в літературі як TNF-RI, і рецептор р75 TNF, який також визначається в літературі як TNF-RII [Bazzoni and Beutler, 1996]. Про переважання TNF-RI при передачі сигналу TNF свідчить здатність агоністичних антитіл, специфічних для цього рецептора, імітувати більшість реакцій, викликаних TNF [Shalaby et al., 1990]. Шляхом скріплення його рецепторів, пов'язаних з мембраною, TNF запускає сигнальний шлях через цитоплазматичні медіатори, подібні TRADD і TRAP-1 (ДЛЯ TNF-RI) або TRAF-1 і TRAF-2 (для TNF-RII), приводячи до різної клітинної реакції, подібній проліферації Т клітин, лізису пухлинних клітин, некрозу дерми, резистентності до інсуліну, апоптозу. Позаклітинні частини обох рецепторів TNF можуть скидатися, і ці розчинні рецептори зберігають здатність зв'язувати TNF, інактивуючи активність TNF шляхом утворення комплексів з високою спорідненістю, зменшуючи таким чином скріплення TNF з рецепторами мембран клітин-мішеней [Nophar etal., 1990]. В ендометрії мишей на рівні пов'язаних з мембраною рецепторів TNF впливають введення естрадіолу і/або прогестерону, приводячи до тимчасової і клітинно-специфічної експресії TNF-RI [Roby et al., 1996]. Однак дане дослідження, як і багато які інші дослідження, проведені на різних моделях, що відносяться до ендометрію, не дало ніяких натяків на дійсний вплив TNF і TNF-RI in vi vo, пов'язаних з мембраною або розчинних, на розвиток ендометріальних вогнищ, але лише дало опис пов'язаних з ендометріозом імунологічних відхилень від норми. Дана заявка на патент заснована на припущенні про те, що антагоніст. TNF здатний скріпленням циркулюючого TNF блокувати прогресування поразок ендометрію. Це припущення підтверджується даними, про які повідомляється в прикладі, що показують, що антагоніст TNF значно зменшує розмір вогнищ, подібних ендометріозним, в експериментальній моделі у пацюків. Внаслідок даних, виявлених заявником, в даній заявці надається спосіб лікування і/або профілактики ендометріозу в індивідуума, що включає введення терапевтично ефективної кількості антагоніста TNF. У другому варіанті реалізації винахід відноситься до способу лікування і/або профілактики пов'язаних з ендометріозом станів безпліддя в індивідуума, що включає введення терапевтично ефективної кількості антагоніста TNF в комбінації з іншими препаратами. Ще однією задачею даного винаходу є застосування антагоніста TNF разом з фармацевтично прийнятним носієм при отриманні фармацевтичних композицій для лікування ендометріозу. У даному винаході введення антагоніста TNF може бути парентеральним або він може вводитися у вигляді інших ефективних композицій. Може підходити будь-який вигляд парентерального введення, включаючи внутрішньовенне, внутрішньом'язове і підшкірне. Крім фармацевтично прийнятного носія, композиції винаходу можуть також включати невеликі кількості добавок, таких як стабілізатори, наповнювачі, буфери і консерванти. Антагоністи TNF, які можуть застосовуватися в способі даного винаходу, включають розчинні молекули рецептора TNF, антитіла і сполуки проти TNF, які запобігають і/або інгібують сигналізацію рецепторів TNF. Можна застосовувати один антагоніст TNF або в комбінації з іншими антагоністами TNF. Можлива також комбінація з одним або декількома фармацевтично активними продуктами, зокрема, для полегшення станів пацієнток, страждаючих безпліддям, пов'язаним з ендометріозом. Описаний в даній заявці винахід ясно показує несподіваний результат, що полягає в тому, що скріплення TNF (який є лише одним з декількох цитокінів, рівень експресії яких зростає в перітонеальній рідині після ендометріозу), за допомогою антагоніста TNF зменшує подібні ендометріозу осередки на експериментальній моделі у пацюків. Ця модель демонструє також, що такий ефект виходить без істотного впливу на гормональний баланс і активність природних клітин-кілерів. Зменшення ендометріозних поразок при використанні антагоністів TNF може також підвищити частоту фертильності, оскільки нормалізація структури статеви х органів впливає позитивний чином на частоту імплантації. Тому головною задачею даного винаходу є надання способу лікування і/або профілактики ендометріозу в індивідуума, що включає введення терапевтично ефективної кількості антагоніста TNF. В другому варіанті реалізації винахід відноситься до способу лікування станів безпліддя, пов'язаних з ендометріозом, в індивідуума, що включає введення терапевтично ефективної кількості антагоніста TNF в комбінації з іншими препаратами. Ще однією задачею даного винаходу є застосування терапевтично ефективної кількості антагоніста TNF разом з фармацевтично прийнятним носієм при отриманні фармацевтичних композицій для лікування і/або профілактики ендометріозу. Отримані таким чином фармацевтичні композиції також є ще однією задачею даного винаходу. Активними інгредієнтами заявлених в даній заявці композицій є антагоністи TNF. Заявлені антагоністи TNF надають свою дію одним або двома шляхами. По-перше, антагоністи можуть з достатньою спорідненістю і специфічністю зв'язуватися з самою молекулою TNF або секвестувати (блокувати) її для того, щоб по суті нейтралізувати епітоп TNF, відповідальний за скріплення рецептора TNF (далі іменуються "секвестуючими антагоністами"). Альтернативно, антагоністи TNF можуть інгібувати сигнальний шлях TNF, активований рецептором клітинної поверхні після скріплення TNF (далі іменуються "антагоністами сигналізації"). Відповідно до даного винаходу, обидві гр упи антагоністів можуть застосовуватися або окремо, або разом, при лікуванні ендометріозу. Антагоністи TNF легко ідентифікуються і ранжуються рутинним скринінгом кандидатів по їх впливу на дію нативного TNF по відношенню чутливи х клітинних ліній in vitro, наприклад, В-клітин людини, в яких TNF викликає проліферацію і секрецію Ig. Кількісний аналіз містить композицію TNF в різному розведенні перспективного антагоніста, наприклад, від 0,1 до 100 молярних кількостей TNF, що застосовуються при аналізі, і контролі без TNF або що містять тільки антагоніст [Tucci et al., 1992]. Відповідно до даного винаходу, секвесуючі антагоністи є переважними антагоністами TNF. Серед секвестуючіх антагоністів переважними є ті поліпептиди, які з високою спорідненістю зв'язують TNF і володіють низькою імуногенністю. Особливо переважними є розчинні молекули рецептора TNF і нейтралізуючі антитіла до TNF. Наприклад, в даному винаході можуть застосовуватися TNF-RI і TNF-RII. Відповідно до даного винаходу, особливо переважними антагоністами є усічені форми цих рецепторів, які включають позаклітинні домени рецепторів або їх усічені частини. Усічені форми рецепторів TNF є розчинними і інгібуючі скріплення TNF білки 30кДа і 40кДа, які спочатку були названі відповідно ТВРІ і ТВРІІ, були виявлені в сечі і сироватці [Engelmann et al., 1990]. Похідні, фрагменти, області і біологічно активні частини молекул рецептора функціонально нагадують молекули рецептора, які можуть застосовуватися в даному винаході. Такі біологічно активні еквіваленти або похідні молекул рецептора відносяться до частини вказаного поліпептиду, або послідовності, що кодує молекулу рецептора, яка має достатній розмір і здатна зв'язувати TNF з такою спорідненістю, що інгібується або блокується взаємодія з пов'язаним з мембраною рецептором TNF. У переважному варіанті реалізації людський розчинний TNF-RI є антагоністом TNF для введення пацієнткам. Природні і рекомбінантні розчинні молекули рецептора TNF і способи їх виробництва були описані в [європейських патентних заявках ЕР 308378, ЕР 398327 і ЕР 433900]. Багатомірний молекули рецептора TNF і молекули, що злилися імунорецептора TNF і їх похідні і частини являють собою додаткові приклади молекул рецепторів, які можуть застосовуватися в способах даного винаходу. Багатомірні молекули рецептора TNF, які можуть застосовуватися в способах даного винаходу, включають весь або функціональну частину позаклітинного домену двох або більше рецепторів TNF, пов'язану через один або декілька поліпептидних лінкерів. Багатомірні молекули можуть, крім того, включати сигнальний пептид білка, що секретується, для напряму експресії багатомірної молекули. Ці багатомірні молекули і способи їх отримання були описані в європейській патентній заявці ЕР 526905. Молекули, що злилися імунорецептора TNF, які можуть застосовуватися в способах даного винаходу, включають, щонайменше, одну частину однієї або декількох молекул імуноглобуліну і весь або функціональну частину одного або декількох рецепторів TNF. Ці молекули, що злилися імунорецептора TNF можуть збиратися у вигляді мономерів або гетеро- або гомо-мультимерів. Молекули, що злилися імунорецептора TNF можуть також бути моновалентними і мультивалентними. Молекули, що злилися імунорецептора TNF і способи їх отримання були описані в [європейській патентній заявці ЕР 620739, відповідній патентній заявці РСТ WO 94/06476]. Інший клас секвеструючих антагоністів, які можуть застосовуватися в способі даного винаходу, представлений антитілами проти TNF, включаючи моноклональні, химерні гуманізовані і рекомбінантні антитіла і фрагменти, які характеризуються високою спорідненістю скріплення з TNF in vivo і низькою токсичністю. Антитіла, які можуть застосовуватися у винаході, характеризуються їх здатністю лікувати пацієнток протягом періоду, достатнього для отримання від хорошої до відмінної регресії ендометріозних поразок, полегшення симптомів і низької токсичності. Нейтралізуючі антитіла легко виробляються у таких тварин як кролики або миші при імунізації TNF. Імунізовані миші особливо підходять для забезпечення джерел В-клітин для виробництва гібридом, які в свою чергу культивуються для отримання великих кількостей моноклональних антитіл проти TNF. Химерні антитіла являють собою молекули імуноглобуліну, що характеризуються двома або більше сегментами або частинами, отриманими від різних видів тварин. Загалом, варіабельна область химерного антитіла виходить з антитіла ссавця, такого як мишаче моноклональне антитіло, а константна область імуноглобуліну ви ходить з молекули людського імуноглобуліну. Переважно, обидві області і комбінація мають низьку імуногенність, по даним звичайного визначення [Elliott et al., 1994]. Гуманізовані антитіла являють собою молекули імуноглобуліну, створені методом генної інженерії, в якому мишачі константні області заміняються людськими аналогами, в той же самий час зберігаючи області скріплення мишачого антигенна. Отримане в результаті мишачолюдське химерне антитіло повинно мати знижену імуногенність і поліпшену фармакокінетику у людей [Knight et al., 1993]. Переважними прикладами високоафінних антитіл і їх химерних похідних, які можуть застосовуватися в способах даного винаходу, описані в [європейській патентній заявці ЕР 186833 і патентній заявці РСТ WO 92/16553]. Антагоніст TNF може вводитися індивідууму різними способами. Шляхи введення включають інтрадермальний, трансдермальний (наприклад, в композиціях пролонгованого вивільнення), внутрішньом'язовий, внутрішньочеревний, внутрішньовенний, підшкірний, оральний, епідуральний, місцевий і інтраназальний шляхи. Може застосовуватися будь-який інший терапевтично ефективний шлях введення, наприклад, всмоктування через епітеліальну або ендотеліальну тканини, або геннотерапевтичний, при якому пацієнту вводиться молекула ДНК, що кодує антагоніст TNF (наприклад, за допомогою вектора), яка викликає експресію і секрецію антагоніста TNF in vi vo. Крім того, антагоніст TNF може вводитися разом з іншими компонентами біологічно активних засобів, такими як фармацевтично прийнятні поверхово-активні речовини, наповнювачі, розріджувачі або будь-які інші носії. Визначення «фармацевтично прийнятний» призначено охоплювати будь-який носій, який не перешкоджає реалізації біологічної активності активного інгредієнта і який не токсичний для організму, в який він введений. Наприклад, для парентерального введення антагоніст TNF може бути включений в композиції в дозовану лікарську форму для ін'єкції в таких носіях як сольовий розчин, розчин декстрози, сироватковий альбумін і розчин Рінгера. Для парентерального введення (наприклад, внутрішньовенного, підшкірного, внутрішньом'язового) композиція з включенням антагоністів TNF може бути у вигляді розчину, суспензії, емульсії або ліофілізованого порошку в поєднанні з фармацевтично прийнятним парентеральним носієм (наприклад, водою, сольовим розчином, розчином декстрози) і добавками, які підтримують ізотонічність (наприклад, манітол) або хімічну стійкість (наприклад, консерванти і буфери). Композиція стерилізується методиками, що звичайно використовуються. Біологічна активність антагоніста TNF може бути також підвищена використанням процедур кон'югації, які збільшують період напіввиведення молекули в організмі людини, наприклад, скріплення молекули з поліетиленгліколем, як описано в [патентній заявці PCT WO 92/13095]. Терапевтично ефективні кількості антагоніста TNF будуть залежати від багатьох змінних, включаючи тип антагоніста, спорідненість антагоніста з TNF, будь-яку залишкову цитотоксичну активність, що виявляється антагоністами, шлях введення, клінічний стан пацієнтки (включаючи бажаність підтримки нетоксичного рівня активності ендогенного TNF), присутність множини дільниць, що комбінують TNF, в секвеструючих засобах, наприклад, антитіл. «Терапевтично ефективна кількість» - це така, яка при введенні антагоніста TNF приводить до інгібування біологічної активності TNF. Введена індивідуум у доза у вигляді однократної дози або множинних доз буде варіювати в залежності від множини факторів, включаючи фармакокінетичні властивості антагоніста TNF, шлях введення, стану і характеристик пацієнтів (стать, вік, маса тіла, здоров'я, величина), вираженість симптомів, суп утні види лікування, частота лікування і бажаного ефекту. Підбір і маніпуляції для встановлення діапазонів доз добре відомі фахівцям в даній області, також як і способи визначення інгібування TNF в індивідуума in vitro і in vivo. Оскільки максимальна переносна доза TNF в клінічних випробуваннях у людей досягала приблизно 25мкг/м 2 поверхні тіла / 24год., треба, щоб кількість введеного антагоніста не перевищувала дозу, яка розрахована для нейтралізації даної кількості TNF. Відповідно, молярна доза антагоніста TNF буде варіювати при близно від 0,001 до 10 максимально переносимих молярних доз TNF, хоч, як відмічено вище, це буде значною мірою визначатися міркуваннями ефективного лікування. Більш того дані, отримані в клінічних дослідженнях, в яких збільшення концентрації TNF в перітонеальній рідині у жінок з ендометріозом було продемонстроване з використанням різних схем [Eisemann et al., 1988; Halme.1991; Overton et al., 1996], також можуть використовуватися при визначенні підлягаючої введенню ефективної дози антагоніста TNF. Звичайно добове дозування активного інгредієнта може складати від близько 0,01 до 100мг/кг маси тіла. Звичайно для отримання бажаних результатів ефективні дози від 1 до 40мг/кг, що вводяться дробовими дозами, або в формі з пролонгованим вивільненням. Друге або подальше введення можуть виконуватися в дозуванні, яке, рівне, менше або більше, ніж початкова або попередня доза, введена індивідуум у. Др уге або подальше введення можуть виконуватися у час або перед рецидивом ендометріозу або пов'язаних з ним симптомів. Терміни «рецидив» або «повторне виникнення» призначені охоплювати появу одного або декількох симптомів ендометріозу. Антагоніст TNF може вводитися індивідууму профілактично або з метою лікування перед, одночасно або послідовно з іншими терапевтичними схемами або засобами (наприклад, в схемах багатокомпонентної медикаментозної терапії) в терапевтично ефективній кількості, зокрема, для лікування безпліддя. Антагоністи TNF, які вводяться одночасно з іншими лікувальними засобами, можуть вводитися в тих же або в інших композиціях. Зокрема, коли розлад, що підлягає лікуванню, являє собою безпліддя, пов'язане з ендометріозом, можуть вводитися біологічно активний людський хоріонічний гонадотропін (лХГ), лютеїнізуючій гормон (ЛГ) або фолікулостимулючий гормон (ФСГ), або в природній, високо очищеній, або в рекомбінантні формі. Такі молекули і способи їх о тримання були описані в [європейських патентних заявках ЕР 160699, ЕР 211894 і ЕР 322438]. Даний винахід буде тепер проілюстрований прикладом, який ні в якій мірі не призначений для його обмеження і посилається на наступні креслення. На Фіг.1 показані впливи антиду (2мг/кг, що вводиться підшкірно 1 раз в 3 дні), рекомбінантного розчинного TNF-RI (10мг/кг, що вводиться підшкірно 2 рази/день протягом періоду 1 тижня), на розмір імплантатів у пацюків з експериментальним ендометріозом через 2 і 9 днів після останнього лікування. Ці дані, які були отримані з використанням 6 тварин на групу для першого значення часу, і 5 тварин на групу для другого значення часу, представляють середнє процентне значення інгібування ± стандартна помилка середньої. На Фіг.2 показані впливи рекомбінантного розчинного TNF-RI (10мг/кг, що вводиться 2 рази/день протягом періоду 1 тижня) і антиду (2мг/кг, що вводиться 1 раз в 3 дні) на активність природних кілерів селезінки пацюків проти клітин YAC (вивільнення 51Сr) через 2 дні (панель А) і 9 днів (панель В) після останнього лікування. Дані представляють середнє процентне значення лізісу ± стандартна помилка середньої. На Фіг.3 показані впливи рекомбінантного розчинного TNF-RI (10мг/кг, що вводиться 2 рази/день протягом періоду 1 тижня) в порівнянні з контролем і антидом (2мг/кг, що вводиться 1 раз в 3 дні) на рівень естрадіола17b в сироватці при експериментальному ендометріозі у пацюків. Дані представляють середню концентрацію естрадіолу-17b ± стандартна помилка середньої. Приклад Матеріали і методи Тварини. Самиці пацюків лінії Sprague-Dawley (250-275г) були закуплені у Charles River Italia (Caico, Lecco Italy). Тварин утримували в наступних умовах навколишнього середовища: температура 22±2°С, відносна вологість 55±10%, вентиляція 15±3 об'ємів повітря за 1год., що фільтрується через фільтри НЕРА 99,97% і штучне освітлення з циркадним циклом 12 годинного освітлення (з 7:00 до 19:00). Перед експериментами тваринам давали можливість акліматизуватися до цих умов протягом періоду, щонайменше, 1 тижня. Тварини без обмежень отримували стандартний гранульований корм. Препарати, що досліджуються. Антид був зроблений і представлений фірмою Bachem (California, USA). Молекула, що використовується в прикладі людського рекомбінантного розчинного TNF-RI має послідовність, відповідну сегменту 20-180 людського TNF-RI [Nophar et al., 1990] і була отримана в клітинах СНО і надана Interpharm Laboratories Ltd. (Israel) під назвою r-hTBP-1. Матеріал. Загальний матеріал клітинної культури був закуплений в Gibco BRL, Life Technologies (Paisley, UK). Набір RIA 17b-естрадіолу був закуплений в фірмі DPC (Los Angeles, CA, USA). Інокетам був закуплений в фірмі Virbac (Carros, FR). [51Cr]-натрій хромат був закуплений у NEN Dupont (Boston, MA, USA). Ромпун був закуплений в фірмі Bayer AG (Leverkusen, DE). Шовкова нитка була закуплена у компанії Ethicon (Pomezia, IT). Експериментальна модель ендометріозу у пацюків. Для дослідження впливів рекомбінантного розчинного TNF-RI при ендометріозі використали раніше описану експериментальну модель [Jones, 1987] з невеликими модифікаціями. В умовах анестезії інокетамом/ромпуном аутологічний фрагмент тканини ендометрію (довжиною 1см) резекують з правого рогу матки і вміщують в розчин з фосфатним буфером при 37°С. Сегмент матки розкривають подовжнім розрізом, і відрізок розміром 5´5мм без видалення міометрію трансплантують на внутрішню поверхню черевної стінки з використанням прошиття в чотирьох кута х шовковою ниткою, що не розсмоктується. Дослідження впливів препаратів, що вивчаються при експериментальній моделі ендометріозу. Експериментальний ендометріоз викликають хірургічним шляхом у наркотизованих пацюків, як вказано вище. Крім того, аналогічним образом видаляють один ріг матки в іншої групи, але трансплантують квадрат розміром 5´5мм жирової тканини, що оточує матку (група помилково оперованих тварин). Ще одну групу пацюків, що не зазнавали ніякого хірургічного втручання, тримають як здорову контрольну груп у. Через 3 тижні після індукції ендометріозу тварин піддають другий лапаротомії (лапаротомія перед лікуванням) для оцінки розміру і життєздатності ектопічної тканини ендометрію. Використовуючи вимірник, реєструють площу поверхні (довжина ´ ширину). Як показано в Таблиці І, тварин з ознаками життєздатних імплантатів включають в групи, призначені для лікування, так що в кінці експеримента отримують 6 тварин на групу для точки часу першого забою і 5 тварин на групу для точки часу другого забою. Різні види лікування починають після періоду відновлення три валістю 1 тиждень. Контрольна група отримує тільки сольовий розчин, інша група отримує 3 підшкірних ін'єкції антиду 2мг/кг 1 раз в 3 дні по схемі, яка, як було показано раніше, придушує активність яєчників і гіпоталамуса [Sharpe et al., 1990]. Інша група протягом періоду 1 тиждень отримує 10мг/кг рекомбінантного розчинного TNFRI, розділені на 2 добові дози. Таблиця І Трансплантація ендометрію Немає Помилково оперовані Так Так Так Лікування Дні лікування(1) Дні забою(1) Сольовий розчин Сольовий розчин Сольовий розчин Антид (2мг/кг) Рекомбінантний розчинний TNF-RI (10мг/кг) в двох добови х дозах 28-34 28-34 28-34 28, 31, 34 36,43 36,43 36,43 36,43 28-34 36,43 (1) Від дня хірургічної імплантації (1-ий день) В призначені точки часу забою (2 і 9 дні після останнього лікування, тобто на 36 і 43 день після хірургічної імплантації) тварин наркотизують; з черевної аорти беруть зразки крові, відділяють сироватку і зберігають при -20°С доти, поки не проводять аналіз на вміст 17b-естрадіолу. Посічуть селезінки для вимірювання активності природних кілерів (NK). У кожну точку часу забою вимірюють площу поверхні вогнищ, подібних ендометріозу, для нормалізації даних розраховують процент варіації в порівнянні з величиною при лапаротомії перед лікуванням по формулі: де Х0 - розмір у час лапаротомії перед лікуванням, а X - розмір під час забою. Потім розраховують середню величину варіації в процентах в кожній групі. Визначення активності NK. Ступінь активності NK визначають з використанням аналізу вивільнення 51Сr. Клітини мишачої лімфоми YAC-1 збирають у час фази експонентного зростання і однократно промивають середовищем (RPMI 1640, що містить пеніцилін/стрептоміцин, L-глутамат і 10% інактивованої нагріванням сироватки вівці). Клітинний осадок інкубують з 100мккюри [51Сr]-натрію хромату при 37°С, 5% СО2 протягом 2год. Потім клітини промивають 3 рази 10мл аналітичного середовища, ресуспендують в бажаній концентрації і додають в аналітичну планшету в присутності щурячих спленоцитів. Їх ресуспендують в аналітичному середовищі в бажаній концентрації (2´106/мл) і проводять серійне розведення в аналітичному середовищі в потрійній U-образній лунці 96-лункової планшети перед доданням мічених 51Сr клітин -мішеней. Мічені 51Сr клітинимішені (5´10) додають в кожну лунку аналітичної планшети і для кожного зразка аналізують три відношення ефекторів до мішеней (200:1, 100:1 і 50:1). Планшету, утримуючу клітинну суміш ефекторів і мішеней центрифугують при 200хg протягом 4хв., а потім інкубують при 37°С, в 5% СО2 протягом 4год. Після додаткового центрифугування планшети при 200xg протягом 4хв., 20мкл надосадкової рідини з кожної лунки переносять на скловолоконний фільтр і b-лічильником Оцінюють асоційовану радіоактивність. Процентну частку лізісу розраховують таким чином: дє cpm sample = середнє вивільнення 5ІСr в присутності ефекторних клітин cpm spont = середнє вивільнення 51Сr з клітин-мішеней в присутності культурального середовища cpm total = середнє вивільнення 51Сr з клітин-мішеней в присутності 1% Triton-X100. Визначення вмісту 17b-естрадіолу. Концентрацію 17b-естрадіолу в сироватці визначають з використанням набору, що є в продажу для кількісного визначення естрадіолу в сироватці без етапу екстракції [DPC, Los Angeles, CA, USA]. Коротко, мічений 125І естрадіол конкурує з естрадіолом в зразку сироватки за дільниці антитіл. Після інкубації відділення пов'язаного естрадіолу від вільного досягають декантуванням. Потім пробірку для підрахунку вміщують в гамма лічильник (LKB-Pharmacia Wallak), причому результати підрахунку зворотно пропорціонально пов'язані з кількістю естрадіолу, присутнього в зразку сироватки. Кількість естрадіолу в зразках визначають порівнянням даних підрахунку з калібрувальною кривою. Антисироватка високо специфічна для естрадіолу з відносно низькою перехресною реактивністю по відношенню до інших стероїдів, що природно зустрічаються. Зразки з одного експериментального циклу аналізують в одній імунній пробі. Статистичний аналіз. Статистична значущість відмінностей, що спостерігаються серед груп лікування, оцінюють з використанням програми ANOVA, що є в програмному забезпеченні Statgraphics Plus® (версія 1.4). Застосовують мультипараметричний критерій Tukey (P
ДивитисяДодаткова інформація
Назва патенту англійськоюTumor necrosis factor antagonists for treating and preventing endometriosis
Назва патенту російськоюПрименение антагонистов фактора некроза опухолей для лечения или профилактики эндометриоза
МПК / Мітки
МПК: A61K 39/395, A61P 15/00, A61K 38/19
Мітки: застосування, ендометріозу, фактора, некрозу, антагоністів, лікування, пухлинного, профілактики
Код посилання
<a href="https://ua.patents.su/9-78483-zastosuvannya-antagonistiv-faktora-pukhlinnogo-nekrozu-dlya-likuvannya-abo-profilaktiki-endometriozu.html" target="_blank" rel="follow" title="База патентів України">Застосування антагоністів фактора пухлинного некрозу для лікування або профілактики ендометріозу</a>
Попередній патент: Спосіб отримання карбапенемових сполук
Наступний патент: Спосіб радіоактивного мічення анти-cd20 антитіла
Випадковий патент: Газовий лазер