Спосіб визначення локалізації та складу вуглеводів екзополімерного матриксу біоплівки корозійно-агресивних бактерій
Номер патенту: 81855
Опубліковано: 10.07.2013
Автори: Іутинська Галина Олександрівна, Войчук Сергій Іванович, Асауленко Лариса Григорівна, Пуріш Лариса Михайлівна, Абдуліна Дарина Ренатівна
Формула / Реферат
Спосіб визначення локалізації та складу вуглеводів екзополімерного матриксу біоплівки корозійно-агресивних бактерій, який передбачає підготовку препаратів для дослідження, обробку підготовлених препаратів розчином специфічного лектину з подальшим мікроскопічним дослідженням одержаних препаратів, який відрізняється тим, що одержання препаратів проводять за допомогою методу відбитків, що передбачає накладання на зразки стальної поверхні, що містить біоплівку, мідних сіток, вкритих формваровою плівкою, тривалість експозиції 1 хв., та висушування сіток з відбитками біоплівки на повітрі; нанесення на препарати розчину специфічного для вуглеводу лектину, міченого колоїдним золотом, та витримування препаратів протягом 1 години для зв'язування лектину з вуглеводами екзополімерного матриксу з подальшим промиванням препаратів водою та висушуванням на повітрі; мікроскопічне дослідження одержаних зразків при використанні трансмісійного електронного мікроскопа з прискорювальною напругою 80 кВ для підрахунку кількості колоїдних частинок золота, які зв'язані вуглеводними компонентами, на 1 мкм2 площі поля зору.
Текст
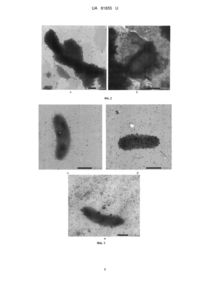
Реферат: Спосіб визначення локалізації та складу вуглеводів екзополімерного матриксу біоплівки корозійно-агресивних бактерій передбачає підготовку препаратів для дослідження, обробку підготовлених препаратів розчином специфічного лектину з подальшим мікроскопічним дослідженням одержаних препаратів. Одержання препаратів проводять за допомогою методу відбитків, що передбачає накладання на зразки стальної поверхні, що містить біоплівку, мідних сіток, вкритих формваровою плівкою, тривалість експозиції 1 хв., та висушування сіток з відбитками біоплівки на повітрі. Далі здійснюють нанесення на препарати розчину специфічного для вуглеводу лектину, міченого колоїдним золотом, та витримування препаратів протягом 1 години для зв'язування лектину з вуглеводами екзополімерного матриксу з подальшим промиванням препаратів водою та висушуванням на повітрі. Мікроскопічне дослідження одержаних зразків здійснюють при використанні трансмісійного електронного мікроскопа з прискорювальною напругою 80 кВ для підрахунку кількості колоїдних частинок золота, які 2 зв'язані вуглеводними компонентами, на 1 мкм площі поля зору. UA 81855 U (12) UA 81855 U UA 81855 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до галузі мікробіології, зокрема до аналітичного способу визначення біохімічного складу екзополімерного матриксу біоплівки корозійно-агресивних бактерій. Запропонований спосіб може знайти своє застосування при розробці способів боротьби з мікроорганізмами, які викликають корозію металевих виробів. Дослідження, проведені в останнє десятиріччя, показали, що у природних екосистемах більшість бактерій існує у вигляді специфічно організованих біоплівок, що прикріплюються до субстратів. Такі біоплівки являють собою мікробне угруповання, яке створюється бактеріями одного або декількох видів. Мікробне угруповання функціонує у біоплівці у формі консорціуму, який є зануреним в екзополімерний матрикс позаклітинних компонентів, що синтезуються бактеріями. До складу екзополімерного комплексу (ЕПК) входять полісахариди, ліпіди, білки, нуклеїнові кислоти та інші сполуки. Екзополімери бактерій відіграють важливу роль не тільки у формуванні біоплівки, а й у взаємодії біоплівки з поверхнею, на якій вона розвивається. Як показали останні дослідження, вивчення складу ЕПК забезпечує важливу інформацію для прогнозування пошкодження корозійно-агресивними бактеріями підземних комунікацій: теплових мереж, нафто- та газопроводів. Було продемонстровано, що у ґрунті, який безпосередньо контактує з поверхнею трубопроводів, формується сульфідогенне угруповання, що сприяє виникненню вогнищ біокорозії. Основну роль у мікробній корозії відіграють сульфатредукуючі бактерії, які беруть безпосередню участь у біоелектрохімічному процесі, що відбувається на поверхні металу, у біоплівці. Крім сульфатредукторів, домінантними представниками такого сульфідогенного угруповання є також бактерії родів Bacillus та Pseudomonas. Розробка способів визначення складових ЕПК, зокрема його вуглеводного складу, забезпечить необхідні дані для створення ефективних методів захисту сталевих поверхонь від корозійно-агресивних бактерій. Для визначення складових ЕПК часто використовують спосіб на основі газорідинної хроматографії (Albersheim P., Nevis D.J., English P.D., Karr A.// Carbohydr. Res. 1976, v. 5, No. 3, p. 340-345). Для цього ліофілізований препарат ЕПК піддають гідролізу з НСl протягом 4-5 годин при 100 °C у запаяній ампулі, гідролізат упарюють, потім ресуспендують у дистильованій воді та додають боргідрид натрію. Зразки залишають у темному місці на 12 годин, нейтралізують за + допомогою катіоніту КУ-2 в Н формі. Після видалення катіоніту за допомогою фільтрування, фільтрат упарюють досуха, промивають метанолом, упарюють на роторному випарнику при кімнатній температурі та додають піридин та оцтовий ангідрид та витримують 15 хвилин при температурі 100 °C. Одержану суміш упарюють досуха у декілька етапів з доданням метанолу, і зразки ресуспендують у хлороформі та центрифугують при 5000 g протягом 20 хвилин. Одержаний супернатант упарюють досуха. Аналіз одержаних похідних нейтральних моносахаридів у формі їх повних ацетатів поліолів здійснюють на газовому хроматографі із масспектрометричним детектором. Хроматографічне розділення здійснюють в ізотермічному режимі при 220 °C, газ-носій - гелій, швидкість потоку через колонку - 1,0 мл/хв. Температура випарника 250 °C. Визначення здійснюють у режимі сканування в діапазоні 100-600 m/z. Визначення кислих та нейтральних моносахаридів здійснюють у вигляді їх ацетильованих метилглікозидів, які аналізують на колонці HP-5MS у відповідності із наступною температурною програмою: 150 °C-5 хв., від 150 до 250 °C - по 3 °C за 1 хв., 250 °C-10 хв. Описаний спосіб є надзвичайно трудомістким, багатостадійним та довготривалим. Крім того, він також є високозатратним так як вимагає багато хімічних реагентів та витратних матеріалів. Останнім часом усе більшого поширення набуває поліфазний аналіз, згідно з яким порівнюються результати, одержані за допомогою різних способів, для їх взаємодоповнення та уточнення. Одним з таких підходів при дослідженні бактеріальних систем поряд з біохімічними методами є застосування мічених лектинів. Здатність лектинів виявляти максимальну спорідненість до олігосахаридів чітко визначеної структури забезпечує можливість вивчення певних вуглеводних компонентів, що продукуються бактеріями при формуванні біоплівки. Так, для дослідження екзополісахаридів (ЕПС) біоплівки може використовуватися спосіб при використанні лектинів, кон'югованих із флуоресцентними барвниками (Thomas R. Neu, Georg D.W. Swerhone and John R. Lawrence "Assessment of lectin analysis for in situ detection of glycoconjugates in biofilm systems", Microbiology (2001), 147. p. 299-313). Для проведення цього аналізу використовують комерційно доступні флуоресцентно мічені за допомогою флуоресцеїну ізотіоціанату (FITC) або тетраметил родаміну ізотіоціанату (TRITC) лектини. їх розчиняють у стерилізованій воді при концентрації 100 мкг/мл. Шматочки скла з поверхнею приблизно 1 см, які несуть біоплівку, безпосередньо покривають 100 мкл розчину лектину (при цьому використовується панель кон'югованих із флуорохромом лектинів). Зразки інкубують у вологій камері при кімнатній температурі до досягнення протягом попередньо визначеного часу для оптимального забарвлювання. Після завершення забарвлювання усі шматочки скла обережно 1 UA 81855 U 5 10 15 20 25 30 35 40 45 50 55 60 промивають водою для видалення незв'язаних лектинів та досліджують під конфокальним лазерним скануючим мікроскопом. Таким чином оцінюють ЕПС-специфічні глікокон'югати та здійснюють їх диференціювання на кілька типів. Вказаний спосіб є вибраним авторами як прототип заявленої корисної моделі. Описаний спосіб є більш простим за спосіб, описаний у попередньому абзаці, проте потребує для визначення наявності специфічних дорогих флуоресцентних барвників. Крім того, природа використовуваного флуорохрому може виявляти свій вплив на специфічність лектинів. Задача даної корисної моделі полягає у спрощенні визначення вуглеводного складу біоплівки за рахунок використання доступних реагентів та обладнання. Вказана задача вирішується шляхом розробки способу визначення локалізації та складу вуглеводів екзополімерного матриксу біоплівки, утвореної бактеріями, зокрема корозійно-агресивними бактеріями, який включає наступні етапи: одержання препаратів за допомогою методу відбитків, що передбачає накладання на зразки стальної поверхні, що містить біоплівку, мідних сіток, вкритих формваровою плівкою, тривалість експозиції 1 хв., та висушування сіток з відбитками біоплівки на повітрі; нанесення на препарати розчину специфічного для вуглеводу лектину, міченого колоїдним золотом, та витримування препаратів протягом 1 години для зв'язування лектину з вуглеводами екзополімерного матриксу з подальшим промиванням препаратів водою та висушуванням на повітрі; мікроскопічне дослідження одержаних зразків при використанні трансмісійного електронного мікроскопа з прискорювальною напругою 80 кВ для підрахунку кількості колоїдних частинок 2 золота, які зв'язані вуглеводними компонентами, на 1 мкм площі поля зору. Таким чином, запропонований, згідно з корисною моделлю, спосіб здійснюється при застосуванні лектинів, мічених колоїдним золотом, які є значно дешевші за кон'юговані із флуорохромом лектини та постачаються українськими виробниками (наприклад, НВО "Лектинтест", Львів). Крім того, спосіб передбачає використання для візуалізації трансмісійного електронного мікроскопа замість конфокальної лазерної сканувальної мікроскопії, яка потребує надто дорогих реагентів. Всебічне дослідження складу та локалізації вуглеводів екзополімерного матриксу біоплівки, зокрема, такої що утворюється сульфатредукуючими бактеріями та їх гетеротрофними супутниками на поверхні сталі, є важливим для прогнозування їх впливу на інженерні системи. Було встановлено, що основну роль у формуванні біоплівок відіграють екзополісахариди, що знаходяться в екзополімерному матриксі. У складі ЕПС виявлені нейтральні вуглеводи (Dглюкоза, D-маноза), а також уронові кислоти та аміносахара (N-ацетил-D-глюкозамін, N-ацетилD-галактозамін), які, взаємодіючи з іншими компонентами матриксу за допомогою карбоксильних та аміногруп, беруть участь у формуванні структури біоплівки. Крім того, полісахариди є здатними зв'язувати у матриксі іони металів та сульфіди, активізуючи таким чином корозійний процес. Для візуалізації вуглеводів у екзополімерному матриксі біоплівки використовували специфічні лектини у вигляді золю, який включав як консервант 0,02 % азид натрію, 10-20 % етиленгліколь в 0,01М фосфатному буферному розчині (рН 6,5-8,5). Розмір частинок колоїдного золота складав 8-12 нм. Концентрація лектинів - А250=5,0±0,2. Розчини лектинів готували у відповідності з інструкціями виробника. У досліді використовували лектини, які є специфічними для певних вуглеводів у відповідності з інформацією щодо повного спектра зв'язування вуглеводів кожним лектином, що одержана з літературних джерел (Луцик А.Д., Детюк Е.С, Луцик М.Д. Лектины в гистохимии Львов: Выща шк. Изд-во при Львов. ун-те, 1989.-144 с.; Луцик М.Д., Панасюк Е.С, Луцик А.Д. Лектины Львов: Выща шк. Изд-во при Львов. ун-те, 1981.-150 с.; Лахтин В.М. Лектины в исследовании углеводной части гликопротеинов и других природных гликоконъюгатов. Биохимия 1995; 60 (2): 187-217). Так, для виявлення N-ацетил-Dгалактозаміну у біоплівці використовували мічені лектини квасолі LBA та сої SBA, для візуалізації N-ацетил-D-глюкозаміну застосовували лектини картоплі STA та зав'язі пшениці WGA, для нейтральних вуглеводів - лектини сочевиці LSA, гороху PSA та конканавалін А. Раніше було показано, що взаємодія лектинів з вуглеводами залежить від структури останніх: від конформації піранозних та фуранозних форм моносахаридних залишків, які входять до складу вуглеводної частини біополімерів, від конфігурації аномерного центру моносахаридів (Dабо L-форми піранозного кільця вуглевода), від - або -положення глікозидного зв'язку при С1положенні моносахариду. У зв'язку із цим найбільш важливими факторами взаємодії лектинів з вуглеводами є стереоспецифічність при зв'язуванні моносахаридів з лектинами, наявність або відсутність координаційних та водородних зв'язків, а також гідрофобних та Ван дер Ваальсових взаємодій. 2 UA 81855 U 5 10 15 20 25 30 35 40 45 50 55 60 Мікроскопічні дослідження проводили при використанні трансмісійного електронного мікроскопа JEM-1400 ("JEOL", Японія) з прискорювальною напругою 80 кВ та загальному інструментальному збільшенні х 3000-12000. Методом рандомізованого відбору проглядали не менше 20 полів зору. Кількість колоїдних частинок золота, що візуалізують зв'язані з вуглеводними компонентами лектини екзополімерного матриксу біоплівки підраховували у 1 2 мкм площі поля зору, використовуючи програму Image J ver 143u (http://esb.info.nih.gov./ij). Статистичну обробку проводили при використанні програми MSExel 2010. Фіг. 1 демонструє зв'язування лектинів з вуглеводами Desulfovibrio sp. 10 у біоплівці. Довжина масштабної мітки а) - 500 нм, б) - 200 нм. Локалізація частинок колоїдного золота на поверхні клітини та у позаклітинному матриксі вибірково вказана стрілками. Фіг. 2 демонструє зв'язуваня лектину LBA з вуглеводами у біоплівці: а - В. subtilis 36, б - P. aeruginosa 27. Довжина масштабної мітки а) - 500 нм, б) - 200 нм. Фіг. 3 показує зв'зування лектинів з вуглеводами у планктоні Desulfovibrio sp. 10: а) лектин PSA, б) - лектин STA, в) лектин LBA. Довжина масштабної мітки - 500 нм, Корисна модель ілюструється конкретними прикладами його реалізації. Приклад 1 Проводили дослідження екзополімерного матриксу біоплівки корозійно-агресивного сульфідогенного мікробного угруповання бактерій Desulfovibrio sp.10, Bacillus subtilis 36, та Pseudomonas aeruginosa 27, а також штучно створeної із цих монокультур асоціації. Для цього моно- та асоціативні культури вирощували на рідкому середовищі Постгейта "В" у флаконах об'ємом 50 мл, яке інокулювали культурами бактерій в експоненціальній фазі росту. Кількість 7 посівного матеріалу складала 10 % від об'єму середовища, вихідний титр монокультур - 10 кл/мл. Біоплівку вирощували на зразках сталі 3. Сталеві зразки піддавали попередній обробці, а потім занурювали у флакони та герметично закривали гумовими пробками. Інкубацію проводили при 28 °C протягом 10 діб. Кожний дослід проводили у трикратній повторюваності. Комерційні препарати лектинів, мічені колоїдним золотом (НВО "Лектинтест", Львів), які використовували у досліді, представлені у Таблиці 1. Використовували стандартну специфічність кожного з використовуваних лектинів у відповідності із каталогом виробника. Препарати біоплівки для електронної мікроскопії одержали при використанні способу відбитків. Для цього зразки біоплівки виймали із флаконів, а потім на поверхню біоплівки накладали мідні сітки, покриті формаваровою плівкою. Час експозиції складав 1 хвилину, після цього обережно знімали сіточки з відбитком біоплівки та висушували на повітрі. Для одержання препаратів суспензійних культур на сіточки наносили суспензію бактерій (10-20 мкл) та також висушували на повітрі. На сіточки зі зразками біоплівки наносили мічений колоїдним золотом лектин, при цьому використовували панель лектинів з різною специфічністю та витримували 1 годину для зв'язування лектину з вуглеводами екзополімерного матриксу. Після експозиції сітки тричі промивали дистильованою водою для видалення залишків лектинів та висушували на повітрі. Мікроскопічні дослідження проводили при використанні трансмісійного електронного мікроскопа JEM-1400 ("JEOL", Японія) з прискорювальною напругою 80 кВ та загальному інструментальному збільшенні х3000-12000. Методом рандомізованого відбору проглядали не менше 20 полів зору. При використанні трансмісійної електронної мікроскопії було показано, що зв'язування лектинів з вуглеводами відбувалося безпосередньо в екзополімерному матриксі, а також на поверхні бактеріальних клітин, про що свідчила наявність частинок колоїдного золота. Мічені колоїдним золотом лектини візуалізувалися на фотографіях як невеликі округлі електронно-щільні частинки розміром 8-12 нм. Кількість колоїдних частинок золота, зв'язаних з 2 вуглеводними компонентами екзополімерного матриксу біоплівки, підраховували у 1 мкм площі поля зору, використовуючи програму Image J ver 143u. Статистичну обробку одержаних результатів здійснювали при використанні стандартного відхилення за виборкою зв'язаних частинок колоїдного золота у полі зору за допомогою програми MSExel 2010. На Фіг. 1-3 представленні електронні мікрофотографії, одержані при здійсненні способу згідно з корисною моделлю, які демонструють локалізацію вуглеводів при використанні специфічних лектинів. Стрілками показані частинки колоїдного золота на поверхні клітин та у позаклітинному матриксі. Таблиці 2 та 3 демонструють результати зв'язування лектинів з вуглеводними компонентами у біоплівці та планктоні, відповідно. Таким чином, запропонований спосіб візуалізації та визначення вуглеводного складу вуглеводів екзополімерного матриксу біоплівки дає змогу досить швидко проводити візуалізацію локалізації глікополімерів у екзополісахаридному матриксі та визначати якісний склад 3 UA 81855 U 5 вуглеводів біоплівки, яка формується компонентами сульфідогенного мікробного угруповання. На відміну від біохімічного методу запропонований спосіб, що використовує мічені частинками колоїдного золота лектини, дає змогу досліджувати повністю гідратовані (нативні) матрикси в моно- та асоцітивних культурах біоплівок для виявлення якісного складу вуглеводів та, таким чином, може використовуватися in situ для дослідження розподілу глікополімерів у мікробних угрупованнях. Однією з переваг способу згідно з корисною моделлю є те, що він дає змогу використовувати простий підхід, що передбачає застосування недорогих та доступних реагентів та обладнання. Крім того, використані у корисній моделі частинки колоїдного золота не впливають на специфічність лектинів, що є притаманним маркерам на основі флуорохрому. 10 Таблиця 1 Характеристика лектинів, що використовуються у досліді (НВО "Лектинтест") Лектин Конканавалін А Лектин зав'язі пшениці Лектин картоплі Лектин сочевиці Лектин гороху Лектин сої Лектин квасолі Джерело одержання лектину Canavalia ensiformes, насіння Назва Con A Triticum vulgaris, WGA зав'язь Solatium tuberosum, бульби Lens culinaris, насіння Pisum sativum, насіння Glicine max, боби Phaseolus limensis, насіння STA LCA PSA SBA LBA Вуглеводна специфічність Кількість Кількість Мол. маса субодиниць в центрів (кДа) молекулі зв'язування -D-глюкоза -D-маноза 102 4 4 N-ацетил-Dглюкозамін, сіалова кислота 36 2 2 N-ацетил-Dглюкозамін 105 2 48 22 2 48 4 110 4 2 127 4 -D-глюкоза -D-маноза -D-глюкоза -D-маноза N-ацетил-Dгалактозамін N-ацетил-Dгалактозамін * "-" немає даних Таблиця 2 Зв'язування лектинів з вуглеводними компонентами у біоплівці Біоплівка, утворена бактеріями Desulfovibrio sp.10 Bacillus subtil is 36 Pseudomonas aeruginosa 27 Штучна асоціація LBA SBA N-ацетил-Dгалактозамін 178±15* 47±17 384±33 65±15 Лектин WGA Специфічність N-ацетил-Dглюкозамін 109±30 69±32 24±7 100±7 21±7 22±6 136±30 51±20 13±2 32±12 STA LSA PSA Con A D-глюкоза, D-маноза 53±24 47±18 46±16 132±11 1 51 2 20±11 11±5 151±40 13±6 64±15 33±8 29±6 25±6 4±1 * - кількість частинок колоїдного золота/мкм 2 4 UA 81855 U Таблиця 3 Зв'язування лектинів з вуглеводними компонентами у планктоні LBA SBA Суспензія бактерій Desulfovibrio sp.10 Bacillus subtilis 36 Pseudomonas aeruginosa 27 Штучна асоціація N-ацетил-Dгалактозамін 494±117* 133±18 128±21 41±8 Лектин WGA Специфічність N-ацетил-Dглюкозамін 118±33 10±3 33±12 29±14 STA LSA PSA Con A D-глюкоза, D-маноза 10±2 8±3 16±4 11±6 12±6 3±1 87±7 16±5 28±9 12±5 7±3 26±14 2±1 291±91 85±21 68±21 17±9 8±2 10±3 4±1 * - кількість частинок колоїдного золота/мкм 2 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 10 15 Спосіб визначення локалізації та складу вуглеводів екзополімерного матриксу біоплівки корозійно-агресивних бактерій, який передбачає підготовку препаратів для дослідження, обробку підготовлених препаратів розчином специфічного лектину з подальшим мікроскопічним дослідженням одержаних препаратів, який відрізняється тим, що одержання препаратів проводять за допомогою методу відбитків, що передбачає накладання на зразки стальної поверхні, що містить біоплівку, мідних сіток, вкритих формваровою плівкою, тривалість експозиції 1 хв., та висушування сіток з відбитками біоплівки на повітрі; нанесення на препарати розчину специфічного для вуглеводу лектину, міченого колоїдним золотом, та витримування препаратів протягом 1 години для зв'язування лектину з вуглеводами екзополімерного матриксу з подальшим промиванням препаратів водою та висушуванням на повітрі; мікроскопічне дослідження одержаних зразків при використанні трансмісійного електронного мікроскопа з прискорювальною напругою 80 кВ для підрахунку кількості колоїдних частинок золота, які 2 зв'язані вуглеводними компонентами, на 1 мкм площі поля зору. 5 UA 81855 U 6 UA 81855 U Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determination of localization and content of carbohydrates of exopolysaccharide matrix of biofilm of corrosion-aggressive bacteria
Автори англійськоюPurish Larysa Mykhailivna, Asaulenko Larysa Hryhorivna, Abdulina Daryna Renativna, Voichuk Serhii Ivanovych, Iutynska Halyna Oleksandrivna
Назва патенту російськоюСпособ определения локализации и состава углеводов экзоплисахаридного матрикса биопленки корозионно-агресивных бактерий
Автори російськоюПуриш Лариса Михайловна, Асауленко Лариса Григорьевна, Абдулина Дарина Ренатовна, Войчук Сергей Иванович, Иутинская Галина Александровна
МПК / Мітки
МПК: G01N 33/00, C12Q 1/00, G01N 21/00, C12Q 3/00
Мітки: матриксу, корозійно-агресивних, складу, екзополімерного, визначення, вуглеводів, біоплівки, локалізації, бактерій, спосіб
Код посилання
<a href="https://ua.patents.su/9-81855-sposib-viznachennya-lokalizaci-ta-skladu-vuglevodiv-ekzopolimernogo-matriksu-bioplivki-korozijjno-agresivnikh-bakterijj.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення локалізації та складу вуглеводів екзополімерного матриксу біоплівки корозійно-агресивних бактерій</a>
Попередній патент: Спосіб лікування атопічного дерматиту
Наступний патент: Спосіб лікування хворих на хронічний пієлонефрит з гіпероксалурією
Випадковий патент: Котельна установка