Спосіб синтезу чистих ізомерів d-(17a)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-3е- та -3z-оксимів та суміші ізомерів (варіанти) та застосування цих ізомерів
Номер патенту: 85190
Опубліковано: 12.01.2009
Автори: Кешеру Дьйордь, Хорват Янош, Козма Йожеф, Балог Габор, Махо Шандор, Туба Золтан
Формула / Реферат
1. Фармацевтична композиція у вигляді пластиру, яка відрізняється тим, що вона містить чистий d-(17![]() )-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)-оксим формули (ІА)
)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)-оксим формули (ІА)
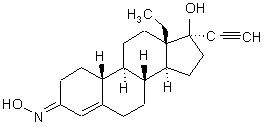 (IA)
(IA)
як гестаген активний інгредієнт.
2. Фармацевтична композиція, яку застосовують перорально, яка відрізняється тим, що вона містить чистий d-(17![]() )-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Z)-оксим формули (IВ)
)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Z)-оксим формули (IВ)
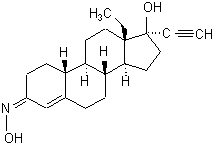 (IB)
(IB)
як гестаген активний інгредієнт.
3. Спосіб синтезу E/Z-ізомерної суміші норелгестроміну, а також чистого d-(17![]() )-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)-оксиму формули (IА) та чистого d-(17
)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)-оксиму формули (IА) та чистого d-(17![]() )-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Z)-оксиму формули (IВ), який відрізняється тим, що
)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Z)-оксиму формули (IВ), який відрізняється тим, що
а) вводять у реакцію 1 моль d-норгестрелу з 1,2-5 моль еквівалентом ацетату гідроксиламонію або сіллю гідроксиламонію та ацетатом лужного металу у кількості не більше, ніж один еквівалент останньої, в оцтовій кислоті, яка містить не більше, ніж 50 мас. % води, при 15-50 °С впродовж 15-45 хв. і отриману реакційну суміш, яка містить суміш ізомерів норелгестроміну,
![]() ) розчиняють приблизно 10-кратним об’ємом води, і суміш ізомерів, що випала в осад, виділяють з одержанням суміші E/Z-ізомерів у співвідношенні близько 56:44-64:36, або у даному разі
) розчиняють приблизно 10-кратним об’ємом води, і суміш ізомерів, що випала в осад, виділяють з одержанням суміші E/Z-ізомерів у співвідношенні близько 56:44-64:36, або у даному разі
![]() ) після додавання близько 10-25 об’ємних процентів води, її перемішують при 10-30 °С впродовж 24-72 годин, у даному разі додають воду до реакційної суміші, і продукт, що випав в осад, виділяють з одержанням (3Е)-ізомеру оксиму формули (ІА), або ж у даному разі
) після додавання близько 10-25 об’ємних процентів води, її перемішують при 10-30 °С впродовж 24-72 годин, у даному разі додають воду до реакційної суміші, і продукт, що випав в осад, виділяють з одержанням (3Е)-ізомеру оксиму формули (ІА), або ж у даному разі
![]() ) після додавання близько 10-кратного об’єму води суміш ізомерів, що випала в осад, виділяють і перемішують у дихлорметані, відфільтровують нерозчинний (3Е)-ізомер оксиму формули (ІА), фільтрат очищують колонковою хроматографією з використанням силікагелю як адсорбенту і суміші неполярного-полярного розчинників як елюенту з одержанням (3Z)-оксиму формули (IВ),
) після додавання близько 10-кратного об’єму води суміш ізомерів, що випала в осад, виділяють і перемішують у дихлорметані, відфільтровують нерозчинний (3Е)-ізомер оксиму формули (ІА), фільтрат очищують колонковою хроматографією з використанням силікагелю як адсорбенту і суміші неполярного-полярного розчинників як елюенту з одержанням (3Z)-оксиму формули (IВ),
та ізомери формули (IА) та (IВ), одержані згідно зі способом а), очищують кристалізацією.
4. Спосіб синтезу E/Z-ізомерної суміші норелгестроміну, а також чистого d-(17![]() )-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)-оксиму формули (IА) та чистого d-(17
)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)-оксиму формули (IА) та чистого d-(17![]() )-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Z)-оксиму формули (IВ), який відрізняється тим, що
)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Z)-оксиму формули (IВ), який відрізняється тим, що
b) суміш E/Z-ізомерів норелгестроміну в будь-якому співвідношенні
![]() ) перемішують з ацетатом гідроксиламонію або сіллю гідроксиламонію та ацетатом лужного металу у кількості не більше одного еквівалента останньої в оцтовій кислоті, яка містить не більше, ніж 50 мас. % води, при 15-30 °С впродовж 24-72 годин, і в даному разі після додавання додаткової кількості води продукт виділяють з одержанням (3Е)-ізомеру оксиму формули (IА), або
) перемішують з ацетатом гідроксиламонію або сіллю гідроксиламонію та ацетатом лужного металу у кількості не більше одного еквівалента останньої в оцтовій кислоті, яка містить не більше, ніж 50 мас. % води, при 15-30 °С впродовж 24-72 годин, і в даному разі після додавання додаткової кількості води продукт виділяють з одержанням (3Е)-ізомеру оксиму формули (IА), або
![]() ) перемішують у дихлорметані, відфільтровують нерозчинний (3Е)-ізомер оксиму формули (IА), фільтрат очищують колонковою хроматографією, використовуючи силікагель як адсорбент і суміш неполярного-полярного розчинників як елюент, з одержанням (3Z)-оксиму формули (IВ),
) перемішують у дихлорметані, відфільтровують нерозчинний (3Е)-ізомер оксиму формули (IА), фільтрат очищують колонковою хроматографією, використовуючи силікагель як адсорбент і суміш неполярного-полярного розчинників як елюент, з одержанням (3Z)-оксиму формули (IВ),
та ізомери формули (IА) та (IВ), одержані згідно зі способом b), очищують кристалізацією.
5. Спосіб синтезу E/Z-ізомерної суміші норелгестроміну, а також чистого d-(17![]() )-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)-оксиму формули (IА) та чистого d-(17
)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)-оксиму формули (IА) та чистого d-(17![]() )-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Z)-оксиму формули (IВ), який відрізняється тим, що
)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Z)-оксиму формули (IВ), який відрізняється тим, що
с) гідролізують ацетатну групу в положенні 17 3Е- або 3Z-ізомеру норгестимату у спиртовому розчині еквівалентною кількістю гідроксиду лужного металу при 5-30 °С, і одержаний таким чином продукт, що має таку саму конфігурацію, як і вихідний, виділяють з одержанням (3Е)-ізомеру оксиму формули (ІА) або (3Z)-ізомеру оксиму формули (IВ),
та ізомери формули (IА) та (IВ), одержані згідно зі способом с), очищують кристалізацією.
6. Спосіб с) за п. 5, який відрізняється тим, що гідроліз проводять з гідроксидом літію в метанолі.
Текст
1. Фармацевтична композиція у вигляді пластиру, яка відрізняється тим, що вона містить чистий d-(17 a )-13-етил-17-гідрокси-18,19динорпрегн-4-ен-20-ін-3-он-(3Е)-оксим формули (ІА) 3 85190 4 та ізомери формули (IА) та (IВ), одержані згідно зі способом а), очищують кристалізацією. 4. Спосіб синтезу E/Z-ізомерної суміші норелгестроміну, а також чистого d-(17 a )-13-етил-17гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)оксиму формули (IА) та чистого d-(17 a )-13-етил17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Z)оксиму формули (IВ), який відрізняється тим, що b) суміш E/Z-ізомерів норелгестроміну в будьякому співвідношенні a ) перемішують з ацетатом гідроксиламонію або сіллю гідроксиламонію та ацетатом лужного металу у кількості не більше одного еквівалента останньої в оцтовій кислоті, яка містить не більше, ніж 50 мас. % води, при 15-30 °С впродовж 24-72 годин, і в даному разі після додавання додаткової кількості води продукт виділяють з одержанням (3Е)-ізомеру оксиму формули (IА), або b ) перемішують у ди хлорметані, відфільтровують нерозчинний (3Е)-ізомер оксиму формули (IА), фільтрат очищують колонковою хроматографією, використовуючи силікагель як адсорбент і суміш неполярного-полярного розчинників як елюент, з одержанням (3Z)-оксиму формули (IВ), та ізомери формули (IА) та (IВ), одержані згідно зі способом b), очищують кристалізацією. 5. Спосіб синтезу E/Z-ізомерної суміші норелгестроміну, а також чистого d-(17 a )-13-етил-17гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)оксиму формули (IА) та чистого d-(17 a )-13-етил17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Z)оксиму формули (IВ), який відрізняється тим, що с) гідролізують ацетатну групу в положенні 17 3Еабо 3Z-ізомеру норгестимату у спиртовому розчині еквівалентною кількістю гідроксиду лужного металу при 5-30 °С, і одержаний таким чином продукт, що має таку саму конфігурацію, як і вихідний, виділяють з одержанням (3Е)-ізомеру оксиму формули (ІА) або (3Z)-ізомеру оксиму формули (IВ), та ізомери формули (IА) та (IВ), одержані згідно зі способом с), очищують кристалізацією. 6. Спосіб с) за п. 5, який відрізняється тим, що гідроліз проводять з гідроксидом літію в метанолі. Винахід відноситься до чистого ізомеру d(17α)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен20-ін-3-он-3Е-оксиму формули (IA), їтального контрацептиву було запропоновано у [патенті США №3780073]. З ура хуванням того, що дуже важливим є зменшення застосованої дози активного інгредієнту у випадку кожного активного інгредієнту, який використовують у терапії, що є особливо актуальним для стероїдних похідних, які мають високу біологічну активність, задачею дослідження було одержання та вивчення біологічного ефекту чистих оптичних антиподів стероїдних похідних, які раніше були описані в літературі як рацемічні суміші. Синтез d-(17α)-13-етил-17-ацетокси-18,19динорпрегн-4-ен-20-ін-3-оксиму (норгестимату) описаний у [патенті США №4027019]. Біологічне та клінічне дослідження норгестимату показує більш ефективне інгібування фертильності. Ця сполука у поєднанні з етинілестрадіолом знайшла терапевтичне застосування як ORTHO-CYCLEN та CILEST. Використання оптично активного ізомеру робить можливим застосування активного інгредієнту у меншій дозі порівняно з рацемічною сумішшю. Подальшим досягненням у дослідженні став синтез 17-деацетил-норгестимату (норелгестроміну), а також його фармакологічне та клінічне випробування. Автори наступних публікацій - [Am. J. Obstet. Gynecol., 166, 1969-77 (1992) та Am. J. Obstet. Gynecol. 163, 2127-31, (1990)] - виявили, що метаболітами норгестимату, який застосовують перорально, є 17-деацетил-норгестимат та 3-кетоноргестимат (левоноргестрел ацетат), а також dноргестрел (левоноргестрел), які, здебільшого, і відповідають за біологічну активність. Патент [США №4906169] описує використання норгестимату та d-норгестрелу у поєднанні з естрогенним компонентом у трансдермальному пластирі. [Патентна публікація PCT №WO 96/40355] розкриває використання деацетил-норгестимату чистого ізомеру d-(17α)-13-етил-17-гідрокси18,19-динорпрегн-4-ен-20-ін-3-он-3Z-оксиму формули (IB), які виявляють гестагенну активність, а також до способу синтезу чисти х ізомерів або їх суміші. Винахід відноситься також до фармацевтичних композицій, які містять як активний інгредієнт або чистий ізомер формули (IA), або чистий ізомер формули (IB) як такі або у поєднанні з іншими активними інгредієнтами (наприклад, з естрогенним агентом) і разом із фармацевтичними допоміжними компонентами, які звичайно застосовують на практиці, та до способу їх одержання. Синтез та біологічні дослідження 3-оксиміноандростенових і гоненових похідних, які містять стерановий скелет, було розпочато у 1960-х. Застосування похідних dl-(17α)-13-етил-17-ацилокси18,19-динорпрегн-4-ен-20-ін-3-он-оксиму як постко 5 85190 як одного з метаболітів норгестимату - як такого або у поєднанні з естрогенним компонентом у трансдермальному пластирі. Синтез dl- та d-(17α)-13-етил-17-гідрокси18,19-динорпрегн-4-ен-20-ін-3-он-оксиму описаний в угорському [патенті №165,356]. Сполуки описані як проміжні у синтезі рацемічного та оптично активного норгестрелу, але їх біологічна активність не представлена. Вищезгадані патенти представляють, по суті, однаковий метод синтезу оксимних похідних. В них використовують гідрохлорид гідроксиламонію як реагент, піридин як розчинник та основу; стероїд розчиняють при нагріванні на водяній бані та нагрівають до завершення реакції. Продукт виділяють додаванням води та перекристалізують. Співвідношення E/Z ізомерів в одержаних таким чином похідних оксиму складає приблизно 60:40-64:36. Виділення декількох відомих стероїдів - серед них і норелгестроміну -хроматографією під високим тиском описаний у наступній публікації: [J.Chromatogr., 392, 464-9 (1987)], однак там представлені лише хроматографічні параметри, без визначення фізико-хімічних характеристик виділених ізомерів оксиму, які б доводили їх структур у. Аналіз деяких проміжних сполук у синтезі норгестрелу за допомогою рідинної хроматографії високого дозволу та газо-рідинної хроматографії описаний у наступній публікації: [J.Chromatogr., 191(1), 145-54, (1980)]. Серед вищевказаних сполук там також описані рацемічні суміші та оптично чисті похідні оксимів, які описані в угорському [патенті №165,356]. Але з опису не випливає однозначно, чи були досліджені оптично чисті або рацемічні суміші стероїдних оксимів. Згідно з вищевказаною публікацією ізомери оксимів поділялися за допомогою методу аналітичної РХВД, з нормальними фазами, після чого їх структури були визначені. Для визначення структури посилаються на публікацію Нага зі співроб. [Chem. lnd. (London), 832, (1967)], де син- та анти-ізомери оксимів тестостерону були виділені, їх стр уктури були визначені методами ЯМР та УФ-спектроскопії, при цьому відзначена значна різниця у величинах молярного поглинання для двох ізомерів оксиму при довжині хвилі 242нм. Головним напрямом фармацевтичної промисловості є синтез структурно гомогенних і стереохімічно чистих активних інгредієнтів та їх використання в терапії, що означає застосування менших доз активних інгредієнтів, які мають більш чіткий профіль біологічної активності та, відповідно, більш слабкі побічні ефекти. Здійснена спроба призвела авторів до синтезу Ε-ізомеру оксиму формули (IA) та Z-ізомеру оксиму формули (IB) d-(17α)-13-етил-17-гідрокси-18,19динорпрегн-4-ен-20-ін-3-он-3Е-оксиму, який використовують у терапії як стереохімічну суміш ізомерів E/Z оксиму. Використання чистого ізомеру робить можливим збільшити однорідність профілю біологічної активності ι дає скористатися перевагою різних фізичних властивостей (наприклад, розчинності, абсорбції, транспорту) індивідуальних ізомерів для реалізації більш прийнятного способу застосування в терапії. 6 Як описано вище, відомі методики синтезу стероїдних сполук, які містять оксимну групу у положенні 3, - норгестимату та 17-дезацетилноргестимату - призводять до ізомерної суміші оксимів, у якій співвідношення ізомерів E/Z оксимів дорівнює приблизно 60:40-64:36. Несподівано було знайдено, що, застосовуючи спосіб згідно з цим винаходом для реакції оксимування та для розробленої процедури для отриманої суміші оксимів, можна одержати або d-(17α)13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3он-(3Е)-, або -(3Z)-оксим, так само як і суміш -(3E і Z)-оксимів за бажанням. Спосіб згідно з винаходом полягає у наступному: а) 1моль d-норгестрелу вводять у реакцію з 1,2-5 молярним еквівалентом ацетату гідроксиламонію або із сіллю гідроксиламонію та ацетатом лужного металу у кількості не більше, ніж один еквівалент останньої в оцтовій кислоті, яка містить не більше, ніж 50мас.% води, при 15-50°С впродовж 15-45хв., і одержану в результаті реакції суміш, яка містить суміш ізомерів норелгестроміну, α) розчиняють приблизно 10-кратним об'ємом води, і осаджену суміш ізомерів виділяють з одержанням E/Z суміші ізомерів у співвідношенні приблизно 56:44-64:36, або у даному разі β) після додавання близько 10-25 об'ємних процентів води її перемішують при 10-30°С впродовж 24-72 годин, у даному разі воду додають до реакційної суміші, і продукт, що випав в осад, виділяють з одержанням (3E) ізомеру оксиму формули (IA), або ж у даному разі γ) після додавання приблизно 10-кратного об'єму води осаджену суміш ізомерів виділяють і перемішують у дихлорметані, нерозчинний (3E) ізомер оксиму формули (IA) відфільтровують, фільтрат очищують на хроматографічній колонці з використанням силікагелю як адсорбенту та суміші неполярного-полярного розчинників як елюенту з одержанням (3Z)-оксимy формули (IB), або b) суміш Ε/Ζ ізомерів норелгестроміну у будьякому співвідношенні α) перемішують з гідроксиламоній ацетатом або з сіллю гідроксиламонію та ацетатом лужного металу у кількості не більше, ніж один еквівалент останньої в оцтовій кислоті, яка містить не більше, ніж 50мас.% води, при 15-30°С впродовж 24-72 годин і в даному разі після додавання води продукт виділяють з одержанням (3Е)-оксиму формули (IA), або β) перемішують у дихлорметані, нерозчинний (3E) ізомер оксиму формули (IA) відфільтровують, фільтрат очищують на хроматографічній колонці із використанням силікагелю як адсорбенту та суміші неполярного-полярного розчинників як елюенту з одержанням (3Z)-оксимy формули (IB), або с) ацетатну груп у в положенні 17 в 3E- або 3Zізомepi норгестимату гідролізують у спиртовому розчині еквівалентною кількістю гідроксиду лужного металу при 5-30°С, і одержаний продукт, що має ту саму конфігурацію, як і вихідний, виділяють з одержанням (3Е)-ізомеру оксиму формули (IA) або (3Z)-ізомеру оксиму формули (IB) та ізомери формули (IA) або (IB), одержані згідно зі способами а)-с), очищують кристалізацією. 7 85190 У способі с) переважно використовують моногідрат гідроксиду літію як гідроксид лужного металу, і реакцію проводять в метанолі. Згідно з винаходом, якщо утворення оксимів проводять з гідрохлоридом гідроксиламонію та ацетатом натрію або ацетатом гідроксиламонію, одержаного заздалегідь у крижаній оцтовій кислоті, тоді співвідношення E/Z ізомерів в одержаній сирій суміші ізомерів може змінюватись між 56:44 та 94:6 залежно від подальшої обробки суміші. Це дозволяє, наприклад, виділяти Ε-ізомер оксиму прямо з реакційної суміші, і допомагає виділити Zізомер оксиму колонковою хроматографією, наприклад із суміші 56:44, оскільки це співвідношення може змінюватись до 65,5:34,5 після перемішування в дихлорметані. Z-ізомер можна легко виділити із суміші, наприклад, колонковою хроматографією. Використовуючи спосіб b) винаходу, можна одержати чистий Ε-ізомер з будь-якої E/Z суміші ізомерів або навіть з чистого Z-ізомеру за допомогою ізомеризації. Докладний опис подано у прикладах. Згідно зі способом с) цього винаходу чисті Eабо Z-ізомери оксиму можуть бути одержані з відомих [Journal of Chromatography, 635, 342345(1993)] d-(17α)-13-етил-17-ацетокси-18,19динорпрегн-4-ен-20-ін-3-он-(3Е) або -(3Z)-оксимів гідролізом ацетоксигрупи в положенні 17. Стереохімічна чистота не змінюється в м'яких умовах гідролізу згідно з винаходом. Спосіб згідно з винаходом може бути проведений переважно наступним чином: 1,2-5 молярних еквівалентів (у розрахунку на 1моль d-норгестрелу) хлориду гідроксиламонію та ацетат натрію в кількості не більше, ніж один еквівалент останнього, суспендують у крижаній оцтовій кислоті, і одержану суспензію (хлорид натрію випадає в осад) перемішують впродовж 30хв., потім хлорид натрію відфільтровують. dНоргестрел додають до фільтрату, і реакційну суміш перемішують до повного завершення реакції, потім розріджують водою, продукт, що випав в осад, відфільтровують, промивають водою, висушують і перекристалізують. Згідно з іншим варіантом винаходу хлорид натрію не відфільтровують, оскільки після додавання води він розчиняється і не впливає на вихід і якість продукту. E/Z співвідношення у таким чином одержаній суміші ізомерів оксиму складає близько 60:40. Ацетат гідроксиламонію, одержаний заздалегідь, також може бути використаний як реагент. Якщо реакційну суміш перемішують додатково 24-72 години, краще 48 годин, після витрачання вихідного матеріалу - без виділення утвореного оксиму - і проводять реакцію у вищеописаних умовах, використовуючи крижану оцтову кислоту або 85% водну оцтову кислоту як розчинник, і утворений продукт відфільтровують або виділяють після додавання води, то одержана ізомерна суміш містить Ε/Ζ ізомери у співвідношенні 94:6. Згідно з іншим втіленням винаходу суміш 60:40 Ε/Ζ ізомерів або навіть чистий Z-ізомер суспендують в оцтовій кислоті, яка містить гідрокси 8 ламоній гідрохлорид та ацетат натрію у кількості не більше, ніж один еквівалент останнього, та здійснюють спосіб у ви щеописаних умовах. У цьому разі одержують суміш ізомерів, яка містить Ε/Ζ ізомери у співвідношенні 90:10-96:4. Якщо на першій стадії способу а) реакцію оксимування проводять при підтриманні реакційної суміші гомогенною, і негайно після витрачання вихідного матеріалу реакційну суміш розріджують водою, і твердий продукт, що випав, виділяють, то ізомерне співвідношення одержаної суміші дорівнює 56:44 Ε/Ζ оксимів. Цю ізомерну суміш перемішують з дихлорметаном на стадії γ способу а). У цьому разі нерозчинний Ε-ізомер може бути відфільтрований, а співвідношення ізомерів у фільтраті може змінитися в бік ізомеру Z (приблизно Ε/Ζ=33/77), що сприяє виділенню Z-ізомеру колонковою хроматографією. Виділення E- та Z-ізомерів проводять переважно методом колонкової хроматографії із використанням силікагелю як адсорбенту, та елюювання починають переважно неполярною сумішшю розчинників з поступовим збільшенням концентрації більш полярного розчинника. Фракції, які містять один з ізомерів, концентрують, і залишок перекристалізують. Ще одна можливість одержання чистих E- або Z-ізомерів представлена у способі с). Згідно з цим способом Ε/Ζ ізомерну суміш норгестимату розділяють відомим хроматографічним способом [J. Chromatogr., 635, 342-345 (1993)], а ацетатну групу в положенні 17 чистого E- або Z-ізомеру оксиму гідролізують еквівалентною кількістю гідроксиду лужного металу, переважно гідроксиду літію або натрію в спиртовому розчині у м'яких умовах, переважно при 5-20°С. Якщо гідроліз проводять у цих умовах, стереохімія гідроксильної групи оксиму в положенні 3 не змінюється. Згідно з новим способом за винаходом можна одержувати чистий Е-ізомер оксиму у промисловому масштабі. Виділення Z-ізомеру оксиму може бути рентабельним, оскільки співвідношення E/Z ізомерів може змінюватись в бік Z-ізомеру, і його можна виділити із суміші методом колонкової хроматографії. Окрім нового способу чисті ізомери формули (IA) і (IB) також є новими, оскільки в описі наведені їх характеристичні властивості, що однозначно підтверджує їх стр уктуру. В норелгестроміні згідно з відносною конфігурацією гідроксильної групи в оксимній групі існують два геометричних ізомери сполуки. Ці ізомери можна розділити звичайною колонковою хроматографією, причому Z-ізомер є більш полярним, ніж Ε-ізомер. При використанні суміші ізомерів норелгестроміну в трансдермальних пластирах виникає питання, чи може бути різною абсорбція крізь шкіру для ізомерів, які мають різну полярність. Наступне дослідження присвячене цьому припущенню. Досліджуванню піддавались фізико-хімічні характеристики, так само як і фармакокінетика in vitro. При фізико-хімічному дослідженні визначали розчинність ізомерів у воді, так само, як їх ліпофільні властивості за допомогою стандартної та ізократичної РХВД. Фармакокінетичне дослідження in 9 85190 vitro вміщувало метаболічну стабільність, метаболічний кліренс і проникність сполук на моделі клітин Сасо-2. Протокол визначення розчинності Визначення рівноважної розчинності E- і Zізомерів норелгестроміну проводили в дистильованій воді. 20мг норелгестроміну додавали до 20мл дистильованої води при кімнатній температурі. Суспензію постійно перемішували і час від часу брали проби. Проби відфільтровували і спектрометричним методом r визначали вміст норелгестроміну у фільтраті. Спектрофотометричні вимірювання проводили на спектрофотометрі VARIAN Сагу 3Е при кімнатній температурі. Протокол визначення ліпофільності Ліпофільність визначали методом РХВД. РХВД-вимірювання проводили на приладі для РХВД Thermo Separation Product (Spectra System P4000 і Spectra FOCUS Forward Optical Scanning Detector). Дані були обчислені за допомогою програмного забезпечення ChromQuest (версія 2.51). Для вимірювань у перебігу зверненофазової РХВД використовували колонку Nova-Pak C18 (розміром 4мкм´4,6мм´250мм: Waters, Ірландія), детекцію проводили при λ=280нм і 25°C. Швидкість подання рухомої фази дорівнює 1,0мл/хв. Як органічний компонент використовували ацетонітрил кваліфікації "для градієнта РХВД" (Merck KGaA, Дармштадт, Німеччина). Дані щодо утримування двох ізомерів були одержані за допомогою ізократичного аналізу з рухомими фазами, які містять різну кількість ацетонітрилу. Час виходу вільного об'єму (t0) визначали упорскуванням метанолу. Зразки розчиняли у суміші 1:1 ацетонітрил:вода в концентрації 1мг/4мл. Значення log K' розраховували із середнього часу утримування, виміряного після двох послідовних упорскувань об'єму 10мкл (log K'=log((tR-t0)'t0)). Значення log K' представлені як функція концентрації ацетонітрилу. Час завершення (t0) дорівнював 1,49хв. у цих експериментальних умовах. Хроматографічний індекс гідрофобності (φο) являє собою ступінь ліпофільного характеру сполук при вимірюваннях зверненофазової РХВД. За визначенням, за параметр φθ беруть ту концентрацію ацетонітрилу рухомої фази, при якій log K'=0. Протокол визначення метаболічної стабільності та кліренсу Метаболічну стабільність ізомерів E і Z норелгестроміну визначали на мікросомах печінки людини. Інкубаційна суміш (2,5мл) містила 6мМ Naпірофосфату, 5мм MgCI2, 5мм глюкозо-6-фосфату, 1Од/мл глюкозо-6-фосфатдегідрогенази, мікросоми печінки людини (1мг/мл) і 5мкм E або Zізомерів норелгестроміну. Значення рН доводили до 7,4 за допомогою 100мм трис-НСІ буфера. Реакцію ініціювали додаванням 5мм NADPH. Проби по 0,5мл брали через 0,5 і 20 хвилин з негайним осадженням за допомогою 0,5мл крижаного метанолу, 1мл осадженої проби центрифугували впродовж 30хв. при 1200g і вводили 10мкл супернатанту у систему РХВД. 10 Аналітичні вимірювання проводили з використанням системи РХВД Merck-Hitachi з УФмоніторингом при 244нм. Незмінений матеріал вимірювали, і його характеристичний кліренс (Сlint) та метаболічну біодоступність (F%) розраховували за наступними рівняннями: dc/dt/c0=CIint1 (мл/хв.´г білка) де dc/dt - зміна концентрації за даний період часу, a Co являє собою початкову концентрацію ізомеру норелгестроміну (виміряну в зразку у початковий час 0хв.). А також CIint1´45 = Cl int2(мл/хв.´г печінки) та EH=Clint2/Clint2+HBF, де EH є печінковою екстракцією і HBF - печінковою кровотечією. Остаточно метаболічна стабільність: F%=(100-EH)´100. Для статистичного аналізу використовували tтест Стьюдента (Microsoft Excel). Результати, наведені у таблиці 1, розраховані як середні значення 3-х паралельних вимірів. Протокол для вимірювання проникності на клітинах Сасо-2 Дослідження абсорбції ліків проводили з моношарами культури клітин людської аденокарциноми (епітеліальної) Сасо-2 як in vitro моделі. Характеристики пасивного потоку лікарських засобів крізь моношар Сасо-2 показують кореляцію з біодоступністю при прийманні всередину. Клітини Сасо-2, одержані з Американської колекції типових культур (American Type Culture Collection, Rockville, MD (ATCC)) вирощували при 37°C в атмосфері 5% CO2 у середовищі Голка, модифікованому Dulbecco's , з додаванням 10% інактивованої нагріванням фетальної бичачої сироватки (GIBCOBRL 11360-039) та антибіотиків: пеніциліну 100Од/мл і стрептоміцину 100мкг/мл (GIBCOBRL 15140-031). Конфлюентні моношари клітин, вирощені в інкубаторі (при 37°C з 5% СО2, 95% O2 і 95% вологості), кожні сім днів субкультивували шля хом обробки 25% трипсином, який містить 1мм ЕДТА. 19-23-денні конфлюентні моношари з повністю диференційованими клітинами Сасо-2 використовують для досліджування транспорту після 6-10 пасажів. Були використані матрикс EHC для прикріплення клітин (Promega G 5971), мінімальне середовище Голка з незамінними добавками із солями Ерла та L-глютаміном (GIBCOBRL 41500091) та полікарбонатна мембрана для Transwell (Costar 3401). Вкладиші Transwell покривали матриксом EHS для прикріплення клітин (Promega G 5971), і по 200000-500000 клітин Сасо-2 наносили на вкладиш. E- та Z-ізомери норелгестроміну піддавали аналізу при концентрації 50мкм. [14С]-манніт використовували як пара-клітинний маркер (3,7´104Бк/тестову камеру). Після видалення клітинного культурального середовища 3 моношари клітин Сасо-2 у паралель були преінкубовані для кожної випробуваної сполуки з попередньо нагрітим (37°C) HBBS-TRIS (по 400мкл у просвіт і по 1,5мл з базолатерального боку на компартмент) впродовж 20хв. при 37°C. Після цього додають 0,4мл 50-100мкм робочих концентрацій досліджуваних і контрольних моле 11 85190 кул у робочій концентрації 50-100мкм у просвітний/апікальний компартменти вкладишів. Вимірювання абсорбції (у напрямку від просвіту до базолатерального боку) здійснювали, відбираючи зразки з люмінального апікального ("донорного") компартменту у нульовий момент часу та з базолатерального ("що приймає") боку кожні 15хв. (трикратно). Концентрації ізомерів визначали методом рідинної хроматографії з УФ (РХВД/УФ) аналізом. 12 Метод: градієнтне елюювання при 35°C. Елюент А: метанол - 0,05M, ацетат амонію =300-200+500мкл 10% оцтової кислоти. Елюент В: метанол. Швидкість подання: 0,50мл/хв., де текція: при довжині хвилі 240нм. Тип колонки: Merck Puroshper С-18 (розміри 125-3мм+передколонка). Вид хромат: РХВД, канал: 2, кількісний аналіз піків: за висотою, метод розрахунку: EXT-STD. Концентрації ізомерів, що проникли, у базолатеральному відсіку подані у таблиці 1. Таблиця 1 Параметри Розчинність (виміряна за УФ-поглинанням) Полярність (K'; РХВД) Полярність (СНІ індекс, РХВД) Метаболічна стабільність (%) Метаболічний кліренс мл/хв.г печінки Концентрація у базолатеральному відсіку (мкМ в 30ухв.) Як показують вищенаведені дані, розчинність Z-ізомеру норелгестроміну у воді є вищою, ніж у Εізомеру. У випадку Z-ізомеру проникнення крізь епітеліальний клітинний шар є швидшим, метаболічна стабільність вищою, так само як і кліренс є меншим, ніж у випадку Е-ізомеру. Ці якості показують, що після прийняття всередину абсорбціяZ-ізомеру є кращою, ніж така для Ε-ізомеру, відповідно, його застосування у сполуках, які вводяться перорально (наприклад, у таблетках), має переваги. Siddiqui та співавтори [J. Pharm. Biopharm, 17, 405 (1989)] показали шляхом проведення експериментів на ізольованих препаратах людської шкіри, що ліпофільні стероїди швидше проникають крізь епідерміс, ніж полярні стероїди, але швидкість кліренсу є приблизно однаковою в обох випадках. Згідно з нашими експериментами щодо розчинності та полярності Ε-ізомер норелгестроміну є значно більш ліпофільним, ніж Z-ізомер. Згідно з експериментами Siddiqui та співавт. проникнення менш ліпофільного Ε-ізомеру крізь епідерміс відбувається швидше, ніж для Z-ізомеру, відповідно, застосування Ε-ізомеру у трансдермальних пластирах є вигіднішим. Благодійний ефект збільшення ліпофільності для трансдермальної абсорбції був доведений шляхом проведення дослідження взаємозв'язку структури з абсорбцією з шістьома різними стероїдами. У наступних публікаціях: [Int. J. Pharm. 2001, 217], 1 та J. Chromatography, 49, 631 (1993) показано, що хроматографічний індекс гідрофобності (СНІ), виміряний в ізократичних умовах, є дуже гарним показником ліпофільності. Ми визначили значення СНІ стероїдів, випробуваних у ци х експериментах, та співвіднесли їх з виміряними коефіцієнтами розподілу між клітинами рогового шару епідермісу (stratum corneam) і водою. Одержана гарна кореляція (г2 = 0,88) показує, що стероїд, який має більш високий СНІ індекс, краще проникає крізь клітини рогового шару епідермісу. Згідно з нашими вимірами індекс СНІ Ε-ізомеру є вищим, ніж у Z-ізомеру, внаслідок чого цей аналіз також доводить трансдермальну застосовність Е Е-ізомер 3,8мкг/мл 1,02 74 86,7±1,67 0,1815±0,026 1,27±0,56 Z-ізомер 12,1мкг/мл 1,46 70 91,9±1,52 0,1042±0,021 1,98±0,78 ізомеру. Співвідношення між коефіцієнтами проникності у системі клітини рогового шару епідермісу вода (ІодKр) та індексами СНІ показане на кресленні Фіг. Під терміном "чисті ізомери" в цьому описі маються на увазі ізомери, які мають таку саму чистоту, як ізомери, одержані у прикладах. Фармацевтичні композиції за цим винаходом можуть переважно являти собою таблетки, драже або трансдермальні пластирі. Таблетки можуть містити, окрім активного(их) інгредієнта(ів), звичайні носії, наповнювачі, розріджувачі, стабілізатори, підсилювачі смаку та ароматизатори, так само, як і добавки, що прискорюють або сприяють приготуванню продукту. Приготування таблеток проводять способами, які звичайно застосовують на практиці. Приготування драже проводять нанесенням покриття на гранули, одержані тим самим способом, як і таблетки згідно зі звичайними методами. Пластирі можуть бути переважно трансдермальними пластирами матричного типу, які складаються з 3-х шарів. їх зовнішній шар являє собою мембрану, яка є непроникною для активних інгредієнтів та інших компонентів матриці, яка складається з ПВХ-, поліетиленової-поліпропіленової або поліуретанової плівки. Матриця, яка містить активне начало, знаходиться на цьому зовнішньому шарі. Матриця також містить чутливий до тиску адгезивний компонент, яким може бути поліакрилат, полідиметилсилоксан або поліізобутилен. Один з цих адгезивних агентів змішують з активними інгредієнтами та полівінілпіролідоном як допоміжним матеріалом, що запобігає кристалізації. Допоміжні речовини (підсилювачі), що сприяють абсорбції стероїдів крізь шкіру, також переважно диспергують у матриці. Цими компонентами можуть бути, наприклад, складні ефіри аліфатичних спиртів, такі як лауриллактат, олеїнова кислота та ін. Одержана таким чином дисперсія наноситься на зовнішній шар пластиру та висушується. Матриця до нанесення покривається третім шаром пластиру - захисним шаром, який може бути, наприклад, поліетилентерефталатною плів 13 85190 кою. Захисний шар повинен видалятись перед нанесенням (приклеюванням на шкіру) пластиру. Винахід ілюструється наступними прикладами, що не обмежують його обсяг. Приклад 1 d-(17α)-13-етил-17-гідрокси-18,19-динорпрегн4-ен-20-ін-3-он-(Е/Z)-оксим 34,7 (0,5моля) гідрохлориду гідроксиламонію і 34г (0,41моль) ацетату натрію суспендують в 500мл крижаної оцтової кислоті та після перемішування впродовж 1 години додають 31,2г (0,1моль) d-норгестрелу в атмосфері азоту. Гетерогенну реакційну суміш перемішують до повного завершення реакції і потім виливають у 3л води. Осаджений продукт відфільтровують, послідовно промивають водою, 5% водним розчином гідроксиду амонію, водою і висушують при температурі нижче 60°С у вакуумі. Одержаний сирий продукт розчиняють у 320мл етанолу, очищують на деревному вугіллі і після відфільтровування вугілля розчин концентрують до об'єму, що складає 10% первісного. Залишок охолоджують до 0°C і через 5 годин фільтрують. Твердий продукт промивають етанолом і висушують з одержанням 29,4г (90%) вказаної у заголовку сполуки. Т.пл.: 110-130°С (суміш геометричних ізомерів). Співвідношення ізомерів оксимів: Еоксим=58%; Z-оксим=42%. Приклад 2 d-(17α)-13-етил-17-гідрокси-18,19-динорпрегн4-ен-20-ін-3-он-(3Е)-оксим До суспензії, яку інтенсивно перемішують, 2,5г (0,035моль) гідрохлориду гідроксиламонію, 2г (0,024моль) ацетату натрію та 55мл 70% водної оцтової кислоти додають 5г (0,016моль) dноргестрелу в атмосфері азоту, і перемішування продовжують впродовж 50 годин. Потім реакційну суміш виливають у 500мл води, продукт, що випав в осадок, відфільтровують, промивають послідовно водою, 5% водним розчином гідроксиду амонію, водою і висушують при температурі нижче 60°С. Одержаний сирий продукт (співвідношення ізомерів оксиму: Е-оксим=94,5%, Z-оксим=5,5%) перекристалізують з дихлорметану з одержанням 4,65г (88,7%) вказаної у заголовку сполуки, чистий Εізомер. Т.пл. 198-200°С. Приклад 3 d-(17α)-13-етил-17-гідрокси-18,19-динорпрегн4-ен-20-ін-3-он-(3Е)-оксим 5г (0,07моль) гідрохлориду гідроксиламонію та 5,8г (0,07моль) ацетату натрію суспендують у 100мл крижаної оцтової кислоти, суспензію перемішують впродовж 1 години і хлорид натрію, що утворився, відфільтровують. В атмосфері азоту 10г (0,032моль) d-норгестрелу додають до фільтрату при перемішуванні, і перемішування продовжують до повного завершення реакції. Додають 30мл води до реакційної суміші, і перемішування продовжують ще 50 годин. Реакційну суміш виливають у 1000мл води, продукт, що висадився, відфільтровують, промивають згідно зі способом, описаним у прикладі 2, та висушують. Сирий продукт перекристалізують з ацетонітрилу з виходом 14 9,1г (86,8%) вказаної у заголовку сполуки, чистий Ε-ізомер: Т.пл.: 198-200°С. Приклад 4 d-(17α)-13-етил-17-гідрокси-18,19-динорпрегн4-ен-20-ін-3-он-(3Е)-оксим До суспензії, яку інтенсивно перемішують, 10г (0,027моль) d-(17α)-13-eтил-17-гідрокси-18,19динорпрегн-4-ен-20-ін-3-он-3(Е/Z)-оксиму [співвідношення ізомерів: Е-оксим 58%, Z-оксим 42%] та 100мл крижаної оцтової кислоти в атмосфері азоту додають 2,5г (0,035моль) гідрохлориду гідроксиламонію і 2,9г (0,035моль) ацетату натрію у 20мл води. Реакційну суміш перемішують впродовж 50 годин, потім виливають у 1000мл води. Далі продовжують процедуру аналогічно способу, описаному в прикладі 2, з виходом 9,6г (96%) сирого продукту. Одержаний сирий продукт [співвідношення ізомерів: Е-оксим 94%, Z-оксим 6%] перекристалізують з етилацетату згідно зі способом, описаним у прикладі 2, з виходом 9,1г (91%) вказаної у заголовку сполуки, чистий Е-ізомер. Т.пл.: 197-199°C. Приклад 5 d-(17α)-13-етил-17-гідрокси-18,19-динорпрегн4-ен-20-ін-3-он-(32)-оксим Суспензію 43,8г (0,53моль) ацетату натрію, 50г (0,72моль) гідрохлориду гідроксиламонію і 100мл 90% водної оцтової кислоти інтенсивно перемішують при кімнатній температурі впродовж 1 години. Осад хлориду натрію відфільтровують, до фільтрату додають 100г (0,32моль) d-норгестрелу в атмосфері азоту, і одержану суміш перемішують впродовж 1,5 годин. Впродовж цього часу температура цієї реакції піднімається до 45°C. Реакційна суміш стає гомогенною, що вказує на завершення реакції. Реакційну суміш виливають у 4000мл води, продукт, що випав в осад, відфільтровують, послідовно промивають водою, 5% водним розчином гідроксиду амонію, водою і висушують. Одержану суміш ізомерів (104г) оксимів [співвідношення ізомерів: Е-оксим 57,4%, Z-оксим 42,6%] інтенсивно перемішують з 20-кратним об'ємом дихлорметану впродовж 30хв., нерозчинний продукт відфільтровують і висушують при температурі до 60°С з виходом 45,6г продукту [співвідношення ізомерів: Е-оксим 94,4%, Z-оксим 4,6%]. Маткову рідину, одержану після виділення вищеописаного продукту, концентрують з одержанням 58г продукту [співвідношення ізомерів: Zоксим 65,5%, Е-оксим 33,2%]. Концентрат розчиняють у 2300мл (40-кратний об'єм) дихлорметану і витримують при 0-5°C впродовж 5 годин. Кристалічний продукт, що випав, відфільтровують, промивають дихлорметаном і висушують з ви ходом 17,6г продукту [співвідношення ізомерів: Е-оксим 9%, Z-оксим -91%]. Одержаний таким чином матковий розчин також концентрують, і залишок -39г - очищають колонковою хроматографією, використовуючи 700г силікагелю як адсорбент і толуол, з подальшою більш полярною сумішшю толуол-ацетон як елюентом. Фракції, які містять однакові ізомери, концентрують з ви ходом 3,7г E-оксиму (чистота ізомеру 94%) і 25,2г Z-оксиму (чистота ізомеру: 95%). 15 85190 Відповідні кристали, одержані кристалізацією та колонковою хроматографією, об'єднують та перекристалізують спочатку з 20-кратного об'єму ацетонітрилу, потімз 23-кратного об'єму етилацетату з ви ходом 29г Z-оксиму (чистота: 99,3%) і 38,4г Е-оксиму (чистота: 99,7%). Т.пл. Z-оксиму: 206-207°C, т.пл. Е-оксиму: 199-200°С. ЯМР-дані: Z-оксим 1 Н-ЯМР{500МГц, ДМСО-d 6 (TMC), δ(м.д.)}:0,92 (3Н,т, -CH2-CH3), 1,40(2Н,m -CH2-CH3), 2,05 і 2,24 (2Н, m і m,Н-2), 3,28 (1H,s,ºCH), 5,23 (1H,s,17-OH), 6,40 (1Н, m, Н-4), 10,12 (1H,s,=N-OH). 13 С-ЯМР{125МГц, ДМСО-d6 (TMC), δ(м.д.)}: 9,4(-CH 2-CH3), 18,3(-CH2-CH3), 26,9(С-2), 79,6 (С17), 89,1(-Cº), 74,9 (ºСН), 111,6 (С-4), 151,2 (С-3), 152,0 (05). Е-оксим 1 Н-ЯМР{500МГц, ДМСО-d 6 (TMC), δ(м.д.)}:0,92 (3Н,т, -CH2-CH3), 1,40 (2Н,m -CH 2-CH3), 1,87 і 2,87 (2Н, m і m,Н-2), 3,28 (1H,s,ºCH), 5,23 (1H,s,17-OH), 5,78 (1Н,m, Н-4), 10,38 (1H,s,=N-OH). 13 С-ЯМР{125МГц, fl MCO-d 6 (TMC), δ(м.д.)}: 9,4(-CH 2-CH3), 18,3(-CH2-CH3), 20,6(C-2), 79,6 (С17), 89,1(-Cº), 74,9 (ºСН), 118,6 (С-4), 154,3 (С-3), 148,1 (С-5). Приклад 6 d-(17α)-13-етил-17-гідрокси-18,19-динорпрегн4-ен-20-ін-3-он-(3Е)-оксим До розчину, який інтенсивно перемішують, 10г (0,027моль) d-(17α)-13-етил-17-гідрокси-18,19динорпрегн-4-ен-20-ін-3-он-(3Z)-оксиму та 100мл 80% водної оцтової кислоти додають 2,5г (0,035моль) гідрохлориду гідроксиламонію і 2,9г (0,035моль) ацетату натрію. Реакційну суміш перемішують близько 50 годин, потім повторюють спосіб згідно з прикладом 4, одержуючи 8,5г (85%) вказаної у заголовку сполуки, чистий Е-оксим. Т.пл.: 196-198°C. Приклад 7 d-(17α)-13-етил-17-гідрокси-18,19-динорпрегн4-ен-20-ін-3-он-(3Е)-оксим До розчину, який інтенсивно перемішують, 5г (0,01моль) d-(17α)-13-етил-17-ацетокси-18,19динорпрегн-4-ен-20-ін-3-он-(3Z)-оксиму та 50мл метанолу в атмосфері азоту додають 1,7г (0,04моль) моногідрату гідроксиду літію при 0-5°C, і перемішування продовжують впродовж 2 годин. Після завершення реакції, яке контролюється тонкошаровою хроматографією, реакційну суміш виливають у 500мл води, і рН одержаної суспензії доводять до 7,5-9 оцтовою кислотою. Продукт, що випав в осад, відфільтровують, промивають водою і висушують при температурі до 60°С у вакуумі. Одержаний сирий продукт (4,5г) перекристалізують з ацетонітрилу з виходом 4г (90,2%) d-(17α)13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3он-(3Z)-оксиму. Т.пл.: 203-204°C. d-(17α)-13-етил-17-гідрокси-18,19-динорпрегн4-ен-20-ін-3-он-(3Е)-оксим одержують згідно зі способом, описаним вище, з 5г d-(17α)-13-етил-17ацетокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)оксиму. Вихід: 4,1г (92,45%). Т.пл. 198-200°С. Приклад 8 16 d-(17α)-13-етил-17-гідрокси-18,19-динорпрегн4-ен-20-ін-3-он-(3Е)-оксим До суспензії, яку інтенсивно перемішують, 1,25г (0,017моль) гідрохлориду гідроксиламонію, 1,45г (0,017моль) ацетату натрію та 60мл 50% водної оцтової кислоти додають в атмосфері азоту 2,5г (0,08моль) d-норгестрелу. Після завершення реакції, яке контролюється тонкошаровою хроматографією, реакційну суміш виливають у 500мл води. Продукт, що випав в осад, відфільтровують, послідовно промивають водою, 5% водним розчином гідроксиду амонію, водою і висушують при температурі до 60°С. Сирий продукт перекристалізують з дихлорметану з виходом 2,27г (86,7%) сполуки, вказаної у заголовку. Т.пл. 198-200°С. Приклад 9 d-(17α)-13-етил-17-гідрокси-18,19-динорпрегн4-ен-20-ін-3-он-оксим (суміш ізомерів) До суспензії, яку інтенсивно перемішують, 5,8г (0,07моль) ацетату натрію і 80мл крижаної оцтової кислоти додають 5г (0,007моль) гідрохлориду гідроксиламонію у 22мл води. Потім до реакційної суміші додають 10г (0,032моль) d-норгестрелу в атмосфері азоту, і перемішування продовжують до повного завершення реакції. Після завершення реакції, яке контролюється тонкошаровою хроматографією, реакційну суміш виливають у 800мл води. Осад, що випав, відфільтровують, послідовно промивають водою, 5% водним розчином гідроксиду амонію, водою і висушують при температурі до 60°С з виходом 8,9г (84,92%) сполуки, вказаної у заголовку, у вигляді суміші 55,88:44,05 Ε/Ζ ізомерів. Т.пл. 110-130°С. Приклад 10 Фармацевтична композиція, яка містить d(17α)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен20-ін-3-он-(3Е)-оксим та етиніл-естрадіол як активні інгредієнти, у формі таблеток. 250мг Z-ізомеру норелгестроміну та 35мг етиніл-естрадіолу перемішують до гомогенного стану з 75,715г лактози, 22,5 мікрокристалічної целюлози, 1г колоїдного діоксиду кремнію (Aerosil) та 500мг стеарату магнію. Одержану таким чином порошкоподібну суміш пресують у таблетки по 100мг без гранулювання. Одержано близько 1000 штук таблеток. Приклад 11 Фармацевтична композиція, яка містить d(17α)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен20-ін-3-он-(3Z)-оксим та етиніл-естрадіол як активні інгредієнти, у формі таблеток. 250мг Z-ізомеру норелгестроміну та 35мг етиніл-естрадіолу розчиняють у 10мл етанолу, і одержану таким чином суміш розпилюють на гомогенну суміш 75,715г лактози та 20,5 кукурудзяного крохмалю. Етанол видаляють із суміші висушуванням у зрідженому шарі. Одержану порошкоподібну суміш, яка містить активні інгредієнти, гранулюють з водним розчином 2г полівініліпіролідону (PVP) у пристрої для псевдозріджування, потім висушують. 1г колоїдного діоксиду кремнію та 0,5г стеарату магнію гомогенізують з гранульованим матеріалом і пресують у таблетки по 100мг. Одержано близько 1000 таблеток. 17 85190 Приклад 12 Фармацевтична композиція, яка містить d(17α)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен20-ін-3-он-(3Z)-оксим та етиніл-естрадіол як активні інгредієнти у формі таблеток. 250мг Z-ізомеру норелгестроміну, 35мг етинілестрадіолу та 2г полівінілпіролідону (PVP) розчиняють у 10мл етанолу, одержану таким чином суміш розпилюють на гомогенну суміш 75,715г лактози та 20,5 кукурудзяного крохмалю у змішувачі з високою зрізувальною напругою. Суміш гранулюють, і етанол видаляють у мікрохвильовій вакуумній сушарці. 1г колоїдного діоксиду кремнію та 0,5г стеарату магнію гомогенізують з гранульованим матеріалом і пресують у таблетки по 100 мг. Одержано близько 1000 таблеток. Приклад 13 Фармацевтична композиція d-(17α)-13-етил17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-(3Е)оксиму та етиніл-естрадіолу як активних інгредієнтів у вигляді трансдермального пластиру. Один кусок трансдермального 3-х шарового пластиру матричного типу містить 6,0мг Ε-ізомеру норелгестроміну та 0,75мг етиніл-естрадіолу. Для кожного куску пластиру 6,0мг Ε-ізомеру норелгестроміну, 0,75мг етиніл-естрадіолу, 25мг полівінілпіролідону, 20мг лауриллактату (агенту, що стимулює абсорбцію) та 248мг поліізобутилену Комп’ютерна в ерстка Т.Чепелева 18 диспергують у суміші 8:1:1 гексан/етилацетат/етанолу при кімнатній температурі впродовж 45хв. Одержану таким чином дисперсію виливають на зовнішню мембрану пластиру та висушують при 70°С впродовж 45хв. За хисну мембрану нашаровують на поРХВДню висушеної матриці. Приклад 14 Фармацевтична композиція, яка містить d(17α)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен20-ін-3-он-(3Е)-оксим та етиніл-естрадіол як активні інгредієнти, у вигляді трансдермального пластиру. Один кусок трансдермального 3-х шарового пластиру матричного типу містить 6,0мг Ε-ізомеру норелгестроміну та 0,75мг етиніл-естрадіолу. Для кожного куску пластиру 261мг полідиметилсилоксану та 17мг полівінілпіролідону гомогенізують при кімнатній температурі. 15мг метиллаурату, 6,0мг Ε-ізомеру норелгестроміну та 0,75мг етиніл-естрадіолу додають до суміші і диспергують з 350мл етанолу при кімнатній температурі впродовж 45хв. Одержану таким чином дисперсію виливають на зовнішню мембрану пластиру та висушують при 70°С впродовж 45хв. Захисну мембрану нашаровують на поРХВДню висушеної матриці. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the synthesis of pure d-(17a)-13-ethyl-17-hydroxy-18,19-dinorpregn-4-ene-20-yne-3-one-3e- and -3z-oxime isomers and the mixture of isomers, and use of those isomers
Автори англійськоюTuba Zoltan, MAKHO SHANDOR, Keseru Gyorgy, Kozma Jozsef, Horvath Janos, Balogh Gabor
Назва патенту російськоюСпособ синтеза чистых изомеров d-(17a)-13-этил-17-гидрокси-18,19-динорпрегн-4-ен-20-ин-3-он- -3е- и -3z-оксимов и смеси изомеров (варианты) и применение этих изомеров
Автори російськоюТуба Зольтан, Махо Шандор, Кешеру Дердь, Козма Ежеф, Хорват Янош, Балог Габор
МПК / Мітки
МПК: C07J 41/00
Мітки: застосування, 3z-оксимів, d-(17a)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-3е, суміші, чистих, ізомерів, варіанти, цих, спосіб, синтезу
Код посилання
<a href="https://ua.patents.su/9-85190-sposib-sintezu-chistikh-izomeriv-d-17a-13-etil-17-gidroksi-1819-dinorpregn-4-en-20-in-3-on-3e-ta-3z-oksimiv-ta-sumishi-izomeriv-varianti-ta-zastosuvannya-cikh-izomeriv.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу чистих ізомерів d-(17a)-13-етил-17-гідрокси-18,19-динорпрегн-4-ен-20-ін-3-он-3е- та -3z-оксимів та суміші ізомерів (варіанти) та застосування цих ізомерів</a>
Попередній патент: Пристрій для прихованої передачі інформації у звукових сигналах
Наступний патент: Спосіб розкриття і підготовки робочих горизонтів кар’єру в умовах відкритої розробки крутопадаючих родовищ
Випадковий патент: Спосіб зведення литої смуги












