Похідні ксантину у вигляді суміші ізомерів або індивідуальних ізомерів, що мають властивість антагоніста аденозину
Номер патенту: 26427
Опубліковано: 30.08.1999
Автори: ЛЕР Еріх, Вебер Карл-Гейнц, Вальтер Герхард, Кун Франц-Йозеф, Шінгнітц Гюнтер, Странскі Вернер, Кюфнер-Мюль Ульріке, Ейзінгер Гельмут
Формула / Реферат
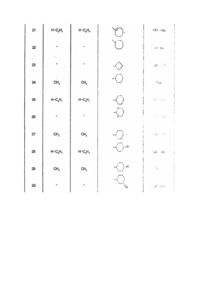
1. Производные ксантина общей формулы:
где R1 и R2 - низший алкил;
R3 - остаток из группы, включающей тетрагидрофуранон, тиофен, дитиоланил, дитианил, фуран, при необходимости замещенный группой:
где Alk - C1-C4-алкил,
где Alk имеет указанное значение, тетрагидрофуран, при необходимости замещенный низшим алкилом или группой
или фуран, или тиофен, замещенные низшим алкилом или нитрогруппой, или незамещенный циклоалкен с 6 - 8 атомами углерода, циклоалканон или циклоалканол с 5 - 6 атомами углерода, незамещенный циклоалкан с 4 - 6 атомами углерода или циклоалкан C4-C6, замещенный группами =CH2, =N-NH-фенил, причем фенил может быть замещен, =NOH, -OCONH-фенил, причем фенил может быть замещен =CH-COOCH3, -CH2COOCH3, -CH2CH2NH2, -OC(C6H5)3, -OAlk,
где Alk имеет вышеуказанное значение, OCOR4,
где R4 - остаток камфановой кислоты, низший алкил, фенил, замещенный низшим алкоксилом, фенил, ментоксиметил, шестичленный азотсодержащий гетероцикл, циклогексан, замещенный цианометиленом или оксиалкилом C1-C4, или гидроксигруппой, или циклопентан, замещенный низшим алкилом или фенилом, который может иметь в качестве второго заместителя в геминальном положении относительно первого, гидроксильную группу, или кеталь формулы:
или R3 - остаток, выбранный из группы:
в виде смеси изомеров или индивидуальных изомеров, обладающие свойством антагониста аденозина.
2. 1,3-Дипропил-8-(3-оксициклопентил) ксантин по п.1, обладающий свойством антагониста аденозина.
Текст
Изобретение относится к новым химическим веществам, пригодным для применения в качестве лекарств, в частности к производным ксантина общей формулы I где R1 и R2 - низший алкил; R3 - остаток из группы, включающей тетрагидрофуранон, тиофен, дитиоланил, дитианил, фуран, при необходимости замещенный группой: где Alk означает алкил с 1 - 4 атомами углерода. -CONH-(CH2)2N(Alk)2, где Alk имеет указанное значение, тетрагидрофуран, при необходимости, замещенный низшим алкилом или группой или фуран или тиофен, замещенный низшим алкилом или нитрогруппой, или незамещенный циклоалкен с 6 - 8 атомами углерода, циклоалканон или циклоалканол с 5 - 6 атомами углерода, незамещенный циклоалкен с 4 - 6 атомами углерода или циклоалкан C4-C6, замещенный группами =CH2, =N,NH-фенил, причем фенил может быть замещен, =NOH, -OCONH фенил, причем фенил может быть замещен =CH-COOCH3, -CH2COOCH3, -CH2CH2NH2, -OC(C6H5)3, -OAlk, где Alk имеет указанное значение, OCOR4, где R4 имеет значения: остаток камфановой кислоты, низший алкил, фенил, замещенный низшим алкоксилом, фенил, ментоксиметил, шестичленный азотсодержащий гетероцикл: циклогексан, замещенный цианометиленом или оксиалкилом C1-C4, или гидроксигруппой, или циклопентан, замещенный низшим алкилом или фенилом, который может иметь в качестве второго заместителя в геминальном положении относительно первого гидроксильную группу или кеталь формулы или R3 - остаток, выбранный из группы: в виде смеси изомеров или индивидуальных изомеров, обладающим свойствами антагонистов аденозина. Новые производные ксантина формулы I можно получать способами-аналогами, например, следующим образом. А. Соединение общей формулы II где R1 и R2 имеют указанное значение, подвергают взаимодействию с соединением общей формулы III где R3 имеет указанное значение, причем функциональные группы в остатке R3 могут быть защищены, и с N,Nдиметилгидразином, возможно имеющиеся защитные группы снимают и получаемый при этом целевой продукт формулы I в случае необходимости переводят в другой целевой продукт формулы I. Б. Соединение общей формулы IV где R1 и R2 имеют указанное значение, подвергают взаимодействию с соединением общей формулы V где X означает CHO или COOH, и функциональные группы в остатке R3 могут быть защищены, или его реакционноспособным производным с последующей циклизацией, снятием возможно имеющихся защитных групп, и переведением, в случае необходимости, получаемого при этом целевого продукта формулы I в др угой целевой продукт формулы I. В случае, если используют соединение формулы V, в которой R3 означает CHO, то циклизацию предпочтительно осуществляют в присутствии диэтилазодикарбоксилата. В случае использования соединения формулы V, в которой R3 означает COOH, или его реакционноспособного производного, циклизацию предпочтительно осуществляют в присутствии гидроокиси кальция или оксихлорида фосфора. В. Соединение общей формулы VI где R1, R2 и R3 имеют указанное значение и функциональные группы в остатке R3 могут быть защищены, подвергают циклизации с последующим снятием возможно имеющихся защитных групп и переведением, в случае необходимости, получаемого при этом целевого продукта формулы (I) в другой целевой продукт формулы (I). Получаемый согласно пп.А - В целевой продукт выделяют в виде смеси изомеров или индивидуальных изомеров. Возможное переведение целевого продукта формулы I в др угой целевой продукт формулы I осуществляют известными приемами. Получение новых производных ксантина формулы I, а также возможности переведения целевого продукта формулы I в другой целевой продукт формулы I поясняются следующими примерами. Пример 1. 1,3-Дипропил-8-(1,4-бензодиоксан-6-ил)ксантин. Перемешивают 2,18г (0,013моль) 1,4-бензодиоксан-6-альдегида, 80мл этанола и 2,4мл ледяной уксусной кислоты и смешивают с 2,8г (0,012моль) 5,6-диамино-1,3-дипропилурацила. Прозрачный раствор кипятят с обратным холодильником в течение 2 1/4ч и затем охлаждают до 60°C. При этой температуре каплями добавляют 2,1мл (0,013моль) сложного диэтилового эфира азодикарбоновой кислоты, полученную вязкую суспензию смешивают с 80мл этанола и кипятят с обратным холодильником в течение 2ч. По истечении дальнейших 20ч при комнатной температуре смесь охлаждают до 5°C, твердое вещество отсасывают и промывают этанолом и простым эфиром. Получают 4,1г (92% теории), указанного соединения в качестве серого твердого вещества, т.пл. = 280 - 282°C. Пример 2. 1,3-Дипропил-8-(тетрагидропиран-4-ил)ксантин. 3,2г (0,025моль) тетрагидрофуран-4-карбоновой кислоты, 4,0г (0,025моль) карбонилдиимидазола и 85мл абсолютного метиленхлорида перемешивают в течение 30мин при комнатной температуре. После добавления 5,7г (0,025моль) 5,6-диамино-1,3-дипропипурацила смесь перемешивают в течение 4ч при комнатной температуре и затем сгущают в вакууме, Оста ток смешивают с 130мл воды и 11,6г гидроокиси кальция, перемешивают в течение 30мин при 80°C и после охлаждения при охлаждении льдом подкисляют концентрированной соляной кислотой. Смесь экстрагируют этилацетатом и органическую фазу сушат и сгущают. Хроматографией кристаллического остатка на силикагеле с применением в качестве элюента метиленхлорида и метанола в соотношении 99 : 1 получают 1,7г (15% теории) указанного соединения в виде белых кристаллов, т.пл. 171 - 172°C. Пример 3. 1,3-Дипропил-8-(3-оксоциклопентил)-ксантин. 2,4г (0,014моль) 1,4-диоксаспиро[4,4]нонан-7-карбоновой кислоты растворяют в 56мл хлористого метилена и после добавления 2,2г (0,014моль) карбонилдиимидазола перемешивают в течение часа при комнатной температуре. Затем добавляют 3,2г (0,014моль) 5,6-диамино-1,3-дипропилурацила и перемешивают далее в течение 4ч при комнатной температуре. Раствор сгущают в вакууме, маслянистый остаток смешивают с 70мл воды и 4,5г гидроокиси кальция и перемешивают в течение часа при 60°C. Добавляют 100мл 50% - ной гидроокиси натрия, перемешивают в течение дальнейшего часа при 70°C и в течение 16ч при комнатной температуре. При охлаждении льдом раствор доводят до значения pH 6 соляной кислотой и экстрагируют хлористым метиленом. Из объединенных органических фаз после высушивания и сгущения под вакуумом получают кристаллический остаток, который перекристаллизовывают из этанола в присутствии активного угля. Получают 0,8г (16%) белых кристаллов с т.пл. 147 - 148°C. Используемый в качестве защитной группы диоксолан гидролизуют кислотой известным в литературе образом и получают приведенное соединение. Пример 4. 1,3-Дипропил-8-(3-оксоциклопентил)-ксантин. а) Получение 3-оксоциклопентанкарбоновой кислоты. 100,0г (0,7моль) сложного метилового эфира 3-оксоциклопентанкарбоновой кислоты смешивают с 1000мл 2молярной соляной кислоты и перемешивают в течение 10ч при температуре кипения. Раствор охлаждают и полностью сгущают в вакууме. Оставшееся количество воды удаляют в три стадии, каждый раз с помощью 50мл толуола (толуол добавляют к остатку и отгоняют на испарителе при полном водоструйном вакууме и температуре водяной ванны 60 - 70°C), Получаемый сырой продукт подвергают фракционной перегонке в высоком вакууме. 1. Фракция: т.к.002 20 - 110°C (получают: 1,2г масла); 2. Фракция: т.к.002 (110 - 116°C. Получают: 4-7г частично кристаллического масла. 3. Фракция: т.к.0002 116 - 121°C. Получают: 74,0г (82,1% теории) бесцветного масла, которое позже выкристаллизовывают. 8,8г (0,072моль) 3-оксоциклопентанкарбоновой кислоты подают в 240мл абсолютного метиленхлорида и при перемешивании подают при 20 - 25°C 11,6г карбонилдиимидазола и перемешивают в течение 2ч при комнатной температуре. Затем добавляют при 20 - 25°C 16,0г (0,072моль) 1,6-диамино-1,3-ди-н-пропилурацила и перемешивают далее в течение 3ч при комнатной температуре. Реакционную смесь сгущают досуха в вакууме. Маслянистый остаток смешивают с 3200мл дистиллированной воды и 35г гидроокиси кальция и перемешивают в течение 0,5ч при 80°C. Затем охлаждают до 5°C. pH среды доводят до 1 - 2 концентрированной соляной кислотой и экстрагируют три раза, каждый раз 100мл метиленхлорида. Объединенные органические фазы раз промывают 100мл воды, сушат сульфатом магния, фильтруют и сгущают досуха. Получаемый сырой продукт очищают на 350г силикагеля марки S160 с применением в качестве элюента примерно 4л метиленхлориде и метанола в соотношении 99 : 1. Чистые фракции сгущают досуха. Кристаллический остаток смешивают с 100мл простого эфира и отсасывают. Выход: 11,5г серых кристаллов (50,2% теории). Т.пл. 164 - 168°C. Пример 5. 1,3-Дипропил-8-(4,7,7-триметил-2-оксабицикло[2,2,1]-гептан-3-он-1-ил)ксантин. 1,2г (5,4ммоль) 5,6-диамино-1,3-дипропилурацила и 1,0г (10ммоль) триэтиламина растворяют в 50мл абсолютного метиленхлорида. После добавления каплями 1,2г (5,5ммоль) хлорангидрида камфановой кислоты перемешивают в течение 20ч при комнатной температуре и сгущают в вакууме. Остаток смешивают с 28мл воды и 1,6г гидроокиси кальция и перемешивают в течение 3ч при 80°C. Охлажденную суспензию подкисляют при охлаждении льдом и экстрагируют хлористым метиленом. Объединенные органические фазы сушат и сгущают и остаток очищают хроматографией на силикагеле с применением в качестве элюэнта метиленхлорида и метанола в соотношении 99 : 1. Получают 200мг (10% теории) приведенного соединения в виде белых кристаллов с т.пл. 200 - 201°C. Пример 6. 1,3-Дипропил-8-(2-формилфуран-5-ил)ксантин. К 400мл абсолютного диметилформамида при 0 - 10°C каплями добавляют 16,4г (0,11моль) оксихлорида фосфора. При 5 - 15°C добавляют раствор 15,6г (0,05моль) 1,3-дипропил-8-фуранксантина в 330мл диметилформамида. Реакционную смесь перемешивают в течение часа при комнатной температуре и в течение 7ч при 85°C. Смесь подают на 500мл льда и экстрагируют хлористым метиленом. Объединенные органические экстракты сушат и сгущают в вакууме, остаток кристаллизуют из простого диэтилового эфира. Получают 12,1г (73% теории) указанного соединения в виде коричневых кристаллов с т.пл. 215 - 217°C. Пример 7. 1,3-Дипропил-8-(2-карбоксифуран-5-ил)ксантин. Раствор 0,26г (1,5ммоль) нитрата серебра в 2мл воды встряхивают вместе с раствором 0,4 гидроокиси натрия в 1мл воды в течение 5мин. Серо-черный осадок окиси серебра отсасывают и промывают водой, затем подают в 5мл воды и смешивают с 1,3-дипропил-8-[5-формил(2-фуранил)]ксантином. Смесь нагревают до 50°C, и каплями медленно добавляют раствор 0,1г гидроокиси натрия в 2мл воды. Затем перемешивают в течение 15мин при 50°C и в течение часа при комнатной температуре, после чего фильтруют. Фильтрат подкисляют и смешивают с метиленхлоридом, выпавший осадок отсасывают и промывают метиленхлоридом и простым диэтиловым эфиром. Получают 0,4г (77% теории) указанного соединения в виде светло-коричневых кристаллов с т.пл. 201 - 203°C. Пример 8. 1,3-Дипропил-8-[2(2,2'-бис(этоксикарбонил)винил)-фуран-5-ил]-ксантин. Смесь 2,5г (7,6ммоль) 1,3-дипропил-8-[5-формил-(2-фуранил)]-ксантина, 1,2г (7,6ммоль) сложного диэтилового эфира малоновой кислоты, 0,03г (0,3ммоль) пиперидина, 0,09г (1,5ммоль) ледяной уксусной кислоты и 5мл бензола кипятят в течение 6ч на водоотделителе. После охлаждения реакционную смесь разбавляют 10мл толуола, твердое вещество о тсасывают и растворяют в 100мл теплого хлористого метилена. Раствор фильтруют, фильтрат сгущают в вакууме и остаток перекристаллизовывают из 2-пропанола. Получают 1,0г (28% теории) приведенного соединения в виде желтых кристаллов с т.пл. 220 - 222°C. Пример 9. 1,3-Дипропил-8-[2-N,N-диэтиламинокарбонил)фуран-5-ил]-ксантин. 1,0г (2,9ммоль) 1,3-дипропил-8-[2-карбоксифуран-5-ил)]-ксантина растворяют в абсолютном диметилформамиде и смешивают при 0 - 5°C с 0,38г триэтиламина и 0,45г (3,3ммоль) изобутилхлороформата. Смесь перемешивают в течение 2ч при 0 - 5°C, затем добавляют 0,34г (2,9ммоль) N,N-диэтиламиноэтиламина, и продолжают перемешивание смеси в течение 12ч на таящей ледяной бане. Смесь сгущают в высоком вакууме, смешивают с хлористым метиленом и водой, подщелачивают и экстрагируют хлористым метиленом. Органические фазы удаляют, водную фазу подкисляют и опять экстрагируют. Объединенные органические экстракты сушат, фильтруют, сгущают и остаток кристаллизуют из этилацетата. Получают 0,25г упомянутого соединения в виде желтоватых кристаллов с т.пл. 247 - 250°C. Пример 10. 1,3-Дипропил-8-(1-охсициклопент-3-ил)-ксантин. 0,5г (1,6ммоль) 1,3-дипропил-8-(1-оксо-3-циклотентил)ксантина, 10мл этанола и 0,1г (2,6ммоль) тетрагидридобораната натрия перемешивают в течение 2 1/2 дней при комнатной температуре. Реакционную смесь сгущают в вакууме и смешивают с водой и хлористым метиленом, водяную фазу подкисляют и экстрагируют. Объединенные органические экстракты сушат и сгущают в вакууме. Остаток разделяют на изомеры хроматографией на силикагеле с применением в качестве элюента метиленхлорида и метанола в соотношении 95 : 5. Из первой фракции получают 0,4г (39% теории) приведенного соединения в виде белых кристаллов (39% теории), т.пл. 174 - 176°C, а из второй фракции получают 0,4г (39% теории) приведенного соединения в виде белых кристаллов с т.пл. 191 - 193°C. Пример 11. 1,3-Дипропил-8-[1-((4,7,7-триметил-2-оксабицикло[2,2,1]-гептан-3-он-1ил)карбонилокси)циклопентан-3-ил]ксантин. 0,2г (0,6ммоль) 1,3-дипропил-8-(1-окси-3-циклопентил)ксантина и 0,24г (3ммоль) пиридина перемешивают в 10мл абсолютного хлористого метилена и после добавления 0,2г (0,9ммоль) хлорангидрида камфановой кислоты перемешивают в течение 4ч при комнатной температуре. Реакционную смесь смешивают с водой и отделяют водную фазу. Органическую фазу сушат и сгущают в вакууме, остаток очищают хроматографией на силикагеле с применением в качестве элюента метиленхлорида и метанола в соотношении 95 : 5. Получают 50мг приведенного соединения в виде желтоватого масла. Пример 12. 1,3-Дипропил-8-(1-цианометиленциклопент-3-ил)ксантин. 0,28г (1,6ммоль) сложного диэтилового эфира цианометанфосфоновой кислоты растворяют в 20мл абсолютного бензола, добавляют 0,13г (3,2ммоль) 60% - ной дисперсии гидрида натрия и кипятят с обратным холодильником в течение 5ч. Реакционную смесь сгущают в вакууме, подают в хлористый метилен и воду и затем подкисляют. Водную фазу экстрагируют, суша т и объединенные органические экстракты сгущают. Последующей хроматографией остатка на силикагеле с применением в качестве элюента метиленхлорида и метанола в соотношении 97 : 3 получают 0,1г (18% теории) приведенного соединения в виде бесцветного масла. Пример 13. 1,3-Дипропил-8-(норборнан-2-ил)ксантин. 1,0г (3,1ммоль) (1,3-дипропил-8-(5-норборнен-2-ил)ксантана в среде 30мл этанола подвергают гидрированию под давлением в присутствии палладия на угле до тех пор, пока больше не наблюдается поглощение водорода. Катализатор фильтруют, фильтрат сгущают и остаток хроматографируют на силикагеле с применением в качестве элюента метиленхлорида и метанола в соотношении 99 : 1. Получают 0,4г (39% теории) приведенного соединения в виде белых кристаллов с т.пл. 136 - 138°C. Пример 14. 1,3-Дипропил-8-(2-(2'-этоксикарбонил-2'-карбоксивинил)-фуран-5-ил)ксантин. К раствору 0,8г (1,4ммоль) гидроокиси калия в 20мл этанола добавляют 3,2г (6,8ммоль) 1,3-дипропил-8-[2(2',2'-бис(этоксикарбонил)винилфуран-5-ил]ксантина и смесь кипятят с обратным холодильником в течение 4ч. После охлаждения разбавляют 50мл воды и экстрагируют хлористым метиленом Водную фазу подкисляют при охлаждении льдом, получаемый осадок фильтруют и промывают водой. Получают 2,2г (73% теории) приведенного соединения в виде желтых кристаллов с т.пл. 252 - 253°C. Пример 15. 1,3-Дипропил-8-(1-(2-оксиэтил)-циклопент-3-ил)ксантин. 1,7ммоль 1,3-дипропил-8-(1-метоксикарбонилметилциклопент-3-ил)ксантина растворяют в 5мл тетрагидрофурана и добавляют каплями к суспензии 0,04 (1,1ммоль) аланата лития в 5мл тетрагидрофурана. Смесь перемешивают в течение 35ч при комнатной температуре и смешивают с насыщенным раствором тартрата диаммония. Водную фазу экстрагируют этилацетатом, объединенные органические экстракты сушат и сгущают в вакууме. Продукт очищают кристаллизацией из смеси хлористого метилена и метанола. Получают 1,3-дипропил-8-(1-(2-оксиэтил)-циклопент-3-ил)ксантин с т.пл. 164 - 165°C. Выход: 80% теории. Пример 16. (+)1,3-Дипропил-8-(З-оксициклопентил)ксантин. а) 2,0г (6,2ммоль) рацемического 1,3-дипропил-8-(3-оксициклопентил)ксантина суспендируют в 2л абсолютного толуола и при интенсивном перемешивании смешивают с 640мг ацетангидрида и 2,0г липазы из Candida cyllndracea. По истечении 6ч при комнатной температуре энзим фильтруют и промывают метанолом. Объединенные фильтраты сгущают досуха в вакууме и остаток хромотографируют на силикагеле с применением в качестве элюента метиленхлорида и метанола в соотношении 95 : 5. б) 0,6г ацетилированного продукта растворяют в 22мл абсолютного тетрагидрофурана и после добавление 70мг алюмогидрида лития перемешивают в течение 2ч при комнатной температуре. При охлаждении льдом гидролизуют водой, подаваемой каплями в количестве 5мл, подкисляют и экстрагируют метиленхлоридом. Органическую фазу сушат и сгущают, остаток хроматографируют на силикагеле с применением в качестве элюента метиленхлорида и метанола в соотношении 95 : 5. Получают 490мг спирта с показателем вращения [a]D20 = 12° (c = 0,4 метанол). в) Оптически обогащенный спирт растворяют в 490мл абсолютного хлористого метилена и смешивают с 490мг ацетангидрида и 1,5г липазы "Amano P". Смесь перемешивают в течение 24ч при комнатной температуре, энзим удаляют фильтрацией и фильтрат сгущают досуха в вакууме. В результате хроматографии на силикагеле с применением в качестве элюента метиленхлорида и метанола в соотношении 95 : 5 получают 480мг приведенного соединения с показателем вращения [a]D20 = 12° (c = 0,5 метанол), согласно с данными высокопроизводительной жидкостной хроматографии оптическая чистота составляет >99%. Пример 17. (-)-1,3-Дипропил-8-(3-оксоциклопентил)ксантин. а) 1,0г рацемического 1,3-дипропил-8-(3-оксициклопентил)ксантина суспендируют в 1л абсолютного толуола и вместе с 320г ацетангидрида и 1,0г липазы из Candida cylindracea перемешивают в течение 8ч при комнатной температуре. Затем энзим удаляют фильтрацией, фильтрат промывают метанолом и сгущают досуха в вакууме. Остаток хроматографируют на силикагеле с применением в качестве элюента метиленхлорида и метанола в соотношении 95 : 5. Получают 0,45г кристаллического остатка, который смешивают с простым диэтиловым эфиром и отсасывают. При этом получают 350мг кристаллов с показателем вращения [a]D20 = -13,7° (c = 0,4, метанол). б) Оптически обогащенный спирт в среде толуола опять перемешивают вместе с 110мг ацетангидрида и 350мг лигазы из Candida cylindracea в течение 16ч при комнатной температуре. Смесь перерабатывают описанным выше образом. Получают 200мг бесцветных кристаллов с показателем вращения [a]D20 = 020,2° (c = 0,5, метанол). Согласно данным высокопроизводительной жидкостной хроматографии энантиомер имеет чистоту >99%. Пример 18. (+) и (-) 1,3-Дипропил-8-(3-оксоциклопентил)ксантин. 1,0г оптически чистого спирта 1,3-дипропил-8-(3-оксициклопентил)ксантина растворяют в 30мл абсолютного хлористого метилена и после добавления 1,1г хлорхромата пиридиния перемешивают в течение 2,5ч при комнатной температуре. Смесь промывают два раза водой, водную фазу экстрагируют хлористым метиленом и объединенные органические фазы сушат и упаривают в вакууме. Очистку осуществляют хроматографией на силикагеле с применением в качестве элюента метиленхлорида и метанола в соотношении 99 : 1, 98 : 2 и 97 : 3, соответственно. В зависимости от используемого оптически чистого спирта получают следующие соединения. Из (+)спирта получают (-)1,3-дипропил-8-(3-оксоциклопентил)ксантин (пример 18а) [a]D20 = -8,3° (c = 0,5, метанол). Из (-)спирта получают (+)1,3-дипропил-8-(3-оксоциклопентил]ксантил (пример 18б). [а]D20 = +8,0° (c = 0,5, метанол). Согласно принятой номенклатуре это соединение имеет следующее название: 8-(3-оксоциклопентил)1,3-дипропил-7Н-пурин-2,6-дион. Аналогично приведенным примерам можно получать приведенные в табл.1 соединения формулы I. В табл.1 использованы следующие условные сокращения: Me - метил; Et - этил; Ks - камфановая кислота. Фармакологические данные. Кора головного мозга резуса гемогенизировалась в 10-кратном объеме ледяной сахарозы (0,32моль/л) в 50ммоль/л буфера трис-HCl (pH 7,4), после чего смесь центфифугировалась при 4°C и 3000об/мин, в течение 10мин. Надосадочная жидкость снова центрифугировалась при 20000об/мин в течение 15мин и остаток повторно суспендировался в 50ммоль/л буфера трис-HCl, содержащего 10ммоль/л хлористого магния. Полученная суспензия центрифугировалась и два раза гомогенизировалась перед использованием мембранной суспензии в опыте по определению концентрации активного вещества, требуемой для связывания с рецептором аденозима (значение K1). Инкубация проводилась при 25°C в течение 60мин. В качестве радиолиганда использовалось 0,5нмоль/л [3H]-1,3-дипропил-8-циклопентиладенозина. Кроме того, инкубируемая смесь содержала еще 1мкг/мл диаминазы аденозина (для удаления остаточного аденозина), 10ммоль/л хлористого магния и 200мкл продукта гомогенизации мембраны. Для определения неспецифичного связывания использовалось 10-5моль/л (-)-N6фенилизопропиладенозина. После инкубации смесь фильтровалась. Определение значения K1 осуществлялось с помощью компьютерной программы. Исследуемые соединения и результаты опыта приведены в табл.2. В качестве сравнения использовался широко известный антагонист аденозина теофиллин. Сравнение данных табл.2 свидетельствует о лучшей активности новых соединений по сравнению с известным. Соединения формулы I относятся к категории малотоксичных веществ.
ДивитисяДодаткова інформація
Автори англійськоюKufner-Muhl Ulrike, Weber Karl-Heinz, Walter Gerhard, Stranski Werner, Eisinger Helmut, Schingnitz Gunter, Kun Franz-Joseph, LEHR ERICH
Автори російськоюКюфнер-Мюль Ульрике, Вебер Карл-Гейнц, Вальтер Герхард, Странски Вернер, Эйзингер Гельмут, Шингнитц Гюнтер, Кун Франц-Йозеф, Лер Эрих
МПК / Мітки
МПК: A61K 31/52, C07D 473/08, A61P 25/00, C07D 473/06, C07D 519/00, A61P 9/00, A61K 31/522, A61P 25/02
Мітки: ізомерів, похідні, аденозину, мають, властивість, ксантину, суміші, антагоніста, вигляді, індивідуальних
Код посилання
<a href="https://ua.patents.su/13-26427-pokhidni-ksantinu-u-viglyadi-sumishi-izomeriv-abo-individualnikh-izomeriv-shho-mayut-vlastivist-antagonista-adenozinu.html" target="_blank" rel="follow" title="База патентів України">Похідні ксантину у вигляді суміші ізомерів або індивідуальних ізомерів, що мають властивість антагоніста аденозину</a>
Попередній патент: Спосіб очищення амідів, які отримують із оксимів при перегрупуванні бекмана
Наступний патент: Приманка для орального введення лікарського засобу тваринам та спосіб її виготовлення
Випадковий патент: Спосіб одержання афінних сорбентів для очищення лектинів