Каталізатор парової конверсії монооксиду вуглецю, спосіб його одержання та спосіб його використання
Номер патенту: 92263
Опубліковано: 11.10.2010
Автори: Мінюкова Татьяна Пєтровна, Юрьєва Тамара Міхайловна, Дємєшкіна Маргаріта Пєтровна, Рєзнічєнко Іріна Дмітрієвна, Бочаров Алєксандр Пєтровіч, Андрєєва Татьяна Івановна, Плясова Людміла Міхайловна, Баронская Наталья Алєксєєвна, Лєбєдєва Маріна Валєрьєвна, Волчатов Лєонід Гєннадьєвіч, Хасін Алєксандр Алєксандровіч, Посохова Ольга Міхайловна, Целютіна Маріна Івановна
Формула / Реферат
1. Каталізатор парової конверсії монооксиду вуглецю, що містить залізо і хром, який відрізняється тим, що він містить в своєму складі фазу гідроксосполуки заліза і хрому із структурою типу гетиту та/або гідрогематиту.
2. Каталізатор за п. 1, який відрізняється тим, що атомарне співвідношення вмісту заліза до вмісту хрому в ньому складає більше 1.
3. Каталізатор за п. 1, який відрізняється тим, що він додатково містить більше 1,0 мас. % міді.
4. Спосіб одержання каталізатора парової конверсії монооксиду вуглецю, який містить залізо і хром з використанням металічного заліза, який відрізняється тим, що спосіб включає наступну послідовність стадій: змішування металічного заліза або композиції, яка містить металічне залізо із сполуками хрому 6+ або його водним розчином і водним розчином азотної кислоти з початковою концентрацією 6-46 мас.% при температурі нижче від 40 °С, барботаж одержаної суміші повітрям за температури 40-60 °С, змішування одержаного розчину і водного розчину карбонату і/або гідроксиду амонію, і/або калію, і/або натрію, відмивання осаду від вихідного розчину водою, фільтрація осаду та його просушування.
5. Спосіб за п. 4, який відрізняється тим, що до суміші сполук заліза, хрому і азотної кислоти додатково вводять сполуки Сu2+ або його водного розчину.
6. Спосіб за п. 4, який відрізняється тим, що як композицію, яка містить металічне залізо, використовують чавун або сталь.
7. Спосіб за п. 4 або 5, який відрізняється тим, що додатково проводять стадії прожарювання каталізатора при температурі 150-250 °С в струмені повітря та/або 150-450 °С в струмені інертного газу, азоту або суміші їх з парою.
8. Спосіб за п. 7, який відрізняється тим, що додатково проводять стадії змішування осаду з графітом і формування або таблетування.
9. Спосіб парової конверсії монооксиду вуглецю з використанням каталізатора, що містить залізо і хром, який відрізняється тим, що його здійснюють з використанням каталізатора за пп. 1-3.
10. Спосіб парової конверсії монооксиду вуглецю за п. 9, який відрізняється тим, що його здійснюють в діапазоні температур, вищих від 250 °С.
Текст
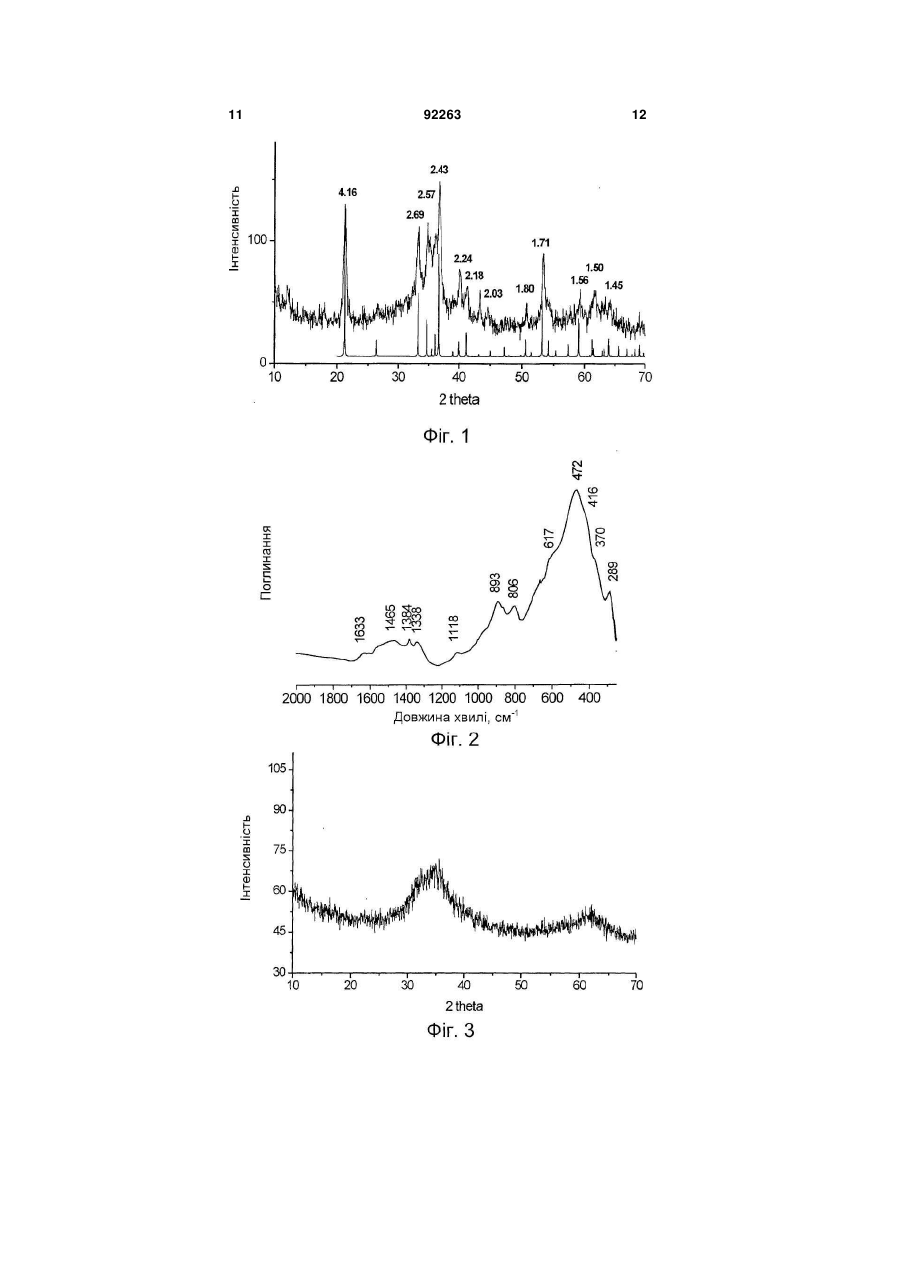
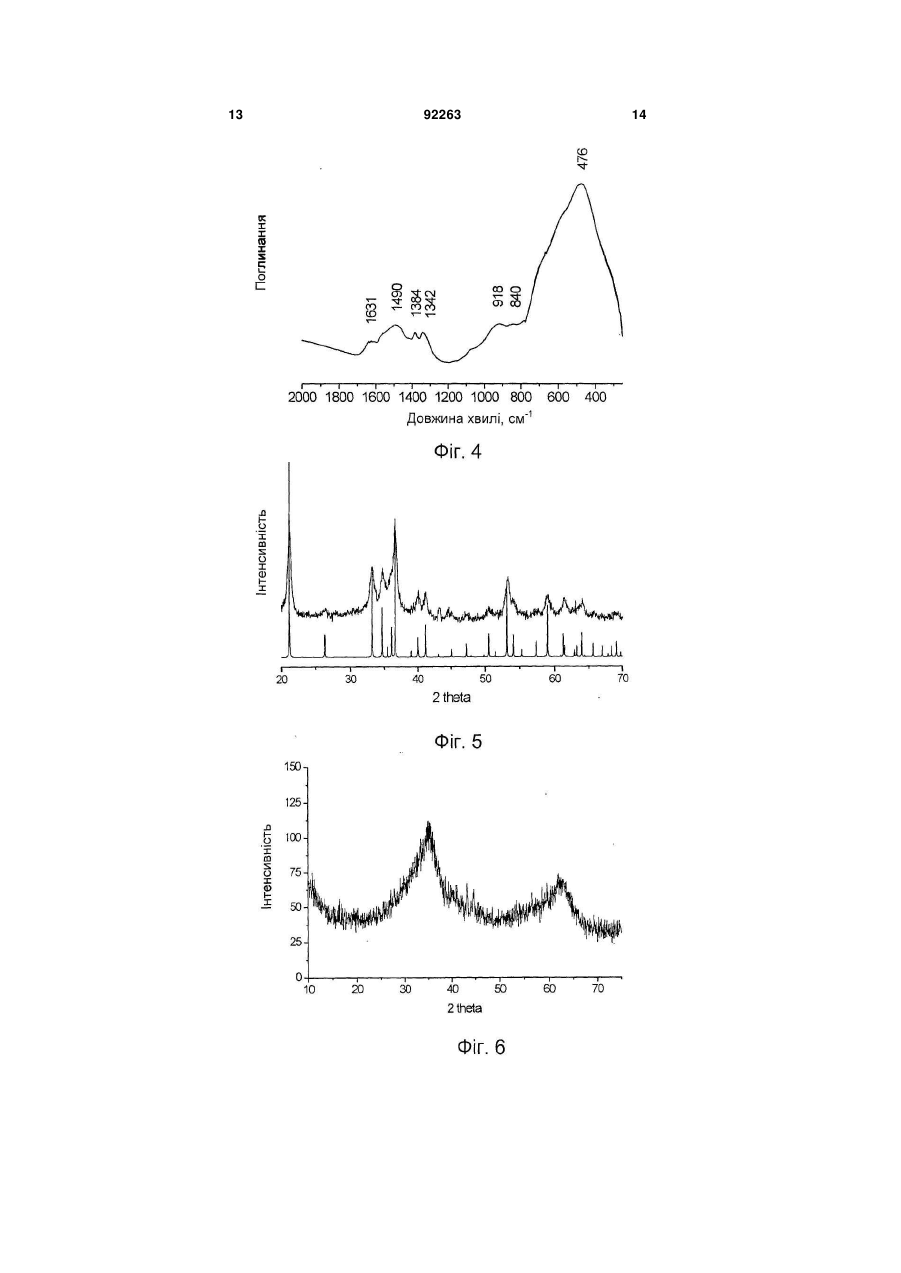
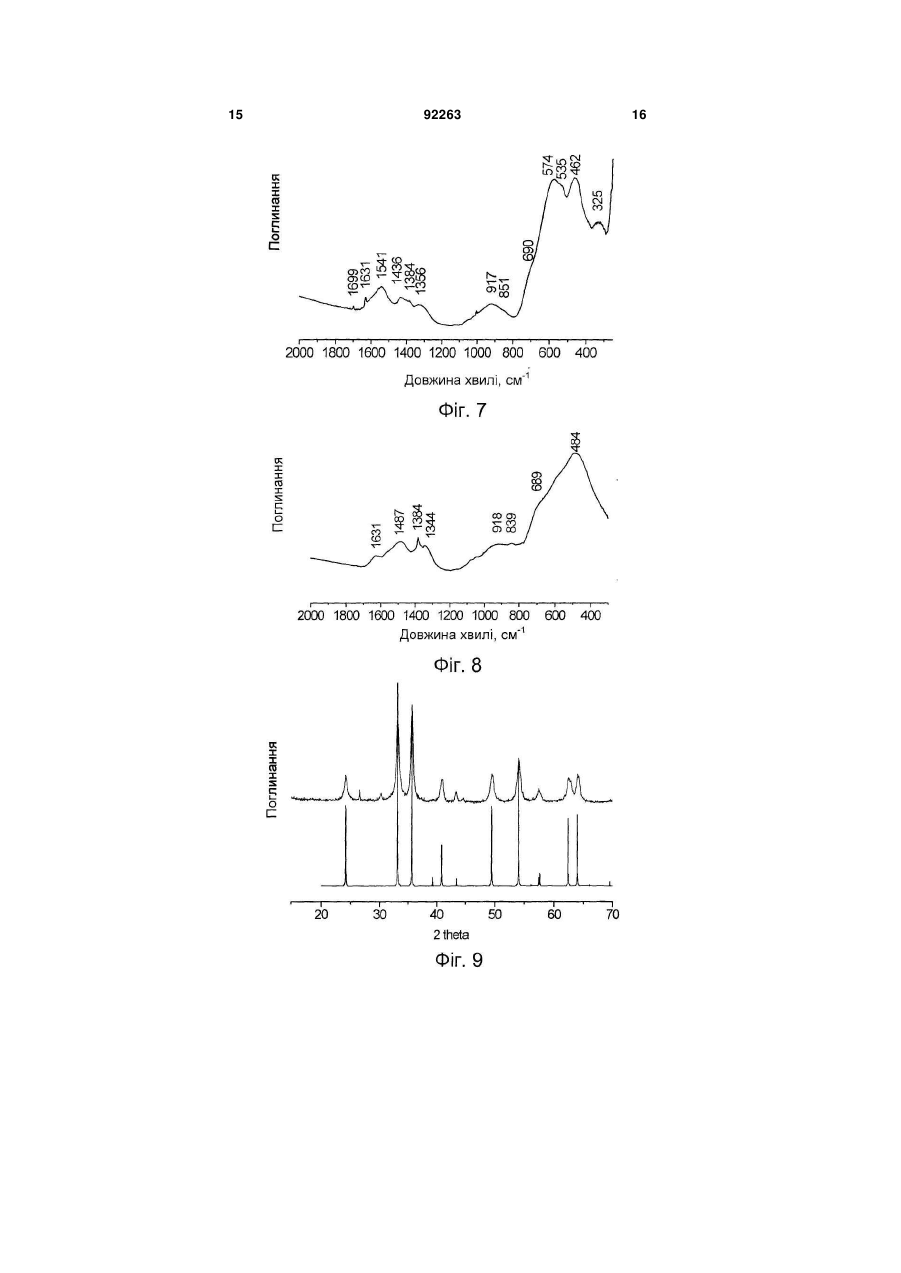
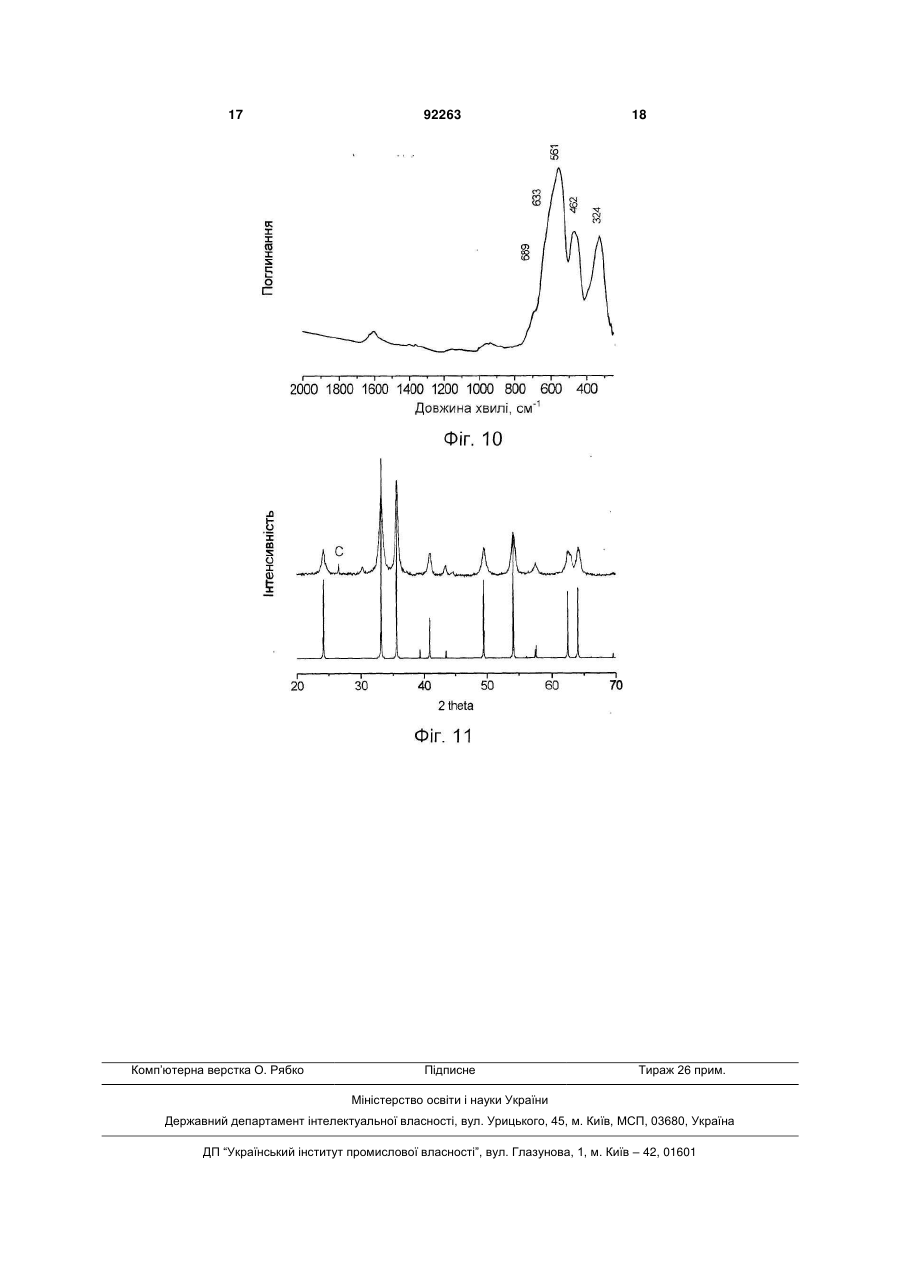
1. Каталізатор парової конверсії монооксиду вуглецю, що містить залізо і хром, який відрізняється тим, що він містить в своєму складі фазу гідроксосполуки заліза і хрому із структурою типу гетиту та/або гідрогематиту. 2. Каталізатор за п. 1, який відрізняється тим, що атомарне співвідношення вмісту заліза до вмісту хрому в ньому складає більше 1. 3. Каталізатор за п. 1, який відрізняється тим, що він додатково містить більше 1,0 мас. % міді. C2 2 (19) 1 3 Реакція парової конверсії монооксиду вуглецю є стадією процесу отримання водню з природного газу. Реакція парової конверсії СО є екзотермічною, глибина перетворення визначається термодинамічною рівновагою, яка однозначно пов'язана з температурою газової суміші на виході з шару каталізатора. Традиційно парова конверсія монооксиду вуглецю здійснюється в дві стадії: в діапазоні температур (1) 350-500°С на залізо-хромовому каталізаторі і (2) 190-300°С на мідно-цинковоалюмінієвому каталізаторі [Каталізатори, що застосовуються в азотній промисловості. Під загальною редакцією А.М. Алексеева. Черкаси. НІІТЕхім. 1979]. Найбільш перспективними каталізаторами на 1 стадії процесу на даний час є каталізатори на основі залізо-хромових і залізо-хром-мідних сполук. Основними вимогами до них є: (1) вміст сірки не більше 0,03мас.%, (2) вміст хрому 6+ не більше 0,05мас.%, (3) активність каталізатора, який забезпечує здійснення процесу за температур на початку шару менших від 350°С, наприклад 320330°С, (4) екологічна безпека технології приготування. (1) Вміст сірки в каталізаторі обмежується у зв'язку з тим, що в умовах реакційного середовища сполуки сірки, які присутні у відомих каталізаторах у вигляді сульфатів, перетворюються на газоподібні H2S і CS2 і отруюють купрумвмісний каталізатор низькотемпературної парової конверсій СО. Для зниження вмісту сірки в реакційному газі перед початком експлуатації рекомендується проводити «віддування» каталізатора від сірки протягом 8-10год. (операція, яка значно знижує економічні показники процесу), проте і в цьому випадку повного видалення сірки не вдається досягнути [Очищення технологічних газів. / Під ред. Т.А. Семенової та І.Л. Лейтеса. М., Хімія, 1977, 488с.]. Безумовно, кращим способом зниження вмісту сірки є використання сировини, яка не містить сірки або яка містить незначну кількість сірки, що знижується в процесі приготування каталізатора (осадження, відмивання каталізаторної маси). (2) Обмеження вмісту в каталізаторі сполук хрому 6+ (не більше 0,05мас.% - сучасна вимога до промислового каталізатора) диктується умовами безпечної роботи при завантаженні і вивантаженні каталізатора в апарат і небезпекою забруднення навколишнього середовища при зберіганні і утилізації відпрацьованого каталізатора. (3) При використанні адіабатичних апаратів, зниження температури на початку шару реактора забезпечує зниження температури газового потоку на виході з реактора і, отже, збільшення глибини перетворення СО, наприклад - до залишкового вмісту СО 2-2,5об.% і менше. (4) Під екологічною безпекою технології приготування слід розуміти мінімальне утворення NО і ΝΟ2 і санітарне поглинання їх, відсутність хрому 6+ і міді 2+ в стоках або їх вміст в межах прийнятих санітарних норм. Відомим є спосіб отримання каталізатора парової конверсії оксиду вуглецю (SU 651838, B01J37/04, 15.03.79), який містить 7,2мас.% Сr2О3, змішуванням оксиду заліза Fе2О3 з хромовою кис 92263 4 лотою, з подальшим формуванням, сушкою і прожарюванням. Відомим є спосіб отримання каталізатора (SU 1790064, B01J37/04 20.05.96), який відрізняється додатковим введенням магнетиту Fe3О4 в кількості 15-100% від маси оксиду заліза. Недоліками цих способів є відносно невисока активність отриманих за їх допомогою каталізаторів. Відомим є спосіб отримання каталізатора (RU 2170615, B01J23/881 20.07.01), який отримується змішуванням оксиду заліза з водним розчином хромової кислоти і сіллю марганцю, з подальшим формуванням гранул, їх просушуванням і прожарюванням. Перед прожарюванням додатково вводять сполуки Мg, або Са, Nd або Рr. До недоліків відноситься висока вартість отриманого каталізатора. Відомим є спосіб отримання залізо-хромового каталізатора (RU 2275963, B01J37/03, 10.05.06) шляхом змішування хромового ангідриду з сполуками заліза, приготованими осаджуванням гідроксосполук заліза розчином аміаку або карбонату натрію з розчинів сульфату заліза з подальшим відмиванням, формуванням і прожарюванням при 280-420°С. Використання сульфату заліза як сировини вимагає великої кількості води і тривалого часу для видалення сірки. До недоліків відноситься також високий вміст хрому 6+ і порівняно низька активність каталізатора у всьому діапазоні температур, особливо за температур нижчих від 350°С (див. прототип, описаний в прикладі 6). Варіанти цього винаходу припускають змішування хромового ангідриду з гідроксосполуками заліза і прожарювання отриманої суміші при 50-200°С перед формуванням каталізатора, що не дозволяє уникнути вищезазначених недоліків, проте додатково призводить до сильної усадки каталізатора в ході його використання. Відомим є також залізо-хромовий каталізатор конверсії оксиду вуглецю водяною парою [RO 100112, B01J23/08, 14.08.1990], отриманий прогріванням на повітрі при 250°С попередника, якого отримують, використовуючи розчини нітратів заліза (III), хрому (III) і відповідний лужний агент (розчин аміаку, гідроксиду натрію). До недоліків каталізатора відноситься його низька активність і підвищений вміст хрому б+. Підвищений вміст Сr6+ є наслідком прожарювання на повітрі. Крім того, використання азотнокислих солей як сировини приводить до високої вартості каталізатора. Поліпшення економічних показників при використанні реагентів, які не містять сірки, досягається шляхом отримання нітратів в рамках технології приготування каталізатора з використанням дешевої сировини наприклад металічного заліза і хромового ангідриду, шляхом отримання нітратів заліза 2+ і 3+ і хрому 3+ окислювально-відновною взаємодією металічного заліза, хромового ангідриду з азотною кислотою. Найбільш близьким до запропонованого винаходу є винахід [BG 62040, B01J23/702, 9.01.1999], в якому описаний метод отримання залізо-хромномідного каталізатора парової конверсії CO з висо 5 ким гідроксильним покриттям поверхні, який працює при 300-360°С. Каталізатор отримують шляхом змішування з розчином аміаку, який продувається СО2, розчинів нітратів заліза (III), хрому (III) і нітрату міді з подальшим сушінням і прожарюванням на повітрі при 350-450°С. Нітрати заліза (III) і Сr (III) отримують розчиненням в 23мас.% азотній кислоті металічного залізного брухту і хромового ангідриду з продуванням повітря при 40-60°С. Недоліками відомого каталізатора є: 1. Неможливість отримання каталізатора із вмістом хрому 6+ не більшим від 0,05мас.% (сучасні вимоги до промислового каталізатора), оскільки каталізатор за винаходом прожарюють на повітрі при 350-450°С. За цих температур в середовищі, яке містить кисень, спостерігається висока швидкість окислення Сr3+ до Сr6+ [Т.В. Роде «Кисневі сполуки хрому», Вид-во АН СРСР, Москва, 1962p.]. 2. Запропоновані умови отримання нітратів заліза і хрому (23мас.% кислота, повітря і температура 40-60°С) забезпечують відсутність виділення оксидів азоту NO і ΝO2 в ході отримання нітратів, але не повноту відновлення Сr6+ до Cr3+. Хром, який не відновився, залишається у фільтраті після виділення каталізаторної маси з суспензії, отриманої при осадженні, і переходить до стоків. Повнота відновлення хрому в патенті не розглядається. 3. Вузький температурний діапазон роботи каталізатора - 300-360°С. Винахід вирішує задачу розробки каталізатора, який проявляє високу активність в реакції парової конверсії в температурному діапазоні 250350°С. Даний винахід пропонує для вирішення поставленого завдання каталізатор парової конверсії монооксиду вуглецю, який містить в своєму складі фазу гідроксосполук заліза 3+ і хрому 3+ із структурою гетиту (FeOOH, Pbnm (2/m 2/m 2/m), ICSD 28247, 6.1.1.2) і/або гідрогематита FeO(1,5-0,5х) (OH)x [E. Wolska, Zeitschr. for Kristallogr. V154, N1/2, 1981, p.69-71]. Атомарне співвідношення вмісту заліза до вмісту хрому в ньому складає більше 1. Каталізатор може додатково містити більше 1,0мас.% міді. Каталізатор, який містить одну з названих вище гідроксидних фаз, проявляє активність в реакції парової конверсії в температурному діапазоні 250-350°С, яка значно перевищує відомі аналоги, що містять кращу з поміж фаз із структурою гематиту а-Fe2O3 або магнетиту Fe3O4, як це ілюструють приклади, які приводяться нижче. Даний винахід пропонує також спосіб отримання каталізатора з використанням як сировини металічного заліза або композиції, яка містить металічне залізо, сполуки хрому 6+ або його водного розчину, сполуки міді 2+ або його водного розчину і водного розчину азотної кислоти. Запропонований спосіб отримання каталізатора конверсії монооксиду вуглецю, який містить залізо і хром, передбачає наступну послідовність дій: змішування металічного заліза або композиції, яка містить металічне залізо, із сполуками хрому 6+ або його водним розчином і водним розчином 92263 6 азотної кислоти з початковою концентрацією 6,046мас.% за температури нижчої від 40°С; барботаж отриманої суміші повітрям за температури 4060°С, змішування отриманого розчину і водного розчину карбонату та/або гідроксиду амонію, та/або калію, та/або натрію, відмивання осаду від вихідного розчину водою, фільтрація осаду і його просушування. Спосіб дозволяє отримувати гідроксосполуки з вказаними вище структурами. Як композицію, яка містить металічне залізо, використовують чавун або сталь. До суміші сполук заліза, хрому і азотної кислоти додатково вводять сполуки Сu2+ або його водного розчину. Можна додатково проводити стадії змішування осаду з графітом і формування або таблетування, а також стадії прожарювання каталізатора за температури 150-250°С в струмені повітря та/або 150450°С в струмені інертного газу, азоту або суміші їх з парою. Конкретна структура отриманих сполук визначається параметрами приготування, такими як температура змішування сировини, рН вихідного розчину та іншими. Як композицію металічного заліза можна використовувати продукцію металургійних виробництв, а також залізний брухт або відходи машинобудівних виробництв, проте більш бажаним є використання сірого чавуну. Сірий чавун має низький вміст сірки (реально можливе досягнення вмісту 0,02мас.%) і фосфору. Вуглець і кремній, які містяться в чавуні, не погіршують показників каталізатора, але можуть покращувати його здатність формуватись. Марганець, який міститься в чавуні, може позитивно впливати на каталітичні властивості (так використання марганцю як промотуючої добавки пропонується в патентах RU 2170615, B01J37/04. 20.07.01 і RU 2275963, B01J37/03, 10.05.06). Даний винахід пропонує також спосіб здійснення процесу парової конверсії CO з використанням вказаних вище каталізаторів в діапазоні температур вищих від 250°С. Достоїнствами запропонованого каталізатора є: широка область робочих температур з високою активністю в діапазоні 250-350°С, вміст сірки не більший від 0,03мас.%; вміст хрому (VI) не більший від 0,05мас.%. Перевагами запропонованого способу приготування каталізатора є: відсутність виділення NО і NO2; відсутність хрому (VI) в стоках; швидке відмивання, хороша фільтрованість осаду. Перевагами способу здійснення процесу парової конверсії монооксиду вуглецю є можливість здійснення процесу в широкому інтервалі температур. Зокрема за температури в початковому шарі каталізатора нижчої, ніж для традиційного каталізатора. Можливість отримання гідроксосполук із структурами гетиту і гідрогематиту, а також можливість та ефективність їх використання в процесі парової конверсії СО ілюструється прикладами. Визначення структури гідроксосполук та їх відмінність від гідроксосполук із структурою лепідокрокиту ( -FeOOH, Amam (2/m 2/m 2/m), ICSD 27846, Дана клас. 6.1.2.2.), а також оксидів заліза із структурами гематиту (Fe2O3, R 3с (3 2/m), ICSD 7 64599, Дана клас. 4.3.1.2) і магнетиту (Fe3O4, F d3m (4/m 3 2/m), Дана клас. 7.2.2.3) може бути однозначно проведене за даними рентгенівської дифракції та ІЧ-спектроскопії, як ілюструється прикладами. Приклад 1 Каталізатор складу Fe0,9Cr0,1 із структурою гетиту У реакторі, оснащеному лопатевою мішалкою та інжектором газового потоку, змішують 9,26г крихти чавуну із вмістом заліза 0,94мас. часток, 1,62г хромового ангідриду СгО3, 157г води, 84,7г 4 6мас.% водного розчину азотної кислоти і перемішують при 35°С протягом 1,5год., потім включають барботаж суміші повітрям, підвищують температуру до 45°С і інтенсивно перемішують протягом 30хв. Отриманий розчин азотнокислих солей змішують з 10% розчином карбонату натрію, шляхом подачі розчинів солей і осаджувача двома потоками при безперервному перемішуванні в розчин буфера. В ході осадження підтримують постійними рН (8,0-8,5) і температуру (68-70°С). Осад промивають декантацією. Каталізаторну масу сушать при 90°С і прожарюють в струмі суміші азоту і пари протягом 1год. при 250°С. Дифрактограма отриманого каталізатора представлена на Фіг.1. Дифрактограму отримують на дифрактометрі D-500 (фірма Siemens) в Сu-К випромінюванні з графітовим монохроматором на відбитому пучку при напрузі 35kV і силі струму 35мА. Реєстрацію дифракційної картини проводять сцинтиляційним лічильником методом сканування з кроком 0,05 градусів 2 і часом накопичення 5сек в кожній точці в інтервалі кутів 2 =1075град. ІЧ-спектр отриманого каталізатора приведений на Фіг.2. ІЧ-спектр отримують в області 2504000см-1 на Фур'є-спектрометрі BomemMB-102. Зразки готують методом пресування в матрицю КВr. На Фіг.1 також приведені дані модельної дифрактограми а-FeOOH (гетиту), розраховані відповідно до ICSD 28247. Дифрактограма і ІЧ-спектр, які при цьому спостерігаються, свідчать, що отриманим каталізатором є сполуки Fe3+O(OH) із структурою гетиту - орторомбічна сингонія, просторова група Pbnm (2/m 2/m 2/m), Дана клас. 6.1.1.2.]. Характеристичні дані про каталітичні властивості отриманого каталізатора представлені в таблиці. Приклад 2 Каталізатор складу Fe0,9Cr0,1 із структурою гідрогематиту Каталізатор готують аналогічно до прикладу 1, проте змішування чавуну, хромового ангідриду і водного розчину азотної кислоти проводять при 15°С протягом 2год., барботаж суміші повітрям проводять при 55°С, а осадження - при рН (7,58,0). Прожарювання сухої каталізаторної маси проводять при 350°С. До отриманої маси додають 1мас.% графіту і таблетують в циліндрові пігулки 5мм×5мм. Дифрактограма отриманого каталізатора до введення до нього графіту представлена на Фіг.3. ІЧ-спектр отриманого каталізатора приведений на Фіг.4. 92263 8 На дифрактограмі каталізатора присутні два широкі рефлекси при d близько 2,7А і 2,5А, які характеризують сполуки як сильно розупорядковану фазу з кубічною структурою. ІЧ-СПЕКТР отриманого каталізатора в області власних коливань близький до гідрогематиту (E.Wolska, Zeitschr. fur Kristallogr. V.154, Ν. 1/2, 1981, p.69-71). У ІЧ-спектрі міститься смуга поглинання в області 920см-1, яка є відміною для гідрогематитів від оксиду -Fе2О3, гематиту. Додатково, в ІЧ-спектрі містяться смуги поглинання в області коливань води (3400см-1 і 1630см-1) і домішкових аніонів СО3 і NO3 в області 1340-1540см-1. Фазовий перехід каталізатора із структурою гідрогематиту в структуру гематиту відбувається екзотермічно тільки в діапазоні температур 560-590°С. Каталізатор, прожарений при 600°С в струмені азоту, має структуру добре відкристалізованого гематиту. Характеристичні дані про каталітичні властивості отриманого каталізатора представлені в таблиці. Приклад 3 Каталізатор складу Fe0,89Cr0,09Cu0,02 із структурою гетиту Каталізатор готують аналогічно до прикладу 1, проте до суміші сполук заліза, хрому і азотної кислоти додатково вводять 0,35г CuO та 2г 15 масі розчину азотної кислоти. Дифрактограма отриманого каталізатора представлена на Фіг.5. На Фіг.5 також приведені дані модельної дифрактограми а-FeOOH (гетиту), розраховані відповідно до ICSD 28247. Дифрактограма, яка при цьому спостерігається свідчить, що отриманим каталізатором є сполуки Fe3+О(OH) із структурою гетиту - орторомбічна сингонію, просторова група Pbnm (2/m 2/m 2/m) , Дана клас. 6.1.1.2.]. Характеристичні дані про каталітичні властивості отриманого каталізатора представлені в таблиці. Приклад 4 Каталізатор складу Fe0,89Cr0,09Cu0,02 із структурою гідрогематита Каталізатор готують аналогічно до прикладу 2, проте в як композицію, яка містить металічне залізо, використовують сталеву тирсу в кількості 8,8г, а до суміші сполук заліза, хрому і азотної кислоти додатково вводять 0,35г CuO і 2г 15мас.% азотної кислоти. Дифрактограма отриманого каталізатора до введення до нього графіту представлена на Фіг.6. ІЧ-спектр отриманого каталізатора приведений на Фіг.7. ІЧ-спектр отриманого каталізатора Fe-Cr-Cu в області власних коливань приблизно відповідає спектру гідрогематиту (E. Wolska, Zeitschr. fur Kristallogr. V.154, Ν. 1/2, 1981, p.69-71). Смуга в області 920 см"1, яка спостерігається в спектрах гідрогематитів і відрізняє їх від гематиту, добре виражена. Додатково, в ІЧ-спектрі містяться смуги -1 поглинання в області коливань води (3400см і -1 1630см ) і домішкових аніонів СО3 і NО3 в області 1340-1540см-1. Характеристичні дані про каталітичні властивості отриманого каталізатора представлені в таблиці. Приклад 5 9 Каталізатор складу Fe0,73Cr0,07Cu0,2 is структурою гідрогематиту Каталізатор готують аналогічно до прикладу 2, проте до суміші сполук заліза, хрому і азотної кислоти додатково вводять 4,2г CuO і 24г 15мас.% азотної кислоти. ІЧ-спектр отриманого каталізатора приведений на Фіг.8. ІЧ-спектр отриманого каталізатора Fe-Cr-Cu в області власних коливань приблизно відповідає спектру гідрогематиту (E. Wolska, Zeitschr. fur Kristallogr. V.154, Ν. 1/2, 1981, p.69-71). Смуга в області 920см-1, яка спостерігається в спектрах гідрогематитів і відрізняє їх від гематиту, добре виражена. Додатково, в ІЧ-спектрі містяться смуги поглинання в області коливань води (3400см-1 і 1630см-1) і домішкових аніонів СО3 і NO3 в області 1340-1540см-1. Характеристичні дані про каталітичні властивості отриманого каталізатора представлені в таблиці. Приклад 6 (для порівняння) Каталізатор складу Fe0,9Cr0,1 із структурою гематиту Каталізатор готують відповідно до патенту RU 2275963, шляхом послідовно проведених операцій (1) осадження сполуки заліза (II) з розчину сульфату заліза (II) змішуванням розчинів карбонату і гідроксиду натрію, (2) промивання осаду декантацією, (3) прожарювання при 250°С, (4) послідовного промивання прожареною масою декантацією і на фільтрі; (5) змішування промитої маси з хромо 92263 10 вим ангідридом, (6) формування в екструдати діаметром 3мм, (7) термообробки за температури 350°С. Дифрактограма отриманого каталізатора представлена на Фіг.9. ІЧ-СПЕКТР отриманого каталізатора приведений на Фіг.10. На Фіг.9 також приведені дані модельної дифрактограми a-Fe2О3 (гематиту), розрахованих відповідно до ICSD 64599. Дані, представлені на Фіг.9 та Фіг.10, свідчать, що отриманий каталізатор має структуру a-Fe2О3 (гематиту). Характеристичні дані про каталітичні властивості отриманого каталізатора представлені в таблиці. Приклад 7 (для порівняння) Каталізатор складу Fe0,89Cr0,09Cu0,02 із структурою гематиту Каталізатор готують відповідно до патенту RU 2275963, аналогічно до прикладу 6, проте осадження ведуть з суміші розчинів сульфату заліза (II) і сульфату міді (II) в пропорціях, які відповідають складу каталізатора; для полегшення формування до каталізатора додають графіт. Дифрактограма отриманого каталізатора представлена на Фіг.11. Дані, представлені на Фіг.11, свідчать, що отриманий каталізатор має структуру a-Fe2О3 (гематиту). Характеристичні дані про каталітичні властивості отриманого каталізатора представлені в таблиці. Таблиця Температура °С Приклад 1 Приклад 2 Приклад 3 Приклад 4 Приклад 5 Приклад 6 (для порівняння) Приклад 7 (для порівняння) Константи швидкості реакції парової конверсії СО на фракції каталізаторів 0,25-0,5мм. Склад сухої газової суміші, об.%: CO - 9,6, СО2 - 7,9, Н2 82,5. Співвідношення пара:газ = 0,8. Активація 300 1,8 2,2 4 14 18 0,2 1,0 Константа швидкості, с-1 330 3,9 5,5 17 24 38 1,0 2,2 450 56 62 73 127 92 21 60 каталізаторів проведена в два етапи: (1) підвищення температури до 200°С в струмені азоту; (2) підвищення температури до 300-320°С в струмені вологої реакційної суміші. 11 92263 12 13 92263 14 15 92263 16 17 Комп’ютерна верстка О. Рябко 92263 Підписне 18 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCatalyst of vapour conversion of carbon monoxide, method for preparation thereof and method for use thereof
Автори англійськоюYurieva Tamara Mikhailovna, Diemieshkina Marharita Pietrovna, Khasin Alieksandr Alieksandrovich, Miniukova Tatiana Pietrovna, Pliasova Liudmila Mikhailovna, Baronskaia Natalia Alieksieievna, Liebiedieva Marina Valierievna, Rieznichienko Irina Dmitriievna, Volchatov Lieonid Hiennadievich, Bocharov Alieksandr Pietrovich, Tseliutina Marina Ivanovna, Posokhova Olha Mikhailovna, Andrieieva Tatiana Ivanovna
Назва патенту російськоюКатализатор паровой конверсии монооксида углерода, способ его получения и способ его использования
Автори російськоюЮрьева Тамара Михайловна, Демешкина Маргарита Патровна, Хасин Александр Александрович, Минюкова Татьяна Петровна, Плясова Людмила Михайловна, Баронская Наталья Алексеевна, Лебедева Марина Валерьевна, Резниченко Ирина Дмитриевна, Волчатов Леонид Геннадьевич, Бочаров Александр Петрович, Целютина Марина Ивановна, Посохова Ольга Михайловна, Андреева Татьяна Ивановна
МПК / Мітки
МПК: B01J 23/86, C01B 3/16, B01J 37/04
Мітки: спосіб, одержання, конверсії, парової, вуглецю, каталізатор, використання, монооксиду
Код посилання
<a href="https://ua.patents.su/9-92263-katalizator-parovo-konversi-monooksidu-vuglecyu-sposib-jjogo-oderzhannya-ta-sposib-jjogo-vikoristannya.html" target="_blank" rel="follow" title="База патентів України">Каталізатор парової конверсії монооксиду вуглецю, спосіб його одержання та спосіб його використання</a>
Попередній патент: Молотильний пристрій для обмолоту зерна на корені
Наступний патент: Матеріал для електроіскрового легування
Випадковий патент: Пов'язка-застібка