Спосіб одержання ортотитанової кислоти
Номер патенту: 98142
Опубліковано: 25.04.2012
Автори: Миронюк Іван Федорович, Коцюбинський Володимир Олегович, Джура Уляна Ярославівна, Челядин Володимир Любомирович
Формула / Реферат
1. Спосіб одержання ортотитанової кислоти, у якому беруть вихідний прекурсор тетрахлорид титану ТіСl4, проводять рідкофазний гідроліз ТіСl4 із наступним відмиванням одержаного продукту та висушуванням, який відрізняється тим, що процес рідкофазного гідролізу здійснюють шляхом вливання прекурсора у концентровану соляну кислоту із наступним розкисленням загідролізованого продукту порошкоподібним NaHCО3, при цьому змінюють рН середовища із -3,5 до 5-6 без різкого зростання температури в діапазоні приблизно -10-0 °С.
2. Спосіб за п. 1, який відрізняється тим, що осаджений гелевидний продукт відмивають холодною дистильованою водою з температурою менше 15 °С до відсутності у промивних водах NaCl.
Текст
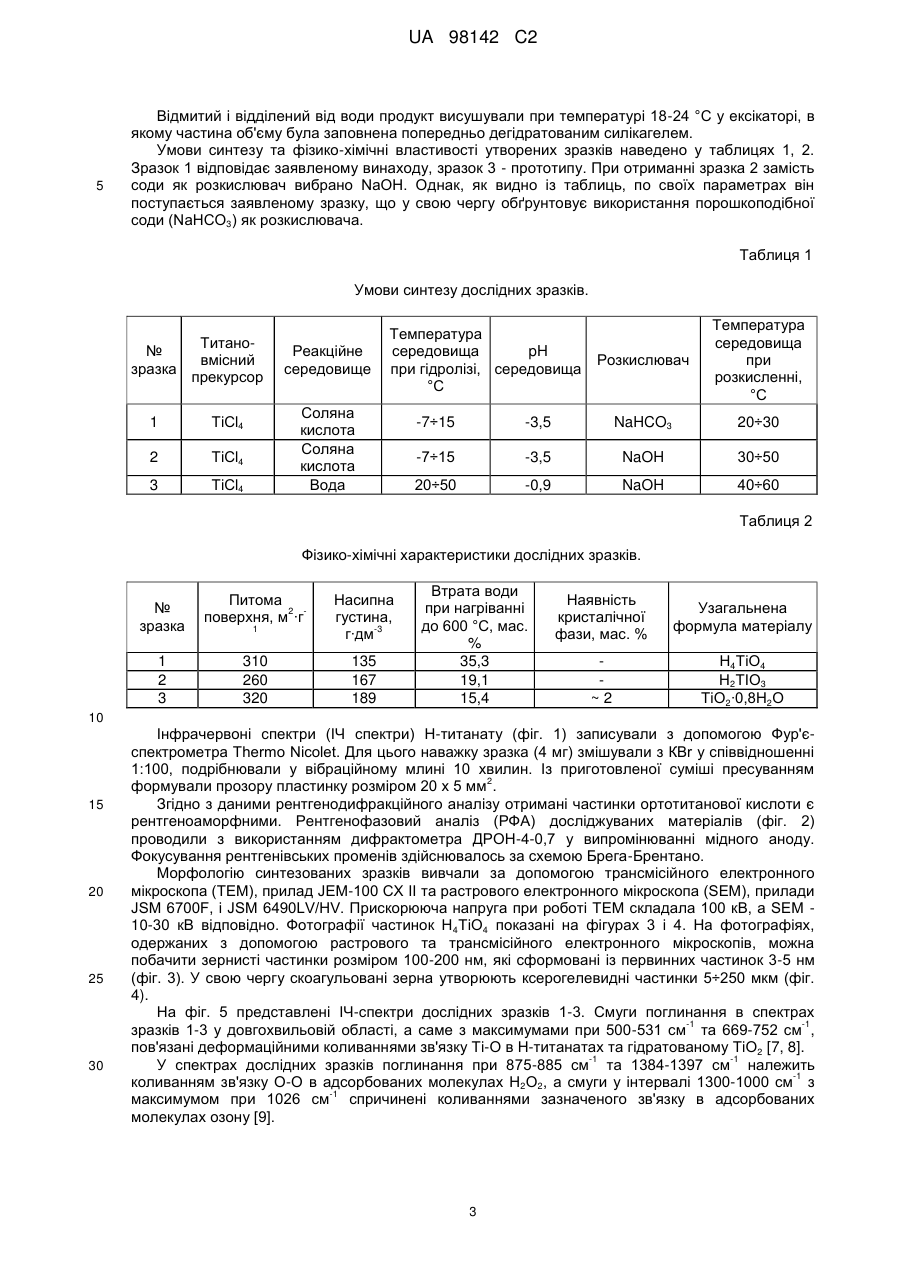
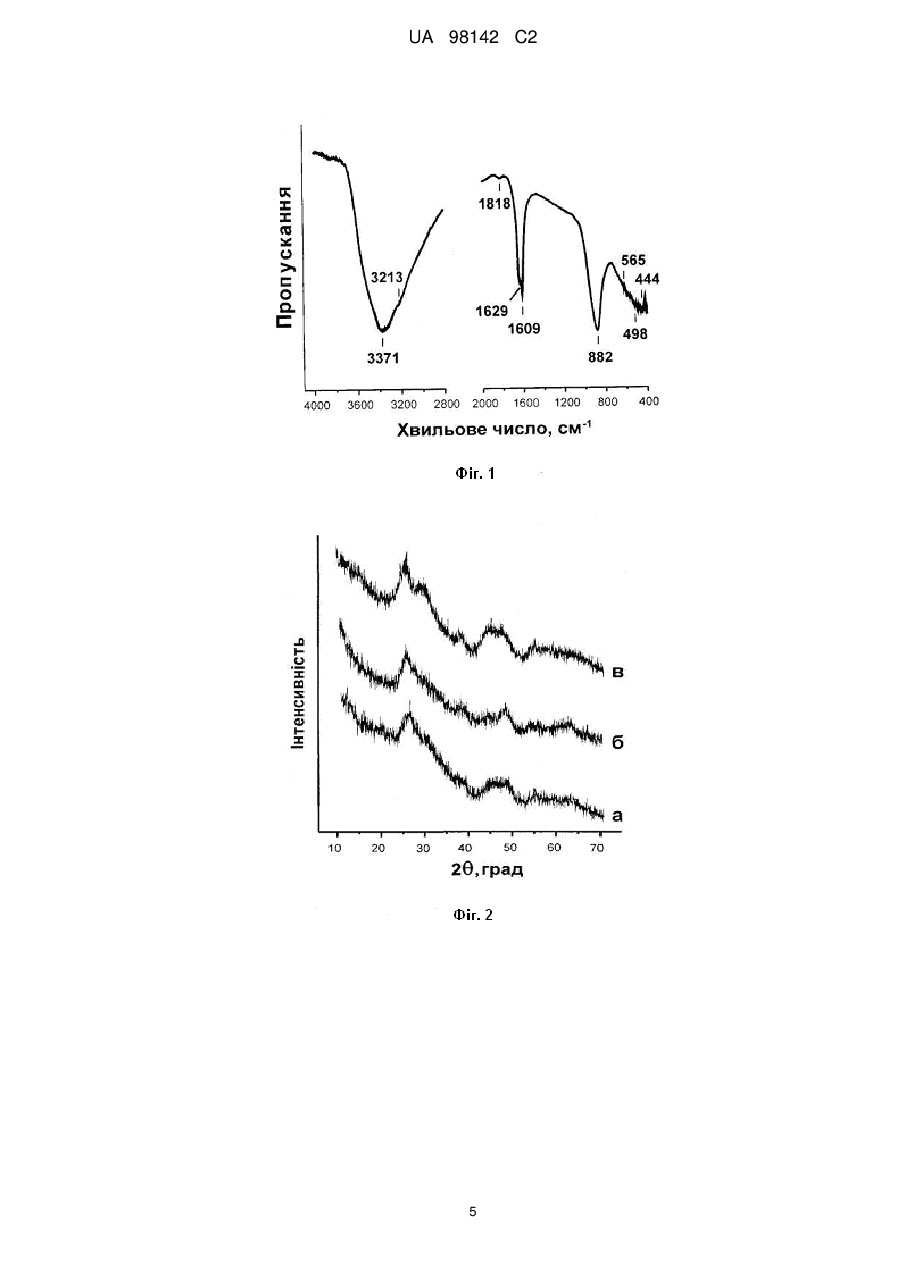
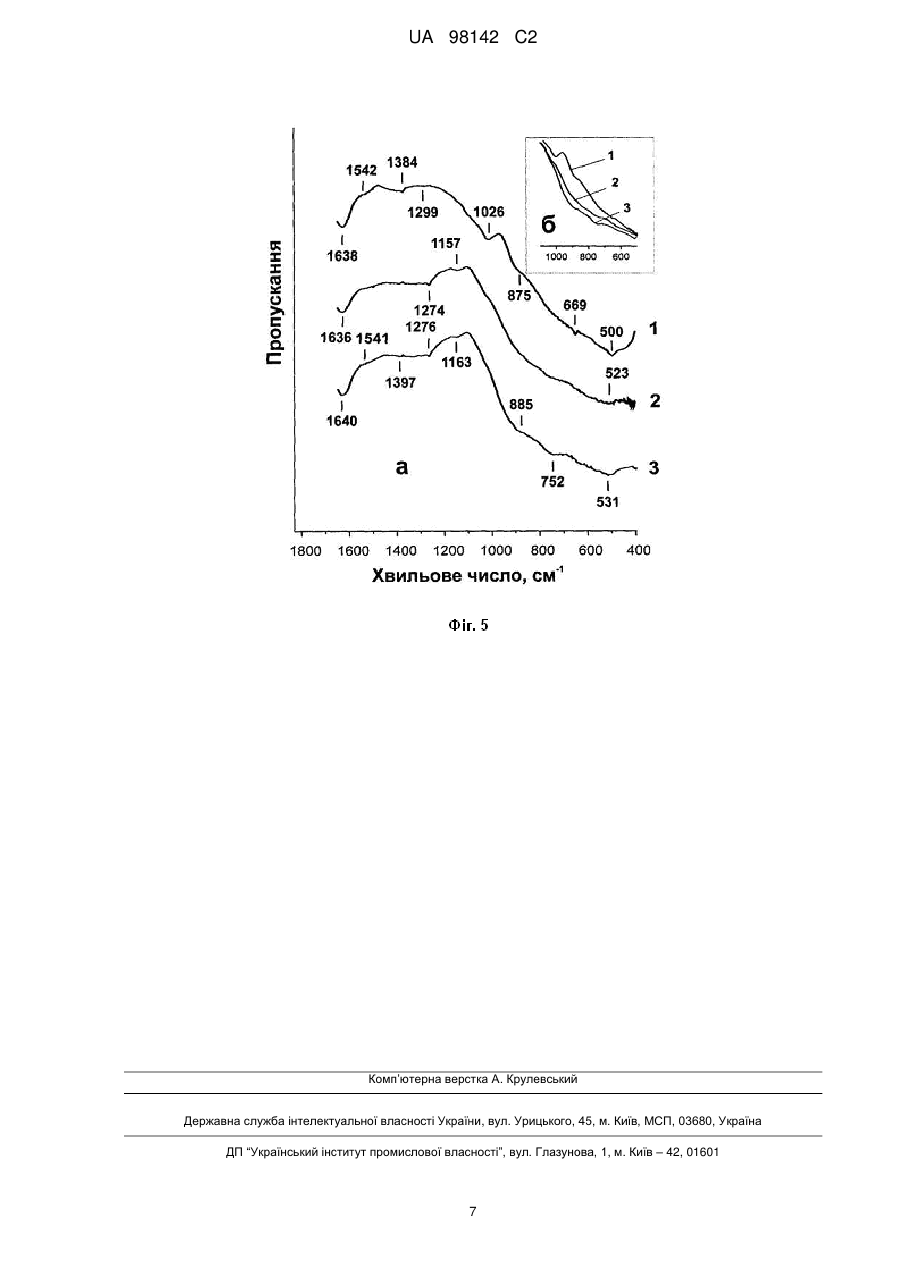
Реферат: Винахід належить до рідкофазного синтезу рентгеноаморфної ортотитанової кислоти Н 4ТіO4 з максимально гідроксильованою поверхнею, в якому як вихідний гідролізуючий реагент для прекурсора тетрахлориду титану ТіСl4 використовують концентровану соляну кислоту, а формування структури ортотитанової кислоти здійснюють розкисленням загідролізованого продукту порошковою NaHCО3. UA 98142 C2 (12) UA 98142 C2 UA 98142 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід належить до хімічної технології і може бути використаний для отримання речовини із великою питомою поверхнею з можливістю подальшого застосування як електродний матеріал електрохімічного джерела струму, селективний каталізатор окислення органічних речовин, адсорбент для вилучення корисних або шкідливих мікрокомпонентів із великого об'єму розчину, тощо. Рентгеноаморфні гідратовані форми діоксиду титану, у порівнянні з кристалічними, а особливо безводними поліморфними модифікаціями: анатазом, рутилом та брукітом, є менш дослідженими щодо їх фізико-хімічних властивостей та функціональних можливостей. За хімічним складом гідратовані форми діоксиду титану є протонованими політитанатними кислотами (скорочена назва Н-титанати). У науковій літературі їх ще називають оксидгідроксидами титану. В залежності від хімічної природи вихідного прекурсора, умов синтезу, можна одержати рентгеноаморфний або кристалічний Н-титанати. Дисперсії рентгеноаморфної ортотитанової кислоти Н4ТіО4 у водному розчині Н2О2 можуть знайти використання в медицині для знезараження гнійних ран, хірургічного інструменту, в технологічних процесах очищення питної води та, наприклад, при хіміко-механічному поліруванні поверхні напівпровідникових монокристалів. Відомий спосіб отримання Н-титанату кристалічної модифікації у вигляді нанотрубок (систем просторово впорядкованої будови) із бездоганною геометричною формою базується на лужній гідротермальній конверсії анатазного або рутильного ТіО 2 [1]. Для заміщення іонів лужного металу в матеріалі на іони водню його витримують у розчині HNO 3 (рН=4) або НСl. Гідротермальний метод дозволяє отримувати кристалічні протоновані політитанатні кислоти із загальною формулою: Н2ТinO2n+1, де n=5; 6; 8. Отримані таким чином нанотрубчасті Н-титанати мають шарувату будову. У стінці нанотрубки може міститися від 2 до 10 атомних шарів. Однак, кристалічні форми Н-титанату через закриту, хоча й велику питому поверхню поступаються рентгеноаморфним матеріалам щодо сорбції неорганічних речовин із водних розчинів [2] і є менш енергетично спроможними у порівнянні з рентгеноаморфними різновидами при їх використанні як електродного матеріалу літієвих джерел електричної енергії [3]. Прототипом до заявленого винаходу є спосіб отримання рентгеноаморфної форми ортотитанової кислоти методом осадження із водних розчинів солей титану Ti(SO 4)2; TiOSO4 або ТіСl4, змішуючи їх із гідроксидом, та гідролізом органічних сполук титану Ti(OR)4, де R - С2Н5, С3Н7, С4Н9, із наступною промивкою та висушуванням [4, 5]. Рентгеноаморфні Н-титанати у порівнянні з їх кристалічними аналогами через високий ступінь гідроксильованості та дисперсність мають значно кращу перспективу щодо їх прикладного застосування. Однак, синтез рентгеноаморфного Н-титанату, запропонований у прототипі, забезпечує одержання переважно метатитанової кислоти Н2ТіО3. Зазначена речовина є оксигідроксидом титану ТіО(ОН)2, у якому сусідні атоми титану з'єднані між собою містком Ті-О-Ті. Також слід візначити, що Н2ТіO3 в порівнянні з Н4ТіО4 швидше піддається старінню з утворенням ТіО2. Задачею винаходу є розробити шляхом рідкофазного синтезу спосіб отримання рентгеноаморфної ортотитанової кислоти Н4ТіО4 з максимально гідроксильованою поверхнею. Для вирішення задачі винаходу, як вихідний гідролізуючий реагент для прекурсора тетрахлориду титану ТіСl4 запропоновано використати концентровану соляну кислоту (36 % водний розчин НСl). Вибір соляної кислоти для гідролізу ТіСl4 пов'язаний з необхідністю уповільнити швидкість конденсаційних процесів утворення Н 4ТіО4 щодо швидкості реакції гідролізу ТіСl4. У процесі солянокислотного гідролізу ТіСl4 відбуваються побічні реакції за участі супероксидного іона О2, які призводять до утворення в реакційному середовищі Н2О2 [6]. Гідроліз ТіСl4 здійснюється гідроксильними групами, які утворюються в результаті гомолітичного розриву зв'язку у молекулах Н2О. • • Н2О → Н + ОН (1) Наступне розкислення загідролізованого продукту Н4ТіО4∙НСl, а особливо ТіСl2(ОН)2, необхідно здійснювати порошковою NaHCO3 (сода). Використання соди дозволяє сформувати структуру ортотитанової кислоти без утворення >Ті-О-Ті Ti OH HO 20 25 30 35 40 45 50 55 Ti < . Хімічна природа гідролізуючого реагента, температура реакційного середовища, спосіб розкислення загідролізованого продукту впливають на ступінь гідроксильованості матеріалу, його питому поверхню та морфологію частинок ортотитанової кислоти. Отже, спільними ознаками із прототипом є: 1. Використання як вихідного прекурсора ТіСl4. 2. Осадження ТіСl4 здійснюють рідкофазним гідролізом. 3. Отриману речовину відмивають дистильованою водою та висушують. У прототипі процес розкислення не передбачений, оскільки осадження із водних розчинів солей титану ТіСl4 відбувається змішуванням їх із гідроксидом та гідролізом органічних сполук титану. Використання ж концентрованої соляної кислоти для рідкофазного гідролізу потребує наступного процесу розкислення загідролізованого продукту. Тому, відмінними ознаками із прототипом є: 1. Здійснення рідкофазного гідролізу відбувається шляхом вливання тетрахлориду титану в концентровану соляну кислоту. -3 2. Загідролізований продукт розбавляли дистильованою водою до густини 167 г∙дм . 3. Формування структури ортотитанової кислоти відбувається через розкислення загідролізованого продукту Н4ТіO4∙НСl і ТіСl2(ОН)2 порошковою NaHCO3 (содою). 4. Розкислення загідролізованого продукту содою здійснюється при від'ємній температурі (~10÷0 °С) від рН з величиною -3,5 до фіксації значення 5÷6. 5. Осаджений гелевидний продукт відмивали холодною дистильованою водою (температура менше 20 °С) до відсутності у промивних водах NaCl. Приклади конкретного виконання. Вихідним прекурсором для одержання дослідних зразків Н-титанатів служив тетрахлорид титану ТіСl4 із вмістом 99,9 мас. % основної речовини (придбаний у фірми Merck). Гідролізуючим реагентом і одночасно реакційним середовищем був водний розчин соляної кислоти із вмістом 36 % НСl. Дослідні зразки Н-титанатів одержували рідкофазним методом шляхом покраплинного введення ТіСl4 у соляну кислоту. 100 мл ТіСl4 суміщали з 50 мл гідролізуючого реагента. Охолодження реакційного середовища під час гідролізу ТіСl4 і розкислення продуктів реакції здійснювали з допомогою водяної бані. Температуру води ~-10÷0 °С у бані підтримували за допомогою льоду та за рахунок ендотермічного ефекту при розчиненні у ній NaCl. -3 Загідролізований продукт розбавляли дистильованою водою до густини 167 г∙дм . Розкислення загідролізованого продукту здійснювали порошковою NaHCO 3 та водним розчином NaOH. Замішування порошкового NaHCO3 у реакційне середовище при одержанні зразка 1 дозволяє підняти рН середовища із -3,5 до 5÷6 без різкого зростання температури. Осаджений гелевидний продукт нейтралізували 40 % водним розчином NaOH до встановлення стабільного протягом 2 годин значення рН = 7,0 і відмивали дистильованою водою до відсутності у промивних водах NaCl. 2 UA 98142 C2 5 Відмитий і відділений від води продукт висушували при температурі 18-24 °С у ексікаторі, в якому частина об'єму була заповнена попередньо дегідратованим силікагелем. Умови синтезу та фізико-хімічні властивості утворених зразків наведено у таблицях 1, 2. Зразок 1 відповідає заявленому винаходу, зразок 3 - прототипу. При отриманні зразка 2 замість соди як розкислювач вибрано NaOH. Однак, як видно із таблиць, по своїх параметрах він поступається заявленому зразку, що у свою чергу обґрунтовує використання порошкоподібної соди (NaHCO3) як розкислювача. Таблиця 1 Умови синтезу дослідних зразків. Титано№ вмісний зразка прекурсор 1 ТіСl4 3 Соляна кислота Соляна кислота Вода ТіСl4 2 Реакційне середовище Температура середовища pH при гідролізі, середовища °С ТіСl4 Розкислювач Температура середовища при розкисленні, °С -7÷15 -3,5 NaHCO3 20÷30 -7÷15 -3,5 NaOH 30÷50 20÷50 -0,9 NaOH 40÷60 Таблиця 2 Фізико-хімічні характеристики дослідних зразків. № зразка 1 2 3 Питома 2 поверхня, м ∙г Насипна густина, -3 г∙дм 310 260 320 135 167 189 1 Втрата води при нагріванні до 600 °С, мас. % 35,3 19,1 15,4 Наявність кристалічної фази, мас. % Узагальнена формула матеріалу ~2 Н4ТіО4 Н2ТІО3 ТіО2∙0,8Н2О 10 15 20 25 30 Інфрачервоні спектри (ІЧ спектри) Н-титанату (фіг. 1) записували з допомогою Фур'єспектрометра Thermo Nicolet. Для цього наважку зразка (4 мг) змішували з КВr у співвідношенні 1:100, подрібнювали у вібраційному млині 10 хвилин. Із приготовленої суміші пресуванням 2 формували прозору пластинку розміром 20 х 5 мм . Згідно з даними рентгенодифракційного аналізу отримані частинки ортотитанової кислоти є рентгеноаморфними. Рентгенофазовий аналіз (РФА) досліджуваних матеріалів (фіг. 2) проводили з використанням дифрактометра ДРОН-4-0,7 у випромінюванні мідного аноду. Фокусування рентгенівських променів здійснювалось за схемою Брега-Брентано. Морфологію синтезованих зразків вивчали за допомогою трансмісійного електронного мікроскопа (ТЕМ), прилад JEM-100 СХ II та растрового електронного мікроскопа (SEM), прилади JSM 6700F, і JSM 6490LV/HV. Прискорююча напруга при роботі ТЕМ складала 100 кВ, a SEM 10-30 кВ відповідно. Фотографії частинок Н4ТіO4 показані на фігурах 3 і 4. На фотографіях, одержаних з допомогою растрового та трансмісійного електронного мікроскопів, можна побачити зернисті частинки розміром 100-200 нм, які сформовані із первинних частинок 3-5 нм (фіг. 3). У свою чергу скоагульовані зерна утворюють ксерогелевидні частинки 5÷250 мкм (фіг. 4). На фіг. 5 представлені ІЧ-спектри дослідних зразків 1-3. Смуги поглинання в спектрах -1 -1 зразків 1-3 у довгохвильовій області, а саме з максимумами при 500-531 см та 669-752 см , пов'язані деформаційними коливаннями зв'язку Ті-О в Н-титанатах та гідратованому ТiO2 [7, 8]. -1 -1 У спектрах дослідних зразків поглинання при 875-885 см та 1384-1397 см належить -1 коливанням зв'язку O-O в адсорбованих молекулах Н2О2, а смуги у інтервалі 1300-1000 см з -1 максимумом при 1026 см спричинені коливаннями зазначеного зв'язку в адсорбованих молекулах озону [9]. 3 UA 98142 C2 -1 5 10 15 20 25 30 35 Смуги із максимумом при 1638-1640 см обумовлені деформаційними коливаннями ОН груп -1 у досліджуваних матеріалах, а смугу при 1541-1542 см ми пов'язуємо з коливаннями ОН груп в молекулах Н2О2. Суміщення ІЧ спектрів дослідних зразків (фіг. 5, 6) ілюструє зсув спектра поглинання в -1 діапазоні 400-1100 см у короткохвильову область. Цей зсув пов'язаний із структурними змінами в матеріалах, а саме зменшенням довжини зв'язку Ті-O в результаті їх дегідратації. Дані експериментальних досліджень підтверджують отримання максимально гідроксильованого матеріалу рентгеноаморфної ортотитанової кислоти Н4ТіО4. Відтворювальна технологія вказує на промислову придатність заявленого способу. Перелік цитованої літератури 1. D.V. Bavykin, J.M. Friedrich, F.C. Walsh. Protonated titanates and TiO 2 nanostructured materials: Synthesis, Properties, and Applications //Adv. Mater., 18, pp. 2807-2824 (2006). 2. Печенюк С.И. Сорбция анионов на оксигидроксидах металов //Сорбционные и хроматографические процессы, 8(3), С. 380-429 (2008). 3. Гальванічний елемент: Патент на корисну модель № 28090 (Україна), Н01М 4/06 /І.Ф. Миронюк, Р.В. Ільницький, В.Л. Челядин. (Україна). - № u200707843; Заявлено 11.07.07; Опубл. 26.11.08, Бюл. № 15. 4. Method for producting orthotitanic acid: Patent 2564365 (USA), CI. 23-140 /Franklin L. Kingbury, Patented Aug. 14, 1951. 5. Горощенко Я.Г. Химия титана. Наук. Думка, К. 416 с. - 1970. 6. Миронюк І.Ф., Челядин В.Л., Коцюбинський В.О., Джура У.Я. Одержання ортотитанової кислоти та дослідження її каталітичних властивостей //ФХТТ, 10(2). С. 347-356 (2009). 7. Юхневич Г.В. Инфракрасная спектроскопия воды. Наука, М. 207 с. (1973). 8. G. Busca, G. Ramis, J.M. Gallardo Amores, V.S. Escribano, P. Piagglo. FT Raman FTIR studies of titanias and metatitanate powders //J. Chem. Soc. Faraday Trans, 90(20), pp. 3181-3190 (1994). 9. Weijun Zheng, David Jewitt, and Ralf I. Kaiser. Formation of Hydrogen, Oxygen, and Hydrogen Peroxide in Electron Irradiated Crystalline Water Ice //The Astrophysical Journal, 639, pp. 534-548 (2006). Перелік фігур креслення Фіг. 1. ІЧ спектр продуктів реакцій у реакційному середовищі. Фіг. 2. Рентгенограми дослідних зразків. Фіг. 3. Зображення частинок Н4ТіО4. Фіг. 4. Зображення частинок Н4ТіО4. Фіг. 5. ІЧ спектри дослідних зразків 1(1), 2(2) та 3(3): а - несуміщені; б - суміщені. ФОРМУЛА ВИНАХОДУ 40 45 1. Спосібодержання ортотитанової кислоти, у якому беруть вихідний прекурсор тетрахлорид титану ТіСl4, проводять рідкофазний гідроліз ТіСl4 із наступним відмиванням одержаного продукту та висушуванням, який відрізняється тим, що процес рідкофазного гідролізу здійснюють шляхом вливання прекурсора у концентровану соляну кислоту із наступним розкисленням загідролізованого продукту порошкоподібним NaHCО3, при цьому змінюють рН середовища із -3,5 до 5-6 без різкого зростання температури в діапазоні приблизно -10-0 °С. 2. Спосіб за п. 1, який відрізняється тим, що осаджений гелевидний продукт відмивають холодною дистильованою водою з температурою менше 15 °С до відсутності у промивних водах NaCl. 4 UA 98142 C2 5 UA 98142 C2 6 UA 98142 C2 Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of ortho-titanic acid
Автори англійськоюMyroniuk Ivan Fedorovych, Cheliadyn Volodymyr Liubomyrovych, Kotsiubynskyi Volodymyr Olehovych, Dzhura Uliana Yaroslavivna
Назва патенту російськоюСпособ получения ортотитановой кислоты
Автори російськоюМиронюк Иван Федорович, Челядин Владимир Любомирович, Коцюбинский Владимир Олегович, Джура Ульяна Ярославовна
МПК / Мітки
МПК: C01G 23/04
Мітки: одержання, спосіб, ортотитанової, кислоти
Код посилання
<a href="https://ua.patents.su/9-98142-sposib-oderzhannya-ortotitanovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання ортотитанової кислоти</a>
Попередній патент: Вузол сталезалізобетонного каркаса
Наступний патент: Спосіб вібраційного різання
Випадковий патент: Спосіб інтенсивного лікування шизофренії з шубоподібним перебігом і суїцидальною поведінкою