Антитіло людини проти тканинного фактора
Номер патенту: 109633
Опубліковано: 25.09.2015
Автори: де Йонґ Роб Н., Аудсхорн Маруска, Блекер Віллем Карел, Брайнхольт Вібеке Міллер, Паррен Пауль, Хауткамп Міса, Хут Рене М. А., Вінк Том, Бадсґард Оле, Сатейн Давід П. Е., Ехрнрот Ева, ван де Вінкел Ян, Верплуґен Сандра
Формула / Реферат
1. Антитіло людини, яке зв'язує тканинний фактор людини, і яке містить VH область, що включає CDR1, 2 і 3 послідовності SEQ ID NO: 10, 11 і 12, і VL область, що включає CDR1, 2 і 3 послідовності SEQ ID NO: 66, 67 і 68.
2. Антитіло за п. 1, яке відрізняється тим, що це антитіло має одну або декілька характеристик:
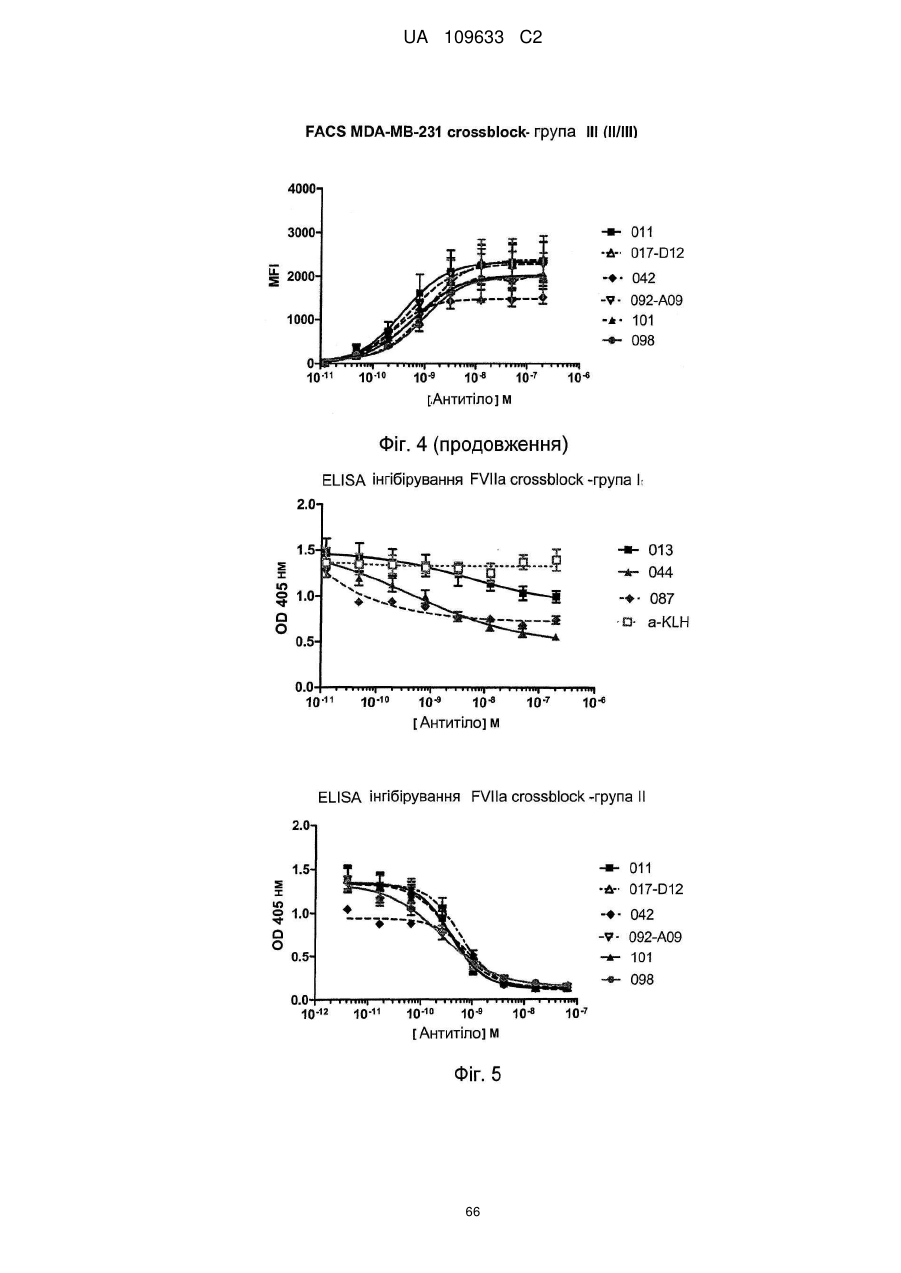
а) зв'язується з позаклітинним доменом тканинного фактора зі сподіваною афінністю (EC50) 3 нМ або менше, такою як 0,50 нМ або менше, наприклад, 0,35 нМ або менше, такою як 0,20 нМ або менше, наприклад, 0,1 нМ або менше, при визначенні методом ELISA,
b) зв'язується із клітинами ссавців, які експресують тканинний фактор, такими як клітини A431, трансфіковані конструкцією, яка кодує тканинний фактор, бажано зі сподіваною афінністю (EC50) 10 нМ або менше, наприклад, 8 нМ або менше, такою як 5 нМ або менше, наприклад, 2 нМ або менше, такою як 1 нМ або менше, наприклад, 0,5 нМ або менше, такою як 0,3 нм або менше, при визначенні FACS-аналізом,
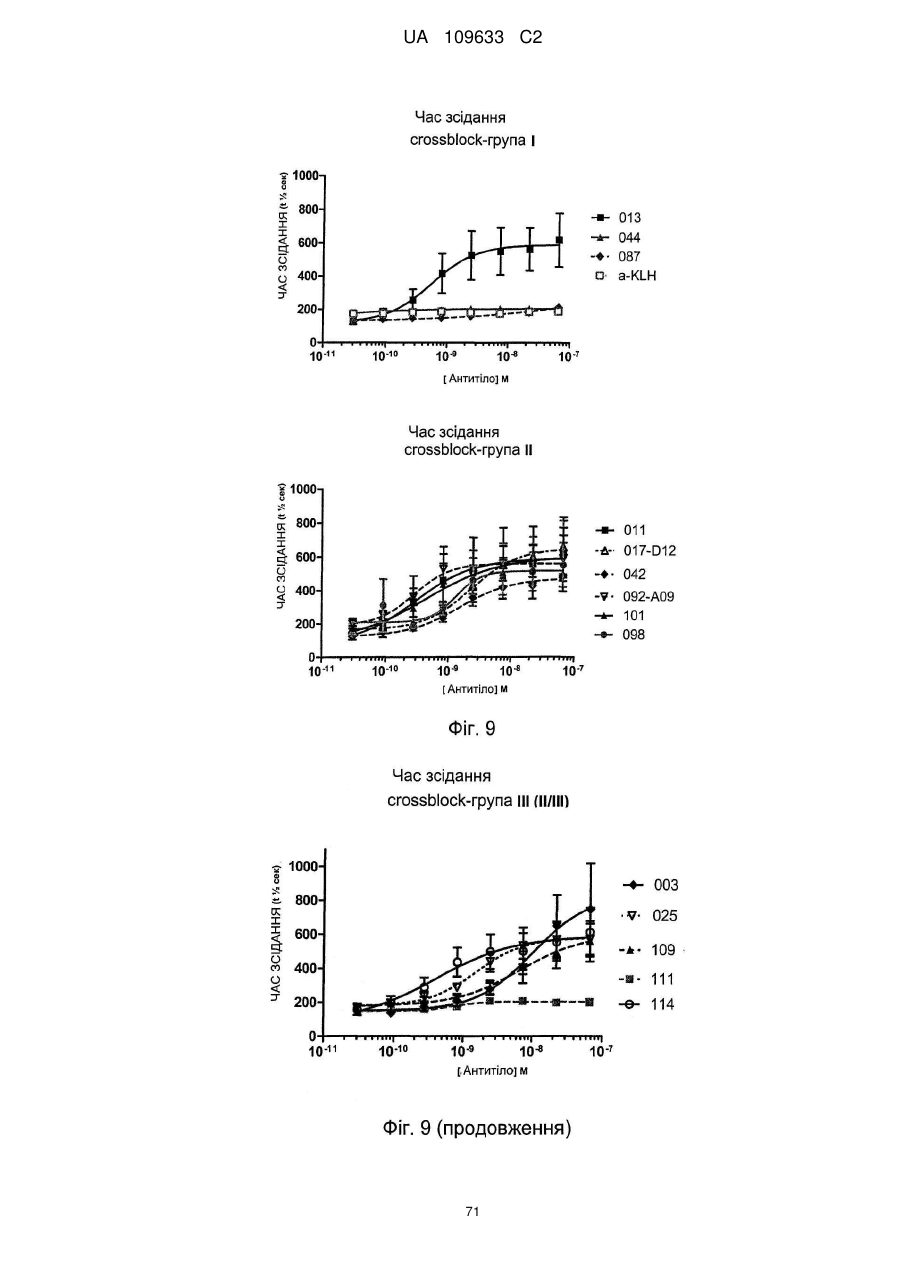
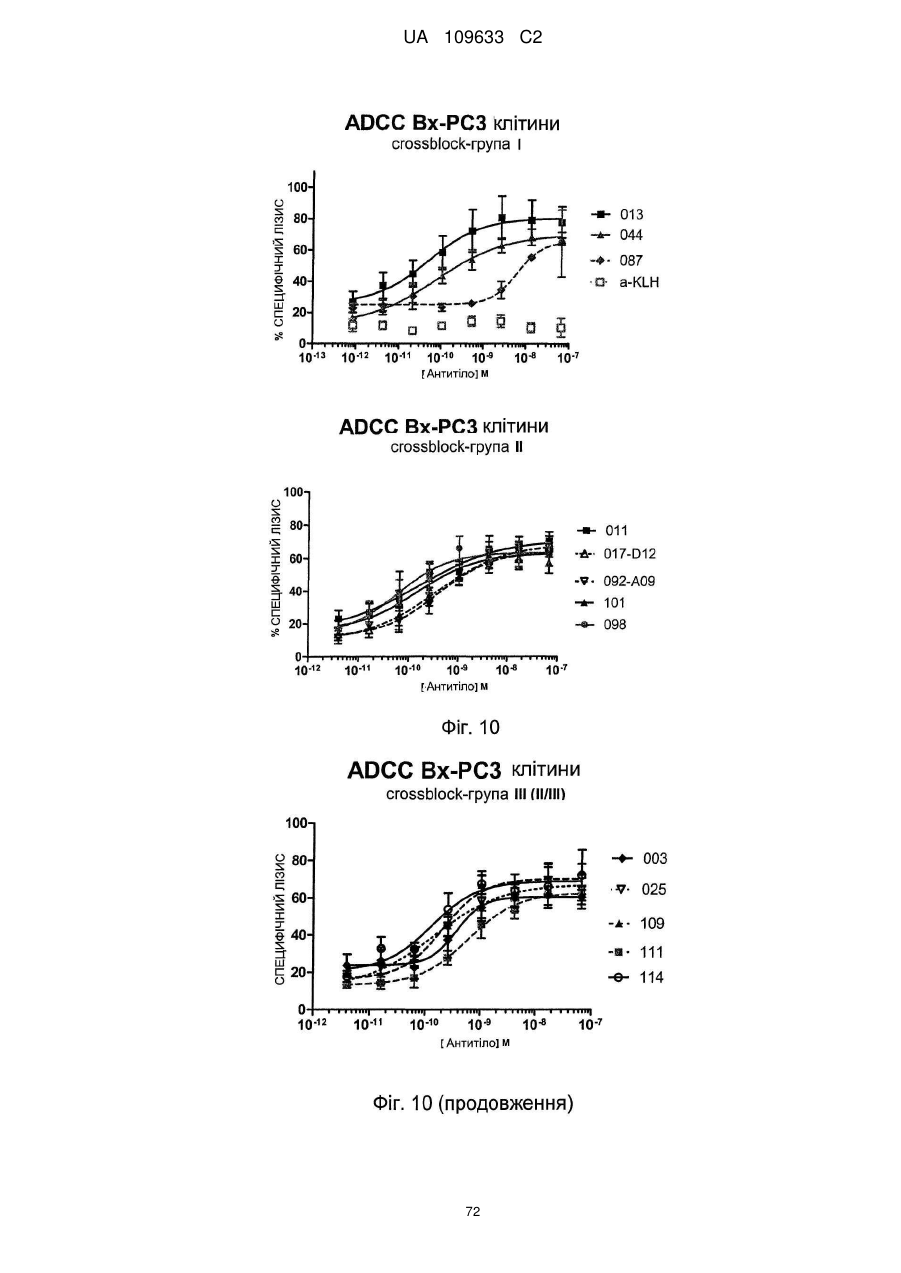
c) антитіло здатне індукувати антитілозалежну клітинну цитотоксичність у клітинах A431, бажано з величиною EC50 2 нМ або менше, наприклад, 1 нМ або менше, такою як 0,7 нМ або менше або 0,3 нМ або менше, такою як 0,2 нМ або менше або 0,1 нМ або менше або 0,05 нМ або менше, при визначенні за допомогою гамма-лічильника по вивільненню 51Cr з мічених 51Cr клітин мішеней
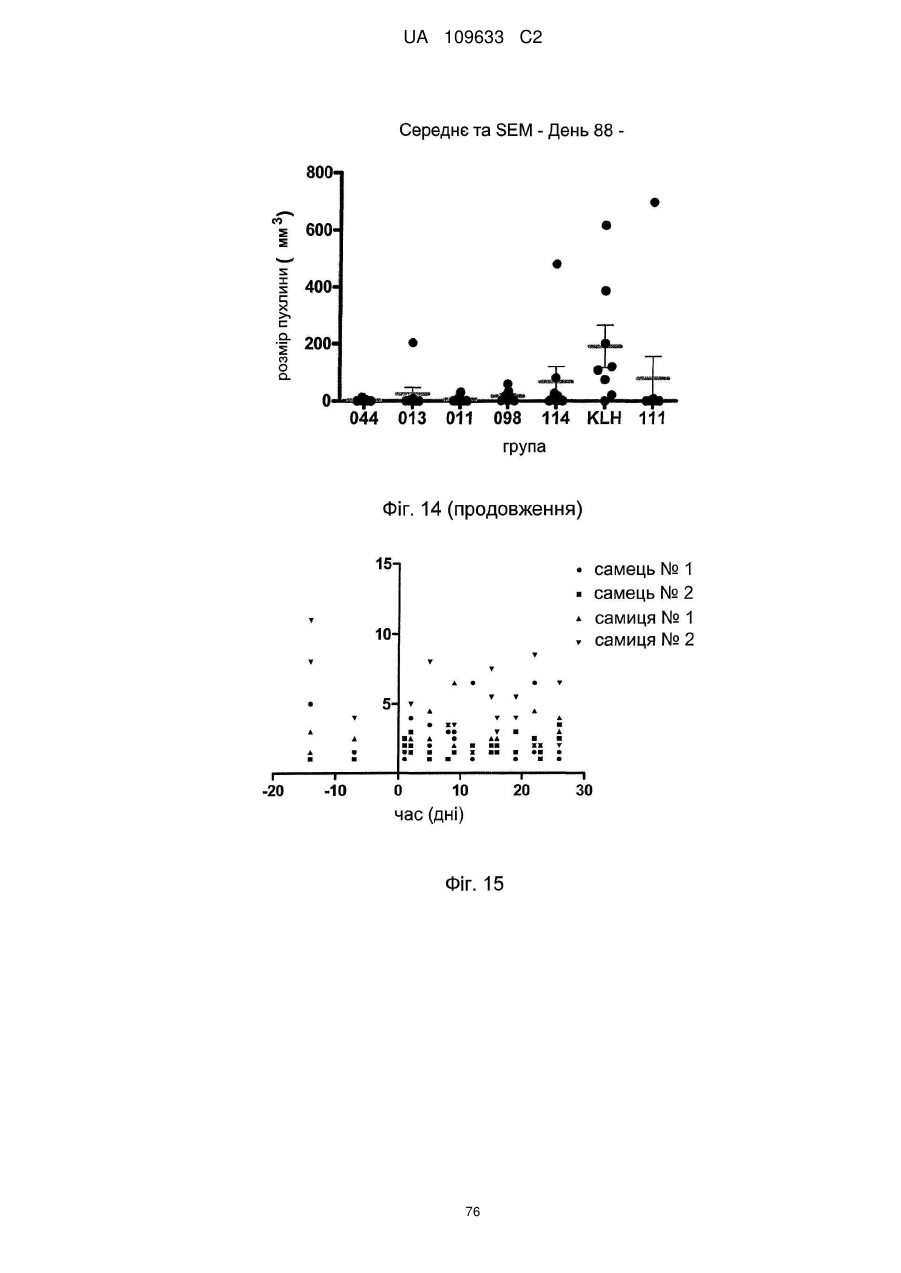
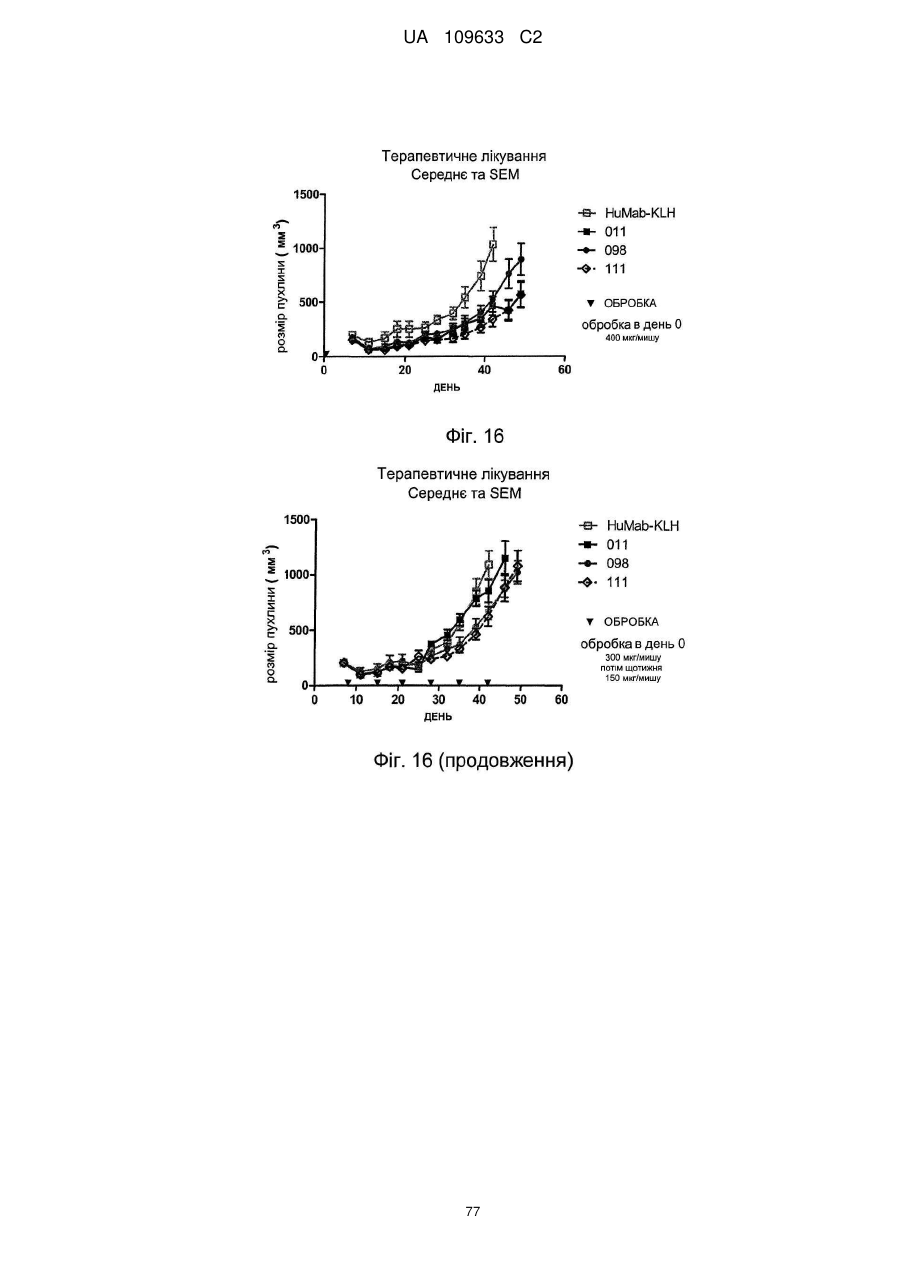
d) антитіло є ефективним для інгібування росту встановлених пухлин MDA-MB-231 при визначенні шляхом вимірювання пухлинного ксенотрансплантата у жирових тілах молочної залози мишей SCID, оброблених антитілом і/або для інгібування росту встановлених пухлин ВхРС3, причому об'єм пухлини визначали з розрахунку (PLEXX) у вигляді 0,52×(довжина)×(ширина)
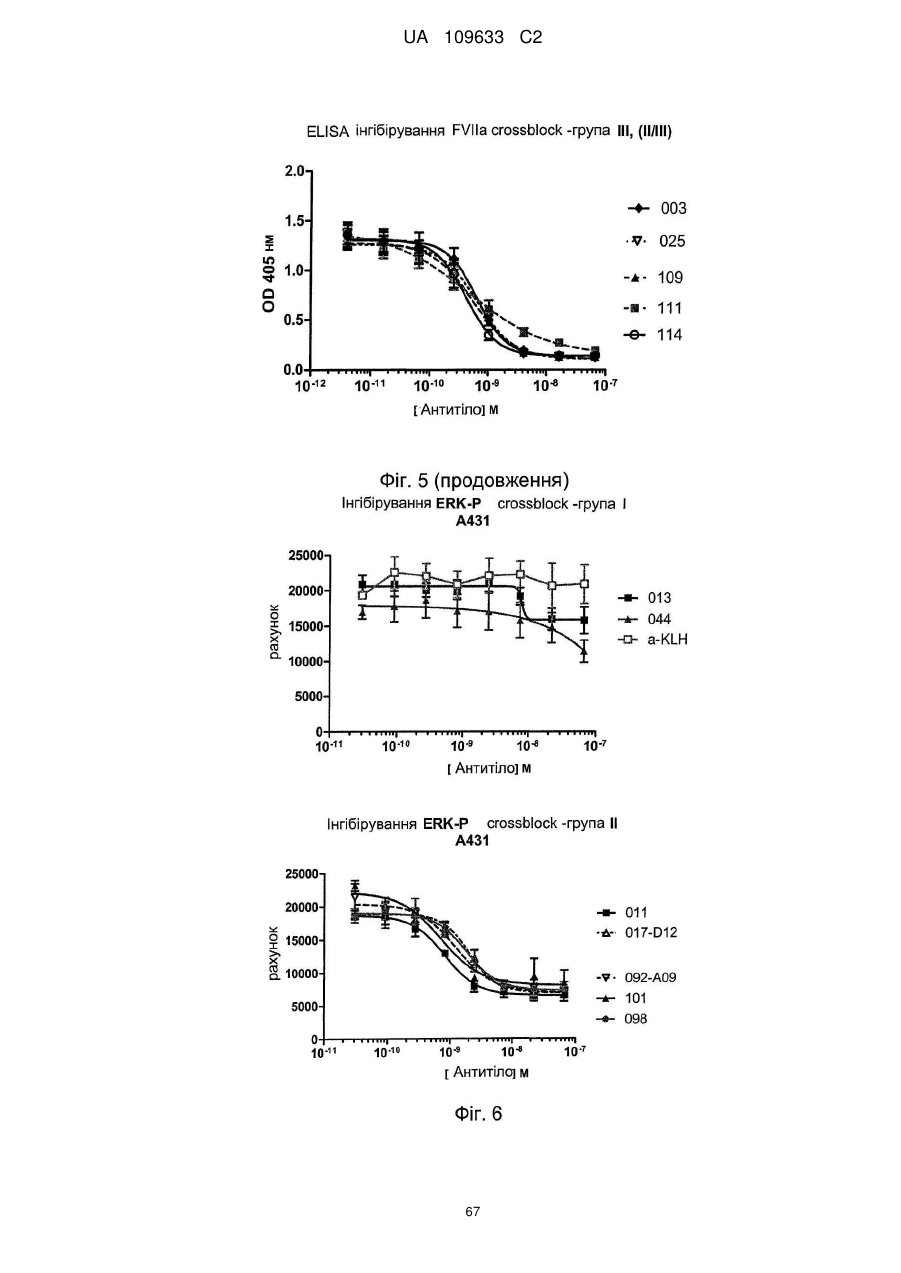
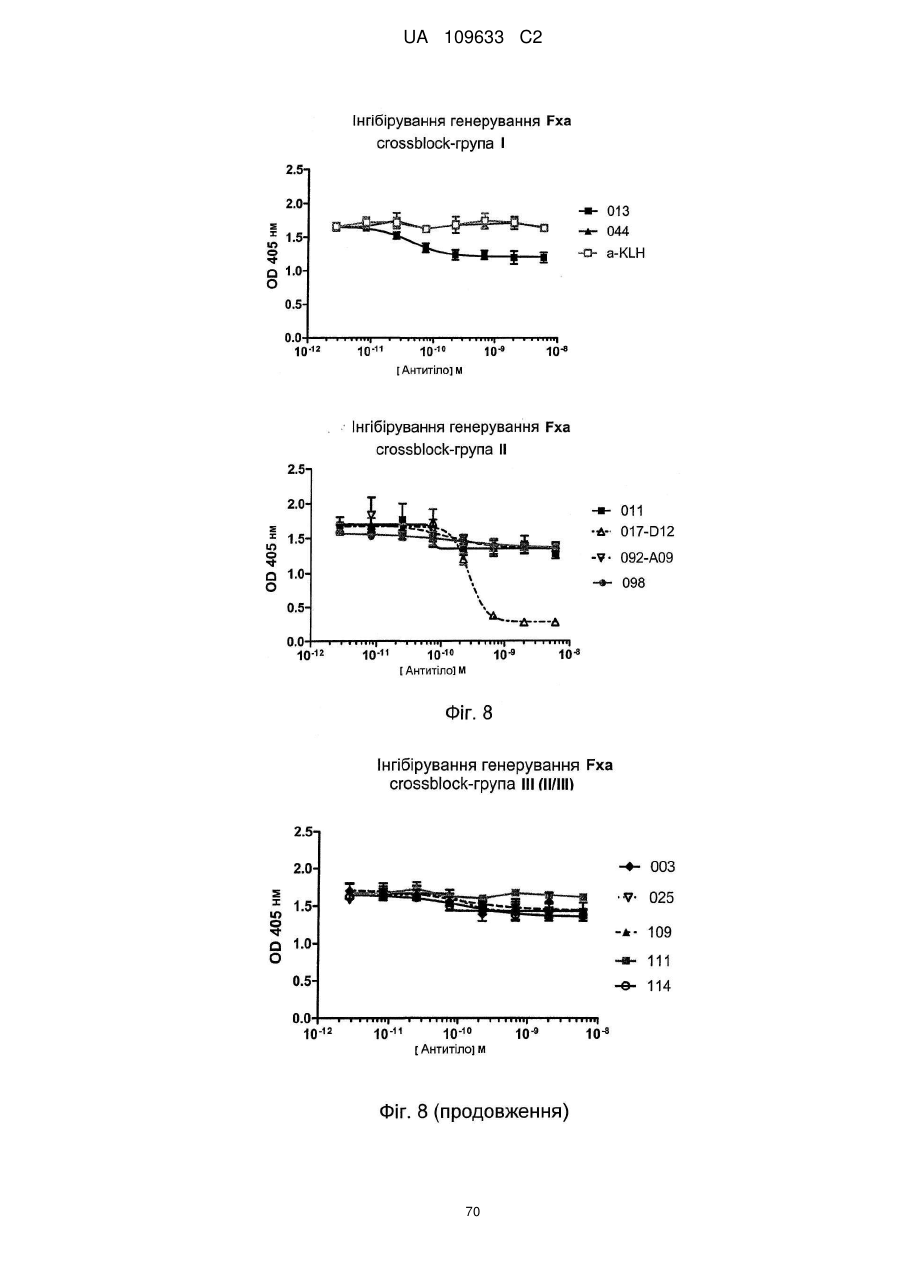
e) антитіло інгібує перетворення FX на FXa комплексом TF/FVIIa, бажано менше ніж на 50 %, наприклад, менше ніж на 40 %, наприклад, у діапазоні 1-30 %, при визначенні шляхом вимірювання перетворення FX на FXa за допомогою комплексу TF/FVIIa, із використанням колориметричного Fxa специфічного субстрату
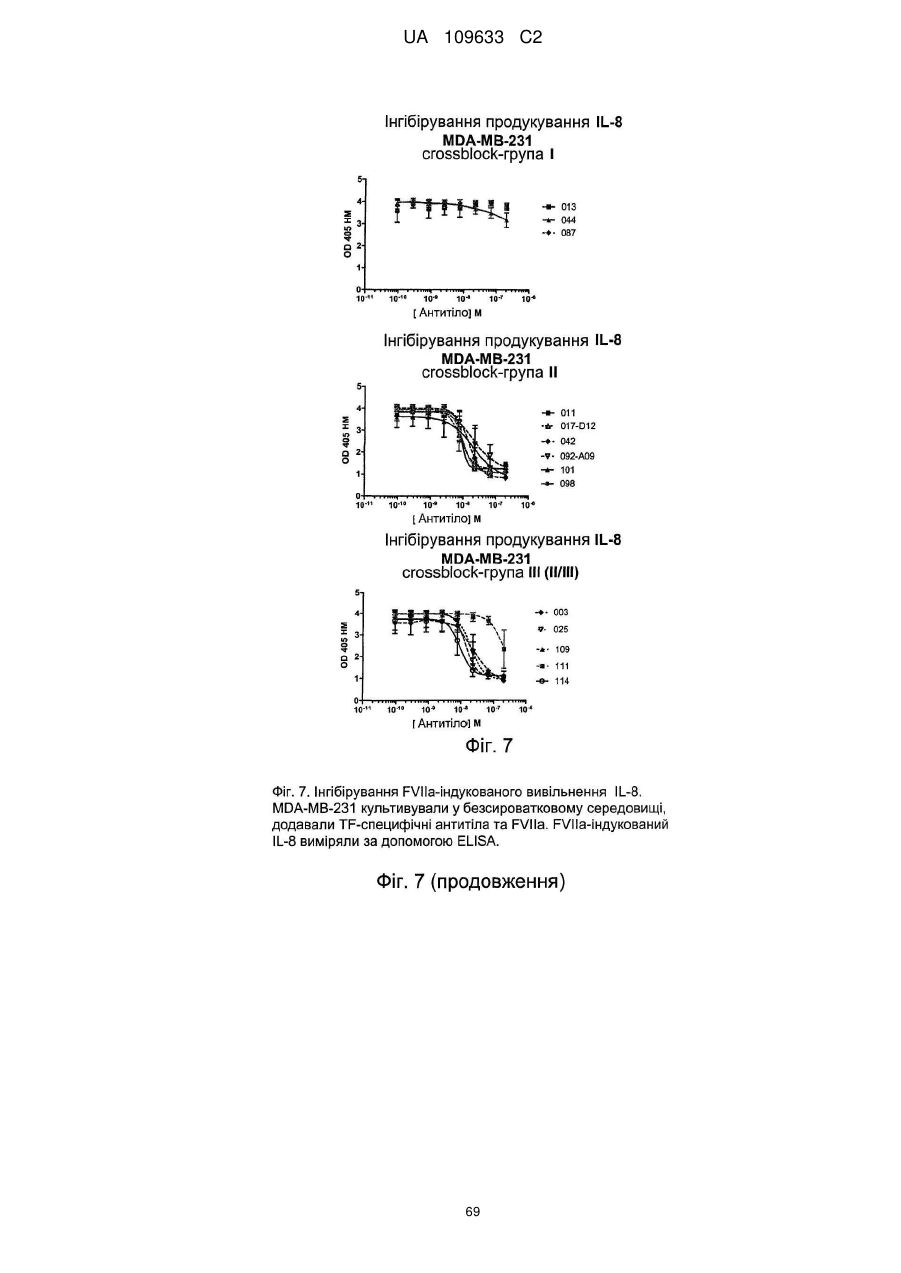
f) антитіло інгібує FVIIa-індуковане вивільнення IL-8 клітинами MDA-MB-231, бажано з максимальною величиною інгібування більше 40 %, такою як більше 50 %, наприклад, більше 60 %, при визначенні методом ELISA
3. Антитіло за будь-яким з попередніх пунктів, яке відрізняється тим, що має одну або декілька наступних характеристик:
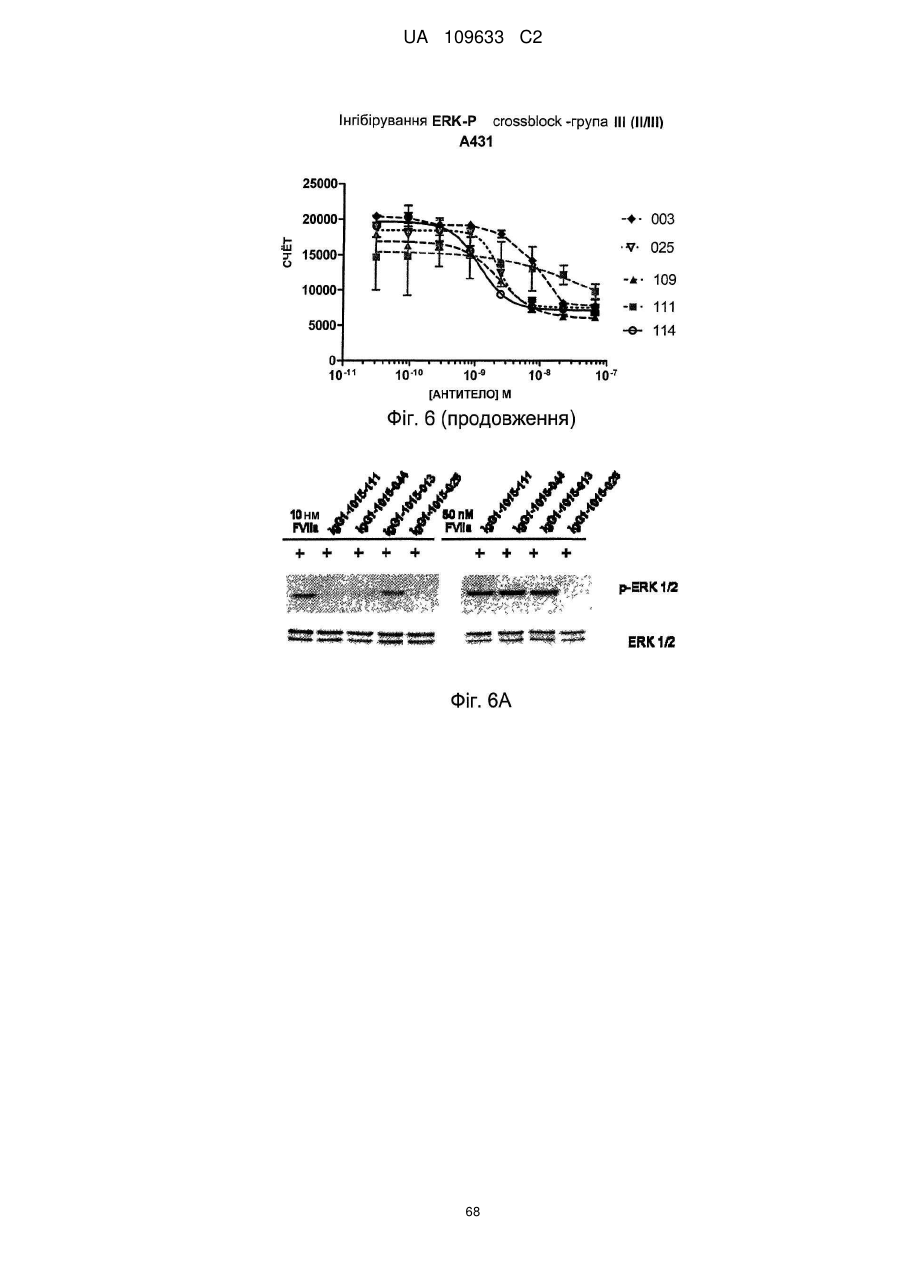
а) інгібує FVIIa-індуковане фосфорилювання ERK, бажано з медіаною концентрації інгібування, меншою ніж 10 нм, такою як менша ніж 5 нм, наприклад, менша ніж 2 нM, при визначенні методом Alphascreen Surefire ERK essay,
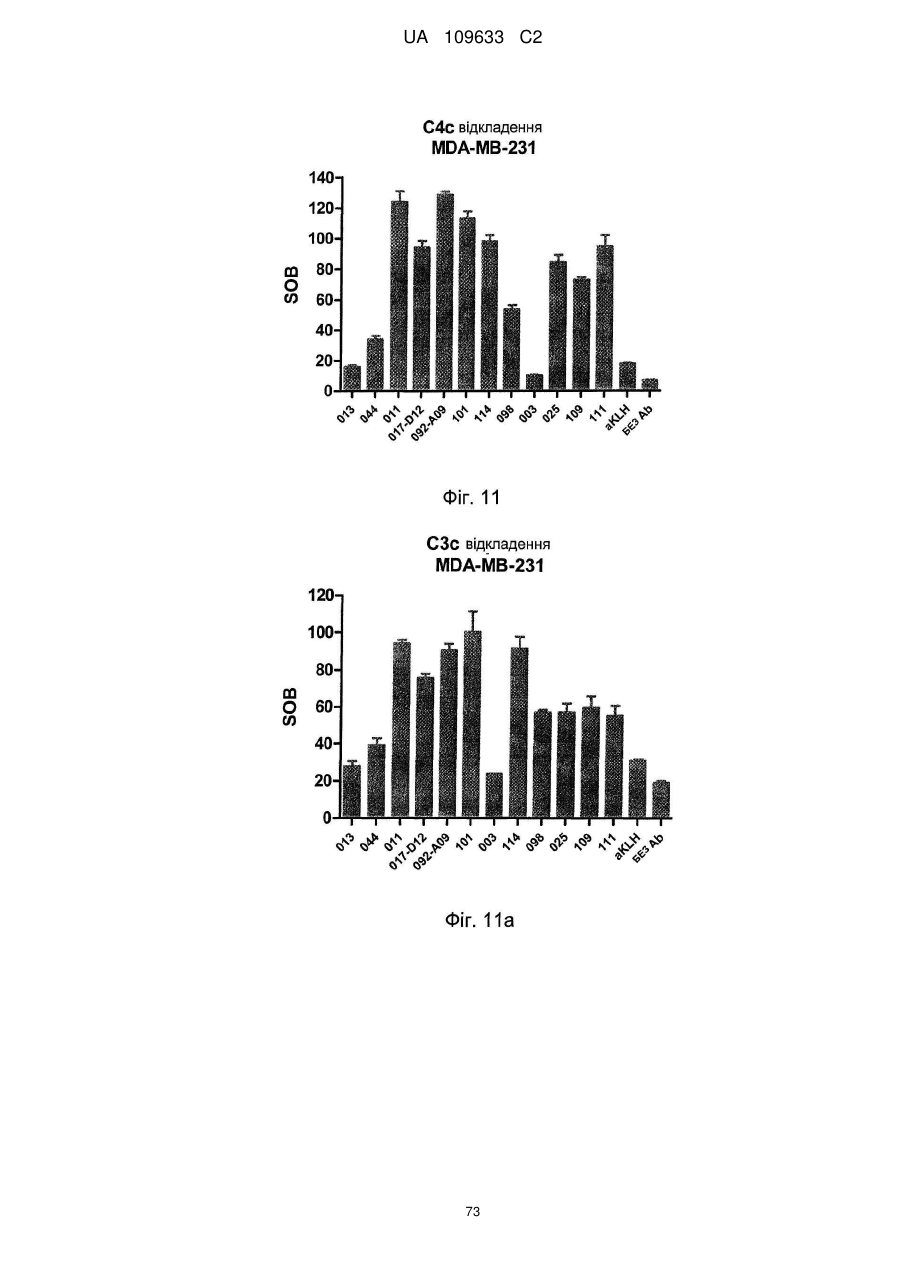
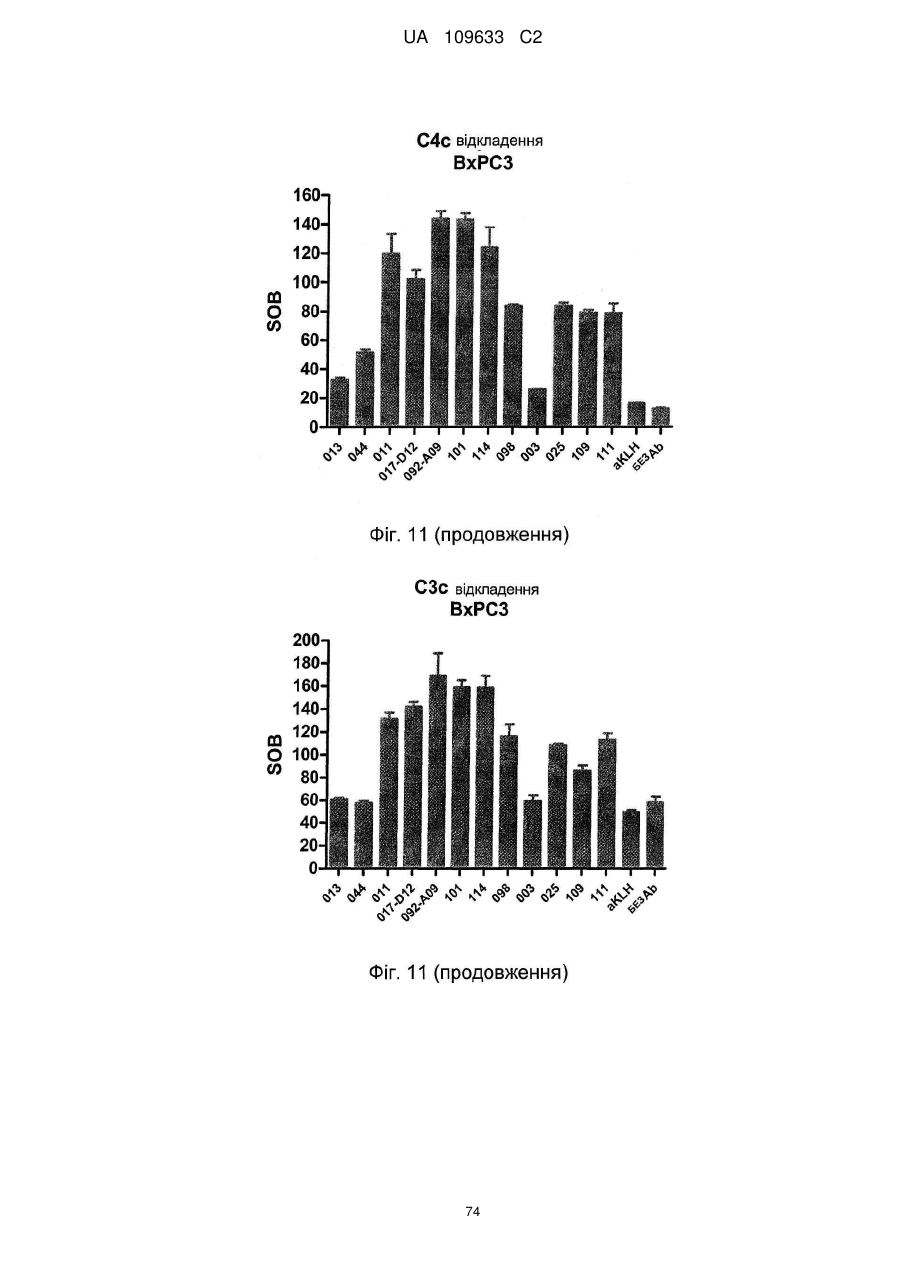
b) здатне індукувати відкладання C3c і C4c, бажано, де це антитіло здатне індукувати відкладання C3c і C4c, як визначено методом FACS,
c) Fab-фрагменти цього антитіла зв'язуються з позаклітинним доменом тканинного фактора з величиною EC50 нижчою 0,1 мкг/мл, такою як нижча 0,05 мкг/мл, наприклад, нижча 0,04 мкг/мл, як це визначено за допомогою ELISA;
d) Fab-фрагменти цього антитіла зв'язуються з позаклітинним доменом тканинного фактора з величиною EC50 нижчою 10 мкг/мл, як це визначено за допомогою ELISA;
e) Fab-фрагменти цього антитіла зв'язуються з позаклітинним доменом тканинного фактора з величиною EC50 нижчою 10 мкг/мл, такою як нижча 1 мкг/мл, наприклад, нижча 0,5 мкг/мл або нижча 0,2 мкг/мл або
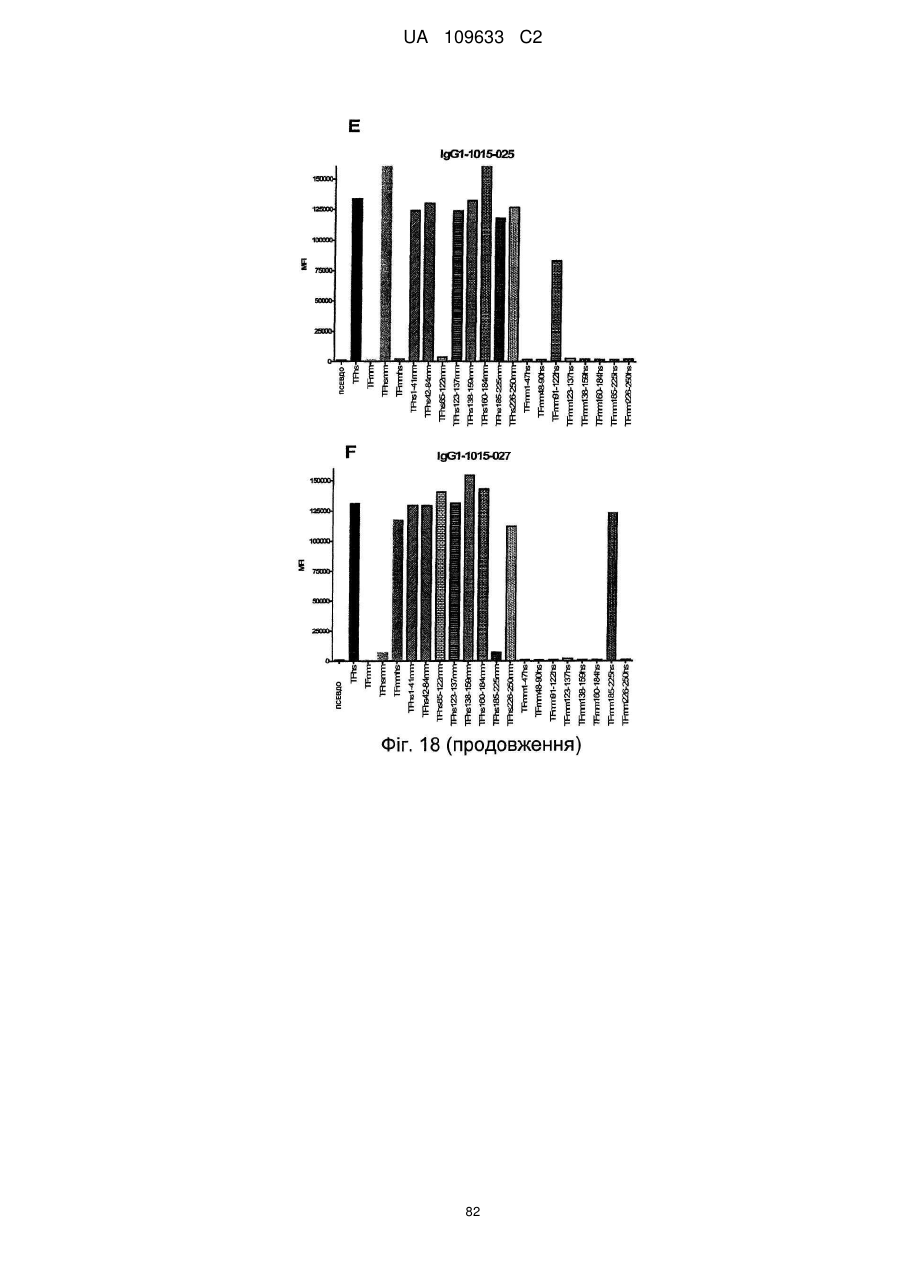
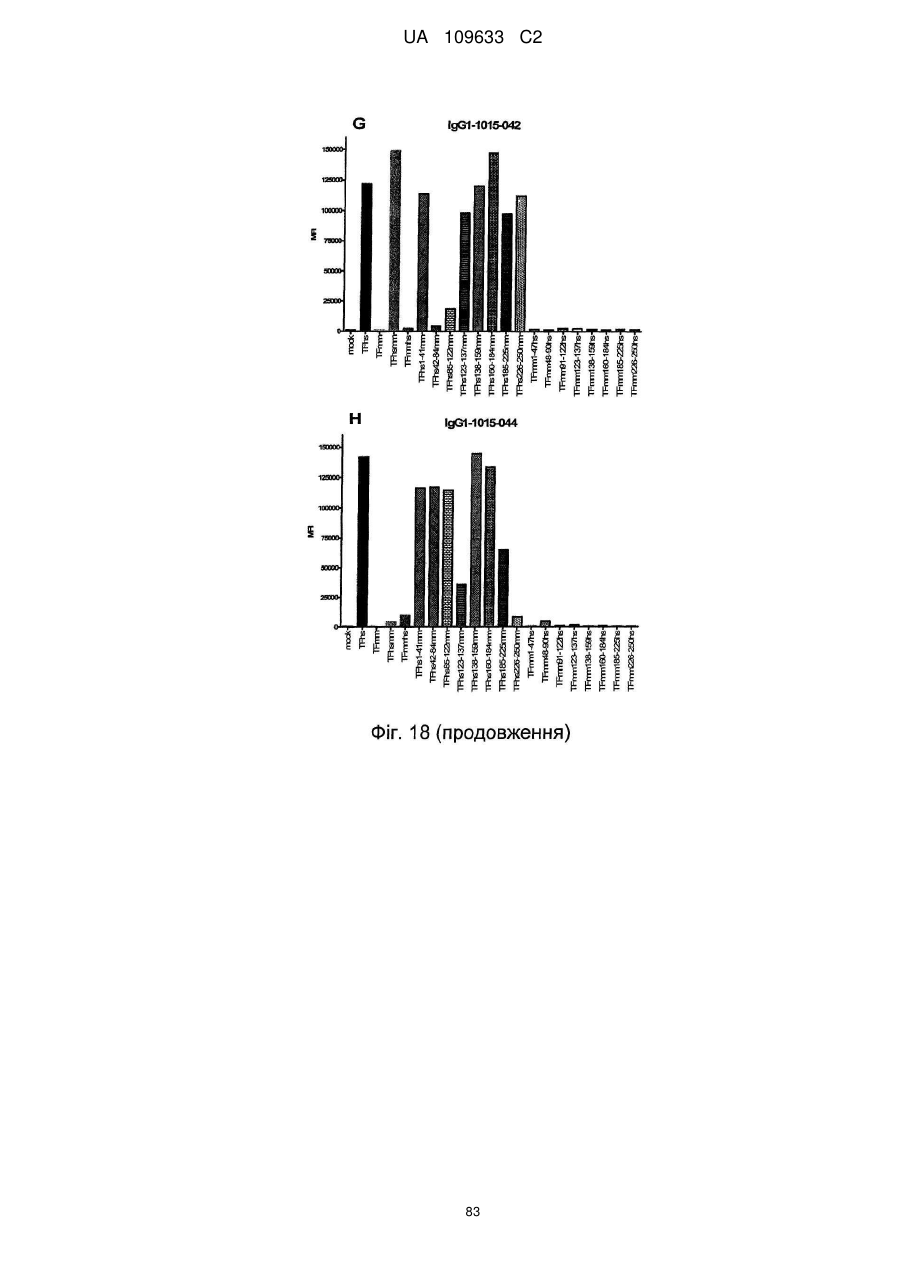
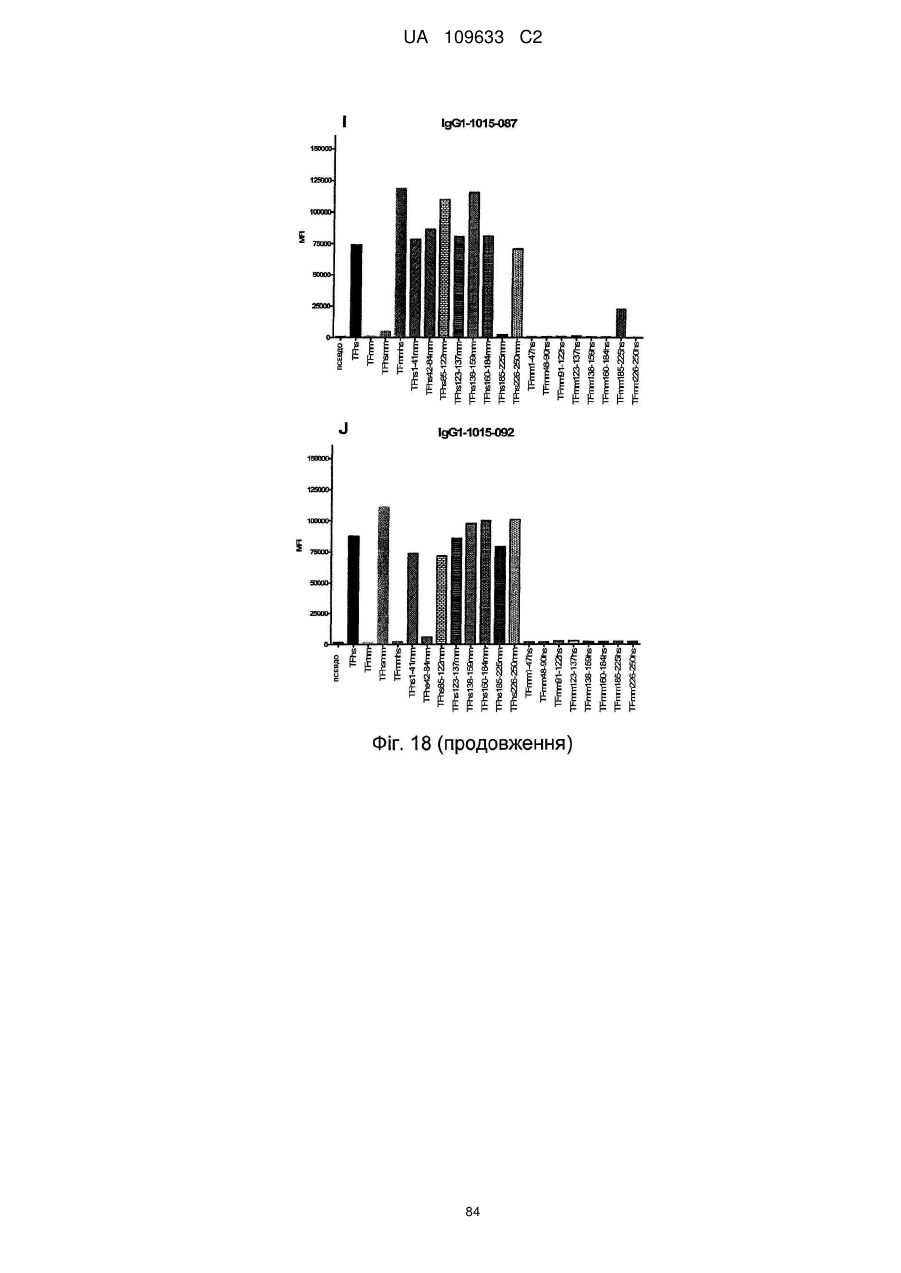
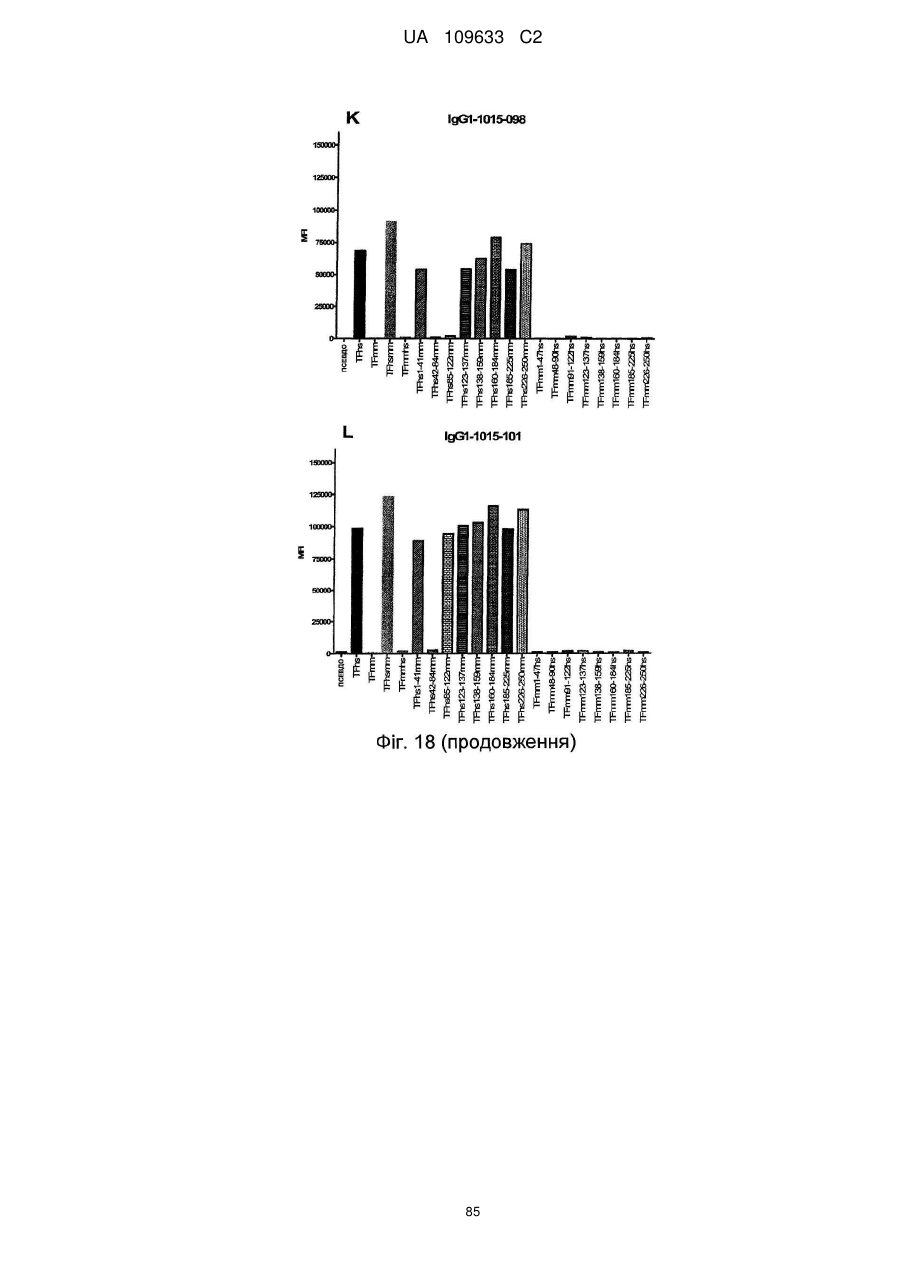
f) антитіло зв'язується із тканинним фактором людини, але не з мишачим тканинним фактором і виявляє зменшене зв'язування в порівнянні зі зв'язуванням з TF людини з перетасованою конструкцією 42-84 мм, яка містить послідовність TF людини, за винятком амінокислот 42-84, які були замінені послідовністю миші.
4. Антитіло за пп. 1-3, яке відрізняється тим, що це антитіло містить VН, має
a) щонайменше 80 % ідентичність, таку як щонайменше 90 %, щонайменше 95 % або щонайменше 98 % або 100 % ідентичність послідовності VН-району, вибраної із групи, яка складається з: SEQ ID NO: 9; або
b) щонайбільше 20, таких як, 15 або 10, або 5, 4, 3, 2, або 1 амінокислотних модифікацій, більш бажано амінокислотних замін, таких як консервативні амінокислотні заміни, у порівнянні з послідовністю VН-району SEQ ID NO: 9.
5. Антитіло за пп. 1-4, яке відрізняється тим, що містить VL, що має
a) щонайменше 80 % ідентичність, таку як щонайменше 90 %, щонайменше 95 % або щонайменше 98 %, або 100 % ідентичність послідовності VL-району SEQ ID NO: 65, або
b) щонайбільше 20, таких як, 15 або 10, або 5, 4, 3, 2, або 1 амінокислотних модифікацій, більш бажано амінокислотних замін, таких як консервативні амінокислотні заміни, у порівнянні з послідовністю VL-району SEQ ID NO: 65.
6. Антитіло за пп. 1-5, яке відрізняється тим, що містить VН-район, який містить послідовність SEQ ID NO: 9, і VL-район, який містить послідовність SEQ ID NO: 65.
7. Антитіло за будь-яким з пунктів 1-6, яке відрізняється тим, що це антитіло має одну або декілька наступних характеристик:
а) має афінність відносно тканинного фактора, яка менша 5 нМ, наприклад, менша 3,5 нМ, наприклад, менша 2 нМ при визначенні шляхом аналізу резонансу поверхневих плазмонів;
b) має kd більшу 10-3 сек-1, при визначенні способом визначення афінності, описаним тут у прикладі 22, і/або ka більшу 5×104 моль-1 сек-1 при визначенні шляхом використання подвійного посилального вирахування langmuir аналізу зв'язування;
c) має kd більшу 10-3 сек-1, при визначенні способом визначення афінності, описаним тут у прикладі 22, і афінність меншу 5 нМ, таку як менша 1 нМ, наприклад, менша 0,2 нМ, при визначенні шляхом аналізу резонансу поверхневих плазмонів.
8. Антитіло за будь-яким з попередніх пунктів, яке відрізняється тим, що це антитіло є кон′югованим з іншою часткою, такою як цитотоксична частка, радіоактивний ізотоп або лікарський засіб.
9. Біспецифічна молекула, яка містить антитіло за будь-яким з пунктів 1-8 і другу специфічність зв'язування, таку як специфічність зв'язування відносно ефекторної клітини людини, Fc-рецептора людини або Т-клітинного рецептора.
10. Експресуючий вектор, який відрізняється тим, що містить нуклеотидну послідовність, яка кодує одну або кілька амінокислотних послідовностей, вибраних із групи, яка складається з SEQ ID NO: 9 -SEQ ID NO: 12 і SEQ ID NO: 65-68.
11. Рекомбінантна еукаріотична або прокаріотична клітина-хазяїн, яка продукує антитіло за будь-яким з пунктів 1-8.
12. Фармацевтична композиція, яка містить антитіло за будь-яким з пунктів 1-8 або біспецифічну молекулу за п. 9 і фармацевтично прийнятний носій.
13. Антитіло за будь-яким з пунктів 1-8 або біспецифічна молекула за п. 9 для застосування як лікарського засобу.
14. Застосування антитіла за будь-яким з пунктів 1-8 або біспецифічної молекули за п. 9 для приготування лікарського засобу для лікування раку.
15. Спосіб одержання антитіла за будь-яким з пунктів 1-7, який відрізняється тим, що передбачає стадії
а) культивування клітини-хазяїна за п. 11 і
b) очищення антитіла від культурального середовища.
16. Діагностична композиція, яка містить антитіло за будь-яким з пунктів 1-8 або біспецифічну молекулу за п.9.
17. Спосіб детектування присутності тканинного фактора в пробі, який передбачає:
- контактування цієї проби з антитілом за будь-яким з пунктів 1-8 або біспецифічної молекули по п. 9 за умов, які дозволяють утворення комплексу між цим антитілом або біспецифічними молекулами й тканинним фактором; і
- проведення аналізу, який визначає - чи був утворений комплекс.
18. Набір для детектування присутності тканинного фактора в пробі, який містить
- антитіло за будь-яким з пунктів 1-8 або біспецифічну молекулу за п. 9; і
- інструкції для застосування цього набору.
19. Антиідіотипічне антитіло, яке відрізняється тим, що зв'язує антитіло за будь-яким з пунктів 1-7.
Текст
Реферат: Винахід належить до виділеного моноклонального антитіла людини, яке зв'язується з тканинним фактором людини, та фармацевтична композиція на основі антитіла, а також терапевтичні й діагностичні способи застосування вказаного антитіла. UA 109633 C2 (12) UA 109633 C2 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої відноситься винахід Даний винахід відноситься до антитіл, спрямованих на тканинній фактор, зокрема, тканинний фактор людини, і застосування таких антитіл, зокрема, їх застосування при лікуванні раку, запалень й судинних захворювань. Рівень техніки Тканинний фактор (TF), який також називається тромбопластином, фактором III або CD142, є білком, який присутній у субендотеліальній тканині, тромбоцитах і лейкоцитах, необхідним для ініціації утворення тромбіну із зимогену протромбіну. Утворення тромбіну призводить в остаточному підсумку до коагуляції крові. Тканинний фактор дозволяє клітинам ініціювати каскади коагуляції крові, і він функціонує як високоафінний рецептор для фактора коагуляції VII. Отриманий комплекс забезпечує каталітичну подію, яка є відповідальною за ініціацію протеазних каскадів коагуляції за допомогою специфічного обмеженого протеолізу. На відміну від інших кофакторів цих протеазних каскадів, які циркулюють у вигляді нефункціональних попередників, цей фактор є сильнодіючим ініціатором, який є повністю функціональним при експресії на клітинних поверхнях. Тканинний фактор є рецептором клітинної поверхні для фактора Viia (FVIIa), який є сериновою протеазою. Було виявлено, що зв'язування FVIIa із тканинним фактором запускає процеси передачі сигналу в цій клітині, причому зазначена функція передачі сигналу відіграє роль в ангіогенезі. У той час як ангіогенез є нормальним процесом росту й розвитку, а також у загоєнні ран, він є також фундаментальною стадією в переході пухлин зі стану спокою в злоякісний стан: коли ракові клітини набувають здатності продукувати білки, які беруть участь в ангіогенезі, так звані ангіогенні фактори росту, ці білки вивільняються пухлиною в сусідні тканини й стимулюють нові кровоносні судини до проростання з існуючих здорових кровоносних судин у напрямку до пухлини й у пухлину. Як тільки нові кровоносні судини входять у пухлину, вона може швидко збільшувати свій розмір і проникати в локальну тканину й органи. За допомогою цих нових кровоносних судин ракові клітини можуть також просочуватися в кров'яне русло і локалізуватися в інших органах з утворенням нових пухлин (метастазів). Крім того, TF відіграє роль у запаленні. Передбачається, що роль TF опосередковується коагуляцією крові (A.J. Chu: «Tissue factor mediates inflammation» in Archives of biochemistry and biophysics, 2005, vol. 440, No. 2, pp. 123-132). Таким чином, інгібування TF, наприклад, моноклональними анти-TF-антитілами, є важливим у перериванні циклу коагуляції-запалення в сприянні не тільки антизапаленню, але також лікуванню судинних захворювань. Експресія TF спостерігається при багатьох типах раку й асоційована з більш агресивним захворюванням. Крім того, TF людини існує також у розчинній альтернативно сплайсованій формі, asHTF. Недавно було виявлено, що asHTF стимулює ріст пухлини (Hobbs et al. 2007 Thrombosis Res. 120(2) S13-S21). Зв'язування антитіл з TF було розкрито в попередньому рівні техніки: WO98/40408 описує антитіла, які можуть зв'язувати нативний TF людини, або окремо, або будучи присутнім в комплексі TF:Viia, ефективно запобігаючи зв'язуванню фактора X з TF або цим комплексом і зменшуючи за допомогою цього коагуляцію крові. Розкривається, що ці антитіла можуть бути використані для полегшення тромбозів після інвазивної медичної процедури, такої як артеріальна або серцева хірургія, або для елімінації коагуляції крові, що виникає внаслідок використання медичної програми. Крім того, описано, що антитіла можуть бути використані в діагностичних способах in vivo, у тому числі в діагностичній візуалізації in vivo нативного TF людини. WO04/094475 пропонує антитіла, здатні зв'язуватися із тканинним фактором людини, які не інгібують опосередковану фактором коагуляцію крові, у порівнянні з нормальною плазмою як контролем. Антитіла людини не описані. Передбачається, що це антитіло може бути використане для лікування раку. WO03/093422 відноситься до антитіл, які зв'язуються з більш високою афінністю з комплексом TF:Viia, ніж з одним TF. Пропонується використання цих антитіл як антикоагулянту в лікуванні деяких захворювань, таких як сепсис, дисемінована внутрішньосудинна коагуляція, ішемічний інсульт, тромбоз, гострі коронарні синдроми й коагулопатія, у випадку запущеного раку. WO01/27079 описує композиції й способи для інгібування проліферації клітин, яке відхиляється від норми, зокрема, проліферації ендотеліальних клітин, наприклад, у випадку раку, аномального розвитку ембріонів, порушення функції імунних реакцій, а також ангіогенезу, пов'язаного з неоваскуляризацією і ростом пухлини. Пропонуються багато активних речовин, у тому числі антитіла, але які-небудь конкретні антитіла не описуються. WO03/037361 відноситься до застосування агоніста або антагоніста TF для лікування, 1 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 пов'язаного з апоптозом. WO03/029295 відноситься до виділених антитіл людини, які імунореагують з TF людини з інгібуванням зв'язування фактора коагуляції Viia. Однак, ця заявка не розкриває жодного прикладу антитіла, що має ці властивості. Схвалені ряд терапій з використанням моноклональних антитіл для лікування різних типів пухлин, у тому числі бевацицумаба (Avastin®), цетуксимаба (Erbitux®), панітумумаба (Vectibix™) і трастуцумаба (Herceptin®). Сутність винаходу Хоча був досягнутий великий прогрес, залишається необхідність розробки поліпшених способів лікування серйозних захворювань, наприклад, поліпшеного лікування рака, на основі терапевтичних антитіл. Метою даного винаходу є запропонувати нові високоспецифічні і ефективні анти-TFантитіла людини для медичного застосування. Антитіла цього винаходу проявляють TFзв'язувальні характеристики, які відрізняються від характеристик антитіл, описаних у даній галузі. У кращих варіантах здійснення, антитіла цього винаходу мають високу афінність відносно тканинного фактора людини, опосередковують антитілозалежну клітинну цитотоксичність (ADCC), інгібують FVIIa-індуковане фосфорилювання ERK і вивільнення IL-8, не інгібують або слабо інгібують коагуляцію. Короткий опис фігур Фігура 1: Співставлення послідовностей антитіл даного винаходу. CDR1, CDR2 і CDR3 відповідно до IMGT виділені: послідовності, виділені курсивом, представляють район CDR1, не підкреслені послідовності представляють район CDR2, послідовності, виділені жирним шрифтом, представляють район CDR3 Фігура 2: послідовності IgG4 (SEQ ID NO: 113-114) SEQ ID NO: 113: Амінокислотна послідовність СН-району дикого типу IgG4 людини. Послідовність, виділена курсивом, представляє район CH1, виділена послідовність представляє шарнірну область, нормальна послідовність представляє район СН2 і не підкреслена послідовність представляє район СН3. SEQ ID NO: 114: Амінокислотна послідовність, яка не має шарнірної області району СН IgG4 людини. Фігура 3: Зв'язування анти-TF-HuMab з позаклітинним доменом TF. Фігура 4: Зв'язування анти-TF-HuMab з мембранозв′язаним TF. Фігура 5: Інгібування зв'язування FVIIa з TF. Фігура 6: Інгібування FVIIa-індукованого фосфорилювання ERK. Фігура 6a: Інгібування FVIIa-індукованого фосфорилювання ERK Фігура 7: Інгібування FVIIa-індукованого вивільнення IL-8. Фігура 8: Інгібування генерування FXa. Фігура 9: Інгібування коагуляції крові. Фігура 10: TF-HuMab індукує лізис клітин Bx-PC3 за допомогою ADCC. Фігура 11: Відкладання компонентів комплементу С3с і С4с на клітинах-мішенях. Фігура 12: Імуногістохімічний аналіз зв'язування TF-HuMab із клубочками (гломерулами). Фігура 13: Імуногістохімічний аналіз зв'язування TF-HuMab з панкреатичними пухлинами. Фігура 14: In vivo ефективність TF-HuMab у встановленому ксенотрансплантаті пухлини MDA-MB-231. Фігура 15: Час кровотечі, визначений на собакоподібних мавпах після внутрішньовенних ін'єкцій TF-специфічного HuMab 011. Це антитіло вводили в день 1 (0 мг/кг), 8 (1 мг/кг), 15 (10 мг/кг) і 22 (100 мг/кг). Фігура 16: In vivo ефективність TF-HuMab у профілактичному й установленому ксенотрансплантаті пухлини BX-PC3. Фігура 17: Перетасована конструкція й домени TF. Фігура 18: Зв'язування анти-TF-антитіл з перетасованими конструкціями TF. Фігура 19: Зв'язування Fab-фрагментів HuMab-TF з позаклітинним доменом TF, ELISA. Фігура 20: Зв'язування Fab-фрагментів HuMab-TF з позаклітинним доменом TF, FACS. Фігура 21: Профіль зв'язування анти-TF-HuMab залежно від кількості експресованих молекул TF. Відомості, які підтверджують можливість здійснення винаходу Визначення Терміни «тканинний фактор», «TF», «CD142», «антиген тканинного фактора», «антиген TF» і «антиген CD142» використовуються тут як взаємозамінні і, якщо немає інших вказівок, включають в себе будь-які варіанти, ізоформи й видові гомологи тканинного фактора людини, 2 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 які природно експресуються клітинами або експресуються на клітинах, трансфікованих геном тканинного фактора. Термін «імуноглобулін» відноситься до класу структурно споріднених глікопротеїнів поліпептидних ланцюгів, які складаються із двох пар, однієї пари легких (L) низькомолекулярних ланцюгів і однієї пари важких (H) ланцюгів, які можуть, усі чотири, бути зв'язані дисульфідними зв'язками. Структура імуноглобулінів була добре охарактеризована. Див., наприклад, Fundamental Immunology Ch. 7 (Paul, W., ed., 2nd ed. Raven Press, N. Y. (1989)). Коротко, кожний важкий ланцюг звичайно складається з варіабельного району важкого ланцюга (що скорочується тут як VH або VH) і константного району важкого ланцюга. Цей константний район важкого ланцюга звичайно складається із трьох доменів, С Н1, СН2 і СН3. Кожний легкий ланцюг звичайно складається з варіабельного району легкого ланцюга (що скорочується тут як V L або VL) і константного району легкого ланцюга. Цей константний район легкого ланцюга звичайно містить один домен, CL. Райони VH і VL можуть бути додатково підрозділені на райони гіперваріабельності (або гіперваріабельні райони, які можуть бути гіперваріабельними в послідовності й/або утворюють структурно визначені петлі), які також називаються районами (CDR), які визначають комплементарність, і які перемежовуються з районами, які є більш консервативними, названими каркасними районами (FR). Кожний з V H і VL звичайно складається із трьох CDR і чотирьох FR, розташованих від аміно-кінця до карбокси-кінця в такому порядку: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 (див. також Chothia and Lesk J. Mol. Biol. 196, 901-917 (1987)). Звичайно, нумерацією амінокислотних залишків у цьому районі є нумерація відповідно до IMGT, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991) (такі фрази тут як «нумерація залишків варіабельного домену за Кабатом» або «відповідно до Кабату» відносяться до цієї нумерації варіабельних доменів важкого ланцюга або варіабельних доменів легкого ланцюга). З використанням цієї системи нумерації, фактична лінійна амінокислотна послідовність пептиду може містити менше амінокислот або додаткові амінокислоти, які відповідають скороченням FR або CDR або вбудовуванню до FR або CDR варіабельного домену. Наприклад, варіабельний домен важкого ланцюга може містити в собі єдиний амінокислотний інсерт (залишок 52а за Кабатом) після залишку 52 CDR2 VH та інсертовані залишки (наприклад, залишки 82а, 82b і 82c тощо за Кабатом) після залишку 82 FR важкого ланцюга. Нумерація Кабата залишків може бути визначена для конкретного антитіла зіставленням у районах гомології цієї послідовності антитіла з «стандартною» нумерованою за Кабатом послідовністю. Термін «антитіло» (Ab) у контексті даного винаходу відноситься до молекули імуноглобуліну, фрагменту молекули імуноглобуліну або похідного кожного з них, яка має здатність специфічно зв'язуватися з антигеном за типових фізіологічних умов з часом напівжиття значних періодів часу, таких як щонайменше приблизно 30 хвилин, щонайменше приблизно 45 хвилин, щонайменше приблизно одна година, щонайменше приблизно 2 години, щонайменше приблизно 4 години, щонайменше приблизно 8 годин, щонайменше приблизно 12 годин, приблизно 24 години або більше, приблизно 48 годин або більше, приблизно 3, 4, 5, 6, 7 або більше днів тощо, або будь-якого іншого придатного функціонально-певного періоду (такого як час, достатній для індукції, стимуляції, посилення й/або модуляції фізіологічної реакції, асоційованої зі зв'язуванням антитіла з антигеном, і/або час, достатній цьому антитілу для рекрутинга ефекторної активності). Варіабельні райони важкого й легкого ланцюгів цієї молекули імуноглобуліну містять з'єднувальний домен, який взаємодіє з антигеном. Константні райони цих антитіл (Ab) можуть опосередковувати зв'язування імуноглобуліну із тканинами або факторами хазяїна, які включають у себе різні клітини імунної системи (такі як ефекторні клітини) і компонента системи комплементу, такі як С1q, перший компонент у класичному шляху активації комплементу. Анти-TF-антитіло може бути також біспецифічним антитілом, діатілом або подібною молекулою (див., наприклад, PNAS USA 90(14), 6444-8 (1993) відносно опису діатіл). Дійсно, біспецифічні антитіла, діатіла тощо, запропоновані даним винаходом, можуть зв'язувати будь-яку придатну мішень, поряд із частиною тканинного фактора або комплексом тканевий фактор-FVIIa. Як зазначено вище, термін антитіло, якщо немає іншої вказівки, включає в себе фрагменти антитіла, які зберігають здатність специфічно зв'язуватися із цим антигеном. Було показано, що антигензв′язувальна функція антитіла може виконуватися фрагментами повнорозмірного антитіла. Приклади з'єднувальних фрагментів, включених у термін «антитіло», містять у собі (i) Fab або Fab-фрагмент, моновалентний фрагмент, який складається з доменів VL, VH, CL і CH1, або моновалентне антитіло, описане в WO2007059782 (Genmab); (ii) F(ab’) 2фрагменти, двовалентні фрагменти, які містять два Fab-фрагмента, зв'язані дисульфідним містком у шарнірній області; (iii) Fd-фрагмент, який складається власне з доменів VH і CH1; (iv) Fv-фрагмент, який складається власне з доменів VL і VH, (v) dab-фрагмент (Ward et al., Nature 3 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 341, 544-546 (1989)), який складається власне з домена VH, і також називаються антитілами, які складаються із доменів (Holt et al; Trends Biotechnol. 2003 Nov;21(11):484-90); (vi) верблюдові або нанотіла (Revets et al; Expert Opin Biol Ther. 2005 Jan;5(l):111-24) і (vii) виділений район (CDR), який визначає комплементарність. Крім того, хоча два домена Fv-фрагмента, VL і VH, кодуються окремими генами, вони можуть бути з'єднані, з використанням рекомбінантних способів, синтетичним лінкером, який дозволяє приготувати їх у вигляді єдиного білкового ланцюга, у якому райони VL і VH спаровуються з утворенням моновалентних молекул (відомих як одноланцюгові антитіла або одноланцюговий Fv (scfv), див., наприклад, Bird et al., Science 242, 423-426 (1988) and Huston et al., PNAS USA 85, 5879-5883 (1988)). Такі одноланцюгові антитіла охоплені терміном антитіло, якщо немає іншої вказівки або інший варіант не вказується ясно контекстом). Хоча такі фрагменти звичайно включені в поняття антитіла, вони, разом або кожний незалежно, є унікальними ознаками даного винаходу, що проявляють різні біологічні властивості й можливість застосування. Ці й інші застосовані фрагменти антитіл у контексті даного винаходу обговорюються тут додатково. Повинно бути зрозумілим, що термін антитіло, якщо немає іншої вказівки, включає у себе також поліклональні антитіла, моноклональні антитіла (mab), антитіло-подібні поліпептиди, такі як химерні антитіла й гуманізовані антитіла, і фрагменти антитіл, які зберігають здатність специфічно зв'язуватися із цим антигеном (антигензв′язувальні фрагменти), які забезпечуються будь-яким відомим способом, таким як ферментативне розщеплення, пептидний синтез і рекомбінантні способи. Генероване антитіло може мати будь-який ізотип. «Анти-TF-антитіло» є антитілом, описаним вище, яке специфічно зв'язується c антигенним тканинним фактором. Термін «антитіло людини», у даному контексті, включає в себе антитіла, які мають варіабельні й константні райони, складені з послідовностей імуноглобуліну зародкової лінії людини. Антитіла людини цього винаходу можуть містити в собі амінокислотні залишки, які не кодуються послідовностями імуноглобуліну зародкової лінії людини (наприклад, мутації, уведені випадковим або сайт-специфічним мутагенезом in vitro або під час реаранжування генів або соматичної мутації in vivo). Однак, термін «антитіло людини», у даному контексті, не покликаний охоплювати антитіла, у яких CDR-послідовності, узяті із зародкової лінії іншого виду ссавця, такого як миша, були трансплантовані на послідовності каркасної області людини. В одному кращому варіанті здійснення, антитіло цього винаходу є виділеним. «Виділене антитіло» відноситься в даному контексті до антитіла, яке власне не містить інших антитіл, які мають відмінні антигенні специфічності (наприклад, виділене антитіло, яке специфічно зв'язується із тканинним фактором, власне не містить антитіл, які специфічно зв'язують антигени, відмінні, від тканинного фактора). Однак, виділене антитіло, яке специфічно зв'язується з епітопом, ізоформою або варіантом тканинного фактора людини, може мати перехресну реактивність у відношенні інших споріднених антигенів, наприклад, з інших видів (таких як видові гомологи тканинного фактора). Крім того, виділене антитіло може бути власне вільним від іншого клітинного матеріалу й/або хімікаліїв. В одному варіанті здійснення даного винаходу, два або більше «виділених» моноклональних антитіл, які мають різні антигензв′язувальні специфічності, об'єднані в добре визначеній композиції. Терміни «конкурує з» або «перехресно конкурує з», як вони застосовуються тут, у контексті двох або більш антитіл, указує на те, що ці два або більше антитіл конкурують за зв'язування з TF, наприклад, конкурують за зв'язування TF в аналізі, описаному тут в прикладі 6. Для деяких пар антитіл, конкуренція в цьому аналізі прикладу 6 спостерігається тільки при нанесенні одного антитіла у вигляді покриття на планшет і при використанні іншого для конкуренції, а не vice versa. Термін «конкурує з», як його використано тут, охоплює також такі комбінації антитіл. Терміни «моноклональне антитіло» або «композиція моноклонального антитіла» відноситься в даному контексті до препарату молекул антитіл єдиної молекулярної сполуки. Композиція моноклонального антитіла проявляє єдину специфічність і афінність зв'язування у відношенні до конкретного епітопа. Таким чином, термін «моноклональне антитіло людини» відноситься до антитіл, які проявляють єдину специфічність зв'язування, які мають варіабельні й константні райони, отримані з послідовностей імуноглобуліну зародкової лінії людини. Моноклональні антитіла людини можуть бути генеровані гібридомою, яка містить у собі Вклітину, отриману із трансгенної або трансхромосомної тварини не людини, такої як трансгенна миша, яка має геном, який містить трансген важкого ланцюга й трансген легкого ланцюга людини, злиті з іморталізованою клітиною. Термін «зв'язування», як його застосовано тут, у контексті зв'язування антитіла із заздалегідь визначеним антигеном звичайно позначає зв'язування з афінністю, яка відповідає -7 -8 -9 KD приблизно 10 M або менше, такий як приблизно 10 M або менше, такою як приблизно 10 4 UA 109633 C2 -10 5 10 15 20 25 30 35 40 45 50 55 60 -11 M або менше, приблизно 10 M або менше, або приблизно 10 M або навіть менше, при визначенні, наприклад, технологією резонансу поверхневих плазмонів (SPR) у приладі Biacore 3000 з використанням цього антигену як ліганда й цього антитіла як аналіта, і це антитіло зв'язує заздалегідь визначений антиген з афінністю, що відповідає K D, яка є щонайменше вдесятеро більш низькою, наприклад, щонайменше в 100 раз більш низькою, наприклад, щонайменше в 1000 раз більш низькою, наприклад, щонайменше в 10000 раз більш низькою, наприклад, щонайменше в 100000 раз більш низькою, ніж його афінність відносно неспецифічного антигену (наприклад, БСА, казеїну), інакшого, ніж заздалегідь визначений антиген або близькоспоріднений антиген. Величина, з якою ця афінність є більш низькою, залежить від KD цього антитіла, так що, коли KD антитіла є дуже низькою (тобто це антитіло є високоспецифічним), величина, з якою афінність відносно цього антигену є більш низькою, ніж афінність відносно неспецифічного антигену, може бути щонайменше 10000-разовою. -1 Термін «kD» (сек ) відноситься в даному контексті до константи швидкості дисоціації конкретної взаємодії антитіло-антиген. Зазначену величину називають також величиною k off. -1 -1 Термін «ka» (M × сек ) відноситься в даному контексті до константи швидкості асоціації конкретної взаємодії антитіло-антиген. Термін «KD» (M) відноситься в даному контексті до константи рівноваги дисоціації конкретної взаємодії антитіло-антиген. -1 Термін «KA» (M ) відноситься в даному контексті до константи рівноваги асоціації конкретної взаємодії антитіло-антиген, і її одержують ділячи k a на KD. Даний винахід пропонує також антитіла, які містять функціональні варіанти району V L, району VH або одного або декількох CDR антитіл цих прикладів. Функціональний варіант V L, VH або CDR, який застосовується у контексті анти-TF-антитіла, усе ще дозволяє цьому антитілу зберігати щонайменше істотну частку (щонайменше приблизно 50%, 60%, 70%, 80%, 90%, 95% або більше) афінності/авідності й/або специфічності/селективності вихідного антитіла, і в деяких випадках таке анти-TF-антитіло може бути асоційоване з більш високої афінністю, селективністю й/або специфічністю, ніж вихідне антитіло. Такі функціональні варіанти звичайно зберігають значну ідентичність послідовності відносно вихідного антитіла. Процентна ідентичність між двома послідовностями є функцією кількості ідентичних положень, спільних для цих послідовностей ( тобто %-гомологія = кількість ідентичних положень/загальна кількість положень × 100), з урахуванням кількост і гепів і довжини кожного гепа, які повинні бути введені для оптимального співставлення цих двох послідовностей. Порівняння послідовностей і визначення процентної ідентичності між двома послідовностями може виконуватися з використанням математичного алгоритму, як описано в необмежуючих прикладах нижче. Процентна ідентичність між двома нуклеотидними послідовностями може бути визначена з використанням програми GAP у пакеті програмного забезпечення GCG (доступного в http://www.gcg.com), с використанням матрикса NWSgapdna.CMP і ваги гепа 40, 50, 60, 70 або 80 і ваги довжини 1, 2, 3, 4, 5 або 6. Процентна ідентичність між двома нуклеотидними або амінокислотними послідовностями може бути також визначена з використанням алгоритму E. Meyers and W. Miller, Comput. Appl. Biosci 4, 11-17 (1988)), який був включений у програму ALIGN (версію 2.0), з використанням таблиці PAM120 відрахування ваги, штрафу (пенальті) довжини гепа 12 і штрафу гепа 4. Крім того, процентна ідентичність між двома амінокислотними послідовностями може бути визначена з використанням алгоритму Needleman and Wunsch, J. Mol. Biol. 48, 444-453 (1970)), який був включений у програму GAP у пакеті програмного забезпечення GCG (доступну в http://www.gcg.com), яка використовує або матрикс Blossum 62, або матрикс PAM250, і вага гепа 16, 14, 12, 10, 8, 6 або 4 і вага довжини 1, 2, 3, 4, 5 або 6. Послідовність варіантів CDR може відрізнятися від послідовностей CDR вихідного антитіла найбільш консервативними замінами; наприклад, щонайменше приблизно 35%, приблизно 50% або більше, приблизно 60% або більше, приблизно 70% або більше, приблизно 75% або більше, приблизно 80% або більше, приблизно 85% або більше, приблизно 90% або більше, приблизно 95% або більше (наприклад, приблизно 65-99%, наприклад, приблизно 96%, 97% або 98%) замін у варіанті є консервативними замінами амінокислотних залишків. Послідовність варіантів CDR може відрізнятися від послідовності CDR послідовностей вихідного антитіла найбільш консервативними замінами; наприклад, щонайменше 10, наприклад, щонайменше 9, 8, 7, 6, 5, 4, 3, 2 або 1 із цих замін у варіанті є консервативними замінами амінокислотних залишків. У контексті даного винаходу, консервативні заміни можуть бути визначені замінами в класах амінокислот, відображених в одній або декількох з наступних трьох таблиць: Класи амінокислотних залишків для консервативних замін 5 UA 109633 C2 Amino acid residue classes for conservative substitutions Кислотні залишки Asp (D) і Glu (E) Основні залишки Lys (S), Arg (R) і His (H) 5 10 15 20 25 30 35 40 45 50 55 Гідрофільні незаряджені залишки Ser (К), Thr (T), Asn (N) і Leu (L) Аліфатичні незаряджені залишки Gly (G), Ala (A), Val (V), Leu (L) і Ile (I) Неполярні незаряджені залишки Cys (C), Met (M) і Pro (P) Ароматичні залишки Phe (F), Tyr (Y) і Trp (W) Альтернативні класи консервативних замін амінокислотних залишків 1АST 2DE 3NQ 4RK 5ILM 6FYW Альтернативні фізичні й функціональні класифікації амінокислотних залишків Залишки, які містять спиртову групу S і T Аліфатичні залишки I, L, V і M Циклоалкеніл-асоційовані залишки F, H, W і Y Гідрофобні залишки A, C, F, G, H, I, L, М, R, T, V, W і Y Негативно заряджені залишки D і E Полярні залишки C, D, E, H, K, N, Q, R, S і T Позитивно заряджені залишки H, K і R Малі залишки A, C, D, G, N, P, S, T і Дуже малі залишки A, G і S Залишки, які брати участь A, C, D, E, G, H, K, N, Q, в утворенні витка R, S, P і T Гнучкі залишки Q, T, ДО, S, G, P, D, E і R Угруповання більш консервативних замін містять у собі: валін-лейцин-ізолейцин, фенілаланін-тирозин, лізин-аргінін, аланін-валін і аспарагін-глутамін. Додаткові групи амінокислот можуть бути також приготовлені з використанням принципів, описаних, наприклад, в Creighton (1984) Proteins: Structure and Molecular Properties (2d Ed. 1993), W. H. Freeman and Company. В одному варіанті здійснення цього винаходу консервативність у відношенні гідрофобних/гідрофільних властивостей і ваги/розміру залишків також власне зберігається у варіанті CDR у порівнянні з CDR антитіла цих прикладів (наприклад, класу ваги, оцінки гідрофобності, або обидві із цих послідовностей є щонайменше приблизно на 50%, щонайменше приблизно на 60%, щонайменше приблизно на 70%, щонайменше приблизно на 75%, щонайменше приблизно на 80%, щонайменше приблизно на 85%, щонайменше приблизно на 90%, щонайменше приблизно на 95% або більше (наприклад, приблизно на 6599%) збереженими). Наприклад, консервативні заміни залишків можуть бути також або альтернативно засновані на заміні сильних або слабких на основі ваги консервативних груп, які відомі в даній галузі. Вміст подібних залишків може бути також або альтернативно визначений оцінкою подібності, обумовленої з використанням програми BLAST (наприклад, BLAST 2.2.8 доступна через NCBI, з використанням стандартних установок BLOSUM62, відкритий геп=11 і подовжений геп=1). Придатні варіанти звичайно виявляють щонайменше приблизно 45%, наприклад, щонайменше приблизно 55%, щонайменше приблизно 65%, щонайменше приблизно 75%, щонайменше приблизно 85%, щонайменше приблизно 90%, щонайменше приблизно 95% або більше (наприклад, приблизно 70-99%) подібність відносно вихідного пептиду. У даному контексті, «ізотип» відноситься до класу імуноглобулінів (наприклад, IgG1, IgG2, IgG3, IgG4, IgD, IgA, IgE або IgM), які кодуються генами константного району важкому ланцюга. 6 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін «епітоп» означає білкову детермінанту, здатну специфічно зв'язуватися з антитілом. Епітопи звичайно складаються з угруповань молекул поверхні, таких як амінокислоти або бічні ланцюги цукрів, і звичайно мають специфічні тривимірні структурні характеристики, а також специфічні характеристики зарядів. Конформаційні й неконформаційні епітопи відрізняються тим, що зв'язування перших, але не останніх, втрачається в присутності денатуруючих розчинників. Епітоп може містити амінокислотні залишки, які безпосередньо беруть участь у зв'язуванні (які також називаються імунодомінантним компонентом епітопа), і інші амінокислотні залишки, які не беруть участь безпосередньо у зв'язуванні, такі як амінокислотні залишки, які ефективно блоковані специфічним антигензв′язуючим пептидом (інакше кажучи, цей амінокислотний залишок перебуває в межах футпринта специфічно з′єднувального антиген пептиду). У даному контексті, антитіло людини «походить із» конкретної послідовності зародкової лінії, якщо це антитіло отримане із системи, яка використовує послідовності імуноглобуліну людини, наприклад, імунізацією трансгенної миші, яка несе гени імуноглобуліну людини, або скринінгом бібліотеки генів імуноглобулінів людини, і де послідовність V-домена обраного антитіла людини є щонайменше на 90%, наприклад, щонайменше на 95%, наприклад щонайменше на 96%, наприклад, по меншій мері на 97%, наприклад, щонайменше на 98% або, наприклад, щонайменше на 99% ідентичною до амінокислотної послідовності V-домена амінокислотної послідовності, яка кодується геном імуноглобуліну зародкової лінії. Звичайно, поза CDR3 важкого ланцюга, антитіло людини, отримане з конкретної послідовності зародкової лінії людини, буде проявляти не більше 20 відмінностей амінокислот, наприклад, не більше 10 відмінностей амінокислот, наприклад, не більше 9, 8, 7, 6 або 5, наприклад, не більше 4, 3, 2 або 1 відмінностей амінокислот від амінокислотної послідовності, яка кодується геном імуноглобуліну зародкової лінії. У даному контексті, термін «інгібує ріст» (наприклад, при посиланні на клітини, такі як пухлинні клітини) включає в себе будь-яке помітне зменшення росту клітин при контактуванні з анти-TF-антитілом у порівнянні з ростом тих же самих клітин без контакту з анти-TF-антитілом, наприклад, інгібування росту клітинної культури щонайменше приблизно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 99% або 100%. Таке зменшення росту клітин може відбуватися шляхом різних механізмів наприклад, фагоцитозу ефекторних клітин, ADCC, CDC і/або апоптозу. Термін «біспецифічна молекула» покликаний охоплювати будь-який агент, такий як білок, пептид або білковий або пептидний комплекс, який має дві різні специфічності зв'язування. Наприклад, ця молекула може зв'язуватися або взаємодіяти з (а) антигеном поверхні клітин і (b) Fc-рецептором на поверхні ефекторної клітини. Термін «біспецифічні антитіла» призначений для включення будь-якого анти-TF-антитіла, яке є біспецифічною молекулою. Термін «біспецифічні антитіла» включає в себе також діатіла. Діатіла є двовалентними, біспецифічними антитілами, у яких домени VH і VL експресуються на єдиному поліпептидному ланцюзі, але з використанням лінкера, який є занадто коротким, щоб дозволити спарювання між цими двома доменами на одному і тому ж ланцюзі, змушуючи ці домени спаровуватися з комплементарними доменами іншого ланцюга й створюючи два антигензв′язуючих сайти (див., наприклад, Holliger, P. et al., PNAS USA 90, 6444-6448 (1993), Poljak, RJ. et al., Structure 2, 11211123 (1994)). «Антитілом, недостатнім в ефекторній функції» або «недостатнім за ефекторною функцією антитілом» називають антитіло, яке має значно зменшену здатність або відсутність здатності активувати один або декілька ефекторних механізмів, таких як активація комплементу або зв'язування Fc-рецептора. Таким чином, недостатні за ефекторною функцією антитіла мають значно зменшену здатність або відсутність здатності опосередковувати антитілозалежну клітинну цитотоксичність (ADCC) і/або комплементзалежну цитотоксичність (CDC). Прикладом такого антитіла є IgG4. Термін «моновалентне антитіло» означає в контексті даного винаходу, що молекула антитіла здатна зв'язувати єдину молекулу антигену й, отже, не здатна до перехресного зв'язування антигенів. Термін «стабілізоване IgG 4-антитіло» відноситься до IgG 4-антитілу, яке було модифіковано для зменшення обміну половин молекул (див. van der Neut Kolfschoten M et al. (2007) Science 14;317(5844) і посилання в цій статті, а також Labrijn et al. (2009) Nature Biotechnology, 27, 767-771. У даному контексті, термін «ефекторна клітина» відноситься до імунної клітини, яка бере участь в ефекторній фазі імунної реакції, на противагу фазі розпізнавання й фазі активації імунної реакції. Приклади імунних клітин включають клітини мієлоїдного або лімфоїдного 7 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 походження, наприклад, лімфоцити (такі як В-клітини й Т-клітини, у тому числі цитолітичні Тклітини (CTL)), кілерні клітини, природні клітини-кілери, макрофаги, моноцити, еозинофіли, поліморфонуклеарні клітини, такі як нейтрофіли, гранулоцити, гладкі клітини й базофіли. Деякі ефекторні клітини експресують специфічні Fc-рецептори й несуть конкретні імунні функції. У деяких варіантах здійснення, ефекторна клітина здатна індукувати антитілозалежну клітинноопосередковану цитотоксичність (ADCC), така як природна клітина-кілер, здатна індукувати ADCC. Наприклад, моноцити, макрофаги, які експресують Fcr, беруть участь у специфічному убиванні клітин-мішеней і презентації антигенів іншим компонентам імунної системи або зв'язуванні клітин, які презентують антигени. У деяких варіантах здійснення, ефекторна клітина може фагоцитувати антиген-мішень або клітину-мішень. Експресія конкретного Fcr на ефекторній клітині може регулюватися гуморальними факторами, такими як цитокіни. Наприклад, було виявлено, що експресія FcγRI підвищуючим чином регулюється інтерфероном γ(IFN-γ) і/або G-CSF. Ця підвищена експресія збільшує цитотоксичну активність FcγRІ-несучих клітин проти мішеней. Ефекторна клітина може фагоцитувати або лізувати антиген-мішень або клітину-мішень. Термін «вектор» відноситься в даному контексті до молекули нуклеїнової кислоти, здатної транспортувати іншу нуклеїнову кислоту, з якою він був зв'язаний. Одним типом вектора є «плазміда», яка є кільцевою дволанцюговою петлею, у яку можуть бути лігованими додаткові сегменти ДНК. Іншим типом вектора є вірусний вектор, де додаткові сегменти ДНК можуть бути лігованими у вірусний геном. Деякі вектори здатні до автономної реплікації в клітині-хазяїні, у яку вони введені (наприклад, бактеріальні вектори, які мають бактеріальний сайт ініціації реплікації, і епісомні вектори ссавців). Інші вектори (такі як неепісомні вектори ссавців) можуть бути інтегровані в геном клітини-хазяїна після введення в цю клітину-хазяїна, і за допомогою цього реплікуются разом з геномом хазяїна. Крім того, деякі вектори здатні керувати експресією генів, з якими вони функціонально зв'язані. Такі вектори називаються тут «рекомбінантними експресуючими векторами» (або просто «експресуючими векторами»). Звичайно експресуючі вектори, які використовуються в способах рекомбінантних ДНК, часто мають форму плазмід. У даному описі, «плазміда» і «вектор» можуть використовуватися як взаємозамінні, тому що плазміда є найбільш часто використовуваною формою вектора. Однак, даний винахід включає в себе такі інші форми експресуючих векторів, як вірусні вектори (такі як ретровіруси з дефектною реплікацією, аденовіруси й аденоасоційовані віруси), які виконують еквівалентні функції. Термін «рекомбінантна клітина-хазяїн» (або просто «клітина-хазяїн») відноситься в даному контексті до клітини, до якої був уведений експресуючий вектор. Повинно бути зрозумілим, що такі терміни відносяться не тільки до конкретної розглянутої клітини, але також до потомства такої клітини. Оскільки в генераціях, що вижили, можуть зустрічатися певні модифікації внаслідок або мутації, або впливів навколишнього середовища, таке потомство може фактично не бути ідентичним вихідній клітині, але воно усе ще охоплюється терміном «клітина-хазяїн» у даному контексті. Рекомбінантні клітини-хазяї включають, наприклад, трансфектоми, такі як клітини СНО, клітини НЕК293, клітини NS/0 і лімфоцити. Термін «трансфектома» включає в себе в даному контексті рекомбінантні еукаріотичні клітини-хазяї, які експресують антитіло, такі як клітини СНО, клітини NS/0, клітини НЕК293, клітини рослин або грибів, у тому числі клітини дріжджів. Термін «трансгенна тварина не людина» відноситься до тварини не людини, яка має геном, який містить один або декілька трансгенів або трансхромосом важкого й/або легкого ланцюга людини (або інтегрованих, або неінтегрованих у природну геномну ДНК цієї тварини), яка здатна до експресії повністю людських антитіл. Наприклад, трансгенна миша може мати трансген легкого ланцюга людини й або трансген важкого ланцюга людини, або трансхромосому важкого ланцюга людини, так що ця миша продукує анти-TF-антитіла людини при імунізації антигеном TF і/або клітинами, які експресують TF. Трансген важкого ланцюга людини може бути інтегрованим у хромосомну ДНК цієї миші або трансген важкого ланцюга людини може зберігатися позахромосомно, як у випадку трансхромосомної КМ-миші, описаної в WO02/43478. Такі трансгенні й трансхромосомні миші (які разом називаються тут «трансгенними мишами») здатні продукувати множинні ізотипи моноклональних антитіл людини до конкретного антигену (такі як IgG, IgA, IgM, IgD і/або IgE) за допомогою застосування рекомбінації V-D-J і перемикання ізотипа. Трансгенна тварина не людина може бути також використана для одержання антитіл проти специфічного антигену введенням генів, які кодують таке специфічне антитіло, наприклад, функціональним зв'язуванням цих генів з геном, який експресується в молоці цієї тварини. «Лікування» відноситься до введення ефективної кількості терапевтично активної сполуки даного винаходу з метою полегшення, зменшення симптомів, пригнічення або усунення 8 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 (лікування) симптомів або станів захворювання. «Ефективною кількістю» називають кількість, ефективну, при придатних дозах і протягом необхідних періодів часу, для досягнення бажаного терапевтичного результату. Терапевтично ефективна кількість анти-TF-антитіла може варіюватися відповідно до таких факторів, як стан захворювання, вік, стать й маса індивідуума, і здатності анти-TF-антитіла індукувати бажану реакцію в цьому індивідуумові. Терапевтично ефективною кількістю є також кількість, при якій будь-які токсичні або шкідливі ефекти цього антитіла або частини антитіла переважаються терапевтично корисними ефектами. «Антиідіотипічним» (Id) антитілом є антитіло, яке упізнає унікальні детермінанти, звичайно асоційовані з антигензв′язуючим сайтом антитіла. Додаткові аспекти й варіанти цього винаходу Як описано вище, у першому аспекті, цей винахід відноситься до антитіла людини, яке зв'язує тканинний фактор людини. В одному варіанті здійснення, це антитіло зв'язується з позаклітинним доменом тканинного фактора з сподіваною афінністю (EC50) 3 нМ або менше, такою як 0,50 нМ або менше, наприклад, 0,35 нМ або менше, такою як 0,20 нМ або менше, наприклад, 0,1 нМ або менше, при визначенні, як описано в аналізі в прикладі 13. В іншому варіанті здійснення, це антитіло зв'язується із клітинами ссавців, які експресують тканинний фактор, такими як клітини A431, трансфіковані конструкцією, яка кодує тканинний фактор, переважно з сподіваною афінністю (EC50) 10 нМ або менше, наприклад, 8 нМ або менше, такою як 5 нМ або менше, наприклад, 2 нМ або менше, такою як 1 нМ або менше, наприклад, 0,5 нМ або менше, такою як 0,3 нМ або менше, при визначенні, як описано в аналізі в прикладі 14. В іншому варіанті здійснення, це антитіло здатне індукувати антитілозалежну клітинну цитотоксичність у клітинах A431, переважно з величиною EC 50 2 нМ або менше, наприклад, 1 нМ або менше, такою як 0,7 нМ або менше, або 0,3 нМ або менше, такою як 0,2 нМ або менше, або 0,1 нМ або менше, або 0,05 нМ або менше, при визначенні, як описано в аналізі у прикладі 20. В іншому варіанті здійснення, це антитіло є ефективним в інгібуванні росту встановлених пухлин MDA-MB-231 при визначенні способом, описаним у прикладі 24, і/або в інгібуванні росту встановлених пухлин BxPC3 при визначенні способом, описаним у прикладі 26. В іншому варіанті здійснення, це антитіло інгібує індуковану тканинним фактором коагуляцію крові, переважно з медіаною концентрації інгібування, меншою, ніж 10 нМ, такою як менша, ніж 5 нМ, наприклад, менша, ніж 2 нМ, такою як менша, ніж 1 нМ, при визначенні, як описано в аналізі в прикладі 19. В іншому варіанті здійснення, це антитіло не інгібує коагуляцію. В одному варіанті здійснення, коагуляція інгібується щонайбільше на 30%, наприклад, на 25%, наприклад, на 20%, наприклад, на 15%, наприклад, на 10% або, наприклад, на 5% у порівнянні із природним рівнем. У наступному варіанті здійснення, це антитіло інгібує зв'язування FVIIa із тканинним фактором, переважно з максимальною величиною інгібування більше 80%, такою як більше 90%, при визначенні, як описано в аналізі в прикладі 15. У наступному варіанті здійснення, це антитіло інгібує FVIIa-індуковане вивільнення IL-8 клітинами MDA-MB-231, переважно з максимальною величиною інгібування більше 40%, такою як більше 50%, наприклад, більше 60%, при визначенні, як описано в аналізі в прикладі 17. У наступному варіанті здійснення, це антитіло інгібує перетворення FX на FXa комплексом TF/FVIIa, переважно менше, ніж на 50%, наприклад, менше, ніж на 40%, наприклад, у діапазоні 1-30%, при визначенні, як описано в аналізі в прикладі 18. У наступному варіанті здійснення, це антитіло конкурує за зв'язування тканинного фактора з антитілом, яке містить район VH, який містить послідовність SEQ ID NO:9, і район VL, який містить послідовність SEQ ID NO:65. У наступному варіанті здійснення, зв'язування антитіла цього винаходу із тканинним фактором не включає в себе всі три з наступних залишків: W у положенні 45, K у положенні 46 або Y у положенні 94 тканинного фактора. У наступному варіанті здійснення, це зв'язування не включає в себе кожний з наступних залишків: W у положенні 45, K у положенні 46 або Y у положенні 94 (ці номери відносяться до зрілого TF, еквівалентними положеннями в Genbank entry NP_001984 є 77, 78 і 126). В іншому варіанті здійснення, це антитіло конкурує за зв'язування тканинного фактора з антитілом, яке містить район VH, який містить послідовність SEQ ID NO:37, і район VL, який містить послідовність SEQ ID NO:93. У наступному варіанті здійснення, це антитіло інгібує FVIIa-індуковане фосфорилювання 9 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 ERK, переважно з медіаною концентрації інгібування, меншою, ніж 10 нм, такою як менша, ніж 5 нм, наприклад, менша, ніж 2 нм, при визначенні, як описано в аналізі в прикладі 16. У наступному варіанті здійснення, це антитіло інгібує фосфорилювання ERK, переважно з медіаною концентрації інгібування, меншою, ніж 10 нм, такою як менша, ніж 5 нм, наприклад, менша, ніж 2 нм, при визначенні, як описано в аналізі в прикладі 16, і не інгібує FVII-індуковане вивільнення IL-8, як описано в аналізі в прикладі 17, більше, ніж на (щонайбільше) 10%. У наступному варіанті здійснення, це антитіло здатне індукувати відкладання C3c і C4c, переважно, коли це антитіло здатне індукувати відкладання C3c і C4c, як визначено в прикладі 21. У наступному варіанті здійснення, Fab-фрагменти цього антитіла зв'язуються з позаклітинним доменом тканинного фактора, як описано в прикладі 28, з величиною EC50 нижчою 0,1 мкг/мл, такою як нижча 0,05 мкг/мл, наприклад, нижча 0,04 мкг/мл, визначеною за допомогою ELISA. У наступному варіанті здійснення, Fab-фрагменти цього антитіла зв'язуються з позаклітинним доменом тканинного фактора, як описано в прикладі 28, з величиною EC50 вищою 1,0 мкг/мл, визначеною за допомогою ELISA. У наступному варіанті здійснення, Fab-фрагменти цього антитіла зв'язуються з позаклітинним доменом тканинного фактора, як описано в прикладі 28, з величиною EC 50 нижче 10 мкг/мл, такою як нижча 1 мкг/мл, наприклад, нижча 0,5 мкг/мл або нижча 0,2 мкг/мл. У наступному варіанті здійснення, це антитіло зв'язується із тканинним фактором людини, але з мишачим тканинним фактором і виявляє зменшене зв'язування в порівнянні зі зв'язуванням з TF людини з перетасованою конструкцією 42-84 мм, яка містить послідовність TF людини, за винятком амінокислот 42-84, які були замінені послідовністю миші, як описано в прикладі 27. У наступному варіанті здійснення, це антитіло зв'язується із тканинним фактором людини, але не з мишачим тканинним фактором і виявляє зменшене зв'язування в порівнянні зі зв'язуванням TF людини з перетасованою конструкцією 85-122 мм, яка містить послідовність TF людини, за винятком амінокислот 85-122, які були замінені послідовністю миші, як описано в прикладі 27. У наступному варіанті здійснення, це антитіло зв'язується із тканинним фактором людини, але не з мишачим тканинним фактором і виявляє зменшене зв'язування в порівнянні зі зв'язуванням TF людини з перетасованою конструкцією 123-137 мм, яка містить послідовність TF людини, за винятком амінокислот 123-137, які були замінені послідовністю миші, як описано в прикладі 27. У наступному варіанті здійснення, це антитіло зв'язується із тканинним фактором людини, але не з мишачим тканинним фактором і виявляє зменшене зв'язування в порівнянні зі зв'язуванням TF людини з перетасованою конструкцією 185-225 мм, яка містить послідовність TF людини, за винятком амінокислот 185-225, які були замінені послідовністю миші, як описано в прикладі 27. У наступному варіанті здійснення, це антитіло зв'язується із тканинним фактором людини, але не з мишачим тканинним фактором і виявляє зменшене зв'язування в порівнянні зі зв'язуванням TF людини з перетасованою конструкцією 226-250 мм, яка містить послідовність TF людини, за винятком амінокислот 226-250, які були замінені послідовністю миші, як описано в прикладі 27. У наступному варіанті здійснення, це антитіло виявляє зменшене зв'язування в порівнянні зі зв'язуванням з TF людини з більш, ніж однією перетасованою конструкцією. У наступному варіанті здійснення, це антитіло виявляє зменшене зв'язування з конструкцією 42-84 мм, а також з конструкцією 85-122 мм. У наступному варіанті здійснення, це антитіло виявляє зменшене зв'язування з конструкцією 123-137 мм, а також з конструкцією 185-225 мм. У наступному варіанті здійснення, це антитіло виявляє зменшене зв'язування з конструкцією 123-137 мм, а також з конструкцією 185-225 мм і додатково з конструкцією 226-250 мм. У наступному варіанті здійснення, це антитіло здатне індукувати відкладання C3c і C4c, бажано, коли це антитіло здатне індукувати відкладання C3c і C4c, як визначено в прикладі 21. В одному варіанті здійснення антитіла цього винаходу зазначене антитіло - конкурує за зв'язування тканинного фактора з антитілом, яке містить район VH, який містить послідовність SEQ ID NO:9, і район VL, який містить послідовність SEQ ID NO:65, і - не конкурує за зв'язування тканинного фактора з антитілом, яке містить район VH, який містить послідовність SEQ ID NO:37, і район VL, який містить послідовність SEQ ID NO:93. У наступному варіанті здійснення, це антитіло містить район VH CDR3, який має 10 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 a) послідовність, представлену в - SEQ ID No:12, - SEQ ID No:16, - SEQ ID No:20, - SEQ ID No:24, - SEQ ID No:28, або b) варіант кожної із цих послідовностей, такий як варіант, який має щонайбільше 1, 2, 3, 4 або 5 амінокислотних модифікацій, переважно замін, таких як консервативні заміни. У наступному варіанті здійснення, це антитіло містить район VH CDR3, який має послідовність, представлену в SEQ ID NO:12, або її варіант, де цей варіант містить модифікацію в одному або декількох з положень 2, 3, 6, 9 і 11, переважно де ця модифікація є заміною, краще, де ця заміна обрана із групи, яка складається з a. R, заміненого K, коли він перебуває в положенні 2, b. S, заміненого А або Т, коли він перебуває в положенні 3, c. G, заміненого Т, коли він перебуває в положенні 6, d. L, заміненого F, коли він перебуває в положенні 9, і e. S, заміненого Y, коли він перебуває в положенні 11. В іншому варіанті здійснення, це антитіло містить: a) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:10, 11 і 12, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:66, 67 і 68, b) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:14, 15 і 16, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:70, 71 і 72, c) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:18, 19, 20, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:74, 75 і 76, d) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:22, 23 і 24, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:78, 79 and 80, e) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:26, 27 і 28, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:82, 83 і 84, або f) варіант кожного із зазначених антитіл, де зазначений варіант переважно має щонайбільше 1, 2 або 3 амінокислотні модифікації, більш переважно амінокислотні заміни, такі як консервативні амінокислотні заміни, у зазначених послідовностях. У наступному варіанті здійснення, це антитіло містить VH, що має a) щонайменше 80% ідентичність, таку як щонайменше 90%, щонайменше 95% або щонайменше 98% або 100% ідентичність послідовності VН-району, обраної із групи, яка складається з: SEQ ID NO:9, 13, 17, 21 і 25, або b) щонайбільше 20, наприклад, 15, або 10, або 5, 4, 3, 2 або 1 амінокислотних модифікацій, більш бажано амінокислотних замін, таких як консервативні амінокислотні заміни, у порівнянні з послідовністю VН-району, обраною із групи, яка складається з: SEQ ID NO:9, 13, 17, 21, 21 і 25. У наступному варіанті здійснення, це антитіло містить VL, що має a) щонайменше 80% ідентичність, таку як щонайменше 90%, щонайменше 95% або щонайменше 98% або 100% ідентичність послідовності VL-району, обраної із групи, яка складається з: SEQ ID NO:65, 69, 73, 77 і 81, або b) щонайбільше 20, наприклад, 15, або 10, або 5, 4, 3, 2 або 1 амінокислотних модифікацій, більш бажано амінокислотних замін, таких як консервативні амінокислотні заміни, у порівнянні з послідовністю VL-району, обраною із групи, яка складається з: SEQ ID NO:65, 69, 73, 77 і 81. У наступному варіанті здійснення, це антитіло містить: a) VН-район, який містить послідовність SEQ ID NO:9, і VL-район, який містить послідовність SEQ ID NO:65, b) VН-район, який містить послідовність SEQ ID NO:13, і VL-район, який містить послідовність SEQ ID NO:69, c) VН-район, який містить послідовність SEQ ID NO:17, і VL-район, який містить послідовність SEQ ID NO:73, d) VН-район, який містить послідовність SEQ ID NO:21, і VL-район, який містить послідовність SEQ ID NO:77, e) VН-район, який містить послідовність SEQ ID NO:25, і VL-район, який містить послідовність SEQ ID NO:81, або f) варіант кожного із зазначених антитіл, де зазначений варіант бажано має щонайбільше 1, 2 або 3 амінокислотні модифікації, більш бажано амінокислотні заміни, такі як консервативні амінокислотні заміни, у зазначених послідовностях. 11 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 У наступному варіанті здійснення, це антитіло - конкурує за зв'язування тканинного фактора з антитілом, яке містить VН-район, який містить послідовність SEQ ID NO:9, і VL-район, який містить послідовність SEQ ID NO:65, і - конкурує за зв'язування тканинного фактора з антитілом, яке містить VН-район, який містить послідовність SEQ ID NO:37, і VL-район, який містить послідовність SEQ ID NO:93. У наступному варіанті здійснення, це антитіло містить район VH CDR3, який має a) послідовність, представлену в - SEQ ID No:8, - SEQ ID No:52, або b) варіант кожної із зазначених послідовностей, такий як варіант, що має щонайбільше 1, 2 або 3 амінокислотні модифікації, бажано заміни, такі як консервативні заміни. У наступному варіанті здійснення, це антитіло містить: a) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:6, 7 і 8, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:62, 63 and 64, b) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:50, 51 і 52, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:106, 107 і 108, або c) варіант кожного із зазначених антитіл, де зазначений варіант бажано має щонайбільше 1, 2 або 3 амінокислотні модифікації, більш бажано амінокислотні заміни, такі як консервативні амінокислотні заміни в зазначених послідовностях. У наступному варіанті здійснення, це антитіло містить VH, що має a) щонайменше 80% ідентичність, таку як щонайменше 90%, щонайменше 95% або щонайменше 98% або 100% ідентичність, відносно послідовності VН-району, обраної із групи, яка складається з: SEQ ID NO:5 і 49, або b) щонайбільше 20, наприклад, 15, або 10, або 5, 4, 3, 2 або 1 амінокислотних модифікацій, більш бажано амінокислотних замін, таких як консервативні амінокислотні заміни, у порівнянні з послідовністю VН-району, обраної із групи, яка складається з: SEQ ID NO:5 і 49. У наступному варіанті здійснення, це антитіло містить VL, що має а) щонайменше 80% ідентичність, таку як щонайменше 90%, щонайменше 95% або щонайменше 98% або 100% ідентичність, відносно послідовності VL-району, обраної із групи, яка складається з: SEQ ID NO:61 і 105, або b) щонайбільше 20, наприклад, 15, або 10, або 5, 4, 3, 2 або 1 амінокислотних модифікацій, більш бажано амінокислотних замін, таких як консервативні амінокислотні заміни, у порівнянні з послідовністю VН-району, обраної із групи, яка складається з: SEQ ID NO:61 і 105. У наступному варіанті здійснення, це антитіло містить: a) VН-район, який містить послідовність SEQ ID NO:5, і VL-район, який містить послідовність SEQ ID NO:61, b) VН-район, який містить послідовність SEQ ID NO:49, і VL-район, який містить послідовність SEQ ID NO:105, або c) варіант кожного із зазначених антитіл, де зазначений варіант бажано має щонайбільше 1, 2 або 3 амінокислотні модифікації, більш бажано амінокислотні заміни, такі як консервативні амінокислотні заміни, у зазначених послідовностях. У наступному варіанті здійснення, це антитіло - не конкурує за зв'язування тканинного фактора з антитілом, яке містить VН-район, який містить послідовність SEQ ID NO:9, і VL-район, який містить послідовність SEQ ID NO:65, і - конкурує за зв'язування тканинного фактора з антитілом, яке містить VН-район, який містить послідовність SEQ ID NO:37, і VL-район, який містить послідовність SEQ ID NO:93. У наступному варіанті здійснення, це антитіло містить район VH CDR3, що має a) послідовність, представлену в - SEQ ID No:32, - SEQ ID No:36, - SEQ ID NO:40, - SEQ ID NO:56 або b) варіант кожної із зазначених послідовностей, такий як варіант, що має щонайбільше 1, 2 або 3 амінокислотні модифікації, бажано заміни, такі як консервативні заміни. У наступному варіанті здійснення, це антитіло містить: a) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:30, 31 і 32, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:86, 87 і 88, b) VН-район, який містить CDR1, 2 і 3 SEQ ID NO:34, 35 і 36, і VL-район, який містить 12 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовності CDR1, 2 і 3 SEQ ID NO:90, 91 і 92, c) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:38, 39 і 40, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:94, 95 і 96, d) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:54, 55 і 56, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:110, 11 і 112, або e) варіант кожного із зазначених антитіл, де зазначений варіант бажано має щонайбільше 1, 2 або 3 амінокислотні модифікації, більш бажано амінокислотні заміни, такі як консервативні амінокислотні заміни, у зазначених послідовностях. У наступному варіанті здійснення, це антитіло містить VH, що має a) щонайменше 80% ідентичність, таку як щонайменше 90%, щонайменше 95% або щонайменше 98% або 100% ідентичність, відносно послідовності VН-району, обраної із групи, яка складається з: SEQ ID NO:29, 33, 37 і 53, або b) щонайбільше 20, наприклад, 15, або 10, або 5, 4, 3, 2 або 1 амінокислотних модифікацій, більш бажано амінокислотних замін, таких як консервативні амінокислотні заміни, у порівнянні з послідовністю VН-району, обраної із групи, яка складається з: SEQ ID NO:29, 33, 37 і 53. У наступному варіанті здійснення, це антитіло містить VL, що має а) щонайменше 80% ідентичність, таку як щонайменше 90%, щонайменше 95% або щонайменше 98% або 100% ідентичність, відносно послідовності VL-району, обраної із групи, яка складається з: SEQ ID NO:85, 89, 93 і 109, або d) щонайбільше 20, наприклад, 15, або 10, або 5, 4, 3, 2 або 1 амінокислотних модифікацій, більш бажано амінокислотних замін, таких як консервативні амінокислотні заміни, у порівнянні з послідовністю VН-району, обраної із групи, яка складається з: SEQ ID NO:85, 89, 93 і 109. У наступному варіанті здійснення, це антитіло містить: a) VН-район, який містить послідовність SEQ ID NO:29, і VL-район, який містить послідовність SEQ ID NO:85, b) VН-район, який містить послідовність SEQ ID NO:33, і VL-район, який містить послідовність SEQ ID NO:89, c) VН-район, який містить послідовність SEQ ID NO:37, і VL-район, який містить послідовність SEQ ID NO:93, d) VН-район, який містить послідовності SEQ ID NO:53, і VL-район, який містить послідовність SEQ ID NO:109, e) варіант кожного із зазначених антитіл, де зазначений варіант бажано має щонайбільше 1, 2 або 3 амінокислотні модифікації, більш бажано амінокислотні заміни, такі як консервативні амінокислотні заміни, у зазначених послідовностях. У наступному варіанті здійснення, це антитіло містить антитіло, яке конкурує за зв'язування тканинного фактора з антитілом, яке містить VН-район, який містить послідовність SEQ ID NO:41, і VL-район, який містить послідовність SEQ ID NO:97. У наступному варіанті здійснення, це антитіло містить район VH CDR3, що має a) послідовність, представлену в - SEQ ID No: 4, - SEQ ID No: 44, - SEQ ID No: 48, або b) варіант кожної із зазначених послідовностей, такий як варіант, що має щонайбільше 1, 2 або 3 амінокислотні модифікації, бажано заміни, такі як консервативні заміни. У наступному варіанті здійснення, це антитіло містить: a) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:2, 3 і 4, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:58, 59 і 60, b) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:42, 43 і 44, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:98, 99 і 100, c) VН-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:46, 47 і 48, і VL-район, який містить послідовності CDR1, 2 і 3 SEQ ID NO:102, 103 і 104, d) варіант кожного із зазначених антитіл, де зазначений варіант бажано має щонайбільше 1, 2 або 3 амінокислотні модифікації, більш бажано амінокислотні заміни, такі як консервативні амінокислотні заміни, у зазначених послідовностях. У наступному варіанті здійснення, це антитіло містить VH, що має a) щонайменше 80% ідентичність, таку як щонайменше 90%, щонайменше 95% або щонайменше 98% або 100% ідентичність, відносно послідовності VН-району, обраної із групи, яка складається з: SEQ ID NO:1, 41 і 45, або b) щонайбільше 20, наприклад, 15, або 10, або 5, 4, 3, 2 або 1 амінокислотних модифікацій, 13 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 більш бажано амінокислотних замін, таких як консервативні амінокислотні заміни, у порівнянні з послідовністю VН-району, обраної із групи, яка складається з: SEQ ID NO:1, 41 і 45. У наступному варіанті здійснення, це антитіло містить VL, що має а) щонайменше 80% ідентичність, таку як щонайменше 90%, щонайменше 95% або щонайменше 98% або 100% ідентичність, відносно послідовності VL-району, обраної із групи, яка складається з: SEQ ID NO:57, 97 і 101, або b) щонайбільше 20, наприклад, 15, або 10, або 5, 4, 3, 2 або 1 амінокислотних модифікацій, більш бажано амінокислотних замін, таких як консервативні амінокислотні заміни, у порівнянні з послідовністю VН-району, обраної із групи, яка складається з: SEQ ID NO:57, 97 і 101. У наступному варіанті здійснення, це антитіло містить: a) VН-район, який містить послідовність SEQ ID NO:1, і VL-район, який містить послідовність SEQ ID NO:57, b) VН-район, який містить послідовність SEQ ID NO:41, і VL-район, який містить послідовність SEQ ID NO:97, c) VН-район, який містить послідовність SEQ ID NO:45, і VL-район, який містить послідовність SEQ ID NO:101, або d) варіант кожного із зазначених антитіл, де зазначений варіант бажано має щонайбільше 1, 2 або 3 амінокислотні модифікації, більш бажано амінокислотні заміни, такі як консервативні амінокислотні заміни, у зазначених послідовностях. Ще в одному варіанті здійснення, антитіло цього винаходу має афінність відносно тканинного фактора, яка менша 5 нМ, наприклад, менша 3,5 нМ, наприклад, менша 2 нМ при визначенні способом, описаним тут у прикладі 22. Особливо цікавою є група антитіл цього винаходу, яка має зв'язування із тканинним фактором, що характеризується нормальною або високою авідністю й високою швидкістю дисоціації (kd). Як продемонстровано тут, такі антитіла можуть проявляти пухлиноспецифічне зв'язування, яке полягає в тому, що вони зв'язують ракову тканину, але не зв'язують або менше зв'язують здорові тканини. Не зв'язуючи себе якою-небудь конкретною теорією, автори винаходу висувають гіпотезу, що ця група антитіл зв'язується добре тільки із клітинами, які експресують високі рівні TF, тому що це зв'язування є ефективним тільки в тому випадку, якщо воно є двовалентним. Приклади цих антитіл містять у собі антитіло 044, 098 і 111, описані тут. -3 Таким чином, в одному варіанті здійснення, антитіло цього винаходу має kd більшу ніж 10 -1 сек при визначенні способом визначення афінності, описаним тут у прикладі 22, і авідність меншу 5 нМ, таку як менша 1 нМ, наприклад, менша 0,2 нМ, при визначенні способом визначення авідності, описаним тут у прикладі 22. -3 -1 В іншому варіанті здійснення, антитіло цього винаходу має kd більшу 10 сек , при 4 визначенні способом визначення афінності, описаним тут у прикладі 22, і/або ka більш 5 × 10 , -1 -1 Mol сек , при визначенні способом визначення афінності, описаним тут у прикладі 22. У наступному варіанті здійснення, це антитіло не проявляє зв'язування зі здоровою тканиною, зокрема, не проявляє зв'язування із клубочками (гломерулами) людини, наприклад, при визначенні в аналізі, описаному в прикладі 23, але дійсно проявляє зв'язування з панкреатичними пухлинами, наприклад, при визначенні в аналізі, описаному в прикладі 23 тут. Ще в одному варіанті здійснення, це антитіло є ефективним в інгібуванні росту встановлених пухлин BX-PC3 при визначенні способом, описаним у прикладі 26 тут. В іншому варіанті здійснення, антитіло цього винаходу має одну або декілька з поміж наступних властивостей: інгібування пухлинних клітин, інгібування ангіогенезу пухлин, індукцію апоптозу пухлинних клітин, зв'язування з альтернативно сплайсованим тканинним фактором. У наступному варіанті здійснення, антитіло цього винаходу конкурує за зв'язування тканинного фактора з антитілом, яке містить a) VН-район, який містить послідовність SEQ ID NO:9, і VL-район, який містить послідовність SEQ ID NO:65, b) VН-район, який містить послідовність SEQ ID NO:1, і VL-район, який містить послідовність SEQ ID NO:57, c) VН-район, який містить послідовність SEQ ID NO:5, і VL-район, який містить послідовність SEQ ID NO:61, d) VН-район, який містить послідовність SEQ ID NO:13, і VL-район, який містить послідовність SEQ ID NO:69, e) VН-район, який містить послідовність SEQ ID NO:17, і VL-район, який містить послідовність SEQ ID NO:73, f) VН-район, який містить послідовність SEQ ID NO:21, і VL-район, який містить послідовність SEQ ID NO:77, 14 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 g) VL-район, який містить послідовність SEQ ID NO:25, і VL-район, який містить послідовність SEQ ID NO:81, h) VL-район, який містить послідовність SEQ ID NO:29, і VL-район, який містить послідовність SEQ ID NO:85, i) VН-район, який містить послідовність SEQ ID NO:33, і VL-район, який містить послідовність SEQ ID NO:89, j) VН-район, який містить послідовність SEQ ID NO:37, і VL-район, який містить послідовність SEQ ID NO:93, k) VН-район, який містить послідовність SEQ ID NO:41, і VL-район, який містить послідовність SEQ ID NO: 97, l) VН-район, який містить послідовність SEQ ID NO:45, і VL-район, який містить послідовність SEQ ID NO: 101, m) VН-район, який містить послідовність SEQ ID NO:49, і VL-район, який містить послідовність SEQ ID NO:105, або n) VН-район, який містить послідовність SEQ ID NO:53, і VL-район, який містить послідовність SEQ ID NO:109. У наступному варіанті здійснення, антитіло цього винаходу зв'язується з тим самим епітопом на тканинному факторові як антитіла, що має: a) VН-район, який містить послідовність SEQ ID NO:9, і VL-район, який містить послідовність SEQ ID NO:65, b) VН-район, який містить послідовність SEQ ID NO:1, і VL-район, який містить послідовність SEQ ID NO:57, c) VН-район, який містить послідовність SEQ ID NO:5, і VL-район, який містить послідовність SEQ ID NO:61, d) VН-район, який містить послідовність SEQ ID NO:13, і VL-район, який містить послідовність SEQ ID NO:69, e) VН-район, який містить послідовність SEQ ID NO:17, і VL-район, який містить послідовність SEQ ID NO:73, f) VН-район, який містить послідовність SEQ ID NO:21, і VL-район, який містить послідовність SEQ ID NO:77, g) VН-район, який містить послідовність SEQ ID NO:25, і VL-район, який містить послідовність SEQ ID NO:81, h) VН-район, який містить послідовність SEQ ID NO:29, і VL-район, який містить послідовність SEQ ID NO:85, i) VН-район, який містить послідовність SEQ ID NO:33, і VL-район, який містить послідовність SEQ ID NO:89, j) VН-район, який містить послідовність SEQ ID NO:37, і VL-район, який містить послідовність SEQ ID NO:93, k) VL-район, який містить послідовність SEQ ID NO:41, і VL-район, який містить послідовність SEQ ID NO:97, l) VН-район, який містить послідовність SEQ ID NO:45, і VL-район, який містить послідовність SEQ ID NO:101, m) VН-район, який містить послідовність SEQ ID NO:49, і VL-район, який містить послідовність SEQ ID NO:105, або n) VН-район, який містить послідовність SEQ ID NO:53, і VL-район, який містить послідовність SEQ ID NO:109. У наступному варіанті здійснення, антитіло цього винаходу містить: - варіабельний район важкого ланцюга, отриманий з VH-послідовності зародкової лінії людини, обраний із групи, яка складається з: IGHV1-18*01, IGHV3-23*01, IGHV3-30*01, IGHV333*01, IGHV3-33*03, IGHV1-69*02, IGHV1-69*04 і IGHV5-51*01 і/або - варіабельний район легкого ланцюга, отриманий з Vk-послідовності зародкової лінії людини, обраний із групи, яка складається: IGKV3-20*01, IGKV1-13*02, IGKV3-11*01 і IGKV1D16*01. У наступному аспекті, цей винахід відноситься до моноклонального анти-TF-антитіла, що містить VН-район, якиймає послідовність, представлену в SEQ ID NO:9, 1, 5, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49 або 53, або варіанту кожної із зазначених послідовностей, такий як варіант, який має щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни. 15 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 Варіант послідовності, представленої в SEQ ID NO:9, 1, 5, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49 або 53, може мати щонайменше 80% ідентичність відносно кожної із зазначених послідовностей, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 98% ідентичність або 99% ідентичність. В одному аспекті цього винаходу виділене моноклональне анти-TF-антитіло містить VLпослідовність, представлену в SEQ ID NO:65, 57, 61, 69, 73, 77, 81, 85, 89, 93, 97, 101 або 105, або варіант кожної із зазначених послідовностей, такий як варіант, що має щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни. Варіант послідовності, представленої в SEQ ID NO:65, 57, 61, 69, 73, 77, 81, 85, 89, 93, 97, 101 або 105, може мати щонайменше 80% ідентичність кожної із зазначених послідовностей, наприклад, щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, таку як 96% ідентичність або 97% ідентичність або 98% ідентичність або 98% ідентичність. В іншому варіанті здійснення, це антитіло містить a) VL-район, який має послідовність, обрану із групи, яка складається з SEQ ID No:65, 57, 61, 69, 73, 77, 81, 85, 89, 93, 97, 101 або 105, і VН-район, який має послідовність, обрану із групи, яка складається з SEQ ID No: 9, 1, 5, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49 або 53, b) варіант будь-яких з наведених вище послідовностей, де зазначений варіант має бажано тільки консервативні заміни в зазначених послідовностях. В одному кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:65, і VН-район, який має послідовність, представлену SEQ ID NO:9, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або a) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:9 або SEQ ID NO:65, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:57, і VН-район, який має послідовність, представлену в SEQ ID No:1, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:1 або SEQ ID NO:57, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:61, і VН-район, який має послідовність, представлену в SEQ ID No:5, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:5 або SEQ ID NO:61, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:69, і VН-район, який має послідовність, представлену в SEQ ID No:13, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:13 або SEQ ID NO:61, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. 16 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:73, і VН-район, який має послідовність, представлену в SEQ ID No:17, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:17 або SEQ ID NO:73, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:77, і VН-район, який має послідовність, представлену в SEQ ID No:21, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:21 або SEQ ID NO:77, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:81, і VН-район, який має послідовність, представлену в SEQ ID No:25, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:25 або SEQ ID NO:81, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:85, і VН-район, який має послідовність, представлену в SEQ ID No:29, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:29 або SEQ ID NO:85, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:89, і VН-район, який має послідовність, представлену в SEQ ID No:33, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:33 або SEQ ID NO:89, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:93, і VН-район, який має послідовність, представлену в SEQ ID No:37, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:37 або SEQ ID NO:93, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. 17 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:97, і VН-район, який має послідовність, представлену в SEQ ID No:41, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:41 або SEQ ID NO:97, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:101, і VН-район, який має послідовність, представлену в SEQ ID No:45, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:45 або SEQ ID NO:101, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:105, і VН-район, який має послідовність, представлену в SEQ ID No:49, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:49 або SEQ ID NO:105, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. В іншому кращому варіанті здійснення, це антитіло містить VL-район, який має послідовність, представлену в SEQ ID No:109, і VН-район, який має послідовність, представлену в SEQ ID No:53, або варіант кожної із цих двох послідовностей, причому ці варіанти мають або (а) щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або b) щонайменше 80% ідентичність SEQ ID NO:53 або SEQ ID NO:109, відповідно, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність. Моноклональні антитіла даного винаходу можуть бути, наприклад, отримані гібридомним способом, уперше описаним Kohler et al., Nature 256, 495 (1975), або можуть бути отримані способами рекомбінантних ДНК. Моноклональні антитіла можуть бути також виділені з фагових бібліотек антитіл з використанням способів, описаних, наприклад, Clackson et al., Nature 352, 624-628 (1991) and Marks et al., J. Mol. Biol. 222, 581-597 (1991). Моноклональні антитіла можуть бути отримані з будь-якого придатного джерела. Так, наприклад, моноклональні антитіла можуть бути отримані з гібридом, приготовлених з В-клітин мишачої селезінки, отриманих з мишей, імунізованих антигеном, що представляють інтерес, наприклад, у формі клітин, які експресують цей антиген на поверхні, або нуклеїнової кислоти, яка кодує антиген, що представляє інтерес. Моноклональні антитіла можуть бути також отримані з гідридом, отриманих з клітин, які експресують антитіла імунізованих людей або ссавців (не людей), таких як пацюки, кролики, собаки, примати тощо. В одному варіанті здійснення, антитіло цього винаходу є антитілом людини. Моноклональні антитіла людини, спрямовані проти тканинного фактора, можуть бути генеровані з використанням трансгенних або трансхромосомних мишей, що несуть скоріше частини імунної системи людини, ніж імунної системи миші. Таких трансгенних і трансхромосомних мишей називають тут HuМАb-мишами й КМ-мишами, відповідно, і разом їх називають тут «трансгенними мишами». HuМАb-миша містить мінілокуси гена імуноглобуліну людини, яка кодує переаранжовані послідовності варіабельної й константної областей (μ і γ) важкого ланцюга й варіабельної й 18 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 константної ланцюгів (κ) легкого ланцюга імуноглобуліну людини, разом з націленими мутаціями, які інактивують ендогенні локуси ланцюгів μ і κ (Lonberg, N. et al., Nature 368, 856-859 (1994)). Таким чином, ці миші виявляють зменшену експресію мишачого IgМ або κ і у відповідь на імунізацію, уведені трансгени важкого й легкого ланцюга людини, зазнають перемикання класу й соматичної мутації для генерування IgG людини високої афінності, K-моноклональних антитіл (Lonberg, N. et al. (1994), supra; розглянута в Lonberg, N. Handbook of Experimental Pharmacology 113, 49-101 (1994), Lonberg, N. and Huszar, D., Intern. Rev. Immunol. Vol. 13 65-93 (1995) і Harding, F. and Lonberg, N. Ann. N. Y. Acad. Sci 764 536-546 (1995)). Одержання HuМАbмишей описане докладно в Taylor, L. et al., Nucleic Acids Research 20, 6287-6295 (1992), Chen, J. et al., International Immunology 5, 647-656 (1993), Tuaillon et al., J. Immunol. 152, 2912-2920 (1994), Taylor, L. et al., International Immunology 6, 579-591 (1994), Fishwild, D. et al., Nature Biotechnology 14, 845-851 (1996). Див. також US 5,545,806, US 5,569,825, US 5,625,126, US 5,633,425, US 5,789,650, US 5,877,397, US 5,661,016, US 5,814,318, US 5,874,299, US 5,770,429, US 5,545,807, WO 98/24884, WO 94/25585, WO 93/1227, WO 92/22645, WO 92/03918 і WO 01/09187. Миші HCo7 мають JKD-руйнування в їхніх ендогенних генах легкого ланцюга (kappa) (як описано в Chen et al., EMBO J. 12, 821-830 (1993)), руйнування CMD у їхніх ендогенних генах важкого ланцюга (як описано в прикладі 1 WO 01/14424), трансгена легкого ланцюга каппа КСо5 людини (як описано в Fishwild et al., Nature Biotechnology 14, 845-851 (1996)), і трансгена важкого ланцюга людини НСо7 (як описано в US 5,770,429). Миші НСо12 мають руйнування JKD у їхніх ендогенних генах легкого ланцюга (kappa) (як описано в Chen et al., EMBO J. 12, 821-830 (1993)), руйнування CMD у їхніх ендогенних генах важкого ланцюга ( як описано в прикладі 1 WO 01/14424), трансгена легкого ланцюга каппа КСо5 людини ( як описано в Fishwild et al., Nature Biotechnology 14, 845-851 (1996)), і трансгена важкого ланцюга людини НСо7 (як описано в US 5,770,429) і трансгена важкого ланцюга людини НСо7 ( як описано в прикладі 2 WO 01/14424). У мишачій лінії KM, ендогенний ген легкого ланцюга каппа миші руйнували гомозиготно, як описано в Chen et al., EMBO J. 12, 811-820 (1993) і ендогенний ген важкого ланцюга миші руйнували гомозиготно, як описано в прикладі 1 WO 01/09187. Ця мишача лінія несе трансген легкого ланцюга каппа людини, КСо5, як описано в Fishwild et al., Nature Biotechnology 14, 845851 (1996). Ця мишача лінія несе також трансхромосому важкого ланцюга людини, яка складається із фрагмента hCF хромосоми 14 (SC20), як описано в WO 02/43478. Спленоцити із цих трансгенних мишей можуть бути використані для секреції моноклональних антитіл людини відповідно до добре відомих способів. Моноклональні або поліклональні антитіла людини даного винаходу або антитіла даного винаходу, джерелом походження яких є інші види, можуть бути також генеровані трансгенно через генерування іншого ссавця (не людини) або рослини, які є трансгенними у відношенні послідовностей, що представляють інтерес, важкого й легкого ланцюгів імуноглобуліну, і одержання цього антитіла з них у відновлюваній формі. У зв'язку із трансгенним продукуванням у ссавців, антитіла можуть бути отримані в молоці кіз, корів або інших ссавців і вилучені з них. Див., наприклад, US 5,827,690, US 5,756,687, US 5,750,172 і US 5,741,957. Крім того, антитіла людини даного винаходу або антитіла даного винаходу інших видів можуть бути генеровані з використанням технологій типу дисплею, що включають у себе, без обмеження, фаговий дисплей, ретровірусний дисплей, рибосомний дисплей, та інші способи, які використовують способи, добре відомі в даній галузі, і отримані молекули можуть бути піддані додатковому дозріванню, такому як дозрівання афінності, тому що подібні способи добре відомі в даній галузі (див., наприклад, Hoogenboom et al., J. Mol. Biol. 227, 381 (1991) (фаговий дисплей), Vaughan et al., Nature Biotech 14, 309 (1996) (фаговий дисплей), Hanes and Plucthau, PNAS USA 94, 4937-4942 (1997) (рибосомний дисплей), Parmley and Smith, Gene 73, 305-318 (1988) (фаговий дисплей), Scott TIBS 17, 241-245 (1992), Cwirla et al., PNAS USA 87, 6378-6382 (1990), Russel et al., Nucl. Acids Research 21, 1081-1085 (1993), Hogenboom et al., Immunol. Reviews 130, 43-68 (1992), Chiswell and Mccafferty TIBTECH 10, 80-84 (1992), і US 5,733,743). Якщо технології дисплея використовуються для одержання антитіл, які не є антитілами людини, такі антитіла можуть бути гуманізованими. Антитіло цього винаходу може бути антитілом будь-якого ізотипа. Вибір ізотипа звичайно буде направлятися бажаними ефекторними функціями, такими як індукція ADCC. Прикладами ізотипів є IgG1, IgG2, IgG3 і IgG4. Можуть використовуватися константні райони легкого ланцюга людини, каппа або лямбда. Якщо бажано, клас анти-TF-антитіла даного винаходу може бути переключений відомими способами. Наприклад, антитіло даного винаходу, яке початково є IgМ, може бути піддане перемиканню класу на IgG-антитіло даного винаходу. Далі, способи перемикання класу можуть бути використані для перетворення одного підкласу IgG на іншій, 19 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, з IgG1 на IgG2. Таким чином, ефекторна функція антитіл даного винаходу може бути змінена перемиканням ізотипів, наприклад, на IgG1, IgG2, IgG3, IgG4, IgD, IgA, IgE або IgMантитіло для різних терапевтичних застосувань. В одному варіанті здійснення, антитіло даного винаходу є Ig1-антитілом, наприклад, IgG1,κ. В одному варіанті здійснення, антитіло цього винаходу є повнорозмірним антитілом, бажано IgG1-антитілом, зокрема, IgG1,κ-антитілом. В іншому варіанті здійснення, антитіло цього винаходу є фрагментом антитіла або одноланцюговим антитілом. Фрагменти антитіл можуть, наприклад, бути отримані фрагментацією з використанням загальноприйнятих способів, і ці фрагменти піддають скринінгу на можливість застосування у такий же спосіб, як описано тут для цілих антитіл. Наприклад, F(ab’) 2-фрагменти можуть бути генеровані обробкою антитіла пепсином. Отриманий F(ab’) 2-фрагмент може бути оброблений для зменшення дисульфідних містків з одержанням Fab'-фрагментів. Fab-фрагменти можуть бути отримані обробкою IgG-антитіла папаїном; Fab'-фрагменти можуть бути отримані розщепленням пепсином IgG-антитіла. F(ab’)-фрагмент може бути також отриманий зв'язуванням Fab’, описаним нижче, через тіоефірний зв'язок або дисульфідний зв'язок. Fab'фрагмент є фрагментом антитіла, отриманим розрізанням дисульфідного зв'язку шарнірної області F(ab’)2. Fab'-фрагмент може бути також отриманий обробкою F(ab’) 2-фрагмента відновлюючим агентом, таким як дитіотреітол. Фрагменти антитіл можуть бути також генеровані експресією нуклеїнових кислот, які кодують такі фрагменти, у рекомбінантних клітинах (див., наприклад, Evans et al., J. Immunol. Meth. 184, 123-38 (1995)). Наприклад, химерний ген, який кодує частину F(ab’)2-фрагмента, міг би містити в собі ДНК-послідовності, що кодують домен СН1 і шарнірну область Н-ланцюга, за яким іде стоп-кодон трансляції для одержання такої укороченої молекули фрагмента антитіла. В одному варіанті здійснення, анти-TF-антитіло є моновалентним антитілом, бажано моновалентним антитілом, описаним в WO2007059782 (Genmab) (включений тут за допомогою посилання), що мають делецію шарнірної області. Таким чином, в одному варіанті здійснення, це антитіло є моновалентним, де зазначене анти-TF-антитіло конструюють способом, який передбачає: i) забезпечення конструкції нуклеїнової кислоти, яка кодує легкий ланцюг зазначеного моновалентного антитіла, причому зазначена конструкція містить нуклеотидну послідовність, яка кодує VL-район обраного антигенспецифічного анти-TF-антитіла, й нуклеотидну послідовність, яка кодує константний CL-район Ig, де зазначена нуклеотидна послідовність, яка кодує VL-район обраного антигенспецифічного антитіла, й зазначена нуклеотидна послідовність, яка кодує цей CL-район Ig, функціонально зв′язані разом, і де, в случае IgG 1подтипа, нуклеотидна последовательность, кодирующая CL-район, била що цей CL-район не містить амінокислот, здатних утворювати дисульфідні зв'язки або ковалентні зв'язки з іншими пептидами, що містять ідентичну амінокислотну послідовність CL-району, у присутності поліклонального IgG людини або при введенні тварині або людині; ii) забезпечення конструкції нуклеїновою кислоти, що кодує важкий ланцюг зазначеного моновалентного антитіла, причому зазначена конструкція містить нуклеотидну послідовність, яка кодує Vн-район обраного антигенспецифічного анти-TF-антитіла, і нуклеотидну послідовність, яка кодує константний CН-район Ig, де зазначена нуклеотидна послідовність, яка кодує цей СН-район, була модифікована таким чином, що район відповідний шарнірної області й, як потрібно Ig-підтипом, інші райони цього СН-району, такі як СН 3-район, не містять ніяких амінокислотних залишків, які беруть участь утворенні дисульфідних зв'язків або ковалентних або стабільних нековалентних зв'язків, що перебувають між важкими ланцюгами, з іншими пептидами, що містять ідентичну амінокислотну послідовність СН-району Ig людини, у присутності поліклонального IgG людини або при введенні тварині або людині, причому зазначена нуклеотидна послідовність, яка кодує VН-район обраного антигенспецифічного антитіла, і зазначена нуклеотидна послідовність, яка кодує CН-район зазначеного Ig, функціонально зв'язані разом; iii) забезпечення системи клітинної експресії для одержання зазначеного моновалентного антитіла; iv) забезпечення зазначеного моновалентного антитіла коекспресією конструкцій нуклеїнових кислот (i) і (ii) у клітинах цієї системи клітинної експресії (iii). Подібним чином, в одному варіанті, анти-TF-антитіло є моновалентним антитілом, яке містить (i) варіабельний район антитіла цього винаходу, описаний тут, або антигензв′язуюча частина зазначеного району, і (ii) CН-район імуноглобуліну або його фрагмента, що містить CH2- і CH 3-райони, де цей CН 20 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 район або його фрагмент був модифікований таким чином, що район, відповідний до шарнірної області, і, якщо цей імуноглобулін не є імуноглобуліном підтипу IgG4, інші райони цього CНрайону, такі як CH 3-район, не містять ніяких амінокислотних залишків, які здатні утворювати дисульфідні зв'язки з ідентичним CН-районом або іншими ковалентними або стабільними нековалентними, що перебувають між важкими ланцюгами с ідентичним CН-районом у присутності поліклонального IgG людини. У наступному варіанті здійснення, важкий ланцюг моновалентного анти-TF-антитіла була модифікована таким чином, що вся шарнірна область була делетована. У наступному варіанті здійснення, зазначене моновалентне антитіло є антитілом підтипу IgG4 (див. SEQ ID NO:114, яке не містить шарнірної області варіант SEQ ID NO:113), але CH 3район був модифікований таким чином, що була зроблена одна або кілька наступних амінокислотних замін: Thr (T) у положенні 234 був замінений Ala (A); Leu (L) у положенні 236 був замінений Ala (A); Leu (L) у положенні 236 був замінений Val (V); Phe (F) у положенні 273 був замінений Ala (A); Phe (F) у положенні 273 був замінений Leu (L); Tyr (Y) у положенні 275 був замінений Ala (A). В іншому додатковому варіанті здійснення, послідовність зазначеного моновалентного антитіла була модифікована таким чином, що вона не містить ніяких акцепторних сайтів Nзв'язаного глікозилювання. Анти-TF-антитіла цього винаходу включають також одноланцюгові антитіла. Одноланцюгові антитіла є пептидами, у яких Fv-райони важкого й легкого ланцюга є зв'язаними. В одному варіанті здійснення, даний винахід пропонує одноланцюговий Fv (scfv), де важкий і легкий ланцюги в Fv анти-TF-антитіла цього винаходу з'єднані гнучким пептидним лінкером (звичайно приблизно 10, 12, 15 або більш амінокислотних залишків) у єдиному пептидному ланцюгу. Способи одержання таких антитіл описані, наприклад, в US 4,946,778, Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds. Springer-Verlag, New York, pp. 269-315 (1994), Bird et al., Science 242, 423-426 (1988), Huston et al., PNAS USA 85, 5879-5883 (1988) і Mccafferty et al., Nature 348, 552-554 (1990). Це одноланцюгове антитіло може бути моновалентним, якщо використовуються тільки єдині VH і VL, двовалентним, якщо використовуються два VH і VL, або полівалентним, якщо використовуються більш, ніж два VH і VL. В одному варіанті здійснення, анти-TF-антитіло цього винаходу є недостатнім у відношенні ефекторної функції антитілом. Такі антитіла є особливо застосовними при використанні цього антитіла в стимуляції імунної системи через блокування інгібующих ефектів TF. Для таких застосувань, може бути вигідним, що це антитіло не має ефекторних функцій, таких як ADCC, тому що вони можуть привести до небажаної цитотоксичності. В одному варіанті здійснення, недостатнє у відношенні ефекторної функції анти-TF-антитіло є стабілізованим IgG 4-антитілом. Прикладами придатних стабілізованих IgG 4-антитіл є антитіла, у яких аргінін у положенні 409 у константному районі важкого ланцюга IgG4 людини, яка зазначена в Eu-Індексі, як в Kabat et al., замінений лізиному, треоніном, метіоніном або лейцином, бажано лізиному ( як описано в WO2006033386 (Kirin)), і/або в яких шарнірна область містить послідовність Cys-pro-pro-cys. У наступному варіанті здійснення, це стабілізоване анти-TF-антитіло IgG4 є IgG 4-антитілом, яке містить важкий ланцюг і легкий ланцюг, де зазначена важкий ланцюг містить константний район IgG4 людини, що має залишок, обраний із групи, яка складається з: Lys, Ala, Thr, Met і Leu, у положенні, що відповідає 409, і/або залишок, обраний із групи, яка складається з: Ala, Val, Gly, Ile і Leu, у положенні, що відповідає 405, і де зазначене антитіло необов'язкове містить одну або кілька замін, делецій і/або інсерцій, але не містить послідовності Cys-pro-pro-cys у шарнірній області. Бажано, зазначене антитіло містить залишок Lys або Ala у положенні, що відповідає 409, або CH 3-район цього антитіла був замінений CH 3-районом IgG1 людини або IgG3 людини. Ще в одному додатковому варіанті здійснення, стабілізоване анти-TF-антитіло IgG4 є IgG 4антитілом, яке містить важкий ланцюг і легкий ланцюг, де зазначена важкий ланцюг містить константний район IgG4 людини, що має залишок, обраний із групи, яка складається з: Lys, Ala, Thr, Met і Leu, у положенні, що відповідає 409, і/або залишок, обраний із групи, яка складається з: Ala, Val, Gly, Ile і Leu, у положенні, що відповідає 405, і де зазначене антитіло необов'язкове містить одну або кілька замін, делецій і/або інсерцій і де зазначене антитіло містить послідовність Cys-pro-pro-cys у шарнірній області. Бажано, зазначене антитіло містить залишок Lys або Ala у положенні, що відповідає 409, або CH 3-район цього антитіла був замінений CH 3районом IgG1 людини, IgG2 людини або IgG3 людини. У наступному варіанті здійснення, недостатнє у відношенні ефекторних функцій анти-TF 21 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіло є антитілом не-IgG 4-типу, наприклад, IgG1, IgG2 або IgG3, яке зазнало мутації таким чином, що здатність опосередковувати ефекторні функції, такі як ADCC, була зменшена або елімінована. Такі мутації були, наприклад, описані в Dall'acqua WF et al., J Immunol. 177(2): 1129-1138 (2006) і Hezareh M, J Virol.;75(24): 12161-12168 (2001). У наступному варіанті здійснення, антитіло цього винаходу є кон′югованим з іншою часткою, такою як цитотоксична частка, радіоізотоп або лікарський засіб. Такі антитіла можуть бути отримані хімічною кон'югацією іншої частки з N-кінцевою стороною або С-кінцевою стороною анти-TF-антитіла або його фрагмента (наприклад, Н-ланцюги, L-ланцюги анти-TF-антитіла або його анти-TF-специфічного/селективного фрагмента) (див., наприклад, Antibody Engineering Handbook, edited by Osamu Kanemitsu, published by Chijin Shokan (1994)). Такі кон′югьовані похідні антитіл можуть бути також генеровані кон'югацією внутрішніх залишків або цукрів якщо буде потреба. Звичайно, описані тут анти-TF-антитіла можуть бути модифіковані включенням будь-якого придатного кількості таких модифікованих амінокислот і/або асоціацією з такими кон′югованими заступниками. Придатність у цьому контексті звичайно визначається здатністю щонайменше власне зберігати Tf-селективність і/або TF-специфічність, асоційовану з недериватизованим вихідним анти-TF-антитілом. Включення однієї або декількох амінокислот може бути вигідним, наприклад, у збільшенні напівжиття поліпептиду в сироватці, зменшенні антигенності поліпептиду або збільшенні стабільності поліпептиду при зберіганні. Амінокислоти модифікують, наприклад, котрансляційно або посттрансляційно під час рекомбінантного одержання (наприклад, N-зв'язаного глікозилювання в мотивах N-X-S/T під час експресії в клітинах ссавців), або модифікують синтетичним способом. Необмежуючі приклади модифікованої амінокислоти містять у собі глікозильовану амінокислоту, сульфатовану амінокислоту, пренилировану амінокислоту (наприклад, фарнезилировану, геранилгеранільовану) амінокислоту, ацетильовану амінокислоту, ацильовану амінокислоту, Пегільовану амінокислоту, біотинільовану амінокислоту, карбоксильовану амінокислоту, фосфорильовану амінокислоту й т.п. Посилання, достатні для орієнтування кваліфікованого фахівця в модифікації амінокислот, забезпечені удосталь у літературі. Зразки протоколів можна знайти в Walker (1998) Protein Protocols On Cd-Rom, Humana Press, Towata, NJ. Модифікована амінокислота може бути, наприклад, обрана із глікозильованої амінокислоти, пегільованої амінокислоти, фарнезильованої амінокислоти, ацетильованої амінокислоти, біотинільованої амінокислоти, амінокислоти, кон′югованої з ліпідною частиною молекули, або амінокислоти, кон′югованої з органічним дериватизованим агентом. Анти-TF-антитіла можуть бути також хімічно модифіковані ковалентною кон'югацією з полімером, наприклад, для збільшення їх напівжиття в кров′яному руслі. Зразки полімерів й способів приєднання їх до пептидів ілюстровані, наприклад, в US 4,766,106, US 4,179,337, US 4,495,285 і US 4,609,546. Додаткові ілюстративні полімери містять у собі поліоксиетильовані поліоли й поліетиленгліколь (PEG) (наприклад, PEG з молекулярною масою приблизно 1000 приблизно 40000, такою як приблизно 2000 - приблизно 20000, наприклад, приблизно 300012000 г/моль). В одному варіанті здійснення, даний винахід пропонує анти-TF-антитіло, кон′юговане із другою молекулою, яка обрана з поміж радіонукліда, ферменту, субстрату ферменту, кофактора, флуоресцентного маркера, хемілюмінесцентного маркера, пептидної мітки або магнітної частки. В одному варіанті здійснення, анти-TF-антитіло може бути кон′югованим з одним або декількома фрагментами антитіл, нуклеїновими кислотами (олігонуклеотидами), нуклеазами, гормонами, імуномодуляторами, хелаторами, сполуками бору, фотоактивними агентами, барвниками й т.п. Ці й інші придатні агенти можуть бути зв'язані безпосередньо або опосередковано з анти-TF-антитілом даного винаходу. Одним прикладом опосередкованого зв'язування другого агента є зв'язування спейсерною часткою. Ці спейсери можуть бути, у свою чергу, нерозчинними й розчинними (див., наприклад, Diener et al., Science 231, 148 (1986)) і можуть бути обрані для полегшення вивільнення лікарського засобу з анти-TF-антитіла в сайтімішені й/або при конкретних умовах. Додаткові приклади агентів, які можуть бути пов'язані з анти-TF-антитілом, містять у собі лектини й флуоресцентні пептиди. В одному варіанті здійснення, забезпечені анти-TF-антитіла, що містять одну або декілька радіоактивно мічених амінокислот. Радіоактивно мічене анти-TF-антитіло може бути використане як для діагностичних, так і для терапевтичних цілей (кон'югація з радіоактивно міченими молекулами є іншою можливою ознакою). Необмежуючі приклади міток для 3 14 15 35 90 99 125 131 186 поліпептидів містять у собі, але не обмежуються ними, Н, С, N, S, Y, Tc і I, I і Re. Способи одержання радіоактивно мічених амінокислот і споріднених пептидних похідних відомі в даній галузі (див., наприклад, Junghans et al., in Cancer Chemotherapy and Biotherapy 655-686 22 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2d edition, Chafner and Longo, eds., Lippincott Raven (1996)) і US 4,681,581, US 4,735,210, US 5,101,827, US 5,102,990 (US RE35,500), US 5,648,471 і US 5,697,902. Наприклад, радіоактивний ізотоп може бути кон′югованим способом із хлораміном Т. В одному варіанті здійснення, анти-TF-антитіло цього винаходу містить кон′юговану нуклеїнову кислоту або асоційовану з нуклеїновою кислотою молекулу. В одному такому аспекті даного винаходу, ця кон′югована нуклеїнова кислота є цитотоксичною рибонуклеазою. В одному варіанті здійснення, ця кон′югована нуклеїнова кислота є антизначеннєвий нуклеїновою кислотою (наприклад, націленої на S10010 антизначеннєвою молекулою, яка може бути також незалежним компонентом у комбінованій композиції або комбінованому способі введення даного винаходу – див., наприклад, Zhang et al., J Biol Chem. 279(3), 2053-62 (2004)). В одному варіанті здійснення, ця кон′югована нуклеїнова кислота є інгібіторною РНК-молекулою (наприклад, молекулою sirna). В одному варіанті здійснення, ця кон′югована нуклеїнова кислота є імуностимуляторною нуклеїновою кислотою (наприклад, імуностимуляторною Cpg-мотиввмісною ДНК-молекулою). В одному варіанті здійснення, ця кон′югована нуклеїнова кислота є експресійною касетою, що кодує експресію гена супресора пухлини, протираковою вакциною, протираковим цитокіном або апоптотичним агентом. Такі похідні можуть також містити кон'югацію нуклеїнової кислоти, що кодує експресію одного або декількох цитотоксичних білків, таких як токсини рослин і бактеріальні токсини. В одному варіанті здійснення, анти-TF-антитіло є кон′югованим з функціональною молекулою нуклеїновою кислоти. Функціональні молекули нуклеїнових кислот містять у собі антизначеннєві молекули, інтерферуючі молекули нуклеїновою кислоти (наприклад, молекули sirna), аптамери, рибозими, що утворюють триплекс молекули й зовнішні напрямні послідовності. Ці функціональні молекул нуклеїнових кислот можуть діяти як ефекторів, інгібіторів, модуляторів і стимуляторів специфічної активності, яка має молекулу-мішень, або функціональні молекули нуклеїнових кислот можуть мати активність de novo, незалежної від яких-небудь інших молекул. В іншому варіанті здійснення, анти-TF-антитіло цього винаходу є кон′югованим з аптамером. В іншому варіанті здійснення, даний винахід пропонує анти-TF-антитіло, яке є кон′югованим з рибозимом. Для кон'югації анти-TF-антитіла з кон′югованою молекулою (кон′югованими молекулами), такими як описані вище, може бути використаний будь-який спосіб, відомий у даній галузі, у тому числі способи, описані Hunter et al., Nature 144, 945 (1962), David et al., Biochemistry 13, 1014 (1974), Pain et al., J. Immunol. Meth. 40, 219 (1981) і Nygren, J. Histochem. and Cytochem. 30, 407 (1982). Численні типи цитотоксичних сполук можуть бути приєднані до білок з використанням реакційноздатної групи на цій цитотоксичній сполуці, або з використанням зшиваючого агента. Звичайною реакційноздатною групою, яка буде утворювати стабільний ковалентний зв'язок in vivo з аміном, є ізотіоціанат (Means et al., Chemical modifications of proteins (Holden-Day, San Francisco 1971) pp. 105-110). Ця група бажано взаємодіє з (-амінною групою лізина. Малеімід є реакційноздатною групою, яка звичайно використовується для утворення стабільного in vivo ковалентного зв'язку із сульфгідрильною групою на цистеїні (Ji., Methods Enzymol 91, 580-609 (1983)). Моноклональні антитіла звичайно не здатні утворювати ковалентні зв'язки з іонами радіоактивних металів, але вони можуть бути приєднані до антитіла безпосередньо з використанням хелатоутворюючих агентів, які ковалентно пов'язані із цими антитілами. Хелатоутворюючі агенти можуть бути приєднані через амінні (Meares et al., Anal. Biochem. 142, 68-78 (1984)) і сульфгідрильні групи (Koyama, Chem. Abstr. 120, 217262t (1994)) амінокислотних залишків, а також через вуглеводні групи (Rodwell et al., PNAS USA 83, 26322636 (1986), Quadri et al., Nucl. Med. Biol. 20, 559-570 (1993)). Оскільки ці хелатоутворюючі агенти містять два типи функціональних груп, один для зв'язування іонів металів і іншої для приєднання хелата до антитіла, їх звичайно називають біфункціональними хелатоутворюючими агентами (Sundberg et al., Nature 250, 587-588 (1974)). В одному варіанті здійснення, даний винахід пропонує анти-TF-антитіло, таке як анти-TFантитіло людини, кон′юговане з терапевтичною часткою, такою як цитотоксин, хіміотерапевтичне лікарський засіб, імунодепресант або радіоізотоп. Такі кон′югати називають тут "імунокон′югатами". Імунокон′югати, які містять у собі один або кілька цитотоксинів, називають "імунотоксинами". Цитотоксин або цитотоксичний агент включає в себе будь-який агент, який є шкідливим для клітин (наприклад, убиває клітини). Відносно опису цих класів лікарських засобів, які добре відомі в даній галузі, і їх механізмів дії див. Goodman et al., Goodman and Gilman's The Pharmacological Basis Of Therapeutics, 8th Ed., Macmillan Publishing Co., 1990. Додаткові способи, що відносяться до приготування імунотоксинів антитіл, забезпечені, наприклад, в 23 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 Vitetta, Immunol. Today 14, 252 (1993) і US 5,194,594. Придатні терапевтичні агенти для утворення імунокон′югатов даного винаходу містять у собі таксол, цитохалазин В, грамицидин D, етидийбромид, еметин, митоміцин, етопозид, тенопозид, винкристин, винбластин, колхицин, доксорубіцинин, даунорубіцинин, дигідроксиантрациндион, митоксантрон, митраміцин, актиноміцин D, 1-дегідротестостерон, глюкокортикоиди, прокаїн, тетракаїн, лидокаин, пропранолол і пуроміцин, антиметаболіти (такі як метотрексат, 6меркаптопурин, 6-тіогуанин, цитарабін, флударабин, 5-фторурацмл, декарбазин, гідроксисечовина, аспарагиназа, гемцитабин, кладрибин), алкилюючі агенти (такі як мехлоретамін, тіоепа, хлорамбуцил, мелфалан, кармустин (BSNU), ломустин (CCNU), циклофосфамид, бусульфан, дибромоманіт, стрептозотоцин, дакарбазин (DTIC), прокарбазин, митоміцин З, цисплатин і інші похідні платини, такі як карбоплатин), антибіотики (такі як дактиноміцин (раніше актиноміцин), блеоміцин, даунорубіцинин (раніше дауноміцин), доксорубіцинин, ідарубіцинін, мітраміцин, мітоміцин, мітоксандрон, плікамимін, антраміцин (AMC)), дифтерійний токсин і споріднені молекули (такі як А-Ланцюг дифтерійного токсину і її активні фрагменти, і гібридні молекули), рициновий токсин (такий як рицин А або деглікозильований токсин ланцюга А рицину), холерний токсин, Shiga-подібний токсин (SLT-I, SLT-II, SLT-IIV), Lt-токсин, C 3-токсин, Shiga-Токсин, коклюшний токсин, правцевий токсин, Bowman-Birk інгібітор протеаз, екзотоксин Pseudomonas, алорин, сапорин, модекцин, геланін, Аланцюг абріну, А-ланцюг модекцину, альфа-сарцин, білки Aleurites fordii, білки діантину, білки Phytolacca americana (PAPI, PAPII і PAP-S), інгібітор Мomordica charantia, курцин, кротин, інгібітор Saponaria officinalis, гелонін, мітгелін, рестриктоцин, феноміцинові й еноміцинові токсини. Інші придатні кон′югьовані молекули містять у собі рибонуклеазу (РНКазу), ДНКазу I, стафілококовий ентеротоксин-а, антивірусний білок фітолаки американської, дифтерійний токсин і ендотоксин Pseudomonas endotoxin. Див., наприклад, Pastan et al., Cell 47, 641 (1986) і Goldenberg, Calif. A Cancer Journal for Clinicians 44, 43 (1994). Терапевтичні агенти, які можуть уводитися в комбінації з анти-TF-антитілом даного винаходу, описані в іншім місці тут, можуть бути також кандидатами на терапевтичні частки, застосовні для кон'югації з анти-TF-антитілом даного винаходу. В одному варіанті здійснення, анти-TF-антитіло даного винаходу приєднане до лінкерухелатору, наприклад, тиуксетану, який дозволяє кон′югування цього антитіла з радіоактивним ізотопом. У наступному аспекті, цей винахід відноситься до біспецифічної молекули, що містить антиTF-антитіло цього винаходу, описане тут вище, і другу з′єднувальну специфічність, наприклад, специфічність, що зв'язує у відношенні ефекторної клітини людини, Fc-рецептора людини або Ткліткового рецептора, або з′єднувальну специфічність у відношенні іншого епітопа TF. Біспецифічні молекули даного винаходу можуть додатково містити в собі третю з′єднувальну специфічність, на додаток до анти-TF-з′єднувальної специфічності і з′єднувальної специфічності у відношенні ефекторної клітини людини, Fc-рецептора людини або Т-клітинного рецептора. Зразки молекул біспецифічного антитіла цього винаходу включають: (i) два антитіла, одне зі специфічністю у відношенні TF і інше зі специфічністю відносно другої мішені, які кон′юговані разом, (ii) єдине антитіло, яке має один ланцюг, специфічний у відношенні TF, і другий ланцюг, специфічний відносно другої молекули, і (iii) одноланцюгове антитіло, яке має специфічність у відношенні TF і другої молекули. Звичайно, ця друга мішень/друга молекула є молекулою, інакшою, ніж TF. В одному варіанті здійснення, ця друга молекула є раковим антигеном/пухлиноасоційованим антигеном, таким як карциноембріональний антиген (CEA), простата-специфічний антиген (PSA), RAGE (нирковий антиген), α-фетопротеїн, CAMEL ( CtlПізнаваний антиген на меланомі), Ct-антигени (такі як MAGE-B5, -B6, -C2, -C3 і D; Mage-12; CT10; NY-ESO-1, SSX-2, GAGE, BAGE, MAGE і SAGE), антигени муцину (наприклад, MUC1, муцин-CA125, і т.д.), гангліозидні антигени, тірозиназа, gp75, C-myc, Marti, Melana, MUM-I, MUM2, MUM-3, HLA-B7 і Ep-cam. В одному варіанті здійснення, ця друга молекула є асоційованим з раком інтегріном, таким як інтегрін α5β3. В одному варіанті здійснення, ця друга молекула є ангіогенним фактором або іншим асоційованим з раком фактором росту, таким як ендотеліальний фактор росту судин (VEGF), фактор росту фібробластів (FGF), епідермальний фактор росту (EGF), рецептор епідермального фактора росту (EGFR), ангіогенін і його рецептори, зокрема, рецептори, асоційовані із прогресуванням раку (наприклад, один з рецепторів HER1-HER4, c-met або RON). Інші асоційовані із прогресуванням раку беки, обговорювані тут, можуть бути також придатними другими молекулами. В одному варіанті здійснення, біспецифічне антитіло даного винаходу є діатілом. Біспецифічні антитіла містять у собі також зшиті або «гетерокон′югатні» антитіла. Наприклад, 24 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 одне з антитіл у гетерокон′югаті може бути пов'язане з авідином, а інше з біотином. Такі антитіла були, наприклад, запропоновані для націлювання клітин імунної системи на небажані клітини (див., наприклад, US 4,676,980). Гетерокон′югатні антитіла можуть бути зроблені з використанням будь-яких придатних зшиваючи способів. У наступному аспекті, цей винахід відноситься до експресуючого вектора, який кодує антитіло цього винаходу. В одному варіанті здійснення, експресуючий вектор цього винаходу містить нуклеотидну послідовність, яка кодує одну або декілька з амінокислотних послідовностей, обраних із групи, яка складається з SEQ ID NO:1-112. В іншому конкретному варіанті здійснення, експресуючий вектор цього винаходу містить нуклеотидну послідовність, яка кодує одну або кілька амінокислотних послідовностей VH, обраних із групи, яка складається з: SEQ ID NO:9, 1, 5, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49 і 53. В одному конкретному варіанті здійснення, експресуючий вектор цього винаходу містить нуклеотидну послідовність, яка кодує одну або кілька амінокислотних послідовностей VH CDR3, обраних із групи, яка складається з: SEQ ID NO 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52 і 56. В іншому конкретному варіанті здійснення, експресуючий вектор цього винаходу містить нуклеотидну послідовність, яка кодує одну або кілька амінокислотних послідовностей VL, обраних із групи, яка складається з: SEQ ID NO: 65, 57, 61, 69, 73, 77, 81, 85, 89, 93, 97, 101 і 105. В іншому варіанті здійснення, експресуючий вектор цього винаходу містить нуклеотидну послідовність, яка кодує одну або кілька амінокислотних послідовностей VL CDR3, обраних із групи, яка складається з: SEQ ID NO: 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104 і 108. В одному конкретному варіанті здійснення, експресуючий вектор цього винаходу містить нуклеотидну послідовність, яка кодує варіанти однієї або декількох наведених вище амінокислотних послідовностей, причому зазначені варіанти мають щонайбільше 25 амінокислотних модифікацій, наприклад, 20, наприклад, щонайбільше 15, 14, 13, 12 або 11 амінокислотних модифікацій, наприклад, 10, 9, 8, 7, 6, 5, 4, 3, 2 або 1 з амінокислотних модифікацій, таких як делеції або інсерції, бажано заміни, такі як консервативні заміни, або щонайменше 80% ідентичність кожної із зазначених послідовностей, таку як щонайменше 85% ідентичність або 90% ідентичність або 95% ідентичність, наприклад, 96% ідентичність або 97% ідентичність або 98% ідентичність або 99% ідентичність кожної з вищезгаданих амінокислотних послідовностей. У наступному варіанті здійснення, цей експресуючий вектор містить нуклеотидну послідовність, яка кодує константний район легкого ланцюга, важкого ланцюга або як легкого, так і важкого ланцюгів антитіла, наприклад, антитіла людини. Такі експресуючі вектори можуть бути використані для рекомбінантного одержання антитіл цього винаходу. Експресуючий вектор у контексті даного винаходу може бути будь-яким придатним вектором, у тому числі хромосомним, нехромосомним і утримуючим синтетичну нуклеїнову кислоту векторами (послідовність нуклеїновою кислоти, що містить придатний набір регуляторних елементів експресії). Приклади таких векторів містять у собі похідні SV40, бактеріальні плазміди, фагові ДНК, бакуловірус, плазміди дріжджів, вектори, отримані з комбінацією плазмід і фагових ДНК, і вектори вірусних нуклеїнових кислот (РНК або ДНК). В одному варіанті здійснення, нуклеїнова кислота, яка кодує анти-TF-антитіло міститься в голому ДНК- або РНК-векторі, що включає в себе, наприклад, лінійний елемент експресії ( як описано, наприклад, Sykes and Johnston, Nat Biotech 12, 355-59 (1997)), компактний вектор, який складається з нуклеїновою кислоти (описаний, наприклад, в US 6,077, 835 і/або WO 00/70087), плазмідний вектор, такий як pbr322, puc 19/18 або puc 118/119, «midge»-вектор нуклеїнової кислоти мінімального розміру (описаний, наприклад, Schakowski et al., Mol Ther 3, 793-800 (2001)), або преципітована конструкція вектора нуклеїновою кислоти, така як CaР04преципітована конструкція (наприклад, описана в WO 00/46147, Benvenisty and Reshef, PNAS USA 83, 9551-55 (1986), Wigler et al., Cell 14, 725 (1978), і Coraro and Pearson, Somatic Cell Genetics 2, 603 (1981)). Такі вектори, які складаються із нуклеїнових кислот та їх застосування добре відомі в даній галузі (див., наприклад, US 5,589,466 і US 5,973,972). В одному варіанті здійснення, цей вектор підходить для експресії анти-TF-антитіла в бактеріальній клітині. Приклади таких векторів містять у собі експресуючі вектори, такі як BlueScript (Stratagene), pIN-вектори (Van Heeke & Schuster, J Biol Chem 264, 5503-5509 (1989), pET-вектори (Novagen, Madison WI) і т.п.). Експресуючий вектор може бути також або альтернативно вектором, що підходять для експресії в дріжджовій системі. Може бути використаний будь-який вектор, що підходить для 25 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 експресії в дріжджовій системі. Придатні вектори містять у собі, наприклад, вектори, які містять конститутивні або індуковані промотори, такі як альфа-фактор, алкогольоксидаза й PGH (огляд: F. Ausubel et al., ed. Current Protocols in Molecular Biology, Greene Publishing and Wiley Interscience New York (1987), і Grant et al., Methods in Enzymol 153, 516-544 (1987)). Нуклеїнова кислота й/або вектор може також містити послідовність нуклеїнової кислоти послідовність, яка кодує, секреції/локалізації, яка може націлювати на поліпептид, такий як виникаючий поліпептидний ланцюг, на перипламатичний простір або в середовище культури клітини. Такі послідовності відомі в даній галузі й містять у собі пептиди лідера секреції або сигнальної послідовності, що націлюють на органелу послідовності (наприклад, послідовності ядерної локалізації, сигнали втримання в ER, митохондріальні послідовності транспорту, хлоропластні послідовності транспорту), послідовності мембранної локалізації/якірні послідовності (наприклад, послідовності зупинки транспорту, якірні GРІ-послідовності), тощо. В експресуючому векторі цього винаходу, що кодують анти-TF-антитіло нуклеїнові кислоти можуть містити будь-який придатний промотор, енхансер і інші елементи, які полегшують експресію або бути асоційовані з будь-яким придатним промотором, енхансером і іншими елементами, які полегшують експресію. Приклади таких елементів включають сильні промотори експресії (наприклад, промотор/енхансер CMV IE людини, а також промотори RSV, SV40, SL3-3, MMTV і HIV LTR), ефективні послідовності полі (А) термінації, сайт ініціації реплікації для плазмідного продукту в E. coli, ген стійкості до антибіотика як селектованого маркера й/або зручний сайт клонування (наприклад, полілінкер). Нуклеїнові кислоти можуть також містити індукований промотор на противагу конститутивному промотору, такому як CMV IE (кваліфікованому в даній галузі фахівцеві буде зрозуміло, що такі терміни є фактично дескрипторами ступеня експресії гена за певних умов). В одному варіанті здійснення, експресуючий вектор, що кодує анти-TF-антитіло може бути поміщений у клітину-хазяїна або у тварина-хазяїна й/або доставлений у клітину-хазяїна або тварина-хазяїна за допомогою вірусного вектора. Ще в одному додатковому аспекті, цей винахід відноситься до рекомбінантної еукаріотичної або прокаріотичної клітини-хазяїна, такої як трансфектома, яка продукує антитіло цього винаходу, визначена тут, або до біспецифічної молекулі цього винаходу, визначеної тут. Приклади клітин-хазяїв містять у собі клітини дріжджів, бактеріальні клітини й клітини ссавців, такі як клітини СНО або НЕК. Наприклад, в одному варіанті здійснення, даний винахід пропонує клітину, що містить нуклеїнову кислоту, стабільно інтегровану в клітинний геном, яка містить послідовність, яка кодує експресію анти-TF-антитіла даного винаходу. В іншому варіанті здійснення, даний винахід пропонує клітину, що містить неінтегровану нуклеїнову кислоту, таку як плазміда, косміда, фагміда або лінійний елемент експресії, який містить послідовність, яка кодує анти-TF-антитіло цього винаходу. У наступному аспекті, цей винахід відноситься до гібридоми, яка продукує антитіло цього винаходу, визначена тут. Ще в одному аспекті, цей винахід відноситься до трансгенному тварині (не людині), що містить нуклеїнові кислоти, що кодують важкий ланцюг людини й легкий ланцюг людини, де ця тварина або рослина продукує антитіло цього винаходу. Генерування таких гібридом і трансгенних тварин було описано вище. У наступному аспекті, цей винахід відноситься до способу одержання анти-TF-антитіла цього винаходу, що передбачає стадії a) культивування гібридоми або клітини-хазяїна цього винаходу, як описано тут вище, і b) очищення антитіла цього винаходу з культуральних середовищ. У додатковому основному аспекті, цей винахід відноситься до анти-TF-антитілу, визначеному тут, або біспецифічної молекули, визначеної тут, для застосування як лікарського засобу. Ще в одному аспекті, цей винахід відноситься до фармацевтичної композиції, що містить: - анти-TF-антитіло, визначена тут, або біспецифічну молекулу, певну тут, і - фармацевтично прийнятний носій. Ця фармацевтична композиція може бути приготовлена з фармацевтично прийнятними носіями або розріджувачами, а також будь-якими відомими ад′ювантами й ексципієнтами відповідно до загальноприйнятих способів, такими як способи, описані в Remington The Science and Practice of Pharmacy, 19th Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995. Ці фармацевтично прийнятні носії або розріджувачі, а також будь-які інші відомі ад′юванти й ексципієнти повинні бути придатними для обраного сполуки даного винаходу й обраного режиму введення. Придатність для носіїв і інших компонентів фармацевтичних композицій визначається на основі відсутності значної негативної дії на бажані біологічні властивості обраних сполуки або фармацевтичної композиції даного винаходу (наприклад, менш, чим 26 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 істотної дії (10% або менше відносного інгібування, 5% або менше відносного інгібування, і т.д.) Фармацевтична композиція даного винаходу може також містити в собі розріджувачі, наповнювачі, солі, буфери, детергенти (наприклад, неіоногенний детергент, такий як Твін-20 або Твін-40), стабілізатори (наприклад, цукри або амінокислоти, які не містять білка), консерванти, фіксатори тканин, солюбілізатори й/або інші матеріали, що підходять для включення у фармацевтичну композицію. Повідомлялося, що в ракових клітинах, таких як колоректальні ракові клітини людини, експресія TF перебуває під контролем 2 головних неопластичних подій, що перероджують, запускають прогресування захворювання (активації онкогена K-ras і інактивації супресора пухлини р53, способом, залежним від MEK/ мітоген-активованої протеїнкінази (MAPK) і фосфатиділінозит-3-кінази (PI3K) (Yu et al. (2005) Blood 105: 1734. Ракові клітини, суперекспресуючі TF, можуть бути особливо гарними мішенями для анти-TFантитіла цього винаходу, тому що може бути зв'язане більше антитіл на клітину. Таким чином, в одному варіанті здійснення, раковий пацієнт, що підлягає лікуванню анти-TF-антитілом цього винаходу, є пацієнтом, наприклад, що мають панкреатичний лак, рак легенів або колоректальний рак, який було діагностовано, що як має одну або кілька мутацій в K-Ras і/або одну або кілька мутацій в p53 у їхніх пухлинних клітинах. В альтернативному варіанті здійснення, пацієнт, який повинен лікуватися анти-TFантитілами цього винаходу, є пацієнтом, наприклад, що мають панкреатичний лак, рак легенів або колоректальний рак, який не має мутації в K-Ras. Без зв'язування себе якою-небудь конкретною теорією, автори цього винаходу вважають за можливе, що деякі пухлинні клітини, що мають активацію К-Ras, є менш чутливими до лікування анти-TF-антитілом, тому що дії анти-TF-антитіл на механізми внутрішньоклітинної передачі сигналів можуть бути менш ефективними в клітинах, у яких К-Ras є активованим. Фактичні рівні доз активних інгредієнтів у фармацевтичних композиціях даного винаходу можуть варіюватися таким чином, щоб одержати кількість активного інгредієнта, яка є ефективною для досягнення бажаної терапевтичної реакції для конкретного пацієнта, конкретних композиції й схеми введення, без прояву токсичності для цього пацієнта. Обраний рівень дози буде залежати від різних фармакокінетичних факторів, які включають у себе активність конкретних використаних композицій даного винаходу, або його аміду, способу введення, часу введення, швидкості екскреції конкретної використаної сполуки, тривалості лікування, інших лікарських засобів, сполук і/або матеріалів, які застосовувались у комбінації з конкретними використаними композиціями, віку, статі, маси, , загального стану здоров'я й попередньої історії хвороби пацієнта, який потребує лікування і подібних факторів, добре відомих в галузі медицини. Ця фармацевтична композиція може вводитися з використанням будь-якого придатного способу й режиму. Придатні способи введення сполуки даного винаходу in vivo і in vitro добре відомі в даній галузі й можуть бути обрані фахівцем зі звичайною кваліфікацією в даній галузі. В одному варіанті здійснення, фармацевтичну композицію даного винаходу вводять парентерально. Фрази «парентеральне введення» і «які вводяться парентерально», які використовуються тут, означають способи, інакші, ніж ентеральне (тонкокишкове) і місцеве введення, звичайно за допомогою ін'єкції, і включають епідермальну, внутрішньовенну, внутрішнм'язову, інтраартеріальну, внутрішньоболонкову, інтракапсулярну, інтраорбітальну, інтракардіальну, інтрадермальну, інтраперитонеальну, внутрішньосухожильну, транстрахеальну, підшкірну, субкутикулярну, внутрішньосуглобну, субкапсулярну, субарахноідальну, інтраспінальну, інтракраніальну, інтраторакальну, епідуральну й інтрастернальну ін'єкцію і інфузію. В одному варіанті здійснення, цю фармацевтичну композицію вводять внутрішньовенною або підшкірною ін'єкцією або інфузією. Фармацевтично прийнятні носії містять у собі будь-які й усі придатні розчинники, диспергуючі середовища, покриття, антибактеріальні й протигрибкові агенти, агенти ізотонічності, антиоксиданти й затримуючі абсорбцію агенти, та ін.., які є фізіологічно сумісними зі сполукою даного винаходу. Приклади придатних водних і неводних носіїв, які можуть використовуватися у фармацевтичних композиціях даного винаходу, містять у собі воду, сольовий розчин, забуференний фосфатом сольовий розчин, етанол, декстрозу, поліоли (такі як гліцерин, пропіленгліколь, поліетиленгліколь і т.п.) і їхні придатні суміші, рослинні олії, такі як маслинове олія, кукурудзяне олія, арахісове олія, бавовняне олія й кунжутне олія, колоїдні розчини карбоксиметилцелюлози, трагакантову камедь і ін′єктовані органічні ефіри, такі як етилолеат, і/або різні буфери. Інші носії добре відомі у фармацевтичних галузях. 27 UA 109633 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтично прийнятні носії містять у собі стерильні водяні розчини або дисперсії й стерильні порошки для незапланованого приготування стерильних ін'єкційних розчинів або дисперсії. Застосування таких середовищ і агентів для фармацевтично активних речовин відомо в даній галузі. За винятком випадків, коли будь-яке звичайне середовище або агент несумісні із цією активною сполукою, розглядається їхнє використання у фармацевтичних композиціях даного винаходу. Необхідна плинність може підтримуватися, наприклад, застосуванням матеріалів покриття, таких як лецитин, за допомогою підтримки необхідного розміру часток у випадку дисперсій і застосуванням поверхнево-активних речовин. Фармацевтичні композиції даного винаходу можуть також містити фармацевтично прийнятні антиоксиданти, наприклад, (1) водорозчинні антиоксиданти, такі як аскорбінова кислота, цистеїну гідрохлорид, натрію бісульфат, натрію метабисульфіт, натрію сульфіт та ін.; (2) розчинні в олії антиоксиданти, такі як аскорбілпальмітат, бутильований гідроксианізол (BHA), бутильований гідрокситолуол (BHT), лецитин, пропілгалат, альфа-токоферол тощо; і (3) металхелатуючі агенти, такі як лимонна кислота, етилендиамінтретаоцтова кислота (ЕДТА), сорбіт, винна кислота, фосфорна кислота тощо. Фармацевтичні композиції даного винаходу можуть також містити агенти ізотонічності, такі як цукру, поліспирти, такі як маніт, сорбіт, гліцерин, або хлорид натрію, у цих композиціях. Фармацевтичні композиції даного винаходу можуть також містити один або декілька ад′ювантів, придатних для обраного способу введення, таких як консерванти, зволожуючі агенти, емульгуючі агенти, диспергуючі агенти, консерванти або буфери, які можуть збільшувати строк зберігання або ефективність цієї фармацевтичної композиції. Сполуки даного винаходу можуть бути приготовлені з носіями, які будуть захищати цю сполуку проти швидкого вивільнення, наприклад, форми контрольованого вивільнення, що включають у себе імплантати, трансдермальні пластири й мікроінкапсульовані системи доставки. Такіносії можуть містити в собі желатин, гліцерилмоностеарат, гліцерилдистеарат, біосумісні полімери здатні до біологічної деградації, такі як етилен-вінілацетат, поліангідриди, полігліколеву кислоту, колаген, поліортоефіри й полімолочну кислоту, одну або з воском, або інші матеріали, добре відомі в даній галузі. Способи приготування таких готових форм звичайно відомі кваліфікованим у даній галузі фахівцям. Див., наприклад, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978. В одному варіанті здійснення, сполуки даного винаходу можуть бути приготовлені для гарантії правильного розподілу in vivo. Фармацевтично прийнятні носії для парентерального введення містять у собі стерильні водяні розчини або дисперсії й стерильні порошки для незапланованого приготування стерильних ін'єкційних розчинів або дисперсії. Застосування таких середовищ і агентів для фармацевтично активних речовин відомо в даній галузі. За винятком випадків, коли будь-яке звичайне середовище або агент несумісні із цією активною сполукою, розглядається їх використання у фармацевтичних композиціях даного винаходу. Додаткові активні сполуки можуть бути також включені в ці композиції. Фармацевтичні композиції для ін'єкції повинні бути звичайно стерильними й стабільними в умовах приготування й зберігання. Ця композиція може бути приготовлена у вигляді розчину, мікроемульсії, ліпосоми або іншої впорядкованої структури, яка підходить для високої концентрації лікарського засобу. Цей носій може бути водним або неводним розчинником або дисперсійним середовищем, що містить, наприклад, воду, етанол, поліолі (такі як гліцерин, пропіленгліколь, поліетиленгліколь тощо), і їхні придатні суміші, рослинні олії, такі як маслинова олія, та ін′єктовані органічні ефіри, такі як етилолеат. Необхідна плинність може підтримуватися, наприклад, застосуванням матеріалів покриття, таких як лецитин, за допомогою підтримки необхідного розміру часток у випадку дисперсії й застосуванням поверхнево-активних речовин. У багатьох випадках, буде кращим включення ізотонічних агентів, наприклад, цукрів, поліспиртів, таких як гліцерин, маніт, сорбіт, або хлорид натрію, у цій композиції. Пролонгована абсорбція ін′єктованих композицій може бути викликана включенням у цю композицію агента, який затримує абсорбцію, наприклад, моностеаратних солей, і желатину. Стерильні ін′єктовані розчини можуть бути приготовлені включенням активної сполуки в необхідній кількості у придатному розчиннику з одним інгредієнтом або комбінацією інгредієнтів, наприклад, перерахованих вище, якщо необхідно, з наступною стерилізацією мікрофільтруванням. Звичайно, дисперсії готовлять включенням активної сполуки в стерильний носій, який містить базове дисперсійне середовище й необхідні інші інгредієнти, наприклад, з інгредієнтів, перерахованих вище. У випадку стерильних порошків для приготування стерильних ін′єктованих розчинів, прикладами способів приготування є вакуумне сушіння (ліофілізація), яке дає порошок цього активного інгредієнта плюс будь-який додатковий активний інгредієнт із його 28
ДивитисяДодаткова інформація
Автори російськоюVerploegen, Sandra, Satijn, Danid, P., E., Hoet, Rene, M., E., Parren, Paul, van de Winkel, Jan, Breinholt, Vibeke, Miller, Ehrnrooth, Eva, Baadsgaard, Ole, Vink, Tom, Bleeker, Willem, Karel, Houtkamp, Mischa, Oudshoorn, Maroeska, de Jong, Rob, N.
МПК / Мітки
МПК: A61P 35/00, C07K 16/36
Мітки: фактора, тканинного, людини, антитіло
Код посилання
<a href="https://ua.patents.su/90-109633-antitilo-lyudini-proti-tkaninnogo-faktora.html" target="_blank" rel="follow" title="База патентів України">Антитіло людини проти тканинного фактора</a>
Попередній патент: Спосіб та пристрій для розділення суміші речовин перегонкою
Наступний патент: Спосіб формування вогнетривкого агента у вогнетривкій масі печі та шарувата вогнетривка футерівка для печі, одержана у цей спосіб
Випадковий патент: Полістирольне зв'язуюче для виготовлення ливарних форм та стержнів