Застосування анти-нsp60 антитіл як маркерів імунної безпеки проведення гемотрансфузій у кардіохірургії вроджених вад серця
Номер патенту: 103141
Опубліковано: 10.09.2013
Автори: Ткаченко Яніна Вікторівна, Яковенко Людмила Федорівна, Ємець Ілля Миколайович, Воробйова Ганна Михайлівна, Сидорик Людмила Леонідівна
Формула / Реферат
Застосування анти-HSP60 антитіл сироватки крові донорів як маркерів імунної безпеки проведення гемотрансфузій в кардіохірургії вроджених вад серця.
Текст
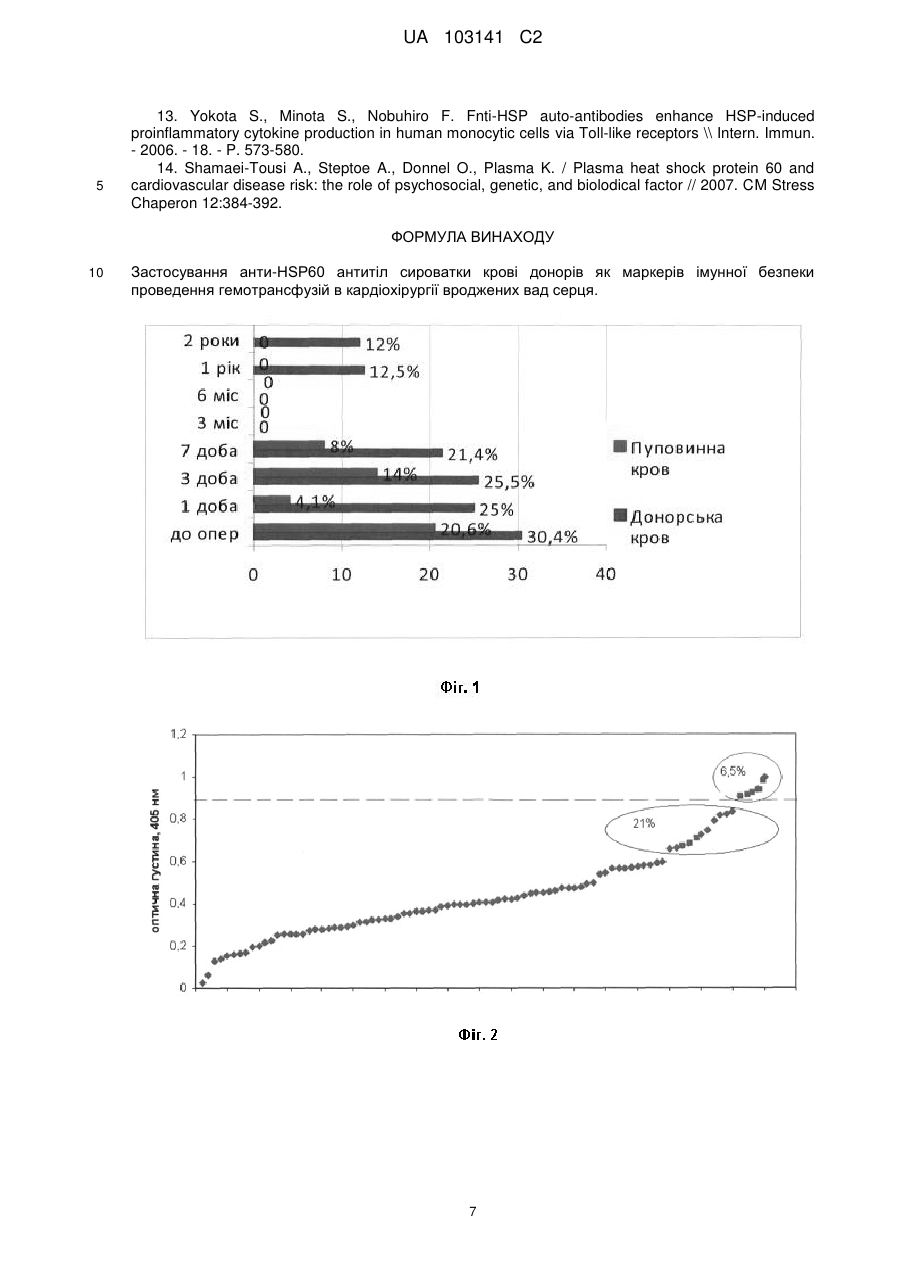
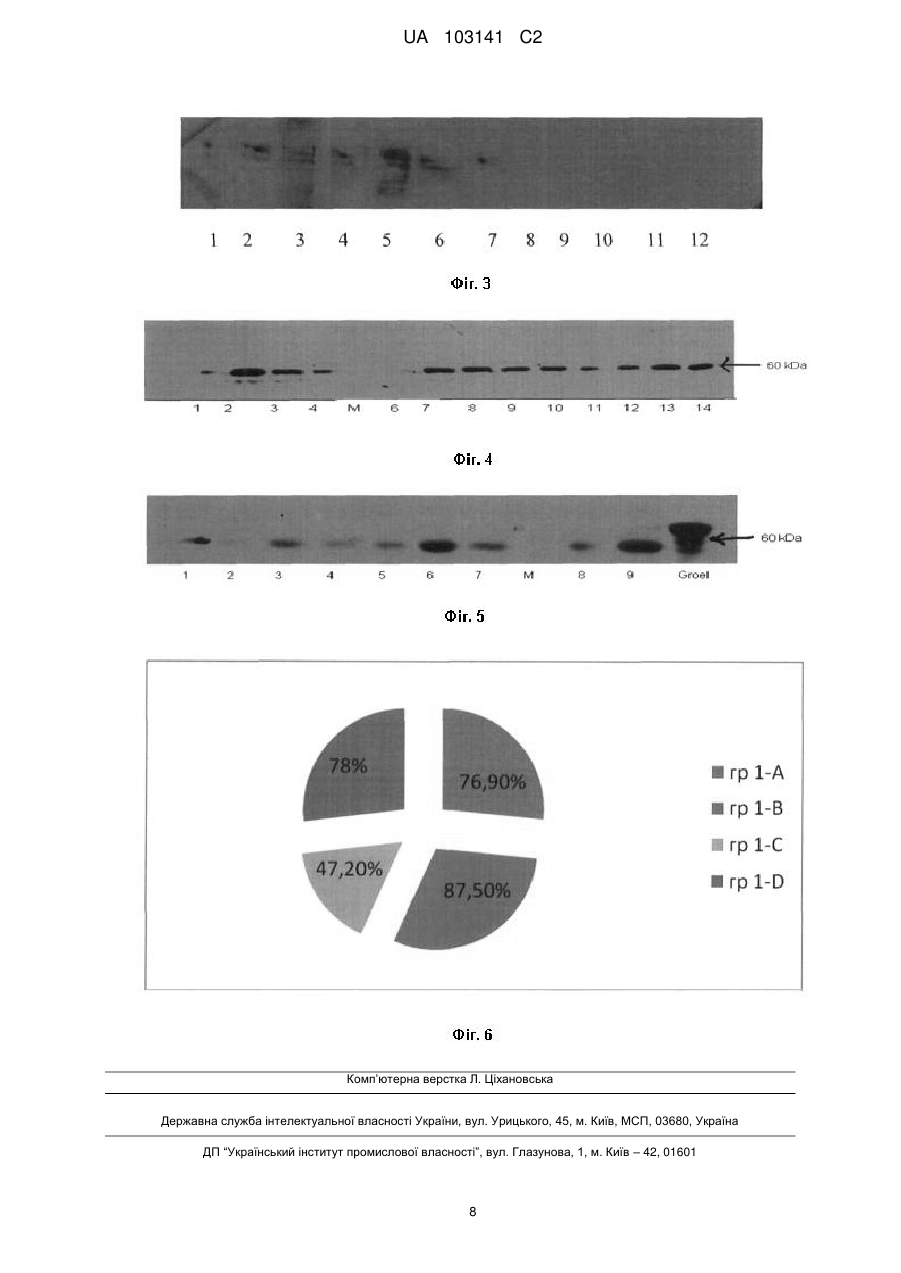
Реферат: Винахід стосується застосування анти-HSP60 антитіл сироватки крові донорів як маркерів імунної безпеки проведення гемотрансфузій в кардіохірургії вроджених вад серця. UA 103141 C2 (12) UA 103141 C2 UA 103141 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід належить до молекулярної біології, імунології, медицини, зокрема до способу визначення нових маркерів безпеки гемотрансфузій у кардіохірургїї вроджених вад серця. HSP60 людини - молекулярний шаперон, який залежно від локалізації може виконувати різні функції. У мітохондріях HSP60 за допомогою ко-шаперону HSP10 забезпечує правильну укладку клітинних білків, при стресі - запобігає їх неправильному згортанню та агрегації. Цитоплазматичний HSP60 виконує антиапоптичну функцію [1, 2]. Присутність HSP60 на клітинній мембрані асоційована з мембранним транспортом та сигнальними процесами [3]. Підвищення рівня мембраннозв'язаного HSP60 вважається сигналом небезпеки для імунної системи [4]. HSP60 також секретується із клітин, виявляється у плазмі [5]. Відомо, що на клітинній поверхні кардіоміоцитів, HSP60 експресується лише після дії стресових факторів, у тому числі при гіпоксії [1] та хірургічному втручанні [6]. На культурі неонатальних кардіоміоцитів було показано, що HSP60 може секретуватись у позаклітинний простір екзосомальним шляхом, причому за стресових умов цей процес посилюється [5]. Підвищена експресія HSP60 захищає клітини та органи, включаючи серце, від негативних стресових чинників [7, 8]. Встановлено, що попередня індукція HSP60 у серці помірним стресом забезпечує протективний ефект проти більш сильного стресу [9, 10]. З іншого боку, підвищена експресія HSP60 на мембрані кардіоміоцитів, а також його наявність у позаклітинному просторі може представляти потенційну мішень для перехресно-реактивних антитіл до мікробних HSP60, які можуть бути у донорській крові, що використовується при хірургічній корекції вроджених вад серця (ВВС). Показано, що такі анти-НSР60 антитіла можуть опосередковувати комплементзалежну цитотоксичність, зумовлювати лізис або апоптоз клітин, що експресують на своїй поверхні ендогенний HSP60. Анти-НSР60 здатні формувати імунні комплекси з ендогенним HSP60 і зумовлювати активацію комплементу [11]. Вони також можуть зв'язувати циркулюючий у плазмі крові ендогенний HSP60 і утворювати імунні комплекси з патологічним впливом на тканини [12]. Експериментально було показано, що моноклональні анти-НSР60 антитіла підсилювали запальні реакції, індуковані HSP60 [13]. Встановлено зв'язок між наявністю у доопераційний період циркулюючих анти-НSР60 антитіл у дорослих пацієнтів з операціями на серці та розвитком у післяопераційному періоді фібриляції передсердя (atrial fibrillation) [6]. Відповідно до пп. 3.2.1. Порядку медичного обстеження донорів крові та (або) її компонентів Закону України "Про донорство крові та її компонентів" (Відомості Верховної Ради України (ВВР), 1995, № 23, ст.183): Перед здаванням крові у донора визначається вміст гемоглобіну та (або) гематокрит, група крові за системою АВ0. Подальше обстеження взятої донорської крові проводиться у лабораторіях закладів переливання крові за такими показниками: група крові та резус-належність, Rh-типування, визначення антиеритроцитарних антитіл; маркерів ВІЛ-1/2; маркерів гепатиту С; маркерів гепатиту В; маркерів до сифілісу; активність аланін-амінотрансферази (АЛТ). Проте, дослідження донорської крові на особливо небезпечні інфекції не дає можливості повноцінно оцінити здатність донорської крові виконувати найважливіші функції не порушуючи імунної системи реципієнта. Саме чужорідні антитіла, які потрапляють із крові донора, здатні викликати імунні розлади, які приводять до певних дисфункцій і проявляються у вигляді клінічних ускладнень після гемотрансфузій, іноді вони можуть бути незворотні. Анти-HSP60 антитіла, присутні у сироватці крові донорів, можуть потрапляти в організм реципієнта і спричинювати різні імунні дисфункції, зв'язувати циркулюючий у плазмі крові ендогенний HSP60 і утворювати імунні комплекси з патологічним впливом на тканини [12, 14]. Експериментально було показано, що моноклональні aнти-HSP60 антитіла підсилювали запальні реакції, індуковані HSP60 [13]. Відомий спосіб дослідження властивостей білка теплового шоку (бтш70) (патент РФ № 2334988, МПК (2006.01) G01N33/68, опубліковано: 27.09.2008), під час якого визначають активність білка теплового шоку (БТШ70), для чого готують переживаючі зрізи нервової тканини мозку, інкубаційне середовище для зрізів, проводять вимірювання і зіставлення параметрів біоелектричної активності до і після тестуючих впливів. А саме, у приготованих зрізів реєструють вихідні параметри амплітуди N-метил-О-аспартатного збудливого постсинаптичного потенціалу (НМДА ВПСП), для визначення амплітуди НМДА ВПСП зрізи стимулюють електричними імпульсами прямокутної форми, тривалістю 0,1 мс, інтенсивністю 10 В, з частотою 1 імпульс у хвилину, далі аплікують (БТШ70) на всі зрізи в концентрації 1 мкг/мл, потім зрізи однієї групи тетанізують електричними імпульсами з частотою 100/с, тривалістю 30 с, зрізи 1 UA 103141 C2 5 10 15 20 25 30 35 40 45 50 55 іншої групи піддають аноксичному впливові шляхом заміни кисневої атмосфери на азот протягом 10 хв., у всіх зрізах вимірюють амплітуду НМДА ВПСП після впливів. Однак, даний спосіб не дає можливості визначити біологічну активність саме анти-HSP60 антитіл, їх здатності розпізнавати антиген-мішень у лізатах передсердь новонароджених з транспозицією магістральних судин (ТМС). Авторами під час проведення патентно-інформаційних досліджень і підготовки заявки не виявлені способи визначення нових маркерів безпеки гемотрансфузій у кардіохірургїї вроджених вад серця. В основу винаходу поставлена задача створення такого способу визначення нових маркерів безпеки гемотрансфузій у кардіохірургії вроджених вад серця, який би дав можливість визначити імунологічну безпечність використання донорської крові та доказати переваги аутологічної пуповинної крові в кардіохірургії вроджених вад серця. Поставлена задача вирішуються тим, що визначення нових маркерів безпеки гемотрансфузій у кардіохірургїї вроджених вад серця, який включає забір венозної крові у новонароджених з транспозицією магістральних судин до операції, її заморожування при температурі 38-40 °C, проведення операції "артеріального переключення" з використанням аутологічної пуповинної крові для пацієнтів першої групи і застосування компонентів донорської крові для пацієнтів другої групи, забір біоптату з правого передсердя під час операції і заморожування його при температурі 38-40 °C, забір венозної крові на першу, третю, сьому добу після операції, центрифугування її і заморожування сироватки крові при температурі 3840 °C, імунологічне дослідження по визначенню кількості анти-HSP60 антитіл в сироватці крові у новонароджених з транспозицією магістральних судин на всіх етапах дослідження до операції та на першу, третю, сьому добу після неї, визначення експресії HSP60 в сумарному лізаті біоптату правого передсердя новонароджених з транспозицією магістральних судин методом імуноблотингу, проведення скринінгу сироватки крові здорових донорів на наявність анти НSР60-антитіл, визначення найбільш імунореактивних до HSP60 сироваток, афінне очищення анти-НSР60 антитіл з найбільш імунореактивних до HSP60 сироваток донорів та новонароджених з транспозицією магістральних судин, визначення біологічної активності aнтиHSP60 антитіл, проведення статистичної обробки отриманих даних, проведення кореляційного аналізу між імунологічними та клінічними показниками, за результатами досліджень визначення нових маркерів безпеки гемотрансфузій в кардіохірургії вроджених вад серця. Суть пропозиції пояснюється на схематичних кресленнях: Суть винаходу пояснює креслення. На фіг. 1 показано процент антитілопозитивних сироваток до анти-HSP60 у новонароджених з ТМС, яким під час операції застосовували кордову кров та компоненти донорської крові. На фіг. 2 показано рівень aнти-HSP60 антитіл в сироватках крові донорів. На фіг. 3 показано HSP60-імунореактивність сироваток крові донорів, яку підтверджували методом імуноблотингу, де № 1- маркер, № 2-HSP60 оброблений поліклональними антитілами до HSP60 миші, № 3-7 - сироватка донорів з високою анти-HSP60 реактивністю, № 8-12 сироватка донорів з низькою анти HSP60 реактивністю. На фіг. 4 представлено результати досліджень рівня експресії HSP60 у передсерді новонароджених з ТМС, яким переливали пуповинну (1 група, n = 4) або донорську кров (2 група, n = 14), де № 1-4, 6-14 Лізати правого передсердя новонароджених оброблені поліклональними анти-HSP60 антитілами, № 5 - маркер. На фіг. 5 представлено результати досліджень рівня експресії HSP60 у передсерді новонароджених з ТМС, яким переливали пуповинну (1 група, n = 4) або донорську кров (2 група, n = 14), де № 1-7, 8-9 Лізати правого передсердя новонароджених оброблені анти-HSP60 антитілами афінноочищеними з найбільш імунореактивних сироваток донорів. На фіг. 6 графічно представлено післяопераційна гіпертермія у пацієнтів з перелитою донорською кров'ю по підгрупах (1-А, 1-В, 1-С, 1-D) з антитілопозитивною та антитілонегативною сироваткою крові до HSP60 у відсотках. Спосіб визначення нових маркерів безпеки гемотрансфузій в кардіохірургії вроджених вад серця проводили наступним чином: Об'єкт дослідження 122 новонароджених, із них 99 з транспозицією магістральних судин, розділені на дві групи: Перша група новонароджених з транспозицією магістральних судин (N = 34), включала: пренатально встановлений діагноз, застосування аутологічної пуповинної крові під час оперативного втручання. 2 UA 103141 C2 5 10 15 20 25 30 Друга група новонароджених з транспозицією магістральних судин (N = 65), включала: постнатально встановлений діагноз, застосування донорської крові під час оперативного втручання. Третя група практично здорові новонароджені (N = 23). 1. Проводили забір венозної крові у новонароджених з транспозицією магістральних судин до операції, заморожували сироватку крові при t -40 °C. 2. Проводили операцію "артеріальне переключення" новонародженим з ТМС з використанням в 1-й групі аутологічної пуповинної крові, в 2-й групі компоненти донорської крові. 3. Проводили забір біоптату з правого передсердя у новонароджених з ТМС, під час операції, матеріал заморожували при t -40 °C. 4. Проводили забір венозної крові у новонароджених з транспозицією магістральних судин після операції на 1-у, 3-ю, 7-у добу, відбирали сироватку крові і заморожували при t -40 °C. 5. Проводили імунологічне дослідження по визначенню рівнів антитіл до білка HSP60 в сироватці крові новонароджених з ТМС до операції, на 1-у, 3-ю, 7-у добу після неї методом ELISA. 6. Проводили забір венозної крові у здорових донорів (123n), кров яких переливали новонародженим під час операції "артеріального переключення" з використанням апарата штучного кровообігу. Досліджували вміст анти-HSP60 антитіл в сироватці крові донорів. 7. На наступному етапі роботи найбільш імунореактивні до HSP60 сироватки донорів були афінно очищені з використанням ProteinG-сефарози для подальшого дослідження їх біологічних властивостей. Також були почищені найбільш імунореактивні до HSP60 сироватки новонароджених з ТМС (Табл. 1), для цього сироватки в загальному об'ємі 480-500 мкл розводили буфером РВС (4 мл) та фільтрували через Міllіроrе фільтр (0,45 мн). Колонку врівноважували буфером PBS. Профільтровані сироватки 4 рази пропускали через колонку, потім наносили на колонку та інкубували 1 год. при кімнатній температурі. Колонку відмивали від білка, що не зв'язався, буфером PBS. Елюцію зв'язаного білка проводили 0,2 М гліциновим буфером, рН 2,5, з наступною нейтралізацією рН розчином 1 М Трис, рН 7,0. Пікові фракції антитіл діалізували проти буфера PBS протягом ночі при 4 °C. Антитіла зберігали з додаванням 1 мМ азиду натрію при +4 °C. Таблиця 1 Концентрація IgG антитіл, почищених на ProteinG сефарозі з найбільш імунореактивних до HSP60 сироваток N п/п Групи пацієнтів 1 2 Донори Донори Новонароджені з ВВС, яким переливали донорську кров, до операції (рівень анти-Hsр60 антитіл підвищений) Новонароджені з ВВС, яким переливали донорську кров, 8 доба після операції (до операції рівень анти-НSР60 антитіл підвищений) Новонароджені з ВВС, яким переливали донорську кров, 8 доба після операції (до операції рівень анти-НSР60 антитіл в нормі) Новонароджені з ВВС, яким переливали пуповинну кров, до операції Новонароджені з ВВС, яким переливали пуповинну кров, 8 доба після операції 3 4 5 6 7 35 Концентрація афінно очищених на ProteinG сефарозі IgG антитіл С = 1,04 мг/мл С = 0,93 мг/мл С = 0,87 мг/мл С = 1,0 мг/мл С = 0,37 мг/мл С = 0,89 мг/мл С = 0,61 мг/мл 8. Одержували сумарний лізат із тканини правого передсердя міокарду. Тканину правого передсердя новонароджених з ТМС (m = 10-14 мг) промивали в PBS буфері та обережно гомогенізували у фарфоровій ступці з додаванням кварцового піску, всі процедури здійснювали на льоду. Використовували Ripa буфер: 20 мМ Трис-НСl, рН 7,5; 150 мM NaCl; 1 мМ ЕДТА; 1 % NP-40; 1 % дезоксихолат натрію; 0,1 % додецилсульфат натрію; 0,1 % SDS, 0,1 % розчин суміші інгібіторів протеаз (Sigma, США), PMSF. Екстракцію проводили протягом 30 хв. при +4 °C. Гомогенат центрифугували (14000 × g, 30 хвилин при +4 °C). Надосад обережно переносили в 3 UA 103141 C2 5 10 15 20 25 30 35 40 45 50 55 60 полістиролову мікропробірку і вимірювали концентрацію білка в лізаті на спектрофотометрі при 280 нм. Лізат зберігали при -20 °C. 9. Досліджували рівень експресії HSP60 у передсерді новонароджених з ТМС, яким переливали пуповинну або донорську кров. Для цього: - проводили електрофоретичне розділення білків у поліакриламідному гелі (ПААГ). Електрофорез отриманих лізатів проводили у 12 % ПААГ-SDS у денатуруючих умовах за Леммлі. У лунки ПААГ пластини наносили зразки, вирівняні по концентрації білка (5 мкг/мкл) та по об'єму (по 15 мкл на доріжку). До досліджуваних зразків додавали 1/4 об'єму Sample буфера (500 мМ Трис-НСl, рН 6,8; 2 % додецилсульфату натрію (SDS); 5 % 2-меркаптоетанолу; 0,1 % барвника бромфенолового синього). Зразки прогрівали (5 хв., 95 °C) і наносили на гель. Після електрофорезу гель використовували для електропереносу на нітроцелюлозу ВА-85 (ShleicherandShull), після чого гель фарбували для контролю переносу білків буфером, який містив 0,2 % CoomassiebrilliantR-250 в 45 % етанолі та 10 % оцтовій кислоті, упродовж ночі при кімнатній температурі, або 30-60 хв. при температурі 90 °C. Надлишок фарби відмивали буфером, що містив 10 % оцтової кислоти та 5 % етанолу при перемішуванні до появи чітких білкових зон. - проводили вестерн-блот аналіз (імуноблотинг). Після електрофорезу гель прикладали до нітроцелюлозної мембрани і переносили білки протягом 1 години при 180 мА на приладі для напівсухого перенесення CSLSemiDryMiniSystem "CleaverScientificLtd" (США), з використанням буфера, що містив 200 мМ гліцину, 25 мМ Трис-НСl, рН 7,4 і 20 % метанолу. Потім вільні сайти адсорбції на мембрані блокували 5 % розчином знежиреного молока в буфері PBS-T протягом 1 години при кімнатній температурі. Після цього її інкубували протягом ночі з поліклональними анти-GroEl антитілами у розчині PBS-T-5 % знежирене молоко (100 мкл антитіл [С = 1 мг/мл] на 5 мл буфера). Надлишок антитіл відмивали PBS-T 3 рази по 10 хвилин. Далі мембрану інкубували 1 годину при кімнатній температурі з вторинними антитілами у розведенні 1:5000 (Jackson, GreatBritain) в PBS-T. Надлишок антитіл відмивали PBS-T. Для візуалізації результату блотингу мембрану вимочували впродовж 5 хвилин в ECL реагенті (1,25 мМ люмінол, 0,45 мМ кумарова кислота, 0,015 % Н2О2 в 100 мМ Трис-НСl, рН 8,5) і експонували на рентгенівську плівку. 10. Для визначення, які взаємозв'язки можуть утворювати aнти-HSP60 антитіла із клінічними маркерами і як це клінічно проявляється, проводили кореляційний аналіз між деякими досліджуваними клінічними показниками і кількістю антитіл в сироватці крові новонароджених 2ї групи. Друга група новонароджених, яким переливалась донорська кров, була поділена на підгрупи: 1А - пацієнти, які як до операції, так і після неї мали високі титри анти-НSР60 антитіл в сироватці крові; 1В - діти які до операції мали низькі титри анти-НSР60 антитіл в сироватці, після операції мали антитілопозитивну сироватку крові; 1С - новонароджені, які як до, так і після операції мали низькі титри анти-НSР60 антитіл; 1D - діти які до операції мали низькі титри анти-НSР60 антитіл в сироватці, а після операції їх кількість зростала і вони мали як підвищені, так і високі анти-НSР60 антитіла в сироватці крові. За результатами способу визначення нових маркерів безпеки гемотрансфузій в кардіохірургії вроджених вад серця при дослідженні сироваток крові новонароджених з ТМС на наявність анти-НSР60 у після операційний період підвищений рівень анти-НSР60 антитіл виявлявся лише у новонароджених 2-ї групи, яким переливали донорську кров (у 40 % випадків), тоді як у новонароджених 1-ї групи, яким переливали пуповинну кров у післяопераційний період анти-НSР60 позитивні сироватки не детектувались (Фіг. 1). Антитілопозитивною вважали сироватку m+2SD. До операції ми бачимо що антитілопозитивні до HSP60 сироватки крові зустрічались як в 1-й так і в 2-й групі пацієнтів, ці антитіла діти отримали від матері трансплацентарно. У післяопераційному періоді у антитілопозитивних до операції новонароджених 1-ї групи, яким переливали аутологічну пуповинну кров, спостерігалось поступове зниження рівня антиНSР60 антитіл в сироватці крові, що свідчить про те що дані антитіла поступово руйнуються в організмі дитини. Слід відмітити, що в жодного пацієнта цієї групи не спостерігалось зростання рівня таких антитіл. Тоді як у частини новонароджених, яким переливали донорську кров, у післяопераційний період, навпаки спостерігалось зростання рівня анти-НSР60 антитіл, причому, деякі пацієнти ставали антитілопозитивними, отримавши донорську кров та плазму. Авторами було проведено кореляційний аналіз між кількістю перелитої чужорідної плазми новонародженим 2-ї групи та кількістю aнти-HSP60 антитіл в сироватці крові дітей 2-ї групи на 1у та 3-ю добу після операції і виявлено позитивну кореляцію r = 0,37 (на 1-у добу), r = 0,4 (на 3-ю 4 UA 103141 C2 5 10 15 20 25 30 35 40 45 добу). Тобто, чим більша кількість плазми вливалась тим вищими були рівні анти-НSР60 антитіл в сироватці крові новонароджених. Проведення кореляції між перелитою пуповинною кров'ю та кількістю анти-НSР60 антитіл у новонароджених 1-ї групи показало негативну кореляцію на 3-ю добу після операції r = -0,39, між кількістю перелитої пуповинної крові на 1 кг маси тіла дитини і кількістю анти-НSР60 антитіл в сироватці також отримали негативну кореляцію, де r = -0,42, що свідчить про те, що власна пуповинна кров впливає на руйнування антитіл до HSP60, чим більше її вливаєш, тим нижче вміст анти-НSР60 антитіл в сироватці крові. Досліджували рівень експресії HSP60 у передсерді новонароджених з ТМС, яким переливали пуповинну (1 група, n = 4) або донорську кров (2 група, n = 14), - результати представлено на Фіг. 4, 5. Отримані авторами результати, які представлені на Фіг. 5, свідчать, що IgG антитіла, почищені з найбільш імунореактивних до HSP60 сироваток донорів на ProteinG-сефарозі, проявляли свою біологічну активність, розпізнаваючи в лізатах передсердь новонароджених з ТМС білок з молекулярною вагою близько 60 кДа, що відповідає молекулярній вазі досліджуваного шапероніну HSP60. Це свідчить, що анти-НSР60 антитіла, потрапляючи в організм реципієнта із донорської крові, здатні зв'язуватись з білком HSP60 на поверхні кардіоміоцитів, де їх кількість значно перевищує за інші клітини, особливо після стресу, яким може бути операція на серці, коли цитоплазматичний HSP60 експресується на поверхні клітини і виходить у позаклітинний простір. Зв'язуючись з HSP60 на поверхні клітини анти-НSР60 антитіла можуть опосередковувати комплементзалежну цитотоксичність, зумовлювати лізис або апоптоз клітин, що експресують на своїй поверхні ендогенний HSP60. Aнти-HSP60 здатні формувати імунні комплекси з ендогенним HSP60 і зумовлювати активацію комплементу [11]. Скринінг сироваток крові здорових донорів показав, що анти-НSР60 антитіла виявлено у всіх донорів (n = 123, віком від 20 до 48 років) Фіг. 2. За результатами проведених досліджень у 6,5 % обстежених донорів сироватки були антитілопозитивними, у 21 % анти-НSР60 антитіла були вищими більше, ніж в 2 рази за показник середнього значення. Антитілопозитивною вважали сироватку m+2SD. Авторами встановлена кореляція між перелитою донорською кров'ю пацієнтам 2 групи та перебуванням їх в стаціонарі r = 0,54, р
ДивитисяДодаткова інформація
Автори англійськоюVorobiova Hanna Mykhailivna, Sydoryk Liudmyla Leonidivna, Yakovenko Liudmyla Fedorivna, Yemets Illia Mykolaiovych
Автори російськоюВоробьева Анна Михайловна, Сидорик Людмила Леонидовна, Яковенко Людмила Федоровна, Емец Илья Николаевич
МПК / Мітки
МПК: G01N 33/53
Мітки: безпеки, антитіл, гемотрансфузій, маркерів, імунної, вад, застосування, серця, вроджених, кардіохірургії, проведення, анти-нsp60
Код посилання
<a href="https://ua.patents.su/10-103141-zastosuvannya-anti-nsp60-antitil-yak-markeriv-imunno-bezpeki-provedennya-gemotransfuzijj-u-kardiokhirurgi-vrodzhenikh-vad-sercya.html" target="_blank" rel="follow" title="База патентів України">Застосування анти-нsp60 антитіл як маркерів імунної безпеки проведення гемотрансфузій у кардіохірургії вроджених вад серця</a>
Попередній патент: Вертикальний кільцевий високоградієнтний магнітний сепаратор
Наступний патент: Ручний аплікатор для встановлення на клапанному з’єднанні пляшки з адаптером пістолета-аплікатора
Випадковий патент: Спосіб одержання хлорованого поліетилену