Спосіб синтезу (1s,2r)-мілнаципрану
Номер патенту: 104884
Опубліковано: 25.03.2014
Автори: Ельє Поль, Дьяр Катрін, Сюбра Лоран, Ніколя Марк
Формула / Реферат
1. Спосіб синтезу фармацевтично прийнятної кислотно-адитивної солі (1S,2R)-мілнаципрану такої формули (І):
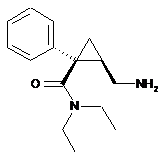 , (I)
, (I)
що включає такі послідовні стадії, на яких:
(а) піддають взаємодії фенілацетонітрил та (R)-епіхлоргідрин в присутності основи, що містить лужний метал, з наступною обробкою основою і потім обробкою кислотою, щоб одержати лактон такої формули (II):
 ; (II)
; (II)
(б) піддають взаємодії лактон (II), отриманий на попередній стадії (а), з MNEt2, де М є лужним металом, або з NHEt2 в присутності комплексу кислота Льюїса-амін, де амін вибраний з діетиламіну, триетиламіну, діізопропілетиламіну, N,N-діетиланіліну, N,N-диметилбензиламіну, N-метилпіперидину, N-метилморфоліну, N,N'-диметилпіперазину та гексаметилентетраміну, щоб одержати амідний спирт такої формули (III):
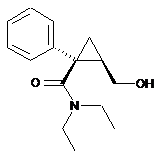 ; (III)
; (III)
(в) піддають взаємодії амідний спирт формули (III), отриманий на попередній стадії (б), з тіонілхлоридом, щоб одержати хлорвмісний амід такої формули (IV):
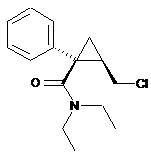 ; (IV)
; (IV)
(г) піддають взаємодії хлорвмісний амід формули (IV), отриманий на попередній стадії (в), із сіллю фталіміду, такою як калієва сіль, щоб одержати фталімідне похідне такої формули (V):
 ; (V)
; (V)
(д) здійснюють гідроліз фталімідної групи фталімідного похідного формули (V), отриманого на попередній стадії (г), щоб одержати (1S,2R)-мілнаципран, і
(e) одержують сіль (1S,2R)-мілнаципрану, отриманого на попередній стадії (д), у придатній системі розчинників в присутності фармацевтично прийнятної кислоти.
2. Спосіб за п. 1, який відрізняється тим, що стадії (а)-(д) проводять у реакційному середовищі, яке містить один й той самий простий розчинник.
3. Спосіб за п. 2, який відрізняється тим, що розчинник є толуолом.
4. Спосіб за будь-яким з пп. 1 і 2, який відрізняється тим, що жоден із проміжних продуктів, отриманих на стадіях (а)-(г), краще (а)-(д), не виділяють із реакційного середовища.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що стадію (б) проводять в присутності NHEt2 і АlСl3 як кислоти Льюїса.
6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що стадію гідролізу (д) проводять у ході реакції з гідразином, алкіламіном, таким як метиламін, або гідроксіалкіламіном, таким як етаноламін.
7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що стадію солеутворення (e) проводять в присутності соляної кислоти, щоб одержати гідрохлорид (1S,2R)-мілнаципрану.
8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що стадію солеутворення (є) проводять у системі розчинників, що включає толуол.
9. Спосіб за п. 8, який відрізняється тим, що система розчинників є сумішшю толуолу, ізопропілацетату та ізопропанолу.
10. Спосіб за п. 9, який відрізняється тим, що система розчинників має такий склад, від загального об'єму розчинників:
0-50 %, краще від 30 до 40 % об., толуолу,
40-90 %, краще від 50 до 80 % об., ізопропілацетату, і
5-25 %, краще від 10 до 20 % об., ізопропанолу.
11. Сполука такої формули (IV) у її (1S,2R)-енантіомерній формі:
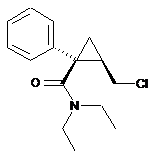 (IV).
(IV).
Текст
Реферат: Даний винахід стосується способу синтезу фармацевтично прийнятної кислотно-адитивної солі (1S,2R)-мілнаципрану, що включає такі послідовні стадії, на яких: (а) піддають взаємодії фенілацетонітрил і (R)-епіхлоргідрин в присутності основи, що містить лужний метал, з наступною обробкою основою і потім обробкою кислотою, щоб одержати лактон; (б) піддають взаємодії зазначений лактон з MNEt2, де М є лужним металом, або з NHEt2 в присутності комплексу кислота Льюїса-амін, щоб одержати амідний спирт; (в) піддають взаємодії зазначений амідний спирт із тіонілхлоридом, щоб одержати хлорвмісний амід; (г) піддають взаємодії зазначений хлорвмісний амід із сіллю фталіміду, щоб одержати фталімідне похідне; (д) здійснюють гідроліз фталімідної групи зазначеного фталімідного похідного, щоб одержати (1S,2R)-мілнаципран, і (є) одержують сіль (1S,2R)-мілнаципрану в придатній системі розчинників в присутності фармацевтично прийнятної кислоти. UA 104884 C2 (12) UA 104884 C2 UA 104884 C2 5 10 15 20 Даний винахід стосується способу асиметричного синтезу (1S,2R)-мілнаципрану, а також хлорвмісної проміжної сполуки в основній (1S,2R) енантіомерній формі. Мілнаципран є антидепресантом, інгібуючим зворотне захоплення серотонінунорадреналіну, рекомендованим при лікуванні депресії (FR 2508035). В літературі описані численні синтези рацемічної сполуки (ЕР 0377381; ЕР 0200638; ЕР 1757597; ЕР 1767522; ЕР 1845084; ЕР 1770084; Shuto S. et al., J. Med. Chem. 1995, 38, 29642968). Крім того, останнім часом було продемонстровано, що енантіомер (1S,2R)-мілнаципрану є більш активним, ніж рацемічна суміш (Viazzo P. et al., Tetrahedron Lett. 1996, 37, 26, 4519-4522). Перший спосіб одержання цього енантіомера в збагаченій формі полягав у відокремленні або виділенні енантіомерів з рацемічної суміші (Bonnaud B. et al., J. Chromatogr. 1985, 318, 398403). Однак такий спосіб економічно не ефективний у промисловому масштабі, тому що втрачається щонайменше половина продукту. Потім розробляли енантіоселективні синтези для одержання енантіомерно збагаченого мілнаципрану (Doyle M.P. and Hu W. Adv. Synth. Catal. 2001, 343, 299-302; Roggen H. et al., Bioorg. Med. Chem. 2007, 17, 2834-2837; Shuto S. et al., Tetrahedron Lett. 1996, 37, 641-644; Wang X.-Q. et al., Chinese journal of Pharmaceuticals 2004, 35, 259-260; WO 2005/118564). Однак у більшості цих синтезів як реагент використовується азид натрію, який навряд чи можна розглядати з погляду промислового виробництва через його токсичність та його нестабільність, яка може привести до вибуху. Отже, досі існує значна потреба в нових способах синтезу (1S,2R)-мілнаципрану, які будуть більш безпечними, більш економічними та більш ефективними. Таким чином, зокрема, предметом даного винаходу є спосіб синтезу фармацевтично прийнятної кислотно-адитивної солі (1S,2R)-мілнаципрану такої формули (I): 25 що включає послідовні стадії, на яких: (а) піддають взаємодії фенілацетонітрил та (R)-епіхлоргідрин у присутності основи, що містить лужний метал, з наступною обробкою основою і потім обробкою кислотою, щоб одержати лактон такої формули (II): 30 (б) піддають взаємодії лактон (II), отриманий на попередній стадії (а), з MNEt 2, де М є лужним металом, або з NНEt2 у присутності комплексу кислота Льюїса-амін, де амін вибраний з діетиламіну, триетиламіну, діізопропілетиламіну, N,N-діетиланіліну, N,N-диметилбензиламіну, N-метилпіперидину, N-метилморфоліну, N,N'-диметилпіперазину та гексаметилентетраміну, щоб одержати амідний спирт такої формули (III): 35 в) піддають взаємодії амідний спирт формули (III), отриманий на попередній стадії (б), з тіонілхлоридом, щоб одержати хлорвмісний амід такої формули (IV): 1 UA 104884 C2 (г) піддають взаємодії хлорвмісний амід формули (IV), отриманий на попередній стадії (в), із сіллю фталіміду, такою як калієва сіль, щоб одержати фталімідне похідне такої формули (V): 5 10 15 20 25 (д) здійснюють гідроліз фталімідної групи фталімідного похідного формули (V), отриманого на попередній стадії (г), щоб одержати (1S,2R)-мілнаципран, і (е) одержують сіль (1S,2R)-мілнаципрану, отриманого на попередній стадії (д), у придатній системі розчинників в присутності фармацевтично прийнятної кислоти. В даному винаході термін "фармацевтично прийнятний" описує, що це є придатним при одержанні фармацевтичної композиції, яка, як правило, є безпечною, нетоксичною та біологічно чи інакше придатною, і яка є прийнятною як для ветеринарного застосування, так і для фармацевтичного використання людиною. Термін "фармацевтично прийнятна кислотно-адитивна сіль" сполуки призначений для позначення в даному винаході солей, які є фармацевтично прийнятними, як визначено тут, мають необхідну фармакологічну активність вихідної сполуки, і які одержують шляхом додавання фармацевтично прийнятної кислоти до сполуки. Конкретніше, під "фармацевтично прийнятною кислотою" мають на увазі неорганічні кислоти, такі як соляна кислота, бромистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота та подібні, або органічні кислоти, такі як оцтова кислота, бензолсульфонова кислота, бензойна кислота, камфорсульфонова кислота, лимонна кислота, етансульфонова кислота, фумарова кислота, глюкогептонова кислота, глюконова кислота, глутамінова кислота, гліколева кислота, гідроксинафтойна кислота, 2-гідроксіетансульфонова кислота, молочна кислота, малеїнова кислота, яблучна кислота, мигдалева кислота, метансульфонова кислота, муконова кислота, 2-нафталінсульфонова кислота, пропіонова кислота, саліцилова кислота, бурштинова кислота, дибензоїл-L-винна кислота, винна кислота, п-толуолсульфонова кислота, триметилоцтова кислота, трифтороцтова кислота та подібні. Краще, це соляна кислота. Стадія (а): Дана стадія відповідає такій реакційній послідовності: 30 35 Під "основою, що містить лужний метал", мається на увазі у змісті даного винаходу основа формули RM, де: - М є лужним металом, зокрема, натрієм (Na), калієм (K) або літієм (Li), і - R є атомом водню, алкілом (таким як бутил або гексил), алкокси (таким як трет-бутилокси) 1 1 або групою NR 2, де R є атомом водню, алкілом (таким як ізопропіл) або групою Si(CH3)3. 2 UA 104884 C2 5 10 15 20 25 30 35 40 45 50 55 Під "алкілом" мається на увазі у змісті даного винаходу насичений, лінійний або розгалужений вуглеводневий ланцюг, що складається з 1-6 атомів вуглецю. Зокрема, це буде бутильна, гексильна або ізопропільна група. Під "алкокси" мається на увазі у змісті даного винаходу алкільна група, як визначено вище, пов'язана з іншою частиною молекули за допомогою атома кисню. Зокрема, це буде третбутилоксигрупа. Основа, що містить лужний метал, зокрема, вибрана з NaH, NaNH 2, гексаметилдисилазану калію або літію (KHMDS або LiHMDS), бутиллітію, гексиллітію, трет-бутилату натрію чи калію або діізопропіламіду літію (LDA). Краще, це буде NaH або NaNH 2, і краще це буде NaNH2. За допомогою подальшої обробки основою можливо гідролізувати нітрильну функціональну групу сполуки (3) до карбонової кислоти, щоб одержати сполуку (4). Гідроксид лужного металу є особливо придатним для цієї обробки, такий як NaOH або KOH, і особливо NaOH. Крім того, за допомогою обробки кислотою можливо здійснити циклізацію гідроксильного похідного кислоти (4) в лактон (II). Особливо придатною кислотою для цієї обробки є соляна кислота, а саме, у водному розчині, наприклад, 25 %. Стадії (а1), (а2) і (а3), краще, проводять в одному й тому самому реакційному апараті, не виділяючи проміжні продукти (3) і (4) (спосіб описаний як однореакторний метод). При цих умовах, краще, один й той самий простий розчинник використовують на цих 3 стадіях, і краще це толуол, однак основу та кислоту на стадіях (а2) і (а3), краще, вводять у формі водного розчину. Стадія (б): Конкретніше, під "лужним металом" розуміють натрій, калій і літій. Зокрема, MNEt2 може бути отриманий по реакції NHEt2 з алкоголятом лужного металу. До того ж MNEt2 може бути, краще, отриманий in situ, тобто шляхом додавання двох реагентів, NHEt2 та алкоголяту лужного металу, у реакційне середовище, що містить лактон. Під "алкоголятом лужного металу" у змісті даного винаходу мають на увазі сполуку формули Alk-O-M, де М є лужним металом, як визначено вище, і Alk є насиченим, лінійним або розгалуженим вуглеводневим ланцюгом, що містить від 1 до 6, краще, від 1 до 4 атомів вуглецю. Конкретніше, це MeONa, MeOK, EtONa або ще EtOK. Коли М = Li, LiNEt2 може бути отриманий шляхом додавання літієвого похідного, такого як бутиллітій, до NHEt2. У цьому випадку LiNEt2, краще, одержують заздалегідь перед введенням у реакційне середовище, що містить лактон. Під "літієвим похідним", зокрема, мають на увазі у змісті даного винаходу похідне формули Alk'Li, де Alk' є насиченим, лінійним або розгалуженим вуглеводневим ланцюгом, що містить від 1 до 6, краще, від 1 до 4 атомів вуглецю. Зокрема, це бутиллітій. Під "кислотою Льюїса" мають на увазі у змісті даного винаходу хімічну частинку, здатну акцептувати пару електронів і тому здатну утворювати комплекс із кисневим атомом карбонілу C=O лактону (II). У зв'язку із цим карбоніл лактону може бути активований і тому може бути додана нуклеофільна сполука (NHEt2) до лактону. Зокрема, кислотою Льюїса може бути AlCl3. Краще, цю стадію здійснюють в присутності діетиламіну та комплексу AlCl 3-NHEt2. Зокрема, цю стадію можна проводити в толуолі як розчиннику, застосовуючи в цьому випадку NHEt2 в присутності кислоти Льюїса, незважаючи на те, що можна очікувати реакцію ацилювання Фріделя-Крафтса між лактоном і толуолом в присутності кислоти Льюїса, такої як AlCl3. Краще, цю стадію виконують в присутності NHEt2 і AlCl3 як кислоти Льюїса. Стадія (в): У ході цієї стадії хлорування утворюється соляна кислота. Важливо видалити цю сполуку перед наступною стадією. Використання розчинника, такого як толуол, може полегшити це видалення в ході концентрування реакційного середовища. Безсумнівно, за допомогою толуолу можна легше видалити соляну кислоту в ході співвипаровування, ніж з таким розчинником, як метиленхлорид, через його більш високу температуру кипіння. Стадія (г): Цю стадію краще здійснюють із калієвою сіллю фталіміду. Реакцію, краще, можна проводити в толуолі як розчиннику. Стадія (д): Цю стадію гідролізу похідного фталіміду в первинному аміні, краще, здійснюють в ході реакції з гідразином, алкіламіном, таким як метиламін, або гідроксіалкіламіном, таким як етаноламін. 3 UA 104884 C2 5 10 15 20 25 30 35 40 45 50 Під "алкіламіном" мають на увазі у змісті даного винаходу амін формули Alk''NH 2, де Alk'' є насиченим, лінійним або розгалуженим вуглеводневим ланцюгом, що містить від 1 до 6, краще, від 1 до 4 атомів вуглецю. Зокрема, це метиламін. Під "гідроксіалкіламіном" мають на увазі у змісті даного винаходу гідроксиламін формули 2 2 HO-R -NH2, де R є насиченим, лінійним або розгалуженим вуглеводневим ланцюгом, що містить від 1 до 6, краще, від 1 до 4 атомів вуглецю. Зокрема, це етаноламін. Краще, цю стадію проводять в присутності етаноламіну. Цю стадію можна, краще, здійснювати в розчиннику, такому як толуол. Однак гідразин, алкіламін або гідроксіалкіламін можуть бути додані у формі водного розчину. Стадія (е): На цій стадії можливо одержати сіль (1S,2R)-мілнаципрану, отриманого на попередній стадії (д), і одночасно очистити та виділити кислотно-адитивну сіль (1S,2R)-мілнаципрану в ході кристалізації і потім фільтрації. Краще, цю стадію здійснюють в присутності соляної кислоти, щоб одержати гідрохлорид (1S,2R)-мілнаципрану. Краще, система розчинників, використовувана для солеутворення, включає толуол, і краще, є сумішшю толуолу, ізопропілацетату та ізопропанолу. Краще, ця суміш має такий склад, від загального об'єму розчинників: - 0-50 %, краще, від 30 до 40 % об., толуолу, - 40-90 %, краще, від 50 до 80 % об., ізопропілацетату, і - 5-25 %, краще, від 10 до 20 % об., ізопропанолу. Конкретніше, стадії (а)-(д) краще проводять у реакційному середовищі, яке включає один й той самий простий розчинник, такий як толуол. Безсумнівно, використовуючи один й той самий простий розчинник на всіх стадіях (за винятком останньої стадії солеутворення), можливо спростити процедуру одержання сполуки та зменшити її вартість завдяки тому, що розчинник не потрібно міняти на кожній стадії. При цих умовах, отже, не треба виділяти проміжні продукти реакції, навіть якщо стадії екстракції можуть бути здійснені для видалення деяких домішок, що можуть заважати належному протіканню наступних стадій. Таким чином, авторами винаходу несподівано знайдено, що всю послідовність реакцій можна здійснювати з одним й тим самим простим розчинником на стадіях (а)-(д), краще, з толуолом. При цих умовах, краще, не виділяють проміжні продукти, отримані на стадіях (а)-(г), краще, (а)-(д), з реакційного середовища. Таким чином, зрозуміло, що отримані проміжні продукти завжди знаходяться у розчині в реакційному середовищі, краще, в толуолі, і їх ніколи не виділяють у сухій або квазі-сухій формі. Однак можна виконувати стадії концентрування реакційного середовища, зокрема, після стадій екстракції, але краще, реакційне середовище не випарюють до сухого стану, зокрема, через витрати та незручність. Додаткова перевага полягає в запобіганні додатковим втратам продукту в ході проміжних стадій очищення. Таким чином, за допомогою даного способу можливо одержати (1S,2R)-мілнаципран з енантіомерним надлишком (ен) щонайменше 95 %, краще, щонайменше 98 %, і краще, з виходом більше 40 %, краще, більше 45 %, від (R)-епіхлоргідрину, використовуваного як вихідний продукт. Предметом даного винаходу є також сполука такої формули (IV) в (1S,2R) енантіомерній формі: а саме, як проміжна сполука синтезу. Цю сполуку, краще, одержують із енантіомерним надлишком більше 90 %, краще, більше 95 %, і ще краще, більше 98 %. Даний винахід буде краще зрозумілий з урахуванням необмежуючих прикладів, які наведені далі. Приклади: 4 UA 104884 C2 Гідрохлорид (1S,2R)-мілнаципрану, виходячи з 41 кг кінцевого продукту, синтезують згідно з такою схемою та робочою процедурою: 5 10 15 20 Стадії 1 - 4: 28 кг аміду натрію (682 моль) суспендують в 400 л толуолу і потім, інтенсивно перемішуючи, 85,5 кг фенілацетонітрилу (729,5 моль), розведеного в 10 л толуолу, виливають при температурі від 0 до 5 °C. Реакційну суміш перемішують протягом щонайменше 1 години при 10 °C. Додають 27 кг хірального епіхлоргідрину (292 моль) у розчині в 20 л толуолу, підтримуючи температуру 10 °C. По закінченні вливання суміш перемішують протягом щонайменше 2 годин. Гідроліз проводять, вливаючи реакційну суміш в 240 л водного розчину, підтримуючи температуру між 5 і 40 °C. Після концентрування отриманого розчину додають 115 кг 30 % соди та суміш нагрівають до 95 °C, щоб здійснити гідроліз нітрильних функціональних груп. Суміш двічі промивають 190 л толуолу. Толуольні фази видаляють, і водну фазу виділяють після додавання 270 л толуолу та підкисляють 25 % розчином соляної кислоти до рН в діапазоні від 1 до 2. Потім суміш нагрівають до 60 °C протягом щонайменше 3 годин. Після декантації толуольну фазу, що містить лактон, промивають 140 л води, нейтралізують 10 % розчином карбонату натрію до рН в діапазоні від 8 до 9 і потім знову промивають 140 л води. Отриману толуольну фазу концентрують до об'єму 120 л, що містить 38 кг лактону (218 моль). Стадія 5: 5 UA 104884 C2 5 10 15 20 25 30 35 34 кг хлориду алюмінію (255 моль) суспендують в 240 л толуолу і потім додають 38,3 кг діетиламіну (523,5 моль), підтримуючи температуру між 15 і 30 °C. Концентрат лактону (38 кг), отриманий раніше, виливають у суміш, підтримуючи 25 °C. Реакційну суміш перемішують протягом щонайменше 1 години 30 хвилин. Спостерігають утворення осаду. Цю реакційну суміш піддають гідролізу з 345 л води і потім фільтрують, додаючи речовину, що сприяє фільтрації. Після декантації органічну фазу двічі промивають 235 л і 175 л води і потім концентрують до утворення 110 л амід-спиртового концентрату. Стадія 6: 24,7 кг тіонілхлориду (207 моль) вливають у концентрат протягом 1 години при 25 °C при інтенсивному перемішуванні. Реакційну суміш концентрують у вакуумі, обмежуючи температуру 50 °C. Дану процедуру концентрування повторюють двічі після додавання двічі 62 л толуолу, щоб одержати концентрат хлорвмісного аміду. Стадія 7: Концентрат хлорвмісного аміду, отриманий на попередній стадії, виливають у суспензію фталіміду калію (51,9 кг фталіміду калію (280 моль) в 155 л толуолу), і суміш нагрівають до 85 °C протягом щонайменше 3 годин. Реакційну суміш охолоджують до 45 °C, двічі промивають 130 л води. Після декантації отримана толуольна фаза містить близько 74 кг фталімідоаміду (196,5 моль). Стадія 8: 92,4 кг етаноламіну (1513 моль) вводять у толуольний розчин фталімідоаміду при інтенсивному перемішуванні; суміш нагрівають до 82,5 °C протягом 2 годин. Після охолодження та додавання 247 л толуолу реакційну суміш промивають 225 л 20 % водного сольового розчину NaCl. Після 2 протитечійних екстракцій водної фази з 52 л толуолу толуольні фази поєднують і двічі промивають 225 л 20 % сольового розчину NaCl. Після декантації 185 л води додають до толуольної фазі та суміш підкисляють до рН в діапазоні від 2 до 3 за допомогою 25 % соляної кислоти. Після декантації кислотну органічну фазу знову екстрагують 74 л води. Потім органічну фазу видаляють. Об'єднані кислотні водні фази двічі екстрагують 370 і 150 л толуолу, після чого повертають основний рН, що дорівнює 12-13, за допомогою водного розчину 20 % соди. Об'єднані органічні фази промивають 80 л води і потім концентрують. Стадія 9: До толуольного концентрату додають 283 л ізопропілацетату та 48,4 л ізопропанолу. 5Н розчин соляної кислоти в ізопропанолі виливають у цей органічний розчин, знижуючи рН до 3-4 (близько 30 л розчину), при температурі 30 °C. У ході введення розчину кислоти гідрохлорид випадає в осад, суміш охолоджують до 10 °C и залишають щонайменше на 2 години при цій температурі. Суспензію фільтрують, 3 рази промивають 56 л ізопропілацетату. Отриманий продукт сушать у вакуумі при 70 °C. Одержують 41 кг гідрохлориду (1S, 2R)-мілнаципрану (145 моль), тобто вихід 49,6 % від хірального епіхлоргідрину. ФОРМУЛА ВИНАХОДУ 40 1. Спосіб синтезу фармацевтично прийнятної кислотно-адитивної солі (1S,2R)-мілнаципрану такої формули (І): O NH2 N 45 , (I) що включає такі послідовні стадії, на яких: (а) піддають взаємодії фенілацетонітрил та (R)-епіхлоргідрин в присутності основи, що містить лужний метал, з наступною обробкою основою і потім обробкою кислотою, щоб одержати лактон такої формули (II): 6 UA 104884 C2 O 5 O ; (II) (б) піддають взаємодії лактон (II), отриманий на попередній стадії (а), з MNEt2, де М є лужним металом, або з NHEt2 в присутності комплексу кислота Льюїса-амін, де амін вибраний з діетиламіну, триетиламіну, діізопропілетиламіну, N,N-діетиланіліну, N,N-диметилбензиламіну, N-метилпіперидину, N-метилморфоліну, N,N'-диметилпіперазину та гексаметилентетраміну, щоб одержати амідний спирт такої формули (III): O OH N ; (III) (в) піддають взаємодії амідний спирт формули (III), отриманий на попередній стадії (б), з тіонілхлоридом, щоб одержати хлорвмісний амід такої формули (IV): O Cl N 10 ; (IV) (г) піддають взаємодії хлорвмісний амід формули (IV), отриманий на попередній стадії (в), із сіллю фталіміду, такою як калієва сіль, щоб одержати фталімідне похідне такої формули (V): O O N N O 15 20 ; (V) (д) здійснюють гідроліз фталімідної групи фталімідного похідного формули (V), отриманого на попередній стадії (г), щоб одержати (1S,2R)-мілнаципран, і (e) одержують сіль (1S,2R)-мілнаципрану, отриманого на попередній стадії (д), у придатній системі розчинників в присутності фармацевтично прийнятної кислоти. 2. Спосіб за п. 1, який відрізняється тим, що стадії (а)-(д) проводять у реакційному середовищі, яке містить один й той самий простий розчинник. 3. Спосіб за п. 2, який відрізняється тим, що розчинник є толуолом. 4. Спосіб за будь-яким з пп. 1 і 2, який відрізняється тим, що жоден із проміжних продуктів, отриманих на стадіях (а)-(г), краще (а)-(д), не виділяють із реакційного середовища. 5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що стадію (б) проводять в присутності NHEt2 і АlСl3 як кислоти Льюїса. 7 UA 104884 C2 5 10 15 6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що стадію гідролізу (д) проводять у ході реакції з гідразином, алкіламіном, таким як метиламін, або гідроксіалкіламіном, таким як етаноламін. 7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що стадію солеутворення (e) проводять в присутності соляної кислоти, щоб одержати гідрохлорид (1S,2R)-мілнаципрану. 8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що стадію солеутворення (є) проводять у системі розчинників, що включає толуол. 9. Спосіб за п. 8, який відрізняється тим, що система розчинників є сумішшю толуолу, ізопропілацетату та ізопропанолу. 10. Спосіб за п. 9, який відрізняється тим, що система розчинників має такий склад, від загального об'єму розчинників: 0-50 %, краще від 30 до 40 % об., толуолу, 40-90 %, краще від 50 до 80 % об., ізопропілацетату, і 5-25 %, краще від 10 до 20 % об., ізопропанолу. 11. Сполука такої формули (IV) у її (1S,2R)-енантіомерній формі: O Cl N (IV). Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for syntiesis of (1s, 2r)-milnacipran
Автори англійськоюNicolas, Marc, Hellier, Paul, Diard, Catherine, Subra, Laurent
Автори російськоюЭлье Поль
МПК / Мітки
МПК: C07C 231/18, C07C 233/58, C07C 237/20
Мітки: 1s,2r)-мілнаципрану, спосіб, синтезу
Код посилання
<a href="https://ua.patents.su/10-104884-sposib-sintezu-1s2r-milnacipranu.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу (1s,2r)-мілнаципрану</a>
Попередній патент: Стабілізована агрохімічна композиція
Наступний патент: Ізотіазолілоксифеніламідини та їх застосування як фунгіцидів
Випадковий патент: Спосіб визначення температурної області існування проміжного порядку в склоподібних напівпровідниках












