Спосіб синтезу периндоприлу і його фармацевтично прийнятних солей
Формула / Реферат
1. Спосіб синтезу периндоприлу формули (І):

і його фармацевтично прийнятних солей, який відрізняється тим, що сполуку формули (II), конфігурації (S):
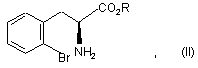
в якій R являє собою атом водню або захисну групу кислотної функції, піддають реакції зі сполукою формули (III), конфігурації (R):
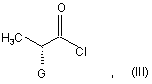
в якій G являє собою атом хлору або брому або гідрокси, р-толуолсульфонілокси, метансульфонілокси або трифторметансульфонілокси групу, у присутності основи з одержанням сполуки формули (IV):
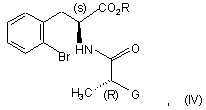
в якій R і G є такими ж, як визначено тут вище,
яку піддають реакції внутрішньомолекулярного поєднання з одержанням сполуки формули (V):
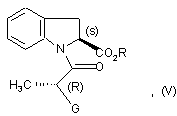
в якій R і G є такими ж, як визначено тут вище, яку піддають реакції зі сполукою формули (VI):
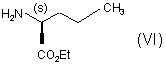
з одержанням сполуки формули (VII):
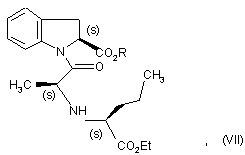
в якій R є таким же, як визначено тут вище,
яку піддають реакції каталітичної гідрогенізації з одержанням, після зняття захисту, де прийнятно, сполуки формули (І).
2. Спосіб синтезу за п. 1, який відрізняється тим, що R являє собою бензил або лінійну або розгалужену (С1-С6)алкільну групу.
3. Спосіб синтезу за п. 1, який відрізняється тим, що реакцію внутрішньомолекулярного поєднання проводять або у присутності основи і каталізатора, основаного на паладії, або використовуючи гідрид натрію і йодид міді (І) або бромід міді (І).
4. Спосіб синтезу за п. 3, який відрізняється тим, що реакцію внутрішньомолекулярного поєднання проводять у присутності основи і каталізатора, основаного на паладії і на арилфосфіні або бісфосфіні.
5. Спосіб синтезу за п. 4, який відрізняється тим, що основу, яку використовують для реакції внутрішньомолекулярного поєднання, вибирають з Cs2CO3, NaOtBu, Na2CO3, NaOAc i КО Ас.
6. Спосіб синтезу за п. 4 або 5, який відрізняється тим, що каталізатор, оснований на паладії і на арилфосфіні або бісфосфіні, вибирають з Рd(0)/РРh3, Рd(0)/Р(о-толіл)3, Рd(0)/Р(1-нафтил)3, Рd(0)/Р(о-метоксифеніл)3, Рd2(dbа)3/РРh3, Рd2(dbа)3/Р(о-толіл)3, Рd2(dbа)3/Р(1-нафтил)3, Рd2((dbа)3/Р(o-метоксифеніл)3, Pd2(dba)3/P(2-фурил)3, Pd2(dba)3/dppp, Pd2(dba)3/(±)-BINAP і (DPPF)PdCl2.CH2Cl2/DPPF,
BINAP, як повинно бути зрозумілим, являє собою 2,2'-біс(дифенілфосфіно)-1,1'-бінафтил,
dba, як повинно бути зрозумілим, являє собою дибензиліденацетон,
DPPF, як повинно бути зрозумілим, являє собою 1,1'-біс(дифенілфосфіно)фероцен і dppp, як повинно бути зрозумілим, являє собою 1,3-біс(дифенілфосфіно)пропан.
7. Спосіб синтезу за п. 1, який відрізняється тим, що G являє собою атом хлору або атом брому або р-толуолсульфонілокси, метансульфонілокси або трифторметансульфонілокси групу.
8. Спосіб синтезу за п. 7, який відрізняється тим, що реакцію між сполуками формул (V) і (VI) проводять у присутності органічного аміну, який вибирають з триетиламіну, піридину або діізопропілетиламіну, або мінеральної основи, яку вибирають з Na2CО3, К2СО3, NaHCO3 або КНСО3.
9. Спосіб синтезу за п. 1, який відрізняється тим, що G являє собою гідроксигрупу.
10. Спосіб синтезу за п. 9, який відрізняється тим, що реакцію між сполуками формул (V) і (VI) проводять у присутності N-метил-N-феніламінотрифенілфосфоній йодиду або, коли R відрізняється від атома водню, шляхом реакції Мітцунобу.
11. Сполука формули (IV) як проміжна сполука способу синтезу периндоприлу:

в якій R і G є такими ж, як визначено у п. 1.
12. Спосіб за будь-яким з пп. 1-10 синтезу периндоприлу у формі трет-бутиламінної солі.
Текст
Спосіб синтезу периндоприлу формули (І): H 3 83269 (s) N H3C CO2R O CH3 (s) NH (s) , (VII) CO2Et в якій R є таким же, як визначено тут вище, яку піддають реакції каталітичної гідрогенізації з одержанням, після зняття захисту, де прийнятно, сполуки формули (І). 2. Спосіб синтезу за п. 1, який відрізняється тим, що R являє собою бензил або лінійну або розгалужену (С1-С6)алкільну групу. 3. Спосіб синтезу за п. 1, який відрізняється тим, що реакцію внутрішньомолекулярного поєднання проводять або у присутності основи і каталізатора, основаного на паладії, або використовуючи гідрид натрію і йодид міді (І) або бромід міді (І). 4. Спосіб синтезу за п. 3, який відрізняється тим, що реакцію внутрішньомолекулярного поєднання проводять у присутності основи і каталізатора, основаного на паладії і на арилфосфіні або бісфосфіні. 5. Спосіб синтезу за п. 4, який відрізняється тим, що основу, яку використовують для реакції внутрішньомолекулярного поєднання, вибирають з Cs2CO3, NaOtBu, Na2CO3, NaOAc i КО Ас. 6. Спосіб синтезу за п. 4 або 5, який відрізняється тим, що каталізатор, оснований на паладії і на арилфосфіні або бісфосфіні, вибирають з Рd(0)/РРh3, Рd(0)/Р(о-толіл)3, Рd(0)/Р(1-нафтил)3, Рd(0)/Р(о-метоксифеніл)3, Рd2(dbа)3/РРh3, Рd2(dbа)3/Р(о-толіл)3, Рd2(dbа)3/Р(1-нафтил)3, Рd2((dbа)3/Р(o-метоксифеніл)3, Pd2(dba)3/P(2фурил)3, Pd2(dba)3/dppp, Pd2(dba)3/(±)-BINAP і (DPPF)PdCl2.CH2Cl2/DPPF, Даний винахід відноситься до способу синтезу периндоприлу формули (І): і його фармацевтично прийнятних солей. Периндоприл і його фармацевтично прийнятні солі, і більш конкретно трет-бутиламінна сіль, володіють цінними фармакологічними властивостями. 4 BINAP, як повинно бути зрозумілим, являє собою 2,2'-біс(дифенілфосфіно)-1,1'-бінафтил, dba, як повинно бути зрозумілим, являє собою дибензиліденацетон, DPPF, як повинно бути зрозумілим, являє собою 1,1'-біс(дифенілфосфіно)фероцен і dppp, як повинно бути зрозумілим, являє собою 1,3біс(дифенілфосфіно)пропан. 7. Спосіб синтезу за п. 1, який відрізняється тим, що G являє собою атом хлору або атом брому або р-толуолсульфонілокси, метансульфонілокси або трифторметансульфонілокси групу. 8. Спосіб синтезу за п. 7, який відрізняється тим, що реакцію між сполуками формул (V) і (VI) проводять у присутності органічного аміну, який вибирають з триетиламіну, піридину або діізопропілетиламіну, або мінеральної основи, яку вибирають з Na2CО3, К2СО3, NaHCO3 або КНСО3. 9. Спосіб синтезу за п. 1, який відрізняється тим, що G являє собою гідроксигрупу. 10. Спосіб синтезу за п. 9, який відрізняється тим, що реакцію між сполуками формул (V) і (VI) проводять у присутності N-метил-Nфеніламінотрифенілфосфоній йодиду або, коли R відрізняється від атома водню, шляхом реакції Мітцунобу. 11. Сполука формули (IV) як проміжна сполука способу синтезу периндоприлу: (s) CO2R Br HN O H3C (R) G , (IV) в якій R і G є такими ж, як визначено у п. 1. 12. Спосіб за будь-яким з пп. 1-10 синтезу периндоприлу у формі трет-бутиламінної солі. їх головна властивість являє собою інгібування ангіотензин І перетворювального ферменту (або кінінази II), що дозволяє, з одного боку, запобігти перетворенню декапептид ангіотензину І в октапептид ангіотензину II (вазоконстриктор) і, з іншого боку, запобігти деградації брадикініну (вазодилататор) в неактивний пептид. Ці дві дії сприяють позитивному впливу периндоприлу на серцево-судинні захворювання, більш конкретно на артеріальну гіпертензію і параліч серця. Периндоприл, його приготування і застосування в терапії були розкриті в [описі Європейського патенту ЕР 0 049 658]. Беручи до уваги фармацевтичне значення цієї сполуки, було важливо спромогтись одержати її ефективним способом синтезу, легковідтворюваною у промисловому масштабі, що веде до одержання периндоприлу у хорошому виході і з відмін 5 ною мірою чистоти, починаючи з вихідних матеріалів, які мають розумну ціну. [Опис патенту ЕР 0 308 341] розкриває промисловий синтез периндоприлу шляхом поєднання бензилового ефіру (28,За8,7а8)-октагідроіндол-2карбонової кислоти з етиловим ефіром N-[(S)-1карбоксибутил]-(8)-аланіну, з наступним зняттям захисту карбонової групи гетероциклу шляхом каталітичної гідрогенізації. Заявник в даний момент розробив новий спосіб синтезу периндоприлу, який використовує легко одержувані вихідні матеріали. Більш конкретно, даний винахід відноситься до способу синтезу периндоприлу та його фармацевтично прийнятних солей, який відрізняється тим, що сполуку формули (II), конфігурації (S): в якій R являє собою атом водню або захисну групу кислотної функції, піддають реакції зі сполукою формули (III), конфігурації (R): в якій G являє собою атом хлору або брому або гідрокси, р-толуолсульфонілокси, метансульфонілокси або трифторметансульфонілокси групу, у присутності основи для того, щоб одержати сполуку формули (IV): в якій R і G є такими ж, як визначено тут вище, яку піддають реакції внутрішньомолекулярного поєднання, для того, щоб одержати сполуку формули (V): в якій R і G є такими ж, як визначено тут вище, яку піддають реакції зі сполукою формули (VI): 83269 6 для того, щоб одержати сполуку формули (VII): в якій R є таким же, як визначено тут вище , яку піддають реакції каталітичної гідрогенізації для того, щоб одержати, після зняття захисту, де прийнятно, сполуку формули (І). Серед захисних груп для аміно функції можуть бути згадані, без будь-якого обмеження, групи бензилу і лінійного або рогзгалуженого (С1-С6)алкілу. Серед основ, які можуть бути використані для реакції між сполуками формули (II) і (III), можуть бути згадані, без будь-якого обмеження, органічні аміни, такі як триетиламін, піридин або діізопропілетиламін, і мінеральні основи, такі як NaOH, КОН, Na2CO3, К2СО3, NaHCO3 або КНСО3. Реакцію внугрішньомолекулярного поєднання переважно проводять або у присутності основи і каталізатора, основаного на паладії, або використовуючи гідрид натрію і йодид міді (І) або бромід міді (І). Каталізатори, основані яа паладії, які переважно використовують в реакції поєднання, являють собою каталізатори, основані на паладії і на арилфосфіні або бісфосфіні. Серед таких каталізаторів можуть бути згадані, без будь-якого обмеження, Pd(0)/PPh3, Рd(0)/Р(о-толіл)3, Рd(0)/Р(1-нафтил)3, Рd(0)/Р(ометоксифеніл)3, Pd2(dba)3/PPh3, Рd2(dbа)3/Р(отоліл)3, Ра2(dbа)3/Р(1-нафтил)3 , Pd2(dba)3/P(oметоксифеніл)3, Ра2(dbа)з/Р(2-фурил)3 Pd2(dba)3/dppp, Pd2(dba)3/(±)-BINAP і (DPPF)PdCl2.CH2Cl2/DPPF. BINAP, як повинно бути зрозумілим, являє собою 2,2'-біс(дифенілфосфіно)-1,1¢-бінафтил, dba, як повинно бути зрозумілим, являє собою дибензиліденацетон, DPPF, як повинно бути зрозумілим, являє собою 1,1¢ -біс(дифенілфосфіно)фероцен і dppp, як повинно бути зрозумілим, являє собою 1,3-біс(дифенілфосфіно)пропан. Серед основ, які можуть бути використані для реакції поєднання у присутності каталізатора, основаного на паладії, можуть бути згадані, без будь-якого обмеження, Cs2CO3, NaOtBu, Na2CO3, NaOAc і КОАс. Коли G являє собою атом хлору або атом брому або р-толуолсульфонілокси, метансульфонілокси або трифторметансульфонілокси групу, реакцію між сполуками формул (V) і (VI) переважно проводять у присутності основи, переважно органічного аміну, такого як триетиламін, піридин або діізопропілетиламін, або мінеральної основи, такої як Na2CO3, K2CO3, NaHCO3 або КНСО3. 7 Коли G являє собою гідроксигрупу, реакцію між сполуками формул (V) і (VI) переважно проводять у присутності реагенту активації, такого як Nметил-М-феніл-амінотрифенілфосфонію йодид, або, коли R відрізняється від атома водню, шляхом реакції Мітцунобу. Сполуки формули (IV) являють собою нові продукти, які є корисними як проміжні сполуки синтезу в хімічній або фармацевтичній промисловості, особливо в синтезі периндоприлу, і як такі утворюють невід'ємну частину даного винаходу. Сполуки формули (II) можуть бути одержані відповідно до методики, яка розкрита у [публікації J. Am. Chem. Soc. 1994, 116,10847-10848]. Приклад1: (2S, 3aS, 7аS)-1-{(2S)-2-[(1S)-1(Етоксикарбоніл)-бутиламіно]-пропіоніл}-октагідро1H-індол-2-карбонової кислоти трет-бутиламінна сіль Стадія А: Бензил (2S)-3-(2-бромфеніл)-2{[(2R)-2-бромпропаноїл]аміно}-пропаноат Вмішують 25,7г бензил (S)-2бромфенілаланінату і 150мл дихлорметану в реактор, потім доводять температуру реакційної суміші до 0°С і додають 20мл діізопропілетиламіну, з наступним додаванням 13,2г (2R)-2-бромпропіоніл хлориду. Згодом, доводять температуру суміші до температури навколишнього середовища. Після перемішування протягом 1 години при цій температурі, промивають суміш водою і потім розбавленим розчином оцтової кислоти, і випарують розчинники для того, щоб одержати вказану у заголовку сполуку. Стадія В: Бензил (2S)4-[(2R)-2бромпропаноїл]-2-індолінкарбоксилат Вміщують 15,5г сполуки, одержаної на Стадії вище, розчиненої в толуолі, 1,57г Pd2(dba)3, 1,83г Р(о-толіл)3 і 21,5г Cs2CO3 в реактор. Потім доводять температуру реакційної суміші до 100°С. Після перемішування протягом 15 годин при цій температурі, температуру суміші знов доводять до температури навколишнього середовища і очищують хроматографією над силікагелем для того, щоб одержати вказану у заголовку сполуку. Стадія С: Бензил (2S)-1-((2S)-2-{[(1S)-1(етоксикарбоніл)бутил]аміно}-пропаноїл)-2індолінкарбоксилат Вміщують 12,3г етил (25)-2-амінопентаноату, 16мл триетил'аміну і 16мл ацетонітрилу в реактор; потім доводять температуру суміші до 60°С, повільно додають розчин 19,4г сполуки, одержаної на Стадії вище, розчиненої в дихлорметані, і нагрівають зі зворотним холодильником протягом 4 годин. Після повернення до температури навколишнього середовища, промивають суміш водою і розбавленим розчином оцтової кислоти; потім випаровують розчинники для того, щоб одержати вказану у заголовку сполуку. Стадія D: (2S, 3aS, 7аS)-1-{(2S)-2-[(1S)-1(Етоксикарбоніл)-бутиламіно]-пропіоніл}-октагідро1H-індол-2-карбонова кислота Вміщують 20г сполуки, одержаної на Стадії вище, розчиненої в оцтовій кислоті, і потім 0,5г 10% Pd/C в гідрогенізатор. Гідрогенізують під тиском 0,5бар між 15 і 30°С, поки теоретична кількість водню не абсорбується. Видаляють каталізатор фільтруванням і потім охолоджують до між 0 і 5°С і 83269 8 збирають утворену в результаті тверду речовину фільтруванням. Промивають коржик і висушують його до постійної ваги для того, щоб одержати вказану у заголовку сполуку з енантіомерною чистотою 99%. Стадія Е: (2S, 3aS, 7аS)-1-{(2S)-2-[(1S)-1(Етоксикарбоніл)-бутиламіно]-пропіоніл}-октагідро1H-індол-2-карбонової кислоти трет-бутиламінна сіль Осад, одержаний на Стадії вище, (20г) розчиняють в 280мл етилацетату, і потім додають 4г трет-бутиламіну і 40мл етилацетату. Утворену в результаті суспензію потім нагрівають зі зворотним холодильником поки не буде завершене розчинення; потім утворений в результаті розчин фільтрують, поки він гарячий, і охолоджують до температури 15-20°С, з перемішуванням. Одержаний осад потім відфільтровують, перетворюють в пасту, знову використовуючи етилацетат, висушують і потім розтирають в порошок для того, щоб одержати очікуваний продукт з виходом 95%. Приклад2: (2S, 3aS, 7аS)-1-{(2S)-2-[(1S)-1(Етоксикарбоніл)-бутиламіно]-пропіоніл}-октагідро1H-індол-2-карбонової кислоти трет-булитамінна сіль Стадія А: (2S)-3-(2-Бромфеніл)-2-{[(2S)-2бромпропаноїл]амiно}пропанова кислота Вміщують 28,8г (S)-2-бромфенілаланіну, 7,5мл води і 15мл толуолу в реактор; потім доводять температуру суміші до між 0 і 5°С і додають 25мл 5М розчину гідроксиду натрію і потім розчин 20,2г (2R)-2-бромпропіоніл хлориду в толуолі, підтримуючи температуру нижче 10°С і підтримуючи рН суміші на рівні 10 за допомогою додавання 5М розчину гідроксиду натрію. Після перемішування протягом наступної 1 години при 10°С додають концентровану хлористоводневу кислоту, щоб довести рН суміші до 6. Відокремлюють фазу толуолу і потім додають концентровану хлористоводневу кислоту до водної фази, щоб довести рН до 2. Утворений осад потім відфільтровують і висушують для того, щоб одержати вказану у заголовку сполуку. Стадія В: Аналогічна Стадії В Прикладу 1. Стадія С: (2S)-1-((2S)-2-{[(1S)-1(Етоксикарбоніл)-бутил]-аміно}-пропаноїл)-2індолінкарбонова кислота Вміщують 10,5г етил (2S)-2-амінопентаноату, 13,5мл триетиламіну і 13,5мл ацетонітрилу в реактор; потім доводять суміш до 60°С і повільно додають розчин 19,3г сполуки, одержаної на Стадії вище, в 130мл дихлорметану, і потім нагрівають зі зворотним холодильником протягом 4 годин. Після повернення до температури навколишнього середовища промивають суміш водою і розбавленим розчином оцтової кислоти; потім випаровують розчинники для того, щоб одержати вказану у заголовку сполуку. Стадії D і Е: Аналогічні Стадіям D і Ε Прикладу 1. Приклад3: (2S, 3aS, 7аS)-1-{(2S)-2-[(1S)-1(Етоксикарбоніл)-бутиламіно]-пропіоніл}-октагідро1Н-індол-2-карбонової кислоти трет-бутиламінна сіль 9 83269 Стадія А: Бензил (2S)-3-(2-бромфеніл)-2{[(2R)-2-(р-толуолсульфонілокси)-пропаноїл]аміно}-пропаноат Вміщують 25,7г бензил (R)-2бромфенілаланінату і 150мл дихлорметану в реактор; потім доводять температуру реакційної суміші до 0°С і додають 20мл діізопропілетиламіну і потім 20,2г (1R)-2-хлор-1-метил-2-оксоетил-р Комп’ютерна верстка В. Клюкін 10 толуолсульфонат хлориду. Потім доводять суміш до температури навколишнього середовища. Після перемішування протягом 1 години при цій температурі, суміш промивають водою. Розчинники потім випаровують для того, щоб одержати вказану у заголовку сполуку. Стадії В - Е: Аналогічні Стадіям В - Ε Прикладу 1. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for synthesis of perindopril and the pharmaceutically-acceptable salts thereof
Автори англійськоюDubuffet Thierry, Langlois Pascal
Назва патенту російськоюСпособ синтеза периндоприла и его фармацевтически приемлемых солей
Автори російськоюДюбюффе Тьерри, Ланглуа Паскаль
МПК / Мітки
МПК: C07C 309/00, C07C 229/36, C07K 5/06
Мітки: солей, синтезу, фармацевтично, прийнятних, периндоприлу, спосіб
Код посилання
<a href="https://ua.patents.su/5-83269-sposib-sintezu-perindoprilu-i-jjogo-farmacevtichno-prijjnyatnikh-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу периндоприлу і його фармацевтично прийнятних солей</a>
Попередній патент: Інсектицидний засіб
Наступний патент: Спосіб вирощування сільськогосподарських культур з використанням розчину біологічно активних речовин
Випадковий патент: Комплексна добавка в бетонні суміші і будівельні розчини









