Спосіб синтезу периндоприлу і його фармацевтично прийнятних солей
Формула / Реферат
1. Спосіб синтезу сполуки формули (І):
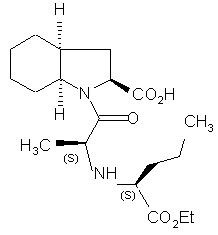 (I)
(I)
та її фармацевтично прийнятних солей, який відрізняється тим, що
сполуку формули (II):
 (II),
(II),
в якій R являє собою атом водню або бензил, або лінійну, або розгалужену
(С1-С6)алкільну групу,
піддають реакції зі сполукою формули (III), яка має (R) конфігурацію:
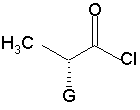 (III),
(III),
в якій G являє собою атом хлору, брому або йоду, або гідрокси, р-толуол-сульфонілокси-, метансульфонілокси- або трифторметансульфонілоксигрупу,
у присутності основи,
з тим, щоб одержати сполуку формули (IV):
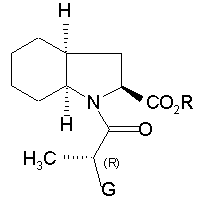 (IV),
(IV),
в якій R і G є такими ж, як визначено вище, яку піддають реакції зі сполукою формули (V), яка має (S) конфігурацію:
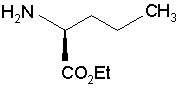 (V),
(V),
з тим, щоб одержати, після зняття захисту, де необхідно, сполуку формули (І).
2. Спосіб синтезу за п. 1, який відрізняється тим, що основа, яку використовують для реакції між сполуками формул (II) і (III), являє собою органічний амін, який вибирають з триетиламіну, піридину і діізопропілетиламіну, або мінеральну основу, яку вибирають з NaOH, КОН, Na2CO3, К2СО3, NaHCО3 і КНСО3.
3. Спосіб синтезу за п. 1, який відрізняється тим, що G являє собою атом хлору або брому, або р-толуолсульфонілокси-, метансульфонілокси- або трифторметансульфонілоксигрупу.
4. Спосіб синтезу за п. 3, який відрізняється тим, що реакцію між сполуками формул (IV) і (V) проводять у присутності органічного аміну, який вибирають з триетиламіну, піридину і діізопропілетиламіну, або мінеральної основи, яку вибирають з Na2CO3, К2СО3, NаНСО3 або КНСО3.
5. Спосіб синтезу за п. 1, який відрізняється тим, що G являє собою гідроксигрупу.
6. Спосіб синтезу за п. 5, який відрізняється тим, що реакцію між сполуками формул (IV) і (V) переважно проводять у присутності реагенту активації, який вибирають з йодиду N-метил-N-феніламінотрифенілфосфонію і триаміду гексаметилфосфору, разом з перхлоратом амонію, або коли R є іншим, ніж атом водню, реакцією Мітсунобу.
7.Спосіб за будь-яким з пп.1-6 синтезу периндоприлу у формі його третбутиламінової солі.
Текст
1. Спосіб синтезу сполуки формули (І): 2 O H3C G (III), в якій G являє собою атом хлору, брому або йоду, або гідрокси, р-толуол-сульфонілокси-, метансульфонілоксиабо трифторметансульфонілоксигрупу, у присутності основи, з тим, щоб одержати сполуку формули (IV): H H H3C NH (S) CO2Et (I) та її фармацевтично прийнятних солей, який відрізняється тим, що сполуку формули (II): H CO2R O (13) (S) N (R) G (IV), в якій R і G є такими ж, як визначено вище, яку піддають реакції зі сполукою формули (V), яка має (S) конфігурацію: CH3 H2 N 80905 CO2H O CH3 (11) N C2 H H H 3C Cl CO2R (II), в якій R являє собою атом водню або бензил, або лінійну, або розгалужену (С1-С6)алкільну групу, піддають реакції зі сполукою формули (III), яка має (R) конфігурацію: (19) H N H (V), з тим, щоб одержати, після зняття захисту, де необхідно, сполуку формули (І). 2. Спосіб синтезу за п. 1, який відрізняється тим, що основа, яку використовують для реакції між сполуками формул (II) і (III), являє собою органічний амін, який вибирають з триетиламіну, піридину і діізопропілетиламіну, або мінеральну основу, яку вибирають з NaOH, КОН, Na2CO3, К2СО3, NaHCО3 і КНСО3. 3. Спосіб синтезу за п. 1, який відрізняється тим, що G являє собою атом хлору або брому, або р UA CO2Et 3 80905 4 толуолсульфонілокси-, метансульфонілокси- або трифторметансульфонілоксигрупу. 4. Спосіб синтезу за п. 3, який відрізняється тим, що реакцію між сполуками формул (IV) і (V) проводять у присутності органічного аміну, який вибирають з триетиламіну, піридину і діізопропілетиламіну, або мінеральної основи, яку вибирають з Na2CO3, К2СО3, NаНСО3 або КНСО3. 5. Спосіб синтезу за п. 1, який відрізняється тим, що G являє собою гідроксигрупу. 6. Спосіб синтезу за п. 5, який відрізняється тим, що реакцію між сполуками формул (IV) і (V) переважно проводять у присутності реагенту активації, який вибирають з йодиду N-метил-Nфеніламінотрифенілфосфонію і триаміду гексаметилфосфору, разом з перхлоратом амонію, або коли R є іншим, ніж атом водню, реакцією Мітсунобу. 7.Спосіб за будь-яким з пп.1-6 синтезу периндоприлу у формі його третбутиламінової солі. Даний винахід відноситься до способу синтезу периндоприлу формули (І): Ефір (28,3аS,7аS)-октагідроандол-2карбонової кислоти не є комерційним продуктом, і його приготування вимагає різних стадій синтезу (включаючи стадію розкладання), починаючи з індол-2-карбонової кислоти. Заявник в даний момент розробив новий спосіб синтезу периндоприлу, який використовує легкодоступні вихідні матеріали. Більш конкретно, даний винахід відноситься до способу синтезу периндоприлу і його фармацевтично прийнятних солей, який відрізняється тим, що сполуку формули (II): і його фармацевтичне прийнятних солей. Периндоприл і його фармацевтичне прийнятні солі, і більш конкретно його трет-бутиламінова сіль, володіють цінними фармакологічними властивостями. їх головна властивість являє собою інгібування ангіотензин І перетворювального фенменту (або кініназа II), що дозволяє, з одного боку, запобігти перетворенню декапептид ангіотензину І в октапептид ангіотензин II (вазоконстриктор) і, з іншого боку, запобігти деградації брадикініну (вазодилататор) в неактивний пептид. Ці дві дії сприяють позитивному впливу периндоприлу на серцево-судинні захворювання, більш конкретно на артеріальну гіпертензію і параліч серця. Периндоприл, його приготування і застосування в терапії були розкриті в [описі Європейського патенту ЕР 0 049 658]. Беручи до уваги фармацевтичне значення цієї сполуки, було важливо спромогтись одержати її ефективним способом синтезу, легко відтворюваним у промисловому масштабі, що дає хороший вихід периндоприлу з відмінною чистотою, починаючи з вихідних матеріалів прийнятної вартості. [Опис патенту ЕР 0 308 341] розкриває синтез периндоприлу шляхом поєднання бензилового ефіру (28,За8,7а8)-октагідроандол-2-карбонової кислоти з етиловим ефіром N[(S)-1карбоксибутил]-(8)-аланіну, з наступним зняттям захисту карбонової групи гетероциклу шляхом каталітичної гідрогенізації. в якій R являє собою атом водню або бензил або лінійну або розгалужену (С1-С6)алкільну групу, піддають реакції зі сполукою формули (III), яка має (R) конфігурацію: в якій G являє собою атом хлору, брому або йоду або гідрокси, р-толуол-сульфонілокси-, метансульфонілоксиабо трифторметансульфонілоксигруну, у присутності основи, з тим, щоб одержати сполуку формули (IV): в якій R і G є такими ж, як визначено тут вище, 5 яку піддають реакції зі сполукою формули (V), яка має (S) конфігурацію: з тим, щоб одержати, після зняття захисту, де необхідно, сполуку формули (І). Серед основ, які можуть бути використані для реакції між сполуками формули (II) і (III) можуть згадані, без будь-якого обмеження, органічні аміни, такі як триетиламін, піридин і діізопропілетиламін, і мінеральні основи, такі як NaOH, КОН. Na2CО3, К2СО3, NaHCO3 і КНСО3. Коли G являє собою атом хлору, брому або йоду, або р-толуолсульфонілокси-, метансульфонілоксиабо трифторметансульфонілоксигрупу, реакцію між сполуками формул (IV) і (V) переважно проводять у присутності основи, переважно органічного аміну, такого як триетиламін, піридин або діізопропілетиламін, або мінеральної основи, такої як Na2CO3, K2CO3, NaHCO3 або КНСО3. Коли G являє собою гідроксигруну, реакцію між сполуками формул (IV) і (V) переважно проводять у присутності реагенту активації, такого як йодид N-метил-N-феніламінотрифенілфосфонію, або триаміду гексаметилфосфору разом з перхлоратом амонію, або коли R відрізняється від атома водню, реакцією Мітсунобу. Сполуки формули (IV), де G являє собою атом хлору або р-толуолсульфонілоксиабо метансульфонілоксигруну являють собою нові арид>кш, які корисні як посередники синтезу в хімічній або фармацевтичній промисловості, особливо у синтезі периндоприлу, і як такі утворюють невід'ємну частину даного винаходу. Приклад 1: (2S,3аS,7аS)-1-{(2S)-2-[(1S)-1(Етоксикарбоніл)бутиламіно]-пропіоніл} октагідро1Н-індол-2-карбонової кислоти трет-бутиламінова сіль Стадія А: Бензил (2S,3aS,7aS)-l-[(2R)-2бромпропіоніл]октагідрo-lH-індол2-карбоксилат Вміщують 200г бензил (2S,3аS,7аS)-октагідро1Н-індол-2-карбоксилату і 1,5 літри дихлорметану в реактор, потім доводять температуру реакційної суміші до 0°С і додають 201мл діізопропілетиламіну, з наступним додаванням 132г (2R)-2-бром-пропіоніл хлориду. Згодом, доводять температуру суміш до температури навколишнього середовища. Після перемішування протягом 1 години при цій температурі промивають суміш водою і потім розбавленим розчином оцтової кислоти. Одержаний таким чином розчин бензил (2S,3aS,7aS)-l-[(2R)-2бромпропіоніл]-октагідро-1Н-індол-2-карбоксилату використовують як такий на наступній Стадії. Стадія В: Бензил (2S,3аS,7аS)-1-{(2S)-2-[(1S)1-(Eтоксикарбоніл)бутиламіно]-пропіоніл}октагідро1Н-індол-2-карбоксилат Вміщують 123г етил (28)-2-амінопентаноату, 160мл триетиламіну і 160мл ацетонітрилу в 80905 6 реактор, і потім доводять температуру суміші до 60°С, повільно додають розчин, який одержують на Стадії А, і нагрівають зі зворотним холодильником протягом 4 годин. Після повернення до температури навколишнього середовища, промивають суміш водою і розбавленим розчином оцтової кислоти, і потім випаровують розчинники з тим, щоб одержати бензил (2S,3аS,7аS)-1-{(2S)-2-[(1S)-1(Eтоксикарбоніл)бутиламіно]пропіоніл}октагідро1Н-індол-2-карбоксилат. Стадія С: (2S,3аS,7аS)-1-{(2S)-2-[(1S)-1(Eтоксикарбоніл)бутиламіно]-пропіоніл}-октагідро1Н-індол-2-карбонова кислота Вміщують 200г сполуки, одержаної на вищезазначеній Стадії А, у розчин в оцтовій кислоті, а потім 5г 10% Pd/C в апарат для гідрогенізації. Гідрогенізують під тиском 0,5бар при температурі від 15 до 30°С, доки теоретична кількість водню не буде абсорбована. Видаляють каталізатор фільтруванням, і потім охолоджують до температури від 0 до 5°С і відновлюють фільтруванням одержану тверду речовину. Промивають коржик і висушують його до постійної ваги. Таким чином одержують (2S,3аS,7аS)-1{(2S)-2-[(1S)-1-(етоксикарбоніл)бутиламіно]пропіоніл}октагідро-1Н-індол-2-карбонову кислоту з виходом 85% і енантіомерною чистотою 99%. Стадія D: (2S,3аS,7аS)-1-{(2S)-2-[(1S)-1(Eтоксикарбоніл)бутиламіно]-пропіоніл}-октагідро1Н-індол-2-крабонової кислоти трет-бутиламінова сіль Осад, одержаний на вищезазначеній Стадії, (200г) розчиняють в 2,8 літра етилацетату, і потім додають 40г трет-бутиламіну і 0,4 літрів етилацетату. Одержану суспензію згодом нагрівають зі зворотним холодильником, доки не відбудеться повне розчинення, і одержаний розчин потім фільтрують у нагрітому стані і охолоджують, з перемішуванням, до температури від 15 до 20°С. Одержаний осад потім відфільтровують, перетворюють в пасту знову з етилацетатом, висушують і потім подрібнюють з тим, щоб одержати очікуваний продукт з виходом 95%. Приклад 2: (2S,3aS,7aS)-1-{(2S)-2-[(1S)-1(Eтоксікарбоніл)бутіламіно]-пропіоніл}октагідро1Н-індол-2-карбонової кислоти трет-бутиламінова сіль Стадія A: (2S,3aS,7aS)-1-[(2R)-2Бромпропіоніл]-октагідро-1H-індол-2-карбонова кислота Вміщують в реактор 200г (2S,3аS,7аS)октагідро-1Н-індол-2-карбонової кислоти, 75мл води і 150мл толуолу, і потім доводять суміш до температури від 0 до 5°С і додають 250мл 5М розчину гідроксиду натрію, з наступним додаванням розчину 202г (2R)-2-бромпропіоніл хлориду в толуолі, підтримуючи температуру нижче 10°С і підтримуючи рН суміші при 10 за допомогою додавання 5М розчину гідроксиду натрію. Після перемішування протягом наступної 1 години при 10°С додають концентровану хлористоводневу кислоту, щоб довести рН суміші до 6. 7 Відділяють фазу толуолу, і потім додають концентровану хлористоводневу кислоту до водної фази з тим, щоб довести рН до 2. Утворений осад потім відфільтровують і висушують з тим, щоб одержати (2S,3aS,7aS)-1[(2R)-2-бpoмпpoпioнiл]oктaгiдpo-lH-iндoл-2кapбoнoвy кислоту. Стадія В: (28,За8,7а8)-1-{(28)-2-[(18)-1(Етоксикарбоніл)бутиламіно]-пропіоніл}октагідро1Н-індол-2-карбонова кислота Вміщують в реактор 105г етил (28)-2амінопентаноату, 135мл триетиламіну і 135мл ацетонітрилу, і потім доводять температуру суміші до 60°С і повільно додають розчин 200г сполуки, одержаної на Стадії А в 1,3 літра дихлорметану, і згодом нагрівають зі зворотним холодильником протягом 4 годин. Після повернення до температури навколишнього середовища промивають суміш водою і розбавленим розчином оцтової кислоти, і потім випаровують розчинники з тим, щоб одержати (2S,3аS,7аS)-1-{(2S)-2-[(1S)-1(етоксикарбоніл)бутиламіно]-пропіоніл}октагідро1Н-індол-2-карбонову кислоту. Стадія С: аналогічна Стадії D Прикладу 1. Приклад 3: (2S,3аS,7аS)-1-{(2S)-2-[(1S)-1(Етоксикарбоніл)бутиламіно]-пропіоніл}октагідро1Н-індол-2-карбонової кислоти трет-бутиламінова сіль Стадія· А: Бензил (2S,3аS,7аS)-1-[2R)-2-{ртолуолсульфонілокси}пропіоніл]-октагідро-1Ніндол-2-карбоксилат Вміщують в реактор 200г бензил (2S,3аS,7аS)октагідро-1Н-індол-2-карбоксилату і 1,5 літри дихлорметану, і потім доводять температуру реакційної суміші до 0°С і додають 201 мл діізопропілетиламіну, з наступним додаванням 202г (1R)-2-хлор-1-метил-2-оксоетил ртолуолсульфонату. Згодом, доводять температуру суміші до температури навколишнього середовища. Після перемішування протягом 1 години при цій температурі промивають суміш водою. Одержаний таким чином розчин бензил (2S,3aS,7aS)-1-[(2R)-2-{pтолуолсульфонілоксиіпропіоніл]октагідро-1Ніндол-2-карбоксилату використовують як такий на наступній Стадії. Стадії В - D: аналогічні Стадіям В - D Прикладу 1. 80905 8
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for synthesis of perindopril and its pharmaceutically acceptable salts
Автори англійськоюFugier Claude, Dubuffet Thierry, Langlois Pascal
Назва патенту російськоюСпособ синтеза периндоприла и его фармацевтически приемлемых солей
Автори російськоюФюжье Клод, Дюбюффе Тьерри, Ланглуа Паскаль
МПК / Мітки
МПК: C07K 5/06, C07D 209/42
Мітки: фармацевтично, солей, прийнятних, синтезу, периндоприлу, спосіб
Код посилання
<a href="https://ua.patents.su/4-80905-sposib-sintezu-perindoprilu-i-jjogo-farmacevtichno-prijjnyatnikh-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу периндоприлу і його фармацевтично прийнятних солей</a>
Попередній патент: Бета-кристалічна форма гідрохлориду івабрадину, спосіб її одержання і фармацевтична композиція, яка її містить
Наступний патент: Мікроелектронний вимірювач магнітної індукції з частотним виходом
Випадковий патент: Полімерна композиція








