Спосіб одержання іринотекану
Формула / Реферат
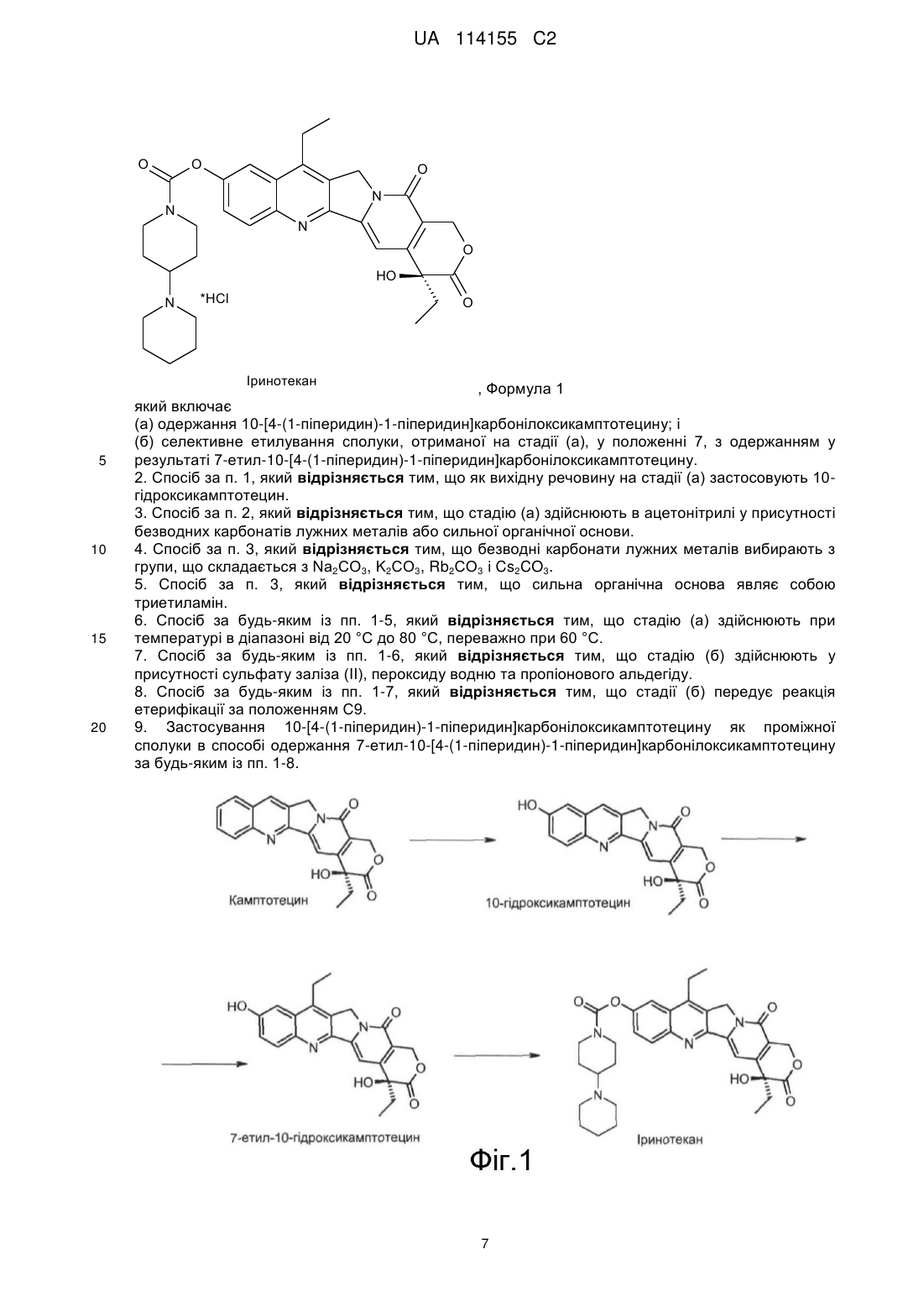
1. Спосіб одержання 7-етил-10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину, що має структуру відповідно до формули (1):
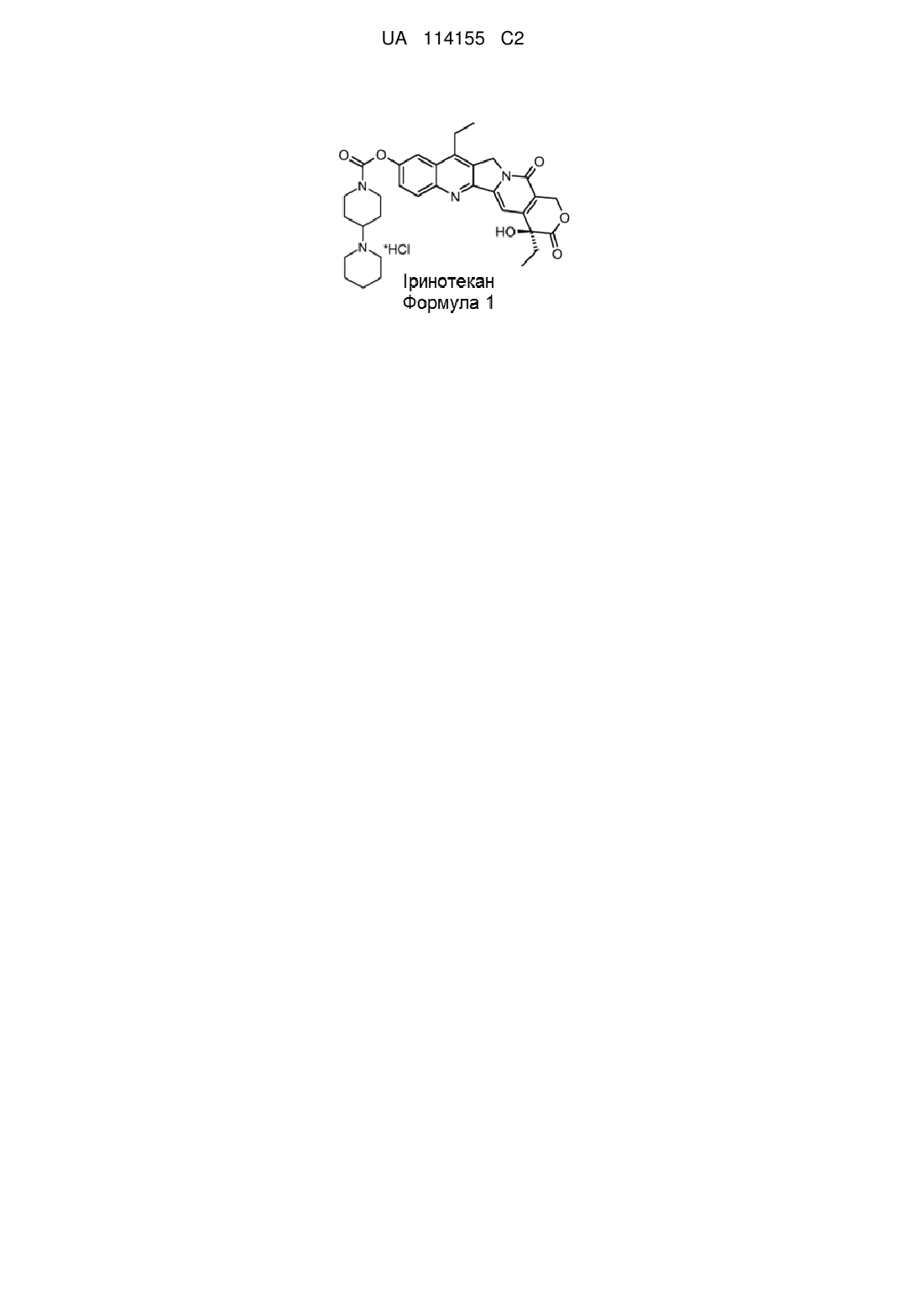
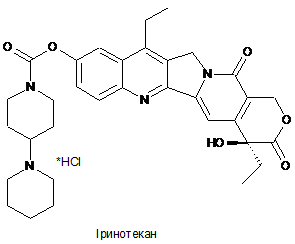 , Формула 1
, Формула 1
який включає
(а) одержання 10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину; і
(б) селективне етилування сполуки, отриманої на стадії (а), у положенні 7, з одержанням у результаті 7-етил-10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину.
2. Спосіб за п. 1, який відрізняється тим, що як вихідну речовину на стадії (а) застосовують 10-гідроксикамптотецин.
3. Спосіб за п. 2, який відрізняється тим, що стадію (а) здійснюють в ацетонітрилі у присутності безводних карбонатів лужних металів або сильної органічної основи.
4. Спосіб за п. 3, який відрізняється тим, що безводні карбонати лужних металів вибирають з групи, що складається з Nа2СО3, K2СО3, Rb2СО3 і Cs2CO3.
5. Спосіб за п. 3, який відрізняється тим, що сильна органічна основа являє собою триетиламін.
6. Спосіб за будь-яким із пп. 1-5, який відрізняється тим, що стадію (а) здійснюють при температурі в діапазоні від 20 °C до 80 °C, переважно при 60 °C.
7. Спосіб за будь-яким із пп. 1-6, який відрізняється тим, що стадію (б) здійснюють у присутності сульфату заліза (II), пероксиду водню та пропіонового альдегіду.
8. Спосіб за будь-яким із пп. 1-7, який відрізняється тим, що стадії (б) передує реакція етерифікації за положенням С9.
9. Застосування 10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину як проміжної сполуки в способі одержання 7-етил-10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину за будь-яким із пп. 1-8.
Текст
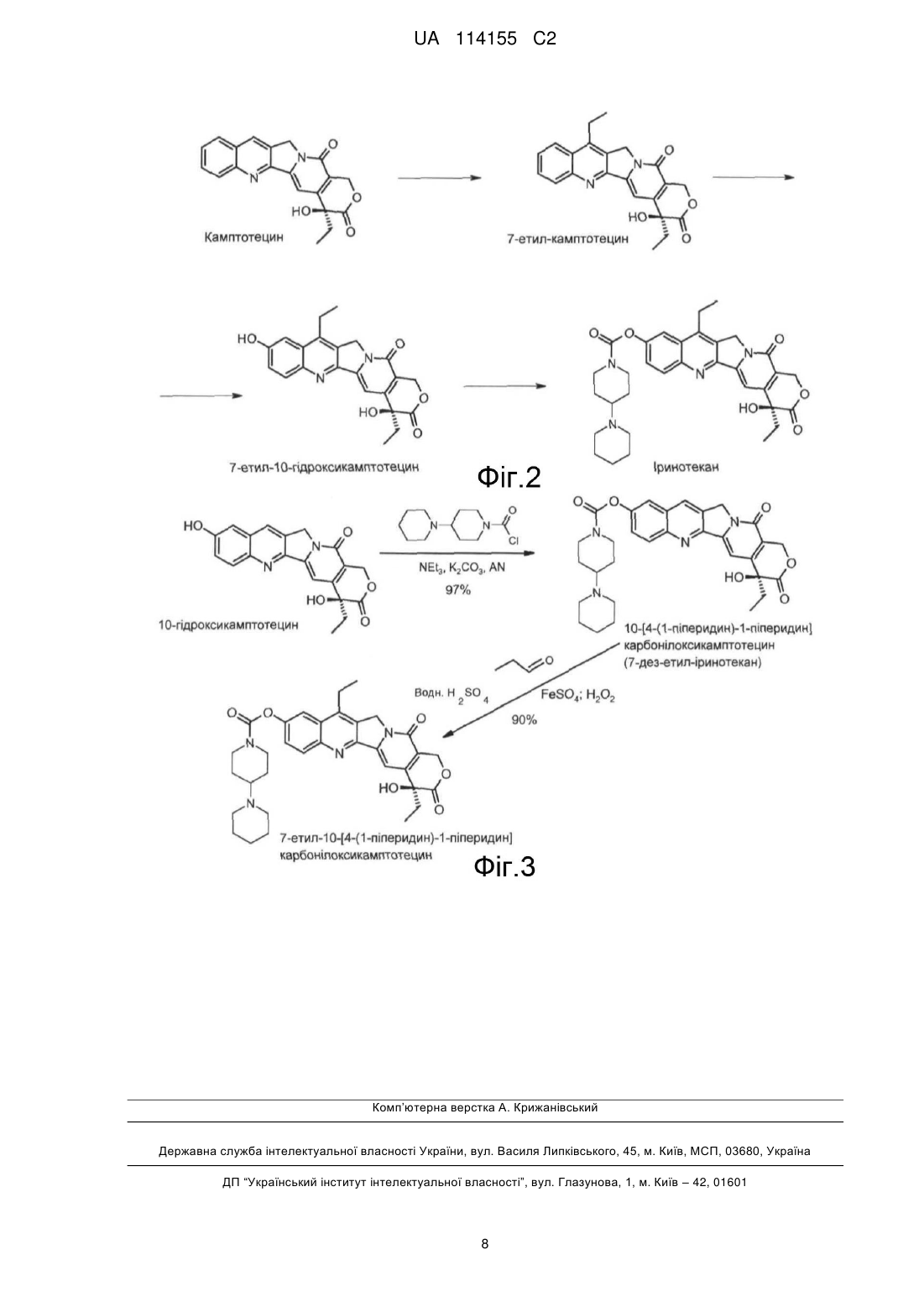
Реферат: Даний винахід стосується способу одержання 7-етил-10-[4-(1-піперидин)-1піперидин]карбонілоксикамптотецину (тобто іринотекану), який включає: (а) одержання 10-[4-(1піперидин)-1-піперидин]карбонілоксикамптотецину; і (б) селективне етилування сполуки, отриманої на стадії (а), у положенні 7, з одержанням у результаті 7-етил-10-[4-(1-піперидин)-1піперидин]карбонілоксикамптотецину. Даний винахід також стосується застосування 10-[4-(1піперидин)-1-піперидин]карбонілоксикамптотецину (тобто 7-дез-етил-іринотекану) як проміжної сполуки в способі одержання іринотекану відповідно до опису даного винаходу. UA 114155 C2 (12) UA 114155 C2 UA 114155 C2 5 10 15 20 25 Область техніки Даний винахід відноситься до способу одержання 7-етил-10-[4-(1-піперидин)-1піперидин]карбонілкамптотецину, який також називають іринотеканом. Рівень техніки Камптотецин являє собою цитотоксичний хіноліновий алкалоїд, який інгібує фермент топоізомеразу I. Камптотецин у природних умовах виділяють з кори та стовбура Камптотеки гострої (Camptotheca acuminate) (яку також називають "деревом щастя") і в традиційній китайській медицині застосовують для лікування ракових захворювань. Камптотецин у попередніх клінічних випробуваннях демонструє разючу протиракову активність, а також низьку розчинність й у значній мірі небажані побічні ефекти. Внаслідок виявлення зазначених недоліків з метою посилення клінічного результату були розроблені різні напівсинтетичні похідні. При цьому два із зазначених напівсинтетичних похідних, а саме топотекан й іринотекан, були схвалені для застосування в хіміотерапії (див., наприклад, огляд Ulukan, H. і Swaan P.W. (2002). Drugs 62, 2039-2057). 7-етил-10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецин, який являє собою іринотекан, характеризується хімічною структурою Формули 1. Існуючі в цей час способи синтезу іринотекану включають одержання 7-етил-10гідроксикамптотецину як проміжний продукт, до якого у положенні 10 приєднують 4-(1піперидин)-1-піперидин. 7-етил-10-гідроксикамптотецин також прийнято називати сполукою "SN 38", що має хімічну структуру Формули 2. SN38 являє собою терапевтично активний "компонент" іринотекану, що проявляє цитостатичну активність. Однак з іншого боку, SN38 характеризується низькою розчинністю у воді та більшості інших розчинників, що в значній мірі перешкоджає можливості застосування відомих схем синтезу з погляду загального виходу та чистоти кінцевого продукту реакції. 30 35 40 Для одержання SN38 існує декілька способів приєднання відповідних 7-етильної та 10гідроксильної груп до камптотецину, який використовують як вихідну речовину. Перший спосіб синтезу, схематично представлений на Фігурі 1, включає введення гідроксильної групи у положенні 10 камптотецину шляхом каталітичного гідрування з наступним окислюванням проміжної сполуки 1,2,6,7-тетрагідрокамптотецину за допомогою похідних йодбензолу з одержанням у результаті 10-гідроксикамптотецину. Далі камптотецин етилюють за положенням 7 пропіоновим альдегідом у присутності пероксиду водню або інших пероксидів і сульфату заліза двовалентного (тобто, сульфату заліза (II)), іншими словами, проводять класичну реакцію Фентона (Fenton, H.J.H. (1894) J.Chem. Soc. Trans. 65, 899-911). 1 UA 114155 C2 5 10 15 20 25 30 Другий спосіб синтезу, схематично представлений на Фігурі 2, включає етилювання камптотецину за положенням 7 пропіоновим альдегідом у присутності пероксиду водню або інших пероксидів і сульфату заліза (II) (Fenton, H.J.H. (1894), див. вище) з наступним введенням гідроксильного радикала у положенні 10 шляхом каталітичного гідрування 7-етилкамптотецину з одержанням у результаті 7-етил-1,2,6,7-тетрагідрокамптотецину, і наступне окислювання за допомогою, наприклад, йодозобензолу, періодату натрію або пероксодисульфату калію. Загальний вихід цільового продукту реакції SN38 становить приблизно 60 %, а чистота становить приблизно 90 %, відповідно. Зазначений шлях реакції додатково описаний, у тому числі, в Європейському патенті № 0137145 B1; патенті США № 7151179 B2; патенті США № 7544801 B2; і заявці на патент CN 102718772 A. Як альтернатива, гідроксильна група у положенні 10 камптотецину також може бути введена фотохімічним шляхом. Така схема включає окислювання 7-етил-камптотецину, отриманого з використанням зазначеної вище реакції Фентона, з метою одержання 1-N-оксид-7-етилкамптотецину з наступним опроміненням ультрафіолетовим випромінюванням. Зазначений шлях реакції додатково описаний, у тому числі, у патенті США № 4473692 і патенті США № 4545880. Ще один шлях синтезу описаний у публікації міжнародної заявки WO2005/019223. Зазначений шлях включає реакцію конденсації 7-етил-10-гідроксикамптотецину та 1хлоркарбоніл-4-піперидинопіперидин гідрохлориду в ацетонітрилі у присутності 4диметиламінопіридину. Однак, вихід у всіх перерахованих способах становить тільки приблизно 60-65 % (стосовно кількості вихідної речовини). Крім того, зазначені способи синтезу в значній мірі утруднені низькою розчинністю реагуючих сполук. Для запобігання позначеної вище проблеми було запропоновано додавати в якості співрозчинника оцтову кислоту або трифтороцтову кислоту (Wu, D. (1998) Cascade Radical Cyclization: Application in the Development of New Anticancer Drug of Camptotecin Family and Development of New Synthetic Method. Master Thesis, University of Hawaii). Така зміна дозволила поліпшити умови реакції, але не призвела до значного збільшення загального виходу. Для подальшого синтезу іринотекану SN 38 модифікували за положенням 10 (тобто, за гідроксильною групою) [4-(1-піперидин)-1-піперидин]карбонільним замісником Формули 3 за допомогою хлориду сечовини або хлорформіату у присутності сильної органічної основи, такої як триетиламін, 4-диметиламінопіридин або етилдіізопропіл- амін). 35 40 45 Проте, загальний вихід для представлених схем реакцій все ще залишається порівняно низьким. Крім того, проміжні сполуки реакцій являють собою типові побічні продукти, у результаті чого знижується чистота цільового продукту реакції – іринотекану. Таким чином, існує необхідність у розробці поліпшених способів одержання іринотекану, які б дозволили обійти перераховані вище недоліки. Зокрема, існує потреба в розробці шляху синтезу, що дозволяє ефективно одержувати іринотекан з високим ступенем чистоти. Відповідно, завданням даного винаходу є забезпечення такого способу. Короткий опис винаходу Даний винахід відноситься до способу одержання 7-етил-10-[4-(1-піперидин)-1піперидин]карбонілоксикамптотецину, що має структуру Формули 1, який включає: 2 UA 114155 C2 5 10 15 20 25 30 35 40 45 50 (а) одержання 10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину; і (б) селективне етилювання сполуки, отриманої на стадії (а), за положенням 7, з одержанням у результаті 7-етил-10-[4-(1-піперидин)-1-піперидин]-карбонілокси- камптотецину. В одному певному варіанті реалізації винаходу як вихідна речовина на стадії (а) застосовують 10-гідроксикамптотецин. Переважно при використанні як вихідна речовина 10-гідроксикамптотецину стадію (а) здійснюють в ацетонітрилі у присутності безводних карбонатів лужних металів або сильної органічної основи. Зокрема, переважно безводні карбонати лужних металів вибирають з групи, що складається з Na2CO3, K2CO3, Rb2CO3 і Cs2CO3; а сильна органічна основа являє собою триетиламін. В іншому переважному варіанті реалізації винаходу стадію (а) здійснюють при температурі в діапазоні від 20 °C до 80 °C, переважно при 60 °C. У певному переважному варіанті реалізації винаходу стадію (б) здійснюють у присутності сульфату заліза (II), пероксиду водню та пропіонового альдегіду. У певному переважному варіанті реалізації винаходу стадії (б) передує реакція етерифікації за положенням С9. Додатково даний винахід відноситься до застосування 10-[4-(1-піперидин)-1піперидин]карбонілоксикамптотецину як проміжна сполука в способі одержання 7-етил-10-[4-(1піперидин)-1-піперидин]-карбонілоксикамптотецину відповідно до опису даного винаходу. Короткий опис креслень Фігура 1: Схематичне зображення загальноприйнятого шляху синтезу для одержання 7етил-10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину із застосуванням як вихідна речовина камптотецину й як проміжна сполука – 10-гідроксикамптотецину. Фігура 2: Схематичне зображення альтернативного загальноприйнятого шляху синтезу для одержання 7-етил-10-[4-(1-піперидин)-1-піперидин]карбонілокси- камптотецину із застосуванням як вихідна речовина камптотецину й як проміжна сполука – 7-етилкамптотецину. Фігура 3: Схематичне зображення шляху синтезу відповідно до об'єкта даного винаходу із застосуванням як вихідна речовина 10-гідроксикамптотецину й як проміжна сполука – 10-[4-(1піперидин)-1-піперидин]карбонілоксикамптотецину. Докладний опис винаходу Даний винахід відноситься до несподіваного виявлення того, що 7-етил-10-[4-(1-піперидин)1-піперидин]карбонілкамптотецин (тобто, іринотекан) може бути отриманий з високим загальним виходом більше 90 % і по суті без забруднюючих побічних продуктів. Зазначений шлях синтезу характеризується використанням для селективного етилювання за положенням 7 як вихідна речовина 10-гідроксикамптотецину й як проміжна сполука – 10-[4-(1-піперидин)-1піперидин] карбонілоксикамптотецину (тобто, 7-дез-етил-іринотекану), що в результаті запобігає відповідно утворенню небажаних побічних продуктів – 11-етил-іринотекану та 7-етил-10гідроксикамптотецину. Даний винахід надалі описаний відповідно до певних варіантів реалізації даного винаходу та з посиланнями на певні фігури, однак, необхідно розуміти, що даний винахід не обмежується ними, а визначений лише прикладеною формулою винаходу. Описані фігури є лише принциповою схемою та не повинні розумітися як обмежуючі даний винахід. При використанні в даному описі та формулі винаходу терміну "який містить" ("містить"), зазначений термін не виключає наявності інших елементів або стадій. Термін "що складається з" ("складається з") для цілей даного винаходу необхідно розуміти як переважний варіант терміну "який містить" ("містить"). У випадку, якщо в тексті даної заявки визначено, що група містить щонайменше певну кількість варіантів, необхідно також розуміти, що описана група, яка переважно складається тільки із зазначених варіантів. 3 UA 114155 C2 5 10 15 20 25 30 35 40 45 50 При використанні в даній заявці визначеного або невизначеного артикля стосовно іменника в однині, тобто "a", "an" і "the", також мається на увазі зазначений іменник у множині, якщо спеціально не зазначено інше. У випадку використання в контексті даної заявки числових значень фахівцю необхідно розуміти, що технічний результат, забезпечуваний розглянутою ознакою, забезпечується в рамках інтервалу припустимої погрішності, який зазвичай включає відхилення від заданого числового значення на ±10 %, і переважно на ±5 %. Крім того, терміни перший, другий, третій, (а), (б), (в) і тому подібні в описі та формулі винаходу використовуються для позначення розходження схожих елементів і не обов'язково описують їх у послідовному або хронологічному порядку. Необхідно розуміти, що зазначені терміни, які використовуються таким чином, є взаємозамінними у відповідних випадках і що варіанти реалізації винаходу, описані в даній заявці, можливо здійснювати у послідовності, відмінній від описаної або проілюстрованої в даній заявці. Додаткові визначення термінів будуть дані в наступному описі, де зазначені терміни будуть використовуватися. Наступні терміни та визначення представлені винятково для полегшення розуміння винаходу. Не мається на увазі, що зазначені визначення обмежують обсяг патентних претензій згідно з даним винаходом, що повинно бути зрозуміло середньому фахівцю в області техніки. В одному аспекті даний винахід відноситься до способу одержання 7-етил-10-[4-(1піперидин)-1-піперидин]карбонілоксикамптотецину, що має структуру Формули 1, який включає: (а) одержання 10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину; і (б) селективне етилювання сполуки, отриманої на стадії (а), за положенням 7, з одержанням у результаті 7-етил-10-[4-(1-піперидин)-1-піперидин]карбонілокси- камптотецину. Загальна схема реакції зазначеного способу згідно з даним винаходом схематично представлена на Фігурі 3. На першій стадії спосіб згідно з даним винаходом включає одержання 10-[4-(1-піперидин)-1піперидин]карбонілоксикамптотецину, тобто 7-дез-етил-іринотекану. У певному варіанті реалізації 10-гідроксикамптотецин використовують як вихідна речовина для одержання 7-дез-етил-іринотекану. 10-гідроксикамптотецин являє собою проміжну сполуку або побічний продукт у декількох інших схемах синтезу, наприклад, у способі синтезу, представленому на Фігурі 1, і таким чином, є легко доступним. Однак також можливе використання інших вихідних речовин, наприклад, використання камптотецину. Далі [4-(1-піперидин)-1-піперидин]карбонільний замісник приєднують до гідроксильної групи за положенням 10 10-гідроксикамптотецину для одержання 7-дез-етил-іринотекану. У переважному варіанті реалізації винаходу зазначену стадію реакції (тобто використання 10-гідроксикамптотецину як вихідна речовина) здійснюють в ацетонітрилі у присутності безводних карбонатів лужних металів або сильної органічної основи. Можуть бути використані будь-які безводні карбонати лужних металів або будь-яка сильна органічна основа, така як триетиламін, 4-диметиламінопіридин або етилдіізопропіламін. Зокрема, переважно безводні карбонати лужних металів вибирають з групи, що складається з Na 2CO3, K2CO3, Rb2CO3 і Cs2CO3; а сильна органічна основа являє собою триетиламін. В іншому переважному варіанті реалізації приєднання [4-(1-піперидин)-1-піперидин] карбонільного замісника здійснюють при температурі в діапазоні від 20 °C до 80 °C, зокрема переважно при температурі реакції 60 °C. Приєднання [4-(1-піперидин)-1-піперидин]карбонільного замісника являє собою відмітну стадію способу згідно з даним винаходом відносно поліпшення селективності етилювання, що проходить тільки за положенням 7. 4 UA 114155 C2 5 10 15 20 25 30 35 40 45 50 55 60 Наявність об'ємної карбокси-піперидин-піперидинової групи в 7-дез-етил-іринотекані утрудняє або навіть повністю блокує небажане етилювання за положенням 11 (що також прийнято називати "відомий ефект орто-положения"), у результаті якого утворюється небажаний побічний продукт 11-етил-іринотекан, що у значних кількостях утворюється в шляхах синтезу іринотекану, загальноприйнятих у даній області техніки, що, у свою чергу, вимагає проведення додаткових стадій реакції для видалення зазначеного побічного продукту. Також було виявлено, що 7-дез-етил-іринотекан характеризується значно кращою розчинністю у порівнянні з камптотецином і 10-гідроксикамптотецином, відповідно, у результаті чого знижується об'єм реакції, необхідний для здійснення стадії етилювання. Нарешті, карбоксипіперидин-піперидинова група нейтралізує функціональність 10-гідроксильної групи як пастка для радикалів, що, у свою чергу, перешкоджає наступному етилюванню за положенням 7. На другій стадії спосіб згідно з даним винаходом включає селективне етилювання 7-дезетил-іринотекану за положенням 7 з одержанням у результаті 7-етил-10-[4-(1-піперидин)-1піперидин]карбонілоксикамптотецину, який являє собою іринотекан. У певному переважному варіанті реалізації реакцію етилювання здійснюють у присутності сульфату заліза (II), пероксиду водню та пропіонового альдегіду, тобто за допомогою класичної реакції Фентона (Fenton, H.J.H. (1894) J.Chem. Soc. Trans. 65, 899-911), добре відомої в даній області техніки. У додатковому певному переважному варіанті реалізації винаходу реакції етилювання передує реакція етерифікації за положенням C9 з метою стеричного утруднення етилювання за положенням 11. У результаті способу згідно з даним винаходом збільшується загальний вихід іринотекану до 90-92 % (щодо вихідної речовини), а також значно поліпшується селективність реакції етилювання, у результаті чого по суті не утворюється небажаний побічний продукт – 11-етил іринотекан, який дуже важко відокремити для збільшення чистоти одержання іринотекану. В іншому аспекті даний винахід відноситься до застосування 10-[4-(1-піперидин)-1піперидин]карбонілоксикамптотецину як проміжна сполука в способі одержання 7-етил-10-[4-(1піперидин)-1-піперидин]-карбонілоксикамптотецину відповідно до опису даного винаходу. Даний винахід додатково описаний за допомогою фігур і нижченаведених прикладів, призначених лише для цілей ілюстрування певних варіантів реалізації винаходу та не мають на увазі обмеження заявленого об'єкта винаходу в якому-небудь ступені. Приклади Приклад 1 20 г 10-гідроксикамптотецину розчиняли в 100 мл ацетонітрилу, після чого додавали 30 г безводного K2CO3. Далі при перемішуванні до 300 мл ацетонітрилу додавали розчин 17,6 г 1хлоркарбоніл-4-піперидин-піперидин гідрохлориду. Перемішування продовжували при 60 °C протягом приблизно 6 годин. Ацетонітрил випарювали та сухий залишок розчиняли в 200 мл дихлорметану. Органічний шар промивали 4×100 мл дистильованої води для видалення неорганічних домішок, і розчинник випарювали. До сухого залишку при 20 °C додавали 400 мл 40 % H2SO4. Після розчинення додавали 10,5 г FeSO4 × 7 H2O, охолоджували до -10 °C і змішували з 10 мл пропіонового альдегіду. Отриманий у результаті розчин H2O2 і пропіонового альдегіду охолоджували до 0 °C (75 мл дистильованої води охолоджували до 0 °C і додавали 3,3 мл 32 % H2O2 і 5 мл пропіонового альдегіду) та інкубували в рівномірному потоці протягом 150 хвилин. Продукт реакції (тобто, іринотекан) розбавляли водою до об'єму 3 л і переносили для очищення методом хроматографії (сорбентна смола Diaion). Приклад 2 20 г 10-гідроксикамптотецину розчиняли в 300 мл ацетонітрилу, додавали 20 мл триетиламіну разом з 17,6 г 1-хлоркарбоніл-4-піперидинопіперидин гідрохлориду. Перемішування продовжували при 60 °C протягом приблизно 2 годин. Реакційну суміш упарювали до сухого залишку. Додавали 300 мл H 2O і знову упарювали. До сухого залишку додавали водний розчин сірчаної кислоти (400 мл 40 % H2SO4). Потім додавали 10,5 г FeSO4×7 H2O при 20 °C, охолоджували до -10 °C і після цього додавали пропіоновий альдегід (10 мл). Отриманий у результаті розчин H2O2 і пропіонового альдегіду охолоджували до 0 °C (75 мл дистильованої води охолоджували до 0 °C і додавали 3,3 мл 32 % H2O2 і 5 мл пропіонового альдегіду) та інкубували в рівномірному потоці протягом 150 хвилин. Продукт реакції (тобто, іринотекан) розбавляли водою до об'єму 3 л і переносили для очищення методом хроматографії (сорбентна смола Diaion). 5 UA 114155 C2 5 10 Приклад 3 20 г іринотекану розбавляли водним розчином сірчаної кислоти (400 мл 40 % H2SO4). Потім додавали FeSO4 × 7 H2O (10,5 г) при 20 °C, і зазначений розчин охолоджували до -10 °C і після цього додавали пропіоновий альдегід (10 мл). Отриманий у результаті розчин H 2O2 і пропіонового альдегіду охолоджували до 0 °C (75 мл дистильованої води охолоджували до 0 °C і додавали 3,3 мл 32 % H2O2 і 5 мл пропіонового альдегіду) та інкубували в рівномірному потоці протягом 150 хвилин. У результаті аналізу продукту реакції методом ВЕРХ 11-етил-іринотекан не виявили. Приклад 4 При порівнянні способу згідно з даним винаходом, представленого на ФІГУРІ 3, із двома загальноприйнятими в даній області техніки способами одержання іринотекану (представлені на ФІГУРІ 1 і ФІГУРІ 2, відповідно) відносно кількості та типу небажаних продуктів реакції відразу стає очевидним, що спосіб згідно з даним винаходом забезпечує одержання переважаючих результатів. Отримані дані наведені в нижченаведеній таблиці. 15 Назва сполуки 10-гідроксикамптотецин енантіомер іринотекану 7-дез-етил-іринотекан 7-етил-10гідроксикамптотецин 11-етил іринотекан 7-етил-камптотецин 7,11-діетил-10гідроксикамптотецин камптотецин 20 25 30 35 Функція в способі згідно з даним винаходом Фігурі 1 Фігурі 2 Фігурі 3 проміжна сполука по суті відсутня вихідна речовина побічний продукт побічний продукт побічний продукт побічний продукт побічний продукт проміжна сполука по суті відсутня проміжна сполука по суті відсутня побічний продукт по суті відсутня побічний продукт проміжна сполука по суті відсутня по суті відсутня побічний продукт побічний продукт по суті відсутня вихідна речовина вихідна речовина по суті відсутня Даний винахід, який ілюстративно описаний в даній заявці, може бути відповідним чином застосований під час відсутності будь-якого елемента або елементів, обмеження або обмежень, конкретно не описаних у даній заявці. Так, наприклад, терміни "який містить", "який включає", "що складається з" тощо варто тлумачити розширено та без обмежень. Крім того, терміни та вираження, які використовуються в даній заявці, були використані для опису, а не для обмеження, і не слід припускати, що зазначені терміни та вираження виключають які-небудь еквіваленти представлених й описаних ознак або їх частини, але варто розуміти, що в рамках обсягу патентних претензій заявленого винаходу можливі різні модифікації. Таким чином, необхідно розуміти, що, хоча даний винахід конкретно описаний варіантами реалізації та додаткових ознак, фахівці в даній області техніки можуть вдатися до змін і модифікацій варіантів реалізації даного винаходу, і передбачається, що такі зміни та модифікації включені в обсяг патентних претензій згідно з даним винаходом. Даний винахід описаний в даній заявці в широкому та загальному змісті. Кожний з більш вузьких об'єктів і підродових груп, що підпадає під загальний опис, також утворює частину даного винаходу. Мається на увазі загальний опис винаходу за умови або відсутності обмеження, що виключає будь-який об'єкт із заявленого класу, незалежно від того, чи описаний конкретно в даній заявці виключений об'єкт. Інші варіанти реалізації винаходу представлені в рамках наступної формули винаходу. Крім того, у випадку, коли ознаки або аспекти даного винаходу описані в рамках групи Маркуша, фахівцям в даній області техніки повинно бути зрозуміло, що винахід також описаний у рамках будь-якого окремого члена або підгрупи членів групи Маркуша. ФОРМУЛА ВИНАХОДУ 40 1. Спосіб одержання 7-етил-10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину, що має структуру відповідно до формули (1): 6 UA 114155 C2 O O O N N N O HO N *HCl O Іринотекан 5 10 15 20 , Формула 1 який включає (а) одержання 10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину; і (б) селективне етилування сполуки, отриманої на стадії (а), у положенні 7, з одержанням у результаті 7-етил-10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину. 2. Спосіб за п. 1, який відрізняється тим, що як вихідну речовину на стадії (а) застосовують 10гідроксикамптотецин. 3. Спосіб за п. 2, який відрізняється тим, що стадію (а) здійснюють в ацетонітрилі у присутності безводних карбонатів лужних металів або сильної органічної основи. 4. Спосіб за п. 3, який відрізняється тим, що безводні карбонати лужних металів вибирають з групи, що складається з Nа2СО3, K2СО3, Rb2СО3 і Cs2CO3. 5. Спосіб за п. 3, який відрізняється тим, що сильна органічна основа являє собою триетиламін. 6. Спосіб за будь-яким із пп. 1-5, який відрізняється тим, що стадію (а) здійснюють при температурі в діапазоні від 20 °C до 80 °C,переважно при 60 °C. 7. Спосіб за будь-яким із пп. 1-6, який відрізняється тим, що стадію (б) здійснюють у присутності сульфату заліза (II), пероксиду водню та пропіонового альдегіду. 8. Спосіб за будь-яким із пп. 1-7, який відрізняється тим, що стадії (б) передує реакція етерифікації за положенням С9. 9. Застосування 10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину як проміжної сполуки в способі одержання 7-етил-10-[4-(1-піперидин)-1-піперидин]карбонілоксикамптотецину за будь-яким із пп. 1-8. 7 UA 114155 C2 Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the synthesis of irinotecan
Автори англійськоюZabudkin, Alexander, Matvienko, Viktor
Автори російськоюЗабудкин Александр, Матвиенко Виктор
МПК / Мітки
МПК: C07D 491/22
Мітки: спосіб, одержання, іринотекану
Код посилання
<a href="https://ua.patents.su/10-114155-sposib-oderzhannya-irinotekanu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання іринотекану</a>
Попередній патент: Гетерометалічний поліоксометалатний комплекс формули {[cu(bpy)2]2[cu(bpy)(н2o)2][р2мо5о23]}•5н2о(bру-2,2′-дипіридил) як речовина, що має фотовольтаїчні властивості
Наступний патент: Система зв’язку, базова станція, спосіб зв’язку і енергонезалежний комп’ютерно-читаний носій, який зберігає програму
Випадковий патент: Спосіб отримання водорозчинної полімерної композиції