Спосіб одержання таблеток з безперервним виділенням лікарського засобу
Формула / Реферат
Способ получения таблеток с непрерывным выделением лекарственного средства путем смешения активного вещества и полимера, гранулирование и таблетирование, отличающийся тем, что b-лактамные антибиотики - цефаклор или цефалексин, в количестве 0,1 - 90мас.% перемешивают с 5 - 29мас.% гидрофильного полимера и 5 - 25мас.% акрилового полимера, причем общая масса гидрофильного полимера и акрилового полимера составляет менее 30мас.% с водой или органическим растворителем, таким, как изопропиловый спирт, этанол, полученные гранулы высушивают.
Текст
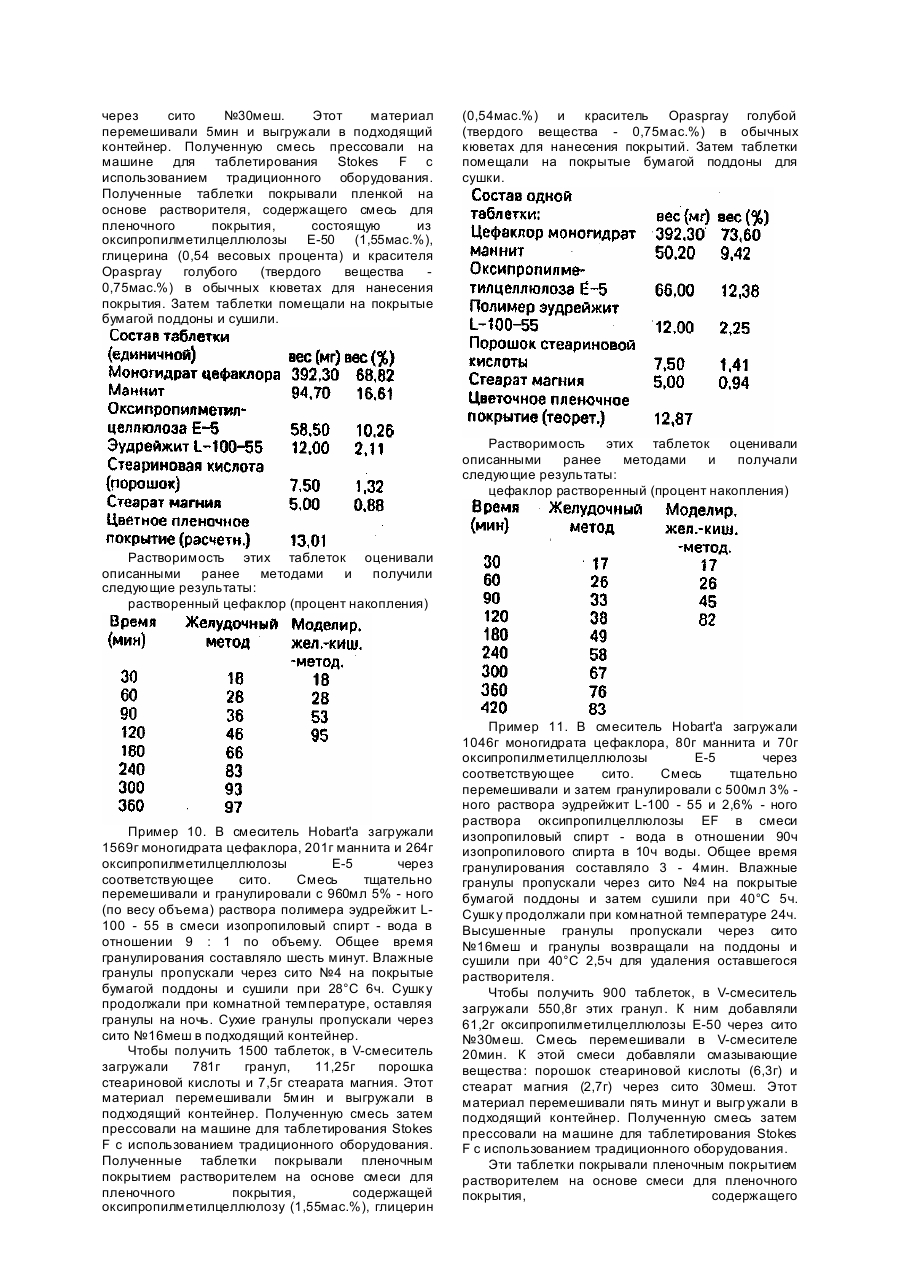
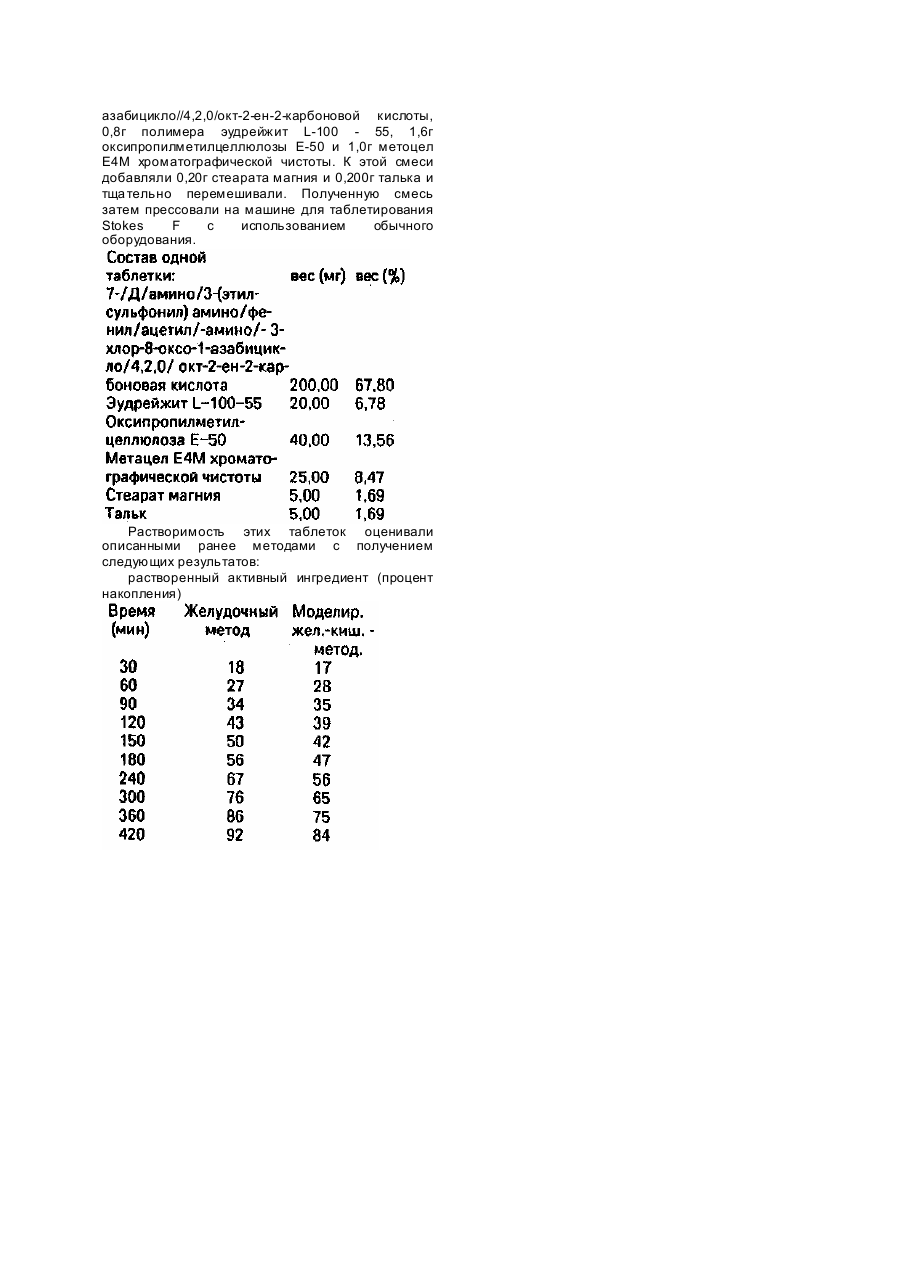
Изобретение касается фармацевтических форм непрерывного действия, длительно освобождаемых из медикаментов, в особенности из содержащих противомикробные средства. В идеале дозированная форма непрерывного освобождения должна отдавать медикамент с постоянной скоростью при прохождении по желудочно-кишечному тракту. В большинстве из имеющихся в настоящее время доступных освобождающих систем это ожидание не может быть оправдано, поскольку многие лекарства, являющиеся слабо кислыми или основными, проявляют растворимость, варьирующуюся в зависимости от pH. Снижение растворимости в ответ на флуктуации pH в организме может привести к уменьшению скорости освобождения, если форма лекарства не претерпевает соответствующи х изменений своих характеристик проницаемости. Матричные композиции, согласно настоящему изобретению, отличаются от существующи х лекарственных форм тем, что настоящие композиции проявляют реакцию на увеличение pH соответствующим увеличением проницаемости дозированной формы. Это позволяет дозированной форме освобождать активный ингредиент с подходящей скоростью при прохождении по желудочно-кишечному тракту. Это изобретение предусматривает матричную композицию, содержащую активное средство, гидрофильный полимер и кишечный полимер, дозированная форма из которой отвечает на физиологические изменения pH. Более конкретно настоящее изобретение касается непрерывно освобождаемой лекарственное средство матричной композиции в форме таблетки, содержащий от 0,1 до 90мас.% активного средства, от 5 до 29мас.% кишечного полимера при условии, что общий вес гидрофильного полимера и кишечного полимера составляет не более 30мас.% от веса композиции. Эта композиция отвечает на увеличение pH соответствующим увеличением своей проницаемости и скорости эрозии. Это проявляется в улучшенном механизме непрерывного освобождения различных соединений, в особенности тех, чья растворимость ухудшается с увеличением pH. Настоящая композиция находится в форме матрицы ингредиентов, составляющи х композицию. Матрица, по определению авторов, означает тщательно смешанный композит ингредиентов, фиксированный в форму посредством таблетирования. Эта однородная смесь ингредиентов обеспечивает непрерывное освобождение содержащегося в ней активного средства при изменении pH среды после введения больному, н уждающемуся в таком пролонгированном получении лекарства. Процентное количество ингредиентов, потребное для осуществления изобретения, а именно, активного ингредиента, гидрофильного полимера и кишечного полимера, дано в расчете, на сухой вес, без ссылки на какую-либо воду или другие присутствующие компоненты. Таким образом, эти три компонента вместе составляют 100% композиции для расчета индивидуальных процентов. Если присутствуют другие ингредиенты, то сумма всех компонентов, за исключением пленочного покрытия, если таковое имеется, составляет 100% композиции, из чего исходят при расчете процентного содержания отдельных компонентов. Активным ингредиентом может быть любое соединение, пригодное для перорального введения, хотя это изобретение особенно эффективно для слабо основных средств. Активное средство может присутствова ть в композиции, согласно изобретению, в концентрации от 0,1 до 90мас.% более предпочтительны концентрации в пределах от 45 до 85мас.%. Типичными медикаментами, которые могут благоприятно освобождаться такого типа питающей системой, являются, например, следующие классы лекарственных средств, которыми, однако, изобретение не ограничивается: бета-блокаторы, такие как пропранолол метопролол, атенолол, лабетолол, тимолол и пиндолол: антибактериальные средства, такие как цефалексин, цефаклор, цефадроксил, цефуроксимаксетил, эритромицин, пенициллин, 7(Д-аминофенилацетил) амино-(-3-хлор-8-оксо-1азабицикло)4, 2,0(-окт-2-ен-2)-карбоновая кислота, известная гакже как лоракарбеф, 7-(амино/3/(метилсульфонил) амино/фенил/ацетил/амино)-3хлор-8-оксо-1-азабицикло(4,2,0)-окт-2-ен-2карбоновая кислота и 7-(Д-(амино-3(этилсульфонил) амино/фенил/ацетил/амино)-3/хлор-8-оксо-1-азабицикло/4,2,0/окт-2-ен-2карбоновая кислота; противогипертонические средства, такие как клонидин, метилдопа и нифедипин; противогистаминные средства, такие как хлорфенирамин и бромфенирамин; транквилизаторы, такие как диазепам, хлордиазепероксид и оксазепам; противосудорожные средства; средства против тошноты, мышечные ралансанты; противовоспалительные средства; психотропные средства; антиманиакальные средства; стимуляторы; средства от запоров; противоангинные лекарства; сосудорасширяющиеся средства; противоаритмические средства; сосудосуживающие средства; средства для лечения мигрени; противорвотные средства; мочегонные средства; противосудорожные препараты; противоастматические средства; средства против болезни Паркинсона; отхаркивающие средства; средства от кашля; муколитические средства, витамины и минеральные и питательные добавки. Примерами соединений, особенно пригодных для осуществления этого изобретения, являются цефалексин и цефаклор. Оба соединения являются цвиттер-ионами, обладающими как кислотными, так и основными функциональными группами. Оба соединения имеют более высокую растворимость при низких значениях pH, о которых говорилось ранее (pH 1 - 3), чем при низких нормальных значениях pH для кишечных жидкостей (pH 5 - 7). Если эти соединения помещали в традиционный гидрогель, то скорость освобождения будет выше в моделированных жидкостях желудка, чем когда препарат помещали в моделированные жидкости кишечника. Композиции, согласно изобретению, содержат также гидрофильный полимер. Гидрофильные полимеры могут присутствовать в композициях, согласно изобретению, в концентрациях от 5 до 29мас.%, и более предпочтительно в пределах от 5 до 20мас.%. Гидрофильные полимеры, пригодные для использования в настоящем изобретении, являются водорастворимыми или набухающимися в воде веществами и включают один или более природных или частично или полностью синтетических анионоактивных или неионогенных гидрофильных клеев, модифицированных целлюлозных веществ или белковых веществ, таких как аравийская камедь, трагакант, камедь ложной акации, guar камедь, karaya камедь, агар, пектин, караген, растворимые и нерастворимые альгинаты, метилцеллюлоза, оксопропилметилцеллюлоза, оксипропилцеллюлоза, оксиэтил целлюлоза, натриевая соль, карбоксиметилцеллюлозы, карбоксипропилметилен, желатин, казеин, зеин, бентонит, алюмосиликат магния и тому подобные. Другие гидрофобные полимеры, которые могут быть применены, включают полисахариды и производные модифицированного крахмала, такие как амазио 721 А (American Maize Products) и пуллулан (Hayashibara Biochemical Laboratories, Inc.). Предпочтительными гидрофильными полимерами являются оксипропилметилцеллюлозы, выпускаемые Dow chemical и известные как метоцел-эфиры. Предпочтительные метоцел-эфиры включают серию клеев метацел E (E 5, E 15, E 50, E 4M, E 10M и тому подобные). Скорость гидратации серии клеев метоцел E обычно ниже скорости гидратации серии клеев метоцел K. Если используют серию клеев метоцел E, то получают таблетки гидрогеля с более тонкими слоями. Как следствие, если таблетки подвергнуть воздействию среды с более высоким pH, то эти таблетки реагируют более быстро, чем когда используют полимеры, дающие более толстые вязкие слои геля, еще одним предпочтительным полимером является пуллулан, водорастворимый полисахарид, являющийся производным крахмала. Пуллулан аналогичен клеям серии метоцел E в том отношении, что таблетки гидрогеля, содержааие пуллулан, обычно образуют тонкие слои геля. Пуллулан имеет лишь умеренную способность задерживать, освобождение лекарства, будучи примененным в таблетках с обычным гидрогелем. Композиции, согласно изобретению, содержат также кишечный полимер. Эти полимеры содержатся в композициях согласно изобретению в концентрациях от 0,5 до 25мас.% и более предпочтительно в пределах от 1,5 до 15мас.%. Растворение этих полимеров начинается при pH в пределах от 5,0 до 7,4. Э ти полимеры нерастворимы при pH ниже 5,0. Поскольку эти полимеры нерастворимы при низких значениях pH, соответствующим гастральным жидкостям, то их целью является задержка освобождения лекарства в этих регионах. Когда же препарат подвергается воздействию жидкостей с более высокими значениями pH, аналогичными тем, которые находят в тонком кишечнике, то эти полимеры будут растворяться и при этом увеличивается проницаемость и скорость эрозии таблеток согласно изобретению. Примеры подходящих полимеров включают акриловые смолы, такие как эудрейжит L, эудрейжит S, эудрейжит L-100 - 55 Rohm Pharma, дисперсии акрилового латекса, например, эудрейжит L30Д - Rohm Pharma, а равно как и другие полимеры, такие как ацетофталат целлюлозы, поливи-нилацетатфталат, фталат оксипропилметилцеллюлозы. Предпочтительным кишечным полимером является эудрейжит L-100 55. Эта смола поставляется как в виде тонкодисперсного порошка, так и водной дисперсии эудрейжит L-30Д. Эта смола начинает растворяться при pH примерно более 5,5 и по этой причине способствует улучшению освобождения лекарства на протяжении большей части тонкого кишечника. Общая концентрация гидрофильного полимера и кишечного полимера должны быть менее 30% от общего веса композиции. Композиции согласно изобретению могут также содержать фармацевтически приемлемое связующее в концентрации от 2,0 до 10,0мас.%, предпочтительно в пределах от 2,0 до 6,0мас.%. Фармацевтически приемлемыми связующими, пригодными для использования в настоящих композициях, являются связующие, обычно используемые для этих целей химиками и включают сахарозу, желатин, крахмальную пасту, аравийскую камедь, трагаканат, и другие смолы; производные целлюлозы, такие как метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, оксипропилцеллюлоза, оксипропилметилцеллюлоза и этилцеллюлоза, микрокристаллическая целлюлоза; повидон; полиэтиленгликоли; кукурузный сироп и другие связующие, известные специалистам в области фармацевтики. Предпочтительными связующими являются пуллуан и оксипропилцеллюлоза. Настоящие композиции могут также содержать от 2,0 до 25,0 весовых процентов фармацевтически приемлемого эксипиента, предпочтительно от 5,0 до 20,0 весовых процентов. Эти эксипиенты могут быть водорастворимыми и должны быть химически неактивными по отношению к другим ингредиентам. Предпочтительные эксипиенты включают лактозу и маннит. Альтернативно могут быть использованы различные другие известные эксипиенты, такие как сахароза, мальтоза, глюкоза, фруктоза, ксилоза, галактоза, ксилит, сорбит, а также и другие фармацевтически приемлемые моносахариды и дисахариди. Другие подходящие эксипиенты включают неорганические соединения, такие как хлориды, сульфаты и фосфа ты калия, натрия и магния, а также кальция и соли янтарной кислоты цитрата, фосфата, лактата и глюконата. Настоящая композиция может также содержать смазку для таблетки. Смазочный материал может присутствова ть в настоящей композиции в концентрации от 0,5 до 4,0мас.%, и предпочтительно в пределах от 1,0 до 2,5мас.%. Предпочтительными связывающими веществами являются стеариновая кислота в виде порошка и стеарат магния. Другие подходящие смазки для таблеток включают стеарат кальция или цинка, гидрогенизированные растительные масла, тальк, полиэтиленгликолит, минеральное масло или другие фармацевтические приемлемые смазки при прессовании поверхности таблеток. Если необходимо, могут быть введены другие традиционные ингредиенты таблеток, такие как консерванты, стабилизаторы, средства для придания гладкости поверхности таблеток. Фармацевтически приемлемые поверхностноактивные вещества и красители а композиции согласно изобретению. Общий вес эти х ингредиентов находится обычно в пределах от 0,1 до 2,0мас.%. Вещества для улучшения скольжения и повышения текучести включают коллоидную двуокись кремния и тальк. Приемлемым поверхностно-активным веществом являются лаурилсульфат натрия, доктилсульфосукцинат натрия, триэтаноламин, полиоксиэтиленсорбитан и производные полоксалкола, четвертичные соли аммония, или другие фармацевтически приемлемые поверхностно-активные вещества. В дополнение смазывающие и поверхностноактивные вещества могут быть объединены и введены в композицию как один, единый ингредиент. Полученные таблетки могут быть покрыты, если нужно, одной из многих легко доступных систем для получения пленочного покрытия. Покрытия таблеток служат для маскировки вкуса лекарства, делает их более легкими для проглатывания и в некоторых случая х улучшает внешний вид дозированной формы. Таблетки могут быть покрыты сахаром способами, широко известными специалистам в данной области, или могут быть покрыты одним из многочисленных средств для получения полимерного пленочного покрытия, часто применяемых специалистами по приготовлению лекарственных форм. Наглядными примерами таких средств для получения пленочных покрытий являются оксипропилметилцеллюлоза, карбоксиметилцеллюлоза, оксипропилцеллюлоза, метилцеллюлоза, этилцеллюлоза, акриловые смолы, поливинилпирролидон, поливиниловый эфир диэтиламиноуксусной кислоты, ацетофталат целлюлозы, фталат оксипропилметилцеллюлозы, эмульсии акрилового латекса, эмульсии латекса этилцеллюлозы или другие коммерчески доступные препараты, такие как фармакоут, поставляемый Shin. Etsu chemical Co., Ltd., и опадрай, (Opudry), производства компании Colorcon Inc. Настоящие композиции и лекарственные формы из них могут быть получены способами, широко известными специалистам медицинской химии. Способ получения может оказать влияние на характеристики освобождения лекарства из конечных таблеток. Кишечный полимер, применяемый в настоящих композициях, может быть введен в композицию несколькими путями. Полимер может быть добавлен в виде тонкодисперсного порошка к активному ингредиенту вместе со всем или частью гидрофильного полимера. Эти ингредиенты тща тельно смешивают и гранулируют с эфирной водой или водным раствором гидрофильного полимера или другого связующего. Это т гранулированный материал сушат и сортируют по размерам. Полученные гранулы могут быть смешаны с дополнительным гидрофильным полимером и смазывающими составными для таблеток и затем спрессованы в таблетки. Этот конкретный пример получения требует расхода больших количеств кишечного полимера для достижения желаемого равновесия освобождения лекарства как в моделированных жидкостях желудка, так и в моделированных жидкостях кишечника, но исключает необходимость использования органических растворителей в процессе получения таблеток. Альтернативно кишечный полимер может быть добавлен в виде тонкодисперсного порошка к активному средству и необязательно к всему или части гидрофильного полимера. Эти ингредиенты тща тельно перемешивают, далее, лучше чем использовать водные ингредиенты в процессе гранулирования, могут быть применены органические растворители, такие как изопропиловый спирт, этанол или тому подобные с водой или без воды. Используя этот тип жидкости для гранулирования, тонкодисперсный порошок кишечного полимера может стать активированным или частично растворенным в процессе гранулирования. В этом состоянии он может быть более эффективен в задержке освобождения лекарства при низких значениях pH. Дальнейшее гранулирование проводили как описано выше. Такой метод введения может привести к уменьшению потребности как кишечного, так и гидрофильного полимеров, что может быть существенным преимуществом, когда активный ингредиент сильно растворим или его следует применять в высоких дозах. Незначительным видоизменением описанного способа будет растворение кишечного полимера в подходящей системе растворителя, такой как изопропиловый спирт, этанол и тому подобной, с водой или без нее, Затем полученный раствор кишечного полимера используют гранулирования активного средства, которое может необязательно содержать часть гидрофильного полимера. Этот метод введения позволяет кишечному полимеру более эффективно задерживать освобождение лекарства при низких значениях pH. Полученный гранулированный материал далее обрабатывают как описано выше. Этот способ получения может также привести к снижению потребности как в кишечном полимере, так и в гидрофильном полимере. Третий способ введения кишечного полимера в композицию, согласно изобретению, требует использования водной дисперсии латекса полимера в качестве жидкости для гранулирования, В этом случае активное средство и весь или часть гидрофильного полимера следует тщательно перемешать. Затем добавить дисперсию кишечного полимера для завершения гранулирования. Полученные таблетки обладают большинством свойств таблеток, полученных гранулированием с растворителем, описанным ранее, но этот метод не требует использования этих растворителей. Водные дисперсии, однако, могут и не иметь такой клейкости, и гидрофобный полимер, который может потребоваться для достижения нужного гранулирования этим методом, может привести к получению таблеток, которые не имеют желаемого профиля освобождения лекарства при высоких и низких значениях pH, который может быть получен при использовании других способов получения. Этот метод введения гидрофильного полимера будет также иметь влияние на скорость освобождения лекарства из полученных таблеток. Эти эффекты хорошо известны специалистам в области технологии гидрогелей. Следует заметить, что чем выше вязкость гидрофильных полимеров, добавляемых а композицию до влажного гранулирования с водными растворами, тем скорее полученные таблетки могут иметь компромиссные профили освобождения лекарств, если их подвергать воздействию среды с достаточно высоким pH для растворения кишечного полимера. Средства для осуществления настоящего изобретения, наиболее подходящие для целей изобретения, цефалексин и цефаклор. Если соединения поместить в композицию с обычным гидрогелем, то скорость освобождения лекарств больше в моделированных жидкостях желудка, чем в медикаменте, подверженному воздействию моделированных жидкостей кишечника. Эта характери-етика продемонстрирована на следующем примере. Пример А. Настоящий пример представляет собой таблетку с непрерывным освобождением моногидрата цефалексина, полученную с непрерывным освобождением моногидрата цефалексина, полученную с использованием традиционной технологии гидрогелей. Состав ингредиентов на одну таблетку, вес (мг) Тенденции освобождения лекарства из этих таблеток оценивались использованием двух методов растворения. Один процесс назван как "желудочный метод" и другой процесс - как "моделированный желудочно-кишечный метод". В соответствии с желудочным методом, таблетки оценивали в 0,1н. хлористоводородной кислоте, которая представляет собой моделирование жидкости желудка. Моделированный желудочнокишечный метод (ГИ) был предназначен для моделирования желудочно-кишечного транзита. В соответствии с этим моделированным желудочнокишечным методом выдерживали 1ч в 750мл 0,1н. хлористоводородной кислоты и в это время pH в сосуде для растворения увеличивали до 6,8 добавлением 250мл 0,2М трехосновного фосфата натрия. Результаты растворения этих таблеток представлены ниже. Растворенный цефалексин (накопленные проценты) Преждевременное препровождение таблетки в тонкий кишечник и происходящее повышение pH, могут привести к уменьшению скорости освобождения цефалексина и бедной биологической доступности, Эти условия приводят к возможным проблемам, если они происходит на длительной основе, к такий как терапевтическая неудача в лечении некоторых типов инфекций. Следующие примеры показывают композиции согласно изобретению и способы их получения. Пример 1. В смеситель Hobart'a загружали 2149т моногидрата цефалексина. Смесь гранулировали с 1000мл смеси изопропиловый спирт - вода (в отношении 9 : 1 по объему), содержащей 15мас.% от объема полимера эудрейжит L-100 - 55, Общее время гранулирования составляло 5 - 7мин. Влажные гранулы пропускали через сито №14 на выстланные бумагой поддоны и сушили при 35°C 5,5ч. Гранулы оставляли на ночь для просушивания при комнатной температуре. Высушенные гранулы пропускали через сита №14 меш в соответствующую емкость. В смеситель загружали 575г этих гранул и 68,5г оксипропилметилцеллюлозы E-50 для приготовления 500 таблеток. Эту смесь перемешивали около получаса. В смесь добавляли порошок стеариновой кислоты (7,5г) и стеарат магния (3,25г) через сито №30меш. Этот материал перемешивали 5мин и выгружали в подходящий контейнер. Полученную смесь прессовали на машине для прессования таблеток Stokes T с использованием обычного оборудования. Растворение этих таблеток было оценено описанными методами со следующими результатами. Растворенный цефалексин (процент накопления) Таблетки помещали в корзину с отверстиями 10меш и вращали в упомянутой ранее среде со скоростью 100 оборотов/мин. Результаты растворения показывают, что возможна проблема при использовании традиционной технологии гидрогелей с соединением, растворимость которого снижается по мере увеличения pH с упомянутой выше композицией; если таблетки выдерживали в среде с более высоким pH в моделированном желудочнокишечном методе, то скорость освобождения цефалексина из таблеток резко снижается. Будучи использована клинически, эта композиция не показывает ожидаемого результата, если дозированная форма не остается в желудке. Пример 2. В миксер Хобарта загружали 1612г моногидрата цефалексина, 300г полимера эудрейжит L-100 55 и 225г оксипропилметилцеллюлозы E-5 через соответствующее сито. Смесь тщательно перемешивали и гранулировали с 750мл смеси изопропиловый спирт - вода в отношении 3 : 7 по объему, содержащей 8мас.% оксипропилметилцеллюлозы E-5 от объема смеси. Общее время гранулирования составляло 5 10мин. Влажные гранулы пропускали через сито №14 на покрытые бумагой поддоны и сушили при 45°C полчаса. Сушку продолжали при комнатной температуре еще 48ч. Сухие гранулы пропускали через сито №14меш в подходящую емкость. В V-смеситель загружали 732г этих гранул с последующим добавлением порошка стеариновой кислоты (11г) и стеарата магния (7,77г) через сито №30меш. Этот материал перемешивали 5мин и выгружали в подходящую емкость. Полученную смесь прессовали на машине для таблетирования Stokes F с использованием обычного оборудования. Полученные таблетки покрывали пленкой растворителя, содержащего смесь для пленочного покрытия, состоящую из оксипропилметилцеллюлозы E-50 (1,581мас.%) и глицерина (0,552мас.%) в обычных кюветах. Затем таблетки помещали на покрытые бумагой поддон для сушки и получения примерно 1000 таблеток. Растворимость этих таблеток оценивали ранее описанными методами со следующими результатами: Растворенный цефалексин (проценты накопления) Пример 3. В малогабаритный вспомогательный смеситель загружали 3224г моногидрата цефалаксина, 300г полимера эудрейжит L-100 - 55 и 93г оксипропилцеллюлозы L.F. через соответствующее сито. Смесь тщательно перемешивали и гранулировали с 1200мл 6% водного раствора олксипропилцеллюлозы L.F. Очищенную воду добавляли в количестве, достаточном для получения удовлетворительного гранулирования. Общее время гранулирования составляло 5 - 10мин. Влажные гранулы пропускали через сито №4 на покрытые бумагой поддоны и сушили при 35°C 20,5ч. Высушенные гранулы пропускали через сито №12меш в подходящий контейнер. Для приготовления 1000 таблеток в Vсмеситель загружали 1230г этих гранул и добавляли 100г метоцела E4M хроматографической чистоты через сито №30меш. Эту смесь перемешивали 20мин после чего добавляли 15г порошка стеариновой кислоты и 10,5г стеарата магния через сито №30меш. Этот материал смешивали 5мин и выгружали в подходящий контейнер. Полученную смесь прессовали на машине для таблетирования Stokes F с использованием обычного оборудования. На полученные таблетки наносили пленочное покрытие на основе растворителя, содержащего смесь пленочного покрытия, состоящую из оксипропилметилцеллюлозы E-50 (1,581мас.%) и глицерина (0,552мас.%) и традиционных поддонах для покрытия. Таблетки помещали на противни, покрытые бумагой, для дальнейшей сушки. Растворимость этих таблеток оценивали описанными методами и получали следующие результаты. Растворенный цефалексин (процент накопления) Пример 4. В смеситель Хобарта загружали 1612г моногидрата цефалексина и 45г оксипропилцеллюлозы L.F. через соответствующее сито. Эту смесь тщательно перемешивали и гранулировали с 500мл водной дисперсии эудрейжит L30Д (эквивалентно 150г эудрейжит L100 - 55). Добавляли очищенную воду в количестве, достаточном для обеспечения удовлетворительного гранулирования. Общее время гранулирования составляло 5 - 10мин. Влажные гранулы пропускали через сито №4 на выстланные бумагой поддоны и сушили при 35°C в течение 20ч. Высушенные гранулы пропускали через сито №14меш в соответствующий контейнер. Для получения 500 таблеток в V-смеситель загружали 602г этих гранул и 50г метоцел E4M хроматографической чистоты добавляли через сито №30меш. Смесь перемешивали около 20мин, после чего добавляли 7,5г порошка в стеариновой кислоты и 5,25г стеарата магния через сито №30меш. Этот материал перемешивали пять минут и выгружали в соответствующий контейнер. Полученную смесь прессовали на машине для таблетирования Stokes F с использованием традиционного оборудования. Растворимость этих таблеток описанными ранее методами и следующие результаты: растворенный цефалексин накопления) Растворимость этих таблеток оценивали описанными ранее методами и получали следующие результаты: Растворенный цефалексин (процент накопления) Пример 5. В смеситель Hobart'a загружали 2149г моногидрата цефалексина. Этот материал гранулировали с 1000мл 10% - го зудрейжита L-100 - 55 в смеси изопропиловый спирт - вода в отношении 9 : 1 по объему. Общее время гранулирования составляло около 7мин. Влажные гранулы пропускали через сито №4 на покрытые бумагой поддоны и сушили при 35°C 2ч. Сушк у продолжали при комнатной температуре, оставляя гранулы на ночь. Высушенные гранулы пропускали через сито №14меш в подходящий контейнер. Чтобы приготовить 300 таблеток, в Vсмеситель загружали 337г гранул и 45г оксипропилметилцеллюлозы E-50. Порошок стеариновой кислоты добавляли в смеси (4,5г) и стеарат магния (1,95г) через сито №30меш. Этот материал перемешивали пять минут и выгружали в подходящий контейнер. Полученную смесь прессовали на машине для таблетирования Stokes F с использованием обычного оборудования. оценивали получали (процент Пример 6. В миксер Hobart'a загружали 500г моногидрата цефаклора, 65г лактозы и 100г оксипропилметилцеллюлозы E-5 через соответствующее сито. Смесь тщательно перемешивали и гранулировали с 350мл 5% - ного (по весу от объема) раствора полимера эудрейжит L-100 - 55 в смеси изопропиловый спирт - вода в отношении 19 : 1 по объему. Общее время гранулирования составляло от 5 до 10мин. Влажные гранулы пропускали через сито №4 на покрытые бумагой поддоны и сушили при 50°C 1ч. Сушк у продолжали при комнатной температуре 48ч. Высушенные гранулы пропускали через сито №16меш в подходящий контейнер. Чтобы приготовить 500 таблеток в V-смеситель загружали 268г гранул и добавляли 3,75г порошка стеариновой кислоты и 2,5г стеарата магния через сито №30меш. Полученную смесь перемешивали 5мин и выгружали в подходящий контейнер. Смесь прессовали на машине для таблетирования Stokes F с использованием обычного оборудования. Растворимость этих таблеток оценивали описанными ранее методами со следующими результатами: растворенный цефаклор (процент накопления) Пример 7. В мешалку Hobart'a загружали 500г моногидрата цефаклора, 40г эудрейжита L-100 55, 50г лактозы и 75г пиллулана Р1 - 20 через соответствующее сито. Смесь тщательно перемешивали и гранулировали с 200мл 5% - ного (по весу от объема) раствора оксипропилметилцеллюлозы L.F. в смеси изопропиловый спирт - вода в отношении 19 : 1 по объему. Общее время гранулирования составляло 5 - 10мин. Влажный гранулят пропускали через сито №4 на покрытые бумагой поддоны и затем сушили при 50°C 2ч. Сушку продолжали при комнатной температуре 24ч. С ухие гранулы пропускали через сито №4 в подходящий контейнер. В V-смеситель загружали 266г гранул и добавляли 3,75г порошка стеариновой кислоты и 2,5г стеарата магния через сито № 30меш. Этот материал перемешивали 5мин и выгружали в подходящий контейнер. Полученную смесь прессовали на машине для таблетирования Stokes F с использованием традиционного оборудования для получения 500 таблеток. Растворимость этих таблеток оценивали описанными ранее методами и получали следующие результаты: растворенный цефаклор (процент накопления) Пример 8. В смеситель Hobart'a загружали 1177г моногидрата цефаклора, 212г маннита и 176г оксипропилметилцеллюлозы E-5 через соответствующее сито. Смесь тщательно перемешивали и гранулировали с 720мл 5% - ного (по весу от объема) раствора полимера эудрейжит L-100 - 55 в смеси изопропиловый спирт - вода в отношении 9 : 1 по объему. Общее время гранулирования составляло 5мин. Сушку продолжали при комнатной температуре, оставляя гранулы на ночь. Сухие гранулы пропускали через сито №16меш в подходящую емкость. Чтобы получить 1500 таблеток, в V-смеситель загружали 800г гранул. Порошок стеариновой кислоты (11,25г) и стеарат магния (7,5г) добавляли в смеситель через сито №30меш. Полученный материал перемешивали 5мин и выгружали в подходящий контейнер. Полученную смесь прессовали на машине для таблетирования Stokes F с использованием традиционного оборудования. Растворимость этих таблеток оценивали описанными ранее методами и получали следующие результаты: растворенный цефаклор (процент накопления) Пример 9. В мешалку Hobart'a загружали 1177г моногидрата цефаклора, 212г маннита и 176г оксипропилметилцеллюлозы E-5 через соответствующее сито. Смесь тщательно перемешивали и затем гранулировали с 720мл 5% ного (по весу от объема) раствора полимера эудрейжит L-100 - 55 в смеси изопропиловый спирт - вода в отношении 9 : 1 по объему. Общее время гранулирования составляло около пяти минут. Влажные гранулы пропускали через сито №4 на покрытые бумагой поддоны и сушили при 40°C 3ч. Сушк у продолжали при комнатной температуре, оставляя гранулят на ночь. Высушенные гранулы пропускали через сито №16меш в соответствующий контейнер. Чтобы получить 1100 таблеток, в V-смеситель загружали 587г этих гранул и 24,6г маннита. Эту смесь перемешивали около тридцати минут и смешивали с порошком стеариновой кислоты (8,25г) и стеаратом магния (5,5г), пропускаемых через сито №30меш. Этот материал перемешивали 5мин и выгружали в подходящий контейнер. Полученную смесь прессовали на машине для таблетирования Stokes F с использованием традиционного оборудования. Полученные таблетки покрывали пленкой на основе растворителя, содержащего смесь для пленочного покрытия, состоящую из оксипропилметилцеллюлозы E-50 (1,55мас.%), глицерина (0,54 весовых процента) и красителя Opaspray голубого (твердого вещества 0,75мас.%) в обычных кюветах для нанесения покрытия. Затем таблетки помещали на покрытые бумагой поддоны и сушили. (0,54мас.%) и краситель Opaspray голубой (твердого вещества - 0,75мас.%) в обычных кюветах для нанесения покрытий. Затем таблетки помещали на покрытые бумагой поддоны для сушки. Растворимость этих таблеток оценивали описанными ранее методами и получали следующие результаты: цефаклор растворенный (процент накопления) Растворимость этих таблеток оценивали описанными ранее методами и получили следующие результаты: растворенный цефаклор (процент накопления) Пример 10. В смеситель Hobart'a загружали 1569г моногидрата цефаклора, 201г маннита и 264г оксипропилметилцеллюлозы E-5 через соответствующее сито. Смесь тщательно перемешивали и гранулировали с 960мл 5% - ного (по весу объема) раствора полимера эудрейжит L100 - 55 в смеси изопропиловый спирт - вода в отношении 9 : 1 по объему. Общее время гранулирования составляло шесть минут. Влажные гранулы пропускали через сито №4 на покрытые бумагой поддоны и сушили при 28°C 6ч. Сушк у продолжали при комнатной температуре, оставляя гранулы на ночь. Сухие гранулы пропускали через сито №16меш в подходящий контейнер. Чтобы получить 1500 таблеток, в V-смеситель загружали 781г гранул, 11,25г порошка стеариновой кислоты и 7,5г стеарата магния. Этот материал перемешивали 5мин и выгружали в подходящий контейнер. Полученную смесь затем прессовали на машине для таблетирования Stokes F с использованием традиционного оборудования. Полученные таблетки покрывали пленочным покрытием растворителем на основе смеси для пленочного покрытия, содержащей оксипропилметилцеллюлозу (1,55мас.%), глицерин Пример 11. В смеситель Hobart'a загружали 1046г моногидрата цефаклора, 80г маннита и 70г оксипропилметилцеллюлозы E-5 через соответствующее сито. Смесь тщательно перемешивали и затем гранулировали с 500мл 3% ного раствора эудрейжит L-100 - 55 и 2,6% - ного раствора оксипропилцеллюлозы EF в смеси изопропиловый спирт - вода в отношении 90ч изопропилового спирта в 10ч воды. Общее время гранулирования составляло 3 - 4мин. Влажные гранулы пропускали через сито №4 на покрытые бумагой поддоны и затем сушили при 40°C 5ч. Сушк у продолжали при комнатной температуре 24ч. Высушенные гранулы пропускали через сито №16меш и гранулы возвращали на поддоны и сушили при 40°C 2,5ч для удаления оставшегося растворителя. Чтобы получить 900 таблеток, в V-смеситель загружали 550,8г этих гранул. К ним добавляли 61,2г оксипропилметилцеллюлозы E-50 через сито №30меш. Смесь перемешивали в V-смесителе 20мин. К этой смеси добавляли смазывающие вещества : порошок стеариновой кислоты (6,3г) и стеарат магния (2,7г) через сито 30меш. Этот материал перемешивали пять минут и выгр ужали в подходящий контейнер. Полученную смесь затем прессовали на машине для таблетирования Stokes F с использованием традиционного оборудования. Эти таблетки покрывали пленочным покрытием растворителем на основе смеси для пленочного покрытия, содержащего оксипропилметилцеллюлозу E-50 (1,581мас.%). глицерин (0,552мас.%) и краситель Opasprayголубой (1,951мас.%) в обычных кюветах для нанесения покрытий. Таблетки помещали на покрытые бумагой поддоны и сушили на воздухе. Растворимость этих таблеток оценивали описанными ранее методами и получали следующие результаты: растворенный цефаклор (процент накопления) Пример 13. Для получения 40 таблеток следующие ингредиенты пропускали через сито №30меш, смешивали и растирали в ступке пестиком: 8,0г 7-//амино/3"-/(метилсульфонил) амино/фенил/ацетил/-амино/-3-хлор-8-оксо-1азабицикло/4,2,0/окси-2-ен-2-карбоновой кислоты, 0,8г полимера эудрейжит L-100 - 55, 1,6г оксипропилметилцеллюлозы E-50 и 0,96г метоцел E-1M хроматографической чистоты. К этой смеси добавляли 0,120г стеарат магния и 0,200г талька и тща тельно перемешивали. Полученную смесь затем прессовали на машине для таблетирования с использованием обычного оборудования. Пример 12. Чтобы получить 40 таблеток, следующие ингредиенты пропускали через сито №30меш и смешивали в ступке и толкли пестиком: 8,44г 7-/Д-(аминофенилацетил) амино/-3-хлор-8оксо-1-азабицикло/4,2,0/окт-2-ен-2-карбоновой кислоты моногидрат, 0,84г, полимера эудрейжит L100 - 55 и 2,56г оксипропилметилцеллюлозы E-50. К этой смеси добавляли 0,104г стеарата магния и 0,216г талька и тщательно перемешивали. Полученную смесь затем прессовали на машине для таблетирования с использованием обычного оборудования. Растворимость этих таблеток оценивали описанными ранее методами и получали следующие результаты: растворенный активный ингредиент (процент накопления) Растворимость этих таблеток оценивали описанными ранее методами и получали следующие результаты: растворенный активный ингредиент (процент накопления) Пример 14. Чтобы получить 40 таблеток, следующие ингредиенты пропускали через сито №30меш., смешивали и растирали в ступке пестиком: 8,0г 7-/Д-/амино-3/-(этилсульфонил) амино/фенил/ацетил/амино/-3-хлор-8-оксо-1 азабицикло//4,2,0/окт-2-ен-2-карбоновой кислоты, 0,8г полимера эудрейжит L-100 - 55, 1,6г оксипропилметилцеллюлозы E-50 и 1,0г метоцел E4M хроматографической чистоты. К этой смеси добавляли 0,20г стеарата магния и 0,200г талька и тща тельно перемешивали. Полученную смесь затем прессовали на машине для таблетирования Stokes F с использованием обычного оборудования. Растворимость этих таблеток оценивали описанными ранее методами с получением следующих результатов: растворенный активный ингредиент (процент накопления)
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of tablets with continuous release of medical agent
Автори англійськоюPeter Lloyd Oren
Назва патенту російськоюСпособ получения таблеток с непрерывным выделением лекарственного средства
Автори російськоюПитер ЛЛойд Орен
МПК / Мітки
МПК: A61K 9/22
Мітки: таблеток, спосіб, виділенням, безперервним, одержання, лікарського, засобу
Код посилання
<a href="https://ua.patents.su/10-18251-sposib-oderzhannya-tabletok-z-bezperervnim-vidilennyam-likarskogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання таблеток з безперервним виділенням лікарського засобу</a>
Попередній патент: Розрядна камера плазмотрона
Наступний патент: Пристрій для контролю якості електрозварювання на корпусах для виготовлення банок
Випадковий патент: Анаеробний очисний пристрій і спосіб його експлуатації