Спосіб одержання похідних омега-ціано-1, омегадіфенілазаалканів або їх оксалатів, гідрохлоридів, амідосульфонатів
Номер патенту: 3938
Опубліковано: 27.12.1994
Автори: Ганс-Георг Курбювейт, Франк Ціммерманн, Рольф Кречмар, Клаус Д.Мюллер, Дірк Вупперманн, Фердіненд Денгель, Вольфрам Франк, Вернер Сейтц, Манфред Рашак, Ганс Ерг Трейбер, Ганс Дітер Леманн, Йозеф Гріз, Оскар Ерманн, Людвіг Фридріх
Формула / Реферат
Способ получения производных омега-циано-1, омега-дифенилазаалканов общей формулы
где R1 - водород, С1-С4-алкил, трифторметил С1-С4 - алкокси-, С1-С4 - алкилмеркаптогруппа, галоид; R2, R3, R7, R8 - водород, С1-С4-алкоксигруппа; R4 - прямой насыщенный или ненасыщенный С9-С18 - алкил; R5 - водород, C1-C4-алкил; R6 - водород, С1-С4 - алкокси, галоген, m=3; n=2; R1+R2- этилевдиоксигруппа, 1,3-диоксатетраметялен; R1+R7 - этилендиокси-, метилендиоксигруппа, их оксалатов, гидрохлорвдов, амидосульфонатов, отличающийся тем, что фенила-цетонитрил общей формулы
где R1-R4 имеют указанные значения, подвергают взаимодействию с 1-фенилазаалканом общей формулы
где R5-R8 имеют указанные значения; Х - галоид; с последующим выделением целевого продукта в свободном виде или в виде оксалатов, или гидрохлоридов, или амидосульфонатов.
Текст
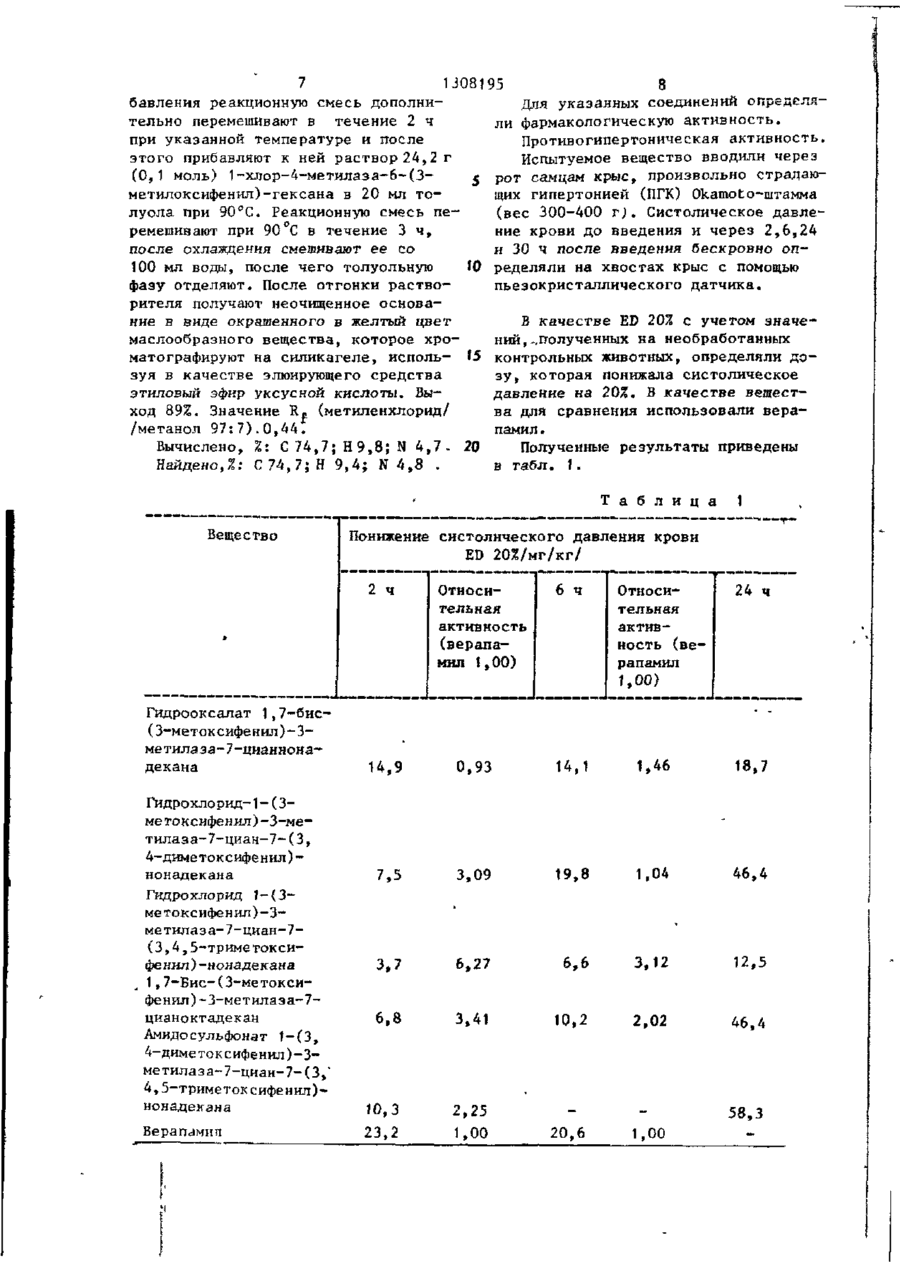
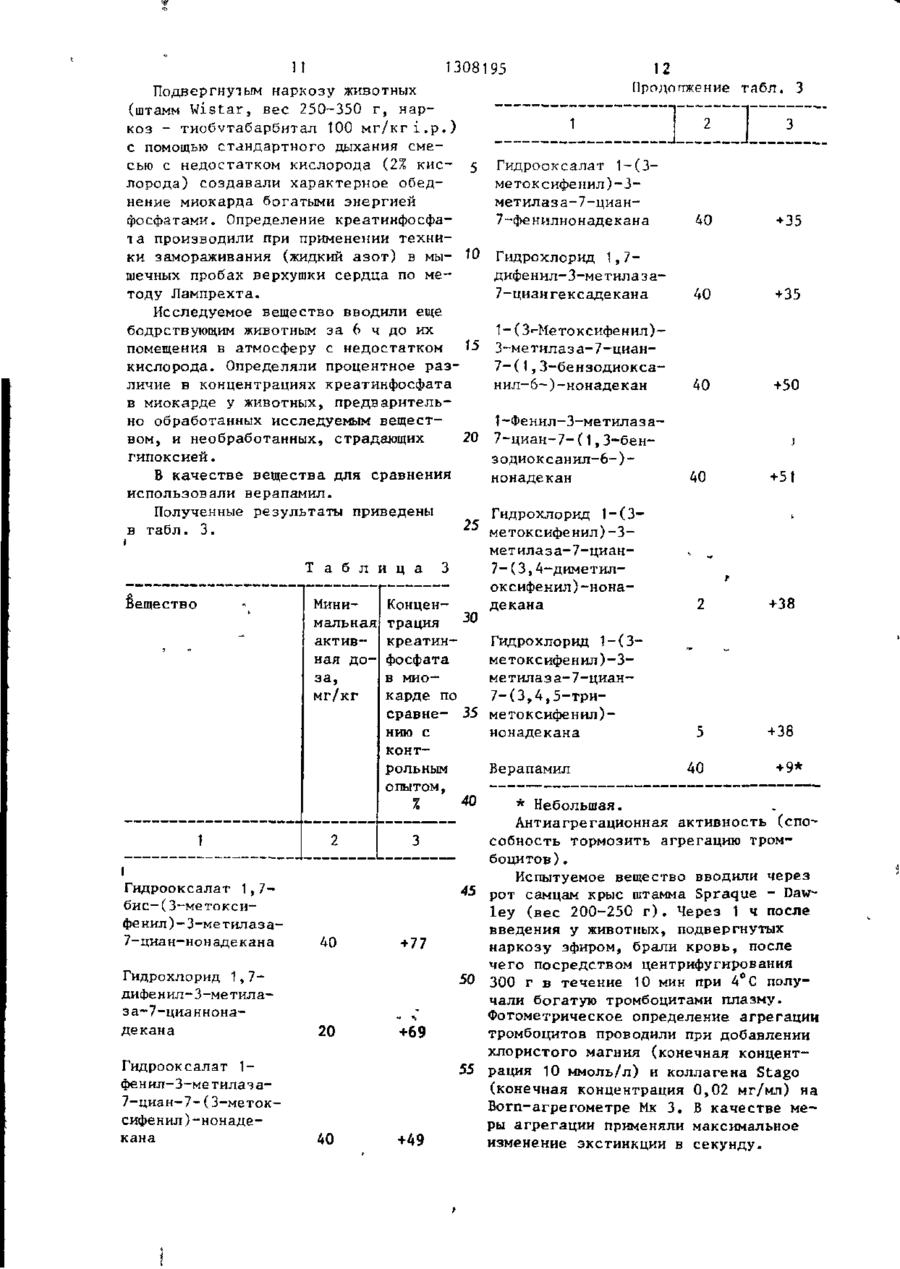
Изобретение касается фенилазаалканов, в частности соединений общей формулы 1 K 1 -CR 4 (CN)-(CH 2 ) 3 -NR ff e 6 ^ 00 о 00 со ел і І Г, 1308195 1 И з о б р е т е н и е о т н о с и т с я к способу туре 100-110"С в течение 30 м и н п р и получения новых производных о м е г а бавляют по каплям 9,3 г (0,07 моль) циано-1, омега-дифенилазаалканов о б 30%-ной суспензии амида натрия в т о щей ф о р м у л ы л у о л е , после чего смесь перемешивают в течение последующих 9 0 м и н при т е м пературе кипения с обратным х о л о д и л ь ником. Полученный реакционный р а с т вор выливают в 200 м л воды, о х л а ж д е н ной льдом, толуольную фазу отделяют 10 и д в а раза промывают в о д о й . Т о л у о л ь ный раствор смешивают с соляной к и с где R 1 - водород, С, С 4Са а л к и л, т р и ,- 4 л к и л лотой, толуол отгоняют при пониженном давлении, после чего полученный Фторметил, С-,-С 4 - алкокси-, остаток перекристаллизовывают из а ц е С 1 - С 4 . - алкилмеркаптогруппа, галоид; і 15 тона. В результате получают 29,7 г (82%) гидрохлорида с т.пл. 132-134 С . Аналогичным способом (примеры 2-42) R7,Rfl - водород, С,-С 4 - алкоксиполучают следующие соединения: групла; R4 - прямой насыщенный или нена2. Гидрохлорид 1,7-бис-(2-метоксисыщенный C g - C t 8 -алкил; 20 фенил)-3-метилаза-7-цианонадекана, R 5 - водород, С^-С^ - алкил; т.пл. 60-69,5°С, выход 7 0 % . KQ - водород, С 1 - С 4 - алкокси-, 3. Гидрооксалат 1,7-бис-(3-метокгалоген-, сифенил)-3-метилаза-7-цианнонадекана, m = 3; т.пл. 97-98°С. Моногидрат гидрохлориn = 2; 25 да имеет т.пл. 60-60,5°С, выход 8 9 % . R, + R 2 - этилендиоксигруппа, 1,3 4. Гидрохлорид 1,7-бис(4-метоксидиоксатетраметилен; фенил)-3-метилаза-7-цианнонадекана, R f c + R 7 - этилендиокси-, метилендиокт.пл. 1Н-116°С, выход 92%. сигруппа, 5. Гидрохлорид 1,7-дифенил-З-метиа также к способу получения их окса- 30 лаза-7-цианнонадекана, т.пл. 112латов, гидрохло^идов, амидосульфона115°С, выход 90%. тов. Указанные соединения обладают фармакологической активностью. 6. Гидрооксалат I,7-бис-(3-метоксифенил)-3-метилаза-7-циандокозана, Целью изобретения является получение новых производных дифенилаза- $5 т.пл. 100-102°С, выход 88%. алканов, которые по сравнению с сое7. Гидрооксалат 1-фенил-З-метиладинениями, близкими по структуре, за-7-циая-(3-метоксифенил)-нонадекаобладают более высокой активностью и на, т.пл. 91-93°С, выход 86%. широтой терапевтического действия. 8. Гидрооксалат 1-(3-метоксифеСпособ осуществляют следующим об- 40 нил)-3-метилаза~7-циан-7-фенилнонадекана, т.пл. 100-102°C, выход 91%. разом. 9. Гидрохлорид 1,7-бис-(3-этоксиП р и м е р 1. Получение 1,7-бисфенил)-3-метилаза-7-циандокозана, (3-этоксифенил)-3-метилаза-7-цианнот.пл. 100-113°С, выход 89%. надекана. 10. Гидрохлорид 1,7-дифенил-З-меВ трехгорлую колбу, снабженную ме- 45 тилаза-7-циангексадекана, т.пл. 109шалкой, капельной воронкой, обратным 111°С, выход 90%. холодильником и термометром, прибав11. 1-(3-Метоксифенил)-3-метилазаляют 20,4 г (0,06 моль) 1-циан-1-(37-циан-7-фенилгексадекан, выход 88%. этоксифенил)-тридекана (полученного Вычислено, %: С 71,3; Н 8,6; N 5 , 2 . в двухфазной системе в присутствии 50 Найдено, %: С 71,1; Н 8,6; N 5,2. катализатора путем алкилирования 312. 1-Фенил-3-метилаза-7-циан-7этоксифенилацетонитрила 1-бромдека(З-метоксифенил)-гексадекан, выном) и 16,9 г (0,06 моль) 1-хлор-4ход 91%. метилаза-6-(3-этоксифенил)-гексана Вычислено, %: С 71,3; Н 8,6; N 5,2. (полученного из N-метил-бета-(3-эток- $$ Найдено, %: С 71,0; Н 8,6; N 5,3. сифенил)-этиламина и 1-бром-З-хлор13. 1,7-Бис-(3-метоксифенил)-3пропана), которые растворяют в 100мл метилаза~7-циангексадекан, выход 92%. сухого толуола. К приготовленному Вычислено, %: С 6 9 , 7 ; Н 8 , 5 ; N 4,9, раствору при,перемешивании и темпера З 13081 95 Найдено, %: С 69,7; Н 8 , 5 ; N 5,0 14. Моногидрат гидрохлорида 1-(3хлорфенил)-3-метилаза-7-циан-7-(3метоксифенил)-нонадекана, т . п л . 687 Г с , выход 87%. 5 15. 1-(3-Метоксифенил)~3-метилаза7-циан-7-(4-хлорфенил)-нонадекан, выход 94%. Вычислено,%: С 75,5; Н 9,4; N 5,3; СІ 6,8-. tO Найдено, %: С 75,5; Н 9,4; N 5,3; СІ 6,6: 16. 1-(3-Метоксифенил)-3-метилаза~ 7-циан-7-( ?, 3~бензоджжсанил-6)-нонадекан, выход 85%. '5 Вычислено^: С 76,6; Н 9,6; N 5,1Найдено,%: С 76,6; Н 9 , 6 ; N 5 , 2 , 17. 1-Фенил-3-металаза-7-циан-7(1,3-бензодиоксанил-6)-нонадекан, выход 82%. 20 Вычислено, %: С 78,7; Н 9 , 7 ; N 5,4* Найдено, %: С 78,4; Н 9,7; N 5,5." 18. 1-(3-Метоксифенил)-3-метилаза7-циан-7-(3-трифторметилфенил)-нонадекан, выход 89%. Вычислено, X: С 73,0; Н 8 , 8 ; N 5 , 0 . Найдено,%: С 7 3 , 1 ; Н 8,8; N 5,0, 19. Гидрохлорнд 1-(3-метоксифенил)-3-метилаза~7-циан-7-(3,4-диметоксифенил)-нонадекана, т . п л . 96-98°С, выход 90%. ' 20. Гидрохлорид 1-(3-метоксифенил)-3-метнлаза-7-циан-7-(3,4,5-гриметоксифенил)-нонадекана, т . п л . 9395°С, выход 92%. 35 21. 1,7-Бис-(3-хлорфенил)-3-метилаза-7-цианнонадекан, выход 85%. Вычислено,Z: С 72,6; Н 8,8; N5,3; СІ 13,4. Найдено, X: С 72,8; Н 8,6; N5,5; 40 С1 13,4' 22. 1-(3~Метоксифенил)-3-метилаза-7-циан-7-(3-хлорфенил)-нонадекан, выход 87%. Вычислено,%: С 75,5; Н 9,4; N 5,5; 45 С1 6,8. Найдено, %: С 75,6; Н 9,4; N 5,3; С1 6,8* 23. 1-(3~Метоксифенил)-3-метилаза7~циан~7-(3,4-этилендиоксифенил)-но- ^0 надекан, выход 92%. Вычислено, %: С 76,6; Н 9,6; N 5,К Найдено,%: С 76,4; Н 9,3; N 5,1. 24. 1-(3-Метоксифенил)-3-метилаза7-циан-7-(3-толил)-нонадекан, вы- 5 5 ход 92%. Вычислено, %: С 80,9; Н10,4; N 5,5. Найдено, %: С 80,6; Н 10,1; N 5,5. А 25. 1,7-Бис-(3-метоксифенил)-3-метилаза-7-цианоктадекан, выход 90%. Вычислено,%: С 78,2; Н 9,9; N 5 , 5 . Найдено,%: С 78,1; Н 9,8; N 5,5. 26. 1~(3-Метоксифенил)-3-метилаза7-циан-7-(3-н-бутокеифенил)-нонадекану выход 78%. Вычислено, %: С 78,9; Н 10,4; N 5 , 0 . Найдено,%: С 78,8; Н10,5; N 5,2 , 27. 1-(3-н-Бутоксифенил)-3-метилаза-7-циан-7-(3-метоксифенил)-нонадекан, выход 75Z. Вычислено,%: С 78,9; 1110,4; N 5 , 0 . Найдено,%: С 78,8; Н 10,3; N 5 , 1 . 28. Гидрохлорид 1,7-бис(3-н-бутоксифенил)-3~метилаза-7-цианнонадекана, т . п л . 127-129°С, выход 79%. 29. 1,7-Бис-(3-метоксифенил)-3метилаза~7-циан-і 7-октадекан, выход 88%. Вычислено,%: С 78,5; Н 9 , 6 ; N 5 , 5 . Найдено,%: С 78,7; Н 9 ? 6 ; N 5 , 4 , 30. 1 (З-Метоксифенил)- 3-метилаза7-циан-7-(3-фторфенил)-нонадекан, выход 85%. Вычислено,Z: С 77,9; Н 9 , 7 ; N5 ,5 , Найдено,%: С 78,0; Н 9,7; N 5,5 , 31. 1-(3-Фторфенил)-3-метилаза-7циан-7-(3-метоксифенил)-нонадекан, выход 92%. Вычислено,%: С 77,9; Н 9,7; N 5 , 5 . Найдено,%: С 78,0; Н 9,6; N 5,4 . 32. },7-Бис-(3-фгорфенил)-3-метилаза-7~цианнонадекан, выход 88%. Вычислено,%: С 77,4; Н 9,3; N 5,6 • Найдено,%: С 77,2; Н 9,3; N 5,6 . 33. 1-(3-Метоксифенил)-3-метилаза7-циак-7-(3-трет-бутоксифенил)-нонадекан, выход 74%. Вычислено,X: С 79,0; Н 10,4; N 5,0 * Найдено,%: С 78,8; Н 10,3; N 4,9 • 34. 1-(З-трет-Бутоксифенил)-Зметилаза-7-циан-7-(3-метоксифенил)нонадекан, выход 70%. Вычислено,X: С 79,0; Н 10,4; N5,0 . Найдено,%: С 78,9; Н 10,5; N 5,0 . 35. 1, 7-Бис-(3-трет -бутоксифенил)3~метнлаза-7-цианнонадекан, выход 75%. Вычислено,X: С 79,4; Н 10, 7; N 4,6 . Найдено,%: С 79,5; Н 10,6; N 4 , 7 . Аналогичным способом могут быть получены следующие соединения; 36. 1-(4-трет-Бутилфенил)-3-метилаза-7^циан-7-(3-метоксифенил)-нонадекан, выход 82%. Вычислено,%: C 8 1 , 3 ; H 1 O , 7 ; N 5 , 1 . Найдено,%: С 81,1; Н 10,6; N 5 , 2 . 1308195 37. 1-(4-Фторфенил)~3-метилаза-7ния реакционную смесь перемешивают в циан-7-(3-метоксифенил)-нонадекан, течение последующих 2,5 ч при укавыход 77%. занной температуре. Охлажденную реВычислено,%: С 77,9; Н 9,7; F 3,7: акционную смесь промывают 100 мп воN5,5. 5 ды. После отгонки растворителя полуНайдено, %: С 78,1; Н 9,6; N 5,4. чают 55 г конечного продукта в виде 38. 1-(3,4-Диметоксифенил)-3-меокрашенного в желтый цвет маслооб-тилаза-7-циан-7-(4-бромфенил)-эйко~ разного вещества, выход 94%. Гидрозан, выход 86%. оксалат полученного соединения имеВычислено, %: С 68,5; Н 8,7; Ю ет т. пл. 93-96°С. Вг 13,0; N 4,6Аналогичным способом (примеры 44Найдено, %: С 68,4; Н 8,5; Вг 13,2; 50) получают следующие соединения: N 4,7 . 44. 1-(3,4-Диметоксифенил)-3-ме39. 1-(4-Этилмеркаптофенил)-3-метилаза-7-циан-7-(3-хлорфенил)-нонатилаза-7-циан-7~(3-метоксифенил)нона- '5 декан, выход 92%. декан, выход 89%. Вычислено, %: С 73,5; Н 9,3; N 5,0; Вычислено, %: C 7 6 , 3 ; H 9 , 9 ; N 5 , 1 ; С1 6,4. S 5,8Найдено, %: С 73,6; Н 9,3; N5,0; Найдено, %: С 76,4; Н 10,0; N 5 , 0 ; С1 6,4. S 5,6. 20 45. 1-(3,4-Диметоксифенил)-3-ме40. 1,7-Бис-(3-метилмеркаптофенил) тилаза-7-циан-7-(1,3-бензодиоксанилЗ-метилаза-7-цианнонадекан, выход 81%. 6 - ) - н о н а д е к а н , выход 89%. Вычислено, %: С 73»9; Н 9,5; N 5 , 1 ; Вычислено, %: С 7 4 , 7 ; Н 9 , 4 ; N 4 , 8 S 11,6. Найдено, %: С 7 4 , 6 ; Н 9 , 2 ; N 4 , 9 , Найдено, %: С 73,7; Н 9,4; N 5,2; 25 46. Амидосульфонат 1-(3,4-диметS 11,8. оксифенил)-3-метилаза-7-циан-7-(3, 41. 1-(3,4-Дихлорфенил)-3-метила4,5-триметоксифенил)нонадекана, за-7-циан-7-(3-метоксифенил)-нонадет.пл. 99-102 г С, выход 88%. кан, выход 78%, 47. Гидрохлорид 1-(3,4-диметоксиВычислено, % : С 70,8; Н8,7; С1 12 ,7;30 фенил)-3-метилаза-7-циан-7-(3-этокси• фенил)докозан, т.пл. 109-112 С, выN 5,0. ход 90%. Найдено, %: С 70,6, Н 8,6; С1 12,8; N 5,1 . 48. Гидрохлорид 1-(3,4-диметоксифенил)-3-метилаза-7-циан-7-(3-эток42. 1-(3-Фторфенил)-3-метилаза-7циан-7- (3-хлорфенил) -jS-нонадекан, 35 сифенил)-нонадекана, т.пл. 111-113 С, выход 92%. выход 76%. 49. Гидрохлорид 1-(3,4-диметоксиВычислено, %: С 74,9; Н 9,0; фенил)-3-метилаза-7-циан-7-(3,4,5С1 6,9; F 3,7; N 5,5 . триметоксифенил)—пентакозана, Найдено, %: С 74,8; Н 9,1; С1 7,0; 40 т.пл. 98^Т01°С, выход 89%. N 5,6 . 50. Амидосульфонат 1-(3,4-диметокП р и м е р 43, Получение 1,7сифенил)-3-метилаза-7-циан-7-(3,4,5бис-(3,4-диметоксифенил)-3-метилазатриметокснфенил)-гептадекана, 7-цианнонадекана. т.пл, 97-1О0°С, выход 85%. В трехгорлую колбу, снабженную ме4 J П р и м е р 51. Получение 1-(3шалкои, капельной воронкой н обратметоксифенил)-3-метилаза-7-циано~7ным холодильником, вводят 34,5 г (3,4,5-триметоксифенил)-эйкозана. (0,1 моль) альфа-додецилвератрил20,7 г (0, 1 моль) 3,4,5-триметокси-цианида и растворяют его при 40 С в фенилацетонитрила растворяют при 40°С 15 мл толуола. К приготовленному раствору прибавляют 26 г порошкооб- 50 в 15 мл толуола и полученный раствор разной гидроокиси калия и 0,2 г йодис- смешивают с 52 г (0,8 моль) 85%-ной порошкообразной гидроокиси калия и того тетрабутиламмония, К смеси при0,2 г йодида тетрабутиламмония. К бавпяют при перемешивании раствор смеси прибавляют при перемешивании 27 г (0,1 моль) М-метил-М-гомовератриламино-гамма-хлопропана в 20 мл 55 26,3 г (0,1 моль) тридецилбромида в 20 мл толуола таким образом, чтобы толуола таким образом, чтобы темпетемпература реакционной смеси на ратура реакционной смеси не превышапревышала 90°С. После завершения прила 90°С. После завершения прибавле 7 13081 95 8 бавлення реакционную смесь дополниДля указанных соединений определятельно перемешивают в течение 2 ч ли фармакологическую активность. при указанной температуре и после Противогипертоническая активность, этого прибавляют к ней раствор 24,2 г Испытуемое вещество вводили через (0,1 моль) 1-хлор-4-метилаза-6-(3j рот самцам крыс, произвольно страдаюметилоксифенил)-гексана в 20 мл тощих гипертонией (ПГК) Okamoto-штамма луола при 90"С. Реакционную смесь пе(вес 300-400 г). Систолическое давлеремешивают при 90°С в течение 3 ч, ние крови до введения и через 2,6,24 после охлаждения смешивают ее со и 30 ч после введения бескровно оп100 мл воды, после чего толуольную W ределяли на хвостах крыс с помощью фазу отделяют. После отгонки раствопьезокристаллического датчика. рителя получают неочищенное основание в виде окрашенного в желтый цвет В качестве ED 20% с учетом значемаслообразного вещества, которое хроний, -.полученных на необработанных матографируют на силикагеле, исполь- Ї5 контрольных животных, определяли дозуя в качестве элюирующего средства зу, которая понижала систолическое этиловый эфир уксусной кислоты. Выдавление на 20%. В качестве вещестход 89%. Значение R- (метиленхлорид/ ва для сравнения использовали вера/метанол 97:7).0,44. памил. Вычислено, %\ С 74,7; Н 9,8; N 4,7- 20 Полученные результаты приведены Найдено,%: С 74,7; Н 9,4; N 4 , 8 . в табл. 1. 1 а б л и ца Вещество Понижение систолического давления крови ED 20%/мг/кг/ 2 ч Гидрооксалат 1,7-бис(З-метоксифенил)-Зметилаза-7-цнаннонадекана Относительная активность (верапа— мил 1,00) 6 ч Относительная активность (верапамил 1,00) 1 -*-———- т 24 ч 14,9 0,93 14,1 1,46 18,7 7,5 3,09 19,8 1,04 46,4 3,7 6,27 6,6 3,12 12,5 10,2 2,02 46,4 20,6 1,00 Гидрохло рид-1-(3метоксифенил)-3-метилаза-7-циан-7-(3, 4-диметоксифенил)нонадекана Гидрохлорид 1-(3метоксифенил)-3метилаза-7-циан-7(3,4,5-триметоксифенил)-нонадекана 1,7-Бис-(3-метоксифенил)-3-метилаэа-7цианоктадекан Амидосульфонат 1-(3f 4-диметоксифенил)-3метилаза-7-циан-7-(3," 4,5-триметоксифенил)нонадекана 6,8 3,41 W,3 2,25 Верапамип 23,2 1,00 58,3 9 13081 95 Противоаритмическое действие. Для определения противоаритмической активности испытуемое вещество вводили через рот крысам (штамм Spraque - Dawley, вес 200-250 г ) . 5 Через 5 ч животным давали наркоз с помощью тиобутабарбитала натрия (100 мг/кг і.р.). В качестве вещества, приводящего к аритмии, применяли аконитин, который вводили внутривен- *0 но через 6 ч после введения испытуемого вещества (скорость дозирования 0,005 мг/кг мин). У необработанных животных через 2,7410,07 мин на электрокардиограмме (ЭКГ) наблюдали арит-'5 мию, наступление которой затягивалось в зависимости от дозы, под действием заявленного противоаритмического вещества. Определяли относительное удлинение времени от момента вве-20 дения аконитина ( Д % ) под действием исследуемых веществ в дозе 46,4 мг/кг. Вещество 2 Удлинение 30 времени от момента введения аконитина 35 1 Гидрооксалат 1,7-бис-(3метоксифенил)-3-метилаза-7-циан-нонадекана 2 22 Гидрохлорид 1,7-дифенилЗ-метилаза-7-цианнонадекана Гидрооксалат 1-фенил-Зме тилаз а-6-циан-7-(3метоксифенил)-нонадекана 88 Гидрооксалат 1-(3-метоксифенил)-3-метилаза~7циан-7-фенилнонадекана 88 1-Фенил-З-метилаза-7циан-7-(3-метоксифенил )-гексадекан 107 98 1-(3-Метоксифенил)-3-метилаза-7-циан-7-(4-хлорфенил)-нонадекан 88 1-(З-Метоксифенил)-3-метилаза-7-циан-7-(1,3бензодиоксанил-6-)-нонадекан 61 Гидрохлорид 1-(3-метоксифенил)-3-метилаза-7-циан1-(3,4-диметоксифенил)нонадекана 50 1-(3-Метоксифенил)-3-метилаза-7-циан-7-(3,4этилдиоксифенил)-нонадекан 86 1-(3-Метоксифенил)-3-метилаза-7-циан-7-(3-толил)нонадекан 68 1,7-Бис-(3-метоксифенил)З-метилаза-7-цианоктадекан 186 155 1,7-Бис-(3,4-диметоксифенил )-3-метилаэа-7цианнонадекан 1-(3,4-Диметоксифенил)3-метилаэа-7-циан-7-(3хлорфенил)-нонадекан Амидосульфонат 1-(3,4диметоксифенил)-3-ме50 тилаза-7-циан-7-(3,4,5,триметоксифенил)-гептадекана Верапамил 45 о 128 188 Моногидрат гидрохлорида 1-(3-хлорфенил)-3-метилаза-7-циан-7-(3метоксифенил)-нонадекана 40 55 1 , 7-Биc-(3-мeтoкcифeнил)-3-мeтилaзa-7циангексадекан 1 1,7-Бис-(3-метоксифенил)3-метилаза-7-циан-17октадекан В качестве вещества для сравнения использовали верапамил. >Полученные результаты представле 25 ны в табл. 2. Т а б л и ц а 10 Продолжение табл. 2 104 63 29* * Небольшое. Кардиозащитное действие против гипоксических нарушений обмена веществ в сердце. 1308195 12 Продопжение табл. 3 Подвергнутым наркозу животных (штамм Wistar, вес 250-350 г, нар1 коз - тиобутабарбитал 100 мг/кгі.р.) с помощью стандартного дыхания смесью с недостатком кислорода (2% кисГидрооксалат 1-(3лорода) создавали характерное обедметоксифенил)-3нение миокарда богатыми энергией метилаза-7-цианфосфатами. Определение креатинфосфа7-фенилнонадекана 40 + 35 7 а производили при применении техники замораживания (жидкий азот) в мы- 10 Гидрохлорид 1,7шечных пробах верхушки сердца по медифе н ил-3-ме тил а з атоду Лампрехта. 7-циангексадекана 40 + 35 Исследуемое вещество вводили еще бодрствующим животным за 6 ч до их помещения в атмосферу с недостатком кислорода. Определяли процентное различие в концентрациях креатинфосфата в миокарде у животных, предварительно обработанных исследуемым веществом, и необработанных, страдающих 20 гипоксией. В качестве вещества для сравнения использовали верапамил. Полученные результаты приведены 25 в табл. 3. і Т а б л и ц а Вещество Минимальная активная д о за, мг/кг 1 2 I Гидрооксалат 1, 7бис-(3—метокси— фе нил) — 3-ме тилаз а7-циан-нонадекана 40 Гидрохлорид 1,7дифенил-3-метилаза~7-цианнонадекана 20 Гидрооксалат 1фенил-3-метилача7-циан-7-(3-метоксифенил)-нонадекана 40 3 І-(З--Метоксифенил)З-метнлаза-7-циан7-(1,3-бензодиоксанил-6-)-нонадекан 40 +50 1-Феннл-З-метилаза7-циан-7-(1,3-бензодиоксанил-6-)нонадекан 40 +51 Гидрохлорид 1-(3метоксифенил)-3метилаза-7-циан7-(3,4-диметилоксифенил)-нонадекана 2 +38 Концентрация Гидрохлорид 1-(3креатинфосфата метоксифенил)-3метилаза-7-цианв миокарде ПС 7-(3,4,5-трисравне- 35 метоксифенил)+ 38 нонадекана 5 нию с контрольным + 9* Верапамил 40 опытом, 40 * Небольшая. Антиагрегационная активность (спо~ собность тормозить агрегацию тром3 боцитов) . Испытуемое вещество вводили через 45 рот самцам крыс штамма Spraque - Dawley (вес 200-250 г ) . Через 1 ч после введения у животных, подвергнутых + 77 наркозу эфиром, брали кровь, после чего посредством центрифугирования 50 300 г в течение 10 мин при 4°С получали богатую тромбоцитами плазму. Фотометрическое определение агрегации тромбоцитов проводили при добавлении +69 хлористого магния (конечная концент55 рация 10 ммоль/л) и коллагена Stago (конечная концентрация 0,02 мг/мл) на Вогп-агрегометре Мк 3. В качестве м е ры агрегации применяли максимальное изменение экстинкции в секунду. +49 13 TJ08195 14 В качестве ED 33% определяли дозу, Противоаллергическая активность. которая на 33% тормозила агрегацию Для исследования применяли модель тромбоцитов, вызванную коллагеном. пассивной кожной анафилаксии (ПКА). В качестве вещества для сравнения Подвергнутых наркозу крыс (100140 г) сенсибилизировали посредством использовали верапамил. Полученные результаты сведены в внутрикожной инъекции (в подстриженную кожу спины) 0,1 мл овальбуминовой табл. 4. противосыворотки. Т а б л и ц а 4 По истечении периода сенсибилизиТорможение 10 рования, составляющего приблизительВещество агрегации но 48 ч, производили обработку (ввоED 33% дили через рот исследуемое вещество). /мг/кг/ После различных латентных периодов (2,6,12 и 24 ч) подопытным животным вводили внутривенно раствор антигена Гидрооксалат 1,7-бис-(3~ и Eransblau. Через 30 мин животных метоксифенил)-3-метштазаумерщвляли, отделяли кожу спины и на 7-цианнонадекана 9,6 внутренней поверхности определяли размеры синих пятен круглой формы. Гидрооксалат 1,7-бис(320 Противоаллергическую активность метоксифенил)-3-метиларассматривали как относительное уменьза-7-циандокозана 49,0 шение ( д % ) диаметра окрашенных пятен. Б качестве вещества для сравнеВерапамил* — ния применяли верапамил. 25 Противоаллергическая активность * Доза 46,4 мг/кг не обладает после введения 21,5 мг/кг исследуемоспособностью тормозить агрего вещества крысам представлена в гацию. табл. 5. Т а б л и ц а 5 % торможения Вещество Латентный период, ч 12 24 Гидрооксалат 1,7-бис-(3метоксифенил)-3-метилаза7-циан-нонадекана 15 40 83 68 Верапамил 53 50 33 31 момента введения аконитина на 50 В случае ПГ-крыс у предлагаемых (пример 19) - 188% (пример 13), т.е. соединений противогипертоническая 45 они значительно отличаются от вераактивность в большинстве случаев бопамила, который в дозе 46,4 мг/кг у лее сильно выражена, чем у верапакрыс оказывает небольшое влияние на мила (табл. Т ) . Кроме того, наблюдааритмию, вызванную аконитином. ется значительное увеличение продолжительности действия. Б противопоПриведенные в табл. 3 предлагаеложность верапамилу, который в субмые соединения в дозах 2-40 мг/кг летальной дозе 100 мг/кг, через 24 ч р.о. обладают значительным карднозаперестает быть активным, остальные щитным действием. Особенно сильно вещества (особенно вещества,оописанные в примерах 3 и 20) даже к этому 55 действуют соединения, соответствующие примерам 3, 5. Верапамил в дозах от моменту проявляют противогипертони40 мг/кг р.о, в условиях, выбранных ческую активность. для проведения опытов, не проявляет Приведенные в табл. 2 предлагаесущественного защитного действия. мые соединения удлиняют лремя от 15 13081 95 Соединение по примеру 3, при введении крысам через рот проявляет наиводород, С і -С + -алкоксиR7, R e большее тормозящее действие на агрегруппа; гацию тромбоцитов (табл. 4 ) . ВераR 4 - прямой насыценный или непамил в таких же условиях проведения $ насыщенный Cn-C-fg -алкил; эксперимента до максимальных приемg - водород, С^-С4-алкил; . лемых доз 46,4 мг/кг не оказывает влияния на агрегацию тромбоцитов. Rfe - водород, Ci~C + - алкокси, галоген, Кроме того, это соединение после ш = 3; введения через рот крысам проявляет Ю п = 2; противоаллергическую активность на R z -этилендиоксигруппа, 1,3модели пассивной кожной анафилаксии R (табл. 5 ) . Изучение продолжительносдиоксатетраметилен; ти действия показало, что соединение R 7 - этилендиокси-, метилендиR после латентных периодов 12 и 24 ч 15 окснгруппа, проявляет значительно более сильную их оксалатов, гидрохлоридов, амидоактивность, чем верапамил и, следосульфонатов, о т л и ч а ю щ и й с я вательно , отличается более продолжитем, что фенилацетонитрил общей фортельным периодом проявления активмулы ности. 20 Предлагаемые соединения обычно назначают через рот или парентерально. При этом аналогично верапамилу (контрольному веществу) не наблюдается летальных эффектов до дозировки 25 не меньше 100 мг/кг. где R-,-R4 - имеют указанные значения, подвергают взаимодействию с 1-фенилФ о р м у л а и з о б р е т е н и я азаалканом общей формулы Способ получения производных оме- 30 га-циано-1, омега-дифенилазаалканов общей формулы ' 35 где R ? - Kg где - имеют указанные значения; X - галоид; R, - водород, С 1 -С 4 -апкил, трис последующим выделением целевого 1 фторметил, С,-С4 ~ алкок- 40 продукта в свободном виде или в виде с и - , С 1 -С 4 ~алкилмеркаптооксалатов, или гидрохлоридов, или группа, галоид; амидосульфонатов. П р и о р и т е т по п р и з н а к а м : 10.04.81 06.11.81 при R-i Rj и R 3 п m R7 = = R5 при R 1 R 2 и R^ Rs R^ + Rj ~ метил, оксалаты, гидрохлориды, амидосульфонаты; - трифторметил, С^-С^-алкил, хлор; - С(-С4-алкоксигруппа, хлор; - Н,_С2-С4-алкил; - этилендиоксигруппа, 1,3-диоксатетраметилен радикал; - метилендиоксигруппа. R^ +R 7 Н, Н; 2; 3; Н, С^-^-алкокси; Сі-С4~алкоксигруппа; 1308195 Редактор А. Лежнина Составитель М. Меркулова Техред М.Ходанич * Корректор И. Муска Заказ 1645/58 Тираж 372 Подписное ВНИИПИ Государственного комитета СССР по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб,, д. 4/5 Производственно-полиграфическое предприятие, г. Ужгород, ул. Проектная, А
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for production of omega-cyano-1, omega-diphenyl-azaalkane derivatives, oxalates, hydrochlorides or amidosulphonates thereof
Назва патенту російськоюСпособ получения производных омега-циано-1, омега-дифенилазаалканов, их оксалатов, гидрохлоридов и амидосульфонатов
МПК / Мітки
МПК: A61K 31/275
Мітки: гідрохлоридів, оксалатів, omega-ціано-1, похідних, омегадіфенілазаалканів, одержання, спосіб, амідосульфонатів
Код посилання
<a href="https://ua.patents.su/10-3938-sposib-oderzhannya-pokhidnikh-omega-ciano-1-omegadifenilazaalkaniv-abo-kh-oksalativ-gidrokhloridiv-amidosulfonativ.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних омега-ціано-1, омегадіфенілазаалканів або їх оксалатів, гідрохлоридів, амідосульфонатів</a>
Попередній патент: Гербіцидна композиція
Наступний патент: Спосіб одержання оксимів
Випадковий патент: Електронний курильний виріб