Спосіб одержання похідних 1,4-дігідропірідіна або їх кислотно-адітивних солей
Номер патенту: 7083
Опубліковано: 30.06.1995
Автори: Сімон Фразер Кемпбелл, Джон Кендрік Стаббз, Пітер Едвард Кросс
Формула / Реферат
1. Способ получения производных 1,4-дигидропиридина общей формулы (1)
где Y - группа - (СН2)2 - или - (СН2СНСН3)-;
R1 - незамещенный фенил или замещенный 1-2 заместителями из числа галогена, С1-С4-алкоксила или оксигруппы;
R2 - водород, C1-C4-алкил, бензил, 2-(С1-С4-алкокси)этил или группа -СН2СОR3, где R3-окси-группа, С1-С4-алкоксил или группа - NR4-R5, где R4 и R5 - независимо друг от друга водород или С1-С4-алкил,
или их кислотно-аддитивных солей, отличающийся тем, что в производном 1,4-дигидропиридина общей формулы (II)
где Y и R1 имеют указанные значения;
Х - защищенная первичная или вторичная аминогруппа, где вторичная группа имеет формулу -NHR2, где R2 имеет указанные значения за исключением водорода,
удаляют защитную группу с последующим выделением целевого продукта в виде основания или кислотно-аддитивной соли или алкилированием соединения формулы (I), где R2 - водород, соединением Hal CH2COO (С1-С4-алкил) где Hal - хлор или бром, для получения соединения формулы (I), где R2-СН2СОО (С1-С4-алкил), или гидролизом соединения формулы (I), где R2 - CH2COO (C1-С4-алкил), для получения соединения формулы (I), где R2 - СН2СООН, или аминированием соединения формулы (I), где R2 - СН2СОО (С1-С4-алкил), для получения соединения формулы (I), где R2 - группа NR4 - R5 где R4 и R5 имеют указанные значения, с последующим выделением целевого продукта в виде основания или соли.
2. Способ по п. 1, отличающийся тем, что Х - NR2 (бензил), где R2 - имеет указанные значения, или Х - группа формулы
3. Способ по п. 2, отличающийся тем, что Х - NR2 (бензил) и удаление бензильной группы осуществляют путем гидрирования.
4. Способ по п. 1, отличающийся тем, что Х - группа NR2СООСН2ССl3 и группу (СООСН2ССl3) удаляют воздействием цинка и муравьиной или уксусной кислоты.
5. Способ по п. 1, отличающийся тем, что Х-фталимидо и фталоильную группу удаляют воздействием метиламина, гидразингидрата или гидрата окиси калия, а затем соляной или серной кислоты.
Текст
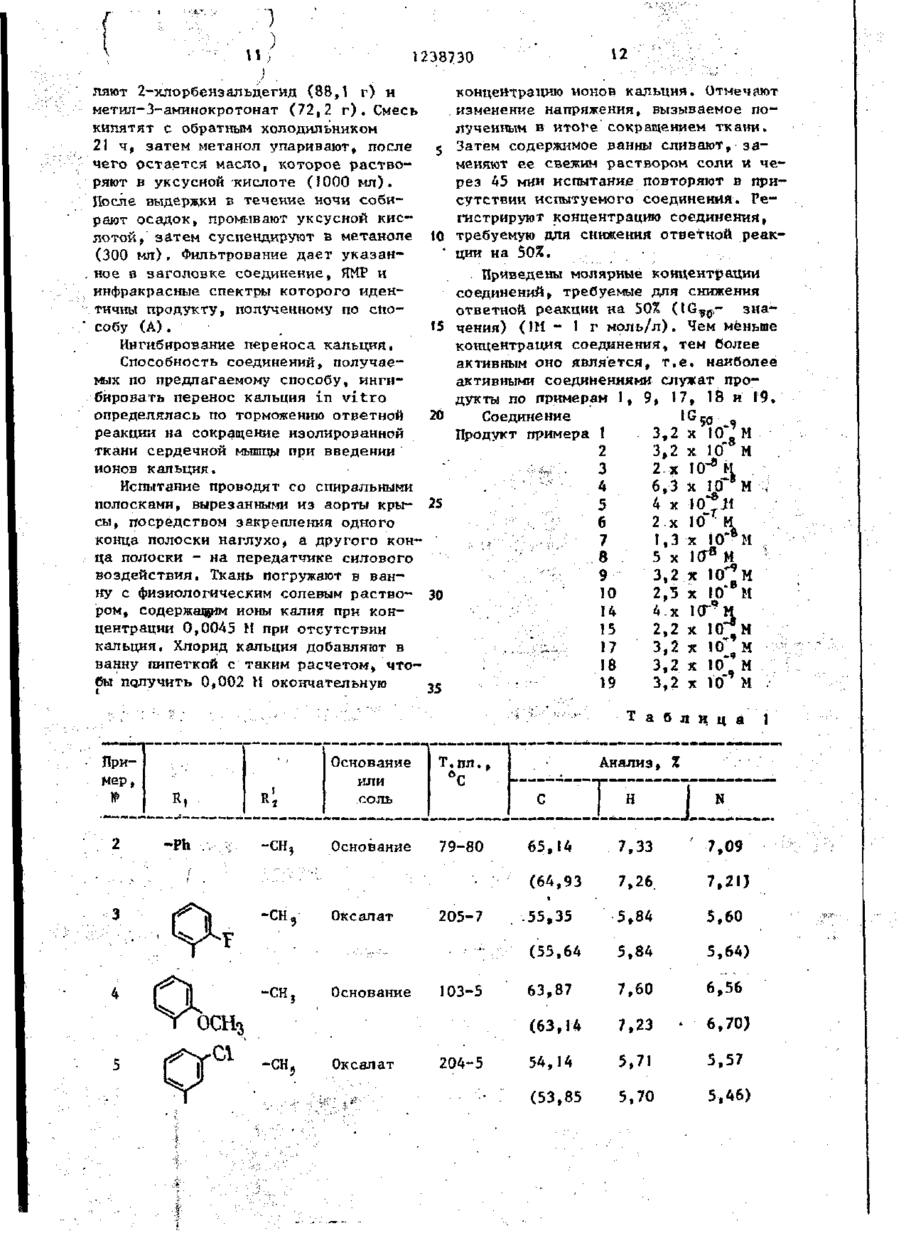
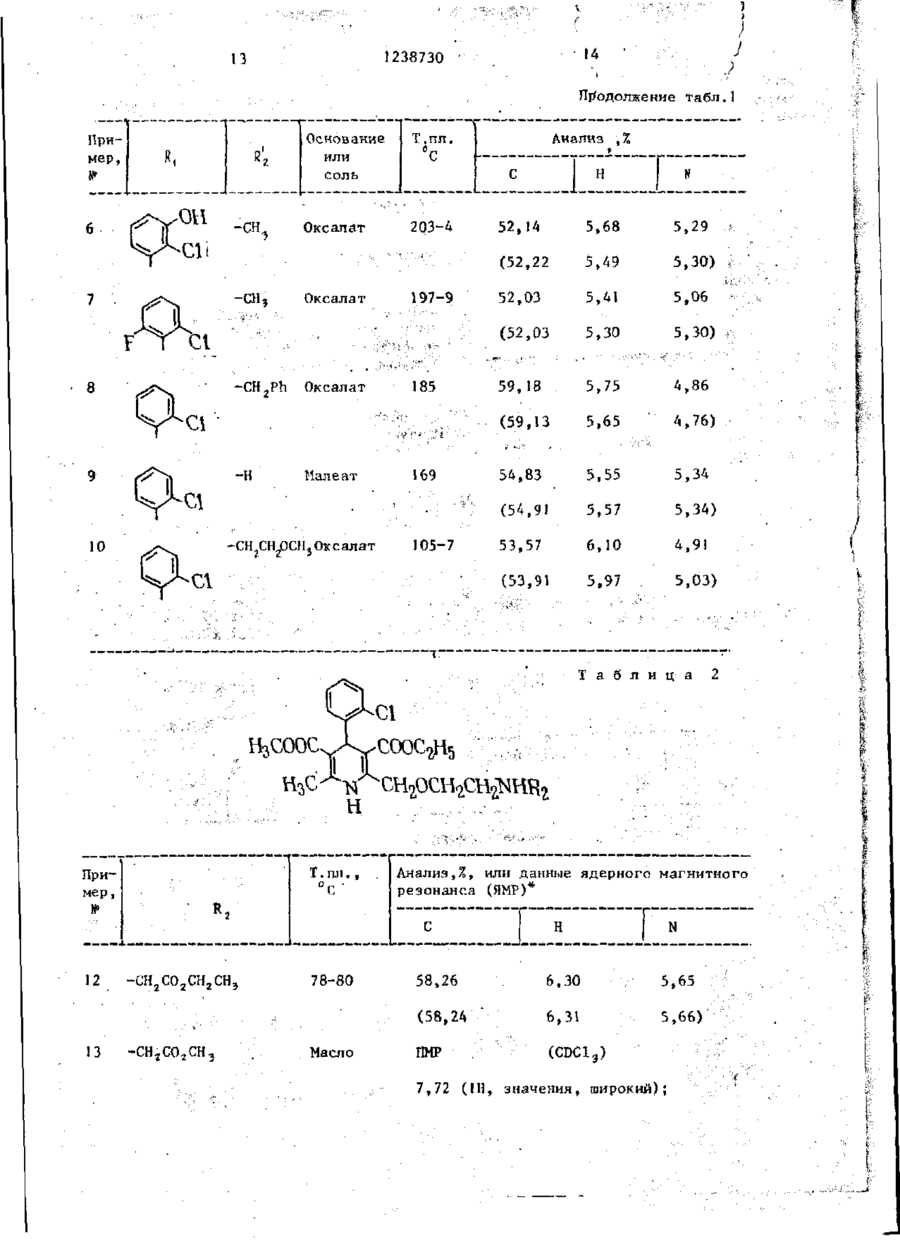
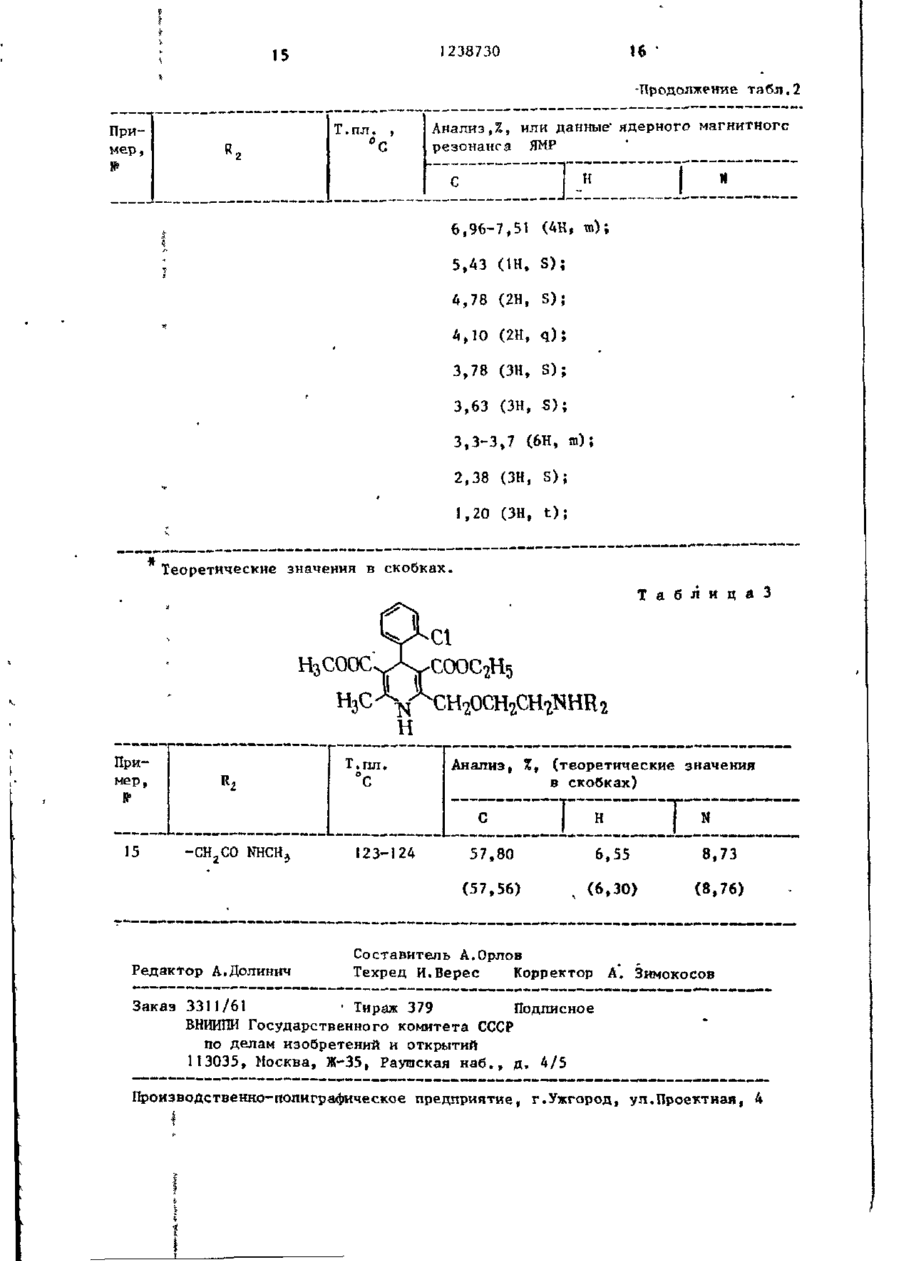
I.Способ получения производных 1,4-дигидропиридина общей формулы(1) Н Ri н где У - группа - (СН 2 ) 2 - или (сн 2 снсн э )-; R, - незамещенный фенил или замещенный 1-2 заместителями из числа галогена, С,-С 4 -алкоксила или оксигруппы; R 2 - водород, С,- С 4 -алкил, бензил , 2- (C t -С + - алкокси) этил или группа -CH^COR,,где R^-оксигруппа, С,-С.алкоксил или группа - N R 4 ~R ? , где R^ и R^ - независимо друг от друга водород или С^-С^-апкнл, или их кислотно-аддитивных солей, о т л и ч а ю щ и й с я тем, что в -1, Х н где Y и R, имеют указанные значения; X - защищенная первичная или вторичная аминогруппа, где вторичная группа имеет формулу - N HR ? , где R^ имеет указанные значения за исключением водорода» удаляют защитную группу с последующим выделением целевого продукта в виде основания или кислотно-аддитивной соли или алкилированием соединения формулы ( І ) і где Rj - водород, соединением Hal СН2С00 ( С , - С 4 -ал~ кил) где Hal - хлор или бром, для получения соединения формулы ( I ) , где R 2 - СН2С00 ( С , - С 4 - а л к и л ) , или гидролизом соединения формулы ( I ) , где R t ~ СН2С00 ( С , - С 4 - а л к и л ) , для получения соединения формулы ( I ) , где R j -CH^COOH, или амииированием с о е динения формулы ( I ) , где R 2 - СН2С00 ( С , - С + - а л к и л ) , для получения соединения формулы ( I ) , где R 2 - группа N R 4 Ry, где R ^ H R ^ имеют указанные значения, с последующим выделением целевого продукта в виде основания или соли. 2. Способ по п . 1 , о т л и ч а ю щ и й с я тем, что X - NR2 (бензил), где R^ - имеет указанные значения) или X - группа формулы 1238730 3. Способ по п. 2, о т л и ч а ющ и й с я тем, что X NR2 (бензил) и удаление бензильной группы осуществляют путем гидрирования. 4. Способ по п . ) , о т л и ч а ю щ и й с я тем, что X - группа NR.2С00СНгСС1э и группу (С00СН2СС15) удаляют воздействием цинка и муравьиной или уксусной кислоты. 5. Способ по п. 1 , о т л и ч а гощ и й с я тем, что Х-фталимидо и — фталоильную группу удаляют воздействием метиламина, гидразингидрата или гидрата окиси калия, а затем соляной или серной кислоты. 1 Изобретение относится к способу получения новых производных 1,4-дигидропиридина, обладающих фармакологической активностью и которые могут найти применение в профилактике и лечении инфаркта миокарда и гипертонии. Цель изобретения - способ получения производных 1 f 4-дигидропиридина или их кислотно-аддитивных со10 лей, которые обладают^активностью при профилактике и лечении инфаркта миокарда и гипертонии. Нижеследующие примеры иллюстрируют синтез соединений и их фармако- 15 логическую активность. П р и м е р 1. Получение щавелевокислой соли 4-(2-хлорфенил)-2-[(2метиламино)этоксиметил]-3-этоксикарбонил-5-метоксикарбонил~б-метил-1,4- 20 дигидропиридина. Раствор щавелевокислой соли 2-^2(Г^-бензил~Н-метиламино)-этоксиметил14-(2-хлорфенилУ-3-этоксикарбонил-5метоксикарбонил-6-метил-1,4-дигидро- 25 пиридина ( 4 , 3 г) в метаноле (220 мл) добавляют к суспензии 10 вес.% палладия на активированном угле (0,4 г ) , предварительно гидрировэнного в метаноле (50 м л ) . Перемешивание под дав- зо лением 3,5 к г / с м 2 водорода (50 фунтов к в . дюйм) при комнатной температуре в течение ночи приводит к полному удалению бензильной группы. После удаления катализатора фильтрованием 35 упаривают метанол и кристаллизуют остаток из небольшого количества метанола, получают указанное соединение (2,4 г ) , т . п л . 2 П ° С . Вычислено,%: С 53,85; Н 5,70; N 5,46. Найдено,%: С 53,99; Н 5,76; N 5,60. Свободное основание имеет т.пл. 88-90°С (из эфира). П р и м е р ы 2-10 ( с м . т а б л . 1 ) . Следующие соединения получают способом, описанным в примере 1. Соединения получают исходя из оксалата соответствующего 11-замев*енного дигидропиридина путем гидрирования в присутствии палладия. Гидрирование И,М-дибензильного исходного материала в примере 8 приводит к получению монобензильного продукта, который, в свою очередь, применяют в качестве исходного продукта в примере 9. П р и м е р 11. MeTRn-N-{2- [4( 2 , З-дихлорфеншО-З-зтоксикарбонилЗ-метоксикарбонил-б-метил-І ,4-дигидропирид-2-илЗметоксиэтил]'аминоацетат 4~дигидрогшрид-2- 20 ил] м е т о к с т э-тиламино) дцетамид, Вычислено,%: С 5 5 , 5 2 ; Н 5 , 9 3 ; Этил-Н~(2-[[4-(2-хлорфенил)-3N 5,89. этоксикарбонил-5-метоксикарбонил-6ЇЇ р и м е р Ї 7 . Получение 2 - [ ( 2 метил-1,4-дигидропирид-2-ил]метокси\ 25 аминоэтокси)метил]-4-(2-хлорфенил)этил)аминоацетат (2,50 г) смешивают З-этоксикарбонил-5-метоксикарбонилс этанолом (40 мл) и 0,880 н. водным б-метил-1,4-дигидропиридин малеат. раствором аммиака (30 мд) и перемеСпособ А (с применением раствора шивают при комнатной температуре метиламина в э т а н о л е ) . 4 дня, затем упаривают. Остаток р а с пределяют между этилацстатом и водой, 30 4-(2-Хлорфенил)-3-этоксикарбонилорганический слой промывают водой, -5-метоксикарбонил-6-метил-2-(2-фтасушат сульфатом магния и упаривают. ламидоэтокси)метил-1,4-дигидропириОстаток хроматографируют на двуокиси дин (80 г ) перемешивают в 33%-ном кремния ("Мерк", "Кизельгель бОН", растворе метиламина в этаноле 30 г) и элюируют с адсорбента ди35 (1067 мл) при комнатной температуре хлорметаном в смеси с 0-5% метанола. 3 ч . Затем упаривают растворитель, Надлежащие фракции объединяют и упаостаток суспендируют в денатурате ривают. Остаток растирают с этил(технический этиловый спирт)(300 мл) і ацетатом, полученное твердое вещестпосле чего фильтруют. К фильтрату во собирают, промывают етилацетатом 40 добавляют малеиновую кислоту (17,4 г) и высушивают, получают названное и после перемешивания получают осасоединение (1,23 г ) , т . п л . 126-129 С док. Его собирают фильтрованием и промывают денатуратом. Твердое в е Найдено,%: С 56,78; Н 6,06; щество кристаллизуют из указанного N 8,68. 45 денатурата (430 мл) и высушивают при 55 С, получают указанное соединение Вычислено,% С 56,71; Н 6,06; (38,4 г) в виде белого твердого в е N 9,02. щества. По данным спектроскопии это П р и м е р 15 (см.табл.3).Слевещество тождественно продуктам, подующее соединение получают по спосо50 лученным в примерах 9 и 12. бу, описанному в примере 14, с и с Способ Б (применение гидразин пользованием соответствующего днгидгидрата). ропиридина и метиламина. 4-(2-Хлорфенил)-3-этоксикарбонилП р и м є р Ї6. Н-(2-[[4-(2-хлор5-метоксикарбонил-6-метил-2-(2-фтафенил) -З-этоксикарбонил-5-метокси55 лимидоэтокси)метил-1,4-дигидропирикарбонил-6-метил-1,4-дигидропириддин (383 г) перемешивают в этаноле, 2-пп]метоксиі'>тил)аминоуксусная киссодержащем гидразин гидрат (106,7 г ) , лота. . с при кипячении с обратным холодиль 238730 ником. Через 2 ч реакционную смесь Экстракты упаривают. Полученное неохлаждают и фильтруют. Фильтрат упаочищенное масло (6,9 г) содерривают, остаток растворяют в метиленжит соответствующее производное хлориде (2000 мл), и раствор промыг 2- [2- (ТЯ-2,2,2-і рихлорэтоксикарбонилвают водой (2000 мл). Органический N-метиламино)этоксиметила^ . раствор упаривают, и оставшееся масУпомянутое масло (3,0 г) растволо растворяют в денатурате (1120 мл). ряют в диметилформамиде (10,5 мл) и К этому раствору добавляют малеиномуравьиной кислоте (0,5 г ) , затем довую кислоту (82,5 г ) , образующийся jg бавляют цинк (0,7 г ) . осадок собирают, промывают техничесСмесь нагревают до комнатной темким этиловым спиртом и высушивают пературы и выдерживают при этой темпри 55 С, получают названное соедипературе 3 дня. Затем реакционную нение (304 г) в виде твердого белосмесь декантируют, выливают в воду го вещества, строение которого под- \$ (100 мл) и подкисляют концентриротверждено спектроскопически. ванной хлористоводородной кислотой до рН=1* Водный раствор промывают Способ В (применение гидрата окин-гексаном (50 мл), затем добавляют си калия с последующей обработкой 0,88 н. раствор аммиака, что дает хлористоводородной кислотой). 4-(2-Хлорфенил)-3-этоксикарбонил- 20 осадок. Его собирают и высушивают, затем растворяют в этилацетате. До5-метоксикарбокип-б-метил-2-(2-фт алибавляют малеиновую кислоту (0,34 г ) , мидо-э ток си) метил-1 ,4-дигидропиридин затем простой эфир. После растира(15 г) растворяют в смеси тетрагидния собирают твердое вещество и вырофурана (150 мл) и воды (150 мл), содержащей гидрат окиси калия (3,13г) 2S сушивают, что дает твердое вещество, соответствие которого продукту по После перемешивания при комнатной примеру 1 установлено по данным ЯМР температуре в течение 1,5 ч добавляи инфракрасной спектроскопии. ют 2 я. хлористоводородную кислоту (100 мл) и полученную взвесь кипятят П р и м е р 19. Получение 4-(2с обратным холодильником 2,5 ч. Раст- зо хлорфенил)-2-[2-(N-метиламино)этоксивор экстрагируют дважды"метиленхлориметил") -3-этоксикарбонил-5-метоксидом (2x100 мл), объединенные экстраккарбонил-6-метил-1,4-дигидропиридин ты высушивают сульбатом магния и упамалеата. ривают. Оставшееся масло растворяют в техническом этаноле. Добавляют ма- ,, Смесь 4-[2-хлорЛенил]-2-[2-(КгЯлеиновую кислоту (3,24 г ) , получендиметиламино)этоксиметил^-3-этоксиный осадок собирают, промывают техникарбонші-5-метоксикарбонил-6-метилческим этиловым спиртом и высушивают > 1,4-дигидропиридина (147,6 г) и ", , при 55 С, получают названное в заго2,2,2-трихлорэтилхлорформиатэ(98,7 г) перемешивают в толуоле при кипячении ловке соединение (10,2 г) в виде се- 40 с обратным холодильником 20 ч. Затем рого твердого вещест ва, строение кореакционную смесь охлаждают до комторого подтверждено спектроскопинатной температуры и добавляют Ї н. чески. хлористоводородную кислоту (1147 мл)* П р и м е р 18. Получение 4-(2Смесь экстрагируют дважды простым хлорфенил)-2- [2-(Ы-метиламино)этокси-45 эфиром (2x1147 м л ) , экстракты объедиметил]-3-этоксикарбонил-5-метоксиняют и упаривают, что дает неочищен-1 карбонил~6-метил-1,4-дигидропиридин~ ное масло (201,6 г ) , содержащее соотмалеата. ветствующее производное 2-[2-(ТЗ1 г 2,2,2-трихлорэтокси карбонил-Н-метилСмесь 2-|_2-(К-бензил-К-метилами- 50 амнно)этоксиметила] . но)этоксиметил]-4-[2-хлорфенил]-3Масло (196 г) растворяют в димеэтоксикарбонил-5-метоксикарбонил-6тилсЬормамиде (686 мл) и муравьиной метил-1,4-дигидропиридина (4,8 г) и кислоте (35,5 г ) , и смесь охлаждают 2,2,2-трихлорэтилхлорфомиата (2,7 г) до 5 С. Цинк (50,5 г) добавляют поркипятят в толуоле с обратным холо55 циями в течение 20 мин и перемешивадильником 20 ч. После охлаждения до ют смесь при комнатной температуре комнатной температуры смесь переме90 ч. Реакционную смесь декантируют, шивают с I н. хлористоводородной кисдобавляют к воде (1500 мл), затем лотой (50 мл) и экстрагируют эфиром. 1238730 рН доводят до рН-1 концентрированной соляной кислотой. Водный раствор промываю і н-гексаном (500 мл) и остаюс щуюся водную фазу доводят до рН = =10 0,88 н. раствором аммиака. Полученную смесь декантируют, собирают твердое вещество и высушивают, что дает неочищенный продукт (138 г ) . Это твердое вещество растворяют в го- Ю рячем этилацетате, содержащем малеиновую кисло гу (37,1 г) , и после охлаждения получают соединение (32,3 г) в виде белого твердого вещества. Тождественность этого вещества с продук- 15 том по примеру І 8 установлена по спектроскопическим данным. Аналогично получены следующие соединения: 2-[(2-*эминоэтокси)метил1 ~4- (22о хлорЛенил)-3-этоксикарбонип-5-меток~ сикай бонил-6.-метил-1,4-ди гидропиридин малеат, т.пл, 169 С; 2-[(2~аминоэтокси)метил]-4-(2хлор(Ъенил)-3-этоксикарбонил-5-меток- 25 сикарбонил-б-метшг-1,4-дигидропиридин малеат, т.пл. 169-I70°С; 2-£(2-аминоэтокси)метил*]-4-(2,3дихлорфенил)-3-этоксикарбонил-5-метоксикарбонил-6--метокси-1,4-дигидро- Зо пиридин полуфумарат полумапеат, т.пл, 17 1-ї 73°С; 2-[(2-аминоэтокси)метил]-4-фенил~ З-этоксикарбонил-5-метоксикарбонил6-метил~1>4-дигидропиридин фумарат 35 полугидрат, т.пп. 158-168°С; 2- [(2-аминоэтокси)метип]-4-(2фторфснил)-3-этокснкарбонип-5-метоксикарбонил-6-метил-1,4-дигидропнридин фумарат, т.пл. 152°С, 2-(2-аминопроп-1-оксиметил)-4-(2хлорсЬенил)~3-этоксикарбонил-5-метоксикарбонил-6-метил-1,4-дигидропиридин полуфумарат попугидрат, т.пл,180183°С. Следующие примеры иллюстрируют получение некоторых исходных материало в „ П р и м е р 1. Получение этил-4[2-(^"бензил^-метиламиио этокси]аце- s o тозцетата. 8 комнатной температуре (20°С), причем раствор этил-4-хлорацетоацетата (16,5 г) в сухом ТГФ (100 мл) добавляют по каплям в течение 3,5 ч. Смесь перемешивают всю ночь при комнатной температуре в атмосфере азота, затем охлаждают путем добавления небольшого количества этанола и выливают на лед (100 г) и концентрированную соляную кислоту (30 м л ) , ТГФ удаляют выпариванием, и остаток промывают петролейным эфиром (т.кип,6080 С) для удаления минерального масла. Остаток подщелачивают твердым карбонатом натрия и экстрагируют этилацетатом (200 мл и 100 мл). Объединенные экстракты высушивают карбонатом натрия, фильтруют и упаривают, попучают названное в заголовке соединение в виде масла (30 г),достаточно чистое для дальнейиего применения. Спектр ЯМР в СБСЦ , S1 значения: 7,27 (5Н, S ) ; 4,12 (2Н, q ) ; 4,06 (2Н, S ) ; 3,45-3,70 (6Н, п ) ; 2,61 (2Н, t ) ; 2,25 (ЗН, S ) ; 1,23 (ЗН, t ) . Следующие ацетоацетаты получают подобно указанному выше способу исходя из соответствующего'К-замещеиного 2-аминоэтанопа и этил-4-хлорі ацетата. где 1^= -СН?,РЬ или-СН2СНг0СН3 ЇЇ р и м е р 2. Получение щавелево кислой соли 2- р~(М-бензшг-№-метиламино)этоксиметил[|-4-(2-хлорфенил)З-этоксикарбонил-5-метоксикарбонилб-метил-1,4-дигидропиридина. А. Этил-4-[2-(Н-бенэил-К-метиламино)этокси]ацетоацетат (25 г ) , 2-хлорбензальдегид (И г ) у метил-3аминокротонат (9,1 г) и уксусную кислоту (5 мл) в этаноле (100 мл) смешивают и кипятят с обратным холодильником 3,5 ч. Затем охлажденную реакционную смесь упаривают досуха и остаток распределяют между 2 н, соляной кислотой (200 мл) и метиГидрид натрия (80 %-ный в масле» ленхлоридом (300 мл). Раствор в ме8 г) перемешивает в сухом тетрагидтипенхлориде промывают насыщенным рофуране (ТГФ)(100 мл) в атмосфере 55 раствором карбоната (200 мл), высуазота, затем медленно добавляют 2шивают сульфатом магния, фильтруют (Н-бензил-Н-метиламино)этанол (17 г) и упаривают досуха. Остаток в просТеплую смесь перемешивают 1 ч, затом эфире растирают с избытком щатем оставляют на водяной бане при 1238730 велевой кислоты, растворенной в простом эфире. Полученный осадок перекристаллизовывают из метанола, получают указанное в заголовке соединение (6,5 г) в виде твердого белого вещества» т.пл. 181 С. Найдеио.%: С 59,42; Н 5,85; N 4,39. С2ВН„С1 N2O5C2H?O4 Вычислено,%:с 59,75; Н 5,85; ,N 4,65. Б. Этил-4- [2-(И-бенэил-Н-метиламино)этокси~]ацетоацетат (141 г) и ацетат аммония (37,3 г) в этаноле (280 кп) осторожно нагревают с обратным холодильником 20 мин. Добавляют метил-2-(2-хлорбензилидин)аце~ тоацетат (115 г) и продолжают кипячение с обратным холодильником 4 ч. Охлажденную реакционную смесь упаривают досуха, повторно растворяют в толуоле (200 мл) и экстрагируют 2 н. соляной кислотой (2x150 мл). Масло и водную фазу экстрагируют метиленхлоридом (Д00 мл и 200 мл).Объединенные экстракты промывают избытком насыщенного раствора карбоната натрия и высушивают карбонатом натрия. Метиленхлорид удаляют упариванием и остаток в толуоле совместно с 20% петролейного эфира фильтруют под давлением через колонку с двуокисью кремния ("Мерк", "Киэельгель бОН", 100 г ) , отмывают с адсорбента толуолом в смеси с 20% петролейного эфира (500 мл) и затем толуолом (1 л ) . Объединенные растворы упаривают досуха, получают неочищенное соединение в виде основаниямасло (177 г ) , достаточно чистое по данным тонкослойной хроматографии для применения в последующей стадии гидрирования. Последующие исходные материалы также получают по способу Б, указанному выше, исходя из соответствующих N-замещенных ацетоацетатов и ацетата аммония. П р и м е р 3, Получение этил 4[2-(фталимидо)этокси]ацетоацетата, Гидрид натрия (57 вес.Х-ный в масл е , 66,1 г) перемешивают в сухом т е т 5 рагидрофуране (500 мл) в атмосфере азота при -1О.°С и добавляют N - ( 2 - O K сиэтил] фталамид 150 г . К этой в з в е си добавляют при -10 С раствор этил10 4-хлорацетоацетата (129,3 г ) в сухом тетрагидрофуране в течение 1 ч . З а тем реакционную смесь нагревают до комнатной температуры и перемешивание продолжают 18 ч . Эту смесь выливают t5 в 1 н. соляную кислоту (800 мл) и добавляют этилацетат (750 мл). Водный слой промывают этилацетатом (300 мл) и органические растворы объединяют. После промывания водой (300 мл) этил20 ацетат упаривают, получают указанное в заголовке соединение в виде масла (243 г ) t достаточно чистого для дальнейшего использования. ЯМР-спектр в C D C l ^ , ^ : 7,80 (4H,m); 25 4,15 (2Н, S ) ; 4,10 (2Н, q ) ; 3,92 (2Н, t ) ; 3,78 (2Н, t ) ; 3,49 (2Н, S ) ; 1,22 (ЗН, t ) . П р и м е р 4. А. Получение 4 - ( 2 хлорфенил)-3-этоксикарбоннл-5-меток30 сикарбонил~6-метил-2-(2-фталимидоэтокси)метил-1,4-дигидролиридина, из 2- [(2-аминоэтокси)метил1-4-(2-хлорфенил)-3-этоксикарбонил-5-метоксикарбонил~6-метил-1,4-дигидропиридина 35 2- [ ( 2 - А м и н о э т о к с и ) м е т и л ] - 4 - ( 2 хлорфенил)-3-этоксикарбонил~5-метоксикарбонил-6-метил-1,4-дигидропиридин ( 2 , 0 г ) и фталевый ангидрид ( 0 , 7 3 г ) перемешивают в уксусной к и с 4Q л о т е (20 мл) при кипячении с о б р а т ным холодильником 2 , 5 ч . После о х лаждения нерастворившийся материал собирают и перемешивают 'в метаноле (10 м л ) . Фильтрование д а е т у к а з а н н о е в з а г о л о в к е соединение ( 1 , 0 г ) в в и 45 де б е л о г о т в е р д о г о в е щ е с т в а , т . п л , 146-147°С. 50 н где R 2 -CH 2 Ph или СН2СН 2ОСН СН ОСН 2 2 3 Ї0 55 Найдено»%: С 6 2 , 1 8 ; Н 5 , 0 2 ; N 5,20. C 2 S H 2 7 C I иго7 Вычислено,%: С 6 2 , 3 9 ; Н 5 , 0 3 ; N 5,20. Б. Получение указанного соединения из этил-4-[2-(фталимидо)этокси]~ ацетоацетата. Этил 4-[2-(фталимидо)этокси^|адетоацетат (200 г) растворяют в изопропаноле (100 мл), и к раствору добав \\ 12 1238730 ляют 2-хлорбенэальдегид (88,1 г) и концентрацию ионов кальция. Отмечают метил-3-аминокротонат (72,2 г ) . Смесь изменение напряжения, вызываемое покипятят с обратным холодильником лученным в итоге сокращением ткани. 21 ч, затем метанол упаривают, после Затем содержимое ванны сливают, зачего остается масло, которое раствоменяют ее свежим раствором соли и черяют в уксусной кислоте (J000 м л ) . рез 45 мнн испытание повторяют в приПосле выдержки в течение ночи собисутствии испытуемого соединения. Рерают осадок, промывают уксусной кисгистрируют концентрацию соединения, лотой, затем суспендируют в метаноле 10 требуемую для снижения ответной реак(300 мл), Фильтрование дает указанции на 50%. • ное в заголовке соединение, ЯКР и Приведены молярные концентрации инфракрасные спектры которого иденсоединений, требуемые для снижения тичны продукту, полученному по споответной реакции на 50% (tG^,- знасобу (А) . 15 чения) (1М - 1 г моль/л). Чем меньше концентрация соединения, тем более Ингибирование переноса кальция. активным оно является, т . е . наиболее Способность соединений, получаеактивными соединениями служат промых по предлагаемому способу, ингидукты по примерам 1, 9, 17, 18 и 19. бировать перенос кальция in vitro определялась по торможению ответной 20 Соединение 1G W a 5 реакции на сокращение изолированной 3,2 х 10 Продукт примера I ткани сердечной мышцы при введении 2 3.2 х 1о М ионов кальция. 2-х 10~* 3 Испытание проводят со спиральными 4 6.3 х и м полосками, вырезанными из аорты кры- 25 4 х Ю'Г 5 сы, посредством закрепления одного 2.x 10 М 6 конца полоски наглухо, а другого кон1,3 х 10*вМ 7 ца полоски - на передатчике силового 5 х ИГ* М 8 воздействия. Ткань погружают в ван3,2 х 10** М 9 ну с физиологическим солевым раство- 30 2,5 х 10 М 10 ром, содержавшим ионы калия при кон4.x КГ'н 14 центрации 0,0045 Н при отсутствии 2,2 х 1 0 , М Ї5 кальция. Хлорид кальция добавляют в 3,2 х 10' М 17 ванну пипеткой с таким расчетом, что3,2 х Ю" М 16 бы получить 0,002 И окончательную 3,2 х 10 М 19 35 Т а б л и ц а Пример, 2 Основание или соль -Ph -сн, Основание Т.пл., 6 Анализ, % Т С 79-80 • -СНа Оксалат 103-5 204-5 7,26. 7,21) 55,35 5,84 5,60 5,84 5,64) 63,87 7,60 6,56 (63,14 Основание 205-7 7,09 (55,64 Оксалат 7,33 (64,93 -СН9 65,14 7,23 54,14 5,71 5,57 (53,85 5,70 5,46) * 6,70) 1 ІЗ 1238730 Продолжение табл.1 Пример, if 6 Основание или соль Оксапат ОН Т.пп, "С 203-4 Анализ ,' 52,14 52,03 d -СНгСНгОСН3 Оксалат 10 105-7 5,75 4,86 5,65 4.76) 5,55 5,34 5,57 5,34) 53,57 169 5,30) 6,10 4.91 (53,91 Малеат 5.30 54,83 СІ 5,06 59,18 185 5,41 (54,91 Оксалат 197-9 5,30) (59,13 -CH 2 Ph Оксалат 5,49 (52,03 -СН« 5,29 (52,22 Cli 5,68 5,97 5,03) Т а б л и ц а Анализ,%, или данные ядерного резонанса (ЯМР)* магнитного N 12 -СН2С02СН2СН5 78-80 ,СН Масло 58.26 6.30 5 ,65 (58,24 ' ІЗ 6,31 5 ,66) ПНР (CDC1-) 7,72 2 (1Н, значения, широкий); 16 238730 15 -Продолжение табл.2 Т.пл. , °С Пример, Анализ,%, или данные1 ядерного магнитного резонанса ЯМР 6,96-7,51 (4Н, ха); 5,43 (1Н, S ) ; 4,78 (2Н, S); 4,Ю (2Н, q ) ; 3,78 (ЗН, S ) ; 3,63 (ЗН, S ) ; 3,3-3,7 (6Н, го); 2,38 (ЗН, S); 1,20 (ЗН, t); Теоретические значення в скобках. Т а б л и ц а З Н 3 С00С Анализ, %, (теоретические значения в скобках) С 15 | Н і N Редактор А.Долинич 123-124 57, 80 6. 55 8, 73 (57, 56) •СН2СО NHCHj (6, 30) ( 8 . 76) Составитель А.Орлов Техред И.Верес Корректор А. Зимокосов Заказ 3311/61 • Тираж 379 Подписное В И П Государственного комитета СССР НИИ по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5 Производственно-полиграфическое предприятие, г.Ужгород, ул.Проектная, 4
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for synthesizing derivatives of 1,4-dihydropyridine or its acid additive salts
Автори англійськоюPeter Edward Cross
Назва патенту російськоюСпособ получения производных 1,4-дигидропиридина или их кислотно-аддитивных солей
Автори російськоюПитер Едвард Кросс
МПК / Мітки
МПК: C07D 211/90, A61P 9/12, C07D 401/04, C07C 247/00, C07D 209/48, A61K 31/4427, A61P 9/06, A61K 31/455, C07C 213/00, C07D 401/12, C07C 241/00, C07C 67/00
Мітки: похідних, одержання, 1,4-дігідропірідіна, солей, кислотно-адітивних, спосіб
Код посилання
<a href="https://ua.patents.su/10-7083-sposib-oderzhannya-pokhidnikh-14-digidropiridina-abo-kh-kislotno-aditivnikh-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних 1,4-дігідропірідіна або їх кислотно-адітивних солей</a>
Попередній патент: Гнучкий контейнер для збереження та транспортування сипучого матеріалу
Наступний патент: Гнучкий контейнер для сипучих матеріалів
Випадковий патент: Встановлений на автомобілі пластиковий барабан для змішування бетону