Похідні піридинзаміщених піразолопіридинів
Номер патенту: 74404
Опубліковано: 15.12.2005
Автори: Вайганд Штефан, Шталь Ельке, Вундер Франк, Алонсо-Алія Крістіна, Перзборн Елізабет, Флубахер Дітмар, Ланг Дітер, Штрауб Александер, Дембовскі Клаус, Шташ Йоханнес-Петер, Фойрер Ахім
Формула / Реферат
1. Похідні піразолопіридину загальної формули (І)
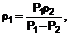 , (І)
, (І)
в якій
R1 означає 4-піридиніл або 3-піридиніл,
R2 означає водень, NH2 або галоген,
а також їх солі, ізомери і гідрати.
2. Похідні піразолопіридину за п. 1, у яких
R1 означає 4-піридиніл або 3-піридиніл,
R2 означає водень, NH2 або хлор,
а також їх солі, ізомери і гідрати.
3. Похідні піразолопіридину за п. 1, у яких
R1 означає 4-піридиніл або 3-піридиніл,
R2 означає водень,
а також їх солі, ізомери і гідрати.
4. Лікарський засіб, який містить щонайменше одну сполуку формули (І) за п. 1.
5. Лікарський засіб за п. 4, який відрізняється тим, що він додатково містить органічні нітрати або донори монооксиду азоту.
6. Лікарський засіб за п. 4, який відрізняється тим, що він додатково містить сполуки, що інгібують деструкцію циклічного монофосфату гуанозину.
Текст
Даний винахід стосується нових хімічних сполук, що стимулюють розчинну гуанілатциклазу, їх одержання і застосування як лікарських засобів, призначених, зокрема, для лікування захворювань кровообігу серця. Однією з найважливіших клітинних систем передачі сигналів у ссавців є циклічний монофосфат гуанозину (cGMP). У сполученні з монооксидом азоту (NO), що вивільняється з ендотелію і передає гормональні і механічні сигнали, циклічний монофосфат гуанозину утворює систему NO/cGMP. Біосинтез циклічного монофосфату гуанозину з трифосфату гуанозину (GTP) каталізують гуанілатциклази. У залежності від особливостей структури і типу лігандів відомі дотепер представники цього сімейства ферментів можуть бути підрозділені на дві групи: відособлені гуанілатциклази, що стимулюються натрійуретичними пептидами, і розчинні гуанілатциклази, що стимулюються NO. Розчинні гуанілатциклази складаються з двох субодиниць і з високою імовірністю містять один гем на гетеродимер, що є частиною центра регуляції. Цей гем має докорінне значення для механізму активування гуанілатциклази. NO здатний приєднуватися до атому заліза гема і, таким чином, істотно підвищувати активність ферменту, однак він не може стимулювати препарати, що не містять гем. Здатність захоплювати центральний атом заліза гема має і монооксид вуглецю (3), хоча в порівнянні з NO він є значно менш ефективним стимулятором. Завдяки утворенню циклічного монофосфату гуанозина, що забезпечує регуляцію фосфодіестераз, іонних каналів і протеїнкіназ, гуанілатциклаза відіграє вирішальну роль у протіканні різних фізіологічних процесів, зокрема, релаксації і проліферації гладких м'язових клітин, агрегуванні та зчепленні тромбоцитів, нейрональній передачі сигналів, а також при захворюваннях, зумовлених порушенням цих процесів. У патофізіологічних умовах система NO/cGMP може бути пригнічена, що може супроводжуватися такими захворюваннями, як, наприклад, підвищений кров'яний тиск, активування тромбоцитів, посилена проліферація клітин, ендотеліарна дисфункція, атеросклероз, стенокардія, серцева недостатність, тромбози, інсульт і інфаркт міокарда. Не залежна від NO можливість лікування подібних захворювань, спрямована на вплив на опосередковуваний циклічним монофосфатом гуанозину шлях передачі сигналів в організмах, у зв'язку з очікуваною високою ефективністю і незначними побічними впливами являє собою багатообіцяючий підхід. Для терапевтичної стимуляції розчинної гуанілатциклази до останнього часу використовувалися виключно сполуки типу органічних нітратів, ефективність яких заснована на утворенні NO. Останній виникає в результаті біоперетворення й активує розчинну гуанілатциклазу, захоплюючи центральний атом заліза гема. Поряд з побічними впливами істотним недоліком даного способу лікування є розвиток толерантності. Недавно були описані деякі речовини, що стимулюють розчинну гуанілатциклазу безпосередньо, тобто без попереднього виділення NO у вільному виді. Мова, зокрема, йде про 3-(5'-гідроксиметил-2'-фурил)-1бензиліндазол (сполука YC-1) [Wu та ін., Blood (Кров), 84 (1994), 4226; Mulsch та ін., Br.J.Pharmacol. (Британ. Фармаколог. Журнал), 120 (1997), 681], кислоти жирного ряду [Goldberg та ін, J. Biol. Chem. (Журнал Біолог. Хімії), 252 (1977), 1279], гексафторфосфат дифенілйодонію [Pettibone та ін., Eur. J.Pharmacol. (Європ. Фармаколог. Журнал), 116 (1985), 307], ізоліквіритигенин [Yu та ін., Brit. J. Pharmacol. (Британ. Фармаколог. Журнал), 114 (1995), 1587], а також різни заміщені похідні пиразолу [міжнародна заявка WO 98/16223]. Крім того, [у міжнародних заявках WO 98/16507, WO 98/23619, WO 00/06567, WO 00/06568, WO 00/06569 і WO 00/21954] описані похідні піразолопіридину, що використовуються як стимулятори розчинної гуанілатциклази. У зазначених заявках описані також піразолопіридини з піримідиновим залишком, приєднаним у положенні 3. Подібні сполуки з надзвичайно високою активністю стимулюють розчинну гуанілатциклазу in vitro. Разом з тим, з'ясувалося, що ці сполуки мають певні недоліки при їх використанні in vivo, наприклад, з точки зору впливу на печінку, рівня фармакологічних властивостей, співвідношення між дозою і її впливом, а також шляхів метаболізму. У зв'язку з вищевикладеним задача даного винаходу полягала у створенні нових похідних піразолопіридину, які є стимуляторами розчинної гуанілатциклази і не мають зазначених вище недоліків, властивих сполукам у відповідності з рівнем техніки. Відповідно до даного винаходу зазначена задача вирішується завдяки сполуким згідно п.1 формули винаходу. Ці нові похідні піразолопіридину заміщені в положенні 3 піримідиновим залишком, який, у свою чергу, містить певні замісники, а саме, піридиніл у положенні 5 і аміногрупу в положенні 4 піримідинового циклу. Даний винахід, зокрема, стосується сполук формули (І) (I) у якій R1 означає 4-піридиніл або 3-піридиніл, R2 означає водень, NH2 або галоген, а також солей, ізомерів і гідратів цих сполук. Відповідно до альтернативного варіанту здійснення даний винахід стосується сполук формули (І), у якій R1·означає 4-піридиніл або 3-піридиніл, R2 означає водень, NH2 або хлор, а також солей, ізомерів і гідратів цих сполук. Відповідно до іншого альтернативного варіанту здійснення даний винахід стосується сполук формули (І), у якій R1 означає 4-піридиніл або 3-піридиніл, R2 означає водень, а також солей, ізомерів і гідратів цих сполук. Сполуки формули (І) відповідно до винаходу можуть існувати також у вигляді відповідних солей. У загальному випадку мова йде про солі, утворені з органічними або неорганічними основами або кислотами. Відповідно до даного винаходу перевага надається солям, які не викликають побоювань з точки зору фізіологічного впливу. Солями сполук відповідно до винаходу, що не викликають побоювань з фізіологічної точки зору, можуть бути солі сполук, які, відповідно до винаходу, утворені з мінеральними, карбоновими або сульфокислотами. Особлива перевага надається, зокрема, солям, утвореним з хлороводневою, бромоводневою, сірчаною і фосфорною кислотами, метансульфокислотою, етансульфокислотою, птолуолсульфокислотою, бензолсульфокислотою, нафталіндисульфокислотою, оцтовою, пропіоновою, молочною, винною, лимонною, фумаровою, малеїновою або бензойною кислотами. Солями, що не викликають побоювань з точки зору фізіологічного впливу, можуть бути також солі металів або солі амонію, утворені сполукою відповідно до винаходу, які містять вільні карбоксильні групи. Особливо переважними є, наприклад, натрієві, калієві, магнієві або кальцієві солі, а також утворені з аміаком солі амонію, або органічні аміни, зокрема, етиламін, диетиламін, триетиламін, диетаноламін, триетаноламін, дициклогексиламін, диметиламіноетанол, аргінін, лізин або етилендіамін. Сполуки відповідно до винаходу можуть існувати у відомих фахівцям таутомерних формах, які також є об'єктом даного винаходу. Крім того, сполуки відповідно до винаходу можуть існувати у вигляді відповідних гідратів. Галогеном відповідно до винаходу є фтор, хлор, бром і йод. Сполуки формули (І) відповідно до винаходу можуть бути отримані шляхом взаємодії сполуки формули (II) (II) А) зі сполукою формули (III) (III) у якій R1 є таким, як зазначено вище, при необхідності, в органічному розчиннику при нагріванні з утворенням сполуки - формули (І), або В) зі сполукою формули (IV) (IV) у якій R1 є таким, як зазначено вище, в органічному розчиннику при нагріванні з утворенням сполуки формули (V) (V) (VI) у якій R1 є таким, як зазначено вище, з наступною взаємодією сполуки формули (V) з галогенувальним агентом з утворенням сполуки формули (VI) у якій R1 є таким, як зазначено вище, R2 означає галоген, і подальшою взаємодією сполуки формули (VI) з водним розчином аміаку при нагріванні і підвищеному тиску. Сполука формули (II) може бути синтезована у відповідності з наступною реакційною схемою: Сполука формули (І) може бути отримана шляхом багатоетапного синтезу, виходячи з відомої з літературних джерел натрієвої солі етилового естеру ціанопіровиноградної кислоти [Borsche und Manteuffel, Liebigs. Ann. Chem. 1934, 512, 97]. Шляхом взаємодії цієї солі з 2-фторбензилгідразином, здійснюваної при нагріванні зазначених реагентів в атмосфері захисного газу в середовищі інертного розчинника, зокрема, у середовищі діоксану, одержують етиловий естер 5-аміно-1-(2-фторбензил)-1-піразол-3-карбонової кислоти, який циклізують шляхом здійснюваної в кислому середовищі в атмосфері інертного газу при нагріванні взаємодії з диметиламіноакролеїном, одержуючи як відповідну піридинову похідну етиловий естер 1-(2фторбензол)-1Н-піразоло[3,4-b]піридин-3-карбонову кислоту. Отриману піридинову похідну шляхом багатоетапного синтезу, який полягає у взаємодії ефіру з аміаком, дегідратуванні за допомогою зневоднювального засобу, зокрема, трифтороцтового ангідриду, для одержання відповідної нитрильної похідної, взаємодії цієї похідної з метилатом натрію і заключної реакції з хлоридом амонію, перетворюють у сполуку формули (II). Сполуки формули (III) можуть бути синтезовані з наявних у продажі (наприклад, у фірми «Aldrich») третбутокси-біс-(диметиламіно)метану і 4-піридилацетонітрилу або 3-піридилацетонітрилу шляхом взаємодії переважно еквімолярних кількостей цих сполук, здійснюваної при нормальному тиску і перемішуванні реакційного розчину протягом декількох, наприклад, двох годин, при підвищеній температурі, наприклад, що в інтервалі від 60 до 130°С, переважно від 80 до 120°С, зокрема, при температурі 100°С. Взаємодія сполук формул (II) і (III) з метою одержання сполук формули (І) може бути здійснене при використанні еквімолярних кількостей вихідних реагентів або при невеликому надлишку сполуки формули (III). Реакцію проводять у середовищі органічного розчинника, наприклад, вуглеводню, переважно, ароматичного вуглеводню, зокрема, ксилолу, переважно, у присутності від 0,1 до 1 еквівалента, переважно, 0,3 еквівалента кислоти Льюїса, зокрема, BF3 Et2O або триметилсилілтрифторсульфонату (TMSOTf), переважно при нормальному тиску і перемішуванні реакційного розчину протягом декількох, наприклад, 12 годин, при підвищеній температурі, наприклад, що в інтервалі від 80 до 160°С, переважно від 100 до 150°С, зокрема, при температурі 140°С. Сполуки формули (IV) є наявними у продажу (наприклад, у фірми «Mercachem»), або синтезовані відомим фахівцям способом. Взаємодія сполук формул (II) і (IV) з метою одержання сполук формули (V) може бути здійснена при використанні еквімолярних кількостей вихідних реагентів або при невеликому надлишку сполуки формули (IV). Реакцію проводять у середовищі органічного розчинника, наприклад, вуглеводню, переважно ароматичного вуглеводню, зокрема, толуолу, переважно при нормальному тиску і перемішуванні реакційного розчину протягом декількох, наприклад, 12 годин, при підвищеній температурі, наприклад, що в інтервалі від 80 до 160°С, переважно, від 100 до 150°С, зокрема, при температурі 140°С. Перетворення сполук формули (V) у сполуки формули (VI) здійснюють шляхом взаємодії сполук формули (V) з галогенувальним агентом, при необхідності, здійснюваної в середовищі органічного розчинника, зазвичай використовуваного для проведення подібних реакцій, наприклад, у середовищі диметилформаміду, переважно при нормальному тиску і перемішуванні реакційного розчину протягом декількох, наприклад, трьох годин, при підвищеній температурі, наприклад, що в інтервалі від 80 до 160°С, переважно від 100 до 120°С. Відповідно до винаходу як галогенувальний агент переважно використовують РОСІ 3. Перетворення сполук формули (VI) у сполуки формули (І) відповідно до винаходу може бути реалізоване шляхом взаємодії сполук формули (VI) з водним аміачним розчином, переважно здійснюваної при підвищеному тиску, наприклад, шляхом взаємодії реагентів в автоклаві під власним тиском реакційної суміші, при її перемішуванні протягом декількох, наприклад, 12 годин, при підвищеній температурі, наприклад, що знаходиться в інтервалі від 80 до 160°С, переважно від 100 до 150°С, зокрема, при температурі 140°С. Сполуки формули (І) відповідно до винаходу мають непередбачений, корисний спектр фармакологічної дії. Сполуки формули (І) відповідно до винаходу викликають релаксацію судин, уповільнення агрегування тромбоцитів таі зниження кров'яного тиску, а також посилення коронарного кровотоку. Ці ефекти забезпечуються завдяки безпосередній стимуляції розчинної гуанілатциклази і збільшенню внутрішньоклітинного вмісту циклічного монофосфату гуанізина (cGMP). Поряд з цим сполуки формули (І) згідно з винаходом підсилюють ефективність дії речовин, що підвищують вміст cGMP, зокрема, EDRF (фактора релаксації, що продукується ендотелієм), NO-донорів, протопорфірину IX, арахідонової кислоти або похідних фенілгідразину. У зв'язку з цим сполуки згідно з винаходом можуть використовуватися як лікарські засоби, що призначені для лікування серцево-судинних захворювань, зокрема, підвищеного кров'яного тиску, серцевої недостатності, постійної і непостійної стенокардії, захворювань периферичних і серцевих судин, аритмії, для лікування тромбоемболічних і ішемічних захворювань, зокрема, інфаркту міокарда, крововиливу в мозок, транзиторних і ішемічних нападів, порушень периферичного кровообігу, для усунення залишкових явищ, що супроводжують лікування тромболізу, черезшкірну транслюмінальну ангіопластику (РОТА), черезшкірну транслюмінальну коронарну ангіопластику (РТСА), операцію шунтування, а також для лікування артеріосклерозу, астматичних захворювань і хвороб сечостатевої системи, зокрема, гіпертрофії передміхурової залози, порушення ерекції, жіночої сексуальної дисфункції, остеопорозу, гастропарезу і нетримання сечі. Крім того, описані в даному винаході сполуки формули (І) є активними речовинами, придатними для боротьби з хворобами центральної нервової системи, обумовленими порушеннями в системі NO/cGMP. Вони придатні, зокрема, для покращення сприйняття, здатності зосередитися, здатності до навчання, розвитку пам'яті після когнітивних порушень, що проявляються, зокрема, у вигляді ситуаційно-хворобливої сукупності симптомів типу «Помірні когнітивні порушення», для лікування старечих порушень здатності до навчання і старечих порушень пам'яті, старечої втрати пам'яті, судинного слабоумства, черепно-мозкових травм, крововиливів у мозок, слабоумства, що виникає внаслідок інсульту («post stroke dementia»), наслідків черепномозкових травм, загального порушення здатності зосередитися, порушення здатності до концентрування уваги в дітей, які мають проблеми у навчанні та запам'ятовуванні, для лікування хвороби Альцгеймера, судинного слабоумства, слабоумства з утворенням тілець Леві, слабоумства з дегенерацією фронтальної частки мозку, включаючи синдром Піка, для лікування хвороби Паркінсона, прогресивного ядерного паралічу, слабоумства з кортикобазальной дегенерацією, аміолатерального склерозу (ALS), хвороби Гунтингтона, розсіяного склерозу, дегенерації Талама, слабоумства Крейцфельда-Джакоба, ВІЛ-слабоумства, шизофренії в сполученні зі слабоумством або психозом Корсакова. Сполуки формули (І) придатні також для лікування захворювань центральної нервової системи, зокрема, стану страху, напруги і депресії, сексуальної дисфункції і розладів сну, обумовлених порушенням центральної нервової системи, а також для регулювання патологічних порушень прийому їжі, збуджувальних засобів і наркотиків. Крім того, активні речовини відповідно до винаходу придатні для регуляції мозкового кровообігу і, отже, є ефективними засобами боротьби з мігренню. Вони придатні також для профілактики і боротьби з наслідками церебрального інфаркту (Apoplexia cerebri), церебральних ішемій і черепно-мозкових травм. Сполуки формули (І) відповідно до винаходу можуть застосовуватися також як болезаспокійливі засоби. Поряд з цим сполуки відповідно до винаходу мають протизапальну дію, у зв'язку з чим їх можна використовувати як засоби, що перешкоджають розвиткові запальних процесів. Крім того, винахід стосується комбінації сполук формули (І) відповідно до винаходу з органічними нітратами і донорами NO. Згідно з даним винаходом органічними нітратами і донорами NO у загальному випадку є речовини, що виявляють свою терапевтичну дію в результаті вивільнення NO або продукту, здатного виділяти NO. Переважними донорами NO є нітропрусид натрію, нітрогліцерин, динітрат ізосорбіду, мононітрат ізосорбіду, молсидонім і продукт SIN-1. Крім того, винахід стосується комбінації сполук, що інгібують деструкцію циклічного монофосфата гуанозину (cGMP), якими є, зокрема, інгібітори фосфодіестераз 1, 2 і 5 [номенклатура по Beavo та Reifsnyder (1990) TiPS 11, S.150-155]. Завдяки таким інгібіторам підсилюється дія сполук відповідно до винаходу і бажаний фармакологічний ефект. Біологічні дослідження Ефект релаксації судин in vitro Кроликів забивають ударом у потилицю, знекровлюють, витягають аорту, звільняють її від приєднаної до неї тканини і розрізають на кільця шириною 1,5мм. Кільця піддають попередній напрузі і переносять у відповідні ванночки об'ємом 5мл, що містять нагрітий до 37°С, насичений карбогеном розчин КребсаГензеляйта наступного складу (ммоль): NaCI: 119, KСІ: 4,8; СаСІ 2´2Н2О: 1, MgSO4´7Н2О: 1,4, KН2РО4: 1,2, NaHCO3: 25, глюкоза: 10. Силу скорочення кілець реєструють за допомогою комірки Statham UC2, підсилюють і перетворюють у цифрову інформацію, використовуючи аналого-цифровий перетворювач (DAS-1802 НС, Keithley Instruments, Мюнхен), одночасно здійснюючи її реєстрацію самописом з безперервним записом. Для скорочення кілець у відповідну ванночку кумулятивно в зростаючій концентрації додають фенілефрин. Після декількох контрольних циклів додають випробувану речовину, щораз використовуючи усе більш високе дозування і порівнюючи ступінь скорочення, що досягається, зі ступенем скорочення при введенні попередньої дози. На основі отриманих даних розраховують концентрацію досліджуваної речовини, яка необхідна для зменшення скорочення до 50% від рівня, досягнутого в контрольних вимірах (ІС50). Стандартно використовуваний об'єм досліджуваної речовини складає 5мкл, вміст диметилсульфоксиду (ДМСО) у розчині, що знаходиться у ванночці, складає 0,1%. Результати досліджень наведені в таблиці 1. Таблиця 1 Ефект релаксації судин in vitro Приклад 1 4 ІС50 (мкмоль) 0,66 1,21 Визначення очищення печінки in vitro Пацюків анестезують, гепаринізують і перфундують через воротну вену in situ. Далі з печінки за допомогою розчину колагенази ex vivo вилучають первинні гепатоцити. При температурі 37°С і підтримці постійної концентрації досліджуваної сполуки інкубують 2×106 гепатоцитів у 1мл. Після закінчення кожного з п'яти проміжків часу від початку інкубації, що знаходяться в інтервалі від 0 до 15 хвилин, методом біологічного аналізу визначають зменшення досліджуваного субстрату в часі (високоефективна рідинна хроматографія/ультрафіолет або рідинна хроматографія/мас-спектрометрія). На основі отриманих даних за числом клітин і масою печінки розраховують ступінь її очищення. Визначення очищення плазми in vitro У хвостову вену пацюка роблять внутрішньовенну ін'єкцію розчину досліджуваної речовини. У задані моменти часу відбирають проби крові, які гепаринізують, загальноприйнятим способом вилучають з них плазму і методом біологічного аналізу визначають кількість досліджуваної речовини в складі плазми. На основі отриманої зазначеним чином залежності концентрації плазми від часу розраховують фармакологічні параметри, використовуючи для цього звичайні нерозділені методи. Даний винахід стосується як фармацевтичних композицій, що містять поряд з нетоксичними, інертними, придатними з фармацевтичної точки зору речовинами-носіями сполуки формули (І) відповідно до винаходу, так і способів одержання цих композицій. При необхідності, активна речовина в сполученні з одним або декількома, зазначеними вище речовинаминосіями може знаходитися в складі фармацевтичних композицій і в мікрокапсульованому стані. Вміст терапевтично активної сполуки формули (І) у зазначених фармацевтичних композиціях повинен складати від 0,1 до 99,5%мас, переважно від 0,5 до 95%мас. у розрахунку на загальну масу суміші. Поряд із сполуками формули (І) відповідно до винаходу зазначені фармацевтичні композиції можуть містити й інші фармацевтично активні речовини. Медична і ветеринарна практика показують, що для досягнення бажаного ефекту переважне сумарне дозування активної речовини згідно з винаходом протягом 24 годин у загальному випадку складає приблизно від 0,01 до 700мг/кг, переважно від 0,01 до 100мг/кг маси тіла, і, при необхідності, його дають у вигляді декількох разових доз. Разова доза переважно містить активну речовину відповідно до винаходу в кількості приблизно від 0,1 до 80, переважно, від 0,1 до 30мг/кг маси тіла. Нижче даний винахід більш докладно пояснюється на переважних прикладах, що не обмежують об'єм винаходу. Якщо не вказано інакше, всі кількісні дані наводяться в масових відсотках. Приклади Скорочення: RT: кімнатна температура, ЕЕ: етиловий естер оцтової кислоти, МСРВА: м-хлорпероксибензойна кислота, ВАВА: н-бутилацетат/н-бутанол/оцтова кислота/фосфатний буфер з рН=6 (співвідношення компонентів органічної фази 50:9:25.15), DMF: Ν,Ν-диметилформамід. Розчинники для тонкошарової хроматографії: толуол - етиловий естер оцтової Т1 Е1: кислоти (1:1), Т1 ЕtOН1: толуол - метанол (1:1), циклогексан - етиловий естер 31 Е1: оцтової кислоти (1:1), циклогексан - етиловий естер 31 Е2: оцтової кислоти (1:2). Методи визначення часу утримання при використанні високоефективної рідинної хроматографії або препаративних способів розділення Метод А (сполучення рідинної хроматографії і мас-спектрометри =LC+MS): А=ацетонітрил+0,1% елюент: мурашиної кислоти, витрата елюенту: 25мл/хв., температура елюювання: 40°С, заповнення Symmetry, С 18, 50´2,1мм, колонки: 3,5мкм. Час (хв.) А В 0 10 90 4,0 90 10 6,0 90 10 6,1 10 90 7,5 10 90 Метод В (препаративна високоефективна рідинна хроматография): А=деіонізована вода+0,6г елюент: концентрованої соляної кислоти в 1л води, В=ацетонітрил, витрата елюенту: 50мл/хв., температура елюювання: кімнатна, заповнення колонки: YMC-гель, ODS-AQS, 11мкм, 250´30мм. Час (хв.) 0 3 27 34 34,01 38 А 90 90 2 2 90 90 В 10 10 98 98 10 10 Вихідні сполуки І. Синтез 4-[(диметиламіно)метилен]піридинацетонітрилу (суміш E/Z) 7,52г (63,7ммоль) 4-Піридилацетонітрилу і 11,09г (63,7ммоль) трет-бутокси-біс-(диметиламіно)метану перемішували протягом двох годин при температурі 100°С. При цьому диметиламін і трет-бутанол, що виділялись, відводили в атмосферу, використовуючи вакуумний насос, який створює незначне розрідження. Отриману сполуку виділяли методом тонкошарової хроматографії (елюювання сумішшю СН2СІ 2/етилацетат із співвідношенням 50:1-20:1). Вихід: 10,2г (93%). Коефіцієнт Rf 0,29 (СН2СІ 2/ЕЕ=20/1). 1 Н-ЯМР: (300 Мгц, D6-ДMCO), δ=3,25 (с, 6Н, 2´СН3), 7,25 (д, 2Н, Аr-Н), 7,80 (с, 1Н, Аr-Н), 8,33(1, 2Н, Аr-Н). II. Синтез 3-[(диметиламіно)метилен]піридинацетонітрилу (суміш Ε/Ζ) 3,00г (25,4ммоль) 3-Піридилацетонітрилу і 4,23г (25,4ммоль) трет-бутокси-біс-(диметиламіно)метану перемішували протягом двох годин при температурі 100°С. При цьому диметиламін і трет-бутанол, що виділялись, відводили в атмосферу, використовуючи вакуумний насос, що створює незначне розрідження. Після охолодження реакційної суміші відфільтровували продукт, що випав в осад, і промивали його невеликою кількістю води, одержуючи задану сполуку. Вихід: 4,23г (96%). Коефіцієнт Rf: 0,27 (СН2СІ 2/метанол =40/1). 1 Н-ЯМР: (300 MHz, D6-ДMCO), δ=3,08 (с, 3Н, СН3), 3,25 (с, 3Н, СН3), 7,29 (дд, 1Н, Аr-Н), 7,57 (с, 1Н, =С-Н), 7,66 (дт, 1Н, Аr-Н), 8,26 (д, 1Н, Аr-Н), 8.54 (д, 1Н, Аr-Н). LC+MS: час утримання 0,33хв. (колонка Symmetry, С-18, 3,5мкм, 50´2,1мм, витрата елюенту 0,5мл/хв., 40°С, градієнт елюювання: вода (+0,1% мурашиної кислоти) : ацетонітрил (+0,1% мурашиної кислоти) для 0хв.=90:10, для 7,5хв. 10:90). Mac-спектрометрія: (ESI позитиви.), m/z=174 ([М+Н]+). III. Синтез 1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-карбоксамідину ІІІA) Етиловий естер 5-аміно-1-(2-фторбензил)піразол-3-карбонової кислоти 100г (0,613моль) Натрієвої солі етилового естеру ціанопіровиноградної кислоти, синтезованої згідно з Borsche та Manteuffel, Liebigs Ann. 1934, 512, 97, у 2,5л діоксану при інтенсивному перемішуванні, в атмосфері аргону, при кімнатній температурі перемішують з 111,75г (75мл, 0,98моль) трифтороцтової кислоти і продовжують перемішування протягом 10 хвилин, при цьому більша частина речовини, що утворюється, переходить у розчин. У реакційну суміш додають 85,93г (0,613моль) 2-фторбензилгідразину і кип'ятять її протягом ночі. Після охолодження суміші кристали трифторацетата натрію, що випали в осад, фільтрують на водоструминному насосі, промивають діоксаном і неочищений розчин піддають подальшому перетворенню. ІІІВ) Етиловий естер 1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-карбонової кислоти Розчин, отриманий відповідно до приклада ІІІА), змішують з 61,25мл (60,77г, 0,613моль) диметиламіноакролеїна і 56,28мл (83,88г, 0,736моль) трифтороцтової кислоти, і реакційну суміш протягом трьох діб кип'ятять у атмосфері аргону. Розчинник видаляють випарюванням у вакуумі, залишок розчиняють у 2л води і тричі екстрагують етиловим естером оцтової кислоти, використовуючи порції об'ємом 1 л. Об'єднані органічні фази сушать над сульфатом магнію, і видаляють розчинник на роторному випарнику. На закінчення здійснюють хроматографію, використовуючи 2,5кг силікагелю і градієнтне елюювання сумішшю толуол/толуол - етиловий естер оцтової кислоти (4:1). Вихід: 91,6г (49,9% від теоретичного для двох стадій синтезу). Температура плавлення: 85°С. Коефіцієнт Rf (SiO2, T1E1) 0,83. llІС) 1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-карбоксамід 10,18г (34ммоль) Ефіру, отриманого відповідно до прикладу ІІІВ), завантажують у 150мл метанолу, насиченого аміаком, при температурі 0-10°С. Реакційний розчин протягом двох діб перемішують при кімнатній температурі, а потім концентрують випарюванням у вакуумі. Коефіцієнт Rf (SiO2, T1E1): 0,33. llID) 3-ціано-1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин 36,1г (133ммоль) 1-(2-Фторбензил)-1Н-піразоло[3,4-b]піридин-3-карбоксаміду, отриманого відповідно до прикладу НІС), розчиняють у 330мл тетрагідрофурану і додають 27г (341ммоль) піридину, після чого протягом 10 хвилин додають 47,76мл (71,66г, 341ммоль) трифтороцтового ангідриду, при цьому температура підвищується до 40°С. Реакційний розчин перемішують при кімнатній температурі протягом ночі, вливають у 1л води і піддають триразовій екстракції етиловим естером оцтової кислоти, використовуючи порції об'ємом 0,5л. Органічну фазу промивають насиченим розчином гідрокарбонату натрію і 1N розчином соляної кислоти, сушать над сульфатом магнію й упарюють на ротаційному випарнику. Вихід: 33,7г (100% від теоретичного). Температура плавлення: 81°С. Коефіцієнт Rf (SiO2, T1E1): 0,74. llIE) Метиловий естер (2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-карбоксіміду 30,37г (562ммоль) Метилату натрію розчиняють у 1,5л метанолу і додають 36,45г (144,5ммоль) 3-ціано-1(2-фторбензил)-1Н-піразоло[3,4-b]піридину, синтезованого відповідно до прикладу IIID). Реакційну суміш перемішують при кімнатній температурі протягом двох годин, і отриманий розчин використовують для безпосереднього здійснення наступної стадії синтезу. IIIF) 1-(2-Фторбензил)-1Н-піразоло[3,4-b]піридин-3-карбоксамідин До розчину метилового естеру (2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-карбоксіміду в метанолі, отриманого відповідно до прикладу ІІІЕ), додають 33,76г (32,19мл, 562ммоль) крижаної оцтової кислоти і 9,28г (173ммоль) хлориду амонію, і перемішують реакційну суміш протягом ночі зі зворотним холодильником. Розчинник видаляють випарюванням у вакуумі, залишок ретельно розтирають з ацетоном і осад фільтрують на водоструминному насосі. 1 Н-ЯМР: (D6-ДМСО, 200МГц), δ=5,93 (с, 2Н), 7,1-7,5 (м, 4Н), 7,55 (дд, 1Н), 8,12 (дд, 1Н), 8,30 (дд, 1Н), 9,5 (шс, 4Н-здатний до обміну). Mac-спектрометрія: (El): m/z=270,2 (М-НСІ) IV. Синтез 2-[1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]-5-(4-піридиніл)-4,6-піримідиндіолу 3,27г (12,1ммоль) 1-(2-Фторбензил)-1Н-піразоло[3,4-b]піридин-3-карбоксімідаміду, отриманого відповідно до приклада III, суспендують у 40мл толуолу, додають 2,88г (12,1ммоль) діетил-2-(4-піридиніл)малонату (може бути придбаний у фірми «Mercachem»), і перемішують реакційну суміш протягом ночі при температурі 140°С. Продукт, що випав в осад, фільтрують на водоструминному насосі і сушать у високому вакуумі. Вихід: 2,43г (43%). LC+MS: час утримання 2,69хв. (метод А). Mac-спектрометрія: (ESI позит.), m/z=415 ([М+Н]+). V. Синтез 3-[4,6-дихлор-5-(4-піридиніл)-2-піримідиніл]-1-(2-фторбензил)-1Н-піразоло[3,4-b]піридину 2,39г (5,77ммоль) 2-[1-(2-Фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]-5-(4-піридиніл)-4,6-піримідиндіолу, синтезованого відповідно до прикладу IV, розчиняють у 10мл фосфорилхлориду. До отриманого розчину додають три краплі диметилформаміду і протягом трьох годин здійснюють перемішування зі зворотним холодильником. Реакційний розчин концентрують і залишок сушать у високому вакуумі. Вихід: 0,67г (24%). LC+MS: час утримання =4,34хв. (метод А). Mac-спектрометрія: (ESI позит.), m/z= 415 ([М+Н]+, Сl1). Приклади 1. 2-[1-[(2-фторфеніл)метил]-1Н-піразоло[3,4-b]піридин-3-іл]-5-(4-піридиніл)-4-піримідинамін 0,50г (1,9ммоль) 1-(2-Фторбензил)-1Н-піразоло[3,4-b]піридин-3-карбоксімідаміду з прикладу III і 0,32г (1,9ммоль) [(диметиламіно)метилен]піридинацетонітрилу з прикладу І суспендували в ксилолі і додавали BF3*OEt2 (71мкл, 79мг, 0,56ммоль, 0,3 еквіваленти). Після нагрівання при температурі 140°С протягом 19 годин і охолодження суспензію концентрували у вакуумі. Вказану в заголовку сполуку можна очистити методом флеш-хроматографії на силікагелі (СН2СІ2:метанол=20:1) з наступним розмішуванням в ацетонітрилі. Вихід: 0,24г (33%). Коефіцієнт Rf: 0,17 (ЕЕ/метанол =20:1). Температура плавлення: 254°С. Час утримання: 2,7хв. (колонка: Symmetry, С-18, 3,5мкм, 50´2,1мм, витрата елюенту 0,5мл/хв., 40°С, градієнт елюювання: вода (+0,1% мурашиної кислоти) : ацетонітрил (+0,1% мурашиної кислоти) =90:10 для 0хв., 10:90 для 7,5хв.). 1 Н-ЯМР: (300МГц, D6-ДMCO), δ=5,81 (с, 2Н, СН2), 7,0-7,6 (м, 9Н, Аr-Н, ΝΗ2), 8,64 (мс, 3Н, Аr-Н), 9,05 (д, 1Н, Аr-Н) Mac-спектрометрія: (ESI позит.), m/z=398([М+Н]+), (ESI негат.), m/z=396([М-Н]+) 2. 2-[1-[2-фторфеніл)метил]1Н-піразоло[3,4-b]піридин-3-іл]-5-(4-піридиніл)-4-піримідинамін 4,00г (14,9ммоль) 1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-карбоксімідаміду з прикладу III і 2,57г (14,9ммоль) 3-[(диметиламіно)метилен]піридинацетонітрилу з прикладу II суспендували в ксилолі. Після нагрівання при 120°С протягом 12 годин суспензію охолоджували до кімнатної температури й відфільтровували продукт, що випав в осад. Маточний розчин очищали, використовуючи метод високоефективної препаративної рідинної хроматографії (колонка Cromsil 120 ODS, С-18, 10мкм, 250´30мм, витрата елюенту 50мл/хв., кімнатна температура, градієнт: вода + ацетонітрил для 0хв.=90:10, для 28хв. 5:95), при необхідності, повторюючи очищення описаним способом. Вихід: 0,024г (0,4%). Коефіцієнт Rf: 0,17 (ЕЕ/метанол =20:1). 1 Н-ЯМР: (200 MHz, D6-ДMCO), δ=5,81 (с, 2Η, ОСН2), 6,95-7,6 (м, 8Н, Ar-H, NH2), 7,92 (дт, 1Н, Аr-Н), 8,21 (с, 1Н, Аr-Н), 8,6-8,75 (м, 2Н, Аr-Н), 9,03 (дд, 1Н, Аr-Н). LC+MS: час утримання 2,66хв. (колонка Symmetry, С-18, 3,5мкм, 50´2,1мм, витрата елюенту 0,5мл/хв., 40°С, градієнт елюювання: вода (+0,1% мурашиної кислоти):ацетонітрил (+0,1% мурашиної кислоти) =90:10 для 0хв., 10:90 для 7,5хв.). Mac-спектрометрія: (ESI позит.), m/z=398([М+Н]+), (ESI негат.), m/z=396([М-Н]+). 3. 6-хлор-2-[1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]-5-(4-піридиніл)-4-піримідиніламін 200мг (0,443ммоль) 3-[4,6-Дихлор-5-(4-піридиніл)-2-піримідиніл]-1-(2-фторбензил)-1Н-піразоло[3,4b]піридину, отриманого відповідно до прикладу V, суспендували в 5мл водного розчину аміаку, концентрацією 25%, і суспензію перемішували протягом ночі в автоклаві при температурі 140°С під власним тиском. Отриману реакційну суміш піддавали триразовій екстракції дихлорметаном, об'єднані екстракти сушили над сульфатом магнію і концентрували. Концентрований залишок піддавали очищенню методом хроматографії на силікагелі з використанням суміші дихлорметану з метанолом (30:1). Додаткове очищення сирого продукту здійснювали способом препаративної високоефективної рідинної хроматографії (метод В). Вихід: 34мг(15%). Коефіцієнт Rf: 0,45 (СН2СІ 2/метанол =20:1). 1 Н-ЯМР: (300МГц, D6-ДMCO), δ=5,85 (с, 2Н, СН2), 7,10-7,48 (м, 9Н, 7 Ar-Η і ΝΗ2), 8,61-8,75 (м, 3Н, Ar-H), 8,99 (дд, 1Н, Аr-Н). LC+MS: час утримання 3,55хв. (метод А). Mac-спектрометрія: (ESI позит.), m/z=398([М+Н]+), (ESI негат.), m/z=396([М-Н]+). 4. 2-[1-(2-Фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]-5-(4-піридиніл)-4,6-піримідиндіамін 200мг (0,443ммоль) 3-[4,6-Дихлор-5-(4-піридиніл)-2-піримідиніл]-1-(2-фторбензил)-1Н-піразоло[3,4b]піридину, отриманого відповідно до прикладу V, суспендували в 5мл водного розчину аміаку концентрацією 25%, і суспензію перемішували протягом ночі в автоклаві при температурі 140°С під власним тиском. Отриману реакційну суміш піддавали триразовій екстракції дихлорметаном, об'єднані екстракти сушили над сульфатом магнію і концентрували. Концентрований залишок піддавали очищенню методом хроматографії на силікагелі, використовуючи суміш дихлорметану з метанолом (30:1). Додаткове очищення сирого продукту здійснювали методом високоефективної препаративної рідинної хроматографії (метод В). Вихід: 45мг (20%). Коефіцієнт Rf: 0,30 (СН2СІ 2/метанол =20:1). 1 Н-ЯМР: (300МГц, D6-ДMCO), δ=5,82 (с, 2Н, СН2), 6,02 (шс, 4Н, ΝΗ2), 7,08-7,48 (м, 7Н, Аr-Н), 8,57-8,68 (м, 3Н, Аr-Н), 9,13 (дд, 1Н, Аr-Н). LC+MS: час утримання 2,55хв. (метод А). Mac-спектрометрія: (ESI позит.), m/z=413,3([М+Н]+), 847,8([2M+Na]+).
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazolopyridine pyridine substituted derivatives
Автори англійськоюStasch Johannes-Peter, Feurer Achim, Weigand Stefan, Lang Dieter, Straub Alexander, Perzborn Elisabeth
Назва патенту російськоюПроизводные пиридинзамещенных пиразолопиридинов
Автори російськоюШташ Йоханнес-Петер, Фойрер Ахим, Вайганд Штефан, Ланг Дитер, Штрауб Александер, Перзборн Элизабет
МПК / Мітки
МПК: A61P 13/00, A61P 29/00, A61K 31/505, A61P 43/00, A61K 31/506, A61P 7/02, A61P 1/04, A61P 21/00, A61P 11/06, A61P 25/20, A61P 25/18, C07D 471/04, A61P 25/00, A61P 25/30, A61P 9/04, A61P 15/10, A61P 13/08, A61P 25/22, A61P 37/04, A61P 19/10, A61P 9/10, A61P 9/12, A61P 9/00, A61K 45/06, A61P 25/14, A61P 15/00, A61P 13/02, A61P 25/28, A61P 25/16, A61P 25/24, A61P 31/18, A61K 45/00
Мітки: піридинзаміщених, піразолопіридинів, похідні
Код посилання
<a href="https://ua.patents.su/10-74404-pokhidni-piridinzamishhenikh-pirazolopiridiniv.html" target="_blank" rel="follow" title="База патентів України">Похідні піридинзаміщених піразолопіридинів</a>
Попередній патент: Поршневий двигун внутрішнього згорання
Наступний патент: Обмежувач витрати і тиску насоса гідропідсилювача керма
Випадковий патент: Компактний електродуговий вібратор рідкого металу












