Індазоламіди з аналгетичною активністю
Номер патенту: 79537
Опубліковано: 25.06.2007
Автори: Фурлотті Гвідо, Алісі Марія Алессандра, Луна Джузеппе, Каццолла Нікола, Гугліелмотті Анджело, Поленцані Лоренцо
Формула / Реферат
1. Індазоламід формули I:
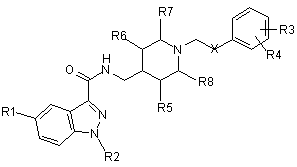 ,(I)
,(I)
у якій
X являє собою NHC(O) або C(O)NH групу,
R1 являє собою атом водню або атом галогену, або амінокарбоніл, ацетиламіногрупу, сульфонілметил, аміносульфонілметил, лінійну або розгалужену С1-3алкільну або С1-3алкоксигрупу,
R2 являє собою атом водню або лінійну або розгалужену С1-6алкільну групу або арил(С1-3)алкільну групу, де вказані вище групи необов'язково заміщені одним або більше замісниками, вибраними з групи, що включає атоми галогену, С1-3алкіл та С1-3алкоксигрупу,
R3 та R4, які можуть бути однаковими або різними, являють собою атом водню або атом галогену, або аміногрупу, нітрогрупу, гідроксил, лінійну або розгалужену С1-3алкільнугрупу, С1-3алкоксигрупу, ді(С1-3)алкіламіногрупу, ацетиламіногрупу або О-(С1-3)алкілфенільну групу, або R3 та R4, разом, утворюють 5-7-членне кільце, у якому один або два з вказаних членів можуть являти собою гетероатом, вибраний з N, S та О,
R5, R6, R7 та R8, які можуть бути однаковими або різними, являють собою Н або метил;
та його солі приєднання кислот з фармацевтично прийнятними органічними та неорганічними кислотами.
2. Індазоламід за п. 1, який відрізняється тим, що R1 являє собою Н, метил або метоксигрупу.
3. Iндазоламід за п. 1 або 2, який відрізняється тим, що R2 являє собою Н, метил або ізопропіл.
4. Індазоламід за будь-яким з пп. 1-3, який відрізняється тим, що R3 являє собою Н, метил, гідроксил, аміно або диметиламінoгрупу.
5. Індазоламід за будь-яким з пп. 1-4, який відрізняється тим, що R4 являє собою Н, метил або гідроксил.
6. Індазоламід за будь-яким з пп. 1-5, який відрізняється тим, що R5, R6, R7 та R8 являють собою Н.
7. Індазоламід за будь-яким з пп. 1-6, який відрізняється тим, що сіль приєднання фармацевтично прийнятної кислоти вибирають з групи, що включає такі кислоти як: щавлева кислота, малеїнова кислота, бурштинова кислота, лимонна кислота, винна кислота, молочна кислота, метансульфонова кислота, пара-толуолсульфонова кислота, соляна кислота, фосфорна кислота, сірчана кислота.
8. Фармацевтична композиція, що містить ефективну кількість сполуки формули (І):
 ,(І)
,(І)
у якій
X являє собою NHC(O) або C(O)NH групу,
R1 являє собою атом водню або атом галогену, або амінокарбоніл, ацетиламіногрупу, сульфонілметил, аміносульфонілметил, лінійну або розгалужену С1-3алкільну або С1-3алкоксигрупу,
R2 являє собою атом водню або лінійну чи розгалужену С1-6алкільну групу або арил(С1-3)алкільну групу, де вказані вище групи необов'язково заміщені одним або більше замісниками, вибраними з групи, що включає атоми галогену, С1-3алкіл та С1-3алкоксигрупу,
R3 та R4, які можуть бути однаковими або різними, являють собою атом водню або атом галогену, або аміногрупу, нітрогрупу, гідроксил, лінійну або розгалужену С1-3алкільну групу, С1-3алкоксигрупу, ді(С1-3)алкіламіногрупу, ацетиламіногрупу або О-(С1-3)алкілфенільну групу, або R3 та R4, разом, утворюють 5-7-членне кільце, у якому один або два з вказаних членів можуть являти собою гетероатом, вибраний з N, S та О,
R5, R6, R7 та R8, які можуть бути однаковими або різними, являють собою Н або метил;
або її сіль приєднання кислоти з фармацевтично прийнятною кислотою, та принаймні один фармацевтично прийнятний інертний інгредієнт.
Текст
1. Індазоламід формули I: C2 2 (11) 1 3 79537 4 метил, аміносульфонілметил, лінійну або розгалурозгалужену С1-3алкільну групу, С1-3алкоксигрупу, жену С1-3алкільну або С1-3алкоксигрупу, ді(С1-3)алкіламіногрупу, ацетиламіногрупу або ОR2 являє собою атом водню або лінійну чи розга(С1-3)алкілфенільну групу, або R3 та R4, разом, лужену С 1-6алкільну групу або арил(С 1-3)алкільну утворюють 5-7-членне кільце, у якому один або груп у, де вказані вище групи необов'язково замідва з вказаних членів можуть являти собою гетещені одним або більше замісниками, вибраними з роатом, вибраний з N, S та О, групи, що включає атоми галогену, С1-3алкіл та С1R5, R6, R7 та R8, які можуть бути однаковими або різними, являють собою Н або метил; 3алкоксигрупу, R3 та R4, які можуть бути однаковими або різними, або її сіль приєднання кислоти з фармацевтично являють собою атом водню або атом галогену, прийнятною кислотою, та принаймні один фармаабо аміногрупу, нітрогрупу, гідроксил, лінійну або цевтично прийнятний інертний інгредієнт. Даний винахід відноситься до індазоламідів, що мають аналгетичну активність, до способу їх одержання та до фармацевтичної композиції, що містить ці речовини. Хронічний біль є широко розповсюдженим захворюванням. В середньому, від нього страждає приблизно 20% дорослого населення. Цей тип болю в основному пов'язаний з хронічними ураженнями та/або дегенеративними процесами. Типовими прикладами патологій, що характеризуються хронічним болем, є ревматоїдний артрит, остеоартрит, фіброміалгія, невропатії, тощо. [Ashburn MA, Staats PS, Management of chronic pain. Lancet 1999; 353: 1865-69]. Аналгетичні лікарські засоби, що застосовуються на сьогоднішній день, по суті відносяться до двох класів: нестероїдні протизапальні засоби (NSAIDs), які об'єднують аналгетичну активність з протизапальною активністю, та опіоїдні аналгетичні засоби. Ці класи складають основу для "аналгетичної шкали" з трьома ступенями, запропонованої Всесвітньою Організацією Охорони Здоров'я для фармацевтичного лікування болю [Textbook of pain. Четверте видання. P.D. Wall та R. Mel zack Eds. Churchill Livingstone, 1999], Хронічний біль часто ослаблює людину, є причиною втрати працездатності та погіршує якість життя. Тому, це має наслідки як у економічній так і у соціальній сфері. Крім того, існує значна кількість пацієнтів, больовий стан яких все ще не має прийнятного лікування [Scholz J, Woolf CJ. Can we conquer pain? Nat Neurosci. 2002 Nov; 5 Suppl: 1062-7]. Спроби всебічного дослідження, направлені на визначення придатних аналгетичних сполук, все ще не привели до помітних результатів. На сьогоднішній день, несподівано, знайдено, що нове сімейство індазоламідів має ці властивості. Таким чином, у першому аспекті, даний винахід відноситься до індазоламіду формули І: у якій X являє собою NHC(O) або C(O)NH групу, R1 являє собою атом водню або атом галогену, або амінокарбоніл, ацетиламіно групу, сульфонілметил, аміносульфонілметил, лінійну або розгалужену С 1-3 алкільну або С 1-3 алкокси групу, R2 являє собою атом водню або лінійну або розгалужену C1-6 алкільну групу або арил(С 13)алкільну груп у, де вказані вище групи необов'язково заміщені одним або більше замісниками, вибраними з групи, що включає атоми галогену, С1-3 алкіл та С 1-3 алкокси групу, R3 та R4, які можуть бути однаковими або різними, являють собою атом водню або атом галогену, або аміно групу, нітро гр упу, гідроксил, лінійну або розгалужену С 1-3 алкільну групу, С1-3 алкокси групу, ди(С1-3)алкіламіно групу, ацетиламіно групу або О-( С1-3)алкілфенільну груп у, або R3 та R4, разом, утворюють 5- - 7-членне кільце, у якому один або два з вказаних членів можуть являти собою гетероатом, вибраний з N, S та О, R5, R6, R7 та R8, які можуть бути однаковими або різними, являють собою Η або метил; та їх солі приєднання кислот з фармацевтично прийнятними органічними та неорганічними кислотами. Кращі значення R1 являють собою Н, метил та метокси групу. Кращі значення R2 являють собою Н, метил та ізопропіл. Кращі значення R3 являють собою Н, метил, гідроксил, аміно та диметиламіно групу. Кращі значення R4 являють собою Н, метил та гідроксил. Краще значення R5, R6, R7 та R8 являє собою Н. Аналгетична активність сполук формули (І) показана з допомогою двох експериментальних моделей на пацюках: механічна гіпералгезія, викликана CFA, та механічна гіпералгезія при діабетичній невропатії, викликана стрептозотоцином. Як відомо з попереднього рівня техніки, згадані вище експериментальні моделі можуть розглядатися як прогнозуючі активність у людини. CFA-викликана гіпералгезія представляє собою синдром, що характеризується активацією ланцюжків, що призначені для контролювання запальної відповіді та пов'язані з появою станів, які впливають на відчуття болю. Особливо, введення CFA здатне викликати периферично вивільнення 5 79537 6 "запального супу" (медіатори запальної відповіді R1 та R2 приймають значення, вказані вище, та алгогенних засобів), що відповідає за локальне та ушкодження, та центрально, у спинному мозку, Υ являє собою атом СІ або Вr, або групу OR біохімічні зміни, що підтримують посилення відчутабо OC(O)R, у яких R являє собою алкіл з лінійним тя болю. Як добре відомо, ця модель представляє або розгалуженим ланцюжком, що містить від 1 до собою ефективний інструмент для вивчення ліків 6 атомів вуглецю, або формули (lllb) для застосування у лікуванні запального болю у людини та, зокрема, у контролюванні станів, таких як гіпералгезія та алодінія (allodynia). Типовими прикладами патологій людини, що характеризуються цим типом болю, пов'язаного з дегенеративними запальними процесами, є ревматоїдний артрит та остеоартрит. При цьому, діабетична невропатія, викликана стрептозотоцином у пацюків, представляє собою інсулін-залежний синдром, що характеризується суп утнім зниженням у швидкості провідності рухоу якій вого та чуттєво го нервів та появою ряду анормаR1 приймає значення, вказані вище, льностей у відчутті болю. Як добре відомо, ця ексз одержанням індазоламіду формули (І), та периментальна модель представляє собою b) необов'язково, з утворенням солі приєднанкорисний інструмент для вивчення ліків для застоня кислоти індазоламіду формули (І) з фармацевсування у лікуванні невропатичного болю у людитично прийнятною органічною або неорганічною ни. Зокрема, ця модель представляє собою ефеккислотою. тивний приклад великої групи типів Амін формули (II) може бути одержаний у відневропатичного болю, що характеризуються таким повідності до звичайних способів, наприклад, явищем, як гіпералгезія та алодінія, що є резульшляхом алкілування ізоніпекотаміду прийнятним татом первинних уражень або дисфункцій нервогалогенідом, а потім відновленням аміду до первої системи. Типовими прикладами патологій лювинного аміну [WO 98/07728] або шляхом захидини, що характеризуються дисфункціями цього щення амінометилпіперидину бензальдегідом типу та присутністю невропатичного болю, є діа[Synthetic Communications 22(16), 2357-2360, бет, рак, імунодефіцит, травма, ішемія, розсіяний 1992], алкілуванням з допомогою придатного галосклероз, ішиас, невралгія трійничного нерву та геніду та зняттям захисту. після-герпетичний синдроми. Проміжна сполука формули (II), у якій X, R3, У другому аспекті, даний винахід відноситься R4, R5, R6, R7 та R8 приймають значення, вказані до способу одержання сполук формули (І) та їх вище, є новою. солей приєднання кислот з фармацевтично приТаким чином, у третьому аспекті, даний винайнятними органічними та неорганічними кислотахід відноситься до проміжної сполуки формули (II), ми, який відрізняється тим, що він включає настуу якій X, R3, R4, R5, R6, R7 та R8 приймають знапні стадії: а) конденсування аміну формули (II) чення, вказані вище. Індазоли формул (lllа) та (lllb) також можуть бути одержані відповідно до загальновідомих способів. Наприклад, сполуки формули (lllа), у якій Υ являє собою хлор, можуть бути одержані з допомогою тіонілхлориду з відповідної кислоти [J. Med. Chem, 1976, том 19 (6), стор.778-783], у той час як сполуки формули (lllа), у якій Υ являє собою OR або OC(O)R, можуть бути одержані з допомогою відомих реакцій естерифікації або відомих реакцій для утворення змішаних ангідридів [R.C. Larock, Comprehensive Organic Transformations, VCH, у якій стор.965-966]. У свою чергу, сполуки формули (lllb) X, R3, R4, R5, R6, R7 та R8 приймають знаможуть бути одержані відповідно до [J.O.C. 1958, чення, вказані вище, том 23, стор.621]. з похідною сполукою індазолкарбонової кислоВ одному втіленні способу даного винаходу, ти формули (ІІІа) стадію (а) виконують введенням у реакцію сполуки формули (II) зі сполукою формули (lllа), у якій Υ являє собою хлор, зі сполукою формули (lllb) у присутності прийнятного розріджувача та при температурі у інтервалі між 0 та 140°С впродовж часу у інтервалі між 0,5 та 20 годинами. Переважно, температура реакції знаходиться у інтервалі між 15 та 40°С. Переважно, час реакції коливається від 1 до 14 годин. Переважно, розріджувач є апротонним, полярним або неполярним. Навіть ще краще, якщо виу якій користовують апротонний неполярний розріджу 7 79537 8 вач. Приклади прийнятних апротонних неполярних лікувань, фармацевтична композиція даного винарозріджувачів включають ароматичні вуглеводні, ходу може містити інші фармацевтично активні наприклад, толуол. Приклади прийнятних апроінгредієнти, одночасне застосування яких є користонних полярних розріджувачів включають дименим. тилформамід та дихлорметан. Кількість сполуки формули (І) або її солі з фаУ втіленні, у якому використовують сполуку рмацевтично прийнятною кислотою у фармацевформули (lllа), у якій Υ являє собою СІ або Вr, затичній композиції даного винаходу може змінювазначена вище стадія (а) може бути здійснена у тися у широкому інтервалі в залежності від присутності акцептора органічної або неорганічної відомих факторів, наприклад, типу хвороби, яку кислоти. необхідно лікувати, серйозності захворювання, Приклади прийнятних акцепторів органічної ваги тіла пацієнта, форми дозування, вибраного кислоти включають піридин, триетиламін та подібшляху застосування, числа прийомів на добу та ні. Приклади прийнятних акцепторів неорганічної ефективності вибраної сполуки формули (І). Одкислоти включають карбонати та бікарбонати лужнак, оптимальна кількість може бути легко та у них металів. плановому порядку визначена спеціалістом, кваВідповідно до способу даного винаходу, у сталіфікованим у даному рівні техніки. дії (b), додаванню фармацевтично прийнятної орЗвичайно, кількість сполуки формули (І) або її ганічної або неорганічної кислоти до індазоламіду солі з фармацевтично прийнятною кислотою у формули (І), одержаного у стадії а), переважно фармацевтичній композиції даного винаходу буде передує стадія виділення вказаного індазоламіду. такою, щоб забезпечити рівень застосування між Типові приклади фармацевтично прийнятних 0,001 та 100мг/кг/день. Навіть більш краще, ця кислот включають такі кислоти як: щавлева кислокількість буде дорівнювати величині між 0,1 та та, малеїнова кислота, метансульфонова кислота, 10мг/кг/день. пара-толуолсульфонова кислота, бурштинова киФорми дозування фармацевтичної композиції слота, лимонна кислота, винна кислота, молочна даного винаходу можуть бути одержані відповідно кислота, соляна кислота, фосфорна кислота, сірдо технологій, які добре відомі хімікамчана кислота. фармацевтам, включаючи змішування, гранулюУ четвертому аспекті, даний винахід відновання, утворення таблетки, розчинення, стериліситься до фармацевтичної композиції, що містить зацію та подібні процедури. ефективну кількість сполуки формули (І) або її солі Наступні приклади слугують для ілюстрації виприєднання з фармацевтично прийнятною кислонаходу, однак, не обмежують його. тою, та принаймні один фармацевтично прийнятУ наступних прикладах, замісники на ароматиний інертний інгредієнт. чному кільці (R3 та R4) показані з нумерацією веТиповим прикладом патологічного стану, що ликими літерами. може ефективно лікуватися фармацевтичною Приклад 1 композицією відповідно до даного винаходу, є 2-(4-(Амінометил)-1-піперидил)-Nхронічний біль. Зазвичай, цей хронічний біль прифенілацетамід дигідрохлорид (AF3R279) писується хронічним ураженням або дегенератив(Сполука II: R3=R4=R5=R6=R7=R8=H, ним процесам, таким як, наприклад, ревматоїдний X=C(O)NH) артрит, остеоартрит, фіброміалгія, онкологічний a) N-гексапдро-4-піридилметил-Nбіль, невропатичний біль та подібні. фенілметиліденамін Переважно, фармацевтичні композиції даного Бензальдегід (12,7г; 0,12моль) додали по кравинаходу одержують у ви гляді придатних форм плям до розчину 4-амінометилпіперидину (13,7г; дозування. 0,12моль) у толуолі (50мл). Приклади придатних форм дозування вклюРозчин, одержаний таким чином, перемішувачають таблетки, капсули, покриті таблетки, гранули при кімнатній температурі. Через 3 години, розли, розчини та сиропи для перорального застосучинник видалили випарюванням при зниженому вання; креми, мазі та лікарські пластирі для тиску та осад двічі обробили толуолом (2´50мл). місцевого застосування; суппозиторії для ректальN-Гексагідро-4-тридилметил-Nного застосування та стерильні розчини для зафенілметиліденамін (25г) одержали таким чином стосування як ін'єкції, аерозолі або для офтальмота використовували без додаткового очищення. логічного застосування. b) 2-(4-(амінометил)-1-піперидил)-NПереважно, ці форми дозування формулюфетлацетамiд ються таким чином, щоб забезпечити контрольоПродукт (26,3г; 0,13моль), одержаний як опиване вивільнення впродовж деякого часу сполуки сано у стадії а), показаній вище, розчинили у абформули (І) або її солі з фармацевтично прийнятсолютному етиловому спирті (100мл) та додали до ною кислотою. Особливо, в залежності від типу суспензії, що містить N-2-хлорацетиланілін (22,4г; лікування, необхідний час вивільнення може бути 0,13моль), одержаний як описано у [Beilstein (I) дуже коротким, нормальним або тривалим. Syst. No 1607, стор.243], та безводний карбонат Форми дозування також можуть містити інші калію (33г; 0,24моль) у абсолютному етиловому інгредієнти, що звичайно використовуються, такі спирті (250мл). як: консерванти, стабілізатори, поверхнево-активні Суспензію, одержану таким чином, нагрівали зі речовини, буфери, солі для регулювання осмотичзворотним холодильником протягом 16 годин. Реного тиску, емульгатори, підсолоджувачі, барвниакційну суміш залишили охолодитися до кімнатної ки, смакові добавки та подібні. температури та відфільтрували. Фільтрат випариКрім того, при необхідності для певних видів ли при зниженому тиску та осад, одержаний таким 9 79537 10 чином, суспендували у 3N НСl (90мл) та переміС Η Ν шували при кімнатній температурі протягом 2 гоЗнайдено % 63,83 5,74 14,75 дин. Розраховано % 63,89 6,86 14,90 Розчин перенесли у ділильну лійку та кислотну 1 водну фазу промили 4 рази етилацетатом H-ЯМР (d,D MSO-d6): 1,55 (d, J=7Гц, 6H); 1,50(4´50мл). Водну фазу підлужили до рН 13 з допо2,10 (m, 5H); 3,00-3,70 (m, 6H); 4,16 (s, 2H); 5,08 могою 6Ν NaOH та екстагували дихлорметаном (септет, J=7Гц, 1Н); 7,11 (t, J=7Гц, 1H); 7,20-7,50 (80мл). Органічну фазу висушили над Na2SO4 та (m, 4H); 7,66 (d, J=8Гц, 2Н); 7,79 (d, J=8Гц, 1Н); розчинник видалили випарюванням при знижено8,18 (d, J=8Гц, 1Н); 8,37 (t, J=6Гц, 1Н); 10,03 (шиму тиску з одержанням 2-(4-(амінометил)-1рокий s, 1H); 11,04 (s, 1H). піперидил)-N-фенілацетаміду (10г). Приклад 3 c) 2-(4-(амінометил)-1-піперидил)-NN3-((1-(2-оксо-2-(феніламіно)етил)-4фенілацетамід дигідрохлорид піперидил)метил)-1Н-індазол-3-карбоксамід тозиПродукт (4г), одержаний як описано у стадії b), лат (AF3R276) показаній вище, перетворили у відповідний дигід(Сполука І: R1=R2=R3=R4=R5=R6=R7=R8=H, рохлорид шляхом розчинення у етанолі (60мл), X=C(O)NH) додаючи хлористий етанол (5мл) та кристалізуючи Розчин продукту (5,7г; 0,026моль), одержаного з 95° етанолу. як описано у Прикладі 1b), у дихлорметані (30мл) Таким чином одержали 2-(4-(амінометил)-1додали, через крапельну лійку, до суспензії піперидил)-N-фенілацетамід дигідрохлорид (3,5г). 7Н,14Н-індазоло[2',3':4,5]шразино[1,2-b]індазолТемпература плавлення: 288°С (розклад) 7,14-диону (3,7г; 0,013моль), одержаного як опиЕлементний аналіз сано у [J.O.C. 1958, том 23, стор.621, у толуолі Для С 14Н21N3 О·2НСL·Н2O (30мл)]. Після перемішування при кімнатній темпераС Η Ν турі протягом 18 годин, реакційну суміш перенесли Знайдено % 49,73 7,55 12,21 у ділильну лійку. Додали дихлорметан (30мл) та Розраховано % 49,71 7,45 12,42 органічну фазу промили з допомогою IN NaOH. Органічну фазу відділили та висушили над 1 Na2SO4. Потім розчинник видалили випарюванням H-ЯМР (d, D MSO-d 6): 1,44-1,70 (m, 2Η); 1,71при зниженому тиску та продукт, одержаний таким 2,20 (m, 3Н); 2,77 (s, 2H); 3,04-3,26 (m, 4H); 4,18 (s, чином, перетворили у відповідний тозилат шляхом 2H); 7.12 (t, J=7Гц, 1Н); 7,35 (t, J=7Гц, 2Н); 7,66 (d, розчинення у етилацетаті, додаючи стехіометричJ=7Гц, 2Н); 8,33 (широкий s, 3Н); 10,18 (s, 1H); ну кількість п-толуолсульфонової кислоти та пере11,07 (s, 1H). кристалізовуючи з 95° етанолу. Приклад 2 Таким чином одержали бажаний продукт N3-((1-(2-оксо-2-(феніламіно)етил)-4(4,3г). піперидил)метил)-1-(1-метилетил)-1Н-індазол-3Температура плавлення: 215,5-217,5°С карбоксамід гідрохлорид (AF3R172) Елементний аналіз (Сполука І: R1=R3=R4=R5=R6=R7=R8=H, Для C22H25N5 O2·C7H 8O3S·1/2H2O R2=i-C 3H7, X=C(O)NH) 1-(1-Метилетил)-1Н-індазол-3-карбоксил хлорид (17,5г; 0,079моль), одержаний як описано у С Η Ν [ЕР-А-0975623], додали порціями до суспензії проЗнайдено % 60,71 5,92 12,24 дукту (19,5г; 0,079моль), одержаного як описано у Розраховано % 60,82 5,98 12,23 Прикладі 1b), у толуолі (300мл). 1 Реакційну суміш перемішували при кімнатній H-ЯМР (d, D MSO-d 6): 1,48-1,73 (m, 2H); 1,77температурі протягом 6 годин. Потім розчинник 2,10 (m, 3Н); 2,28 (s, 3Н); 2,93-3,65 (m, 6H); 4,10 (s, видалили випарюванням при зниженому тиску. 2H); 7,07-7,67 (m, 12Н); 8,18 (d, J=8Гц, 1Н); 8,53 (t, Осад обробили з допомогою 1N NaOH (100мл) та J=6Гц, 1Н); 9,63 (широкий s, 1H); 10,52 (s, 1Н); дихлорметаном (100мл) та перенесли у ділильну 13,57 (s, 1H). лійку. Приклад 4 Органічну фазу відділили та висушили над N3-((1-(2-оксо-2-(феніламіно)етил)-4Na2SO4, потім розчинник видалили випарюванням піперидил)метил)-1-бензил-1Н-індазол-3при зниженому тиску та осад (20г), одержаний такарбоксамід гідрохлорид (AF3R277) ким чином, очистили з допомогою флеш хромато(Сполука І: R1=R3=R4=R5=R6=R7=R8=H, графії, елююючи сумішшю 7/3 гексан/етилацетат. R2=C6H5CH2, X=C(O)NH) Одержаний продукт перетворили у відповіда) 1-бензил-1Η-індазол-3-карбоксил хлорид ний гідрохлорид шляхом розчинення у етилацетаТіонілхлорид (5,6мл; 0,077моль) додали до суті, додаючи хлористий етанол та кристалізуючи з спензії 1-бензил-1Н-індазол-3-карбонової кислоти 9/1 суміші етилацетат/абсолютний етанол. (6,5г; 0,026моль), одержаної як описано у [J. Med. Таким чином одержали бажаний продукт Chem., 1976, том 19 (6). стор.778-783], у толуолі (12,8г). (65мл), та реакційну суміш нагрівали зі зворотним Температура плавлення: 201-202°С (розклад) холодильником протягом 2 годин. Розчинник виЕлементний аналіз далили випарюванням при зниженому тиску та Для C25H31N5 O2·HCl осад двічі обробили толуолом (2´50мл) з одержанням бажаного продукту (7г), який використову 11 79537 12 вали без додаткового очищення. піперидил)метил)-1-(1-метилетил)-1Н-індазол-3b) N3-((1-(2-оксо-2-(феніламіно)етил)-4карбоксамід піперидил)метил)-1-бензил-1Н-індазол-31-(1-Метилетил)-1Н-індазол-3-карбоксил хлокарбоксамід гідрохлорид рид (31,1г; 0,14моль), одержаний як описано у [ЕРПрацюючи відповідно до способу, подібного А-0975623], додали порціями до суспензії N1-(4описаному у Прикладі 2, продукт (8,2г, 0,030моль), ((фенілметші)окси)феніл)-2-(4-(амінометил)-1одержаний як описано у Прикладі 4а), ввели у репіперидил)етанаміду (49,5г; 0,14моль), одержаного акцію з продуктом (7,5г; 0,030моль), одержаним як як описано у Прикладі 5а), у толуолі (500мл). описано у Прикладі 1b), та продукт реакції переРеакційну суміш перемішували при кімнатній творили у відповідний гідрохлорид. температурі протягом 6 годин та потім відфільтруТаким чином одержали бажаний продукт вали. Тверду речовину, одержану таким чином, (4,5г). обробили з допомогою 2N NaOH та дихлорметану. Температура плавлення: 196-198°С Цю суміш перенесли у ділильну лійку. Органічну Елементний аналіз фазу відділили та висушили над Na2SO4, розчинДля C29H31N5 O2·HCl·1/2H 2O ник видалили випарюванням при зниженому тиску та осад (75г), одержаний таким чином, перекристалізували двічі з ізопропанолу з одержанням 56г С Η Ν бажаного продукту. Знайдено % 66,19 6,28 13,24 Температура плавлення: 113-115°С Розраховано % 66,09 6,31 13,29 Елементний аналіз 1 Для C32H37N5 O3 H-ЯМР (δ, CDC13): 1,64-2,40 (m, 5H); 3,10-3,77 (m, 6H); 4,13 (s, 2H); 5,58 (s, 1Н); 7,00-7,40 (m, С Η Ν 13H); 7,74 (d, J=8Гц, 1H); 8,34 (d, J=8Гц, 1H); 10,88 Знайдено % 71,03 7,19 12,95 (s, 1H); 11,26 (широкий s, 1H). Розраховано % 71,22 6,91 12,98 Приклад 5 N3-((1-(2-оксо-2-((41 ((фенілметил)окси)феніл)аміно)етил)-4H-ЯМР (d, DMSO-d 6): 1,24-1,44 (m, 2H); 1,54 піперидил)метил)-1-(1-метилетил)-1Н-індазол-3(d, J=7Гц, 6Н); 1,48-1,78 (m, 3Н); 2,10 (t, J=11Гц, карбоксамід (AF3R3 31) 2H); 2,87 (d, J=11Гц, 2H); 3,05 (s, 2H); 3,24 (t, (Сполука І: R1=R4=R5=R6=R7=R8=H, R2=iJ=6Гц, 2Н); 5,07 (септет, J=7Гц, 1Н); 5,07 (s, 2H); C3H7, R3=4-OCH 2C6H5, X=C(O)NH) 6,96 (d, J=9Гц, 2H); 7,20-7,48 (m, 7H); 7,54 (d, a) N1-(4-((фенілметил)окси)феніл)-2-(4J=9Гц, 2Н); 7,78 (d, J=9Гц, 1H); 8,19 (d, J=8Гц, 1H); (амінометил)-1-піперидил)етанамід гідрохлорид 8,23 (t, J=6Гц, 1H); 9,52 (s, 1H). Продукт (68г; 0,34моль), одержаний як описаПриклад 6 но у Прикладі 1а), ввели у реакцію з N1-(4N3-((1-(2-((4-гідроксифеніл)аміно)-2-оксоетил)((фенілметил)окси)феніл)-2-хлоретанамідом 4-піперидил)метил)-1-(1-метилетил)-1H-індазол-3(93,7г; 0,34моль), одержаним як описано у [Indian карбоксамід гідрохлорид (AF3R278) J. Appl. Chem. 1967, том 30(3-4), стор.91-95], пра(Сполука І: R1=R4=R5=R6=R7=R8=H, R2=iцюючи відповідно до способу, подібного описаноC3H7, R3=4-OH, X=C(O)NH) му у Прикладі 1b). Розчин продукту (36,5г; 0,068моль), одержаноМаслянистий осад (120г), одержаний таким го як описано у Прикладі 5, у 95° етанолі (1000мл) чином, очистили з допомогою флеш хроматограгідрогенували у присутності 10% Pd-C (3,65г) при фії, елююючи сумішшю 10/4/1 хлоро40 пси протягом 5 годин. Реакційну суміш потім форм/метанол/водний амоній. відфільтрували та фільтрат сконцентрували при Таким чином одержали N1-(4зниженому тиску ((фенілметил)окси)феніл)-2-(4-(амінометил)-1Продукт, одержаний таким чином, перетворипіперидил)етанамідну основу (70г), яку перетворили у відповідний гідрохлорид шляхом розчинення ли у відповідний дигідрохлорид шляхом розчинену абсолютному етиловому спирті, додаючи хлориня у етанолі, додаючи хлористий етанол та перестий етанол та перекристалізовуючи з абсолютнокристалізовуючи з абсолютного етанолу, з го етанолу, з одержанням 20г бажаного продукту. одержанням 65г бажаного продукту. Температура плавлення: 277°С (розклад) Елементний аналіз: Елементний аналіз ДляС21Н27N3О 2·2НСI Для C25H31N5 O3·HCl Знайдено % Розраховано % 1 С 58,88 59,16 Η 6,75 6,86 Ν 9,55 9,85 H-ЯМР (d, D MSO-d 6): 1,45-1,70 (m, 2Η); 1,702,20 (m, 3Н); 2,72 (s, 2H); 3,02-3,68 (m, 4H); 4,12 (s, 2H); 5,08 (s, 2H); 7,00 (d, J=9Гц, 2Н); 7,26-7,48 (m, 5H); 8,56 (d, J=9Гц, 2H); 8,27 (s, 3Н); 10,14 (s, 1Н); 10,92 (s, 1H). b) N3-((1-(2-оксо-2-((4((фенілметил)окси)феніл)аміно)етил)-4 Знайдено % Розраховано % 1 С 61,76 61,78 Η 6,76 6,64 Ν 14,44 14,41 H-ЯМР (d, DMSO-d6): 1,55 (d, J=7Гц, 6H); 1,461,75 (m, 2H); 1,75-2,10 (m, 3Н), 2,95-3,64 (m, 6H); 4,07 (s, 2H); 5,08 (септет, J=7Гц, 1Н); 6,75 (d, J=9Гц, 2Н); 7,20-7,31 (m, 1H); 7,35-7,49 (m, 3H); 7,79 (d, J=9Гц, 1Н); 8,17 (dt, J=8; 1Гц, 1Н); 8,36 (t, J=6Гц, 1H); 9,37 (s, 1H); 9,89 (широкий s, 1H); 10,62 (s, 1H). 13 79537 14 Приклад 7 (Сполука І: R1=CH3, N3-((1-(2-оксо-2-((4-нітрофеніл)аміно)етил)-4R2=R3=R4=R5=R6=R7=R8=H, X=C(O)NH) піперидил)метил)-1-(1-метилетил)-1H-індазол-3a) 2,9-диметил-7Н,14Нкарбоксамід (AF3R335) індазоло[2',3':4,51піразино[1,2-b]індазол-7,14-дион (Сполука І: R1=R4=R5=R6=R7=R8=H, R2=iТіонілхлорид (11мл; 0,151моль) додали до суC3H7, R3=4-NO2, X=C(O)NH) спензії 5-метил-1Н-індазол-3-карбонової кислоти а) 2-(4-(амінометил-N-піперидил)-N-(4(12,2г; 0,056моль), одержаної як описано у [J. нітрофеніл)ацетамід Heterocyclic Chem. 1964, том 1 (5) 239-241], у тоПродукт (28г; 0,14моль), одержаний як описалуолі (130мл), та реакційну суміш нагрівали зі звоно у Прикладі 1а), ввели у реакцію з N1-(4ротним холодильником протягом 4 годин. Розчиннітрофеніл)-2-хлоретанамідом (30г; 0,14моль), ник видалили випарюванням при зниженому тиску працюючи відповідно до способу, подібного опита осад обробили двічі у толуолі з одержанням 12г саному у Прикладі 1b). бажаного продукту. 1 Маслянистий осад (20г) одержали таким чиH-ЯМР (d,CDCI3): 2,54 (d, J=1Гц, 6Н); 7,35 (dd, ном та очистили з допомогою флеш хроматограJ=9; 2Гц, 2Н); 7,85 (d, J=9Гц, 2H); 8,01 (m, 1H). фії, елююючи сумішшю 10/4/1 хлороb) 5-метил-N3-((1-(2-оксо-2-(феніламіно)етил)форм/метанол/водний амоній, з одержанням 15г 4-піперидил)метил)-1Н-індазол-3-карбоксамід гідбажаного продукту. рохлорид Елементний аналіз Продукт (4,5г; 0,018моль), одержаний відповіДля С 14Н20N4 О3 дно до Прикладу 1b), та продукт (2,8г; 0,009моль), одержаний відповідно до Прикладу 8а), привели у С Η Ν взаємодію відповідно до способу, подібного описаному у Прикладі 3. Знайдено % 57,23 7,00 18,98 3,8г 5-метил-1Н-((1-(2-оксо-2Розраховано % 57,52 6,90 19,16 (феніламіно)етил)-4-піперидил)метил)-1Н-індазол1 3-карбоксамід одержали таким чином, та перетвоH-ЯМР (d, DMSO-d 6+D2O): 1,20-1,40 (m, 2H); рили у відповідний гідрохлорид шляхом розчинен1,48-1,78 (m, 3Н); 2,17 (t, J=12Гц, 2H); 2,72 (d, ня у етилацетаті, додаючи хлористий етанол та J=7Гц, 2H); 2,89 (d, J=12Гц, 2H); 3,21 (s, 2H); 7,90 перекристалізовуючи з суміші 95/5 етилаце(d, J=9Гц, 2Н); 8,23 (d, J=9Гц, 2Н). тат/етанол з одержанням 2,7г бажаного продукту. b) N3-((1-(2-оксо-2-((4-нітрофеніл)аміно)етил)Температура плавлення: 252°С (розклад). 4-піперидил)метил)-1-(1-метилетил)-1Н-індазол-3Елементний аналіз карбоксамід Для C23H27N5 O2·HCl 1-(1-Метилетил)-1Н-індазол-3-карбоксил хлорид (3,1г; 0,013моль), одержаний як описано у [ЕРС Η Ν А-0975623], додали порціями до суспензії продукту Знайдено % 62,62 6,38 15,70 (4,07г, 0,014моль), одержаного відповідно до ПриРозраховано % 62,51 6,39 15,85 кладу 7а), у толуолі (300мл). Реакційну суміш перемішували при кімнатній 1 температурі протягом 6 годин. Потім розчинник H-ЯМР (d, D MSO-d 6): 1,50-1,72 (m, 2H); 1,80видалили випарюванням при зниженому тиску. 2,00 (m, 3Н); 2,43 (s, 3Н); 2,96-3,64 (m, 6H); 4,13 (s, Осад обробили з допомогою 1N NaOH та дихлор2H); 7,12 (t, J=7Гц, 1Н); 7,24 (dd, J=9; 1,5Гц, 1Н); метану. Цю суміш перенесли у ділильну лійку. Ор7,36 (t, J=7Гц, 2Н); 7,50 (d, J=9Гц, 1H); 7,62 (d, ганічну фазу відділили та висушили над Na2SO4, J=7Гц, 2H); 7,95 (s, 1H); 8,46 (t, J=6Гц, 1Н); 9,86 розчинник видалили випарюванням при знижено(широкий s, 1H); 10,52 (s, 1H); 13,51 (s, 1H). му тиску. Осад, одержаний таким чином, очистили Приклад 9 з допомогою флеш хроматографії, елююючи ети5-метил-N3-((1-(2-оксо-2-(фетламіно)етил)-4лацетатом, з одержанням 2,8г бажаного продукту. піперидил)метил)-1-(1-метилетил)-1Н-індазол-3Елементний аналіз карбоксамід гідрохлорид (AF3R299) Для C25H30N6 O4 (Сполука І: R1=CH3, R2=i-C 3H7, R3=R4=R5=R6=R7=R8=H, X=C(O)NH) С Η Ν a) ізопропіл 1-(1-метилетил)-5-метил-1Ніндазол-3-карбоксилат Знайдено % 62,62 6,38 17,33 60% суспензію гідриду натрію у мінеральному Розраховано % 62,75 6,32 17,56 маслі (17,1г; 0,43моль) додали до суспензії 51 метил-1Н-індазол-3-карбонової кислоти (30г; H-ЯМР (d, CDCI3): 1,36-1,55 (m, 2H); 1,61 (d, 0,17моль), одержаної як описано у [J. Heterocyclic J=7Гц, 6Н); 1,66-1,98 (m, 3Н); 2,32 (td, J=12; 2Гц, Chem. 1964, том 1 (5) 239-241], у диметилформа2H); 2,95 (d, J=12Гц, 2H); 3,13 (s, 2H); 3,46 (t, міді (450мл), та реакційну суміш нагріли до 70°С. J=7Гц, 2Н); 4,89 (септет, J=7Гц, 1Н); 7,19 (t, J=6Гц, Через 30 хвилин, додали ізопропіл бромід (48мл, 1Н); 7,23-7,30 (m, 1Н); 7,35-7,50 (m, 2H); 7,75 (d, 0,51моль). J=9Гц, 2Н); 8,21 (d, J=9Гц, 2Н); 8,38 (dt, J=8; 1Гц, Реакційну суміш перемішували протягом 6 го1Н); 9,60 (s, 1Н). дин при 70°С. Після охолодження, додали воду. Приклад 8 Реакційну суміш перенесли у ділильну лійку та 5-метил-N3-((1-(2-оксо-2-(феніламіно)етил)-4екстрагували диетиловим ефіром. Органічну фазу піперидил)метил)-1Н-індазол-3-карбоксамід гідропромили насиченим розчином бікарбонату натрію хлорид (AF3R295) та розчинник остаточно видалили випарюванням 15 79537 16 при зниженому тиску. Приклад 10 20г масла одержали таким чином та очистили N3-((1-(2-оксо-2-((4з допомогою флеш хроматографії, елююючи сумі(диметиламіно)феніл)аміно)етил)-4шшю 7/3 гексан/етилацетат, з одержанням 12г піперидил)метил)-1-(1-метилетил)-1Н-індазол-3бажаного продукту. карбоксамід дигідрохлорид (AF3R301) 1 (Сполука І: R1=R4=R5=R6=R7=R8=H, R2=iH-ЯМР (d,CDCI3): 1,47 (d, J=6Гц, 6Н); 1,64 (d, C3H7, R3=4-N(CH 3)2, X=C(O)NH) J=7Гц, 6Н); 2,50 (d, J=1Гц, 3Н); 4,92 (септет, J=7Гц, 1Н); 5,39 (септет, J=6Гц, 1Н); 7,23 (dd, J=9; 1Гц, а) 2-(4-(амінометил)-1-піперидил)-N-(4(диметиламіно)феніл)-ацетамід 1Н); 7,40 (d, J=9Гц, 1Н); 7,95 (квінтет, J=1Гц, 1Н). Продукт (25г; 0,12моль), одержаний відповідно b) 1-(1-метилетил)-5-метил-1Н-індазол-3до Прикладу la), ввели у реакцію з N1-(4карбонова кислота (диметиламіно)феніл)-2-хлоретанамідом (25,5г; Суспензію продукту (8г, 0,03моль), одержаного відповідно до Прикладу 9а), у 1М NaOH (42мл) 0,12 оль) відповідно до способу, подібного описаному у Прикладі 1b). нагрівали зі зворотним холодильником протягом 3 36г маслянистого осаду одержали та очистили годин. Потім її вилили у воду, підкислили з допоз допомогою флеш хроматографії, елююючи сумімогою 2М НСl та екстагували дихлорметаном. Пішшю 10/4/1 хлороформ/метанол/водний амоній з сля випарювання розчинника при зниженому тиску, одержали 7г бажаного продукту. одержанням 25г бажаного продукту. 1 Елементний аналіз: H-ЯМР (d, CDCI3): 1,61 (d, J=7Гц, 6Н); 2,44 (s, Для С 16Н26N4 О 3Н); 4,88 (септет, J=7Гц, 1Н); 7,19 (d, J=9Гц, 1Н); 7,34 (d, J=9Гц, 1Н); 7,97 (s, 1H); 9,32 (широкий s, С Η Ν 1H). c) 1-(1-метилетил)-5-метил-1Н-індазол-3Знайдено % 66,53 9,30 18,97 карбоксил хлорид Розраховано % 66,17 9,02 19,29 Продукт (12,2г; 0,056моль), одержаний відпо1 відно до Прикладу 9а), хлор ували відповідно до H-ЯМР (d, DMSO-d 6+D2O): 1,18-1,50 (m, 2H); способу, подібного до описаного у Прикладі 4а). 1,55-1,78 (m, 3Н); 2,15-2,35 (m, 2H); 2,80-3,10 (m, 13,3г бажаного продукту одержали таким чи10Н); 3,34 (s, 2H); 6,67 (d, J=9Гц, 2H); 7,39 (d, ном, та використовували без додаткового очищенJ=9Гц, 2Н). ня. b) N3-((1-(2-оксо-2-((4d) 5-метил-N3-((1-(2-оксо-2-(феніламіно)етил)диметиламіно)феніл)аміно)етил)-44-піперидил)метил)-1-(1-метилетил)-1Н-індазол-3піперидил)метил)-1-(1-метилетил)-1Н-індазол-3карбоксамід гідрохлорид карбоксамід дигідрохлорид Продукт (3г; 0,012моль), одержаний відповідно Працюючи відповідно до способу, подібного до Прикладу 1b), додали до суспензії продукту описаному у Прикладі 2, продукт (6,4г; 0,022моль), (2,9г; 0,012моль), одержаного відповідно до Приодержаний відповідно до Прикладу 10а), ввели у кладу 9с), у толуолі (60мл). реакцію з 1-(1-метилетил)-1Н-індазол-3-карбоксил Реакційну суміш перемішували при кімнатній хлоридом (4,9г; 0,022моль) та продукт реакції петемпературі протягом 6 годин та потім розчинник ретворили у відповідний гідрохлорид. видалили при зниженому тиску. Осад обробили з Таким чином одержали 4,2г бажаного продукдопомогою 2N NaOH та дихлорметану. Цю суміш ту. перенесли у ділильну лійку. Органічну фазу віддіТемпература плавлення: 203°С (розклад) лили та висушили над Na2SO4. Розчинник видалиЕлементний аналіз ли випарюванням при зниженому тиску. Осад (4г), Для С 26Н36N6 О2·2НСL·Н2О одержаний таким чином, очистили з допомогою флеш хроматографії, елююючи сумішшю 97/3 С Η Ν хлороформ/метанол. Одержаний продукт переЗнайдено % 57,18 7,17 14,68 творили у відповідний гідрохлорид шляхом розчиРозраховано % 57,14 7,10 14,81 нення у етилацетаті, додаючи хлористий етанол та кристалізуючи з абсолютного етанолу, з одер1 H-ЯМР (d,CDCI3): 1,61 (d, J=7Гц, 6H); 1,78жанням 2,3г бажаного продукту. 2,30 (m, 5H); 3,16 (s, 6H); 3,00-3,90 (m, 6H); 4,31 (s, Температура плавлення: 241°С(розклад) 2H); 4,90 (септет, J=7Гц, 1Н); 7,25 (t, J=8Гц, 1H); Елементний аналіз 7,35-7,46 (m, 2H); 7,49 (d, J=9Гц, 1Н), 7,70 (d, Для C26H33N5 O2·HCl J=9Гц, 2Н); 7,86 (d, J=9Гц, 2Н); 8,30 (d, J=8Гц, 1Н); 10,65 (широкий s, 2H); 11,55 (s, 1H). С Η Ν Приклад 11 Знайдено % 64,69 7,09 14,44 N3-((1-(2-оксо-2-((2,6Розраховано % 64,52 7,08 14,47 диметилфеніл)аміно)етил)-4-піперидил)метил)-1(1-метилетил)-1Н-індазол-3-карбоксамід оксалат 1 H-ЯМР (d, DMSO-d6): 1,59 (d, J=7Гц, 6H); 1,78(AF3R305) 2,25 (m, 5H); 2,47 (s, 3Н); 3,06-3,27 (m, 2H); 3,41 (t, (Сполука І, R1=R5=R6=R7=R8=H, R2=i-C3H7, J=6Гц, 2H); 3,56-3,77 (m, 2H); 4,01 (s, 2H); 4,83 (сеR3=2-CH 3, R4=6-CH3, X=C(O)NH) птет, J=7Гц, 1Н); 7,06-7,39 (m, 6H); 7,76 (d, J=8Гц, а) 2-(4-(амінометил)-1-піперидил)-N-(2,62H); 8,12 (s, 1H); 10,91 (s, 1H); 11,79 (широкий s, диметилфеніл)ацетамід дипдрохлорид 1H). Продукт (32г; 0,16моль), одержаний відповідно 17 79537 18 до Прикладу 1а), ввели у реакцію з N1-(2,6(Сполука І: R1=R4=R5=R6=R7=R8=H, R2=iдиметилфеніл)-2-хлоретанамідом (31,6г; C3H7, R3=4-NH2, X=C(O)NH) 0,16моль) відповідно до способу, подібного описаРозчин продукту (1,4г; 0,003моль), одержаного ному у Прикладі 1b). відповідно до Прикладу 7b), у абсолютному етило54г осаду отримали таким чином та перекрисвому спирті (50мл) гідрогенували у присутності талізували з етиацетату з одержанням 45г бажа10% Pd-C (90мг) при 40 псі протягом 3 годин. Поного продукту, який перетворили у відповідний тім цю суміш відфільтрували та фільтрат сконценгідрохлорид шляхом розчинення у етилацетаті, трували при зниженому тиску. Продукт, одержаний додаючи хлористий етанол та перекристалізовуютаким чином, перетворили у відповідний дигідрохчи з 95° етанолу з одержанням 40г бажаного пролорид шляхом розчинення у етилацетаті, додаючи дукту. хлористий етанол та кристалізуючи з сумішшю Елементний аналіз 95/5 етилацетат/етанол, з одержанням 0,7 г бажаДля C16H25N3 O·2HCl ного продукту, температура плавлення: 252°С (розклад) Елементний аналіз С Η Ν Для С 25Н32N6 О2·2НСI·Н2 О Знайдено % 55,12 7,77 20,22 Розраховано % 55,17 7,81 20,36 С Η Ν 1 Знайдено % 55,70 6,52 15,44 H-ЯМР (d, D MSO-d 6): 1,43-1,71 (m, 2H); 1,73Розраховано % 55,66 6,73 15,58 2,06 (m, 3Н); 2,18 (s, 6H); 2,71 (s, 2H); 3,05-3,66 (m, 4H); 4,25 (s, 2H); 7.10 (s, 3Н); 8,35 (широкий s, 3Н); 1 10,19 (широкий s, 1H); 10,33 (s, 1Н). H-ЯМР (d, DMSO-d6): 1,55 (d, J=7Гц, 6H); 1,40b) N3-((1-(2-оксо-2-((2,62,09 (m, 5H); 2,96-3,71 (m, 6H); 4,16 (s, 2H); 5,00 диметилфеніл)аміно)етил)-4-піперидил)метил)-1(септет, J=7Гц, 1Н); 7,20-7,38 (m, 3Н); 7,30-7,48 (m, (1-метилетил)-1Н-індазол-3-карбоксамід оксалат 1Н); 7,70 (d, J=9Гц, 2Н); 7,79 (d, J=9Гц, 2Н); 8,17 (d, 1-(1-Метилетил)-1Н-індазол-3-карбоксил хлоJ=8Гц, 1Н); 8,37 (t, J=6Гц, 1Н); 10,03 (широкий s, рид (11,3г; 0,051моль), одержаний як описано у 4H); 11,17 (s, 1H). [ЕР-А-0975623], додали порціями до суспензії проВипробування дукту у вигляді основи (14,1г; 0,051моль), отрима1. CFA-викликана механічна гіпералгезія у паного як описано у Прикладі 11а), у толуолі (200мл). цюків Реакційну суміш перемішували при кімнатній Використовували CD пацюків чоловічої статі з температурі протягом 6 годин. Після видалення вагою 150-200г по прибутті. розчинника випарюванням при зниженому тиску, З допомогою аналгезимерта, вибрали пацюків осад обробили з допомогою 1N NaOH та дихлорз порогом відповіді на механічний ноцицептивний метану. Цю суміш перенесли у ділильну лійку. Орподразник в інтервалі від 150 до 180г. Застосовуганічну фазу відділили та висушили над Na2SO4, ючи поступове підвищення тиску на дорсальну розчинник видалили випарюванням при зниженочастину лівої задньої кінцівки пацюка, цей пристрій му тиску. Осад (20г), одержаний таким чином, очидає можливість записати ноцифенсивну відповідь стили з допомогою флеш хроматографії, елююючи (nocifensive response), виражену у грамах, по відетилацетатом. Одержаний продукт перетворили у ношенню до моменту, у який тварина забирає кінвідповідний оксалат шляхом розчинення у етилацівку [Randall LO та Selitto JJ. А method for the цетаті, додаючи стехіометричну кількість щавлевої measurement of analgesic activity on inflamed tissue. кислоти та кристалізуючи з 95° етанолом, з одерArch. Int. Pharmacodyn. Ther 1957; 111:409-419]. жанням 7,8г бажаного продукту. Гіпералгезію викликали шляхом однобічної Температура плавлення: 214°С (розклад) ін'єкції 150mл "Повного ад'юванта Фрейнда" (CFA) Елементний аналіз у поверхню лівої задньої кінцівки тварини [Andrew Для С 27Н35N5 О2·С2Н 2O4 D, Greenspan JD. Mechanical and heat sensitization of cutaneous nociceptors after peripheral С Η Ν inflammation in the rat. J Neurophysiol. 1999; 82(5): 2649-2656; Hargreaves K, Dubner R, Brown R, Знайдено % 63,09 6,80 12,73 Flores C, Joris J. A new and sensitive method for Розраховано % 63,14 6,76 12,70 measuring thermal nociception in cutaneous 1 hyperalgesia. Pain 1988; 32: 77-88]. H-ЯМР (d,D MSO-d6): 1,54 (d, J=7Гц, 6H); 1,42Тестові сполуки випробовували (доза: 101,64 (m, 2H); 1,72-1,92 (m, 3Н); 2,15 (s, 6H); 2,78 (t, 5 моль/кг), проводячи тест через 23 години після J=12Гц, 2H); 3,17-3,40 (m, 4H); 3,81 (s, 2H); 5,08 ін'єкції CFA. (септет, J=7Гц, 1Н); 6,20 (широкий s, 2Н); 7,09 (s, Через одну годину після обробки, больовий 3Н); 7,20-7,30 (m, 1Н); 7,38-7,48 (m, 1H); 7,79 (d, поріг, виміряний на контрольних тваринах, порівJ=9Гц. 1H); 8,17 (d, J=8Гц, 1H); 8,31 (t, J=6Гц, 1H); няли з порогом, виміряним на тваринах, обробле9,68 (s, 1H). них тестовим продуктом. Контрольних тварин обПриклад 12 робили тим же наповнювачем (вода), що N3-((1-(2-оксо-2-((4-амінофеніл)аміно)етил)-4використовується для застосування тестових пропіперидил)метил)-1-(1-метилетил)-1Н-індазол-3дуктів. Рез ультати проілюстровані у Таблиці 1. карбоксамід дигідрохлорид (AF3R292) 19 Обробка Наповнювач AF3R172 AF3R278 AF3R301 AF3R276 AF3R277 AF3R295 AF3R299 AF3R305 AF3R292 AF3R331 AF3R335 79537 20 цицептивний подразник 120г. Рівні глікемії вимірюТаблиця 1 вали з допомогою рефлектометра, використовуючи активні смужки, просочені оксидазою глюкози. Вплив на CFA Больовий поріг вимірювали, використовуючи аналгезимерт. Застосовуючи поступове підвищення тиску на дорсальну частину лівої задньої кінцівки Кількість Больовий поріг (г) через пацюка, цей пристрій дає можливість записати пацюків 1 годину після обробки ноцифенсивну відповідь, виражену у грамах, по 12 120±6,1 відношенню до моменту, у який тварина забирає 12 175±10,2 кінцівку. 12 164±10,2 Через дві години після обробки, больовий по12 151±10,7 ріг, виміряний на контрольних тваринах, порівняли 12 185±15,9 з порогом, виміряним на тваринах, оброблених 12 170±10,7 тестовим продуктом (доза: 10-5моль/кг). 12 202±17,0 Контрольних тварин обробили тим же напов12 167±8,5 нювачем (вода), що використовується для засто12 174±8,4 сування тестових продуктів. Результати проілюст12 154±11,5 ровані у Таблиці 2. 12 156±8,7 12 168±6,8 Таблиця 2 Больовий поріг нормальних тварин еквівалента вага/вік=155±2,1г 2. Ме ханічна гіпералгезія у пацюків зі стрептозотоцин-викликаним діабетом Використовували CD пацюків чоловічої статі з вагою 240-300г по прибутті. Діабетичний синдром викликали з допомогою однієї внутрішньочеревної (і.р.) ін'єкції 80мг/кг стрептозотоцина, розчиненого у стерильному фізіологічному розчині [Courteix С, Eschalier A, Lavarenne J. Streptozotocin-induced diabetic rats: behavioural evidence for a model of chronic pain. Pain, 1993; 53: 81-88; Bannon AW, Decker MW, Kim DJ, Campbell JE, Arneric SP. ABT594, a novel cholinergic channel modulator, is efficacious in nerve ligation and diabetic neuropathy models of neuropathic pain. Brain Res. 1998; 801: 158-63]. Принаймні через три тижні після ін'єкції стрептозотоцина, вибрали пацюків з рівнем глікемії ³300мг/дл та порогом відповіді на механічний но Комп’ютерна в ерстка О. Гапоненко Вплив на діабетичну невропатію Обробка Наповнювач AF3R172 AF3R278 AF3R301 AF3R276 AF3R277 AF3R295 AF3R299 AF3R305 AF3R292 AF3R331 AF3R335 Кількість Больовий поріг (г) через пацюків 2 години після обробки 8 114±2,7 8 186±13,0 8 240±16,5 8 201±13,8 8 210±10,9 8 188±11,0 8 212±14,6 8 200±10,7 8 189±9,2 8 202±8,7 8 192±11,5 8 180±13,0 Больовий поріг нормальних тварин еквівалента вага/вік=240±8,7г. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюIndazolamides possessing analgesic activity
Автори англійськоюAlisi, Maria, Alessandra, Cazzolla, Nicola, Guglielmotti Angelo, Furlotti, Guido, Polenzani, Lorenzo
Назва патенту російськоюИндазоламиды с анальгетической активностью
Автори російськоюАлиси Мария Алессандра, Каццолла Никола, Гуглиэлмотти Анджело, Фурлотти Гвидо, Поленцани Лоренцо
МПК / Мітки
МПК: C07D 401/12, A61P 23/00, C07D 211/26
Мітки: активністю, аналгетичною, індазоламіди
Код посилання
<a href="https://ua.patents.su/10-79537-indazolamidi-z-analgetichnoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Індазоламіди з аналгетичною активністю</a>
Попередній патент: Установка гідродинамічного вихолощення боєприпасів
Наступний патент: Ролик стрічкового конвеєра (варіанти)
Випадковий патент: Спосіб отримання катодного матеріалу для вторинних джерел електричного струму